Vasotec 2.5mg, 5mg, 10mg Enalapril Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Vasotec et comment est-il utilisé ?
Vasotec est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de l'hypertension artérielle, de la dysfonction ventriculaire gauche et de l'insuffisance cardiaque congestive. Vasotec peut être utilisé seul ou avec d'autres médicaments.
- Vasotec appartient à une classe de médicaments appelés inhibiteurs de l'ECA.
- On ne sait pas si Vasotec est sûr et efficace chez les enfants de moins de 1 mois.
Quels sont les effets secondaires possibles de Vasotec 2,5 mg ?
Vasotec 2,5 mg peut provoquer des effets indésirables graves, notamment :
- étourdissement,
- douleur thoracique,
- jaunissement de la peau ou des yeux (jaunisse),
- peu ou pas de miction,
- fièvre,
- des frissons,
- mal de gorge,
- nausée,
- la faiblesse,
- sensation de picotement,
- battements cardiaques irréguliers et
- perte de mouvement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Vasotec incluent :
- vertiges,
- fatigue, et
- étourdissement
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Vasotec. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
TOXICITÉ FŒTALE
- Lorsqu'une grossesse est détectée, arrêtez VASOTEC® dès que possible.
- Les médicaments qui agissent directement sur le système rénine-angiotensine peuvent causer des blessures et la mort du fœtus en développement. Voir MISES EN GARDE : Toxicité fœtale
LA DESCRIPTION
VASOTEC® (maléate d'énalapril) est le sel de maléate de l'énalapril, l'ester éthylique d'un inhibiteur de l'enzyme de conversion de l'angiotensine à action prolongée, l'énalaprilat. Le maléate d'énalapril est chimiquement décrit comme le sel de (S)-1[N-[1-(éthoxycarbonyl)-3-phénylpropyl]-L-alanyl]-L-proline, (Z)-2-butènedioate (1:1). Sa formule empirique est C20H28N2O5•C4H4O4, et sa formule structurale est :
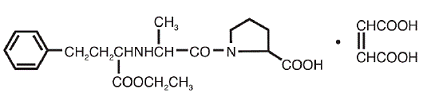
Le maléate d'énalapril est une poudre cristalline blanche à blanc cassé d'un poids moléculaire de 492,53. Il est peu soluble dans l'eau, soluble dans l'éthanol et librement soluble dans le méthanol.
L'énalapril est un pro-médicament ; après administration orale, il est bioactivé par hydrolyse de l'ester éthylique en énalaprilate, qui est l'inhibiteur actif de l'enzyme de conversion de l'angiotensine.
Le maléate d'énalapril est fourni sous forme de comprimés de 2,5 mg, 5 mg, 10 mg et 20 mg pour administration orale. En plus de l'ingrédient actif maléate d'énalapril, chaque comprimé contient les ingrédients inactifs suivants : lactose, stéarate de magnésium, bicarbonate de sodium et amidon. Les comprimés de 10 mg et 20 mg contiennent également des oxydes de fer.
LES INDICATIONS
Hypertension
VASOTEC est indiqué pour le traitement de l'hypertension.
VASOTEC est efficace seul ou en association avec d'autres agents antihypertenseurs, en particulier les diurétiques de type thiazidique. Les effets hypotenseurs de VASOTEC 10 mg et des thiazides sont approximativement additifs.
Insuffisance cardiaque
VASOTEC est indiqué pour le traitement de l'insuffisance cardiaque congestive symptomatique, généralement en association avec des diurétiques et des digitaliques. Chez ces patients, VASOTEC 5 mg améliore les symptômes, augmente la survie et diminue la fréquence d'hospitalisation (voir PHARMACOLOGIE CLINIQUE , Insuffisance cardiaque , Essais de mortalité pour les détails et les limites des essais de survie ).
Dysfonction ventriculaire gauche asymptomatique
Chez les patients asymptomatiques cliniquement stables présentant une dysfonction ventriculaire gauche (fraction d'éjection ≤ 35 pour cent), VASOTEC 5 mg diminue le taux de développement de l'insuffisance cardiaque manifeste et diminue l'incidence des hospitalisations pour insuffisance cardiaque (voir PHARMACOLOGIE CLINIQUE , Insuffisance cardiaque , Essais de mortalité pour les détails et les limites des essais de survie ).
Lors de l'utilisation de VASOTEC 2,5 mg, il convient de tenir compte du fait qu'un autre inhibiteur de l'enzyme de conversion de l'angiotensine, le captopril, a provoqué une agranulocytose, en particulier chez les patients présentant une insuffisance rénale ou une maladie vasculaire du collagène, et que les données disponibles sont insuffisantes pour montrer que VASOTEC 2,5 mg ne provoque pas d'agranulocytose. présentent un risque similaire (voir AVERTISSEMENTS ).
En considérant l'utilisation de VASOTEC, il convient de noter que dans les essais cliniques contrôlés, les inhibiteurs de l'ECA ont un effet sur la pression artérielle qui est moindre chez les patients noirs que chez les non-noirs. De plus, il convient de noter que les patients noirs recevant des inhibiteurs de l'ECA ont été signalés comme ayant une incidence plus élevée d'œdème de Quincke par rapport aux non-noirs (voir AVERTISSEMENTS , Angiœdème de la tête et du cou ).
DOSAGE ET ADMINISTRATION
Hypertension
Chez les patients qui sont actuellement traités par un diurétique, une hypotension symptomatique peut occasionnellement survenir après la dose initiale de VASOTEC. Le diurétique doit, si possible, être interrompu pendant deux à trois jours avant le début du traitement par VASOTEC afin de réduire le risque d'hypotension (voir AVERTISSEMENTS ). Si la pression artérielle du patient n'est pas contrôlée avec VASOTEC seul, le traitement diurétique peut être repris.
Si le diurétique ne peut être interrompu, une dose initiale de 2,5 mg doit être utilisée sous surveillance médicale pendant au moins deux heures et jusqu'à ce que la pression artérielle se soit stabilisée pendant au moins une heure supplémentaire (voir AVERTISSEMENTS et PRÉCAUTIONS , INTERACTIONS MÉDICAMENTEUSES ).
La dose initiale recommandée chez les patients ne prenant pas de diurétiques est de 5 mg une fois par jour. La posologie doit être ajustée en fonction de la réponse tensionnelle. La gamme posologique habituelle est de 10 à 40 mg par jour administrés en une dose unique ou en deux doses fractionnées. Chez certains patients traités une fois par jour, l'effet antihypertenseur peut diminuer vers la fin de l'intervalle posologique. Chez ces patients, une augmentation de la posologie ou une administration deux fois par jour doit être envisagée. Si la pression artérielle n'est pas contrôlée avec VASOTEC 2,5 mg seul, un diurétique peut être ajouté. L'administration concomitante de VASOTEC 5 mg avec des suppléments de potassium, des substituts de sel de potassium ou des diurétiques épargneurs de potassium peut entraîner une augmentation de la kaliémie (voir PRÉCAUTIONS ).
Ajustement posologique chez les patients hypertendus atteints d'insuffisance rénale
La dose habituelle d'énalapril est recommandée chez les patients dont la clairance de la créatinine est supérieure à 30 mL/min (créatinine sérique jusqu'à environ 3 mg/dL). Pour les patients dont la clairance de la créatinine est inférieure ou égale à 30 mL/min (créatinine sérique supérieure ou égale à 3 mg/dL), la première dose est de 2,5 mg une fois par jour. La posologie peut être augmentée jusqu'à ce que la tension artérielle soit contrôlée ou jusqu'à un maximum de 40 mg par jour.
Insuffisance cardiaque
VASOTEC est indiqué pour le traitement de l'insuffisance cardiaque symptomatique, généralement en association avec des diurétiques et des digitaliques. Dans les études contrôlées par placebo qui ont démontré une amélioration de la survie, les patients ont été titrés selon la tolérance jusqu'à 40 mg, administrés en deux doses fractionnées.
La dose initiale recommandée est de 2,5 mg. La plage posologique recommandée est de 2,5 à 20 mg administrés deux fois par jour. Les doses doivent être augmentées, selon la tolérance, sur une période de quelques jours ou semaines. La dose quotidienne maximale administrée dans les essais cliniques était de 40 mg en doses fractionnées.
Après la dose initiale de VASOTEC, le patient doit être observé sous surveillance médicale pendant au moins deux heures et jusqu'à ce que la tension artérielle se soit stabilisée pendant au moins une heure supplémentaire (voir AVERTISSEMENTS et INTERACTIONS MÉDICAMENTEUSES ). Si possible, la dose de tout diurétique concomitant doit être réduite, ce qui peut diminuer le risque d'hypotension. L'apparition d'une hypotension après la dose initiale de VASOTEC n'empêche pas une titration prudente ultérieure de la dose avec le médicament, après une prise en charge efficace de l'hypotension.
Dysfonction ventriculaire gauche asymptomatique
Dans l'essai qui a démontré l'efficacité, les patients ont commencé à prendre 2,5 mg deux fois par jour et ont été titrés selon la tolérance jusqu'à la dose quotidienne ciblée de 20 mg (en doses fractionnées).
Après la dose initiale de VASOTEC 10 mg, le patient doit être observé sous surveillance médicale pendant au moins deux heures et jusqu'à ce que la tension artérielle se soit stabilisée pendant au moins une heure supplémentaire (voir AVERTISSEMENTS et INTERACTIONS MÉDICAMENTEUSES ). Si possible, la dose de tout diurétique concomitant doit être réduite, ce qui peut diminuer le risque d'hypotension. L'apparition d'une hypotension après la dose initiale de VASOTEC 5 mg n'empêche pas une titration prudente ultérieure de la dose avec le médicament, après une prise en charge efficace de l'hypotension.
Ajustement posologique chez les patients souffrant d'insuffisance cardiaque et d'insuffisance rénale ou d'hyponatrémie
Chez les patients insuffisants cardiaques présentant une hyponatrémie (natrémie inférieure à 130 mEq/L) ou une créatinine sérique supérieure à 1,6 mg/dL, le traitement doit être initié à 2,5 mg par jour sous étroite surveillance médicale (voir Insuffisance cardiaque , AVERTISSEMENTS et INTERACTIONS MÉDICAMENTEUSES ). La dose peut être augmentée à 2,5 mg bid, puis 5 mg bid et plus selon les besoins, généralement à des intervalles de quatre jours ou plus si, au moment de l'ajustement posologique, il n'y a pas d'hypotension excessive ou de détérioration significative de la fonction rénale. La dose quotidienne maximale est de 40 mg.
Patients hypertendus pédiatriques
La dose initiale habituelle recommandée est de 0,08 mg/kg (jusqu'à 5 mg) une fois par jour. La posologie doit être ajustée en fonction de la réponse tensionnelle. Les doses supérieures à 0,58 mg/kg (ou supérieures à 40 mg) n'ont pas été étudiées chez les patients pédiatriques (voir PHARMACOLOGIE CLINIQUE , Pharmacologie clinique chez les patients pédiatriques ).
VASOTEC 5mg n'est pas recommandé chez les nouveau-nés et chez les patients pédiatriques avec un débit de filtration glomérulaire inférieur à 30 ml/min/1,73 m², car aucune donnée n'est disponible.
Préparation de suspension (pour 200 mL d'une suspension à 1,0 mg/mL)
Ajouter 50 ml de Bicitra® dans un flacon en polyéthylène téréphtalate (PET) contenant dix comprimés de 20 mg de VASOTEC 10 mg et agiter pendant au moins 2 minutes. Laisser reposer le concentré pendant 60 minutes. Après le temps de maintien de 60 minutes, secouez le concentré pendant une minute supplémentaire. Ajouter 150 ml d'Ora-Sweet SF™2 au concentré dans la bouteille en PET et agiter la suspension pour disperser les ingrédients. La suspension doit être réfrigérée à 2-8°C (36-46°F) et peut être conservée jusqu'à 30 jours. Agiter la suspension avant chaque utilisation.
COMMENT FOURNIE
Stockage
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15-30°C (59-86°F) [voir Température ambiante contrôlée USP ].
Conserver le récipient bien fermé.
Protéger de l'humidité.
Distribuer dans un récipient étanche selon l'USP, si l'emballage du produit est subdivisé.
Fabriqué pour : Valeant Pharmaceuticals North America LLC Bridgewater, NJ 08807 USA. Fabriqué par : Valeant Pharmaceuticals International, Inc. Steinbach, MB R5G 1Z7 Canada. Révision : juillet 2017.
EFFETS SECONDAIRES
L'innocuité de VASOTEC a été évaluée chez plus de 10 000 patients, dont plus de 1 000 patients traités pendant un an ou plus. VASOTEC 10 mg s'est avéré généralement bien toléré lors d'essais cliniques contrôlés portant sur 2 987 patients. Pour la plupart, les effets indésirables étaient de nature légère et transitoire. Dans les essais cliniques, l'arrêt du traitement en raison d'effets indésirables cliniques a été nécessaire chez 3,3 % des patients souffrant d'hypertension et chez 5,7 % des patients souffrant d'insuffisance cardiaque. La fréquence des effets indésirables n'était pas liée à la dose quotidienne totale dans les fourchettes posologiques habituelles. Chez les patients hypertendus, le pourcentage global de patients traités par VASOTEC rapportant des effets indésirables était comparable à celui du placebo.
Hypertension
Les événements indésirables survenus chez plus d'un pour cent des patients hypertendus traités par VASOTEC 2,5 mg dans les essais cliniques contrôlés sont présentés ci-dessous. Chez les patients traités par VASOTEC, la durée maximale du traitement était de trois ans ; chez les patients traités par placebo, la durée maximale du traitement était de 12 semaines.
Insuffisance cardiaque
Les événements indésirables survenus chez plus d'un pour cent des patients insuffisants cardiaques traités par VASOTEC 5 mg sont présentés ci-dessous. Les incidences représentent les expériences des essais cliniques contrôlés et non contrôlés (la durée maximale du traitement était d'environ un an). Chez les patients traités par placebo, les incidences rapportées proviennent des essais contrôlés (la durée maximale du traitement est de 12 semaines). Le pourcentage de patients souffrant d'insuffisance cardiaque sévère (classe IV de la NYHA) était de 29 % et de 43 % pour les patients traités respectivement par VASOTEC 2,5 mg et le placebo.
D'autres effets indésirables cliniques graves survenus depuis la commercialisation du médicament ou des effets indésirables survenus chez 0,5 à 1,0 % des patients souffrant d'hypertension ou d'insuffisance cardiaque dans les essais cliniques sont énumérés ci-dessous et, dans chaque catégorie, par ordre décroissant de gravité.
Corps dans son ensemble
Réactions anaphylactoïdes (voir AVERTISSEMENTS , Réactions anaphylactoïdes et éventuellement apparentées ).
Cardiovasculaire
Crise cardiaque; infarctus du myocarde ou accident vasculaire cérébral, éventuellement secondaire à une hypotension excessive chez les patients à haut risque (voir AVERTISSEMENTS , Hypotension ); embolie pulmonaire et infarctus; œdème pulmonaire; troubles du rythme, y compris tachycardie et bradycardie auriculaires ; fibrillation auriculaire; palpitations, phénomène de Raynaud.
Digestif
Iléus, pancréatite, insuffisance hépatique, hépatite (hépatocellulaire [prouvée lors d'une nouvelle provocation] ou ictère cholestatique) (voir AVERTISSEMENTS , Défaillance hépatique ), méléna, anorexie, dyspepsie, constipation, glossite, stomatite, bouche sèche.
Hématologique
Rares cas de neutropénie, thrombocytopénie et aplasie médullaire.
Musculo-squelettique
Crampes musculaires.
Nerveux/Psychiatrique
Dépression, confusion, ataxie, somnolence, insomnie, nervosité, neuropathie périphérique (p. ex., paresthésie, dysesthésie), anomalie des rêves.
Respiratoire
Bronchospasme, rhinorrhée, mal de gorge et enrouement, asthme, infection des voies respiratoires supérieures, infiltrats pulmonaires, pneumonie à éosinophiles.
Peau
Dermatite exfoliative, nécrolyse épidermique toxique, syndrome de Stevens-Johnson, pemphigus, zona, érythème polymorphe, urticaire, prurit, alopécie, bouffées vasomotrices, diaphorèse, photosensibilité.
Sens spéciaux
Vision floue, altération du goût, anosmie, acouphènes, conjonctivite, sécheresse oculaire, larmoiement.
Urogénital
Insuffisance rénale, oligurie, dysfonctionnement rénal (voir PRÉCAUTIONS et DOSAGE ET ADMINISTRATION ), douleur au flanc, gynécomastie, impuissance.
Divers
Un complexe de symptômes a été signalé qui peut inclure tout ou partie des éléments suivants : un ANA positif, une vitesse de sédimentation élevée des érythrocytes, une arthralgie/arthrite, une myalgie/myosite, de la fièvre, une sérosite, une vascularite, une leucocytose, une éosinophilie, une photosensibilité, une éruption cutanée et d'autres troubles dermatologiques. manifestations.
Angiœdème
Des œdèmes de Quincke ont été rapportés chez des patients recevant VASOTEC 2,5 mg, avec une incidence plus élevée chez les patients noirs que chez les patients non noirs. L'œdème de Quincke associé à un œdème laryngé peut être fatal. En cas d'œdème de Quincke du visage, des extrémités, des lèvres, de la langue, de la glotte et/ou du larynx, le traitement par VASOTEC doit être interrompu et un traitement approprié instauré immédiatement (voir AVERTISSEMENTS ).
Hypotension
Chez les patients hypertendus, une hypotension est survenue chez 0,9 % des patients et une syncope est survenue chez 0,5 % des patients après la dose initiale ou pendant un traitement prolongé. L'hypotension ou la syncope a été une cause d'arrêt du traitement chez 0,1 % des patients hypertendus. Chez les patients souffrant d'insuffisance cardiaque, une hypotension est survenue chez 6,7 % des patients et une syncope s'est produite chez 2,2 % des patients. L'hypotension ou la syncope a été une cause d'arrêt du traitement chez 1,9 % des patients insuffisants cardiaques (voir AVERTISSEMENTS ).
Toux
Voir PRÉCAUTIONS , Toux .
Patients pédiatriques
Le profil des effets indésirables chez les patients pédiatriques semble être similaire à celui observé chez les patients adultes.
Résultats des tests de laboratoire clinique
Électrolytes sériques
Hyperkaliémie (voir PRÉCAUTIONS ), hyponatrémie.
Créatinine, azote uréique du sang
Dans des essais cliniques contrôlés, des augmentations mineures de l'azote uréique sanguin et de la créatinine sérique, réversibles à l'arrêt du traitement, ont été observées chez environ 0,2 % des patients souffrant d'hypertension essentielle traités par VASOTEC seul. Des augmentations sont plus susceptibles de se produire chez les patients recevant des diurétiques concomitants ou chez les patients présentant une sténose de l'artère rénale (voir PRÉCAUTIONS ). Chez les patients atteints d'insuffisance cardiaque qui recevaient également des diurétiques avec ou sans digitaliques, des augmentations de l'azote uréique sanguin ou de la créatinine sérique, généralement réversibles à l'arrêt de VASOTEC 5 mg et/ou d'un autre traitement diurétique concomitant, ont été observées chez environ 11 % des patients. L'augmentation de l'azote uréique sanguin ou de la créatinine était une cause d'abandon chez 1,2 % des patients.
Hématologie
De petites diminutions de l'hémoglobine et de l'hématocrite (diminutions moyennes d'environ 0,3 g pour cent et 1,0 vol pour cent, respectivement) surviennent fréquemment chez les patients souffrant d'hypertension ou d'insuffisance cardiaque congestive traités par VASOTEC 5 mg, mais sont rarement d'importance clinique à moins qu'une autre cause d'anémie ne coexiste. Dans les essais cliniques, moins de 0,1 % des patients ont interrompu le traitement en raison d'une anémie. Une anémie hémolytique, y compris des cas d'hémolyse chez des patients présentant un déficit en G6PD, a été rapportée ; une relation causale avec l'énalapril ne peut être exclue.
Tests de la fonction hépatique
Des élévations des enzymes hépatiques et/ou de la bilirubine sérique sont survenues (voir AVERTISSEMENTS , Défaillance hépatique ).
Pour signaler des RÉACTIONS INDÉSIRABLES SUSPECTÉES, contactez Valeant Pharmaceuticals North America LLC au 1-800-321-4576 ou la FDA au 1-800-FDA-1088 ou www.fda.gov/medwatch.
INTERACTIONS MÉDICAMENTEUSES
Inhibiteurs de la néprilysine
Les patients prenant simultanément des inhibiteurs de la néprilysine peuvent présenter un risque accru d'œdème de Quincke. (voir AVERTISSEMENTS )
Double blocage du système rénine-angiotensine (RAS)
Le double blocage du SRA avec les inhibiteurs des récepteurs de l'angiotensine, les inhibiteurs de l'ECA ou l'aliskirène est associé à des risques accrus d'hypotension, d'hyperkaliémie et de modifications de la fonction rénale (y compris l'insuffisance rénale aiguë) par rapport à la monothérapie. La plupart des patients recevant l'association de deux inhibiteurs du RAS n'obtiennent aucun bénéfice supplémentaire par rapport à la monothérapie. En général, évitez l'utilisation combinée d'inhibiteurs du RAS. Surveillez étroitement la pression artérielle, la fonction rénale et les électrolytes chez les patients sous VASOTEC 2,5 mg et d'autres agents qui affectent le SRA.
Ne pas co-administrer l'aliskirène avec VASOTEC 5 mg chez les patients diabétiques. Éviter l'utilisation d'aliskirène avec VASOTEC chez les patients présentant une insuffisance rénale (DFG
Hypotension - Patients sous traitement diurétique
Les patients sous diurétiques, et en particulier ceux chez qui un traitement diurétique a été récemment instauré, peuvent occasionnellement présenter une baisse excessive de la pression artérielle après le début du traitement par l'énalapril. La possibilité d'effets hypotenseurs avec l'énalapril peut être minimisée en arrêtant le diurétique ou en augmentant la consommation de sel avant le début du traitement par l'énalapril. S'il est nécessaire de poursuivre le diurétique, assurer une surveillance médicale étroite après la dose initiale pendant au moins deux heures et jusqu'à ce que la pression artérielle se soit stabilisée pendant au moins une heure supplémentaire (voir AVERTISSEMENTS et DOSAGE ET ADMINISTRATION ).
Agents provoquant la libération de rénine
L'effet antihypertenseur de VASOTEC 10 mg est augmenté par les agents antihypertenseurs qui provoquent la libération de rénine (par exemple, les diurétiques).
Agents anti-inflammatoires non stéroïdiens, y compris les inhibiteurs sélectifs de la cyclooxygénase-2 (inhibiteurs de la COX-2)
Chez les patients âgés, hypovolémiques (y compris ceux sous traitement diurétique) ou dont la fonction rénale est altérée, la co-administration d'AINS, y compris les inhibiteurs sélectifs de la COX-2, avec des inhibiteurs de l'ECA, y compris l'énalapril, peut entraîner une détérioration de la fonction rénale, y compris possible insuffisance rénale aiguë. Ces effets sont généralement réversibles. Surveiller périodiquement la fonction rénale chez les patients recevant de l'énalapril et un traitement par AINS.
Dans une étude de pharmacologie clinique, l'indométhacine ou le sulindac ont été administrés à des patients hypertendus recevant VASOTEC. Dans cette étude, il n'y avait aucune preuve d'un émoussement de l'action antihypertensive de VASOTEC. Cependant, des rapports suggèrent que les AINS peuvent diminuer l'effet antihypertenseur des inhibiteurs de l'ECA.
Autres agents cardiovasculaires
VASOTEC 10 mg a été utilisé en concomitance avec des bêta-bloquants, la méthyldopa, des nitrates, des inhibiteurs calciques, l'hydralazine, la prazosine et la digoxine sans preuve d'interactions indésirables cliniquement significatives.
Agents augmentant le potassium sérique
VASOTEC atténue la perte de potassium causée par les diurétiques de type thiazidique. Les diurétiques épargneurs de potassium (p. ex., spironolactone, triamtérène ou amiloride), les suppléments potassiques ou les substituts de sel contenant du potassium peuvent entraîner des augmentations significatives du potassium sérique. Par conséquent, si l'utilisation concomitante de ces agents est indiquée en raison d'une hypokaliémie démontrée, ils doivent être utilisés avec prudence et avec une surveillance fréquente du potassium sérique. Les agents d'épargne potassique ne doivent généralement pas être utilisés chez les patients insuffisants cardiaques recevant VASOTEC.
Lithium
Une toxicité du lithium a été rapportée chez des patients recevant du lithium en concomitance avec des médicaments provoquant l'élimination du sodium, y compris des inhibiteurs de l'ECA. Quelques cas de toxicité au lithium ont été signalés chez des patients recevant simultanément VASOTEC et du lithium et ont été réversibles à l'arrêt des deux médicaments. Il est recommandé de surveiller fréquemment les taux sériques de lithium si l'énalapril est administré en même temps que le lithium.
Or
Des réactions nitritoïdes (les symptômes incluent bouffées vasomotrices, nausées, vomissements et hypotension) ont été rarement rapportées chez des patients recevant un traitement par injection d'or (aurothiomalate de sodium) et un traitement concomitant par un inhibiteur de l'ECA, y compris VASOTEC.
Inhibiteurs de mTOR (Mammalian Target Of Rapamycin)
Les patients recevant un traitement concomitant par un inhibiteur de l'ECA et un inhibiteur de mTOR (p. ex., temsirolimus, sirolimus, évérolimus) peuvent présenter un risque accru d'œdème de Quincke (voir AVERTISSEMENTS ).
AVERTISSEMENTS
Réactions anaphylactoïdes et éventuellement liées
Vraisemblablement parce que les inhibiteurs de l'enzyme de conversion de l'angiotensine affectent le métabolisme des eicosanoïdes et des polypeptides, y compris la bradykinine endogène, les patients recevant des inhibiteurs de l'ECA (y compris VASOTEC) peuvent être sujets à divers effets indésirables, dont certains graves.
Angiœdème de la tête et du cou
Des œdèmes de Quincke du visage, des extrémités, des lèvres, de la langue, de la glotte et/ou du larynx ont été rapportés chez des patients traités par des inhibiteurs de l'enzyme de conversion de l'angiotensine, y compris VASOTEC. Cela peut survenir à tout moment pendant le traitement. Dans de tels cas, VASOTEC 2,5 mg doit être rapidement arrêté et un traitement et une surveillance appropriés doivent être assurés jusqu'à la résolution complète et durable des signes et symptômes. Dans les cas où l'enflure a été confinée au visage et aux lèvres, la condition a généralement disparu sans traitement, bien que les antihistaminiques aient été utiles pour soulager les symptômes. L'œdème de Quincke associé à un œdème laryngé peut être fatal. En cas d'atteinte de la langue, de la glotte ou du larynx, susceptible de provoquer une obstruction des voies respiratoires, un traitement approprié, p. fourni (voir EFFETS INDÉSIRABLES ).
Les patients recevant un traitement concomitant par un inhibiteur de l'ECA et un inhibiteur mTOR (mammalian target of rapamycin) (par exemple, temsirolimus, sirolimus, évérolimus) ou un inhibiteur de la néprilysine peuvent présenter un risque accru d'œdème de Quincke (voir PRÉCAUTIONS ).
Angiœdème intestinal
Des œdèmes de Quincke intestinaux ont été rapportés chez des patients traités par des inhibiteurs de l'ECA. Ces patients présentaient des douleurs abdominales (avec ou sans nausées ou vomissements) ; dans certains cas, il n'y avait pas d'antécédent d'angio-œdème facial et les taux d'estérase C-1 étaient normaux. L'œdème de Quincke a été diagnostiqué par des procédures comprenant une tomodensitométrie ou une échographie abdominale, ou lors d'une intervention chirurgicale, et les symptômes ont disparu après l'arrêt de l'inhibiteur de l'ECA. L'œdème de Quincke intestinal doit être inclus dans le diagnostic différentiel des patients sous IEC présentant des douleurs abdominales.
Les patients ayant des antécédents d'œdème de Quincke non lié au traitement par un inhibiteur de l'ECA peuvent être exposés à un risque accru d'œdème de Quincke lorsqu'ils reçoivent un inhibiteur de l'ECA (voir également INDICATIONS ET USAGE et CONTRE-INDICATIONS ).
Réactions anaphylactoïdes pendant la désensibilisation
Deux patients subissant un traitement de désensibilisation au venin d'hyménoptère tout en recevant des inhibiteurs de l'ECA ont subi des réactions anaphylactoïdes potentiellement mortelles. Chez les mêmes patients, ces réactions ont été évitées lorsque les inhibiteurs de l'ECA ont été temporairement suspendus, mais elles sont réapparues lors d'une nouvelle provocation par inadvertance.
Réactions anaphylactoïdes lors de l'exposition à la membrane
Des réactions anaphylactoïdes ont été rapportées chez des patients dialysés avec des membranes à haut débit et traités simultanément par un inhibiteur de l'ECA. Des réactions anaphylactoïdes ont également été rapportées chez des patients subissant une aphérèse des lipoprotéines de basse densité avec absorption de sulfate de dextran.
Hypotension
Une hypotension excessive est rare chez les patients hypertendus non compliqués traités par VASOTEC 5 mg seul. Les patients atteints d'insuffisance cardiaque recevant VASOTEC présentent généralement une certaine réduction de la pression artérielle, en particulier avec la première dose, mais l'arrêt du traitement en cas d'hypotension symptomatique persistante n'est généralement pas nécessaire lorsque les instructions de dosage sont suivies ; la prudence s'impose lors de l'instauration du traitement (voir DOSAGE ET ADMINISTRATION ). Les patients à risque d'hypotension excessive, parfois associée à une oligurie et/ou une azotémie progressive, et rarement à une insuffisance rénale aiguë et/ou à la mort, comprennent ceux qui présentent les affections ou caractéristiques suivantes : insuffisance cardiaque, hyponatrémie, traitement diurétique à forte dose, diurèse ou augmentation de la dose de diurétique, dialyse rénale ou déplétion volémique et/ou sodée sévère de toute étiologie. Il peut être conseillé d'éliminer le diurétique (sauf chez les patients souffrant d'insuffisance cardiaque), de réduire la dose de diurétique ou d'augmenter la consommation de sel avec prudence avant d'initier le traitement par VASOTEC 10 mg chez les patients à risque d'hypotension excessive qui sont capables de tolérer de tels ajustements (voir INTERACTIONS MÉDICAMENTEUSES et EFFETS INDÉSIRABLES ). Chez les patients à risque d'hypotension excessive, le traitement doit être instauré sous surveillance médicale très étroite et ces patients doivent être suivis étroitement pendant les deux premières semaines de traitement et chaque fois que la dose d'énalapril et/ou de diurétique est augmentée. Des considérations similaires peuvent s'appliquer aux patients atteints d'une ischémie cardiaque ou d'une maladie cérébrovasculaire, chez qui une chute excessive de la pression artérielle pourrait entraîner un infarctus du myocarde ou un accident vasculaire cérébral.
En cas d'hypotension excessive, le patient doit être placé en décubitus dorsal et, si nécessaire, recevoir une perfusion intraveineuse de solution saline normale. Une réponse hypotensive transitoire n'est pas une contre-indication à des doses supplémentaires de VASOTEC 2,5 mg, qui peuvent généralement être administrées sans difficulté une fois la pression artérielle stabilisée. Si une hypotension symptomatique se développe, une réduction de la dose ou l'arrêt de VASOTEC ou d'un diurétique concomitant peut être nécessaire.
Neutropénie/Agranulocytose
Il a été démontré qu'un autre inhibiteur de l'enzyme de conversion de l'angiotensine, le captopril, provoque une agranulocytose et une aplasie médullaire, rarement chez les patients non compliqués, mais plus fréquemment chez les patients insuffisants rénaux, en particulier s'ils présentent également une maladie vasculaire du collagène. Les données disponibles issues des essais cliniques sur l'énalapril sont insuffisantes pour montrer que l'énalapril ne provoque pas d'agranulocytose à des taux similaires. L'expérience de commercialisation a révélé des cas de neutropénie ou d'agranulocytose dans lesquels une relation causale avec l'énalapril ne peut être exclue. Une surveillance périodique du nombre de globules blancs chez les patients atteints d'une maladie vasculaire du collagène et d'une maladie rénale doit être envisagée.
Défaillance hépatique
Rarement, les inhibiteurs de l'ECA ont été associés à un syndrome qui commence par un ictère cholestatique et évolue vers une nécrose hépatique fulminante et (parfois) la mort. Le mécanisme de ce syndrome n'est pas compris. Les patients recevant des inhibiteurs de l'ECA qui développent un ictère ou des élévations marquées des enzymes hépatiques doivent arrêter l'inhibiteur de l'ECA et recevoir un suivi médical approprié.
Toxicité fœtale
L'utilisation de médicaments qui agissent sur le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales. L'oligohydramnios qui en résulte peut être associé à une hypoplasie pulmonaire fœtale et à des déformations squelettiques. Les effets indésirables néonataux potentiels comprennent l'hypoplasie crânienne, l'anurie, l'hypotension, l'insuffisance rénale et la mort. Lorsqu'une grossesse est détectée, arrêtez VASOTEC 10 mg dès que possible. Ces effets indésirables sont généralement associés à l'utilisation de ces médicaments au cours des deuxième et troisième trimestres de la grossesse. La plupart des études épidémiologiques examinant les anomalies fœtales après exposition à l'utilisation d'antihypertenseurs au cours du premier trimestre n'ont pas distingué les médicaments affectant le système rénine-angiotensine des autres agents antihypertenseurs. La prise en charge appropriée de l'hypertension maternelle pendant la grossesse est importante pour optimiser les résultats pour la mère et le fœtus.
Dans le cas inhabituel où il n'y a pas d'alternative appropriée au traitement par des médicaments affectant le système rénine-angiotensine pour un patient particulier, informer la mère du risque potentiel pour le fœtus. Effectuer des examens échographiques en série pour évaluer l'environnement intra-amniotique. Si un oligohydramnios est observé, arrêter VASOTEC, à moins qu'il ne soit considéré comme salvateur pour la mère. Des tests fœtaux peuvent être appropriés, en fonction de la semaine de grossesse. Les patients et les médecins doivent toutefois savoir que l'oligohydramnios peut n'apparaître qu'après que le fœtus a subi une lésion irréversible. Observer attentivement les nourrissons ayant des antécédents d'exposition in utero à VASOTEC pour l'hypotension, l'oligurie et l'hyperkaliémie (voir PRÉCAUTIONS , Utilisation pédiatrique ).
Aucun effet tératogène de l'énalapril n'a été observé dans les études sur des rats et des lapins gravides. Sur la base de la surface corporelle, les doses utilisées étaient respectivement de 57 fois et 12 fois la dose quotidienne humaine maximale recommandée (MRHDD).
PRÉCAUTIONS
Général
Sténose aortique/cardiomyopathie hypertrophique
Comme avec tous les vasodilatateurs, l'énalapril doit être administré avec prudence aux patients présentant une obstruction de la voie d'éjection du ventricule gauche.
Fonction rénale altérée
En conséquence de l'inhibition du système rénine-angiotensine-aldostérone, des modifications de la fonction rénale peuvent être anticipées chez les personnes sensibles. Chez les patients atteints d'insuffisance cardiaque sévère dont la fonction rénale peut dépendre de l'activité du système rénine-angiotensine-aldostérone, le traitement par les inhibiteurs de l'enzyme de conversion de l'angiotensine, y compris VASOTEC, peut être associé à une oligurie et/ou une azotémie progressive et rarement à une insuffisance rénale aiguë et /ou la mort (voir INTERACTIONS MÉDICAMENTEUSES ).
Dans des études cliniques chez des patients hypertendus présentant une sténose unilatérale ou bilatérale de l'artère rénale, des augmentations de l'azote uréique sanguin et de la créatinine sérique ont été observées chez 20 % des patients. Ces augmentations étaient presque toujours réversibles à l'arrêt de l'énalapril et/ou du traitement diurétique. Chez ces patients, la fonction rénale doit être surveillée pendant les premières semaines de traitement.
Certains patients souffrant d'hypertension ou d'insuffisance cardiaque sans maladie vasculaire rénale préexistante apparente ont développé des augmentations de l'urée sanguine et de la créatinine sérique, généralement mineures et transitoires, en particulier lorsque VASOTEC a été administré en concomitance avec un diurétique. Ceci est plus susceptible de se produire chez les patients présentant une insuffisance rénale préexistante. Une réduction de la posologie et/ou l'arrêt du diurétique et/ou de VASOTEC 5 mg peuvent être nécessaires.
L'évaluation des patients souffrant d'hypertension ou d'insuffisance cardiaque doit toujours inclure une évaluation de la fonction rénale (voir DOSAGE ET ADMINISTRATION ).
Hyperkaliémie
Une kaliémie élevée (supérieure à 5,7 mEq/L) a été observée chez environ un pour cent des patients hypertendus dans les essais cliniques. Dans la plupart des cas, il s'agissait de valeurs isolées qui ont disparu malgré la poursuite du traitement. L'hyperkaliémie était une cause d'arrêt du traitement chez 0,28 % des patients hypertendus. Dans les essais cliniques sur l'insuffisance cardiaque, une hyperkaliémie a été observée chez 3,8 % des patients, mais n'a pas été une cause d'arrêt du traitement.
Les facteurs de risque de développement de l'hyperkaliémie comprennent l'insuffisance rénale, le diabète sucré et l'utilisation concomitante de diurétiques épargneurs de potassium, de suppléments de potassium et/ou de substituts de sel contenant du potassium, qui doivent être utilisés avec prudence, voire pas du tout, avec VASOTEC (voir INTERACTIONS MÉDICAMENTEUSES ).
Toux
Vraisemblablement en raison de l'inhibition de la dégradation de la bradykinine endogène, une toux non productive persistante a été rapportée avec tous les inhibiteurs de l'ECA, se résolvant toujours après l'arrêt du traitement. La toux induite par les inhibiteurs de l'ECA doit être prise en compte dans le diagnostic différentiel de la toux.
Chirurgie/Anesthésie
Chez les patients subissant une intervention chirurgicale majeure ou pendant une anesthésie avec des agents hypotenseurs, l'énalapril peut bloquer la formation d'angiotensine II secondaire à la libération compensatoire de rénine. Si une hypotension survient et est considérée comme due à ce mécanisme, elle peut être corrigée par une expansion volémique.
Carcinogenèse, mutagenèse, altération de la fertilité
Aucun effet tumorigène n'a été observé lorsque l'énalapril a été administré pendant 106 semaines à des rats mâles et femelles à des doses allant jusqu'à 90 mg/kg/jour ou pendant 94 semaines à des souris mâles et femelles à des doses allant jusqu'à 90 et 180 mg/kg/jour. jour, respectivement. Ces doses sont 26 fois (chez les rats et les souris femelles) et 13 fois (chez les souris mâles) la dose quotidienne humaine recommandée maximale (MRHDD) lorsqu'elles sont comparées sur la base de la surface corporelle.
Ni le maléate d'énalapril ni le diacide actif n'étaient mutagènes dans le test de mutagène microbien d'Ames avec ou sans activation métabolique. L'énalapril s'est également révélé négatif dans les études de génotoxicité suivantes : test de rec-test, test de mutation inverse avec E. coli, échange de chromatides sœurs avec des cellules de mammifères en culture et test du micronoyau avec des souris, ainsi que dans une étude cytogénique in vivo utilisant de la moelle osseuse de souris. .
Il n'y a eu aucun effet indésirable sur la performance reproductive des rats mâles et femelles traités avec jusqu'à 90 mg/kg/jour d'énalapril (26 fois la MRHDD par rapport à la surface corporelle).
Grossesse
Mères allaitantes
L'énalapril et l'énalaprilat ont été détectés dans le lait maternel humain. En raison du risque d'effets indésirables graves chez les nourrissons à partir de l'énalapril, une décision doit être prise soit d'interrompre l'allaitement soit d'arrêter VASOTEC 2,5 mg, en tenant compte de l'importance du médicament pour la mère.
Utilisation pédiatrique
Nouveau-nés ayant des antécédents d'exposition in utero à VASOTEC
En cas d'oligurie ou d'hypotension, diriger l'attention vers le soutien de la pression artérielle et de la perfusion rénale. Des exsanguinotransfusions ou une dialyse peuvent être nécessaires pour inverser l'hypotension et/ou remplacer les troubles de la fonction rénale. L'énalapril, qui traverse le placenta, a été retiré de la circulation néonatale par dialyse péritonéale avec un certain bénéfice clinique, et peut théoriquement être retiré par exsanguinotransfusion, bien qu'il n'y ait aucune expérience avec cette dernière procédure.
Les effets antihypertenseurs de VASOTEC ont été établis chez les patients pédiatriques hypertendus âgés de 1 mois à 16 ans. L'utilisation de VASOTEC 5 mg dans ces tranches d'âge est étayée par des preuves issues d'études adéquates et bien contrôlées de VASOTEC 2,5 mg chez des patients pédiatriques et adultes ainsi que par la littérature publiée chez des patients pédiatriques (voir PHARMACOLOGIE CLINIQUE , Pharmacologie clinique chez les patients pédiatriques et DOSAGE ET ADMINISTRATION ).
VASOTEC n'est pas recommandé chez les nouveau-nés et chez les patients pédiatriques avec un débit de filtration glomérulaire
SURDOSAGE
Des données limitées sont disponibles concernant le surdosage chez l'homme.
Des doses orales uniques d'énalapril supérieures à 1 000 mg/kg et ≥ 1 775 mg/kg ont été associées à une létalité chez la souris et le rat, respectivement.
La manifestation la plus probable d'un surdosage serait l'hypotension, pour laquelle le traitement habituel serait une perfusion intraveineuse de solution saline normale.
L'énalaprilate peut être retiré de la circulation générale par hémodialyse et a été retiré de la circulation néonatale par dialyse péritonéale (voir AVERTISSEMENTS , Réactions anaphylactoïdes lors de l'exposition à la membrane ).
CONTRE-INDICATIONS
VASOTEC 2,5 mg est contre-indiqué chez les patients hypersensibles à ce produit et chez les patients ayant des antécédents d'œdème de Quincke lié à un traitement antérieur par un inhibiteur de l'enzyme de conversion de l'angiotensine et chez les patients présentant un œdème de Quincke héréditaire ou idiopathique.
Ne pas co-administrer l'aliskirène avec VASOTEC chez les patients diabétiques (voir INTERACTIONS MÉDICAMENTEUSES ).
VASOTEC 10 mg est contre-indiqué en association avec un inhibiteur de la néprilysine (par exemple, le sacubitril). Ne pas administrer VASOTEC dans les 36 heures suivant le passage au sacubitril/valsartan, un inhibiteur de la néprilysine (voir AVERTISSEMENTS ).
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
L'énalapril, après hydrolyse en énalaprilate, inhibe l'enzyme de conversion de l'angiotensine (ECA) chez les sujets humains et les animaux. L'ACE est une peptidyl dipeptidase qui catalyse la conversion de l'angiotensine I en substance vasoconstrictrice, l'angiotensine II. L'angiotensine II stimule également la sécrétion d'aldostérone par le cortex surrénalien. Les effets bénéfiques de l'énalapril dans l'hypertension et l'insuffisance cardiaque semblent résulter principalement de la suppression du système rénine-angiotensine-aldostérone. L'inhibition de l'ECA entraîne une diminution de l'angiotensine II plasmatique, ce qui entraîne une diminution de l'activité vasopressive et une diminution de la sécrétion d'aldostérone. Bien que cette dernière diminution soit faible, elle entraîne de légères augmentations du potassium sérique. Chez les patients hypertendus traités par VASOTEC seul jusqu'à 48 semaines, des augmentations moyennes de la kaliémie d'environ 0,2 mEq/L ont été observées. Chez les patients traités par VASOTEC 5 mg plus un diurétique thiazidique, il n'y a pratiquement pas eu de modification de la kaliémie (voir PRÉCAUTIONS ). L'élimination de la rétroaction négative de l'angiotensine II sur la sécrétion de rénine entraîne une augmentation de l'activité de la rénine plasmatique.
L'ACE est identique à la kininase, une enzyme qui dégrade la bradykinine. Il reste à déterminer si des niveaux accrus de bradykinine, un puissant peptide vasodépresseur, jouent un rôle dans les effets thérapeutiques de VASOTEC.
Bien que le mécanisme par lequel VASOTEC 5 mg abaisse la tension artérielle semble être principalement la suppression du système rénine-angiotensine-aldostérone, VASOTEC 10 mg est antihypertenseur même chez les patients présentant une hypertension à rénine basse. Bien que VASOTEC ait été antihypertenseur dans toutes les races étudiées, les patients noirs hypertendus (généralement une population hypertendue à rénine basse) ont eu une réponse moyenne plus faible à l'énalapril en monothérapie que les patients non noirs.
Pharmacocinétique et métabolisme
Après l'administration orale de VASOTEC, les concentrations sériques maximales d'énalapril sont atteintes en une heure environ. Sur la base de la récupération urinaire, le degré d'absorption de l'énalapril est d'environ 60 %. L'absorption de l'énalapril n'est pas influencée par la présence d'aliments dans le tractus gastro-intestinal. Après absorption, l'énalapril est hydrolysé en énalaprilate, qui est un inhibiteur de l'enzyme de conversion de l'angiotensine plus puissant que l'énalapril ; l'énalaprilate est mal absorbé lorsqu'il est administré par voie orale. Les concentrations sériques maximales d'énalaprilate surviennent trois à quatre heures après une dose orale de maléate d'énalapril. L'excrétion de VASOTEC est principalement rénale. Environ 94 % de la dose est récupérée dans l'urine et les matières fécales sous forme d'énalaprilat ou d'énalapril. Les principaux composants de l'urine sont l'énalaprilat, qui représente environ 40 % de la dose, et l'énalapril intact. Il n'y a aucune preuve de métabolites de l'énalapril, autres que l'énalaprilate.
Le profil de concentration sérique de l'énalaprilate présente une phase terminale prolongée, représentant apparemment une petite fraction de la dose administrée qui a été liée à l'ECA. La quantité liée n'augmente pas avec la dose, indiquant un site de liaison saturable. La demi-vie efficace d'accumulation de l'énalaprilate après plusieurs doses de maléate d'énalapril est de 11 heures. L'élimination de l'énalapril et de l'énalaprilate chez les patients insuffisants rénaux est similaire à celle des patients ayant une fonction rénale normale jusqu'à ce que le débit de filtration glomérulaire soit de 30 mL/min ou moins. Avec un débit de filtration glomérulaire ≤ 30 mL/min, les concentrations maximales et minimales d'énalaprilate augmentent, le temps jusqu'à la concentration maximale augmente et le temps jusqu'à l'état d'équilibre peut être retardé. La demi-vie efficace de l'énalaprilate après plusieurs doses de maléate d'énalapril est prolongée à ce niveau d'insuffisance rénale (voir DOSAGE ET ADMINISTRATION ). L'énalaprilat est dialysable à raison de 62 mL/min.
Des études chez le chien indiquent que l'énalapril traverse mal, voire pas du tout, la barrière hémato-encéphalique ; l'énalaprilat ne pénètre pas dans le cerveau. Des doses multiples de maléate d'énalapril chez le rat n'entraînent pas d'accumulation dans les tissus. Le lait des rats en lactation contient de la radioactivité suite à l'administration de maléate d'énalapril marqué au 14C. On a constaté que la radioactivité traversait le placenta après l'administration d'un médicament marqué à des hamsters gravides.
Pharmacodynamique et effets cliniques
Hypertension
L'administration de VASOTEC à des patients souffrant d'hypertension de gravité allant de légère à sévère entraîne une réduction de la tension artérielle en position couchée et debout, généralement sans composante orthostatique. L'hypotension orthostatique symptomatique est donc peu fréquente, bien qu'elle puisse être anticipée chez les patients hypovolémiques (voir AVERTISSEMENTS ).
Chez la plupart des patients étudiés, après l'administration orale d'une dose unique d'énalapril, le début de l'activité antihypertensive a été observé à une heure avec un pic de réduction de la pression artérielle atteint en quatre à six heures.
Aux doses recommandées, les effets antihypertenseurs ont été maintenus pendant au moins 24 heures. Chez certains patients, les effets peuvent diminuer vers la fin de l'intervalle posologique (voir DOSAGE ET ADMINISTRATION ).
Chez certains patients, l'obtention d'une réduction optimale de la pression artérielle peut nécessiter plusieurs semaines de traitement.
Les effets antihypertenseurs de VASOTEC se sont poursuivis pendant un traitement à long terme. L'arrêt brutal de VASOTEC 10 mg n'a pas été associé à une augmentation rapide de la pression artérielle.
Dans les études hémodynamiques chez des patients souffrant d'hypertension essentielle, la réduction de la pression artérielle s'est accompagnée d'une réduction de la résistance artérielle périphérique avec une augmentation du débit cardiaque et peu ou pas de changement de la fréquence cardiaque. Suite à l'administration de VASOTEC, il y a une augmentation du débit sanguin rénal; le taux de filtration glomérulaire est généralement inchangé. Les effets semblent être similaires chez les patients souffrant d'hypertension rénovasculaire.
Lorsqu'il est administré avec des diurétiques de type thiazidique, les effets hypotenseurs de VASOTEC 5 mg sont approximativement additifs.
Dans une étude de pharmacologie clinique, l'indométhacine ou le sulindac ont été administrés à des patients hypertendus recevant VASOTEC. Dans cette étude, il n'y avait aucune preuve d'un émoussement de l'action antihypertensive de VASOTEC (voir INTERACTIONS MÉDICAMENTEUSES ).
Insuffisance cardiaque
Dans des essais menés chez des patients traités par digitaliques et diurétiques, le traitement par énalapril a entraîné une diminution de la résistance vasculaire systémique, de la pression artérielle, de la pression capillaire pulmonaire et de la taille du cœur, ainsi qu'une augmentation du débit cardiaque et de la tolérance à l'effort. La fréquence cardiaque était inchangée ou légèrement réduite, et la fraction d'éjection moyenne était inchangée ou augmentée. Il y avait un effet bénéfique sur la gravité de l'insuffisance cardiaque telle que mesurée par la classification de la New York Heart Association (NYHA) et sur les symptômes de dyspnée et de fatigue. Des effets hémodynamiques ont été observés après la première dose et semblaient se maintenir dans des études non contrôlées d'une durée allant jusqu'à quatre mois. Des effets sur la tolérance à l'exercice, la taille du cœur, la gravité et les symptômes de l'insuffisance cardiaque ont été observés dans des études contrôlées par placebo d'une durée de huit semaines à plus d'un an.
Insuffisance cardiaque, essais de mortalité
Dans un essai clinique multicentrique contrôlé par placebo, 2 569 patients présentant tous les degrés d'insuffisance cardiaque symptomatique et une fraction d'éjection ≤ 35 % ont été randomisés pour recevoir un placebo ou l'énalapril et ont été suivis jusqu'à 55 mois (SOLVD-Treatment). L'utilisation de l'énalapril a été associée à une réduction de 11 % de la mortalité toutes causes confondues et à une réduction de 30 % des hospitalisations pour insuffisance cardiaque. Les maladies qui ont exclu les patients de l'inscription à l'étude comprenaient l'angor stable sévère (> 2 crises/jour), une obstruction valvulaire ou des voies d'éjection significative sur le plan hémodynamique, une insuffisance rénale (créatinine > 2,5 mg/dL), une maladie cérébrovasculaire (p. ex., une maladie importante de l'artère carotide) , maladie pulmonaire avancée, tumeurs malignes, myocardite active et péricardite constrictive. Le bénéfice sur la mortalité associé à l'énalapril ne semble pas dépendre de la présence de digitaliques.
Un deuxième essai multicentrique a utilisé le protocole SOLVD pour l'étude de patients asymptomatiques ou peu symptomatiques. Les patients SOLVD-Prevention, qui avaient une fraction d'éjection ventriculaire gauche ≤ 35 % et aucun antécédent d'insuffisance cardiaque symptomatique, ont été randomisés pour recevoir un placebo (n = 2117) ou l'énalapril (n = 2111) et ont été suivis jusqu'à 5 ans. La majorité des patients de l'essai SOLVD-Prevention avaient des antécédents de cardiopathie ischémique. Des antécédents d'infarctus du myocarde étaient présents chez 80 % des patients, une angine de poitrine actuelle chez 34 % et des antécédents d'hypertension chez 37 %. Aucun effet de mortalité statistiquement significatif n'a été démontré dans cette population. Les sujets traités par l'énalapril avaient 32 % moins de premières hospitalisations pour insuffisance cardiaque et 32 % moins d'hospitalisations totales pour insuffisance cardiaque. Par rapport au placebo, 32 % de patients en moins recevant de l'énalapril ont développé des symptômes d'insuffisance cardiaque manifeste. Les hospitalisations pour raisons cardiovasculaires ont également diminué. Il y a eu une réduction non significative des hospitalisations pour toute cause dans le groupe de traitement par l'énalapril (pour l'énalapril contre le placebo, respectivement, 1166 contre 1201 premières hospitalisations, 2649 contre 2840 hospitalisations au total), bien que l'étude n'ait pas été conçue pour rechercher une telle effet.
L'essai SOLVD-Prévention n'a pas été conçu pour déterminer si le traitement des patients asymptomatiques à faible fraction d'éjection serait supérieur, en termes de prévention d'hospitalisation, à un suivi rapproché et à l'utilisation d'énalapril dès les premiers signes d'insuffisance cardiaque. Cependant, dans les conditions de suivi de l'essai SOLVD-Prévention (tous les 4 mois à la clinique de l'étude ; médecin personnel au besoin), 68 % des patients sous placebo hospitalisés pour insuffisance cardiaque n'avaient pas enregistré de symptômes antérieurs qui auraient a signalé le début du traitement.
L'essai SOLVD-Prevention n'a pas non plus été conçu pour montrer si l'énalapril modifiait la progression de la maladie cardiaque sous-jacente.
Dans un autre essai multicentrique contrôlé par placebo (CONSENSUS) limité aux patients atteints d'insuffisance cardiaque congestive de classe NYHA IV et présentant des signes radiographiques de cardiomégalie, l'utilisation de l'énalapril a été associée à une amélioration de la survie. Les résultats sont présentés dans le tableau suivant.
Dans les essais CONSENSUS et SOLVD-Treatment, les patients recevaient également généralement de la digitaline, des diurétiques ou les deux.
Pharmacologie clinique chez les patients pédiatriques
Une étude pharmacocinétique à doses multiples a été menée chez 40 patients pédiatriques hypertendus de sexe masculin et féminin âgés de 2 mois à ≤ 16 ans après administration orale quotidienne de 0,07 à 0,14 mg/kg de maléate d'énalapril. À l'état d'équilibre, la demi-vie efficace moyenne d'accumulation de l'énalaprilat était de 14 heures et la récupération urinaire moyenne de l'énalapril total et de l'énalaprilat en 24 heures était de 68 % de la dose administrée. La conversion de l'énalapril en énalaprilat était de l'ordre de 63 à 76 %. Les résultats globaux de cette étude indiquent que la pharmacocinétique de l'énalapril chez les enfants hypertendus âgés de 2 mois à ≤ 16 ans est cohérente dans toutes les tranches d'âge étudiées et cohérente avec les données pharmacocinétiques historiques chez les adultes sains.
Dans une étude clinique portant sur 110 patients pédiatriques hypertendus âgés de 6 à 16 ans, les patients pesant
Dans les études pédiatriques ci-dessus, le maléate d'énalapril a été administré sous forme de comprimés de VASOTEC et pour les enfants et les nourrissons qui étaient incapables d'avaler des comprimés ou qui avaient besoin d'une dose plus faible que celle disponible sous forme de comprimés, l'énalapril a été administré sous forme de suspension (voir DOSAGE ET ADMINISTRATION , Préparation de la suspension ).
INFORMATIONS PATIENTS
Angiœdème
L'œdème de Quincke, y compris l'œdème laryngé, peut survenir à tout moment au cours du traitement par les inhibiteurs de l'enzyme de conversion de l'angiotensine, y compris l'énalapril. Les patients doivent en être informés et leur dire de signaler immédiatement tout signe ou symptôme évoquant un œdème de Quincke (gonflement du visage, des extrémités, des yeux, des lèvres, de la langue, difficulté à avaler ou à respirer) et de ne plus prendre de médicament tant qu'ils n'ont pas consulté le médecin prescripteur.
Hypotension
Les patients doivent être avertis de signaler les étourdissements, en particulier au cours des premiers jours de traitement. Si une véritable syncope survient, il faut dire aux patients d'arrêter le médicament jusqu'à ce qu'ils aient consulté le médecin prescripteur. Tous les patients doivent être avertis qu'une transpiration excessive et une déshydratation peuvent entraîner une chute excessive de la pression artérielle en raison de la réduction du volume de liquide. D'autres causes de déplétion volémique telles que les vomissements ou la diarrhée peuvent également entraîner une chute de la pression artérielle ; il faut conseiller aux patients de consulter leur médecin.
Hyperkaliémie
Les patients doivent être informés de ne pas utiliser de substituts de sel contenant du potassium sans consulter leur médecin.
Neutropénie
Les patients doivent être informés qu'ils doivent signaler rapidement tout signe d'infection (par exemple, mal de gorge, fièvre) pouvant être un signe de neutropénie.
Grossesse
Les patientes en âge de procréer doivent être informées des conséquences d'une exposition à VASOTEC pendant la grossesse. Discutez des options de traitement avec les femmes qui envisagent de devenir enceintes. Les patientes doivent être invitées à signaler les grossesses à leur médecin dès que possible.
REMARQUE : Comme pour de nombreux autres médicaments, certains conseils aux patients traités par l'énalapril sont justifiés. Ces informations sont destinées à faciliter l'utilisation sûre et efficace de ce médicament. Il ne s'agit pas d'une divulgation de tous les effets indésirables ou intentionnels possibles.
