Avapro 150mg, 300mg Irbesartan Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Avapro 300 mg et comment est-il utilisé ?
Avapro 300 mg est un médicament sur ordonnance utilisé pour traiter les symptômes de l'hypertension artérielle (hypertension), les douleurs nerveuses causées par le diabète de type 2. Avapro peut être utilisé seul ou avec d'autres médicaments.
Avapro 300 mg appartient à une classe de médicaments ARB.
On ne sait pas si Avapro 150 mg est sûr et efficace chez les enfants de moins de 6 ans.
Quels sont les effets secondaires possibles d'Avapro 300mg ?
Avapro peut provoquer des effets secondaires graves, notamment :
- douleurs musculaires inexpliquées,
- tendresse ou faiblesse,
- fièvre,
- fatigue inhabituelle,
- urine de couleur foncée,
- étourdissement,
- peu ou pas de miction,
- gonflement,
- prise de poids rapide,
- confusion,
- perte d'appétit,
- des vomissements et
- douleur au côté ou au bas du dos
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Avapro incluent :
- diarrhée,
- brûlures d'estomac,
- maux d'estomac, et
- sensation de fatigue
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Avapro. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
TOXICITÉ FŒTALE
- Lorsqu'une grossesse est détectée, arrêtez AVAPRO dès que possible.
- Les médicaments qui agissent directement sur la rénine-angiotense dans le système peuvent causer des blessures et la mort du fœtus en développement [voir MISES EN GARDE ET PRÉCAUTIONS].
LA DESCRIPTION
AVAPRO (irbésartan) est un antagoniste des récepteurs de l'angiotensine II (sous-type AT1).
L'irbésartan est un composé non peptidique, chimiquement décrit comme un 2-butyl-3-[p-(o-1H-tétrazol-5-ylphényl)benzyl]-1,3-diazaspiro[4.4]non-1-en-4 -une.
Sa formule empirique est C25H28N6O, et la formule développée :
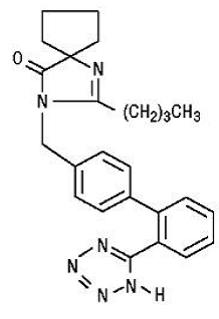
L'irbésartan est une poudre cristalline blanche à blanc cassé d'un poids moléculaire de 428,5. C'est un composé non polaire avec un coefficient de partage (octanol/eau) de 10,1 à un pH de 7,4. L'irbésartan est légèrement soluble dans l'alcool et le chlorure de méthylène et pratiquement insoluble dans l'eau.
AVAPRO est disponible pour administration orale en comprimés non sécables contenant 75 mg, 150 mg ou 300 mg d'irbésartan. Les ingrédients inactifs comprennent : lactose, cellulose microcristalline, amidon prégélatinisé, croscarmellose sodique, poloxamère 188, dioxyde de silicium et stéarate de magnésium.
LES INDICATIONS
Hypertension
AVAPRO® est indiqué pour le traitement de l'hypertension, pour abaisser la tension artérielle. L'abaissement de la pression artérielle diminue le risque d'événements cardiovasculaires (CV) mortels et non mortels, principalement des accidents vasculaires cérébraux et des infarctus du myocarde. Ces avantages ont été observés dans des essais contrôlés de médicaments antihypertenseurs d'une grande variété de classes pharmacologiques, y compris ce médicament.
Le contrôle de l'hypertension artérielle doit faire partie d'une gestion globale des risques cardiovasculaires, y compris, le cas échéant, le contrôle des lipides, la gestion du diabète, la thérapie antithrombotique, l'arrêt du tabac, l'exercice et un apport limité en sodium. De nombreux patients auront besoin de plus d'un médicament pour atteindre leurs objectifs de tension artérielle. Pour des conseils spécifiques sur les objectifs et la gestion, consultez les directives publiées, telles que celles du Comité national mixte sur la prévention, la détection, l'évaluation et le traitement de l'hypertension artérielle (JNC) du National High Blood Pressure Education Program.
De nombreux médicaments antihypertenseurs, appartenant à une variété de classes pharmacologiques et avec différents mécanismes d'action, ont été montrés dans des essais contrôlés randomisés pour réduire la morbidité et la mortalité cardiovasculaires, et on peut conclure qu'il s'agit de la réduction de la pression artérielle, et non d'une autre propriété pharmacologique de les médicaments, qui est en grande partie responsable de ces avantages. Le bénéfice cardiovasculaire le plus important et le plus constant a été une réduction du risque d'accident vasculaire cérébral, mais des réductions de l'infarctus du myocarde et de la mortalité cardiovasculaire ont également été observées régulièrement.
Une pression systolique ou diastolique élevée entraîne un risque cardiovasculaire accru, et l'augmentation du risque absolu par mmHg est plus importante à des pressions artérielles plus élevées, de sorte que même des réductions modestes de l'hypertension sévère peuvent apporter des avantages substantiels. La réduction du risque relatif de la réduction de la pression artérielle est similaire dans les populations avec un risque absolu variable, de sorte que le bénéfice absolu est plus important chez les patients qui présentent un risque plus élevé indépendamment de leur hypertension (par exemple, les patients atteints de diabète ou d'hyperlipidémie), et ces patients seraient attendus bénéficier d'un traitement plus agressif à un objectif de tension artérielle plus basse.
Certains médicaments antihypertenseurs ont des effets plus faibles sur la pression artérielle (en monothérapie) chez les patients noirs, et de nombreux médicaments antihypertenseurs ont des indications et des effets supplémentaires approuvés (p. ex., sur l'angor, l'insuffisance cardiaque ou la néphropathie diabétique). Ces considérations peuvent guider le choix du traitement.
AVAPRO 300 mg peut être utilisé seul ou en association avec d'autres agents antihypertenseurs.
Néphropathie chez les patients diabétiques de type 2
AVAPRO est indiqué pour le traitement de la néphropathie diabétique chez les patients atteints de diabète de type 2 et d'hypertension, d'une créatinine sérique élevée et d'une protéinurie (> 300 mg/jour). Dans cette population, AVAPRO réduit le taux de progression de la néphropathie tel que mesuré par la survenue d'un doublement de la créatinine sérique ou d'une insuffisance rénale terminale (nécessité d'une dialyse ou d'une transplantation rénale) [voir Etudes cliniques ].
DOSAGE ET ADMINISTRATION
considérations générales
AVAPRO peut être administré avec d'autres agents antihypertenseurs et avec ou sans aliments.
Hypertension
La dose initiale recommandée d'AVAPRO 300 mg est de 150 mg une fois par jour. La posologie peut être augmentée jusqu'à une dose maximale de 300 mg une fois par jour si nécessaire pour contrôler la tension artérielle [voir Etudes cliniques ].
Néphropathie chez les patients diabétiques de type 2
La dose recommandée est de 300 mg une fois par jour [voir Etudes cliniques ].
Ajustement de la dose chez les patients souffrant d'épuisement volumique et sodé
La dose initiale recommandée est de 75 mg une fois par jour chez les patients présentant une déplétion du volume intravasculaire ou du sel (p. ex., les patients traités vigoureusement avec des diurétiques ou sous hémodialyse) [voir AVERTISSEMENTS ET PRECAUTIONS ].
COMMENT FOURNIE
Formes posologiques et points forts
AVAPRO 75 mg est un comprimé pelliculé ovale, biconvexe, blanc à blanc cassé, gravé d'un cœur sur une face et de « 2871 » sur l'autre.
AVAPRO 150 mg est un comprimé pelliculé ovale, biconvexe, blanc à blanc cassé, gravé d'un cœur sur une face et de « 2872 » sur l'autre.
AVAPRO 300 mg est un comprimé pelliculé ovale, biconvexe, blanc à blanc cassé, gravé d'un cœur sur une face et de « 2873 » sur l'autre.
Stockage et manutention
AVAPRO (irbésartan) est offert sous forme de comprimés pelliculés blancs à blanc cassé, ovales, biconvexes, gravés d'un cœur d'un côté et d'un code de l'autre (voir le tableau ci-dessous). Les flacons unitaires d'utilisation contiennent 30 ou 90 comprimés pelliculés comme suit :
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15 °C à 30 °C (59 °F à 86 °F) [voir Température ambiante contrôlée USP ].
sanofi-aventis US LLC, Bridgewater, NJ 08807, UNE SOCIÉTÉ SANOFI. Révisé : septembre 2021
EFFETS SECONDAIRES
Les effets indésirables importants suivants sont décrits ailleurs dans l'étiquetage :
- Hypotension chez les patients souffrant d'épuisement volumique ou sodé [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Fonction rénale altérée [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique. Les informations sur les effets indésirables issues des essais cliniques fournissent cependant une base pour identifier les événements indésirables qui semblent être liés à l'utilisation de médicaments et pour estimer les taux.
Hypertension
AVAPRO a été évalué pour la sécurité chez plus de 4300 patients souffrant d'hypertension et environ 5000 sujets au total. Cette expérience comprend 1303 patients traités depuis plus de 6 mois et 407 patients depuis 1 an ou plus.
Dans les essais cliniques contrôlés par placebo, les effets indésirables suivants ont été rapportés chez au moins 1 % des patients traités par AVAPRO (n = 1965) et à une incidence plus élevée par rapport au placebo (n = 641), à l'exclusion de ceux trop généraux pour être informatifs et ceux pas raisonnablement associés à l'utilisation de médicaments parce qu'ils étaient associés à la condition traitée ou sont très fréquents dans la population traitée, comprennent : diarrhée (3 % contre 2 %), dyspepsie/brûlures d'estomac (2 % contre 1 %) et fatigue (4 % contre 3 %).
L'utilisation d'irbésartan n'a pas été associée à une incidence accrue de toux sèche, comme c'est généralement le cas avec l'utilisation d'inhibiteurs de l'ECA. Dans les études contrôlées versus placebo, l'incidence de la toux chez les patients traités par l'irbésartan était de 2,8 % versus 2,7 % chez les patients recevant le placebo.
Néphropathie chez les patients diabétiques de type 2
Hyperkaliémie
Dans l'Irbesartan Diabetic Nephropathy Trial (IDNT) (protéinurie ≥ 900 mg/jour et créatinine sérique comprise entre 1,0 et 3,0 mg/dL), le pourcentage de patients ayant un potassium > 6 mEq/L était de 18,6 % dans le groupe AVAPRO 300 mg versus 6,0 % dans le groupe placebo. Les abandons dus à l'hyperkaliémie dans le groupe AVAPRO 150 mg étaient de 2,1 % contre 0,4 % dans le groupe placebo.
Dans l'IDNT, les effets indésirables étaient similaires à ceux observés chez les patients hypertendus à l'exception d'une incidence accrue de symptômes orthostatiques qui sont survenus plus fréquemment dans le groupe AVAPRO 150 mg versus placebo : étourdissements (10,2 % contre 6,0 %), étourdissements orthostatiques (5,4 % vs 2,7 %) et hypotension orthostatique (5,4 % vs 3,2 %).
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation d'AVAPRO. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Urticaire; œdème de Quincke (impliquant un gonflement du visage, des lèvres, du pharynx et/ou de la langue) ; réaction anaphylactique, y compris choc anaphylactique ; augmentation des tests de la fonction hépatique ; jaunisse; hépatite; hyperkaliémie; anémie; thrombocytopénie; augmentation de la CPK ; acouphène; et l'hypoglycémie chez les patients diabétiques.
INTERACTIONS MÉDICAMENTEUSES
Agents augmentant le potassium sérique
L'administration concomitante d'AVAPRO avec d'autres médicaments qui augmentent les taux sériques de potassium peut entraîner une hyperkaliémie, parfois grave. Surveiller le potassium sérique chez ces patients.
Lithium
Des augmentations des concentrations sériques de lithium et de la toxicité du lithium ont été rapportées lors de l'utilisation concomitante d'irbésartan et de lithium. Surveiller les taux de lithium chez les patients recevant de l'irbésartan et du lithium.
Anti-inflammatoires non stéroïdiens (AINS), y compris les inhibiteurs sélectifs de la cyclooxygénase-2 (inhibiteurs de la COX-2)
Chez les patients âgés, hypovolémiques (y compris ceux sous traitement diurétique) ou dont la fonction rénale est altérée, la co-administration d'AINS, y compris les inhibiteurs sélectifs de la COX-2, avec des antagonistes des récepteurs de l'angiotensine II (y compris l'irbésartan) peut entraîner une détérioration de la fonction rénale. , y compris une éventuelle insuffisance rénale aiguë. Ces effets sont généralement réversibles. Surveiller périodiquement la fonction rénale chez les patients recevant un traitement par irbésartan et AINS.
L'effet antihypertenseur des antagonistes des récepteurs de l'angiotensine II, y compris l'irbésartan, peut être atténué par les AINS, y compris les inhibiteurs sélectifs de la COX-2.
Double blocage du système rénine-angiotensine (RAS)
Le double blocage du SRA avec les inhibiteurs des récepteurs de l'angiotensine, les inhibiteurs de l'ECA ou l'aliskirène est associé à des risques accrus d'hypotension, d'hyperkaliémie et de modifications de la fonction rénale (y compris l'insuffisance rénale aiguë) par rapport à la monothérapie. La plupart des patients recevant l'association de deux inhibiteurs du RAS n'obtiennent aucun bénéfice supplémentaire par rapport à la monothérapie. En général, évitez l'utilisation combinée d'inhibiteurs du RAS. Surveillez étroitement la pression artérielle, la fonction rénale et les électrolytes chez les patients sous AVAPRO 150 mg et d'autres agents qui affectent le SRA.
Ne pas co-administrer l'aliskirène avec AVAPRO chez les patients diabétiques. Éviter l'utilisation d'aliskirène avec AVAPRO chez les patients présentant une insuffisance rénale (DFG
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Toxicité fœtale
AVAPRO 150 mg peut nuire au fœtus lorsqu'il est administré à une femme enceinte. L'utilisation de médicaments qui agissent sur le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales. L'oligohydramnios qui en résulte peut être associé à une hypoplasie pulmonaire fœtale et à des déformations squelettiques. Les effets indésirables néonataux potentiels comprennent l'hypoplasie crânienne, l'anurie, l'hypotension, l'insuffisance rénale et la mort. Lorsqu'une grossesse est détectée, arrêtez AVAPRO dès que possible [voir Utilisation dans des populations spécifiques ].
Hypotension chez les patients appauvris en volume ou en sel
Chez les patients dont le système rénine-angiotensine est activé, tels que les patients présentant une déplétion volémique ou sodée (par exemple, ceux traités par de fortes doses de diurétiques), une hypotension symptomatique peut survenir après l'initiation du traitement par AVAPRO. Corrigez la déplétion volémique ou sodée avant l'administration d'AVAPRO 300 mg ou utilisez une dose initiale plus faible [voir DOSAGE ET ADMINISTRATION ].
Fonction rénale altérée
Des modifications de la fonction rénale, y compris une insuffisance rénale aiguë, peuvent être causées par des médicaments qui inhibent le système rénine-angiotensine. Les patients dont la fonction rénale peut dépendre en partie de l'activité du système rénine-angiotensine (p. ex., les patients présentant une sténose de l'artère rénale, une maladie rénale chronique, une insuffisance cardiaque sévère ou une déplétion volémique) peuvent présenter un risque particulier de développer une insuffisance rénale aiguë ou de mourir. sur AVAPRO. Surveiller périodiquement la fonction rénale chez ces patients. Envisager de suspendre ou d'arrêter le traitement chez les patients qui développent une diminution cliniquement significative de la fonction rénale sous AVAPRO [voir INTERACTIONS MÉDICAMENTEUSES ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Aucun signe de cancérogénicité n'a été observé lorsque l'irbésartan a été administré à des doses allant jusqu'à 500/1000 mg/kg/jour (mâles/femelles, respectivement) chez le rat et 1000 mg/kg/jour chez la souris pendant jusqu'à 2 ans. Pour les rats mâles et femelles, 500 mg/kg/jour ont fourni une exposition systémique moyenne à l'irbésartan (ASC 0-24 heures, lié et non lié) d'environ 3 et 11 fois, respectivement, l'exposition systémique moyenne chez l'homme recevant l'exposition maximale recommandée chez l'homme. dose (MRHD) de 300 mg d'irbésartan/jour, alors que 1 000 mg/kg/jour (administré aux femmes uniquement) ont fourni une exposition systémique moyenne d'environ 21 fois celle rapportée pour les humains à la MRHD. Pour les souris mâles et femelles, 1000 mg/kg/jour ont fourni une exposition à l'irbésartan d'environ 3 et 5 fois, respectivement, l'exposition humaine à 300 mg/jour.
L'irbésartan n'a pas été mutagène dans une batterie de tests in vitro (test microbien d'Ames, test de réparation de l'ADN des hépatocytes de rat, test de mutation génique directe sur des cellules de mammifères V79). L'irbésartan s'est révélé négatif dans plusieurs tests d'induction d'aberrations chromosomiques (in vitro - dosage des lymphocytes humains ; in vivo - étude du micronoyau de souris).
L'irbésartan n'a eu aucun effet indésirable sur la fertilité ou l'accouplement des rats mâles ou femelles à des doses orales ≤ 650 mg/kg/jour, la dose la plus élevée fournissant une exposition systémique à l'irbésartan (ASC 0–24 heures, lié plus non lié) environ 5 fois celle-ci. trouvé chez les humains recevant le MRHD de 300 mg/jour.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
AVAPRO peut nuire au fœtus lorsqu'il est administré à une femme enceinte. L'utilisation de médicaments qui agissent sur le système rénine-angiotensine pendant les deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales [voir Considérations cliniques ]. La plupart des études épidémiologiques examinant les anomalies fœtales après exposition à l'utilisation d'antihypertenseurs au cours du premier trimestre n'ont pas distingué les médicaments affectant le système rénine-angiotensine des autres agents antihypertenseurs. Lorsqu'une grossesse est détectée, arrêtez AVAPRO 150 mg dès que possible.
Toutes les grossesses présentent un risque de fond de malformation congénitale, de perte ou d'autres effets indésirables, quelle que soit l'exposition aux médicaments. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryo-fœtal associé à la maladie
L'hypertension pendant la grossesse augmente le risque maternel de prééclampsie, de diabète gestationnel, d'accouchement prématuré et de complications à l'accouchement (p. ex., nécessité d'une césarienne et hémorragie post-partum). L'hypertension augmente le risque fœtal de retard de croissance intra-utérin et de mort intra-utérine. Les femmes enceintes souffrant d'hypertension doivent être étroitement surveillées et prises en charge en conséquence.
Effets indésirables fœtaux/néonatals
L'oligohydramnios chez les femmes enceintes qui utilisent des médicaments affectant le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse peut entraîner les effets suivants : une fonction rénale fœtale réduite entraînant une anurie et une insuffisance rénale, une hypoplasie pulmonaire fœtale, des déformations du squelette, y compris une hypoplasie du crâne, une hypotension , et la mort.
Dans le cas inhabituel où il n'y a pas d'alternative appropriée au traitement par des médicaments affectant le système rénine-angiotensine pour un patient particulier, informer la mère du risque potentiel pour le fœtus.
Effectuer des examens échographiques en série pour évaluer l'environnement intra-amniotique. Des tests fœtaux peuvent être appropriés, en fonction de la semaine de grossesse. Les patients et les médecins doivent toutefois savoir que l'oligohydramnios peut n'apparaître qu'après que le fœtus a subi une lésion irréversible. Si un oligohydramnios est observé, envisager un traitement alternatif. Observez attentivement les nourrissons ayant des antécédents d'exposition in utero à AVAPRO pour détecter une hypotension, une oligurie, une hyperkaliémie et d'autres symptômes d'insuffisance rénale. Chez les nouveau-nés ayant des antécédents d'exposition in utero à AVAPRO 300 mg, en cas d'oligurie ou d'hypotension, diriger l'attention vers le soutien de la pression artérielle et de la perfusion rénale. L'exsanguinotransfusion ou la dialyse peuvent être nécessaires pour inverser l'hypotension et/ou remplacer les troubles de la fonction rénale.
Données
Données animales
L'irbésartan traverse le placenta chez le rat et le lapin. Chez des rats femelles ayant reçu de l'irbésartan avant l'accouplement pendant la gestation et la lactation à des doses orales de 50, 180 ou 650 mg/kg/jour (1,6 à 21,1 fois la dose maximale recommandée chez l'homme (MRHD) en fonction de la surface corporelle), les fœtus examinés sur Le 20e jour de gestation a montré des incidences accrues d'urètre hydrogéné et de cavitation pelvienne et/ou d'absence de papille rénale dans tous les groupes traités par l'irbésartan. L'oedème sous-cutané s'est produit aussi dans les foetus aux doses maternelles ≥180 mgs/kg/jours (5.8 fois le MRHD). Ces anomalies sont survenues lorsque des rats femelles ont reçu de l'irbésartan avant l'accouplement jusqu'au jour 20 de la gestation, mais n'ont pas été observées chez les ratons après la naissance dans la même étude, ou lorsque l'irbésartan a été administré à des rats gravides uniquement pendant l'organogenèse (jour de gestation 6 à jour de gestation 15) à doses orales de 50 à 450 mg/kg/jour (jusqu'à 14,6 fois la MRHD). De plus, aucun effet indésirable sur le développement des reins n'a été observé chez les chiots de mères ayant reçu de l'irbésartan du 15e jour de gestation au 24e jour de lactation à des doses de 50, 180 ou 650 mg/kg/jour (jusqu'à 21,1 fois la MRHD). On pense que les effets observés sont des effets gestationnels tardifs du médicament. Les lapines gravides ayant reçu des doses orales d'irbésartan de 30 mg/kg/jour (1,9 fois la MRHD basée sur la surface corporelle) ont connu un taux élevé de mortalité maternelle et d'avortement. Les femelles survivantes ont eu une légère augmentation des résorptions précoces et une diminution correspondante des fœtus vivants.
La radioactivité était présente chez les fœtus de rat et de lapin en fin de gestation après l'administration de doses orales d'irbésartan radiomarqué.
Lactation
Il n'y a pas de données disponibles sur la présence d'irbésartan dans le lait maternel, les effets sur la production de lait ou le nourrisson allaité. L'irbésartan ou un métabolite de l'irbésartan est sécrété dans le lait des rates allaitantes [voir PHARMACOLOGIE CLINIQUE ]. En raison du potentiel d'effets indésirables sur le nourrisson, l'utilisation d'AVAPRO 150 mg chez les femmes qui allaitent n'est pas recommandée.
Utilisation pédiatrique
L'irbésartan, dans une étude à une dose allant jusqu'à 4,5 mg/kg/jour, une fois par jour, n'a pas semblé abaisser efficacement la tension artérielle chez les patients pédiatriques âgés de 6 à 16 ans.
AVAPRO n'a pas été étudié chez les patients pédiatriques de moins de 6 ans.
Utilisation gériatrique
Sur 4925 sujets recevant AVAPRO dans des études cliniques contrôlées sur l'hypertension, 911 (18,5 %) avaient 65 ans et plus, tandis que 150 (3,0 %) avaient 75 ans et plus. Aucune différence globale d'efficacité ou de sécurité n'a été observée entre ces sujets et les sujets plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue. [Voir PHARMACOLOGIE CLINIQUE et Etudes cliniques ]
SURDOSAGE
Aucune donnée n'est disponible concernant le surdosage chez l'homme. Cependant, des doses quotidiennes de 900 mg pendant 8 semaines ont été bien tolérées. On s'attend à ce que les manifestations les plus probables de surdosage soient l'hypotension et la tachycardie; une bradycardie peut également survenir en cas de surdosage. L'irbésartan n'est pas éliminé par hémodialyse.
Des études de toxicité orale aiguë avec l'irbésartan chez la souris et le rat ont indiqué que les doses létales aiguës dépassaient 2000 mg/kg, soit environ 25 fois et 50 fois la MRHD (300 mg) en fonction de la surface corporelle, respectivement.
CONTRE-INDICATIONS
AVAPRO 150 mg est contre-indiqué chez les patients hypersensibles à l'un des composants de ce produit.
Ne pas co-administrer l'aliskirène avec AVAPRO 300 mg chez les patients diabétiques.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
L'angiotensine II est un puissant vasoconstricteur formé à partir de l'angiotensine I dans une réaction catalysée par l'enzyme de conversion de l'angiotensine (ACE, kininase II). L'angiotensine II est la principale hormone vasoactive du système rénine-angiotensine et un composant important dans la physiopathologie de l'hypertension. Il stimule également la sécrétion d'aldostérone par le cortex surrénalien. L'irbésartan bloque les effets vasoconstricteurs et sécréteurs d'aldostérone de l'angiotensine II en se liant sélectivement au récepteur AT1 de l'angiotensine II présent dans de nombreux tissus (p. ex., muscle lisse vasculaire, glande surrénale). Il existe également un récepteur AT2 dans de nombreux tissus, mais il n'est pas impliqué dans l'homéostasie cardiovasculaire.
L'irbésartan est un antagoniste compétitif spécifique des récepteurs AT1 avec une bien plus grande affinité (plus de 8500 fois) pour le récepteur AT1 que pour le récepteur AT2 et sans activité agoniste.
Le blocage du récepteur AT1 supprime la rétroaction négative de l'angiotensine II sur la sécrétion de rénine, mais l'augmentation de l'activité de la rénine plasmatique et de l'angiotensine II circulante qui en résulte ne surmonte pas les effets de l'irbésartan sur la pression artérielle.
L'irbésartan n'inhibe pas l'ECA ou la rénine et n'affecte pas d'autres récepteurs hormonaux ou canaux ioniques connus pour être impliqués dans la régulation cardiovasculaire de la pression artérielle et de l'homéostasie du sodium.
Pharmacodynamie
Chez des sujets sains, des doses orales uniques d'irbésartan allant jusqu'à 300 mg ont produit une inhibition dose-dépendante de l'effet vasopresseur des perfusions d'angiotensine II. L'inhibition était complète (100 %) 4 heures après des doses orales de 150 mg ou 300 mg et une inhibition partielle a été maintenue pendant 24 heures (60 % et 40 % à 300 mg et 150 mg, respectivement).
Chez les patients hypertendus, l'inhibition des récepteurs de l'angiotensine II après administration chronique d'irbésartan entraîne une augmentation de 1,5 à 2 fois de la concentration plasmatique de l'angiotensine II et une augmentation de 2 à 3 fois des taux plasmatiques de rénine. Les concentrations plasmatiques d'aldostérone diminuent généralement après l'administration d'irbésartan, mais les taux sériques de potassium ne sont pas significativement affectés aux doses recommandées.
Chez les patients hypertendus, des doses orales chroniques d'irbésartan (jusqu'à 300 mg) n'ont eu aucun effet sur le débit de filtration glomérulaire, le débit plasmatique rénal ou la fraction de filtration. Dans des études à doses multiples chez des patients hypertendus, aucun effet cliniquement important n'a été observé sur les taux de triglycérides à jeun, de cholestérol total ou de cholestérol HDL. Il n'y avait aucun effet sur l'acide urique sérique lors de l'administration orale chronique, et aucun effet uricosurique.
Pharmacocinétique
Absorption
L'absorption orale de l'irbésartan est rapide et complète avec une biodisponibilité absolue moyenne de 60 % à 80 %. Après administration orale d'AVAPRO, les concentrations plasmatiques maximales d'irbésartan sont atteintes 1,5 à 2 heures après l'administration. La nourriture n'affecte pas la biodisponibilité de l'irbésartan.
L'irbésartan présente une pharmacocinétique linéaire sur l'intervalle de doses thérapeutiques.
Distribution
L'irbésartan est lié à 90 % aux protéines sériques (principalement l'albumine et la glycoprotéine α-acide) avec une liaison négligeable aux composants cellulaires du sang. Le volume moyen de distribution est de 53 à 93 litres.
Des études chez l'animal indiquent que l'irbésartan radiomarqué traverse faiblement la barrière hémato-encéphalique et le placenta. L'irbésartan est excrété dans le lait des rates allaitantes.
Élimination
Les clairances plasmatique et rénale totales se situent respectivement entre 157 et 176 mL/min et entre 3,0 et 3,5 mL/min. La demi-vie d'élimination terminale de l'irbésartan est en moyenne de 11 à 15 heures. Les concentrations à l'état d'équilibre sont atteintes en 3 jours. Une accumulation limitée d'irbésartan (
Métabolisme
L'irbésartan est un agent actif par voie orale qui ne nécessite pas de biotransformation en une forme active. L'irbésartan est métabolisé par conjugaison et oxydation des glucuronides. Après administration orale ou intraveineuse d'irbésartan marqué au C, plus de 80 % de la radioactivité plasmatique circulante est attribuable à l'irbésartan inchangé. Le principal métabolite circulant est le conjugué glucuronide d'irbésartan inactif (environ 6 %). Les métabolites oxydatifs restants n'ajoutent pas de manière appréciable à l'activité pharmacologique de l'irbésartan.
Des études in vitro indiquent que l'irbésartan est oxydé principalement par le CYP2C9 ; le métabolisme par le CYP3A4 est négligeable.
Excrétion
L'irbésartan et ses métabolites sont excrétés par voie biliaire et rénale. Après administration orale ou intraveineuse d'irbésartan marqué au 14C, environ 20 % de la radioactivité est récupérée dans les urines et le reste dans les fèces, sous forme d'irbésartan ou de glucuronide d'irbésartan.
Populations spécifiques
Sexe
Aucune différence liée au sexe dans la pharmacocinétique n'a été observée chez les personnes âgées en bonne santé (65 à 80 ans) ou chez les jeunes sujets en bonne santé (18 à 40 ans). Dans les études de patients hypertendus, il n'y a pas de différence entre les sexes dans la demi-vie ou l'accumulation, mais des concentrations plasmatiques légèrement plus élevées d'irbésartan sont observées chez les femmes (11 % à 44 %). Aucun ajustement posologique lié au sexe n'est nécessaire.
Gériatrie
Chez les sujets âgés (65 à 80 ans), la demi-vie d'élimination de l'irbésartan n'est pas significativement modifiée, mais les valeurs de l'ASC et de la Cmax sont environ 20 % à 50 % supérieures à celles des sujets jeunes (18 à 40 ans). Aucun ajustement posologique n'est nécessaire chez la personne âgée.
Race/ethnie
Chez les sujets noirs en bonne santé, les valeurs de l'ASC de l'irbésartan sont environ 25 % supérieures à celles des sujets blancs ; il n'y a pas de différence dans les valeurs Cmax.
Insuffisance rénale
La pharmacocinétique de l'irbésartan n'est pas modifiée chez les insuffisants rénaux ou chez les patients sous hémodialyse. L'irbésartan n'est pas éliminé par hémodialyse. Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance rénale légère à sévère, à moins qu'un patient insuffisant rénal ne présente également une déplétion volémique [voir AVERTISSEMENTS ET PRECAUTIONS et DOSAGE ET ADMINISTRATION ].
Insuffisance hépatique
La pharmacocinétique de l'irbésartan après administration orale répétée n'est pas significativement affectée chez les patients atteints de cirrhose hépatique légère à modérée. Aucun ajustement posologique n'est nécessaire chez les insuffisants hépatiques.
Interactions médicament-médicament
Des études in vitro montrent une inhibition significative de la formation de métabolites oxydés de l'irbésartan avec les substrats/inhibiteurs connus du cytochrome CYP2C9, le sulfénazole, le tolbutamide et la nifédipine. Cependant, dans les études cliniques, les conséquences de l'irbésartan concomitant sur la pharmacodynamie de la warfarine ont été négligeables. D'après les données in vitro, aucune interaction n'est attendue avec les médicaments dont le métabolisme dépend des isoenzymes 1A1, 1A2, 2A6, 2B6, 2D6, 2E1 ou 3A4 du cytochrome P450.
Dans des études distinctes portant sur des patients recevant des doses d'entretien de warfarine, d'hydrochlorothiazide ou de digoxine, l'administration d'irbésartan pendant 7 jours n'a eu aucun effet sur la pharmacodynamie de la warfarine (temps de prothrombine) ni sur la pharmacocinétique de la digoxine. La pharmacocinétique de l'irbésartan n'est pas affectée par l'administration concomitante de nifédipine ou d'hydrochlorothiazide.
Etudes cliniques
Hypertension
Les effets antihypertenseurs d'AVAPRO ont été examinés dans 7 essais contrôlés par placebo d'une durée de 8 à 12 semaines chez des patients dont la pression artérielle diastolique initiale était de 95 à 110 mmHg. Des doses de 1 à 900 mg ont été incluses dans ces essais afin d'explorer pleinement la gamme de doses d'irbésartan. Ces études ont permis de comparer des schémas thérapeutiques une ou deux fois par jour à 150 mg/jour, des comparaisons d'effets de pic et de creux, et des comparaisons de réponse par sexe, âge et race. Deux des sept essais contrôlés par placebo identifiés ci-dessus ont examiné les effets antihypertenseurs de l'irbésartan et de l'hydrochlorothiazide en association.
Les 7 études sur l'irbésartan en monothérapie ont inclus un total de 1 915 patients randomisés pour l'irbésartan (1 à 900 mg) et 611 patients randomisés pour le placebo. Des doses une fois par jour de 150 mg et 300 mg ont entraîné des diminutions statistiquement et cliniquement significatives de la pression artérielle systolique et diastolique avec des effets résiduels (24 heures après la dose) après 6 à 12 semaines de traitement par rapport au placebo, d'environ 8 à 10/ 5–6 mmHg et 8–12/5–8 mmHg, respectivement. Aucune autre augmentation de l'effet n'a été observée à des doses supérieures à 300 mg. Les relations dose-réponse pour les effets sur la pression systolique et diastolique sont présentées dans les figures 1 et 2.
Figure 1 : Réduction soustraite au placebo de la SeSBP minimale ; analyse intégrée
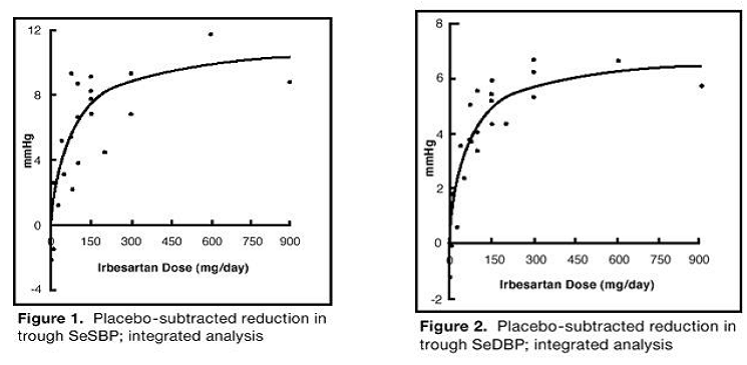
Figure 2 : Réduction soustraite au placebo de la SeSBP minimale ; analyse intégrée
L'administration une fois par jour de doses thérapeutiques d'irbésartan a donné des effets maximaux vers 3 à 6 heures et, dans une étude de surveillance ambulatoire de la pression artérielle, à nouveau vers 14 heures. Cela a été observé avec une administration une fois par jour et deux fois par jour. Les rapports creux/pic pour la réponse systolique et diastolique étaient généralement compris entre 60 % et 70 %. Dans une étude de surveillance continue de la pression artérielle en ambulatoire, une administration uniquotidienne de 150 mg a donné des réponses minimales et moyennes sur 24 heures similaires à celles observées chez les patients recevant une administration biquotidienne à la même dose quotidienne totale.
Dans des essais contrôlés, l'ajout d'irbésartan à des doses d'hydrochlorothiazide de 6,25 mg, 12,5 mg ou 25 mg a produit des réductions supplémentaires de la pression artérielle liées à la dose similaires à celles obtenues avec la même dose d'irbésartan en monothérapie. L'HCTZ a également eu un effet approximativement additif.
L'analyse des sous-groupes d'âge, de sexe et de race de patients a montré que les hommes et les femmes, ainsi que les patients de plus et de moins de 65 ans, avaient des réponses généralement similaires. L'irbésartan a été efficace pour réduire la pression artérielle quelle que soit la race, bien que l'effet ait été un peu moindre chez les Noirs (généralement une population à faible rénine).
L'effet de l'irbésartan est apparent après la première dose, et il est proche de son plein effet observé à 2 semaines. Au terme d'une exposition de 8 semaines, environ les 2/3 de l'effet antihypertenseur étaient encore présents une semaine après la dernière dose. L'hypertension de rebond n'a pas été observée. Il n'y avait pratiquement aucun changement dans la fréquence cardiaque moyenne chez les patients traités par l'irbésartan dans les essais contrôlés.
Néphropathie chez les patients diabétiques de type 2
L'Irbesartan Diabetic Nephropathy Trial (IDNT) était une étude multicentrique randomisée, contrôlée contre placebo et contre comparateur actif, en double aveugle, menée dans le monde entier chez 1715 patients atteints de diabète de type 2, d'hypertension (SeSBP > 135 mmHg ou SeDBP > 85 mmHg) et de néphropathie (sérum créatinine 1,0 à 3,0 mg/dL chez les femmes ou 1,2 à 3,0 mg/dL chez les hommes et protéinurie ≥ 900 mg/jour). Les patients ont été randomisés pour recevoir AVAPRO 75 mg, l'amlodipine 2,5 mg ou un placebo correspondant une fois par jour. Les patients ont été titrés à une dose d'entretien d'AVAPRO 300 mg ou d'amlodipine 10 mg, selon la tolérance. Des agents antihypertenseurs supplémentaires (à l'exclusion des inhibiteurs de l'ECA, des antagonistes des récepteurs de l'angiotensine II et des inhibiteurs calciques) ont été ajoutés au besoin pour atteindre l'objectif de pression artérielle (≤ 135/85 ou réduction de 10 mmHg de la pression artérielle systolique si supérieure à 160 mmHg) pour les patients de tous les groupes .
La population étudiée était composée à 66,5 % d'hommes, 72,9 % de moins de 65 ans et 72 % de Blancs (Asiatiques/Insulaires du Pacifique 5,0 %, Noirs 13,3 %, Hispaniques 4,8 %). Les pressions artérielles systolique et diastolique en position assise étaient respectivement de 159 mmHg et 87 mmHg. Les patients sont entrés dans l'essai avec une créatinine sérique moyenne de 1,7 mg/dL et une protéinurie moyenne de 4144 mg/jour.
La tension artérielle moyenne atteinte était de 142/77 mmHg pour AVAPRO, 142/76 mmHg pour l'amlodipine et 145/79 mmHg pour le placebo. Globalement, 83,0 % des patients ont reçu la dose cible d'irbésartan plus de 50 % du temps. Les patients ont été suivis pendant une durée moyenne de 2,6 ans.
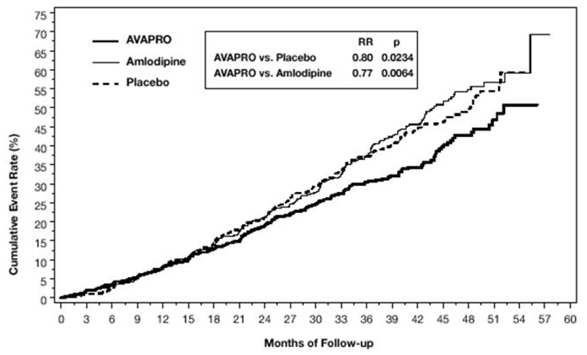
Le critère principal composite était le délai d'apparition de l'un des événements suivants : doublement de la créatinine sérique initiale, insuffisance rénale terminale (IRT ; définie par une créatinine sérique ≥ 6 mg/dL, dialyse ou transplantation rénale) ou décès . Le traitement par AVAPRO 150 mg a entraîné une réduction du risque de 20 % par rapport au placebo (p = 0,0234) (voir Figure 3 et Tableau 1). Le traitement par AVAPRO 150 mg a également réduit la survenue d'un doublement soutenu de la créatinine sérique en tant que critère d'évaluation distinct (33 %), mais n'a eu aucun effet significatif sur l'IRT seul et aucun effet sur la mortalité globale (voir tableau 1).
Figure 3 : IDNT : estimations de Kaplan-Meier du critère d'évaluation principal (doublement de la créatinine sérique, insuffisance rénale terminale ou mortalité toutes causes confondues)
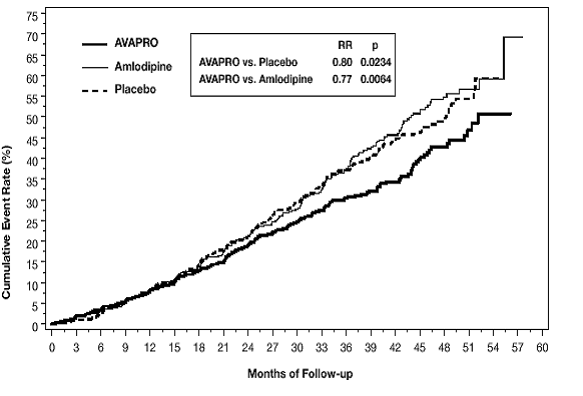
Les pourcentages de patients ayant subi un événement au cours de l'étude sont présentés dans le tableau 1 ci-dessous :
Le critère secondaire de l'étude était un critère composite de mortalité et de morbidité cardiovasculaire (infarctus du myocarde, hospitalisation pour insuffisance cardiaque, accident vasculaire cérébral avec déficit neurologique permanent, amputation). Il n'y avait pas de différences statistiquement significatives entre les groupes de traitement pour ces paramètres. Par rapport au placebo, AVAPRO 150 mg a réduit de manière significative la protéinurie d'environ 27 %, un effet qui s'est manifesté dans les 3 mois suivant le début du traitement. AVAPRO a significativement réduit le taux de perte de la fonction rénale (taux de filtration glomérulaire), tel que mesuré par l'inverse de la concentration de créatinine sérique, de 18,2 %.
Le tableau 2 présente les résultats pour les sous-groupes démographiques. Les analyses de sous-groupes sont difficiles à interpréter, et on ne sait pas si ces observations représentent de vraies différences ou des effets de hasard. Pour le critère d'évaluation principal, les effets favorables d'AVAPRO ont été observés chez des patients prenant également d'autres médicaments antihypertenseurs (les antagonistes des récepteurs de l'angiotensine II, les inhibiteurs de l'enzyme de conversion de l'angiotensine et les inhibiteurs calciques n'étaient pas autorisés), des agents hypoglycémiants oraux et des antihypertenseurs. agents réducteurs.
INFORMATIONS PATIENTS
Grossesse
Informer les patientes en âge de procréer des conséquences d'une exposition à AVAPRO pendant la grossesse. Discutez des options de traitement avec les femmes qui envisagent de devenir enceintes. Les patientes doivent être invitées à signaler les grossesses à leur médecin dès que possible.
Suppléments de potassium
Conseillez aux patients recevant AVAPRO de ne pas utiliser de suppléments de potassium ou de substituts de sel contenant du potassium sans consulter leur professionnel de la santé [voir INTERACTIONS MÉDICAMENTEUSES ].
