Aceon 2mg, 4mg, 8mg Perindopril Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Aceon 4 mg et comment est-il utilisé ?
Aceon 8 mg est un médicament sur ordonnance utilisé pour traiter les symptômes de l'hypertension artérielle (hypertension) et de la maladie coronarienne stable (CAD). Aceon peut être utilisé seul ou avec d'autres médicaments.
Aceon appartient à une classe de médicaments appelés inhibiteurs de l'ECA.
On ne sait pas si Aceon est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles d'Aceon 4mg ?
Aceon peut provoquer des effets secondaires graves, notamment :
- urticaire,
- difficulté à respirer,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- la faiblesse,
- rythme cardiaque lent ou irrégulier,
- évanouissement,
- nausée,
- vomissement,
- perte d'appétit,
- douleur abdominale,
- jaunissement des yeux ou de la peau (jaunisse),
- urine foncée et
- étourdissements sévères
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Aceon 2mg incluent :
- vertiges,
- étourdissement,
- fatigue, et
- toux sèche
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Aceon. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
TOXICITÉ FŒTALE
- Lorsqu'une grossesse est détectée, arrêtez ACEON 4 mg dès que possible. AVERTISSEMENTS ET PRECAUTIONS
- Les médicaments qui agissent directement sur le système rénine-angiotensine peuvent causer des blessures et la mort du fœtus en développement. AVERTISSEMENTS ET PRECAUTIONS
LA DESCRIPTION
Les comprimés ACEON® (perindopril erbumine) contiennent le sel de tert-butylamine du périndopril, l'ester éthylique d'un inhibiteur de l'enzyme de conversion de l'angiotensine (ECA) non sulfhydryle. Le périndopril erbumine est chimiquement décrit comme l'acide (2S,3DS,7DS)-1-[(S)-N-[(S)-1-Carboxy-butyl]alanyl]hexahydro-2-indolinecarboxylique, ester 1-éthylique, composé avec tert-butylamine (1:1). Sa formule moléculaire est C19H32N2O5C4H11N. Sa formule structurale est :
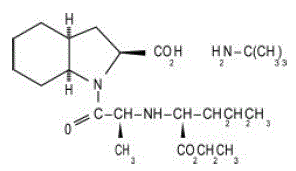
Le périndopril erbumine est une poudre cristalline blanche d'un poids moléculaire de 368,47 (acide libre) ou 441,61 (sel). Il est librement soluble dans l'eau (60 % p/p), l'alcool et le chloroforme.
Le périndopril est la forme acide libre du périndopril erbumine, est un promédicament et métabolisé in vivo par hydrolyse du groupe ester pour former le périndoprilate, le métabolite biologiquement actif.
ACEON est disponible en dosages de 2 mg, 4 mg et 8 mg pour administration orale. En plus du périndopril erbumine, chaque comprimé contient les ingrédients inactifs suivants : silice colloïdale (hydrophobe), lactose, stéarate de magnésium et cellulose microcristalline. Les comprimés de 4 mg et 8 mg contiennent également de l'oxyde de fer.
LES INDICATIONS
Hypertension
ACEON est indiqué pour le traitement des patients souffrant d'hypertension artérielle essentielle. ACEON peut être utilisé seul ou associé à d'autres classes d'antihypertenseurs, en particulier les diurétiques thiazidiques.
Maladie coronarienne stable
ACEON 8 mg est indiqué pour le traitement des patients atteints de maladie coronarienne stable afin de réduire le risque de mortalité cardiovasculaire ou d'infarctus du myocarde non mortel. ACEON peut être utilisé avec un traitement conventionnel pour la prise en charge de la maladie coronarienne, tel qu'un traitement antiplaquettaire, antihypertenseur ou hypolipémiant.
DOSAGE ET ADMINISTRATION
Hypertension
Utilisation chez les patients hypertendus non compliqués
Chez les patients souffrant d'hypertension artérielle essentielle, la dose initiale recommandée est de 4 mg une fois par jour. La dose peut être titrée, au besoin, jusqu'à un maximum de 16 mg par jour. La gamme de doses d'entretien habituelles est de 4 mg à 8 mg administrés en une dose quotidienne unique ou en deux doses fractionnées.
Utilisation chez les patients âgés
La posologie quotidienne initiale recommandée d'ACEON 4 mg pour les personnes âgées est de 4 mg par jour, administrée en une ou deux doses fractionnées. L'expérience avec ACEON est limitée chez les personnes âgées à des doses supérieures à 8 mg. Les doses supérieures à 8 mg doivent être administrées avec une surveillance attentive de la pression artérielle et une titration de la dose [voir Utilisation dans des populations spécifiques ].
Utiliser avec des diurétiques
Chez les patients qui sont actuellement traités par un diurétique, une hypotension symptomatique peut survenir après la dose initiale d'ACEON. Envisagez de réduire la dose de diurétique avant de commencer ACEON [voir INTERACTIONS MÉDICAMENTEUSES ].
Maladie coronarienne stable
Chez les patients présentant une maladie coronarienne stable, ACEON 4 mg doit être administré à une dose initiale de 4 mg une fois par jour pendant 2 semaines, puis augmentée selon la tolérance, jusqu'à une dose d'entretien de 8 mg une fois par jour. Chez les patients âgés (plus de 70 ans), ACEON doit être administré à raison de 2 mg une fois par jour la première semaine, suivi de 4 mg une fois par jour la deuxième semaine et de 8 mg une fois par jour pour la dose d'entretien si toléré.
Ajustement de la dose en cas d'insuffisance rénale et de dialyse
L'élimination du périndoprilate est diminuée chez les insuffisants rénaux. ACEON n'est pas recommandé chez les patients dont la clairance de la créatinine est
COMMENT FOURNIE
Formes posologiques et points forts
Les comprimés sont oblongs avec un score sur un côté.
Le comprimé de 2 mg est blanc et gravé sur le côté non sécable avec « ACN 2 ».
Le comprimé de 4 mg est rose et gravé sur le côté non sécable avec « ACN 4 ».
Le comprimé de 8 mg est saumon et gravé sur le côté non sécable avec "ACN 8".
Stockage et manutention
Les comprimés sont oblongs avec un score sur un côté.
Garder hors de la portée des enfants.
Le magasin à la température de pièce contrôlée 20 ° à 25°C (68 ° à 77°F) [voit USP]. Protéger de l'humidité.
Pour plus d'informations, veuillez appeler notre service de communication médicale sans frais au 888-985-7657.
Fabriqué par : Patheon Pharmaceuticals, Inc. Cincinnati, OH 45237 États-Unis. Révisé : septembre 2017
EFFETS SECONDAIRES
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'événements indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Expérience des essais cliniques
Les effets indésirables suivants sont discutés ailleurs dans l'étiquetage :
- Réactions anaphylactoïdes, y compris œdème de Quincke [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypotension [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Neutropénie et agranulocytose [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Insuffisance rénale [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hyperkaliémie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Toux [voir AVERTISSEMENTS ET PRECAUTIONS ]
Hypertension
L'innocuité d'ACEON 4 mg a été évaluée chez environ 3 400 patients souffrant d'hypertension dans le cadre d'essais cliniques aux États-Unis et à l'étranger. Les données présentées ici sont basées sur les résultats des 1 417 patients traités par ACEON qui ont participé aux essais cliniques américains. Plus de 220 de ces patients ont été traités par ACEON® (perindopril erbumine) pendant au moins un an.
Dans des essais cliniques américains contrôlés par placebo, l'incidence de l'arrêt prématuré du traitement en raison d'événements indésirables était de 6,5 % chez les patients traités par ACEON 2 mg et de 6,7 % chez les patients traités par placebo. Les causes les plus fréquentes étaient la toux, les maux de tête, l'asthénie et les étourdissements.
Parmi 1 012 patients dans des essais américains contrôlés par placebo, la fréquence globale des événements indésirables signalés était similaire chez les patients traités par ACEON et chez ceux traités par placebo (environ 75 % dans chaque groupe). Les seuls événements indésirables dont l'incidence sous ACEON 4 mg était supérieure d'au moins 2 % à celle sous placebo étaient la toux (12 % contre 4,5 %) et les maux de dos (5,8 % contre 3,1 %).
Les étourdissements n'ont pas été signalés plus fréquemment dans le groupe perindopril (8,2 %) que dans le groupe placebo (8,5 %), mais leur probabilité a augmenté avec la dose, suggérant une relation causale avec le périndopril.
Maladie coronarienne stable
L'innocuité du périndopril a été évaluée dans EUROPA, une étude en double aveugle contrôlée par placebo chez 12 218 patients atteints d'une maladie coronarienne stable. Le taux global d'abandon était d'environ 22 % avec le médicament et le placebo. Les raisons médicales les plus courantes d'arrêt du traitement qui étaient plus fréquentes sous périndopril que sous placebo étaient la toux, l'intolérance au médicament et l'hypotension.
Expérience post-commercialisation
Les rapports volontaires d'événements indésirables chez les patients prenant ACEON qui ont été reçus depuis l'introduction sur le marché et dont la relation de cause à effet avec ACEON 8 mg est inconnue comprennent : arrêt cardiaque, pneumonie à éosinophiles, neutropénie/agranulocytose, pancytopénie, anémie (y compris hémolytique et aplasique), thrombocytopénie, insuffisance rénale, néphrite, insuffisance hépatique, ictère (hépatocellulaire ou cholestatique), hyponatrémie symptomatique, pemphigoïde bulleuse, pemphigus, pancréatite aiguë, chutes, psoriasis, dermatite exfoliative et un syndrome pouvant inclure : arthralgie/arthrite, vascularite, sérosite, myalgie, fièvre , une éruption cutanée ou d'autres manifestations dermatologiques, un anticorps antinucléaire (ANA) positif, une leucocytose, une éosinophilie ou une vitesse de sédimentation érythrocytaire (VS) élevée.
Résultats des tests de laboratoire clinique
Hématologie
De petites diminutions de l'hémoglobine et de l'hématocrite surviennent fréquemment chez les patients hypertendus traités par ACEON 8 mg, mais sont rarement d'importance clinique. Dans les essais cliniques contrôlés, aucun patient n'a été interrompu du traitement en raison du développement de l'anémie. Une leucopénie (y compris une neutropénie) a été observée chez 0,1 % des patients dans les essais cliniques américains [voir AVERTISSEMENTS ET PRECAUTIONS ].
Tests de la fonction hépatique
Des élévations des taux d'ALT (1,6 % d'ACEON contre 0,9 % de placebo) et d'AST (0,5 % d'ACEON 2 mg contre 0,4 % de placebo) ont été observées dans des essais cliniques contrôlés par placebo. Les élévations étaient généralement légères et transitoires et résolues après l'arrêt du traitement.
INTERACTIONS MÉDICAMENTEUSES
Diurétiques
Les patients sous diurétiques, et en particulier ceux qui ont commencé récemment, peuvent parfois présenter une réduction excessive de la pression artérielle après le début du traitement par ACEON. La possibilité d'effets hypotenseurs peut être minimisée en diminuant la dose ou en arrêtant le diurétique ou en augmentant la consommation de sel avant le début du traitement par périndopril. Si le traitement diurétique ne peut être modifié, assurer une surveillance médicale étroite avec la première dose d'ACEON, pendant au moins deux heures et jusqu'à ce que la pression artérielle se soit stabilisée pendant une autre heure [voir AVERTISSEMENTS ET PRECAUTIONS ].
La vitesse et l'étendue de l'absorption et de l'élimination du périndopril ne sont pas affectées par les diurétiques concomitants. La biodisponibilité du périndoprilate a cependant été réduite par les diurétiques, ce qui a été associé à une diminution de l'inhibition plasmatique de l'ECA.
Suppléments de potassium et diurétiques épargneurs de potassium
ACEON 8mg peut augmenter le potassium sérique en raison de son potentiel de diminution de la production d'aldostérone. L'utilisation de diurétiques épargneurs de potassium (spironolactone, amiloride, triamtérène et autres), de suppléments de potassium ou d'autres médicaments capables d'augmenter le potassium sérique (indométhacine, héparine, cyclosporine et autres) peut augmenter le risque d'hyperkaliémie. Par conséquent, si l'utilisation concomitante de tels agents est indiquée, surveiller fréquemment la kaliémie du patient.
Lithium
Une augmentation du lithium sérique et des symptômes de toxicité au lithium ont été signalés chez des patients recevant un traitement concomitant au lithium et à un inhibiteur de l'ECA. Une surveillance fréquente de la concentration sérique de lithium est recommandée. L'utilisation d'un diurétique peut encore augmenter le risque de toxicité du lithium.
Or
Des réactions nitritoïdes (les symptômes comprennent des bouffées vasomotrices, des nausées, des vomissements et de l'hypotension) ont été rarement signalées chez des patients recevant un traitement par injection d'or (aurothiomalate de sodium) et un traitement concomitant par un inhibiteur de l'ECA, y compris ACEON.
Digoxine
Une étude pharmacocinétique contrôlée n'a montré aucun effet sur les concentrations plasmatiques de digoxine en cas d'administration concomitante avec ACEON, mais un effet de la digoxine sur la concentration plasmatique de périndopril/périndoprilat n'a pas été exclu.
Gentamicine
Des données animales ont suggéré la possibilité d'une interaction entre le périndopril et la gentamicine. Cependant, cela n'a pas été étudié dans les études humaines.
Agents anti-inflammatoires non stéroïdiens, y compris les inhibiteurs sélectifs de la cyclooxygénase-2 (inhibiteurs de la COX-2)
Chez les patients âgés, hypovolémiques (y compris ceux sous diurétique) ou dont la fonction rénale est altérée, la co-administration d'AINS, y compris les inhibiteurs sélectifs de la COX-2, avec des inhibiteurs de l'ECA, y compris le périndopril, peut entraîner une détérioration de la fonction rénale. , y compris une éventuelle insuffisance rénale aiguë. Ces effets sont généralement réversibles. Surveiller périodiquement la fonction rénale chez les patients recevant du périndopril et un traitement par AINS.
L'effet antihypertenseur des inhibiteurs de l'ECA, dont le périndopril, peut être atténué par les AINS, y compris les inhibiteurs sélectifs de la COX-2.
Double blocage du système rénine-angiotensine (RAS)
Le double blocage du SRA avec les inhibiteurs des récepteurs de l'angiotensine, les inhibiteurs de l'ECA ou l'aliskirène est associé à des risques accrus d'hypotension, d'hyperkaliémie et de modifications de la fonction rénale (y compris l'insuffisance rénale aiguë) par rapport à la monothérapie. La plupart des patients recevant l'association de deux inhibiteurs du RAS n'obtiennent aucun bénéfice supplémentaire par rapport à la monothérapie. En général, évitez l'utilisation combinée d'inhibiteurs du RAS. Surveillez étroitement la pression artérielle, la fonction rénale et les électrolytes chez les patients sous ACEON 2 mg et d'autres agents qui affectent le SRA.
Ne pas co-administrer l'aliskiren avec ACEON 8 mg chez les patients diabétiques. Éviter l'utilisation d'aliskirène avec ACEON 2 mg chez les patients insuffisants rénaux (DFG
Inhibiteurs de mTOR
Les patients prenant un traitement concomitant par un inhibiteur de mTOR (mammalian target of rapamycin) peuvent être exposés à un risque accru d'œdème de Quincke [voir AVERTISSEMENTS ET PRECAUTIONS ].
Inhibiteur de néprilysine
Les patients prenant simultanément des inhibiteurs de la néprilysine peuvent présenter un risque accru d'œdème de Quincke. [voir AVERTISSEMENTS ET PRECAUTIONS ]
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Réactions anaphylactoïdes et éventuellement liées
Vraisemblablement parce que les inhibiteurs de l'enzyme de conversion de l'angiotensine affectent le métabolisme des eicosanoïdes et des polypeptides, y compris la bradykinine endogène, les patients recevant des inhibiteurs de l'ECA (y compris l'ACEON) peuvent être sujets à une variété d'événements indésirables, dont certains graves. Les patients noirs recevant des inhibiteurs de l'ECA ont une incidence plus élevée d'œdème de Quincke par rapport aux non-noirs.
Angiœdème de la tête et du cou
Un œdème de Quincke du visage, des extrémités, des lèvres, de la langue, de la glotte ou du larynx a été rapporté chez des patients traités par des inhibiteurs de l'ECA, y compris ACEON (0,1 % des patients traités par ACEON dans les essais cliniques aux États-Unis). L'œdème de Quincke associé à une atteinte de la langue, de la glotte ou du larynx peut être fatal. Dans de tels cas, arrêtez immédiatement le traitement par ACEON et observez jusqu'à ce que le gonflement disparaisse. Lorsque l'atteinte de la langue, de la glotte ou du larynx semble susceptible de provoquer une obstruction des voies respiratoires, administrer rapidement un traitement approprié, tel qu'une solution d'épinéphrine sous-cutanée 1:1000 (0,3 à 0,5 ml).
Les patients prenant un traitement concomitant par un inhibiteur de mTOR (par exemple, le temsirolimus) ou un inhibiteur de la néprilysine peuvent présenter un risque accru d'œdème de Quincke [voir INTERACTIONS MÉDICAMENTEUSES ].
Angiœdème intestinal
Des œdèmes de Quincke intestinaux ont été rapportés chez des patients traités par des inhibiteurs de l'ECA. Ces patients présentaient des douleurs abdominales (avec ou sans nausées ou vomissements) ; dans certains cas, il n'y avait pas d'antécédent d'angio-œdème facial et les taux d'estérase C-1 étaient normaux. L'œdème de Quincke a été diagnostiqué par des procédures comprenant une tomodensitométrie ou une échographie abdominale, ou lors d'une intervention chirurgicale, et les symptômes ont disparu après l'arrêt de l'inhibiteur de l'ECA. L'œdème de Quincke intestinal doit être inclus dans le diagnostic différentiel des patients sous IEC présentant des douleurs abdominales.
Hypotension
ACEON 4mg peut provoquer une hypotension symptomatique. ACEON a été associé à une hypotension chez 0,3 % des patients hypertendus non compliqués lors d'essais contrôlés par placebo aux États-Unis. Des symptômes liés à l'hypotension orthostatique ont été rapportés chez un autre 0,8 % des patients.
Une hypotension symptomatique est plus susceptible de survenir chez les patients qui ont subi une déplétion volémique ou sodée à la suite d'un traitement diurétique prolongé, d'une restriction alimentaire en sel, d'une dialyse, d'une diarrhée ou de vomissements [voir DOSAGE ET ADMINISTRATION ].
Les inhibiteurs de l'ECA peuvent provoquer une hypotension excessive et peuvent être associés à une oligurie ou une azotémie, et rarement à une insuffisance rénale aiguë et à la mort. Chez les patients atteints de cardiopathie ischémique ou de maladie cérébrovasculaire, une chute excessive de la pression artérielle peut entraîner un infarctus du myocarde ou un accident vasculaire cérébral.
Chez les patients à risque d'hypotension excessive, le traitement par ACEON doit être instauré sous surveillance médicale très étroite. Les patients doivent être suivis de près pendant les deux premières semaines de traitement et chaque fois que la dose d'ACEON 2 mg et/ou de diurétique est augmentée.
En cas d'hypotension excessive, le patient doit être placé immédiatement en décubitus dorsal et, si nécessaire, traité par une perfusion intraveineuse de sérum physiologique. Le traitement par ACEON 4 mg peut généralement être poursuivi après rétablissement du volume et de la pression artérielle.

Neutropénie/Agranulocytose
Les inhibiteurs de l'ECA ont été associés à l'agranulocytose et à la dépression médullaire, le plus souvent chez les patients atteints d'insuffisance rénale, en particulier les patients atteints d'une maladie vasculaire du collagène telle que le lupus érythémateux disséminé ou la sclérodermie.
Toxicité fœtale
Catégorie de grossesse D
L'utilisation de médicaments qui agissent sur le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales. L'oligohydramnios qui en résulte peut être associé à une hypoplasie pulmonaire fœtale et à des déformations squelettiques. Les effets indésirables néonataux potentiels comprennent l'hypoplasie crânienne, l'anurie, l'hypotension, l'insuffisance rénale et la mort. Lorsqu'une grossesse est détectée, arrêter ACEON 4 mg dès que possible [voir Utilisation dans des populations spécifiques ].
Fonction rénale altérée
En conséquence de l'inhibition du système rénine-angiotensine-aldostérone, des modifications de la fonction rénale peuvent être anticipées chez les personnes sensibles. La fonction rénale doit être surveillée périodiquement chez les patients recevant ACEON [voir DOSAGE ET ADMINISTRATION ], [voir INTERACTIONS MÉDICAMENTEUSES ].
Chez les patients atteints d'insuffisance cardiaque congestive sévère, où la fonction rénale peut dépendre de l'activité du système rénine-angiotensinaldostérone, le traitement par les inhibiteurs de l'ECA, y compris l'ACEON, peut être associé à une oligurie, une azotémie progressive et, rarement, une insuffisance rénale aiguë et le décès.
Chez les patients hypertendus présentant une sténose unilatérale ou bilatérale de l'artère rénale, des augmentations de l'azote uréique sanguin et de la créatinine sérique peuvent survenir; généralement réversible à l'arrêt de l'IEC. Chez ces patients, la fonction rénale doit être surveillée pendant les premières semaines de traitement.
Certains patients traités par ACEON ont développé des augmentations mineures et transitoires de l'azote uréique sanguin et de la créatinine sérique, en particulier chez ceux traités simultanément par un diurétique.
Hyperkaliémie
Des élévations du potassium sérique ont été observées chez certains patients traités par des inhibiteurs de l'ECA, y compris ACEON. La plupart des cas étaient des valeurs uniques isolées qui ne semblaient pas cliniquement pertinentes et étaient rarement une cause de retrait. Les facteurs de risque de développement de l'hyperkaliémie comprennent l'insuffisance rénale, le diabète sucré et l'utilisation concomitante d'agents tels que les diurétiques épargneurs de potassium, les suppléments de potassium et/ou les substituts de sel contenant du potassium [voir INTERACTIONS MÉDICAMENTEUSES ].
Le potassium sérique doit être surveillé périodiquement chez les patients recevant ACEON.
Toux
Vraisemblablement en raison de l'inhibition de la dégradation de la bradykinine endogène, une toux non productive persistante a été rapportée avec tous les inhibiteurs de l'ECA, disparaissant généralement après l'arrêt du traitement. Envisager la toux induite par les inhibiteurs de l'ECA dans le diagnostic différentiel de la toux.
Défaillance hépatique
Rarement, les inhibiteurs de l'ECA ont été associés à un syndrome qui commence par un ictère cholestatique et évolue vers une nécrose hépatique fulminante et parfois la mort. Le mécanisme de ce syndrome n'est pas compris. Les patients recevant des inhibiteurs de l'ECA qui développent un ictère ou des élévations marquées des enzymes hépatiques doivent arrêter l'inhibiteur de l'ECA et recevoir un suivi médical approprié.
Chirurgie/Anesthésie
Chez les patients subissant une intervention chirurgicale ou pendant une anesthésie avec des agents provoquant une hypotension, ACEON peut bloquer la formation d'angiotensine II qui se produirait autrement suite à la libération compensatoire de rénine. L'hypotension attribuable à ce mécanisme peut être corrigée par une expansion volémique.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Cancérogénicité
Aucun signe d'effet cancérogène n'a été observé dans les études chez le rat et la souris lorsque le périndopril était administré à des doses allant jusqu'à 20 fois (mg/kg) ou 2 à 4 fois (mg/m2) les doses cliniques maximales proposées (16 mg/jour) pour 104 semaines.
Mutagenèse
Aucun potentiel génotoxique n'a été détecté pour l'ACEON, le périndoprilate et d'autres métabolites dans diverses investigations in vitro et in vivo, y compris le test d'Ames, le test Saccharomyces cerevisiae D4, les lymphocytes humains en culture, le test TK ± lymphome de souris, les tests de micronoyau de souris et de rat et le test de hamster chinois. dosage de la moelle osseuse.
Altération de la fertilité
Il n'y a eu aucun effet significatif sur les performances de reproduction ou la fertilité chez le rat ayant reçu jusqu'à 30 fois (mg/kg) ou 6 fois (mg/m2) la dose clinique maximale proposée d'ACEON 2 mg pendant la période de spermatogenèse chez les mâles ou d'oogenèse et de gestation. chez les femelles.
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse D [voir AVERTISSEMENT DE BOÎTE et AVERTISSEMENTS ET PRECAUTIONS ].
L'utilisation de médicaments qui agissent sur le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales. L'oligohydramnios qui en résulte peut être associé à une hypoplasie pulmonaire fœtale et à des déformations squelettiques. Les effets indésirables néonataux potentiels comprennent l'hypoplasie crânienne, l'anurie, l'hypotension, l'insuffisance rénale et la mort. Lorsqu'une grossesse est détectée, arrêtez ACEON dès que possible. Ces effets indésirables sont généralement associés à l'utilisation de ces médicaments au cours des deuxième et troisième trimestres de la grossesse. La plupart des études épidémiologiques examinant les anomalies fœtales après exposition à l'utilisation d'antihypertenseurs au cours du premier trimestre n'ont pas distingué les médicaments affectant le système rénine-angiotensine des autres agents antihypertenseurs.
La prise en charge appropriée de l'hypertension maternelle pendant la grossesse est importante pour optimiser les résultats pour la mère et le fœtus.
Dans le cas inhabituel où il n'y a pas d'alternative appropriée au traitement par des médicaments affectant le système rénine-angiotensine pour un patient particulier, informer la mère du risque potentiel pour le fœtus. Effectuer des examens échographiques en série pour évaluer l'environnement intra-amniotique. Si un oligohydramnios est observé, arrêtez ACEON 2 mg, sauf si cela est considéré comme salvateur pour la mère. Des tests fœtaux peuvent être appropriés, en fonction de la semaine de grossesse. Les patients et les médecins doivent toutefois savoir que l'oligohydramnios peut n'apparaître qu'après que le fœtus a subi une lésion irréversible. Observer attentivement les nourrissons ayant des antécédents d'exposition in utero à ACEON pour l'hypotension, l'oligurie et l'hyperkaliémie [voir Utilisation pédiatrique ].
La radioactivité était détectable chez les fœtus après l'administration de périndopril marqué au 14C à des rates gravides.
Mères allaitantes
Le lait des rats en lactation contenait de la radioactivité après l'administration de 14C-périndopril. On ne sait pas si le périndopril est sécrété dans le lait maternel. Étant donné que de nombreux médicaments sont sécrétés dans le lait maternel, la prudence s'impose lorsqu'ACEON est administré à des mères qui allaitent.
Utilisation pédiatrique
Nouveau-nés ayant des antécédents d'exposition in utero à l'ACEON
En cas d'oligurie ou d'hypotension, diriger l'attention vers le soutien de la pression artérielle et de la perfusion rénale. Des exsanguinotransfusions ou une dialyse peuvent être nécessaires pour inverser l'hypotension et/ou remplacer les troubles de la fonction rénale. Le périndopril, qui traverse le placenta, peut théoriquement être éliminé de la circulation néonatale par ces moyens, mais une expérience limitée n'a pas montré qu'une telle élimination est essentielle au traitement de ces nourrissons.
L'innocuité et l'efficacité d'ACEON 8 mg chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
L'effet moyen du périndopril sur la pression artérielle était un peu plus faible chez les patients de plus de 60 ans que chez les patients plus jeunes, bien que la différence ne soit pas significative. Les concentrations plasmatiques de périndopril et de périndoprilate ont augmenté chez les patients âgés par rapport aux concentrations chez les patients plus jeunes. Aucun effet indésirable n'a été clairement augmenté chez les patients âgés, à l'exception des étourdissements et éventuellement des éruptions cutanées.
Commencez à faible dose et titrez lentement au besoin. Surveillez les étourdissements en raison du risque de chute.
L'expérience avec ACEON 8 mg chez les patients âgés à des doses quotidiennes supérieures à 8 mg est limitée.
Insuffisance rénale
Un ajustement posologique peut être nécessaire chez les insuffisants rénaux [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
Insuffisance hépatique
La biodisponibilité du périndoprilate est augmentée chez les patients présentant une fonction hépatique altérée [voir PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Chez l'animal, des doses de périndopril allant jusqu'à 2 500 mg/kg chez la souris, 3 000 mg/kg chez le rat et 1 600 mg/kg chez le chien n'ont pas été létales. Les expériences passées étaient rares mais suggéraient que le surdosage avec d'autres inhibiteurs de l'ECA était également assez bien toléré par les humains. La manifestation la plus probable est l'hypotension, et le traitement doit être symptomatique et de soutien. Le traitement par l'inhibiteur de l'ECA doit être interrompu et le patient doit être surveillé. La déshydratation, le déséquilibre électrolytique et l'hypotension doivent être traités selon les procédures établies.
Parmi les cas rapportés de surdosage de périndopril, les patients connus pour avoir ingéré une dose de 80 mg à 120 mg ont nécessité une ventilation assistée et une assistance circulatoire. Un autre patient a développé une hypothermie, un arrêt circulatoire et est décédé après avoir ingéré jusqu'à 180 mg de périndopril. L'intervention en cas de surdosage de périndopril peut nécessiter un soutien vigoureux.
Les déterminations en laboratoire des taux sériques de périndopril et de ses métabolites ne sont pas largement disponibles, et de telles déterminations n'ont, en tout état de cause, aucun rôle établi dans la prise en charge d'un surdosage de périndopril.
Aucune donnée n'est disponible pour suggérer des manœuvres physiologiques (par exemple, des manœuvres pour modifier le pH de l'urine) susceptibles d'accélérer l'élimination du périndopril et de ses métabolites. Le périndopril peut être éliminé par hémodialyse, avec une clairance de 52 mL/min pour le périndopril et de 67 mL/min pour le périndoprilate.
L'angiotensine II pourrait vraisemblablement servir d'antagoniste-antidote spécifique dans le règlement d'un surdosage de périndopril, mais l'angiotensine II est essentiellement indisponible en dehors des installations de recherche dispersées. Étant donné que l'effet hypotenseur du périndopril est obtenu par vasodilatation et hypovolémie efficace, il est raisonnable de traiter le surdosage de périndopril par perfusion d'une solution saline normale.
CONTRE-INDICATIONS
ACEON® (perindopril erbumine) est contre-indiqué chez les patients connus pour être hypersensibles (y compris l'œdème de Quincke) à ce produit ou à tout autre inhibiteur de l'ECA. ACEON 4 mg est également contre-indiqué chez les patients présentant un œdème de Quincke héréditaire ou idiopathique.
Ne pas co-administrer l'aliskiren avec ACEON chez les patients diabétiques. [voir INTERACTIONS MÉDICAMENTEUSES ]
ACEON est contre-indiqué en association avec un inhibiteur de la néprilysine (par exemple, le sacubitril). Ne pas administrer ACEON 8 mg dans les 36 heures suivant le passage au sacubitril/valsartan, un inhibiteur de la néprilysine [voir AVERTISSEMENTS ET PRECAUTIONS ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
ACEON® (perindopril erbumine) est une prodrogue du périndoprilate, qui inhibe l'ECA chez les sujets humains et les animaux. On pense que le mécanisme par lequel le périndoprilate abaisse la tension artérielle est principalement l'inhibition de l'activité de l'ECA. L'ECA est une peptidyl dipeptidase qui catalyse la conversion du décapeptide inactif, l'angiotensine I, en vasoconstricteur, l'angiotensine II. L'angiotensine II est un puissant vasoconstricteur périphérique, qui stimule la sécrétion d'aldostérone par le cortex surrénalien et fournit une rétroaction négative sur la sécrétion de rénine. L'inhibition de l'ECA entraîne une diminution de l'angiotensine II plasmatique, entraînant une diminution de la vasoconstriction, une augmentation de l'activité de la rénine plasmatique et une diminution de la sécrétion d'aldostérone. Cette dernière entraîne une diurèse et une natriurèse et peut être associée à une légère augmentation du potassium sérique.
L'ACE est identique à la kininase II, une enzyme qui dégrade la bradykinine. Il reste à déterminer si des niveaux accrus de bradykinine, un puissant peptide vasodépresseur, jouent un rôle dans les effets thérapeutiques d'ACEON 4 mg.
Bien que l'on pense que le principal mécanisme du périndopril dans la réduction de la pression artérielle passe par le système rénine-angiotensinaldostérone, les inhibiteurs de l'ECA ont un certain effet même en cas d'hypertension apparente à faible rénine. Le périndopril a été étudié chez relativement peu de patients noirs, généralement une population à faible rénine, et la réponse moyenne de la pression artérielle diastolique au périndopril était environ la moitié de la réponse observée chez les patients non noirs, une conclusion cohérente avec l'expérience antérieure d'autres inhibiteurs de l'ECA.
Pharmacodynamie
Après administration de périndopril, l'ECA est inhibée en fonction de la dose et de la concentration sanguine, l'inhibition maximale de 80 à 90 % atteinte par 8 mg persistant pendant 10 à 12 heures. L'inhibition de l'ECA sur vingt-quatre heures est d'environ 60 % après ces doses. Le degré d'inhibition de l'ECA obtenu par une dose donnée semble diminuer avec le temps (la DI50 augmente). La réponse pressive à une perfusion d'angiotensine I est réduite par le périndopril, mais cet effet n'est pas aussi persistant que l'effet sur l'ECA ; il y a environ 35 % d'inhibition à 24 heures après une dose de 12 mg.
Pharmacocinétique
Absorption
L'administration orale d'ACEON entraîne des concentrations plasmatiques maximales qui se produisent à environ 1 heure. La biodisponibilité orale absolue du périndopril est d'environ 75 %. Après absorption, environ 30 à 50 % du périndopril disponible par voie systémique sont hydrolysés en son métabolite actif, le périndoprilate, qui a une biodisponibilité moyenne d'environ 25 %. Les concentrations plasmatiques maximales de périndopril sont atteintes 3 à 7 heures après l'administration de périndopril. L'administration orale d'ACEON 8 mg avec de la nourriture ne diminue pas significativement le taux ou l'étendue de l'absorption du périndopril par rapport à l'état à jeun. Cependant, l'étendue de la biotransformation du périndopril en son métabolite actif, le périndoprilate, est réduite d'environ 43 %, entraînant une réduction de la courbe d'inhibition plasmatique de l'ECA d'environ 20 %, probablement cliniquement insignifiante. Dans les essais cliniques, le périndopril était généralement administré à jeun.
Avec des doses de 4 mg, 8 mg et 16 mg d'ACEON, la Cmax et l'ASC du périndopril et du périndoprilate augmentent de manière proportionnelle à la dose après une administration orale unique et à l'état d'équilibre pendant un schéma posologique multiple une fois par jour.
Distribution
Environ 60 % du périndopril circulant est lié aux protéines plasmatiques et seulement 10 à 20 % du périndopril est lié. Par conséquent, les interactions médicamenteuses médiées par les effets sur la liaison aux protéines ne sont pas anticipées.
Métabolisme et élimination
Après administration orale, le périndopril présente une pharmacocinétique multicompartimentale, y compris un compartiment des tissus profonds (sites de liaison de l'ECA). La demi-vie moyenne du périndopril associée à la majeure partie de son élimination est d'environ 0,8 à 1 heure.
Le périndopril est largement métabolisé après administration orale, avec seulement 4 à 12 % de la dose retrouvée sous forme inchangée dans les urines. Six métabolites résultant de l'hydrolyse, de la glucuronidation et de la cyclisation par déshydratation ont été identifiés. Ceux-ci comprennent l'inhibiteur actif de l'ECA, le périndoprilate (périndopril hydrolysé), le périndopril et les glucuronides de périndopril, le périndopril déshydraté et les diastéréoisomères du périndoprilate déshydraté. Chez l'homme, l'estérase hépatique semble être responsable de l'hydrolyse du périndopril.
Le métabolite actif, le perindoprilate, présente également une pharmacocinétique multicompartimentale suite à l'administration orale d'ACEON. La formation de périndoprilate est progressive avec des concentrations plasmatiques maximales survenant entre 3 et 7 heures. La baisse subséquente de la concentration plasmatique montre une demi-vie moyenne apparente de 3 à 10 heures pour la majorité de l'élimination, avec une demi-vie d'élimination terminale prolongée de 30 à 120 heures résultant de la dissociation lente du périndoprilate de la liaison plasma/tissu à l'ECA. des sites. Lors d'administrations orales répétées une fois par jour de périndopril, le périndoprilate s'accumule environ 1,5 à 2 fois et atteint des concentrations plasmatiques à l'état d'équilibre en 3 à 6 jours. La clairance du périndoprilate et de ses métabolites est presque exclusivement rénale.
Âgé
Les concentrations plasmatiques de périndopril et de périndoprilat chez les patients âgés (plus de 70 ans) sont environ le double de celles observées chez les patients plus jeunes, reflétant à la fois une augmentation de la conversion du périndopril en périndoprilat et une diminution de l'excrétion rénale du périndopril [voir DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ].
Insuffisance cardiaque
La clairance du périndoprilate est réduite chez les patients insuffisants cardiaques congestifs, ce qui entraîne une augmentation de 40 % de l'ASC dans l'intervalle de dose.
Insuffisance rénale
Avec des doses de périndopril de 2 mg à 4 mg, l'ASC du périndoprilate augmente avec la diminution de la fonction rénale. À des clairances de la créatinine de 30 à 80 mL/min, l'ASC est environ le double de celle à 100 mL/min. Lorsque la clairance de la créatinine chute en dessous de 30 ml/min, l'ASC augmente plus nettement.
Chez un nombre limité de patients étudiés, la clairance du périndopril par dialyse variait d'environ 40 à 80 mL/min. La clairance du périndoprilate par dialyse variait d'environ 40 à 90 ml/min [voir DOSAGE ET ADMINISTRATION ].
Insuffisance hépatique
La biodisponibilité du périndoprilate est augmentée chez les patients présentant une insuffisance hépatique. Les concentrations plasmatiques de périndoprilate chez les patients présentant une insuffisance hépatique étaient environ 50 % plus élevées que celles observées chez les sujets sains ou les patients hypertendus ayant une fonction hépatique normale.
Etudes cliniques
Hypertension
Dans des études contrôlées versus placebo sur le perindopril en monothérapie (2 mg à 16 mg une fois par jour) chez des patients ayant une tension artérielle moyenne d'environ 150/100 mm Hg, 2 mg ont eu peu d'effet, mais des doses de 4 mg à 16 mg ont fait baisser la tension artérielle. Les doses de 8 mg et de 16 mg étaient indiscernables et toutes deux avaient un effet plus important que la dose de 4 mg. Dans ces études, des doses de 8 mg et 16 mg par jour ont entraîné des réductions de pression artérielle en décubitus dorsal et creux de 9 à 15/5 à 6 mm Hg. Lorsque les dosages une fois par jour et deux fois par jour ont été comparés, le schéma posologique deux fois par jour était généralement légèrement supérieur, mais pas plus d'environ 0,5 mm Hg à 1 mm Hg. Après des doses de 2 mg à 16 mg de périndopril, les effets moyens sur la tension artérielle systolique et diastolique étaient d'environ 75 à 100 % des effets maximaux.
Les effets du périndopril sur la pression artérielle étaient similaires lorsqu'il était administré seul ou avec un fond de 25 mg d'hydrochlorothiazide. En général, l'effet du périndopril s'est produit rapidement, avec une légère augmentation des effets sur plusieurs semaines.
Aucune étude d'interaction formelle d'ACEON® (perindopril erbumine) n'a été réalisée avec des agents antihypertenseurs autres que les thiazidiques. L'expérience limitée dans les essais contrôlés et non contrôlés co-administrant ACEON 2 mg avec un inhibiteur calcique, un diurétique de l'anse ou une trithérapie (bêta-bloquant, vasodilatateur et diurétique), ne suggère aucune interaction inattendue. En général, les inhibiteurs de l'ECA ont des effets moins qu'additifs lorsqu'ils sont administrés avec des bêta-bloquants, probablement parce que les deux agissent en partie via le système rénine-angiotensine.
Dans des études non contrôlées menées chez des patients diabétiques insulino-dépendants, le périndopril n'a pas semblé affecter le contrôle glycémique. Lors d'une utilisation à long terme, aucun effet sur l'excrétion urinaire de protéines n'a été observé chez ces patients.
L'efficacité d'ACEON 4 mg n'a pas été influencée par le sexe et a été moins efficace chez les patients noirs que chez les patients non noirs. Chez les patients âgés (supérieurs ou égaux à 60 ans), l'effet moyen de la pression artérielle était un peu plus faible que chez les patients plus jeunes, bien que la différence ne soit pas significative.
Maladie coronarienne stable
L'étude EURopean On reduction of heart events with Perindopril in stable coronary artery disease (EUROPA) était une étude multicentrique, randomisée, en double aveugle et contrôlée contre placebo menée chez 12 218 patients présentant des signes de maladie coronarienne stable sans insuffisance cardiaque clinique. Les patients présentaient des signes de maladie coronarienne documentée par un infarctus du myocarde antérieur plus de 3 mois avant le dépistage, une revascularisation coronarienne plus de 6 mois avant le dépistage, des signes angiographiques de sténose (au moins 70 % de rétrécissement d'une ou plusieurs artères coronaires majeures) ou un stress positif test chez les hommes ayant des antécédents de douleur thoracique. Après une période de rodage de 4 semaines au cours de laquelle tous les patients ont reçu du périndopril 2 mg à 8 mg, les patients ont été randomisés pour recevoir du périndopril 8 mg une fois par jour (n = 6 110) ou un placebo correspondant (n = 6 108). Le recul moyen était de 4,2 ans. L'étude a examiné les effets à long terme du périndopril sur le délai avant le premier événement de mortalité cardiovasculaire, d'infarctus du myocarde non mortel ou d'arrêt cardiaque chez les patients atteints d'une maladie coronarienne stable.
L'âge moyen des patients était de 60 ans ; 85 % étaient des hommes, 92 % prenaient des inhibiteurs plaquettaires, 63 % prenaient des β-bloquants et 56 % suivaient un traitement hypolipémiant. L'étude EUROPA a montré que le périndopril réduisait significativement le risque relatif d'événements du critère d'évaluation principal (Tableau 1). Cet effet bénéfique est largement attribuable à une réduction du risque d'infarctus du myocarde non mortel. Cet effet bénéfique du périndopril sur le résultat principal était évident après environ un an de traitement (Figure 1). Le résultat était similaire dans tous les sous-groupes prédéfinis selon l'âge, la maladie sous-jacente ou les médicaments concomitants (Figure 2).
Figure 1. Délai avant la première apparition du critère d'évaluation principal 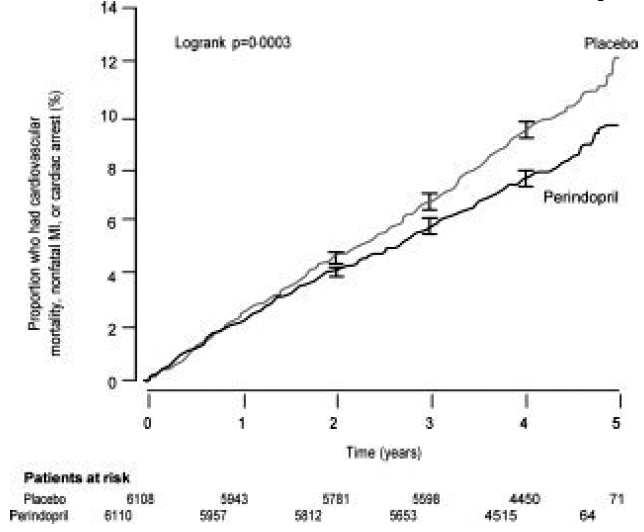
Figure 2. Effet bénéfique du traitement par périndopril sur le critère d'évaluation principal dans des sous-groupes prédéfinis 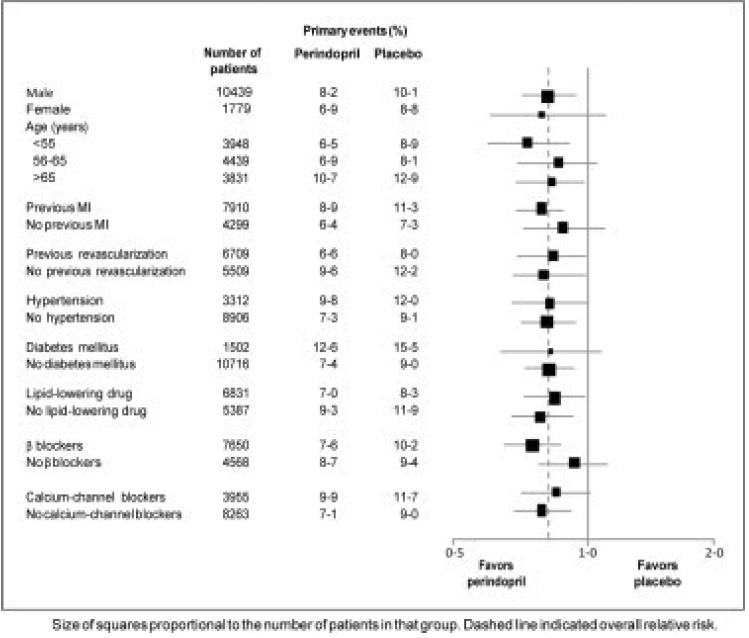
INFORMATIONS PATIENTS
Les patientes en âge de procréer doivent être informées des conséquences de l'exposition à ACEON 2 mg pendant la grossesse. Discutez des options de traitement avec les femmes qui envisagent de devenir enceintes. Les patientes doivent être invitées à signaler les grossesses à leur médecin dès que possible.
Dites aux patients de signaler rapidement tout signe d'infection (par exemple, mal de gorge, fièvre) qui pourrait être un signe de neutropénie.
