Minipress 1mg, 2mg Prazosin Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Minipress et comment l'utiliser ?
Minipress (chlorhydrate de prazosine) est un alpha-bloquant utilisé pour traiter l'hypertension (pression artérielle élevée).
Quels sont les effets secondaires de Minipress 2mg ?
Les effets secondaires courants de Minipress 1 mg incluent :
- mal de tête,
- somnolence,
- fatigue,
- la faiblesse,
- Vision floue,
- nausée,
- vomissement,
- diarrhée ou
- constipation pendant que votre corps s'adapte au médicament
Les autres effets secondaires de Minipress 2mg incluent :
- étourdissements ou étourdissements en position debout, en particulier après la première dose et peu de temps après la prise d'une dose du médicament au cours de la première semaine de traitement.
Informez votre médecin si vous ressentez des effets secondaires graves de Minipress 1 mg, notamment des battements de cœur rapides ou forts ou des battements de poitrine, une sensation de perte de connaissance, des difficultés respiratoires, un gonflement des mains ou des pieds ou une érection douloureuse ou qui dure 4 heures. ou plus.
LA DESCRIPTION
MINIPRESS® (chlorhydrate de prazosine), un dérivé de la quinazoline, est le premier d'une nouvelle classe chimique d'antihypertenseurs. C'est le chlorhydrate de 1-(4-amino-6,7-diméthoxy-2-quinazolinyl)-4-(2-furoyl) pipérazine et sa formule structurale est :
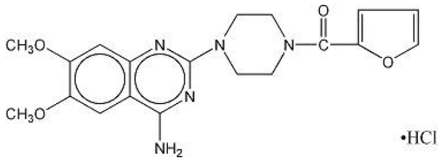
Formule moléculaire C19H21N5O4•HCl
C'est une substance cristalline blanche, légèrement soluble dans l'eau et une solution saline isotonique, et a un poids moléculaire de 419,87. Chaque gélule de 1 mg de MINIPRESS pour usage oral contient un médicament équivalent à 1 mg de base libre.
Les ingrédients inertes dans les formulations sont : les capsules de gélatine dure (qui peuvent contenir du bleu 1, du rouge 3, du rouge 28, du rouge 40 et d'autres ingrédients inertes) ; stéarate de magnésium; le laurylsulfate de sodium; amidon; saccharose.
LES INDICATIONS
MINIPRESS 1mg est indiqué dans le traitement de l'hypertension, pour faire baisser la tension artérielle. L'abaissement de la pression artérielle réduit le risque d'événements cardiovasculaires mortels et non mortels, principalement des accidents vasculaires cérébraux et des infarctus du myocarde. Ces avantages ont été observés dans des essais contrôlés de médicaments antihypertenseurs appartenant à une grande variété de classes pharmacologiques, y compris ce médicament.
Le contrôle de l'hypertension artérielle doit faire partie d'une gestion globale des risques cardiovasculaires, y compris, le cas échéant, le contrôle des lipides, la gestion du diabète, la thérapie antithrombotique, l'arrêt du tabac, l'exercice et un apport limité en sodium. De nombreux patients auront besoin de plus d'un médicament pour atteindre leurs objectifs de tension artérielle. Pour des conseils spécifiques sur les objectifs et la gestion, consultez les directives publiées, telles que celles du Comité national mixte sur la prévention, la détection, l'évaluation et le traitement de l'hypertension artérielle (JNC) du National High Blood Pressure Education Program.
De nombreux médicaments antihypertenseurs, appartenant à une variété de classes pharmacologiques et avec différents mécanismes d'action, ont été montrés dans des essais contrôlés randomisés pour réduire la morbidité et la mortalité cardiovasculaires, et on peut conclure qu'il s'agit de la réduction de la pression artérielle, et non d'une autre propriété pharmacologique de les médicaments, qui est en grande partie responsable de ces avantages. Le bénéfice cardiovasculaire le plus important et le plus constant a été une réduction du risque d'accident vasculaire cérébral, mais des réductions de l'infarctus du myocarde et de la mortalité cardiovasculaire ont également été observées régulièrement.
Une pression systolique ou diastolique élevée entraîne un risque cardiovasculaire accru, et l'augmentation du risque absolu par mmHg est plus importante à des pressions artérielles plus élevées, de sorte que même des réductions modestes de l'hypertension sévère peuvent apporter des avantages substantiels. La réduction du risque relatif de la réduction de la pression artérielle est similaire dans les populations avec un risque absolu variable, de sorte que le bénéfice absolu est plus important chez les patients qui présentent un risque plus élevé indépendamment de leur hypertension (par exemple, les patients atteints de diabète ou d'hyperlipidémie), et ces patients seraient attendus bénéficier d'un traitement plus agressif à un objectif de tension artérielle plus basse.
Certains médicaments antihypertenseurs ont des effets plus faibles sur la pression artérielle (en monothérapie) chez les patients noirs, et de nombreux médicaments antihypertenseurs ont des indications et des effets supplémentaires approuvés (p. ex., sur l'angor, l'insuffisance cardiaque ou la néphropathie diabétique). Ces considérations peuvent guider le choix du traitement.
MINIPRESS peut être utilisé seul ou en association avec d'autres antihypertenseurs tels que les diurétiques ou les bêta-bloquants.
DOSAGE ET ADMINISTRATION
La dose de MINIPRESS 1 mg doit être ajustée en fonction de la réponse tensionnelle individuelle du patient. Voici un guide pour son administration :
Dose initiale
1 mg deux ou trois fois par jour (voir AVERTISSEMENTS .)
Dose d'entretien
La posologie peut être lentement augmentée jusqu'à une dose quotidienne totale de 20 mg administrée en doses fractionnées. Les posologies thérapeutiques les plus couramment utilisées vont de 6 mg à 15 mg par jour administrés en doses fractionnées. Des doses supérieures à 20 mg n'augmentent généralement pas l'efficacité, mais quelques patients peuvent bénéficier d'augmentations supplémentaires jusqu'à une dose quotidienne de 40 mg administrée en doses fractionnées. Après la titration initiale, certains patients peuvent être maintenus de manière adéquate avec un schéma posologique biquotidien.
Utiliser avec d'autres médicaments
Lors de l'ajout d'un diurétique ou d'un autre agent antihypertenseur, la dose de MINIPRESS 1 mg doit être réduite à 1 mg ou 2 mg trois fois par jour et une nouvelle titration doit ensuite être effectuée.
L'administration concomitante de MINIPRESS 1 mg avec un inhibiteur de la PDE-5 peut entraîner des effets hypotenseurs additifs et une hypotension symptomatique ; par conséquent, le traitement par inhibiteur de la PDE-5 doit être initié à la dose la plus faible chez les patients prenant MINIPRESS.
COMMENT FOURNIE
Distribué par : Pfizer Labs, Division of Pfizer Inc., NY, NY 10017. Révisé : février 2015
EFFETS SECONDAIRES
Des essais cliniques ont été menés sur plus de 900 patients. Au cours de ces essais et de l'expérience de commercialisation ultérieure, les réactions les plus fréquentes associées à la thérapie MINIPRESS sont les suivantes : étourdissements 10,3 %, maux de tête 7,8 %, somnolence 7,6 %, manque d'énergie 6,9 %, faiblesse 6,5 %, palpitations 5,3 % et nausées 4,9 %. Dans la plupart des cas, les effets secondaires ont disparu avec la poursuite du traitement ou ont été tolérés sans diminution de la dose de médicament.
Les effets indésirables moins fréquents signalés chez 1 à 4 % des patients sont :
Gastro-intestinal : vomissements, diarrhée, constipation.
Cardiovasculaire: œdème, hypotension orthostatique, dyspnée, syncope.
Système nerveux central: vertige, dépression, nervosité.
Dermatologique : éruption.
Génito-urinaire : fréquence urinaire.
ENTR : vision floue, sclérotique rougie, épistaxis, bouche sèche, congestion nasale.
De plus, moins de 1 % des patients ont rapporté ce qui suit (dans certains cas, les relations causales exactes n'ont pas été établies) :
Gastro-intestinal : inconfort et/ou douleur abdominale, anomalies de la fonction hépatique, pancréatite.
Cardiovasculaire: tachycardie.
Système nerveux central: paresthésie, hallucinations.
Dermatologique : prurit, alopécie, lichen plan.
Génito-urinaire : incontinence, impuissance, priapisme.
ENTR : acouphène.
Autre: diaphorèse, fièvre, titre ANA positif, arthralgie.
Des cas isolés de marbrures pigmentaires et de rétinopathie séreuse, ainsi que quelques cas de développement ou de disparition de cataracte ont été signalés. Dans ces cas, la relation causale exacte n'a pas été établie parce que les observations de base étaient souvent inadéquates.
Dans des études plus spécifiques à la lampe à fente et au fond de l'œil, qui comprenaient des examens de base adéquats, aucun résultat ophtalmologique anormal lié au médicament n'a été rapporté.
Des rapports de la littérature existent associant le traitement par MINIPRESS 1 mg à une aggravation d'une narcolepsie préexistante. Une relation causale est incertaine dans ces cas.
Dans l'expérience post-commercialisation, les événements indésirables suivants ont été rapportés :
Système nerveux autonome: rinçage.
Corps dans son ensemble : réaction allergique, asthénie, malaise, douleur.
Cardiovasculaire, général : angine de poitrine, hypotension.
Endocrine: gynécomastie.
Fréquence cardiaque/rythme : bradycardie.
Psychiatrique: insomnie.
Peau/Appendices : urticaire.
Vasculaire (extracardiaque): vascularite.
Vision: douleur oculaire.
Sens spéciaux : Au cours de la chirurgie de la cataracte, une variante du syndrome de la petite pupille connue sous le nom de syndrome de l'iris flasque peropératoire (IFIS) a été rapportée en association avec un traitement par alpha-1 bloquant (voir PRÉCAUTIONS ).
INTERACTIONS MÉDICAMENTEUSES
MINIPRESS 2 mg a été administré sans aucune interaction médicamenteuse indésirable dans une expérience clinique limitée à ce jour avec les éléments suivants : (1) glycosides cardiaques-digitalis et digoxine ; (2) hypoglycémiants-insuline, chlorpropamide, phenformine, tolazamide et tolbutamide ; (3) tranquillisants et sédatifs - chlordiazépoxide, diazépam et phénobarbital ; (4) antigoutteux-allopurinol, colchicine et probénécide ; (5) antiarythmiques-procaïnamide, propranolol (voir AVERTISSEMENTS cependant), et la quinidine ; et (6) analgésiques, antipyrétiques et anti-inflammatoires - propoxyphène, aspirine, indométhacine et phénylbutazone.
Il a été démontré que l'ajout d'un diurétique ou d'un autre agent antihypertenseur à MINIPRESS 2 mg provoque un effet hypotenseur additif. Cet effet peut être minimisé en réduisant la dose de MINIPRESS à 1 à 2 mg trois fois par jour, en introduisant avec prudence des médicaments antihypertenseurs supplémentaires, puis en retitrant MINIPRESS en fonction de la réponse clinique. L'administration concomitante de MINIPRESS avec un inhibiteur de la phosphodiestérase-5 (PDE-5) peut entraîner des effets hypotenseurs additifs et une hypotension symptomatique (voir DOSAGE ET ADMINISTRATION ).
Interactions médicament/test de laboratoire
Dans une étude portant sur cinq patients ayant reçu de 12 à 24 mg de prazosine par jour pendant 10 à 14 jours, il y a eu une augmentation moyenne de 42 % du métabolite urinaire de la noradrénaline et une augmentation moyenne de la VMA urinaire de 17 %. Par conséquent, des résultats faussement positifs peuvent survenir lors des tests de dépistage du phéochromocytome chez les patients traités par la prazosine. Si un VMA élevé est trouvé, la prazosine doit être arrêtée et le patient retesté après un mois.
Tests de laboratoire
Dans les études cliniques au cours desquelles les profils lipidiques ont été suivis, aucun changement indésirable n'a généralement été noté entre les taux de lipides avant et après le traitement.
AVERTISSEMENTS
Comme tous les alpha-bloquants, MINIPRESS peut provoquer une syncope avec perte de connaissance brutale. Dans la plupart des cas, on pense que cela est dû à un effet hypotenseur postural excessif, bien que parfois la syncopalepisode ait été précédée d'un épisode de tachycardie sévère avec des fréquences cardiaques de 120 à 160 battements par minute. Les odes de syncopalepis se sont généralement produites dans les 30 à 90 minutes suivant la dose initiale du médicament; occasionnellement, ils ont été signalés en association avec des augmentations rapides de la dose ou avec l'introduction d'un autre médicament antihypertenseur dans le régime d'un patient prenant de fortes doses de MINIPRESS. L'incidence des syncopalepis odes est d'environ 1 % chez les patients ayant reçu une dose initiale de 2 mg ou plus. Les essais cliniques menés au cours de la phase expérimentale de ce médicament suggèrent que les épisodes de syncope peuvent être minimisés en limitant la dose initiale du médicament à 1 mg, en augmentant ensuite lentement la dose et en introduisant tout médicament antihypertenseur supplémentaire dans le régime du patient. avec prudence (voir POSOLOGIE ET ADMINISTRATION). Une hypotension peut se développer chez les patients recevant MINIPRESS qui reçoivent également un bêta-bloquant tel que le propranolol.
Si une syncope survient, le patient doit être placé en position allongée et traité de manière symptomatique si nécessaire. Cet effet indésirable est spontanément résolutif et, dans la plupart des cas, ne se reproduit pas après la période initiale de traitement ou lors de l'ajustement posologique ultérieur.
Les patients doivent toujours commencer par les gélules de 1 mg de MINIPRESS. Les gélules de 2 et 5 mg ne sont pas indiquées pour le traitement initial.
Plus fréquents que la perte de conscience sont les symptômes souvent associés à l'abaissement de la tension artérielle, à savoir les étourdissements et les étourdissements. Le patient doit être averti de ces éventuels effets indésirables et informé des mesures à prendre s'ils se développent. Le patient doit également être averti d'éviter les situations où des blessures pourraient survenir si une syncope survenait au début du traitement par MINIPRESS 2 mg.
Priapisme
Des érections prolongées et du priapisme ont été rapportés avec les alpha-1-bloquants, y compris la prazosine, dans l'expérience post-commercialisation. En cas d'érection qui persiste plus de 4 heures, consultez immédiatement un médecin. Si le priapisme n'est pas traité immédiatement, des dommages aux tissus péniens et une perte permanente de puissance pourraient en résulter.
PRÉCAUTIONS
Général
Le syndrome de l'iris flasque peropératoire (IFIS) a été observé lors d'une chirurgie de la cataracte chez certains patients traités par alpha-1 bloquants. Cette variante du syndrome de la petite pupille est caractérisée par la combinaison d'un iris flasque qui gonfle en réponse aux courants d'irrigation peropératoires, d'un myosis peropératoire progressif malgré une dilatation préopératoire avec des médicaments mydriatiques standard et d'un prolapsus potentiel de l'iris vers les incisions de phacoémulsification. L'ophtalmologiste du patient doit être préparé à d'éventuelles modifications de la technique chirurgicale, telles que l'utilisation de crochets d'iris, d'anneaux dilatateurs d'iris ou de substances viscoélastiques. Il ne semble pas y avoir d'avantage à arrêter le traitement par alpha-1 bloquant avant la chirurgie de la cataracte.
Carcinogenèse, mutagenèse, altération de la fertilité
Aucun potentiel carcinogène n'a été démontré dans une étude de 18 mois chez le rat avec MINIPRESS 1 mg à des doses supérieures à 225 fois la dose humaine maximale habituelle recommandée de 20 mg par jour. MINIPRESS 2 mg ne s'est pas révélé mutagène dans les études de toxicologie génétique in vivo. Dans une étude de fertilité et de performances reproductives générales chez des rats, mâles et femelles, traités avec 75 mg/kg (225 fois la dose humaine maximale habituelle recommandée), ont démontré une diminution de la fertilité, tandis que ceux traités avec 25 mg/kg (75 fois la dose habituelle dose humaine maximale recommandée) ne l'a pas fait.
Dans les études chroniques (un an ou plus) de MINIPRESS chez le rat et le chien, des changements testiculaires consistant en une atrophie et une nécrose sont survenus à 25 mg/kg/jour (75 fois la dose humaine maximale recommandée habituelle). Aucun changement testiculaire n'a été observé chez le rat ou le chien à 10 mg/kg/jour (30 fois la dose humaine recommandée maximale habituelle). Compte tenu des changements testiculaires observés chez les animaux, 105 patients sous traitement MINIPRESS à long terme ont été surveillés pour l'excrétion de 17-cétostéroïdes et aucun changement indiquant un effet médicamenteux n'a été observé. De plus, 27 hommes sous MINIPRESS 1 mg pendant 51 mois n'ont pas présenté de modifications de la morphologie des spermatozoïdes évoquant l'effet du médicament.
Utilisation pendant la grossesse
Catégorie de grossesse C. Il a été démontré que MINIPRESS 1 mg est associé à une diminution de la taille de la portée à la naissance, à 1, 4 et 21 jours chez les rats lorsqu'ils reçoivent des doses supérieures à 225 fois la dose humaine maximale recommandée habituelle. Aucun signe d'anomalies fœtales externes, viscérales ou squelettiques liées au médicament n'a été observé. Aucune anomalie externe, viscérale ou squelettique liée au médicament n'a été observée chez les fœtus de lapines gravides et de singes gravides à des doses supérieures à 225 fois et 12 fois la dose humaine recommandée maximale habituelle, respectivement.
L'utilisation de prazosine et d'un bêta-bloquant pour le contrôle de l'hypertension sévère chez 44 femmes enceintes n'a révélé aucune anomalie fœtale ou effet indésirable lié au médicament. Le traitement par la prazosine a été poursuivi jusqu'à 14 semaines.1
La prazosine a également été utilisée seule ou en association avec d'autres agents hypotenseurs dans l'hypertension artérielle sévère de la grossesse par d'autres chercheurs. Aucune anomalie fœtale ou néonatale n'a été signalée avec l'utilisation de la prazosine.2
Il n'y a pas d'études adéquates et bien contrôlées qui établissent la sécurité de MINIPRESS chez les femmes enceintes. MINIPRESS ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour la mère et le fœtus.
Mères allaitantes
Il a été démontré que MINIPRESS 1 mg est excrété en petites quantités dans le lait maternel. La prudence s'impose lorsque MINIPRESS 2 mg est administré à une femme qui allaite.
Utilisation chez les enfants
La sécurité et l'efficacité chez les enfants n'ont pas été établies.
RÉFÉRENCES
1. Lubbe, WF, et Hodge, JV : New Zealand Med J, 94 (691) 169-172, 1981.
2. Davey, DA et Dommisse, J : SA Med J, 4 octobre 1980 (551-556).
SURDOSAGE
L'ingestion accidentelle d'au moins 50 mg de MINIPRESS chez un enfant de deux ans a entraîné une somnolence profonde et une dépression des réflexes. Aucune diminution de la pression artérielle n'a été notée. La récupération s'est déroulée sans incident.
Si un surdosage entraîne une hypotension, le soutien du système cardiovasculaire est de première importance. La restauration de la tension artérielle et la normalisation de la fréquence cardiaque peuvent être accomplies en maintenant le patient en décubitus dorsal. Si cette mesure est insuffisante, le choc doit d'abord être traité avec des extenseurs de volume. Si nécessaire, des vasopresseurs doivent alors être utilisés. La fonction rénale doit être surveillée et soutenue au besoin. Les données de laboratoire indiquent que MINIPRESS n'est pas dialysable car il est lié aux protéines.
CONTRE-INDICATIONS
MINIPRESS est contre-indiqué chez les patients présentant une sensibilité connue aux quinazolines, à la prazosine ou à l'un des ingrédients inertes.
PHARMACOLOGIE CLINIQUE
Le mécanisme exact de l'action hypotensive de la prazosine est inconnu. La prazosine provoque une diminution de la résistance périphérique totale et on pensait à l'origine qu'elle avait une action relaxante directe sur le muscle lisse vasculaire. Cependant, des études animales récentes ont suggéré que l'effet vasodilatateur de la prazosine est également lié au blocage des récepteurs alpha-adrénergiques post-synaptiques. Les résultats d'expériences sur les membres antérieurs du chien démontrent que l'effet vasodilatateur périphérique de la prazosine se limite principalement au niveau des vaisseaux résistants (artérioles). Contrairement aux alpha-bloquants classiques, l'action antihypertensive de la prazosine ne s'accompagne généralement pas d'une tachycardie réflexe. Aucune tolérance n'a été observée lors d'un traitement à long terme.
Des études hémodynamiques ont été menées chez l'homme après administration aiguë d'une dose unique et au cours d'un traitement d'entretien à long terme. Les résultats confirment que l'effet thérapeutique est une chute de la pression artérielle non accompagnée d'une modification cliniquement significative du débit cardiaque, de la fréquence cardiaque, du débit sanguin rénal et du taux de filtration glomérulaire. Il n'y a pas d'effet chronotrope négatif mesurable.
Dans les études cliniques à ce jour, le chlorhydrate de prazosine n'a pas augmenté l'activité de la rénine plasmatique.
Chez l'homme, la tension artérielle est abaissée à la fois en position couchée et debout. Cet effet est plus prononcé sur la pression artérielle diastolique.
Après administration orale, les concentrations plasmatiques humaines atteignent un pic à environ trois heures avec une demi-vie plasmatique de deux à trois heures. Le médicament est fortement lié aux protéines plasmatiques. Des études de biodisponibilité ont démontré que l'absorption totale par rapport au médicament dans une solution alcoolique à 20 % est de 90 %, ce qui donne des niveaux maximaux d'environ 65 % de ceux du médicament en solution. Les études animales indiquent que le chlorhydrate de prazosine est largement métabolisé, principalement par déméthylation et conjugaison, et excrété principalement par la bile et les fèces. Des études humaines moins approfondies suggèrent un métabolisme et une excrétion similaires chez l'homme.
Dans les études cliniques au cours desquelles les profils lipidiques ont été suivis, aucun changement indésirable n'a généralement été noté entre les taux de lipides avant et après le traitement.
INFORMATIONS PATIENTS
Des étourdissements ou une somnolence peuvent survenir après la première dose de ce médicament. Évitez de conduire ou d'effectuer des tâches dangereuses pendant les 24 premières heures suivant la prise de ce médicament ou lorsque la dose est augmentée. Des étourdissements, des étourdissements ou des évanouissements peuvent survenir, en particulier lorsque vous vous levez d'une position allongée ou assise. Se lever lentement peut aider à atténuer le problème. Ces effets peuvent également se produire si vous buvez de l'alcool, restez debout pendant de longues périodes, faites de l'exercice ou s'il fait chaud. Pendant que vous prenez MINIPRESS, faites attention à la quantité d'alcool que vous buvez. Faites également très attention pendant l'exercice ou par temps chaud, ou si vous restez debout pendant de longues périodes. Consultez votre médecin si vous avez des questions.
