Adalat 10mg, 20mg, 30mg Nifedipine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Adalat et comment est-il utilisé ?
Adalat est un médicament d'ordonnance utilisé pour traiter les symptômes de douleur thoracique (angine), d'hypertension artérielle (hypertension) et d'hypertension pulmonaire. Adalat 30 mg peut être utilisé seul ou avec d'autres médicaments.
Adalat 20 mg appartient à une classe de médicaments appelés inhibiteurs calciques ; Bloqueurs des canaux calciques, dihydropyridine.
On ne sait pas si Adalat 30 mg est sûr et efficace chez les enfants de moins de 6 ans.
Quels sont les effets secondaires possibles d'Adalat 10mg ?
Adalat peut provoquer des effets secondaires graves, notamment :
- urticaire,
- difficulté à respirer,
- gonflement du visage ou de la gorge,
- fièvre,
- mal de gorge,
- Yeux brûlants,
- douleurs cutanées,
- éruption cutanée rouge ou violette avec cloques et desquamation,
- aggravation des douleurs thoraciques,
- des battements de cœur battants,
- flottant dans ta poitrine,
- étourdissement,
- gonflement des mains ou du bas des jambes,
- douleur dans le haut de l'estomac et
- jaunissement de la peau ou des yeux (jaunisse)
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Adalat comprennent:
- gonflement,
- bouffées vasomotrices (chaleur, rougeur ou sensation de picotement),
- mal de tête,
- vertiges,
- nausée,
- brûlures d'estomac, et
- se sentir faible ou fatigué
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Adalat. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
Adalat® CC est une forme posologique en comprimés à libération prolongée de la nifédipine, un inhibiteur des canaux calciques. La nifédipine est l'acide 3,5-pyridinedicarboxylique, 1,4-dihydro-2,6-diméthyl-4-(2-nitrophényl)-diméthyl ester, C17H18N2O6, et a la formule développée :
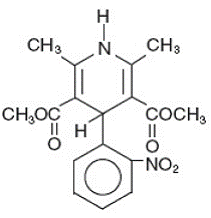
La nifédipine est une substance cristalline jaune, pratiquement insoluble dans l'eau mais soluble dans l'éthanol. Il a un poids moléculaire de 346,3. Les comprimés Adalat CC se composent d'une enveloppe externe et d'un noyau interne. Les deux contiennent de la nifédipine, l'enveloppe sous forme de formulation à libération lente et le noyau sous forme de formulation à libération rapide. Les comprimés Adalat CC contiennent soit : 30, 60 ou 90 mg de nifédipine pour une administration orale une fois par jour.
Les ingrédients inertes de la formulation sont : hydroxypropylcellulose, lactose, amidon de maïs, crospovidone, cellulose microcristalline, dioxyde de silicium et stéarate de magnésium. Les ingrédients inertes du pelliculage pour Adalat 30mg CC 30 et 60 sont : l'hypromellose, le polyéthylène glycol, l'oxyde ferrique et le dioxyde de titane. Les ingrédients inertes du pelliculage pour Adalat 20mg CC 90 sont : l'hypromellose, le polyéthylène glycol et l'oxyde ferrique
LES INDICATIONS
Adalat 10mg CC est indiqué pour le traitement de l'hypertension. Il peut être utilisé seul ou en association avec d'autres agents antihypertenseurs.
DOSAGE ET ADMINISTRATION
La posologie doit être ajustée en fonction des besoins de chaque patient. Il est recommandé d'administrer Adalat 20 mg CC par voie orale une fois par jour à jeun. Adalat 10 mg CC est une forme posologique à libération prolongée et les comprimés doivent être avalés entiers, sans être mordus ni divisés. En général, la titration doit se dérouler sur une période de 7 à 14 jours en commençant par 30 mg une fois par jour. La titration ascendante doit être basée sur l'efficacité et la sécurité thérapeutiques. La dose d'entretien habituelle est de 30 mg à 60 mg une fois par jour. L'ajustement à des doses supérieures à 90 mg par jour n'est pas recommandé.
Si l'arrêt d'Adalat 30 mg CC est nécessaire, une bonne pratique clinique suggère que la posologie doit être diminuée progressivement sous la surveillance étroite d'un médecin.
La co-administration de nifédipine avec du jus de pamplemousse doit être évitée (voir PHARMACOLOGIE CLINIQUE et PRÉCAUTIONS ).
Des précautions doivent être prises lors de la distribution d'Adalat CC pour s'assurer que la forme posologique à libération prolongée a été prescrite.
COMMENT FOURNIE
Adalat CC Les comprimés à libération prolongée sont fournis sous forme de comprimés pelliculés ronds de 30 mg, 60 mg et 90 mg. Les différentes forces peuvent être identifiées comme suit :
Comprimés Adalat® CC sont livrés en :
Les comprimés doivent être protégés de la lumière et de l'humidité et conservés à une température inférieure à 86 °F (30 °C). Répartir dans des contenants étanches et résistants à la lumière.
Fabriqué pour : Bayer HealthCare Pharmaceuticals Inc., Wayne, NJ 07470. Fabriqué en Allemagne. Révisé : décembre 2015
EFFETS SECONDAIRES
Expériences indésirables
L'incidence des événements indésirables pendant le traitement par Adalat CC à des doses allant jusqu'à 90 mg par jour a été dérivée d'essais cliniques multicentriques contrôlés par placebo chez 370 patients hypertendus. L'aténolol 50 mg une fois par jour a été utilisé en concomitance chez 187 des 370 patients sous Adalat CC et chez 64 des 126 patients sous placebo. Tous les événements indésirables signalés au cours du traitement par Adalat 30 mg CC ont été compilés indépendamment de leur relation causale avec le médicament.
L'événement indésirable le plus fréquemment rapporté avec Adalat 10 mg CC était l'œdème périphérique. Cela était lié à la dose et la fréquence était de 18 % sous Adalat 30 mg CC 30 mg par jour, 22 % sous Adalat 30 mg CC 60 mg par jour et 29 % sous Adalat 10 mg CC 90 mg par jour contre 10 % sous placebo.
Les autres événements indésirables courants signalés dans les essais contrôlés par placebo ci-dessus comprennent :
Lorsque la fréquence des événements indésirables avec Adalat 20 mg CC et le placebo est similaire, la relation causale ne peut être établie.
Les effets indésirables suivants ont été signalés avec une incidence de 3 % ou moins à des doses quotidiennes allant jusqu'à 90 mg :
Organisme dans son ensemble/systémique : douleur à la poitrine, douleur aux jambes
Système nerveux central: paresthésie, vertige
Dermatologique : éruption
Gastro-intestinal : constipation
Musculo-squelettique : crampes dans les jambes
Respiratoire: épistaxis, rhinite
Urogénital: impuissance, pollakiurie
Les autres événements indésirables signalés avec une incidence inférieure à 1,0 % étaient :
Organisme dans son ensemble/systémique : réaction allergique, asthénie, cellulite, douleur thoracique sous-sternale, frissons, œdème facial, tests de laboratoire anormaux, malaise, douleur cervicale, douleur pelvienne, douleur, réaction de photosensibilité Cardiovasculaire : fibrillation auriculaire, bradycardie, arrêt cardiaque, extrasystole, hypotension, migraine, palpitations , phlébites, hypotension orthostatique, tachycardie, angectases cutanées
Système nerveux central: anxiété, confusion, diminution de la libido, dépression, hypertonie, hypoesthésie, insomnie, somnolence
Dermatologique : œdème de Quincke, éruption pétéchiale, prurit, sudation
Gastro-intestinal : douleur abdominale, diarrhée, bouche sèche, dysphagie, dyspepsie, éructation, œsophagite, flatulence, trouble gastro-intestinal, hémorragie gastro-intestinale, augmentation de la GGT, trouble des gencives, hémorragie des gencives, vomissements
Hématologique : éosinophilie, lymphadénopathie
Métabolique: goutte, perte de poids
Musculo-squelettique : arthralgie, arthrite, troubles articulaires, myalgie, myasthénie
Respiratoire: dyspnée, augmentation de la toux, râles, pharyngite, stridor
Sens spéciaux : vision anormale, amblyopie, conjonctivite, diplopie, trouble oculaire, hémorragie oculaire, acouphène
Urogénital/Reproducteur : dysurie, calculs rénaux, nycturie, engorgement mammaire, polyurie, trouble urogénital, dysfonction érectile (DE)
Les effets indésirables suivants ont rarement été signalés chez des patientes ayant reçu de la nifédipine sous forme de noyau de pelage ou d'autres formulations : hépatite allergique, alopécie, réaction anaphylactique, anémie, arthrite avec AAN (+), dépression, érythromélalgie, dermatite exfoliative, fièvre, hyperplasie gingivale, gynécomastie, hyperglycémie, ictère, leucopénie, sautes d'humeur, crampes musculaires, nervosité, syndrome paranoïaque, purpura, tremblements, troubles du sommeil, syndrome de Stevens-Johnson, syncope, altération du goût, thrombocytopénie, nécrolyse épidermique toxique, cécité transitoire au pic du taux plasmatique, tremblement et urticaire.
INTERACTIONS MÉDICAMENTEUSES
La nifédipine est principalement éliminée par métabolisme et est un substrat du CYP3A. Les inhibiteurs et inducteurs du CYP3A peuvent avoir un impact sur l'exposition à la nifédipine et par conséquent sur ses effets désirables et indésirables. Les données in vitro et in vivo indiquent que la nifédipine peut inhiber le métabolisme des médicaments qui sont des substrats du CYP3A, augmentant ainsi l'exposition à d'autres médicaments. La nifédipine est un vasodilatateur et l'administration concomitante d'autres médicaments affectant la tension artérielle peut entraîner des interactions pharmacodynamiques.
Inhibiteurs du CYP3A
Les inhibiteurs du CYP3A tels que le kétoconazole, le fluconazole, l'itraconazole, la clarithromycine, l'érythromycine (l'azithromycine, bien que structurellement liée à la classe d'antibiotiques macrolides, est dépourvue d'inhibition cliniquement pertinente du CYP3A4), le pamplemousse, la néfazodone, la fluoxétine, le saquinavir, l'indinavir, le nelfinavir et le ritonavir peuvent entraîner dans une exposition accrue à la nifédipine lorsqu'elle est co-administrée. Une surveillance attentive et un ajustement posologique peuvent être nécessaires ; envisager d'initier la nifédipine à la dose la plus faible disponible si elle est administrée en concomitance avec ces médicaments.
Inducteurs puissants du CYP3A
Les inducteurs puissants du CYP3A, tels que la rifampine, la rifabutine, le phénobarbital, la phénytoïne, la carbamazépine et le millepertuis réduisent la biodisponibilité et l'efficacité de la nifédipine ; par conséquent, la nifédipine ne doit pas être utilisée en association avec des inducteurs puissants du CYP3A tels que la rifampicine (voir CONTRE-INDICATIONS ).
Médicaments cardiovasculaires
Antiarythmiques
Quinidine : La quinidine est un substrat du CYP3A et il a été démontré qu'elle inhibe le CYP3A in vitro. L'administration concomitante de doses multiples de sulfate de quinidine, 200 mg tid, et de nifédipine, 20 mg tid, a augmenté la Cmax et l'ASC de la nifédipine chez des volontaires sains par des facteurs de 2,30 et 1,37, respectivement. La fréquence cardiaque dans l'intervalle initial après l'administration du médicament a été augmentée jusqu'à 17,9 battements/minute. L'exposition à la quinidine n'a pas été modifiée de manière importante en présence de nifédipine. Une surveillance de la fréquence cardiaque et un ajustement de la dose de nifédipine, si nécessaire, sont recommandés lorsque la quinidine est ajoutée à un traitement par nifédipine.
Flécaïnide : Il y a eu trop peu d'expérience avec la co-administration de Tambocor avec la nifédipine pour recommander une utilisation concomitante.
Bloqueurs de canaux calciques
Diltiazem : Le prétraitement de volontaires sains avec 30 mg ou 90 mg tid de diltiazem po a augmenté l'ASC de la nifédipine après une dose unique de 20 mg de nifédipine par des facteurs de 2,2 et 3,1, respectivement. Les valeurs Cmax correspondantes de la nifédipine ont augmenté respectivement de facteurs de 2,0 et 1,7. La prudence s'impose lors de l'administration concomitante de diltiazem et de nifédipine et une réduction de la dose de nifédipine doit être envisagée.
Vérapamil : Le vérapamil, un inhibiteur du CYP3A, peut inhiber le métabolisme de la nifédipine et augmenter l'exposition à la nifédipine lors d'un traitement concomitant. La tension artérielle doit être surveillée et une réduction de la dose de nifédipine doit être envisagée.
Inhibiteurs de l'ECA
Bénazépril : Chez des volontaires sains recevant une dose unique de 20 mg de nifédipine ER et de bénazépril 10 mg, les concentrations plasmatiques de bénazéprilate et de nifédipine en présence et en l'absence l'une de l'autre n'étaient pas statistiquement significativement différentes. Un effet hypotenseur n'a été observé qu'après co-administration des deux médicaments. L'effet tachycardique de la nifédipine a été atténué en présence de bénazépril.
Bloqueurs de l'angiotensine-II
Irbésartan : Des études in vitro montrent une inhibition significative de la formation de métabolites oxydés de l'irbésartan par la nifédipine. Cependant, dans les études cliniques, la nifédipine concomitante n'a eu aucun effet sur la pharmacocinétique de l'irbésartan.
Candésartan : Aucune interaction médicamenteuse significative n'a été rapportée dans les études avec le candésartan cilexitil administré avec la nifédipine. Étant donné que le candésartan n'est pas métabolisé de manière significative par le système du cytochrome P450 et qu'aux concentrations thérapeutiques, il n'a aucun effet sur les enzymes du cytochrome P450, des interactions avec des médicaments qui inhibent ou sont métabolisés par ces enzymes ne sont pas attendues.
Bêta-bloquants
Adalat 10 mg CC a été bien toléré lorsqu'il a été administré en association avec des bêta-bloquants chez 187 patients hypertendus dans un essai clinique contrôlé par placebo. Cependant, il y a eu des rapports occasionnels dans la littérature suggérant que la combinaison nifédipine et bêta-bloquants peut augmenter la probabilité d'insuffisance cardiaque congestive, d'hypotension sévère ou d'exacerbation de l'angor chez les patients atteints de maladies cardiovasculaires. Une surveillance clinique est recommandée et un ajustement de la dose de nifédipine doit être envisagé.
Timolole : L'hypotension est plus susceptible de se produire si des antagonistes calciques de la dihydropriridine tels que la nifédipine sont co-administrés avec le timolol.
Alpha1-bloquants centraux
Doxazosine : Des volontaires sains participant à une étude d'interaction doxazosine-nifédipine à doses multiples ont reçu 2 mg de doxazosine qd seul ou combiné avec 20 mg de nifédipine ER bid en l'absence de nifédipine, respectivement. En présence de doxazosine, l'ASC et la Cmax de la nifédipine ont été augmentées par des facteurs de 1,13 et 1,23, respectivement. Comparativement à la monothérapie à la nifédipine, la pression artérielle était plus faible en présence de doxazosine. La tension artérielle doit être surveillée lorsque la doxazosine est co-administrée avec la nifédipine, et une réduction de la dose de nifédipine doit être envisagée.
Digitale
Digoxine : L'administration simultanée de nifédipine et de digoxine peut entraîner une diminution de la clairance entraînant une augmentation des concentrations plasmatiques de digoxine. Étant donné qu'il y a eu des rapports isolés de patients présentant des taux élevés de digoxine et qu'il existe une interaction possible entre la digoxine et Adalat CC, il est recommandé de surveiller les taux de digoxine lors de l'initiation, de l'ajustement et de l'arrêt d'Adalat 10 mg CC afin d'éviter une éventuelle sur ou sous-dose. numérisation.
Antithrombotiques
Coumarines : De rares cas d'augmentation du temps de prothrombine ont été rapportés chez des patients prenant des anticoagulants coumariniques auxquels de la nifédipine a été administrée. Cependant, la relation avec le traitement par la nifédipine est incertaine.
Inhibiteurs de l'agrégation plaquettaire
Clopidogrel : Aucune interaction pharmacodynamique cliniquement significative n'a été observée lorsque le clopidrogrel était co-administré avec la nifédipine.
Tirofiban : La co-administration de nifédipine n'a pas modifié l'exposition au tirofiban de manière importante.
Autre
Diurétiques, inhibiteurs de la PDE5, alpha-méthyldopa : La nifédipine peut augmenter l'effet hypotenseur de ces agents administrés simultanément.
Médicaments non cardiovasculaires
Médicaments antifongiques
Le kétoconazole, l'itraconazole et le fluconazole sont des inhibiteurs du CYP3A et peuvent inhiber le métabolisme de la nifédipine et augmenter l'exposition à la nifédipine lors d'un traitement concomitant. La tension artérielle doit être surveillée et une réduction de la dose de nifédipine doit être envisagée.
Médicaments antisécrétoires
Oméprazole : Chez des volontaires sains recevant une dose unique de 10 mg de nifédipine, l'ASC et la Cmax de la nifédipine après un prétraitement avec de l'oméprazole 20 mg qd pendant 8 jours étaient de 1,26 et 0,87 fois celles après un prétraitement avec un placebo. Le prétraitement ou la co-administration d'oméprazole n'a pas eu d'impact sur l'effet de la nifédipine sur la tension artérielle ou la fréquence cardiaque. Il est peu probable que l'impact de l'oméprazole sur la nifédipine ait une pertinence clinique.
Pantoprazole : Chez des volontaires sains, l'exposition à aucun des deux médicaments n'a été significativement modifiée en présence de l'autre médicament.
Ranitidine : Cinq études chez des volontaires sains ont étudié l'impact de doses multiples de ranitidine sur la pharmacocinétique d'une ou plusieurs doses de nifédipine. Deux études ont examiné l'impact de la ranitidine co-administrée sur la pression artérielle chez des sujets hypertendus sous nifédipine. La co-administration de ranitidine n'a pas eu d'effets significatifs sur l'exposition à la nifédipine affectant la pression artérielle ou la fréquence cardiaque chez les sujets normotendus ou hypertendus.
Cimétidine : Cinq études chez des volontaires sains ont examiné l'impact de doses multiples de cimétidine sur la pharmacocinétique d'une dose unique ou de doses multiples de nifédipine. Deux études ont examiné l'impact de la cimétidine co-administrée sur la pression artérielle chez des sujets hypertendus sous nifédipine. Chez les sujets normotendus recevant des doses uniques de 10 mg ou des doses multiples allant jusqu'à 20 mg de nifédipine 3 fois/jour seules ou associées à de la cimétidine jusqu'à 1 000 mg/jour, les valeurs d'ASC de la nifédipine en présence de cimétidine étaient comprises entre 1,52 et 2,01 fois celles du absence de cimétidine. Les valeurs de Cmax de la nifédipine en présence de cimétidine ont été augmentées par des facteurs compris entre 1,60 et 2,02. L'augmentation de l'exposition à la nifédipine par la cimétidine s'est accompagnée de modifications pertinentes de la pression artérielle ou de la fréquence cardiaque chez les sujets normotendus. Les sujets hypertendus recevant 10 mg qd de nifédipine seule ou en association avec de la cimétidine 1000 mg qd ont également présenté des modifications pertinentes de la pression artérielle lorsque la cimétidine était ajoutée à la nifédipine. L'interaction entre la cimétidine et la nifédipine est cliniquement pertinente et la pression artérielle doit être surveillée et une réduction de la dose de nifédipine doit être envisagée.
Cisapride : L'administration simultanée de cisapride et de nifédipine peut entraîner une augmentation des concentrations plasmatiques de nifédipine.
Médicaments antibactériens
Quinupristine/Dalfopristine : Des études d'interactions médicamenteuses in vitro ont démontré que la quinupristine/dalfopristine inhibe significativement le métabolisme CYP3A de la nifédipine. L'administration concomitante de quinupristine/dalfopristine et de nifédipine (doses orales répétées) chez des volontaires sains a augmenté l'ASC et la Cmax de la nifédipine par des facteurs de 1,44 et 1,18, respectivement, par rapport à la nifédipine en monothérapie. En cas de co-administration de quinupristine/dalfopristine avec la nifédipine, la tension artérielle doit être surveillée et une réduction de la dose de nifédipine doit être envisagée.
Érythromycine : L'érythromycine, un inhibiteur du CYP3A, peut inhiber le métabolisme de la nifédipine et augmenter l'exposition à la nifédipine lors d'un traitement concomitant. La tension artérielle doit être surveillée et une réduction de la dose de nifédipine doit être envisagée.
Médicaments antituberculeux
Rifampine : Les inducteurs puissants du CYP3A, tels que la rifampicine, la rifapentine et la rifabutine, réduisent la biodisponibilité de la nifédipine, ce qui peut réduire l'efficacité de la nifédipine ; par conséquent, la nifédipine ne doit pas être utilisée en association avec des inducteurs puissants du CYP3A tels que la rifampicine (voir CONTRE-INDICATIONS ). L'impact de doses orales multiples de 600 mg de rifampine sur la pharmacocinétique de la nifédipine après une dose orale unique de gélule de nifédipine à 20 mg a été évalué dans une étude clinique. Douze hommes volontaires en bonne santé ont reçu une dose orale unique de capsule de nifédipine à 20 mg le jour 1 de l'étude. À partir du jour 2 de l'étude, les sujets ont reçu 600 mg de rifampicine une fois par jour pendant 14 jours. Le jour 15 de l'étude, une deuxième dose orale unique de capsule de 20 mg de nifédipine a été administrée avec la dernière dose de rifampicine. Par rapport au jour 1 de l'étude, un prétraitement de 14 jours avec la rifampicine a réduit la Cmax et l'ASC de la nifédipine administrée simultanément en moyenne de 95 % et 97 %, respectivement.

Médicaments antiviraux
L'amprénavir, l'atanazavir, la delavirine, le fosamprinavir, l'indinavir, le nelfinavir et le ritonavir, en tant qu'inhibiteurs du CYP3A, peuvent inhiber le métabolisme de la nifédipine et augmenter l'exposition à la nifédipine. La prudence est justifiée et la surveillance clinique des patients recommandée.
Médicaments du SNC
La néfazodone, un inhibiteur du CYP3A, peut inhiber le métabolisme de la nifédipine et augmenter l'exposition à la nifédipine lors d'un traitement concomitant. La pression artérielle doit être surveillée et une réduction de la dose de nifédipine doit être envisagée.
La fluoxétine, un inhibiteur du CYP3A, peut inhiber le métabolisme de la nifédipine et augmenter l'exposition à la nifédipine lors d'un traitement concomitant. La pression artérielle doit être surveillée et une réduction de la dose de nifédipine doit être envisagée.
L'acide valproïque peut augmenter l'exposition à la nifédipine lors d'un traitement concomitant. La tension artérielle doit être surveillée et une réduction de la dose de nifédipine doit être envisagée.
Phénytoïne, phénobarbital et carbamazépine : La nifédipine est métabolisée par le CYP3A. L'administration concomitante de gélules de nifédipine à 10 mg et de comprimés à noyau d'enveloppe de nifédipine à 60 mg avec de la phénytoïne, un inducteur du CYP3A, a réduit l'ASC et la Cmax de la nifédipine d'environ 70 %. Le phénobarbital et la carbamazépine sont également des inducteurs du CYP3A. Un traitement antihypertenseur alternatif doit être envisagé chez les patients prenant de la phénytoïne, du phénobarbital et de la carbamazépine.
Médicaments antiémétiques
Dolasétron : Chez les patients prenant du dolasétron par voie orale ou intraveineuse et de la nifédipine, aucun effet n'a été mis en évidence sur la clairance de l'hydrodolasétron.
Médicaments immunosuppresseurs
Tacrolimus : Il a été démontré que le tacrolimus est métabolisé via le système CYP3A. Il a été démontré que la nifédipine inhibe le métabolisme du tacrolimus in vitro. Les patients transplantés sous tacrolimus et nifédipine ont eu besoin de doses de 26 % à 38 % plus faibles que les patients ne recevant pas de nifédipine. La nifédipine peut augmenter l'exposition au tacrolimus. Lorsque la nifédipine est co-administrée avec le tacrolimus, les concentrations sanguines de tacrolimus doivent être surveillées et une réduction de la dose de tacrolimus doit être envisagée.
Sirolimus : Une dose unique de 60 mg de nifédipine et une dose unique de 10 mg de solution buvable de sirolimus ont été administrées à 24 volontaires sains. Aucune interaction médicamenteuse pharmacocinétique cliniquement significative n'a été observée.
Médicaments hypoglycémiants
Pioglitazone : La co-administration de pioglitazone pendant 7 jours avec 30 mg de nifédipine ER administrée par voie orale qd pendant 4 jours à des volontaires masculins et féminins a entraîné des valeurs moyennes des moindres carrés (IC à 90 %) pour la nifédipine inchangée de 0,83 (0,73-0,95) pour la Cmax et de 0,88 ( 0,80-0,96) pour l'ASC par rapport à la monothérapie à la nifédipine. Compte tenu de la grande variabilité de la pharmacocinétique de la nifédipine, la signification clinique de ce résultat est inconnue.
Rosiglitazone : Il a été démontré que la co-administration de rosiglitazone (4 mg bid) n'a eu aucun effet cliniquement pertinent sur la pharmacocinétique de la nifédipine.
Metformine : Une étude d'interaction à dose unique metformine-nifédipine chez des volontaires sains normaux a démontré que la co-administration de nifédipine augmentait la Cmax et l'ASC de la metformine plasmatique de 20 % et 9 %, respectivement, et augmentait la quantité de metformine excrétée dans les urines. Le Tmax et la demi-vie n'ont pas été modifiés. La nifédipine semble améliorer l'absorption de la metformine.
Miglitol : Aucun effet du miglitol n'a été observé sur la pharmacocinétique et la pharmacodynamique de la nifédipine.
Répaglinide : La co-administration de 10 mg de nifédipine avec une dose unique de 2 mg de répaglinide (après 4 jours de nifédipine 10 mg tid et de répaglinide 2 mg tid) a entraîné des valeurs inchangées de l'ASC et de la Cmax pour les deux médicaments.
Acarbose : La nifédipine a tendance à produire une hyperglycémie et peut entraîner une perte de contrôle de la glycémie. Si la nifédipine est co-administrée avec l'acarbose, la glycémie doit être surveillée attentivement et un ajustement de la dose de nifédipine doit être envisagé.
Médicaments interférant avec l'absorption des aliments
Orlistat : Chez 17 sujets de poids normal recevant 120 mg d'orlistat 3 fois/jour pendant 6 jours, l'orlistat n'a pas altéré la biodisponibilité de 60 mg de nifédipine (comprimés à libération prolongée).
Compléments alimentaires
Jus de pamplemousse: Chez des volontaires sains, une co-administration d'une dose unique de 250 mL de jus de pamplemousse double concentration avec 10 mg de nifédipine a augmenté l'ASC et la Cmax par des facteurs de 1,35 et 1,13, respectivement. L'ingestion de doses répétées de jus de pamplemousse (5 x 200 mL en 12 heures) après l'administration de 20 mg de nifédipine ER a augmenté l'ASC et la Cmax de la nifédipine d'un facteur 2. Le jus de pamplemousse doit être évité par les patients sous nifédipine. La consommation de jus de pamplemousse doit être arrêtée au moins 3 jours avant de mettre les patients sous nifédipine.
Herbes
Millepertuis : Le millepertuis est un inducteur du CYP3A et peut diminuer l'exposition à la nifédipine. Un traitement antihypertenseur alternatif doit être envisagé chez les patients chez qui un traitement par le millepertuis est nécessaire.
Médicament sonde CYP2D6
Débrisoquine : Chez des volontaires sains, un prétraitement par la nifédipine 20 mg tid pendant 5 jours n'a pas modifié le rapport métabolique de l'hydroxydébrisoquine à la débrisoquine mesuré dans l'urine après une dose unique de 10 mg de débrisoquine. Ainsi, il est peu probable que la nifédipine inhibe in vivo le métabolisme d'autres médicaments qui sont des substrats du CYP2D6.
AVERTISSEMENTS
Hypotension excessive
Bien que chez la plupart des patients l'effet hypotenseur de la nifédipine soit modeste et bien toléré, des patients occasionnels ont eu une hypotension excessive et mal tolérée. Ces réponses sont généralement survenues lors de la titration initiale ou lors d'un ajustement ultérieur de la posologie vers le haut, et peuvent être plus probables chez les patients utilisant des bêta-bloquants en concomitance.
Une hypotension sévère et/ou une augmentation des besoins en volume de liquide ont été rapportées chez des patients qui ont reçu des gélules à libération immédiate avec un agent bêta-bloquant et qui ont subi un pontage aorto-coronarien sous anesthésie à forte dose de fentanyl. L'interaction avec le fentanyl à forte dose semble être due à l'association de la nifédipine et d'un bêta-bloquant, mais la possibilité qu'elle puisse se produire avec la nifédipine seule, avec de faibles doses de fentanyl, dans d'autres procédures chirurgicales ou avec d'autres analgésiques narcotiques ne peut être exclu. Chez les patients traités à la nifédipine chez qui une intervention chirurgicale utilisant une anesthésie à forte dose de fentanyl est envisagée, le médecin doit être conscient de ces problèmes potentiels et, si l'état du patient le permet, un délai suffisant (au moins 36 heures) doit être accordé pour éliminer la nifédipine de le corps avant la chirurgie.
Augmentation de l'angine de poitrine et/ou de l'infarctus du myocarde
Rarement, les patients, en particulier ceux qui ont une maladie coronarienne obstructive sévère, ont développé une augmentation bien documentée de la fréquence, de la durée et/ou de la gravité de l'angor ou de l'infarctus aigu du myocarde au début de la nifédipine ou au moment de l'augmentation de la posologie. Le mécanisme de cet effet n'est pas établi.
Retrait du bêta-bloquant
Lors de l'arrêt d'un bêta-bloquant, il est important de réduire sa dose, si possible, plutôt que d'arrêter brusquement avant de commencer la nifédipine. Les patients récemment arrêtés de bêta-bloquants peuvent développer un syndrome de sevrage avec augmentation de l'angor, probablement lié à une sensibilité accrue aux catécholamines. L'initiation du traitement par la nifédipine n'empêchera pas cet événement et, à l'occasion, il a été rapporté qu'il l'augmentait.
Insuffisance cardiaque congestive
Rarement, des patients (généralement alors qu'ils recevaient un bêta-bloquant) ont développé une insuffisance cardiaque après avoir commencé à prendre de la nifédipine. Les patients présentant une sténose aortique serrée peuvent être plus à risque d'un tel événement, car l'effet de décharge de la nifédipine devrait être moins bénéfique pour ces patients, en raison de leur impédance fixe à traverser la valve aortique.
PRÉCAUTIONS
Général
Hypotension
Étant donné que la nifédipine diminue la résistance vasculaire périphérique, une surveillance attentive de la pression artérielle lors de l'administration initiale et de la titration d'Adalat CC est suggérée. Une surveillance étroite est particulièrement recommandée pour les patients qui prennent déjà des médicaments connus pour abaisser la tension artérielle (voir AVERTISSEMENTS ).
Œdème périphérique
Un œdème périphérique léger à modéré survient de manière dose-dépendante avec Adalat CC. Le taux de soustraction du placebo est d'environ 8 % à 30 mg, 12 % à 60 mg et 19 % à 90 mg par jour. Cet œdème est un phénomène localisé, que l'on pense être associé à une vasodilatation des artérioles dépendantes et des petits vaisseaux sanguins et non dû à un dysfonctionnement ventriculaire gauche ou à une rétention hydrique généralisée. Chez les patients dont l'hypertension est compliquée par une insuffisance cardiaque congestive, il faut veiller à différencier cet œdème périphérique des effets d'une dysfonction ventriculaire gauche croissante.
Utilisation chez les patients cirrhotiques
La clairance de la nifédipine est réduite et l'exposition systémique augmentée chez les patients atteints de cirrhose. On ne sait pas comment l'exposition systémique peut être modifiée chez les patients présentant une insuffisance hépatique modérée ou grave. Une surveillance attentive et une réduction de la dose peuvent être nécessaires ; envisager de commencer le traitement avec la dose la plus faible disponible.
Tests de laboratoire
Des élévations rares, généralement transitoires mais parfois significatives d'enzymes telles que la phosphatase alcaline, la CPK, la LDH, la SGOT et la SGPT ont été notées. La relation avec le traitement par la nifédipine est incertaine dans la plupart des cas, mais probable dans certains cas. Ces anomalies de laboratoire ont rarement été associées à des symptômes cliniques ; cependant, une cholestase avec ou sans ictère a été rapportée. Une légère augmentation (
La nifédipine, comme les autres inhibiteurs calciques, diminue l'agrégation plaquettaire in vitro. Des études cliniques limitées ont démontré une diminution modérée mais statistiquement significative de l'agrégation plaquettaire et une augmentation du temps de saignement chez certains patients sous nifédipine. On pense que cela est une fonction de l'inhibition du transport du calcium à travers la membrane plaquettaire. Aucune signification clinique de ces résultats n'a été démontrée.
Un test de Coombs direct positif avec ou sans anémie hémolytique a été rapporté, mais une relation causale entre l'administration de nifédipine et la positivité de ce test de laboratoire, y compris l'hémolyse, n'a pas pu être déterminée.
Bien que la nifédipine ait été utilisée en toute sécurité chez des patients présentant un dysfonctionnement rénal et qu'elle ait exercé un effet bénéfique dans certains cas, de rares élévations réversibles de l'azote uréique sanguin et de la créatinine sérique ont été rapportées chez des patients présentant une insuffisance rénale chronique préexistante. La relation avec le traitement par nifédipine est incertaine dans la plupart des cas, mais probable dans certains cas.
Carcinogenèse, mutagenèse, altération de la fertilité
La nifédipine a été administrée par voie orale à des rats pendant deux ans et ne s'est pas avérée cancérigène. Lorsqu'elle a été administrée à des rats avant l'accouplement, la nifédipine a provoqué une réduction de la fertilité à une dose d'environ 30 fois la dose humaine maximale recommandée. Il existe un rapport de la littérature sur la réduction réversible de la capacité du sperme humain obtenu à partir d'un nombre limité d'hommes infertiles prenant les doses recommandées de nifédipine à se lier à un ovule et à le féconder in vitro. Les études de mutagénicité in vivo se sont révélées négatives.
Grossesse
Catégorie de grossesse C
Chez les rongeurs, les lapins et les singes, il a été démontré que la nifédipine a divers effets embryotoxiques, placentotoxiques, tératogènes et fœtotoxiques, notamment des fœtus rabougris (rats, souris et lapins), des anomalies digitales (rats et lapins), des déformations des côtes (souris), fente palatine (souris), petits placentas et villosités choriales sous-développées (singes), mort embryonnaire et fœtale (rats, souris et lapins), grossesse prolongée (rats ; non évalué chez d'autres espèces) et diminution de la survie néonatale (rats ; non évalué chez autres espèces). En mg/kg ou en mg/m², certaines des doses associées à ces différents effets sont supérieures à la dose maximale recommandée chez l'homme et d'autres inférieures, mais toutes se situent dans un ordre de grandeur de celle-ci.
Les anomalies numériques observées chez les lapins exposés à la nifédipine sont étonnamment similaires à celles observées chez les chiots exposés à la phénytoïne, et celles-ci sont à leur tour similaires aux déformations phalangiennes qui sont la malformation la plus courante observée chez les enfants humains exposés in utero à la phénytoïne.
D'après les preuves cliniques disponibles, aucun risque prénatal spécifique n'a été identifié. Cependant, une augmentation de l'asphyxie périnatale, de l'accouchement par césarienne, de la prématurité et du retard de croissance intra-utérine a été rapportée.
Une surveillance attentive de la pression artérielle doit être exercée chez les femmes enceintes, lors de l'administration de nifédipine en association avec du sulfate de magnésium IV en raison de la possibilité d'une chute excessive de la pression artérielle qui pourrait nuire à la mère et au fœtus.
Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes.
Mères allaitantes
La nifédipine est excrétée dans le lait maternel. Il est conseillé aux mères qui allaitent de ne pas allaiter leur bébé lorsqu'elles prennent le médicament.
Utilisation pédiatrique
La sécurité et l'efficacité d'Adalat 30 mg CC chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Bien que de petites études pharmacocinétiques aient identifié une demi-vie augmentée et une augmentation de la Cmax et de l'ASC (voir PHARMACOLOGIE CLINIQUE : Pharmacocinétique et métabolisme ), les études cliniques sur la nifédipine n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils réagissent différemment des sujets plus jeunes. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
Patients présentant une intolérance au galactose
Ce médicament contenant du lactose, les patients présentant des problèmes héréditaires rares d'intolérance au galactose, un déficit en lactase de Lapp ou une malabsorption du glucose et du galactose ne doivent pas prendre ce médicament.
SURDOSAGE
L'expérience avec le surdosage de nifédipine est limitée. Les symptômes associés à un surdosage sévère en nifédipine comprennent la perte de conscience, la chute de la tension artérielle, les troubles du rythme cardiaque, l'acidose métabolique, l'hypoxie, le choc cardiogénique avec œdème pulmonaire. En règle générale, un surdosage de nifédipine entraînant une hypotension prononcée nécessite un soutien cardiovasculaire actif comprenant une surveillance de la fonction cardiovasculaire et respiratoire, une élévation des extrémités, une utilisation judicieuse de la perfusion de calcium, des agents vasopresseurs et des liquides. Après ingestion orale, un lavage gastrique approfondi est indiqué, si nécessaire en association avec une irrigation de l'intestin grêle. En cas de surdosage d'un produit à libération lente comme la nifédipine, l'élimination doit être aussi complète que possible, y compris au niveau de l'intestin grêle, pour éviter l'absorption ultérieure de la substance active. Un liquide ou un volume supplémentaire doit être administré avec prudence en raison du risque de surcharge hydrique.
On s'attendrait à ce que la clairance de la nifédipine soit prolongée chez les patients présentant une fonction hépatique altérée. Étant donné que la nifédipine est fortement liée aux protéines, la dialyse ne présentera probablement aucun avantage; cependant, la plasmaphérèse peut être bénéfique.
Un cas de surdosage massif a été signalé avec des comprimés d'une autre formulation à libération prolongée de nifédipine. Les principaux effets de l'ingestion d'environ 4800 mg de nifédipine chez un jeune homme tentant de se suicider à la suite d'une dépression induite par la cocaïne étaient des étourdissements initiaux, des palpitations, des bouffées vasomotrices et de la nervosité. Quelques heures après l'ingestion, des nausées, des vomissements et un œdème généralisé se sont développés. Aucune hypotension significative n'était apparente à la présentation, 18 heures après l'ingestion. Les anomalies de la chimie sanguine consistaient en une élévation légère et transitoire de la créatinine sérique et des élévations modestes de la LDH et de la CPK, mais une SGOT normale. Les signes vitaux sont restés stables, aucune anomalie électrocardiographique n'a été notée et la fonction rénale est revenue à la normale dans les 24 à 48 heures avec les seules mesures de soutien de routine. Aucune séquelle prolongée n'a été observée.
L'effet d'une seule ingestion de 900 mg de gélules de nifédipine chez un patient angineux déprimé sous antidépresseurs tricycliques a été une perte de conscience dans les 30 minutes suivant l'ingestion et une hypotension profonde, qui a répondu à la perfusion de calcium, aux agents vasopresseurs et au remplacement liquidien. Diverses anomalies de l'ECG ont été observées chez ce patient ayant des antécédents de bloc de branche, y compris une bradycardie sinusale et divers degrés de bloc AV. Celles-ci ont dicté le placement prophylactique d'un stimulateur ventriculaire temporaire, mais se sont par ailleurs résolues spontanément. Une hyperglycémie significative a été observée initialement chez ce patient, mais les niveaux de glucose plasmatique se sont rapidement normalisés sans autre traitement.
Un jeune patient hypertendu souffrant d'insuffisance rénale avancée a ingéré 280 mg de gélules de nifédipine en une seule fois, entraînant une hypotension marquée répondant à la perfusion de calcium et aux liquides. Aucune anomalie de la conduction AV, aucune arythmie ou modification prononcée de la fréquence cardiaque n'a été notée, ni aucune autre détérioration de la fonction rénale.
Les troubles bradycardiaques du rythme cardiaque peuvent être traités de manière symptomatique avec des ß-sympathomimétiques, et dans les troubles bradycardiaques menaçant le pronostic vital, un traitement temporaire par stimulateur cardiaque peut être conseillé.
CONTRE-INDICATIONS
L'administration concomitante d'inducteurs puissants du P450, tels que la rifampicine, est contre-indiquée car l'efficacité des comprimés de nifédipine pourrait être significativement réduite. (Voir INTERACTIONS MÉDICAMENTEUSES )
La nifédipine ne doit pas être utilisée en cas de choc cardiogénique.
Adalat est contre-indiqué chez les patients présentant une hypersensibilité connue à l'un des composants du comprimé.
PHARMACOLOGIE CLINIQUE
La nifédipine est un inhibiteur de l'influx d'ions calcium (bloqueur des canaux lents ou antagoniste des ions calcium) qui inhibe l'influx transmembranaire d'ions calcium dans le muscle lisse vasculaire et le muscle cardiaque. Les processus contractiles du muscle lisse vasculaire et du muscle cardiaque dépendent du mouvement des ions calcium extracellulaires dans ces cellules par des canaux ioniques spécifiques. La nifédipine inhibe sélectivement l'afflux d'ions calcium à travers la membrane cellulaire du muscle lisse vasculaire et du muscle cardiaque sans modifier les concentrations sériques de calcium.
Mécanisme d'action
Le mécanisme par lequel la nifédipine réduit la pression artérielle implique une vasodilatation artérielle périphérique et, par conséquent, une réduction de la résistance vasculaire périphérique. L'augmentation de la résistance vasculaire périphérique, une cause sous-jacente de l'hypertension, résulte d'une augmentation de la tension active dans le muscle lisse vasculaire. Des études ont démontré que l'augmentation de la tension active reflète une augmentation du calcium libre cytosolique.
La nifédipine est un vasodilatateur artériel périphérique qui agit directement sur le muscle lisse vasculaire. La liaison de la nifédipine aux canaux voltage-dépendants et éventuellement activés par les récepteurs dans le muscle lisse vasculaire entraîne une inhibition de l'influx de calcium à travers ces canaux. Les réserves de calcium intracellulaire dans le muscle lisse vasculaire sont limitées et dépendent donc de l'influx de calcium extracellulaire pour que la contraction se produise. La réduction de l'influx de calcium par la nifédipine provoque une vasodilatation artérielle et une diminution de la résistance vasculaire périphérique, ce qui entraîne une diminution de la pression artérielle.
Pharmacocinétique et métabolisme
La nifédipine est complètement absorbée après administration orale. La biodisponibilité de la nifédipine sous forme d'Adalat CC par rapport à la nifédipine à libération immédiate est de l'ordre de 84 % à 89 %. Après l'ingestion de comprimés d'Adalat CC à jeun, les concentrations plasmatiques culminent à environ 2,5 à 5 heures avec un deuxième petit pic ou épaule évident à environ 6 à 12 heures après l'administration. La demi-vie d'élimination de la nifédipine administrée sous forme d'Adalat CC est d'environ 7 heures, contrairement à la demi-vie d'élimination connue de 2 heures de la nifédipine administrée sous forme de capsule à libération immédiate.
Lorsqu'Adalat CC est administré en multiples de comprimés de 30 mg sur une plage de doses de 30 mg à 90 mg, l'aire sous la courbe (ASC) est proportionnelle à la dose ; cependant, la concentration plasmatique maximale pour la dose de 90 mg administrée en 3 x 30 mg est supérieure de 29 % à celle prédite à partir des doses de 30 mg et 60 mg.
Deux comprimés d'Adalat CC à 30 mg peuvent être échangés avec un comprimé d'Adalat CC à 60 mg. Cependant, trois comprimés d'Adalat CC à 30 mg entraînent des valeurs de Cmax nettement plus élevées que celles obtenues après un seul comprimé d'Adalat à 90 mg et 20 mg CC. Trois comprimés de 30 mg ne doivent donc pas être considérés comme interchangeables avec un comprimé de 90 mg.
L'administration une fois par jour d'Adalat CC à jeun entraîne une diminution des fluctuations de la concentration plasmatique de nifédipine par rapport à l'administration tid avec des gélules de nifédipine à libération immédiate. La concentration plasmatique maximale moyenne de nifédipine après un comprimé de 90 mg d'Adalat 30 mg CC, administré à jeun, est d'environ 115 ng/mL. Lorsqu'Adalat CC est administré immédiatement après un repas riche en graisses chez des volontaires sains, il y a une augmentation moyenne de 60 % de la concentration plasmatique maximale de nifédipine, un allongement du délai jusqu'à la concentration maximale, mais aucun changement significatif de l'ASC. Les concentrations plasmatiques de nifédipine lorsque Adalat 20 mg CC est pris après un repas gras entraînent des pics légèrement inférieurs par rapport à la même dose quotidienne de la formulation à libération immédiate administrée en trois doses fractionnées. Cela peut être dû, en partie, au fait qu'Adalat CC est moins biodisponible que la formulation à libération immédiate.
La nifédipine est largement métabolisée en métabolites inactifs hautement solubles dans l'eau, représentant 60 à 80 % de la dose excrétée dans l'urine. Seules des traces (moins de 0,1 % de la dose) de la forme inchangée peuvent être détectées dans les urines. Le reste est excrété dans les fèces sous forme métabolisée, très probablement en raison de l'excrétion biliaire.
La nifédipine est métabolisée via le système du cytochrome P450 3A4. Les médicaments connus pour inhiber ou induire ce système enzymatique peuvent modifier le premier passage ou la clairance de la nifédipine.
Aucune étude n'a été réalisée avec Adalat 30 mg CC chez des patients insuffisants rénaux ; cependant, des modifications significatives de la pharmacocinétique des gélules de nifédipine à libération immédiate n'ont pas été signalées chez les patients sous hémodialyse ou dialyse péritonéale ambulatoire chronique. Étant donné que l'absorption de nifédipine d'Adalat CC pourrait être modifiée par une maladie rénale, la prudence s'impose lors du traitement de ces patients.
Étant donné que la nifédipine est métabolisée via le système du cytochrome P450 3A4, sa pharmacocinétique peut être altérée chez les patients atteints d'une maladie hépatique chronique. Adalat 20 mg CC n'a pas été étudié chez les patients atteints de maladie hépatique ; cependant, chez les patients atteints d'insuffisance hépatique (cirrhose du foie), la nifédipine a une demi-vie d'élimination plus longue et une biodisponibilité plus élevée que chez les volontaires sains.
Le degré de liaison aux protéines de la nifédipine est élevé (92 % à 98 %). La liaison aux protéines peut être fortement réduite chez les patients atteints d'insuffisance rénale ou hépatique.
Après administration d'Adalat 30 mg CC à des hommes et des femmes âgés en bonne santé (âge > 60 ans), la Cmax moyenne est supérieure de 36 % et la concentration plasmatique moyenne est supérieure de 70 % à celle des patients plus jeunes.
Chez les sujets sains, la demi-vie d'élimination d'une autre formulation de nifédipine à libération prolongée était plus longue chez les sujets âgés (6,7 h) que chez les sujets jeunes (3,8 h) après administration orale. Une diminution de la clairance a également été observée chez les personnes âgées (348 ml/min) par rapport aux sujets jeunes (519 ml/min) après administration intraveineuse.
La co-administration de nifédipine avec du jus de pamplemousse entraîne une augmentation jusqu'à 2 fois de l'ASC et de la Cmax en raison de l'inhibition du métabolisme de premier passage lié au CYP3A. L'ingestion de pamplemousse et de jus de pamplemousse doit être évitée lors de la prise de nifédipine.
Etudes cliniques
Adalat 10 mg CC a produit des diminutions liées à la dose de la pression artérielle systolique et diastolique, comme l'ont démontré deux essais en double aveugle, randomisés et contrôlés par placebo au cours desquels plus de 350 patients ont été traités avec Adalat CC 30, 60 ou 90 mg une fois par jour pendant 6 semaines. Dans la première étude, Adalat 10 mg CC a été administré en monothérapie et dans la seconde étude, Adalat 20 mg CC a été ajouté à un bêta-bloquant chez des patients non contrôlés par un bêta-bloquant seul. Les résultats moyens de tension artérielle minimale (24 heures après l'administration de la dose) de ces études sont présentés ci-dessous :
RÉDUCTIONS MOYENNES DE LA TENSION ARTÉRIELLE CREUX EN COUCHAGE (mmHg) SYSTOLIQUE/DIASTOLIQUE
Les rapports creux/pic estimés à partir de la surveillance de la pression artérielle sur 24 heures variaient de 41 % à 78 % pour la pression artérielle diastolique et de 46 % à 91 % pour la pression artérielle systolique.
Hémodynamique
Comme les autres bloqueurs des canaux lents, la nifédipine exerce un effet inotrope négatif sur le tissu myocardique isolé. Ceci est rarement, voire jamais, observé chez les animaux intacts ou l'homme, probablement en raison de réponses réflexes à ses effets vasodilatateurs. Chez l'homme, la nifédipine diminue les résistances vasculaires périphériques ce qui entraîne une chute des pressions systolique et diastolique, généralement minime chez le volontaire normotendu (moins de 5-10 mm Hg systolique), mais parfois plus importante. Avec Adalat 30 mg CC, ces diminutions de la pression artérielle ne s'accompagnent d'aucune modification significative du rythme cardiaque. Les études hémodynamiques de la formulation de nifédipine à libération immédiate chez des patients ayant une fonction ventriculaire normale ont généralement trouvé une légère augmentation de l'indice cardiaque sans effets majeurs sur la fraction d'éjection, la pression télédiastolique ventriculaire gauche (LVEDP) ou le volume (LVEDV). Chez les patients dont la fonction ventriculaire est altérée, la plupart des études aiguës ont montré une certaine augmentation de la fraction d'éjection et une réduction de la pression de remplissage ventriculaire gauche.
Effets électrophysiologiques
Bien que, comme d'autres membres de sa classe, la nifédipine provoque une légère dépression de la fonction du nœud sino-auriculaire et de la conduction auriculo-ventriculaire dans des préparations myocardiques isolées, de tels effets n'ont pas été observés dans des études chez des animaux intacts ou chez l'homme. Dans des études électrophysiologiques formelles, principalement chez des patients ayant des systèmes de conduction normaux, la nifédipine administrée sous forme de capsule à libération immédiate n'a eu aucune tendance à prolonger la conduction auriculo-ventriculaire ou le temps de récupération du nœud sinusal, ni à ralentir la fréquence sinusale.
INFORMATIONS PATIENTS
Adalat CC est un comprimé à libération prolongée et doit être avalé entier et pris à jeun. Il ne doit pas être administré avec de la nourriture. Ne pas mâcher, diviser ou écraser les comprimés.
