Benicar 10mg, 20mg, 40mg Olmesartan Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Benicar 40 mg et comment est-il utilisé ?
Benicar est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de l'hypertension artérielle. Benicar 10 mg peut être utilisé seul ou avec d'autres médicaments.
Benicar est un bloqueur des récepteurs de l'angiotensine II ou ARA.
On ne sait pas si Benicar est sûr et efficace chez les enfants de moins de 6 ans.
Quels sont les effets secondaires possibles de Benicar 40mg ?
Benicar peut provoquer des effets secondaires graves, notamment :
- étourdissement
- peu ou pas de miction
- gonflement des mains ou des pieds
- nausée
- la faiblesse
- sensation de picotement
- douleur thoracique
- rythme cardiaque rapide ou irrégulier
- perte de mouvement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Benicar incluent :
- vertiges
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Benicar. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
TOXICITÉ FŒTALE
- Lorsqu'une grossesse est détectée, arrêtez Benicar 40 mg dès que possible [voir MISES EN GARDE ET PRÉCAUTIONS]
- Les médicaments qui agissent directement sur la rénine-angiotense dans le système peuvent causer des blessures et la mort du fœtus en développement [voir MISES EN GARDE ET PRÉCAUTIONS].
LA DESCRIPTION
L'olmésartan médoxomil, un promédicament, est hydrolysé en olmésartan lors de son absorption par le tractus gastro-intestinal. L'olmésartan est un antagoniste sélectif des récepteurs de l'angiotensine II de sous-type AT1.
L'olmésartan médoxomil est décrit chimiquement comme le 2,3-dihydroxy-2-butényl 4-(1 hydroxy-1- méthyléthyl)-2-propyl-1-[p-(o-1H-tétrazol-5-ylphényl)benzyl]imidazole- 5 carboxylate, 2,3-carbonate cyclique.
Sa formule empirique est C29H30N6O6 et sa formule structurale est :
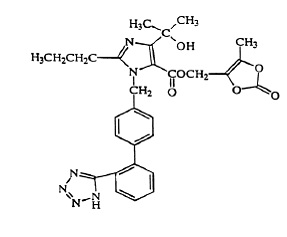
L'olmésartan médoxomil est une poudre ou une poudre cristalline blanche à blanc jaunâtre clair d'un poids moléculaire de 558,59. Il est pratiquement insoluble dans l'eau et peu soluble dans le méthanol. Benicar 20 mg est disponible pour une utilisation orale sous forme de comprimés pelliculés contenant 5 mg, 20 mg ou 40 mg d'olmésartan médoxomil et les ingrédients inactifs suivants : hydroxypropylcellulose, hypromellose, lactose monohydraté, hydroxypropylcellulose faiblement substituée, stéarate de magnésium, cellulose microcristalline. , talc, dioxyde de titane et (5 mg seulement) oxyde de fer jaune.
LES INDICATIONS
Benicar 40 mg est indiqué pour le traitement de l'hypertension chez les adultes et les enfants de six ans et plus, pour abaisser la tension artérielle. L'abaissement de la pression artérielle réduit le risque d'événements cardiovasculaires mortels et non mortels, principalement des accidents vasculaires cérébraux et des infarctus du myocarde. Ces avantages ont été observés dans des essais contrôlés de médicaments antihypertenseurs appartenant à une grande variété de classes pharmacologiques, y compris la classe à laquelle ce médicament appartient principalement. Il n'y a pas d'essais contrôlés démontrant une réduction des risques avec Benicar.
Le contrôle de l'hypertension artérielle doit faire partie d'une gestion globale des risques cardiovasculaires, y compris, le cas échéant, le contrôle des lipides, la gestion du diabète, la thérapie antithrombotique, l'arrêt du tabac, l'exercice et un apport limité en sodium. De nombreux patients auront besoin de plus d'un médicament pour atteindre leurs objectifs de tension artérielle. Pour des conseils spécifiques sur les objectifs et la gestion, consultez les directives publiées, telles que celles du Comité national mixte sur la prévention, la détection, l'évaluation et le traitement de l'hypertension artérielle (JNC) du National High Blood Pressure Education Program.
De nombreux médicaments antihypertenseurs, appartenant à une variété de classes pharmacologiques et avec différents mécanismes d'action, ont été montrés dans des essais contrôlés randomisés pour réduire la morbidité et la mortalité cardiovasculaires, et on peut conclure qu'il s'agit de la réduction de la pression artérielle, et non d'une autre propriété pharmacologique de les médicaments, qui est en grande partie responsable de ces avantages. Le bénéfice cardiovasculaire le plus important et le plus constant a été une réduction du risque d'accident vasculaire cérébral, mais des réductions de l'infarctus du myocarde et de la mortalité cardiovasculaire ont également été observées régulièrement.
Une pression systolique ou diastolique élevée entraîne un risque cardiovasculaire accru, et l'augmentation du risque absolu par mmHg est plus importante à des pressions artérielles plus élevées, de sorte que même des réductions modestes de l'hypertension sévère peuvent apporter des avantages substantiels. La réduction du risque relatif de la réduction de la pression artérielle est similaire dans les populations avec un risque absolu variable, de sorte que le bénéfice absolu est plus important chez les patients qui présentent un risque plus élevé indépendamment de leur hypertension (par exemple, les patients atteints de diabète ou d'hyperlipidémie), et ces patients seraient attendus bénéficier d'un traitement plus agressif à un objectif de tension artérielle plus basse.
Certains médicaments antihypertenseurs ont des effets plus faibles sur la pression artérielle (en monothérapie) chez les patients noirs, et de nombreux médicaments antihypertenseurs ont des indications et des effets supplémentaires approuvés (p. ex., sur l'angor, l'insuffisance cardiaque ou la néphropathie diabétique). Ces considérations peuvent guider le choix du traitement.
Il peut être utilisé seul ou en association avec d'autres agents antihypertenseurs.
DOSAGE ET ADMINISTRATION
Hypertension adulte
La posologie doit être individualisée. La dose initiale habituelle recommandée de Benicar 20 mg est de 20 mg une fois par jour lorsqu'il est utilisé en monothérapie chez des patients qui ne présentent pas de volume contracté. Pour les patients nécessitant une réduction supplémentaire de la pression artérielle après 2 semaines de traitement, la dose de Benicar peut être augmentée à 40 mg. Les doses supérieures à 40 mg ne semblent pas avoir un effet plus important. L'administration biquotidienne n'offre aucun avantage par rapport à la même dose totale administrée une fois par jour.
Chez les patients présentant une déplétion possible du volume intravasculaire (par exemple, les patients traités avec des diurétiques, en particulier ceux dont la fonction rénale est altérée), initier Benicar sous étroite surveillance médicale et envisager l'utilisation d'une dose initiale plus faible [voir AVERTISSEMENTS ET PRECAUTIONS ].
Hypertension pédiatrique (6 ans et plus)
La posologie doit être individualisée. Pour les enfants qui peuvent avaler des comprimés, la dose initiale habituelle recommandée de Benicar est de 10 mg une fois par jour pour les patients pesant de 20 à
L'utilisation de Benicar 10 mg chez les enfants de moins de 1 an n'est pas recommandée [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Pour les enfants qui ne peuvent pas avaler des comprimés, la même dose peut être administrée en utilisant une suspension extemporanée comme décrit ci-dessous [voir PHARMACOLOGIE CLINIQUE ]. Suivez les instructions de préparation de la suspension ci-dessous pour administrer Benicar sous forme de suspension.
Préparation de suspension (pour 200 mL d'une suspension à 2 mg/mL)
Ajouter 50 ml d'eau purifiée dans un flacon ambré en polyéthylène téréphtalate (PET) contenant vingt comprimés Benicar 20 mg et laisser reposer pendant au moins 5 minutes. Agiter le récipient pendant au moins 1 minute et laisser reposer la suspension pendant au moins 1 minute. Répétez 1 minute d'agitation et 1 minute de repos quatre fois supplémentaires. Ajouter 100 ml d'ORA-Sweet® et 50 ml d'ORA-Plus®* à la suspension et bien agiter pendant au moins 1 minute. La suspension doit être réfrigérée à 2-8°C (36-46°F) et peut être conservée jusqu'à 4 semaines. Bien agiter la suspension avant chaque utilisation et remettre rapidement au réfrigérateur.
COMMENT FOURNIE
Formes posologiques et points forts
- 5 mg, comprimés jaunes, ronds, pelliculés, non sécables, gravés avec Sankyo sur une face et C12 sur l'autre face
- Comprimés blancs, ronds, pelliculés, non sécables de 20 mg, gravés Sankyo d'un côté et C14 de l'autre côté
- 40 mg comprimés blancs, ovales, pelliculés, non sécables, gravés avec Sankyo sur une face et C15 sur l'autre face
Stockage et manutention
Benicar est fourni sous forme de comprimés jaunes, ronds, pelliculés, non sécables contenant 5 mg d'olmésartan médoxomil, sous forme de comprimés blancs, ronds, pelliculés, non sécables contenant 20 mg d'olmésartan médoxomil, et sous forme de comprimés blancs, de forme ovale. , comprimés pelliculés non sécables contenant 40 mg d'olmésartan médoxomil. Les comprimés sont gravés Sankyo d'un côté et C12, C14 ou C15 de l'autre côté des comprimés de 5, 20 et 40 mg, respectivement.
Les comprimés sont fournis comme suit :
Stockage
Le magasin à 20-25°C (68-77°F) [voit USP la Température de Pièce Contrôlée].
Fabriqué pour Daiichi Sankyo, Inc., Basking Ridge, NJ 07920. Révisé : octobre 2019
EFFETS SECONDAIRES
Expérience des essais cliniques
Étant donné que les études cliniques sont menées dans des conditions très variables, les taux d'effets indésirables observés dans les études cliniques d'un médicament ne peuvent pas être directement comparés aux taux des études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Hypertension adulte
L'innocuité de Benicar a été évaluée chez plus de 3825 patients/sujets, dont plus de 3275 patients traités pour l'hypertension dans des essais contrôlés. Cette expérience a inclus environ 900 patients traités pendant au moins 6 mois et plus de 525 pendant au moins 1 an. Les événements étaient généralement légers, transitoires et n'avaient aucun rapport avec la dose de Benicar.
L'analyse des groupes de sexe, d'âge et de race n'a démontré aucune différence entre Benicar 40 mg et les patients traités par placebo. Le taux d'abandons en raison d'effets indésirables dans tous les essais de patients hypertendus était de 2,4 % (c'est-à-dire 79/3278) des patients traités par Benicar 40 mg et de 2,7 % (c'est-à-dire 32/1179) des patients témoins. Dans les essais contrôlés par placebo, le seul effet indésirable survenu chez plus de 1 % des patients traités par Benicar 20 mg et à une incidence plus élevée par rapport au placebo était des étourdissements (3 % contre 1 %).
Un œdème facial a été rapporté chez cinq patients recevant Benicar. Des œdèmes de Quincke ont été rapportés avec les antagonistes de l'angiotensine II.
Hypertension pédiatrique
Aucune différence pertinente n'a été identifiée entre le profil des événements indésirables chez les patients pédiatriques âgés de 1 à 16 ans et celui précédemment rapporté chez les patients adultes.
Expérience post-commercialisation
Les effets indésirables suivants ont été rapportés depuis la commercialisation. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Corps dans son ensemble : Asthénie, œdème de Quincke, réactions anaphylactiques
Gastro-intestinal : Vomissements, entéropathie sprue-like [voir AVERTISSEMENTS ET PRECAUTIONS ]
Troubles métaboliques et nutritionnels : Hyperkaliémie
Musculo-squelettique : Rhabdomyolyse
Système urogénital : Insuffisance rénale aiguë, augmentation du taux de créatinine dans le sang
Peau et appendices : Alopécie, prurit, urticaire
Les données d'un essai contrôlé et d'une étude épidémiologique ont suggéré qu'une dose élevée d'olmésartan pourrait augmenter le risque cardiovasculaire (CV) chez les patients diabétiques, mais les données globales ne sont pas concluantes. L'essai ROADMAP randomisé, contrôlé par placebo et en double aveugle (essai randomisé Olmesartan And Diabetes MicroAlbuminuria Prevention, n = 4447) a examiné l'utilisation de l'olmésartan, 40 mg par jour, par rapport à un placebo chez des patients atteints de diabète sucré de type 2, de normoalbuminurie et à au moins un facteur de risque supplémentaire de maladie CV. L'essai a atteint son critère d'évaluation principal, l'apparition retardée de la microalbuminurie, mais l'olmésartan n'a eu aucun effet bénéfique sur la diminution du débit de filtration glomérulaire (DFG). Une augmentation de la mortalité CV a été constatée (mort cardiaque subite jugée, infarctus du myocarde mortel, accident vasculaire cérébral mortel, décès par revascularisation) dans le groupe olmésartan par rapport au groupe placebo (15 olmésartan contre 3 placebo, HR 4,9, intervalle de confiance à 95 % [IC ], 1,4, 17), mais le risque d'infarctus du myocarde non mortel était plus faible avec l'olmésartan (HR 0,64, IC à 95 % 0,35, 1,18).
L'étude épidémiologique a inclus des patients de 65 ans et plus avec une exposition globale de > 300 000 années-patients. Dans le sous-groupe de patients diabétiques recevant de l'olmésartan à forte dose (40 mg/j) pendant > 6 mois, il semble y avoir un risque accru de décès (HR 2,0, IC à 95 % 1,1, 3,8) par rapport à des patients similaires prenant d'autres bloqueurs des récepteurs de l'angiotensine. En revanche, l'utilisation d'olmésartan à forte dose chez les patients non diabétiques semble être associée à une diminution du risque de décès (HR 0,46, IC à 95 % 0,24, 0,86) par rapport à des patients similaires prenant d'autres antagonistes des récepteurs de l'angiotensine. Aucune différence n'a été observée entre les groupes recevant des doses plus faibles d'olmésartan par rapport aux autres inhibiteurs de l'angiotensine ou ceux recevant un traitement pendant
Dans l'ensemble, ces données soulèvent une inquiétude quant à un possible risque CV accru associé à l'utilisation d'olmésartan à forte dose chez les patients diabétiques. Il existe cependant des inquiétudes quant à la crédibilité de la découverte d'un risque CV accru, notamment l'observation dans la grande étude épidémiologique d'un bénéfice de survie chez les non-diabétiques d'une ampleur similaire à la conclusion défavorable chez les diabétiques.
INTERACTIONS MÉDICAMENTEUSES
Agents augmentant le potassium sérique
L'utilisation concomitante d'olmésartan avec d'autres agents qui bloquent le système rénine-angiotensine, des diurétiques épargneurs de potassium (par exemple, la spironolactone, le triamtérène, l'amiloride), des suppléments de potassium, des substituts de sel contenant du potassium ou d'autres médicaments susceptibles d'augmenter les taux de potassium (par exemple, l'héparine) peut entraîner une augmentation du potassium sérique. Si une co-médication est jugée nécessaire, une surveillance de la kaliémie est recommandée.
Agents anti-inflammatoires non stéroïdiens, y compris les inhibiteurs sélectifs de la cyclooxygénase-2 (inhibiteurs de la COX-2)
Chez les patients âgés, hypovolémiques (y compris ceux sous traitement diurétique) ou dont la fonction rénale est altérée, la co-administration d'AINS, y compris les inhibiteurs sélectifs de la COX-2, avec des antagonistes des récepteurs de l'angiotensine II, y compris l'olmésartan médoxomil, peut entraîner une détérioration de la fonction rénale, y compris une éventuelle insuffisance rénale aiguë. Ces effets sont généralement réversibles. Surveiller périodiquement la fonction rénale chez les patients recevant un traitement par olmésartan médoxomil et AINS.
L'effet antihypertenseur des antagonistes des récepteurs de l'angiotensine II, y compris l'olmésartan médoxomil, peut être atténué par les AINS, y compris les inhibiteurs sélectifs de la COX-2.
Double blocage du système rénine-angiotensine (RAS)
Le double blocage du SRA avec les inhibiteurs des récepteurs de l'angiotensine, les inhibiteurs de l'ECA ou l'aliskirène est associé à des risques accrus d'hypotension, d'hyperkaliémie et de modifications de la fonction rénale (y compris l'insuffisance rénale aiguë) par rapport à la monothérapie. La plupart des patients recevant l'association de deux inhibiteurs du RAS n'obtiennent aucun bénéfice supplémentaire par rapport à la monothérapie. En général, évitez l'utilisation combinée d'inhibiteurs du RAS. Surveillez étroitement la pression artérielle, la fonction rénale et les électrolytes chez les patients sous Benicar et d'autres agents qui affectent le RAS.
Ne pas co-administrer l'aliskirène avec Benicar chez les patients diabétiques [voir CONTRE-INDICATIONS ]. Éviter l'utilisation d'aliskirène avec Benicar 40 mg chez les patients insuffisants rénaux (DFG
Lithium
Des augmentations des concentrations sériques de lithium et de la toxicité du lithium ont été rapportées lors de l'administration concomitante de lithium avec des antagonistes des récepteurs de l'angiotensine II, y compris BENICAR. Surveiller les taux sériques de lithium lors d'une utilisation concomitante.
Chlorhydrate de colesevelam
L'administration concomitante de chlorhydrate de colesevelam, agent séquestrant des acides biliaires, réduit l'exposition systémique et la concentration plasmatique maximale d'olmésartan. L'administration d'olmésartan au moins 4 heures avant le chlorhydrate de colesevelam a diminué l'effet d'interaction médicamenteuse. Envisagez d'administrer l'olmésartan au moins 4 heures avant la dose de chlorhydrate de colesevelam [voir PHARMACOLOGIE CLINIQUE ].
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Toxicité fœtale
Benicar 10 mg peut nuire au fœtus lorsqu'il est administré à une femme enceinte. L'utilisation de médicaments qui agissent sur le système rénine-angiotensine (RAS) au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales. L'oligohydramnios qui en résulte peut être associé à une hypoplasie pulmonaire fœtale et à des déformations squelettiques. Les effets indésirables néonataux potentiels comprennent l'hypoplasie crânienne, l'anurie, l'hypotension, l'insuffisance rénale et la mort. Lorsqu'une grossesse est détectée, arrêtez Benicar dès que possible [voir Utilisation dans des populations spécifiques ].
Morbidité chez les nourrissons
L'utilisation de Benicar chez les enfants de moins de 1 an n'est pas recommandée. Les médicaments qui agissent directement sur le système rénine-angiotensine-aldostérone (RAAS) peuvent avoir des effets sur le développement des reins immatures [voir Utilisation dans des populations spécifiques ].
Hypotension chez les patients souffrant d'une déplétion volumique ou sodée
Chez les patients présentant un système rénine-angiotensine-aldostérone activé, tels que les patients présentant une déplétion volémique et/ou sodée (par exemple, ceux traités par des diurétiques à fortes doses), une hypotension symptomatique peut être anticipée après le début du traitement par Benicar. Initier le traitement sous surveillance médicale étroite et envisager de commencer à une dose plus faible. En cas d'hypotension, placer le patient en décubitus dorsal et, si nécessaire, administrer une perfusion intraveineuse de solution saline normale [voir DOSAGE ET ADMINISTRATION ]. Une réponse hypotensive transitoire n'est pas une contre-indication à un traitement ultérieur, qui peut généralement être poursuivi sans difficulté une fois la pression artérielle stabilisée.
Fonction rénale altérée
En raison de l'inhibition du système rénine-angiotensine-aldostérone, des modifications de la fonction rénale peuvent être anticipées chez les personnes sensibles traitées par Benicar. Chez les patients dont la fonction rénale peut dépendre de l'activité du système rénine-angiotensinaldostérone (p. ex., les patients atteints d'insuffisance cardiaque congestive sévère), le traitement par des inhibiteurs de l'enzyme de conversion de l'angiotensine (ECA) et des antagonistes des récepteurs de l'angiotensine a été associé à une oligurie et/ou une azotémie progressive et rarement avec insuffisance rénale aiguë et/ou décès. Des résultats similaires peuvent être attendus chez les patients traités par Benicar [voir DOSAGE ET ADMINISTRATION , INTERACTIONS MÉDICAMENTEUSES , Utilisation dans des populations spécifiques et PHARMACOLOGIE CLINIQUE ].
Dans des études sur les inhibiteurs de l'ECA chez des patients présentant une sténose unilatérale ou bilatérale de l'artère rénale, des augmentations de la créatinine sérique ou de l'azote uréique sanguin (BUN) ont été rapportées. Il n'y a pas eu d'utilisation à long terme de Benicar chez les patients présentant une sténose unilatérale ou bilatérale de l'artère rénale, mais des résultats similaires peuvent être attendus.
Entéropathie de type Sprue
Des diarrhées chroniques sévères accompagnées d'une perte de poids substantielle ont été rapportées chez des patients prenant de l'olmésartan des mois à des années après le début du traitement. Les biopsies intestinales des patients ont souvent mis en évidence une atrophie villositaire. Si un patient développe ces symptômes pendant le traitement par l'olmésartan, exclure les autres étiologies. Envisager un traitement antihypertenseur alternatif dans les cas où aucune autre étiologie n'est identifiée.
Hyperkaliémie
Le potassium sérique doit être surveillé chez les patients recevant Benicar. Les médicaments qui inhibent le système rénine-angiotensine peuvent provoquer une hyperkaliémie. Les facteurs de risque de développement de l'hyperkaliémie comprennent l'insuffisance rénale, le diabète sucré et l'utilisation concomitante de diurétiques épargneurs de potassium, de suppléments potassiques et/ou de substituts de sel contenant du potassium [voir INTERACTIONS MÉDICAMENTEUSES ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
L'olmésartan médoxomil n'a pas été cancérogène lorsqu'il a été administré par voie alimentaire à des rats pendant une période allant jusqu'à 2 ans. La dose la plus élevée testée (2000 mg/kg/jour) était, sur une base mg/m2, environ 480 fois la dose humaine recommandée maximale (MRHD) de 40 mg/jour. Deux études de cancérogénicité menées chez la souris, une étude de gavage de 6 mois chez la souris knock-out p53 et une étude d'administration alimentaire de 6 mois chez la souris transgénique Hras2, à des doses allant jusqu'à 1000 mg/kg/jour (environ 120 fois la MRHD) , n'ont révélé aucune preuve d'un effet cancérigène de l'olmésartan médoxomil.
L'olmésartan médoxomil et l'olmésartan se sont révélés négatifs dans le test in vitro de transformation de cellules d'embryon de hamster syrien et n'ont montré aucun signe de toxicité génétique dans le test d'Ames (mutagénicité bactérienne). Cependant, il a été démontré que les deux induisaient des aberrations chromosomiques dans des cellules cultivées in vitro (poumon de hamster chinois) et ont été testés positifs pour les mutations de la thymidine kinase dans le test in vitro du lymphome de souris. L'olmésartan médoxomil a été testé in vivo négatif pour les mutations dans l'intestin et le rein de MutaMouse et pour la clastogénicité dans la moelle osseuse de souris (test du micronoyau) à des doses orales allant jusqu'à 2000 mg/kg (olmésartan non testé).
La fertilité des rats n'a pas été affectée par l'administration d'olmésartan médoxomil à des doses aussi élevées que 1000 mg/kg/jour (240 fois la MRHD) dans une étude dans laquelle l'administration a commencé 2 (femelle) ou 9 (mâle) semaines avant l'accouplement.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Benicar 10 mg peut nuire au fœtus lorsqu'il est administré à une femme enceinte. L'utilisation de médicaments qui agissent sur le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales. La plupart des études épidémiologiques examinant les anomalies fœtales après exposition à l'utilisation d'antihypertenseurs au cours du premier trimestre n'ont pas distingué les médicaments affectant le système rénine-angiotensine des autres agents antihypertenseurs. Dans les études de reproduction animale, le traitement par Benicar au cours de l'organogenèse a entraîné une augmentation de la toxicité embryofœtale chez le rat à des doses inférieures aux doses toxiques pour la mère.
Lorsqu'une grossesse est détectée, arrêtez Benicar dès que possible. Envisager un traitement antihypertenseur alternatif pendant la grossesse.
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
L'hypertension pendant la grossesse augmente le risque maternel de prééclampsie, de diabète gestationnel, d'accouchement prématuré et de complications à l'accouchement (p. ex., nécessité d'une césarienne et hémorragie post-partum). L'hypertension augmente le risque fœtal de retard de croissance intra-utérin et de mort intra-utérine. Les femmes enceintes souffrant d'hypertension doivent être étroitement surveillées et prises en charge en conséquence.
Effets indésirables fœtaux/néonatals
L'oligohydramnios chez les femmes enceintes qui utilisent des médicaments affectant le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse peut entraîner les effets suivants : une fonction rénale fœtale réduite entraînant une anurie et une insuffisance rénale, une hypoplasie pulmonaire fœtale, des déformations du squelette, y compris une hypoplasie du crâne, une hypotension et la mort. Chez les patientes prenant Benicar 20 mg pendant la grossesse, effectuez des examens échographiques en série pour évaluer l'environnement intra-amniotique. Des tests fœtaux peuvent être appropriés, en fonction de la semaine de gestation. Les patients et les médecins doivent toutefois savoir que l'oligohydramnios peut n'apparaître qu'après que le fœtus a subi une lésion irréversible.
Observer attentivement les nourrissons ayant des antécédents d'exposition in utero à Benicar 40 mg pour l'hypotension, l'oligurie et l'hyperkaliémie. Chez les nouveau-nés ayant des antécédents d'exposition in utero à Benicar, en cas d'oligurie ou d'hypotension, utiliser des mesures pour maintenir une pression artérielle et une perfusion rénale adéquates. Des exsanguinotransfusions ou une dialyse peuvent être nécessaires pour inverser l'hypotension et soutenir la fonction rénale.
Données
Données animales
Aucun effet tératogène n'a été observé lorsque l'olmésartan médoxomil a été administré à des rates gravides à des doses orales allant jusqu'à 1000 mg/kg/jour (240 fois la dose maximale recommandée chez l'humain (MRHD) en mg/m2) ou à des lapines gravides à des doses orales allant jusqu'à 1 mg/kg/jour (la moitié de la MRHD sur une base de mg/m2 ; des doses plus élevées n'ont pas pu être évaluées pour les effets sur le développement fœtal car elles étaient létales pour les lapines). Chez les rats, des diminutions significatives du poids à la naissance et du gain de poids des ratons ont été observées à des doses ≥ 1,6 mg/kg/jour, et des retards dans les étapes du développement (séparation retardée des oreillettes, éruption des incisives inférieures, apparition de poils abdominaux, descente des testicules, et séparation des paupières) et des augmentations dose-dépendantes de l'incidence de la dilatation du bassinet du rein ont été observées à des doses ≥ 8 mg/kg/jour. La dose sans effet observé pour la toxicité sur le développement chez le rat est de 0,3 mg/kg/jour, soit environ un dixième de la MRHD de 40 mg/jour.
Lactation
Résumé des risques
Il n'existe aucune information concernant la présence d'olmésartan dans le lait maternel, les effets sur le nourrisson allaité ou les effets sur la production de lait. L'olmésartan est sécrété à faible concentration dans le lait des rates allaitantes (voir Données ). En raison du potentiel d'effets indésirables sur le nourrisson, une décision doit être prise soit d'interrompre l'allaitement soit d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère.
Données
La présence d'olmésartan dans le lait a été observée après une seule administration orale de 5 mg/kg [14C] d'olmésartan médoxomil à des rates en lactation.
Utilisation pédiatrique
Les effets antihypertenseurs de Benicar ont été évalués dans une étude clinique randomisée en double aveugle chez des patients pédiatriques âgés de 1 à 16 ans [voir Etudes cliniques ]. La pharmacocinétique de Benicar a été évaluée chez des patients pédiatriques âgés de 1 à 16 ans [voir PHARMACOLOGIE CLINIQUE ]. Benicar 10 mg a été généralement bien toléré chez les patients pédiatriques et le profil d'effets indésirables était similaire à celui décrit pour les adultes.
Benicar 20 mg ne s'est pas avéré efficace pour l'hypertension chez les enfants de moins de 6 ans.
L'utilisation de Benicar chez les enfants de moins de 1 an n'est pas recommandée [voir AVERTISSEMENTS ET PRECAUTIONS ]. Le système rénine-angiotensine-aldostérone (RAAS) joue un rôle essentiel dans le développement des reins. Il a été démontré que le blocage du SRAA entraîne un développement anormal des reins chez les très jeunes souris. L'administration de médicaments qui agissent directement sur le système rénine-angiotensine-aldostérone (RAAS) peut altérer le développement normal des reins.
Utilisation gériatrique
Sur le nombre total de patients hypertendus recevant Benicar dans les études cliniques, plus de 20 % étaient âgés de 65 ans et plus, tandis que plus de 5 % étaient âgés de 75 ans et plus. Aucune différence globale d'efficacité ou de sécurité n'a été observée entre les patients âgés et les patients plus jeunes. D'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue [voir PHARMACOLOGIE CLINIQUE ].
Insuffisance hépatique
Des augmentations de l'ASC0-∞ et de la Cmax ont été observées chez les patients présentant une insuffisance hépatique modérée par rapport à ceux des témoins appariés, avec une augmentation de l'ASC d'environ 60 %. Aucun ajustement posologique initial n'est recommandé chez les patients présentant un dysfonctionnement hépatique modéré à marqué [voir PHARMACOLOGIE CLINIQUE ].
Insuffisance rénale
Les patients insuffisants rénaux ont des concentrations sériques élevées d'olmésartan par rapport aux sujets ayant une fonction rénale normale. Après administration répétée, l'ASC a été approximativement triplée chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Patients noirs
L'effet antihypertenseur de Benicar 10 mg était plus faible chez les patients noirs (habituellement une population à rénine basse), comme cela a été observé avec les inhibiteurs de l'ECA, les bêta-bloquants et d'autres antagonistes des récepteurs de l'angiotensine.
SURDOSAGE
Des données limitées sont disponibles concernant le surdosage chez l'homme. Les manifestations les plus probables d'un surdosage seraient l'hypotension et la tachycardie; une bradycardie peut survenir en cas de stimulation parasympathique (vagale). En cas d'hypotension symptomatique, initier un traitement de soutien. La dialysabilité de l'olmésartan est inconnue.
CONTRE-INDICATIONS
Ne pas co-administrer l'aliskirène avec Benicar 20 mg chez les patients diabétiques [voir INTERACTIONS MÉDICAMENTEUSES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
L'angiotensine II est formée à partir de l'angiotensine I dans une réaction catalysée par l'enzyme de conversion de l'angiotensine (ACE, kininase II). L'angiotensine II est le principal agent presseur du système rénine-angiotensine, avec des effets qui comprennent la vasoconstriction, la stimulation de la synthèse et de la libération d'aldostérone, la stimulation cardiaque et la réabsorption rénale du sodium. L'olmésartan bloque les effets vasoconstricteurs de l'angiotensine II en bloquant sélectivement la liaison de l'angiotensine II au récepteur AT1 dans le muscle lisse vasculaire. Son action est donc indépendante des voies de synthèse de l'angiotensine II.
Un récepteur AT2 se trouve également dans de nombreux tissus, mais ce récepteur n'est pas connu pour être associé à l'homéostasie cardiovasculaire. L'olmésartan a plus de 12 500 fois plus d'affinité pour le récepteur AT1 que pour le récepteur AT2.
Le blocage du système rénine-angiotensine avec les inhibiteurs de l'ECA, qui inhibent la biosynthèse de l'angiotensine II à partir de l'angiotensine I, est un mécanisme de nombreux médicaments utilisés pour traiter l'hypertension. Les inhibiteurs de l'ECA inhibent également la dégradation de la bradykinine, une réaction également catalysée par l'ECA. Étant donné que l'olmésartan médoxomil n'inhibe pas l'ECA (kininase II), il n'affecte pas la réponse à la bradykinine. On ne sait pas encore si cette différence a une pertinence clinique.
Le blocage du récepteur de l'angiotensine II inhibe la rétroaction régulatrice négative de l'angiotensine II sur la sécrétion de rénine, mais l'augmentation résultante de l'activité de la rénine plasmatique et des taux circulants d'angiotensine II ne surmonte pas l'effet de l'olmésartan sur la pression artérielle.
Pharmacodynamie
Des doses de Benicar de 2,5 mg à 40 mg inhibent les effets vasopresseurs de la perfusion d'angiotensine I. La durée de l'effet inhibiteur était liée à la dose, avec des doses de Benicar> 40 mg donnant> 90% d'inhibition à 24 heures.
Les concentrations plasmatiques d'angiotensine I et d'angiotensine II et l'activité rénine plasmatique (ARP) augmentent après administration unique et répétée de Benicar 10 mg chez des sujets sains et des patients hypertendus. L'administration répétée jusqu'à 80 mg de Benicar a eu une influence minime sur les taux d'aldostérone et aucun effet sur le potassium sérique.
Pharmacocinétique
Absorption
L'olmésartan médoxomil est rapidement et complètement bioactivé par l'hydrolyse de l'ester en olmésartan lors de l'absorption par le tractus gastro-intestinal.
Les comprimés de Benicar et la formulation en suspension préparée à partir des comprimés de Benicar sont bioéquivalents [voir DOSAGE ET ADMINISTRATION ].
La biodisponibilité absolue de l'olmésartan est d'environ 26 %. Après administration orale, le pic de concentration plasmatique (Cmax) de l'olmésartan est atteint après 1 à 2 heures. La nourriture n'affecte pas la biodisponibilité de l'olmésartan. Benicar peut être administré avec ou sans nourriture.
Distribution
Le volume de distribution de l'olmésartan est d'environ 17 L. L'olmésartan est fortement lié aux protéines plasmatiques (99 %) et ne pénètre pas dans les globules rouges. La liaison aux protéines est constante à des concentrations plasmatiques d'olmésartan bien supérieures à la plage atteinte avec les doses recommandées.
Chez le rat, l'olmésartan a mal traversé la barrière hémato-encéphalique, voire pas du tout. L'olmésartan a traversé la barrière placentaire chez le rat et a été distribué au fœtus. L'olmésartan a été distribué dans le lait à de faibles concentrations chez le rat.
Métabolisme et excrétion
Suite à la conversion rapide et complète de l'olmésartan médoxomil en olmésartan au cours de l'absorption, il n'y a pratiquement plus de métabolisation de l'olmésartan. La clairance plasmatique totale de l'olmésartan est de 1,3 L/h, avec une clairance rénale de 0,6 L/h. Environ 35 à 50 % de la dose absorbée est récupérée dans l'urine tandis que le reste est éliminé dans les fèces via la bile.
L'olmésartan semble être éliminé de manière biphasique avec une demi-vie d'élimination terminale d'environ 13 heures. L'olmésartan présente une pharmacocinétique linéaire après des doses orales uniques allant jusqu'à 320 mg et des doses orales multiples allant jusqu'à 80 mg. Les taux d'olmésartan à l'état d'équilibre sont atteints en 3 à 5 jours et aucune accumulation dans le plasma ne se produit avec une administration une fois par jour.
Populations spécifiques
Patients gériatriques
La pharmacocinétique de l'olmésartan a été étudiée chez le sujet âgé (≥ 65 ans). Dans l'ensemble, les concentrations plasmatiques maximales d'olmésartan étaient similaires chez les jeunes adultes et les personnes âgées. Une accumulation modeste d'olmésartan a été observée chez les personnes âgées avec des doses répétées ; L'ASCss, τ était 33 % plus élevée chez les patients âgés, ce qui correspond à une réduction d'environ 30 % de la CLR [voir DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ].
Patients pédiatriques
La pharmacocinétique de l'olmésartan a été étudiée chez des patients pédiatriques hypertendus âgés de 1 à 16 ans. La clairance de l'olmésartan chez les patients pédiatriques était similaire à celle des patients adultes après ajustement en fonction du poids corporel [voir Utilisation dans des populations spécifiques ].
La pharmacocinétique de l'olmésartan n'a pas été étudiée chez les patients pédiatriques de moins de 1 an [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Patients masculins et féminins
Des différences mineures ont été observées dans la pharmacocinétique de l'olmésartan chez les femmes par rapport aux hommes. L'ASC et la Cmax étaient de 10 à 15 % plus élevées chez les femmes que chez les hommes.
Patients atteints d'insuffisance hépatique
Des augmentations de l'ASC0-∞ et de la Cmax ont été observées chez les patients présentant une insuffisance hépatique modérée par rapport à ceux des témoins appariés, avec une augmentation de l'ASC d'environ 60 % [voir DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ].
Patients atteints d'insuffisance rénale
Chez les insuffisants rénaux, les concentrations sériques d'olmésartan étaient élevées par rapport aux sujets ayant une fonction rénale normale. Après administration répétée, l'ASC a été approximativement triplée chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Études sur les interactions médicamenteuses
Séquestrant des acides biliaires Colesevelam
L'administration concomitante de 40 mg d'olmésartan médoxomil et de 3750 mg de chlorhydrate de colesevelam chez des sujets sains a entraîné une réduction de 28 % de la Cmax et de 39 % de l'ASC de l'olmésartan. Des effets moindres, respectivement une réduction de 4 % et 15 % de la Cmax et de l'ASC, ont été observés lorsque l'olmésartan médoxomil a été administré 4 heures avant le chlorhydrate de colesevelam [voir INTERACTIONS MÉDICAMENTEUSES ].
Autres études
Aucune interaction médicamenteuse significative n'a été rapportée dans les études dans lesquelles l'olmésartan médoxomil était co-administré avec la digoxine ou la warfarine chez des volontaires sains.
La biodisponibilité de l'olmésartan n'a pas été significativement modifiée par la co-administration d'antiacides [Al(OH)3/Mg(OH)2].
L'olmésartan médoxomil n'est pas métabolisé par le système du cytochrome P450 et n'a aucun effet sur les enzymes P450 ; ainsi, des interactions avec des médicaments qui inhibent, induisent ou sont métabolisés par ces enzymes ne sont pas attendues.
Etudes cliniques
Hypertension adulte
Les effets antihypertenseurs de Benicar 10 mg ont été démontrés dans sept études contrôlées contre placebo à des doses allant de 2,5 mg à 80 mg pendant 6 à 12 semaines, chacune montrant des réductions statistiquement significatives de la pression artérielle maximale et minimale. Un total de 2693 patients (2145 Benicar; 548 placebo) souffrant d'hypertension essentielle ont été étudiés. Benicar 40 mg une fois par jour a abaissé la pression artérielle diastolique et systolique. La réponse était liée à la dose, comme le montre le graphique suivant. Une dose de Benicar de 20 mg par jour produit une réduction de la pression artérielle (PA) en position assise par rapport au placebo d'environ 10/6 mmHg et une dose de 40 mg par jour produit une réduction de la PA en position assise par rapport au placebo d'environ 12/7 mmHg. Des doses de 10 mg de Benicar supérieures à 40 mg ont eu peu d'effet supplémentaire. L'apparition de l'effet antihypertenseur s'est produite en 1 semaine et s'est largement manifestée après 2 semaines.
Benicar 40mg Dose Réponse Réduction de la pression artérielle ajustée au placebo (mmHg) 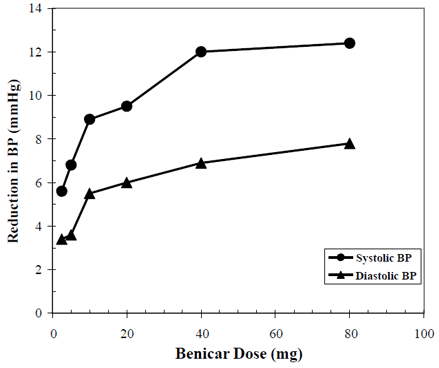
Les données ci-dessus proviennent de sept études contrôlées par placebo (2145 patients Benicar, 548 patients placebo). L'effet d'abaissement de la tension artérielle a été maintenu tout au long de la période de 24 heures avec Benicar une fois par jour, avec des rapports creux/pic pour la réponse systolique et diastolique entre 60 et 80 %.
L'effet hypotenseur de Benicar 40 mg, avec et sans hydrochlorothiazide, a été maintenu chez les patients traités jusqu'à 1 an. Il n'y a eu aucun signe de tachyphylaxie pendant le traitement à long terme par Benicar ou d'effet rebond suite à l'arrêt brutal de l'olmésartan médoxomil après 1 an de traitement.
L'effet antihypertenseur de Benicar était similaire chez les hommes et les femmes et chez les patients âgés et âgés de moins de 65 ans. L'effet était plus faible chez les patients noirs (habituellement une population à faible taux de rénine), comme cela a été observé avec les inhibiteurs de l'ECA, les bêta-bloquants et d'autres antagonistes des récepteurs de l'angiotensine. Benicar a eu un effet hypotenseur supplémentaire lorsqu'il a été ajouté à l'hydrochlorothiazide.
Il n'y a pas d'essais de Benicar démontrant des réductions du risque cardiovasculaire chez les patients souffrant d'hypertension, mais au moins un médicament pharmacologiquement similaire a démontré de tels avantages.
Hypertension pédiatrique
Les effets antihypertenseurs de Benicar 40 mg dans la population pédiatrique ont été évalués dans une étude randomisée en double aveugle portant sur 302 patients hypertendus âgés de 6 à 16 ans. La population étudiée était composée d'une cohorte entièrement noire de 112 patients et d'une cohorte mixte de 190 patients, dont 38 patients noirs. L'étiologie de l'HTA était majoritairement l'HTA essentielle (87 % de la cohorte noire et 67 % de la cohorte mixte). Les patients qui pesaient de 20 à
Dans la même étude, 59 patients âgés de 1 à 5 ans et pesant ≥ 5 kg ont reçu 0,3 mg/kg de Benicar 10 mg une fois par jour pendant trois semaines dans une phase en ouvert, puis ont été randomisés pour recevoir Benicar ou un placebo en double aveugle. phase. À la fin de la deuxième semaine de sevrage, la pression artérielle systolique/diastolique moyenne au creux était inférieure de 3/3 mmHg dans le groupe randomisé pour Benicar ; cette différence de tension artérielle n'était pas statistiquement significative (IC à 95 % -2 à 7/-1 à 7).
INFORMATIONS PATIENTS
Grossesse
Informer les patientes en âge de procréer des conséquences d'une exposition à Benicar 20 mg pendant la grossesse. Discutez des options de traitement avec les femmes qui envisagent de devenir enceintes. Dites aux patientes de signaler les grossesses à leur médecin dès que possible [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Lactation
Déconseiller aux femmes qui allaitent d'allaiter pendant le traitement par BENICAR [voir Utilisation dans des populations spécifiques ].
Hyperkaliémie
Conseillez aux patients de ne pas utiliser de suppléments de potassium ou de substituts de sel contenant du potassium sans consulter leur fournisseur de soins de santé [voir INTERACTIONS MÉDICAMENTEUSES ].
