Cozaar 25mg, 50mg, 100mg Losartan Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Cozaar 50 mg et comment est-il utilisé ?
Cozaar est un médicament d'ordonnance utilisé pour traiter les symptômes de l'hypertension artérielle, réduire le risque d'accident vasculaire cérébral chez certaines personnes souffrant de maladies cardiaques et de douleurs nerveuses diabétiques (neuropathie). Cozaar 100 mg peut être utilisé seul ou avec d'autres médicaments.
Cozaar 25 mg appartient à une classe de médicaments appelés antagonistes des récepteurs de l'angiotensine II (ARA).
On ne sait pas si Cozaar 25 mg est sûr et efficace chez les enfants de moins de 6 ans.
Quels sont les effets secondaires possibles de Cozaar 100 mg ?
Cozaar 100 mg peut provoquer des effets secondaires graves, notamment :
- étourdissement,
- douleur ou brûlure lorsque vous urinez,
- nausée,
- la faiblesse,
- sensation de picotement,
- douleur thoracique,
- battements cardiaques irréguliers,
- perte de mouvements,
- peu ou pas de miction,
- prise de poids rapide et
- gonflement des mains, des pieds ou des chevilles
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Cozaar comprennent :
- vertiges,
- maux de dos, et
- symptômes du rhume (nez bouché, éternuements, mal de gorge)
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Cozaar. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
TOXICITÉ FŒTALE
Lorsqu'une grossesse est détectée, arrêtez COZAAR dès que possible. Les médicaments qui agissent directement sur le système rénine-angiotensine peuvent causer des lésions et la mort du fœtus en développement [voir AVERTISSEMENTS ET PRECAUTIONS ].
LA DESCRIPTION
COZAAR (losartan potassique) est un inhibiteur des récepteurs de l'angiotensine II agissant sur le sous-type de récepteur AT1. Le losartan potassique, une molécule non peptidique, est chimiquement décrit comme le sel monopotassique de 2-butyl-4-chloro-1-[p-(o-1H-tétrazol-5-ylphényl)benzyl]imidazole-5-méthanol.
Sa formule empirique est C22H22ClKN6O et sa formule structurale est :
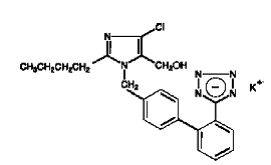
Le losartan potassique est une poudre cristalline fluide blanche à blanc cassé d'un poids moléculaire de 461,01. Il est librement soluble dans l'eau, soluble dans les alcools et légèrement soluble dans les solvants organiques courants, tels que l'acétonitrile et la méthyléthylcétone. L'oxydation du groupe 5-hydroxyméthyle sur le cycle imidazole donne le métabolite actif du losartan.
COZAAR 100 mg est disponible sous forme de comprimés pour administration orale contenant 25 mg, 50 mg ou 100 mg de losartan potassique et les ingrédients inactifs suivants : cellulose microcristalline, lactose hydraté, amidon prégélatinisé, stéarate de magnésium, hydroxypropylcellulose, hypromellose et dioxyde de titane.
Les comprimés COZAAR 25 mg, 50 mg et 100 mg contiennent du potassium dans les quantités suivantes : 2,12 mg (0,054 mEq), 4,24 mg (0,108 mEq) et 8,48 mg (0,216 mEq), respectivement. COZAAR 25 mg, COZAAR 50 mg et COZAAR 100 mg peuvent également contenir de la cire de carnauba.
LES INDICATIONS
Hypertension
COZAAR® est indiqué pour le traitement de l'hypertension chez les adultes et les patients pédiatriques de 6 ans et plus, pour abaisser la tension artérielle. L'abaissement de la pression artérielle réduit le risque d'événements cardiovasculaires (CV) mortels et non mortels, principalement les accidents vasculaires cérébraux et l'infarctus du myocarde. Ces avantages ont été observés dans des essais contrôlés de médicaments antihypertenseurs appartenant à une grande variété de classes pharmacologiques, y compris le losartan.
Le contrôle de l'hypertension artérielle doit faire partie d'une gestion globale des risques cardiovasculaires, y compris, le cas échéant, le contrôle des lipides, la gestion du diabète, le traitement antithrombotique, l'arrêt du tabac, l'exercice et un apport limité en sodium. De nombreux patients auront besoin de plus d'un médicament pour atteindre leurs objectifs de tension artérielle. Pour obtenir des conseils spécifiques sur les objectifs et la prise en charge, consultez les directives publiées, telles que celles du Comité national conjoint sur la prévention, la détection, l'évaluation et le traitement de l'hypertension artérielle (JNC) du National High Blood Pressure Education Program.
De nombreux médicaments antihypertenseurs, appartenant à une variété de classes pharmacologiques et avec différents mécanismes d'action, ont été montrés dans des essais contrôlés randomisés pour réduire la morbidité et la mortalité cardiovasculaires, et on peut conclure qu'il s'agit de la réduction de la pression artérielle, et non d'une autre propriété pharmacologique du médicaments, qui est en grande partie responsable de ces avantages. Le bénéfice cardiovasculaire le plus important et le plus constant a été une réduction du risque d'accident vasculaire cérébral, mais des réductions de l'infarctus du myocarde et de la mortalité cardiovasculaire ont également été observées régulièrement.
Une pression systolique ou diastolique élevée entraîne un risque cardiovasculaire accru, et l'augmentation du risque absolu par mmHg est plus importante à des pressions artérielles plus élevées, de sorte que même des réductions modestes de l'hypertension sévère peuvent apporter des avantages substantiels. La réduction du risque relatif de la réduction de la pression artérielle est similaire dans les populations avec un risque absolu variable, de sorte que le bénéfice absolu est supérieur chez les patients qui présentent un risque plus élevé indépendamment de leur hypertension (par exemple, les patients atteints de diabète ou d'hyperlipidémie), et ces patients devraient en bénéficier d'un traitement plus agressif à un objectif de pression artérielle plus basse.
Certains médicaments antihypertenseurs ont des effets plus faibles sur la pression artérielle (en monothérapie) chez les patients noirs, et de nombreux médicaments antihypertenseurs ont des indications et des effets supplémentaires approuvés (par exemple, sur l'angine de poitrine, l'insuffisance cardiaque ou la maladie rénale diabétique). Ces considérations peuvent guider le choix du traitement.
COZAAR peut être administré avec d'autres antihypertenseurs.
Patients hypertendus avec hypertrophie ventriculaire gauche
COZAAR 25 mg est indiqué pour réduire le risque d'accident vasculaire cérébral chez les patients souffrant d'hypertension et d'hypertrophie ventriculaire gauche, mais il existe des preuves que cet avantage ne s'applique pas aux patients noirs [voir Utilisation dans des populations spécifiques et PHARMACOLOGIE CLINIQUE ] .
Néphropathie chez les patients diabétiques de type 2
COZAAR est indiqué pour le traitement de la néphropathie diabétique avec une créatinine sérique élevée et une protéinurie (rapport albumine urinaire/créatinine ≥ 300 mg/g) chez les patients hospitalisés atteints de diabète de type 2 et ayant des antécédents d'hypertension. Dans cette population, COZAAR 50 mg réduit le taux de progression de la néphropathie tel que mesuré par la survenue d'un doublement de la créatinine sérique ou d'une insuffisance rénale terminale (nécessité d'une dialyse ou d'une transplantation rénale) [voir Etudes cliniques ] .
DOSAGE ET ADMINISTRATION
Hypertension
Hypertension adulte
La dose initiale habituelle de COZAAR 50 mg est de 50 mg une fois par jour. La posologie peut être augmentée jusqu'à une dose maximale de 100 mg une fois par jour si nécessaire pour contrôler la tension artérielle [voir Etudes cliniques ] . Une dose initiale de 25 mg est recommandée chez les patients présentant une possible déplétion intravasculaire (par exemple, sous traitement diurétique).
Hypertension pédiatrique
La dose initiale habituelle recommandée est de 0,7 mg par kg une fois par jour (jusqu'à 50 mg au total) administrée sous forme de comprimé ou de suspension [voir Préparation de suspension (pour 200 mL d'une suspension à 2,5 mg/mL) ] .La posologie doit être ajustée en fonction de la réponse de la pression artérielle. Les doses supérieures à 1,4 mg par kg (ou supérieures à 100 mg) par jour n'ont pas été étudiées chez les patients pédiatriques [voir PHARMACOLOGIE CLINIQUE , Etudes cliniques et AVERTISSEMENTS ET PRECAUTIONS ] .
COZAAR n'est pas recommandé chez les patients pédiatriques de moins de 6 ans ou chez les patients pédiatriques dont le débit de filtration glomérulaire estimé est inférieur à 30 mL/min/1,73 m 2 [voir Utilisation dans des populations spécifiques , PHARMACOLOGIE CLINIQUE et Etudes cliniques ] .
Patients hypertendus avec hypertrophie ventriculaire gauche
La dose initiale habituelle est de 50 mg de COZAAR une fois par jour. L'hydrochlorothiazide 12,5 mg par jour doit être ajouté et/ou la dose de COZAAR doit être augmentée à 100 mg une fois par jour, suivie d'une augmentation de l'hydrochlorothiazide à 25 mg une fois par jour en fonction de la réponse tensionnelle [voir Etudes cliniques ] .
Néphropathie chez les patients diabétiques de type 2
La dose initiale habituelle est de 50 mg une fois par jour. La dose doit être augmentée à 100 mg une fois par jour en fonction de la réponse tensionnelle [voir Etudes cliniques ] .
Modifications posologiques chez les patients atteints d'insuffisance hépatique
Chez les patients atteints d'insuffisance hépatique légère à modérée, la dose initiale recommandée de COZAAR est de 25 mg une fois par jour. COZAAR n'a pas été étudié chez les patients présentant une insuffisance hépatique sévère [voir Utilisation dans des populations spécifiques et PHARMACOLOGIE CLINIQUE ] .
Préparation de suspension (pour 200 mL d'une suspension à 2,5 mg/mL)
Ajouter 10 ml d'eau purifiée USP à une bouteille de polyéthylène téréphtalate (PET) ambré de 8 onces (240 ml) contenant dix comprimés COZAAR de 50 mg. Agiter immédiatement pendant au moins 2 minutes. Laisser reposer le concentré pendant 1 heure puis agiter pendant 1 minute pour disperser le contenu du comprimé. Préparer séparément un mélange volumétrique 50/50 d'Ora-Plus™ et d'Ora-Sweet SF™. Ajouter 190 ml du mélange 50/50 Ora-Plus™/Ora-Sweet SF™ au comprimé et à la bouillie d'eau dans la bouteille en PET et agiter pendant 1 minute pour disperser les ingrédients. La suspension doit être réfrigérée à 2-8°C (36-46°F) et peut être conservée jusqu'à 4 semaines. Agiter la suspension avant chaque utilisation et la remettre rapidement au réfrigérateur.
COMMENT FOURNIE
Formes posologiques et points forts
- COZAAR 100 mg, 25 mg, se présente sous la forme de comprimés pelliculés blancs, ovales et portant le code 951 sur une face.
- COZAAR, 50 mg, se présente sous forme de comprimés pelliculés blancs, ovales, portant le code 952 d'un côté et sécable de l'autre.
- COZAAR 25 mg, 100 mg, sont des comprimés pelliculés blancs en forme de larme avec le code 960 sur une face.
Stockage et manutention
COZAAR est un comprimé pelliculé blanc fourni comme suit :
Conserver à 25 °C (77 °F); les excursions permises à 15-30°C (59-86°F) [voient USP la Température de Pièce Contrôlée]. Conserver le récipient bien fermé. Protéger de la lumière.
Fabriqué pour : Organon LLC, une filiale d'ORGANON & Co., Jersey City, NJ 07302, USA. Révisé : octobre 2021.
EFFETS SECONDAIRES
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux observés dans les essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Hypertension
L'innocuité de COZAAR a été évaluée chez plus de 3 300 patients adultes traités pour une hypertension essentielle et chez 4 058 patients/sujets au total. Plus de 1200 patients ont été traités pendant plus de 6 mois et plus de 800 pendant plus d'un an.
Le traitement par COZAAR 25 mg a été bien toléré avec une incidence globale d'événements indésirables similaire à celle du placebo. Dans les essais cliniques contrôlés, l'arrêt du traitement pour événements indésirables s'est produit chez 2,3 % des patients traités par COZAAR 25 mg et 3,7 % des patients ayant reçu le placebo. Dans 4 essais cliniques portant sur plus de 1 000 patients recevant différentes doses (10 à 150 mg) de losartan potassique et plus de 300 patients ayant reçu un placebo, les événements indésirables survenus chez ≥ 2 % des patients traités par COZAAR 25 mg et plus fréquemment que le placebo étaient les suivants : étourdissements (3 % contre 2 %), les infections des voies respiratoires supérieures (8 % contre 7 %), la congestion nasale (2 % contre 1 %) et les maux de dos (2 % contre 1 %).
Les effets indésirables moins fréquents suivants ont été signalés :
Troubles du système sanguin et lymphatique : Anémie.
Troubles psychiatriques: La dépression.
Troubles du système nerveux : Somnolence, céphalées, troubles du sommeil, paresthésie, migraine.
Troubles de l'oreille et du labyrinthe : Vertiges, acouphènes.
Troubles cardiaques : Palpitations, syncope, fibrillation auriculaire, AVC.
Troubles respiratoires, thoraciques et médiastinaux : Dyspnée.
Problèmes gastro-intestinaux: Douleurs abdominales, constipation, nausées, vomissements.
Affections de la peau et du tissu sous-cutané : Urticaire, prurit, rash, photosensibilité.
Troubles musculo-squelettiques et du tissu conjonctif : Myalgie, arthralgie.
Troubles de l'appareil reproducteur et des seins : Impuissance.
Troubles généraux et anomalies au site d'administration : Œdème.
Toux
Une toux sèche persistante (avec une incidence de quelques pour cent) a été associée à l'utilisation d'inhibiteurs de l'ECA et, dans la pratique, peut être une cause d'arrêt du traitement par inhibiteur de l'ECA. Deux essais prospectifs, à groupes parallèles, à double insu, randomisés et contrôlés ont été menés pour évaluer les effets du losartan sur l'incidence de la toux chez les patients hypertendus qui avaient toussé pendant qu'ils recevaient un traitement par inhibiteur de l'ECA. Les patients qui présentaient une toux typique d'un inhibiteur de l'ECA lors d'une provocation avec du lisinopril, dont la toux a disparu sous placebo, ont été randomisés pour recevoir du losartan 50 mg, du lisinopril 20 mg ou un placebo (une étude, n = 97) ou 25 mg d'hydrochlorothiazide (n = 135). La période de traitement en double aveugle a duré jusqu'à 8 semaines. L'incidence de la toux est indiquée dans le tableau 1 ci-dessous.
Ces études démontrent que l'incidence de la toux associée au traitement par le losartan, dans une population qui avait tous de la toux associée au traitement par inhibiteur de l'ECA, est similaire à celle associée au traitement par l'hydrochlorothiazide ou un placebo.
Des cas de toux, y compris des reprises positives, ont été rapportés avec l'utilisation du losartan depuis la commercialisation.
Patients hypertendus avec hypertrophie ventriculaire gauche
Dans l'étude LIFE (Losartan Intervention for Endpoint), les effets indésirables avec COZAAR 100 mg étaient similaires à ceux rapportés précédemment pour les patients souffrant d'hypertension.
Néphropathie chez les patients diabétiques de type 2
Dans l'étude RENAAL (Reduction of Endpoints in NIDDM with the Angiotensin II Receptor Antagonist Losartan) portant sur 1 513 patients traités par COZAAR 100 mg ou un placebo, l'incidence globale des événements indésirables signalés était similaire dans les deux groupes. Les interruptions de COZAAR en raison d'effets secondaires étaient similaires à celles du placebo (19 % pour COZAAR 100 mg, 24 % pour le placebo). Les événements indésirables, quelle que soit la relation médicamenteuse, signalés avec une incidence ≥ 4 % des patients traités par COZAAR 50 mg et survenant avec une différence ≥ 2 % dans le groupe losartan vs placebo dans le cadre d'un traitement antihypertenseur conventionnel, étaient l'asthénie/fatigue, les douleurs thoraciques , hypotension, hypotension orthostatique, diarrhée, anémie, hyperkaliémie, hypoglycémie, dorsalgie, faiblesse musculaire et infection des voies urinaires.
Expérience post-commercialisation
Les réactions défavorables supplémentaires suivantes ont été annoncées dans l'expérience post-du marketing avec COZAAR. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer leur fréquence de manière fiable ou d'établir une relation causale avec l'exposition au médicament :
Digestif: Hépatite.
Troubles généraux et conditions au site d'administration : Malaise.
Hématologique : Thrombocytopénie.
Hypersensibilité : Un œdème de Quincke, y compris un gonflement du larynx et de la glotte, provoquant une obstruction des voies respiratoires et/ou un gonflement du visage, des lèvres, du pharynx et/ou de la langue, a été rarement rapporté chez des patients traités par losartan ; certains de ces patients ont déjà présenté un œdème de Quincke avec d'autres médicaments, y compris des inhibiteurs de l'ECA. Des vascularites, y compris le purpura de Henoch-Schönlein, ont été rapportées. Des réactions anaphylactiques ont été rapportées.
Métabolisme et nutrition : Hyponatrémie.
Musculo-squelettique : Rhabdomyolyse.
Troubles du système nerveux : Dysgueusie.
Peau: Érythrodermie.
INTERACTIONS MÉDICAMENTEUSES
Agents augmentant le potassium sérique
L'administration concomitante de losartan avec d'autres médicaments qui augmentent les taux sériques de potassium peut entraîner une hyperkaliémie. Surveiller le potassium sérique chez ces patients.
Lithium
Des augmentations des concentrations sériques de lithium et de la toxicité du lithium ont été rapportées lors de l'administration concomitante de lithium avec des antagonistes des récepteurs de l'angiotensine II. Surveiller les taux sériques de lithium lors de l'utilisation concomitante.
Anti-inflammatoires non stéroïdiens (AINS), y compris les inhibiteurs sélectifs de la cyclooxygénase-2 (inhibiteurs de la COX-2)
Chez les patients âgés, hypovolémiques (y compris ceux sous traitement diurétique) ou dont la fonction rénale est altérée, la co-administration d'AINS, y compris les inhibiteurs sélectifs de la COX-2, avec des antagonistes des récepteurs de l'angiotensine II (y compris le losartan) peut entraîner une détérioration de la fonction rénale, y compris une éventuelle insuffisance rénale aiguë. Ces effets sont généralement réversibles. Surveillez périodiquement la fonction rénale chez les patients recevant du losartan et un traitement par AINS.
L'effet antihypertenseur des antagonistes des récepteurs de l'angiotensine II, y compris le losartan, peut être atténué par les AINS, y compris les inhibiteurs sélectifs de la COX-2.
Double blocage du système rénine-angiotensine (RAS)
Le double blocage du SRA avec les antagonistes des récepteurs de l'angiotensine, les inhibiteurs de l'ECA ou l'aliskirène est associé à des risques accrus d'hypotension, de syncope, d'hyperkaliémie et de modifications de la fonction rénale (y compris l'insuffisance rénale aiguë) par rapport à la monothérapie.
L'essai Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) a recruté 1 448 patients atteints de diabète de type 2, présentant un rapport albumine/créatinine urinaire élevé et une diminution du taux de filtration glomérulaire estimé (DFG de 30 à 89,9 mL/min), les a randomisés pour recevoir du lisinopril ou un placebo sur fond de traitement par losartan et les a suivis pendant une durée médiane de 2,2 ans. Les patients recevant l'association de losartan et de lisinopril n'ont obtenu aucun bénéfice supplémentaire par rapport à la monothérapie pour le critère combiné de diminution du DFG, d'insuffisance rénale terminale ou de décès, mais ont présenté une incidence accrue d'hyperkaliémie et d'insuffisance rénale aiguë par rapport au groupe monothérapie.
Chez la plupart des patients, aucun bénéfice n'a été associé à l'utilisation concomitante de deux inhibiteurs du SRA. En général, évitez l'utilisation combinée d'inhibiteurs du RAS. Surveillez étroitement la pression artérielle, la fonction rénale et les électrolytes chez les patients sous COZAAR 100 mg et d'autres agents qui affectent le SRA.
Ne pas co-administrer l'aliskirène avec COZAAR 100 mg chez les patients diabétiques. Éviter l'utilisation d'aliskirène avec COZAAR chez les patients atteints d'insuffisance rénale (DFG
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Toxicité fœtale
COZAAR peut nuire au fœtus lorsqu'il est administré à une femme enceinte. L'utilisation de médicaments qui agissent sur le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales. L'oligohydramnios qui en résulte peut être associé à une hypoplasie pulmonaire fœtale et à des déformations squelettiques. Les effets indésirables néonataux potentiels comprennent l'hypoplasie crânienne, l'anurie, l'hypotension, l'insuffisance rénale et la mort. Lorsqu'une grossesse est détectée, arrêtez COZAAR 100 mg dès que possible [voir Utilisation dans des populations spécifiques ] .
Hypotension chez les patients présentant une déplétion volumique ou sodée
Chez les patients dont le système rénine-angiotensine est activé, tels que les patients présentant une déplétion volémique ou sodée (p. ex., ceux traités par de fortes doses de diurétiques), une hypotension symptomatique peut survenir après le début du traitement par COZAAR. Corriger la déplétion volémique ou sodée avant l'administration de COZAAR [voir DOSAGE ET ADMINISTRATION ] .
Détérioration de la fonction rénale
Des modifications de la fonction rénale, y compris une insuffisance rénale aiguë, peuvent être causées par des médicaments qui inhibent le système rénine-angiotensine et par des diurétiques. Les patients dont la fonction rénale peut dépendre en partie de l'activité du système rénine-angiotensine (par exemple, les patients présentant une sténose de l'artère rénale, une maladie rénale chronique, une insuffisance cardiaque congestive sévère ou une déplétion volémique) peuvent présenter un risque particulier de développer une insuffisance rénale aiguë sous COZAAR. Surveiller périodiquement la fonction rénale chez ces patients. Envisager de suspendre ou d'arrêter le traitement chez les patients qui développent une diminution cliniquement significative de la fonction rénale sous COZAAR [voir INTERACTIONS MÉDICAMENTEUSES et Utilisation dans des populations spécifiques ] .
Hyperkaliémie
Surveiller périodiquement le potassium sérique et traiter de manière appropriée. Une réduction de la posologie ou l'arrêt de COZAAR 25 mg peut être nécessaire [voir EFFETS INDÉSIRABLES ] .
L'utilisation concomitante d'autres médicaments susceptibles d'augmenter la kaliémie peut entraîner une hyperkaliémie [voir INTERACTIONS MÉDICAMENTEUSES ] .
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA (Informations patient).
Grossesse
Informer les patientes en âge de procréer des conséquences d'une exposition à COZAAR 100 mg pendant la grossesse. Discutez des options de traitement avec les femmes qui envisagent de devenir enceintes. Dites aux patientes de signaler les grossesses à leur médecin dès que possible [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ] .
Suppléments de potassium
Conseillez aux patients recevant COZAAR de ne pas utiliser de suppléments de potassium ou de substituts de sel contenant du potassium sans consulter leur professionnel de la santé [voir INTERACTIONS MÉDICAMENTEUSES ] .
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Le losartan potassique n'a pas été cancérigène lorsqu'il a été administré à des doses maximales tolérées à des rats et à des souris pendant 105 et 92 semaines, respectivement. Les rats femelles ayant reçu la dose la plus élevée (270 mg/kg/jour) ont présenté une incidence légèrement plus élevée d'adénome acineux pancréatique. Les doses maximales tolérées (270 mg/kg/jour chez le rat, 200 mg/kg/jour chez la souris) ont fourni des expositions systémiques au losartan et à son métabolite pharmacologiquement actif qui étaient environ 160 et 90 fois (rats) et 30 et 15 fois (souris) l'exposition d'un être humain de 50 kg recevant 100 mg par jour.
Le losartan potassique était négatif dans les tests de mutagenèse microbienne et de mutagenèse sur cellules de mammifères V-79, ainsi que dans les tests d'élution alcaline in vitro et les tests d'aberration chromosomique in vitro et in vivo. De plus, le métabolite actif n'a montré aucun signe de génotoxicité dans les essais de mutagenèse microbienne, d'élution alcaline in vitro et d'aberration chromosomique in vitro.
La fertilité et la performance reproductrice n'ont pas été affectées dans les études avec les rats masculins donnés les doses orales de potassium losartan jusqu'à environ 150 mgs/kg/jours. L'administration de doses toxiques chez les femelles (300/200 mg/kg/jour) a été associée à une diminution significative (p
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
COZAAR peut nuire au fœtus lorsqu'il est administré à une femme enceinte. L'utilisation de médicaments qui agissent sur le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales. La plupart des études épidémiologiques examinant les anomalies fœtales après exposition à l'utilisation d'antihypertenseurs au cours du premier trimestre n'ont pas distingué les médicaments affectant le système rénine-angiotensine des autres agents antihypertenseurs. Lorsqu'une grossesse est détectée, arrêtez COZAAR dès que possible (voir Considérations cliniques ).
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
L'hypertension pendant la grossesse augmente le risque maternel de prééclampsie, de diabète gestationnel, d'accouchement prématuré et de complications à l'accouchement (p. ex., nécessité d'une césarienne, hémorragie post-partum). L'hypertension augmente le risque fœtal de retard de croissance intra-utérin et de mort intra-utérine. Les femmes enceintes souffrant d'hypertension doivent être étroitement surveillées et prises en charge en conséquence.
Effets indésirables fœtaux/néonatals
L'oligohydramnios chez les femmes enceintes qui utilisent des médicaments affectant le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse peut entraîner les éléments suivants : une fonction rénale fœtale réduite entraînant une anurie et une insuffisance rénale, une hypoplasie pulmonaire fœtale, des déformations du squelette, y compris une hypoplasie crânienne, une hypotension , et la mort. Dans le cas inhabituel où il n'y a pas d'alternative appropriée à la thérapie avec des médicaments affectant le système rénine-angiotensine pour un patient particulier, informez la mère du risque potentiel pour le fœtus.
Chez les patientes prenant COZAAR pendant la grossesse, effectuez des examens échographiques en série pour évaluer l'environnement intra-amniotique. Des tests fœtaux peuvent être appropriés, en fonction de la semaine de gestation. Si un oligohydramnios est observé, arrêtez COZAAR 50 mg, sauf si cela est considéré comme salvateur pour la mère. Les patients et les médecins doivent cependant être conscients que l'oligohydramnios peut n'apparaître qu'après que le fœtus a subi une lésion irréversible.
Observer étroitement les nouveau-nés ayant des antécédents d'exposition in utero au COZAAR pour l'hypotension, l'oligurie et l'hyperkaliémie. Chez les nouveau-nés ayant des antécédents d'exposition in utero au COZAAR 100 mg, en cas d'oligurie ou d'hypotension, maintenez la tension artérielle et la perfusion rénale. Des exsanguinotransfusions ou une dialyse peuvent être nécessaires pour inverser l'hypotension et remplacer la fonction rénale.
Données
Données animales
Le losartan potassique a été administré par voie orale à des rats pendant la période de la fin de la gestation jusqu'à la lactation (du 15e jour de la gestation au 20e jour de la lactation) à des doses de 10, 25 et 100 mg/kg/jour. Il a été démontré que le losartan potassique produit des effets indésirables chez les fœtus et les nouveau-nés de rats, notamment une diminution du poids corporel, un retard du développement physique et comportemental, une mortalité et une toxicité rénale. À l'exception du gain de poids néonatal (qui a été affecté à des doses aussi faibles que 10 mg/kg/jour), les doses associées à ces effets ont dépassé 25 mg/kg/jour (environ trois fois la dose humaine maximale recommandée de 100 mg sur un mg /m base). Ces résultats sont attribués à l'exposition au médicament en fin de gestation et pendant l'allaitement. On a montré que des niveaux significatifs de losartan et de son métabolite actif étaient présents dans le plasma foetal de rat pendant la fin de gestation et dans le lait de rat.
Lactation
Résumé des risques
On ne sait pas si le losartan est excrété dans le lait maternel, mais des niveaux significatifs de losartan et de son métabolite actif se sont avérés présents dans le lait de rat. En raison du potentiel d'effets indésirables sur le nourrisson, une décision doit être prise soit d'arrêter l'allaitement soit d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère.
Utilisation pédiatrique
Les effets antihypertenseurs de COZAAR ont été établis chez des patients pédiatriques hypertendus âgés de 6 à 16 ans. L'innocuité et l'efficacité n'ont pas été établies chez les patients pédiatriques de moins de 6 ans ou chez les patients pédiatriques avec un débit de filtration glomérulaire DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE et Etudes cliniques ] .
Utilisation gériatrique
Du nombre total de patients recevant COZAAR 25mg dans les études cliniques contrôlées pour l'hypertension, 391 patients (19 %) avaient 65 ans et plus, tandis que 37 patients (2 %) avaient 75 ans et plus. Dans une étude clinique contrôlée pour la protection rénale chez des patients diabétiques de type 2 atteints de protéinurie, 248 patients (33 %) étaient âgés de 65 ans et plus. Dans une étude clinique contrôlée sur la réduction du risque combiné de décès cardiovasculaire, d'accident vasculaire cérébral et d'infarctus du myocarde chez les patients hypertendus présentant une hypertrophie ventriculaire gauche, 2857 patients (62 %) étaient âgés de 65 ans et plus, tandis que 808 patients (18 %) avaient 75 ans et plus. . Aucune différence globale d'efficacité ou de sécurité n'a été observée entre ces patients et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue.
Course
Dans l'étude LIFE, les patients noirs souffrant d'hypertension et d'hypertrophie ventriculaire gauche traités par l'aténolol présentaient un risque plus faible de présenter le critère d'évaluation composite principal par rapport aux patients noirs traités par COZAAR (tous deux cotraités par l'hydrochlorothiazide chez la majorité des patients). Le critère d'évaluation principal était la première occurrence d'un AVC, d'un infarctus du myocarde ou d'un décès d'origine cardiovasculaire, analysée selon une approche en intention de traiter (ITT). Dans le sous-groupe de patients noirs (n = 533, 6 % des patients de l'étude LIFE), il y avait 29 critères principaux parmi 263 patients sous aténolol (11 %, 26 pour 1 000 années-patients) et 46 critères principaux parmi 270 patients (17 % , 42 pour 1 000 années-patients) sous COZAAR. Ce résultat n'a pas pu être expliqué sur la base de différences dans les populations autres que la race ou de tout déséquilibre entre les groupes de traitement. De plus, les réductions de la pression artérielle dans les deux groupes de traitement étaient cohérentes entre les patients noirs et non noirs. Étant donné la difficulté d'interpréter les différences de sous-ensembles dans les grands essais, on ne peut pas savoir si la différence observée est le résultat du hasard. Cependant, l'étude LIFE ne fournit aucune preuve que les avantages de COZAAR 100 mg sur la réduction du risque d'événements cardiovasculaires chez les patients hypertendus présentant une hypertrophie ventriculaire gauche s'appliquent aux patients noirs [voir Etudes cliniques ] .
Insuffisance rénale
Les patients insuffisants rénaux ont des concentrations plasmatiques élevées de losartan et de son métabolite actif par rapport aux sujets ayant une fonction rénale normale. Aucun ajustement posologique n'est nécessaire chez les patients insuffisants rénaux, à moins qu'un patient insuffisant rénal ne présente également une déplétion volémique [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ] .
Insuffisance hépatique
La dose initiale recommandée de COZAAR est de 25 mg chez les patients présentant une insuffisance hépatique légère à modérée. Après administration orale chez des patients atteints d'insuffisance hépatique légère à modérée, les concentrations plasmatiques de losartan et de son métabolite actif étaient respectivement 5 fois et 1,7 fois celles observées chez des volontaires sains. COZAAR n'a pas été étudié chez les patients atteints d'insuffisance hépatique sévère [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ] .
SURDOSAGE
Une létalité significative a été observée chez les souris et les rats après administration orale de 1 000 mg/kg et 2 000 mg/kg, respectivement, soit environ 44 et 170 fois la dose humaine maximale recommandée sur une base en mg/m2.
Des données limitées sont disponibles concernant le surdosage chez l'homme. La manifestation la plus probable d'un surdosage serait l'hypotension et la tachycardie; la bradycardie pourrait survenir à la suite d'une stimulation parasympathique (vagale). En cas d'hypotension symptomatique, un traitement de soutien doit être institué.
Ni le losartan ni son métabolite actif ne peuvent être éliminés par hémodialyse.
CONTRE-INDICATIONS
COZAAR 50mg est contre-indiqué :
- Chez les patients hypersensibles à l'un des composants de ce produit.
- Pour co-administration avec l'aliskirène chez les patients diabétiques.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
L'angiotensine II [formée à partir de l'angiotensine I lors d'une réaction catalysée par l'enzyme de conversion de l'angiotensine (ACE, kininase II)] est un puissant vasoconstricteur, la principale hormone vasoactive du système rénine-angiotensine et un composant important de la physiopathologie de l'hypertension. Il stimule également la sécrétion d'aldostérone par le cortex surrénalien. Le losartan et son principal métabolite actif bloquent les effets vasoconstricteurs et sécréteurs d'aldostérone de l'angiotensine II en bloquant sélectivement la liaison de l'angiotensine II au récepteur AT1 présent dans de nombreux tissus (p. ex., muscle lisse vasculaire, glande surrénale). Il existe également un récepteur AT1 présent dans de nombreux tissus, mais on ne sait pas qu'il soit associé à l'homéostasie cardiovasculaire. Ni le losartan ni son principal métabolite actif ne présentent d'activité agoniste partielle au niveau du récepteur AT1, et tous deux ont une affinité beaucoup plus grande (environ 1000 fois) pour le récepteur AT1 que pour le récepteur AT1. Des études de liaison in vitro indiquent que le losartan est un inhibiteur compétitif réversible du récepteur AT1. Le métabolite actif est 10 à 40 fois plus puissant en poids que le losartan et semble être un inhibiteur réversible et non compétitif du récepteur AT1.
Ni le losartan ni son métabolite actif n'inhibent l'ECA (kininase II, l'enzyme qui convertit l'angiotensine I en angiotensine II et dégrade la bradykinine), ni ne se lient ou ne bloquent d'autres récepteurs hormonaux ou canaux ioniques connus pour être importants dans la régulation cardiovasculaire.
Pharmacodynamie
Le losartan inhibe l'effet vasopresseur des perfusions d'angiotensine II (ainsi que d'angiotensine I). Une dose de 100 mg inhibe l'effet presseur d'environ 85 % au maximum avec une inhibition de 25 à 40 % persistant pendant 24 heures. L'élimination de la rétroaction négative de l'angiotensine II provoque un doublement voire un triplement de l'activité de la rénine plasmatique et une augmentation consécutive de la concentration plasmatique de l'angiotensine II chez les patients hypertendus. Le losartan n'affecte pas la réponse à la bradykinine, alors que les inhibiteurs de l'ECA augmentent la réponse à la bradykinine. Les concentrations plasmatiques d'aldostérone chutent après l'administration de losartan. Malgré l'effet du losartan sur la sécrétion d'aldostérone, très peu d'effet sur le potassium sérique a été observé.
L'effet du losartan est sensiblement présent en une semaine, mais dans certaines études, l'effet maximal s'est produit en 3 à 6 semaines. Dans les études de suivi à long terme (sans contrôle placebo), l'effet du losartan a semblé se maintenir jusqu'à un an. Il n'y a pas d'effet rebond apparent après l'arrêt brutal du losartan. Il n'y avait essentiellement aucun changement dans la fréquence cardiaque moyenne chez les patients traités par le losartan dans les essais contrôlés.
Pharmacocinétique
Absorption
Après administration orale, le losartan est bien absorbé et subit un important métabolisme de premier passage. La biodisponibilité systémique du losartan est d'environ 33 %. Les concentrations maximales moyennes de losartan et de son métabolite actif sont atteintes en 1 heure et en 3-4 heures, respectivement. Tandis que les concentrations plasmatiques maximales de losartan et de son métabolite actif sont approximativement égales, l'ASC (aire sous la courbe) du métabolite est environ 4 fois supérieure à celle du losartan. Un repas ralentit l'absorption du losartan et diminue sa Cmax mais n'a que des effets mineurs sur l'ASC du losartan ou sur l'ASC du métabolite (diminution d'environ 10 %). La pharmacocinétique du losartan et de son métabolite actif est linéaire avec des doses orales de losartan allant jusqu'à 200 mg et ne change pas avec le temps.
Distribution
Le volume de distribution du losartan et du métabolite actif est d'environ 34 litres et 12 litres, respectivement. Le losartan et son métabolite actif sont fortement liés aux protéines plasmatiques, principalement l'albumine, avec des fractions plasmatiques libres de 1,3 % et 0,2 %, respectivement. La liaison aux protéines plasmatiques est constante sur la plage de concentration obtenue avec les doses recommandées. Des études chez le rat indiquent que le losartan traverse mal, voire pas du tout, la barrière hémato-encéphalique.
Métabolisme
Le losartan est un agent actif par voie orale qui subit un important métabolisme de premier passage par les enzymes du cytochrome P450. Il est converti, en partie, en un métabolite acide carboxylique actif qui est responsable de la majeure partie de l'antagonisme des récepteurs de l'angiotensine II qui suit le traitement par le losartan. Environ 14 % d'une dose de losartan administrée par voie orale sont convertis en métabolite actif. En plus du métabolite acide carboxylique actif, plusieurs métabolites inactifs sont formés. Des études in vitro indiquent que les cytochromes P450 2C9 et 3A4 sont impliqués dans la biotransformation du losartan en ses métabolites.
Élimination
La clairance plasmatique totale du losartan et du métabolite actif est d'environ 600 ml/min et 50 ml/min, respectivement, avec une clairance rénale d'environ 75 ml/min et 25 ml/min, respectivement. La demi-vie terminale du losartan est d'environ 2 heures et celle du métabolite est d'environ 6 à 9 heures. Après des doses uniques de losartan administrées par voie orale, environ 4 % de la dose sont excrétés sous forme inchangée dans les urines et environ 6 % sont excrétés dans les urines sous forme de métabolite actif. L'excrétion biliaire contribue à l'élimination du losartan et de ses métabolites. Après administration orale de losartan marqué au 14C, environ 35 % de la radioactivité est récupérée dans les urines et environ 60 % dans les fèces. Après une dose intraveineuse de losartan marqué au 14C, environ 45 % de la radioactivité est récupérée dans l'urine et 50 % dans les fèces. Ni le losartan ni son métabolite ne s'accumulent dans le plasma lors d'administrations répétées une fois par jour.
Populations spécifiques
Pédiatrique
Les paramètres pharmacocinétiques après plusieurs doses de losartan (dose moyenne 0,7 mg/kg, intervalle de 0,36 à 0,97 mg/kg) sous forme de comprimé chez 25 patients hypertendus âgés de 6 à 16 ans sont présentés dans le tableau 4 ci-dessous. La pharmacocinétique du losartan et de son métabolite actif était généralement similaire dans les groupes d'âge étudiés et similaire aux données pharmacocinétiques historiques chez les adultes. Les principaux paramètres pharmacocinétiques chez l'adulte et l'enfant sont présentés dans le tableau ci-dessous.
La biodisponibilité de la formulation en suspension a été comparée à celle des comprimés de losartan chez des adultes sains. La suspension et le comprimé sont similaires dans leur biodisponibilité en ce qui concerne à la fois le losartan et le métabolite actif [voir DOSAGE ET ADMINISTRATION ] .
Gériatrie et genre
La pharmacocinétique du losartan a été étudiée chez les personnes âgées (65-75 ans) et chez les deux sexes. Les concentrations plasmatiques du losartan et de son métabolite actif sont similaires chez les hypertendus âgés et jeunes. Les concentrations plasmatiques de losartan étaient environ deux fois plus élevées chez les femmes hypertendues que chez les hommes hypertendus, mais les concentrations du métabolite actif étaient similaires chez les hommes et les femmes. Aucun ajustement posologique n'est nécessaire [voir DOSAGE ET ADMINISTRATION ] .
Course
Les différences pharmacocinétiques dues à la race n'ont pas été étudiées [voir Utilisation dans des populations spécifiques ] .
Insuffisance rénale
Après administration orale, les concentrations plasmatiques et les ASC du losartan et de son métabolite actif sont augmentées de 50 à 90 % chez les patients présentant une insuffisance rénale légère (clairance de la créatinine de 50 à 74 ml/min) ou modérée (clairance de la créatinine de 30 à 49 ml/min). . Dans cette étude, la clairance rénale a été réduite de 55 à 85 % pour le losartan et son métabolite actif chez les patients présentant une insuffisance rénale légère ou modérée. Ni le losartan ni son métabolite actif ne peuvent être éliminés par hémodialyse [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ] .
Insuffisance hépatique
Après administration orale chez des patients atteints de cirrhose alcoolique légère à modérée du foie, les concentrations plasmatiques de losartan et de son métabolite actif étaient, respectivement, 5 fois et environ 1,7 fois celles des jeunes volontaires masculins. Par rapport aux sujets normaux, la clairance plasmatique totale du losartan chez les patients hospitalisés atteints d'insuffisance hépatique était inférieure d'environ 50 % et la biodisponibilité orale était environ doublée. Utiliser une dose initiale de 25 mg pour les patients présentant une insuffisance hépatique légère à modérée. COZAAR 50 mg n'a pas été étudié chez les patients présentant une insuffisance hépatique sévère [voir DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ] .
Interactions médicamenteuses
Aucune interaction médicamenteuse cliniquement significative n'a été trouvée dans les études sur le losartan potassique avec l'hydrochlorothiazide, la digoxine, la warfarine, la cimétidine et le phénobarbital. Le fluconazole, un inhibiteur du cytochrome P450 2C9, a diminué l'ASC du métabolite actif d'environ 40 %, mais a augmenté l'ASC du losartan d'environ 70 % après plusieurs doses. La conversion du losartan en son métabolite actif après administration intraveineuse n'est pas affectée par le kétoconazole, un inhibiteur de P450 3A4. L'ASC du métabolite actif après administration orale de losartan n'a pas été affectée par l'érythromycine, un inhibiteur de P450 3A4, mais l'ASC du losartan a été augmentée de 30 %.
Les conséquences pharmacodynamiques de l'utilisation concomitante de losartan et d'inhibiteurs de P450 2C9 n'ont pas été étudiées. Il a été démontré que les sujets qui ne métabolisent pas le losartan en métabolite actif présentent un défaut spécifique et rare du cytochrome P450 2C9. Ces données suggèrent que la conversion du losartan en son métabolite actif est médiée principalement par le P450 2C9 et non par le P450 3A4.
Etudes cliniques
Hypertension
Hypertension adulte
Les effets antihypertenseurs de COZAAR 25 mg ont été démontrés principalement dans 4 essais contrôlés par placebo de 6 à 12 semaines portant sur des doses de 10 à 150 mg par jour chez des patients présentant une tension artérielle diastolique initiale de 95 à 115. Les études ont permis des comparaisons de deux doses (50-100 mg/jour) sous forme de schémas thérapeutiques une fois par jour ou deux fois par jour, des comparaisons des effets de pic et de creux et des comparaisons de réponse selon le sexe, l'âge et la race. Trois études supplémentaires ont examiné les effets antihypertenseurs du losartan et de l'hydrochlorothiazide en association.
Les 4 études de losartan en monothérapie ont inclus un total de 1075 patients randomisés pour recevoir plusieurs doses de losartan et 334 pour le placebo. Les doses de 10 et 25 mg ont produit un certain effet au pic (6 heures après l'administration), mais des réponses minimales et incohérentes (24 heures). Des doses de 50, 100 et 150 mg une fois par jour ont donné des diminutions moyennes systoliques/diastoliques statistiquement significatives de la pression artérielle, par rapport au placebo dans la plage de 5,5-10,5/3,5-7,5 mmHg, la dose de 150 mg ne donnant pas d'effet supérieur à 50- 100 mg. L'administration biquotidienne de 50 à 100 mg/jour a donné des réponses minimales systématiquement plus importantes que l'administration uniquotidienne à la même dose totale. Les effets maximaux (6 heures) étaient uniformément, mais modérément, plus importants que les effets creux, avec le rapport creux/pic pour les réponses systolique et diastolique de 50 à 95 % et de 60 à 90 %, respectivement.
L'ajout d'une faible dose d'hydrochlorothiazide (12,5 mg) au losartan 50 mg une fois par jour a entraîné une réduction de la pression artérielle ajustée au placebo de 15,5/9,2 mmHg.
L'analyse des sous-groupes d'âge, de sexe et de race des patients a montré que les hommes et les femmes, ainsi que les patients de plus et de moins de 65 ans, avaient des réponses généralement similaires. COZAAR 25 mg a été efficace pour réduire la tension artérielle quelle que soit la race, bien que l'effet ait été un peu moindre chez les patients noirs (généralement une population à faible rénine).
Hypertension pédiatrique
L'effet antihypertenseur du losartan a été étudié dans un essai portant sur 177 patients pédiatriques hypertendus âgés de 6 à 16 ans. Les enfants qui pesaient DOSAGE ET ADMINISTRATION . La majorité des enfants souffraient d'hypertension associée à une maladie rénale et urogénitale. La pression artérielle diastolique en position assise (SiDBP) à l'entrée dans l'étude était supérieure au 95e centile pour l'âge, le sexe et la taille du patient. Au bout de trois semaines, le losartan a réduit la pression artérielle systolique et diastolique, mesurée au creux, de manière dose-dépendante. Globalement, les deux doses les plus élevées (25 à 50 mg chez les patients
Patients hypertendus avec hypertrophie ventriculaire gauche
L'étude LIFE était une étude multinationale en double aveugle comparant COZAAR 50 mg et l'aténolol chez 9193 patients hypertendus présentant une hypertrophie ventriculaire gauche documentée par ECG. Les patients ayant subi un infarctus du myocarde ou un accident vasculaire cérébral dans les six mois précédant la randomisation ont été exclus. Les patients ont été randomisés pour recevoir une fois par jour COZAAR 50 mg ou aténolol 50 mg. Si la tension artérielle cible (
Parmi les patients randomisés, 4 963 (54 %) étaient des femmes et 533 (6 %) étaient des Noirs. L'âge moyen était de 67 ans avec 5704 (62 %) âge ≥ 65 ans. Au départ, 1 195 (13 %) étaient diabétiques, 1 326 (14 %) avaient une hypertension systolique isolée, 1 469 (16 %) avaient une maladie coronarienne et 728 (8 %) avaient une maladie cérébrovasculaire. La pression artérielle moyenne initiale était de 174/98 mmHg dans les deux groupes de traitement. La durée moyenne de suivi était de 4,8 ans. À la fin de l'étude ou lors de la dernière visite avant un critère d'évaluation principal, 77 % du groupe traité par COZAAR 50 mg et 73 % du groupe traité par l'aténolol prenaient toujours le médicament à l'étude. Parmi les patients qui prenaient encore le médicament à l'étude, les doses moyennes de COZAAR et d'aténolol étaient toutes les deux d'environ 80 mg/jour, et 15 % prenaient de l'aténolol ou du losartan en monothérapie, tandis que 77 % recevaient également de l'hydrochlorothiazide (à une dose moyenne de 20 mg/jour chez chaque groupe). La réduction de la pression artérielle mesurée au creux était similaire pour les deux groupes de traitement, mais la pression artérielle n'a été mesurée à aucun autre moment de la journée. A la fin de l'étude ou lors de la dernière visite avant un critère principal, les pressions artérielles moyennes étaient de 144,1/81,3 mmHg pour le groupe traité par COZAAR et de 145,4/80,9 mmHg pour le groupe traité par aténolol ; la différence de pression artérielle systolique (PAS) de 1,3 mmHg était significative (p
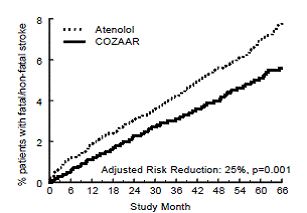
Le critère d'évaluation principal était la première occurrence d'un décès cardiovasculaire, d'un accident vasculaire cérébral non mortel ou d'un infarctus du myocarde non mortel. Les patients présentant des événements non mortels sont restés dans l'essai, de sorte qu'il y avait également un examen du premier événement de chaque type même s'il ne s'agissait pas du premier événement (par exemple, un AVC faisant suite à un infarctus du myocarde initial serait compté dans l'analyse de l'AVC). Le traitement par COZAAR 50 mg a entraîné une réduction de 13 % (p = 0,021) du risque du critère d'évaluation principal par rapport au groupe aténolol (voir Figure 1 et Tableau 3 ) ; cette différence était principalement le résultat d'un effet sur les accidents vasculaires cérébraux mortels et non mortels. Le traitement par COZAAR a réduit le risque d'AVC de 25 % par rapport à l'aténolol (p = 0,001) (voir Figure 2 et Tableau 3).
Figure 1 : Estimations de Kaplan-Meier du critère d'évaluation principal du délai avant décès cardiovasculaire, accident vasculaire cérébral non mortel ou infarctus du myocarde non mortel dans les groupes traités par COZAAR 100 mg et aténolol. La réduction du risque est ajustée en fonction du score de risque de base de Framingham et du niveau d'hypertrophie ventriculaire gauche électrocardiographique
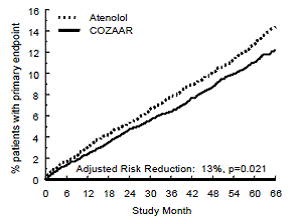
Figure 2 : Estimations de Kaplan-Meier du délai avant AVC mortel/non mortel dans les groupes traités par COZAAR 50 mg et aténolol. La réduction du risque est ajustée en fonction du score de risque initial de Framingham et du niveau d'hypertrophie ventriculaire gauche électrocardiographique
Le tableau 3 montre les résultats pour le critère d'évaluation composite principal et les critères d'évaluation individuels. Le critère d'évaluation principal était la première occurrence d'AVC, d'infarctus du myocarde ou de décès cardiovasculaire, analysée selon une approche ITT. Le tableau indique le nombre d'événements pour chaque composant de deux manières différentes. Les composants du critère principal (en tant que premier événement) ne comptent que les événements qui définissent le critère principal, tandis que les critères secondaires comptent tous les premiers événements d'un type particulier, qu'ils aient été précédés ou non d'un type d'événement différent.
Bien que l'étude LIFE ait favorisé COZAAR par rapport à l'aténolol en ce qui concerne le critère d'évaluation principal (p = 0,021), ce résultat provient d'une seule étude et, par conséquent, est moins convaincant que la différence entre COZAAR et le placebo. Bien qu'elle ne soit pas mesurée directement, la différence entre COZAAR et le placebo est convaincante car il existe des preuves que l'aténolol est lui-même efficace (par rapport au placebo) pour réduire les événements cardiovasculaires, y compris les accidents vasculaires cérébraux, chez les patients hypertendus.
Les autres critères d'évaluation cliniques de l'étude LIFE étaient les suivants : mortalité totale, hospitalisation pour insuffisance cardiaque ou angine de poitrine, procédures de revascularisation coronarienne ou périphérique et arrêt cardiaque réanimé. Il n'y avait aucune différence significative dans les taux de ces critères d'évaluation entre les groupes COZAAR et aténolol.
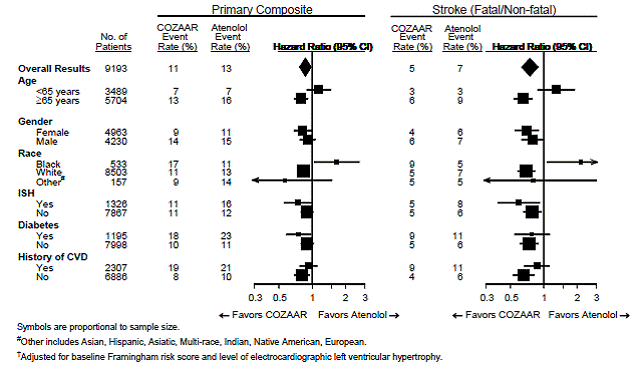
Pour le critère d'évaluation principal et l'AVC, les effets de COZAAR 25 mg dans des sous-groupes de patients définis par l'âge, le sexe, la race et la présence ou l'absence d'hypertension systolique isolée (ISH), de diabète et d'antécédents de maladie cardiovasculaire (MCV) sont présentés dans la figure 3 ci-dessous . Les analyses de sous-groupes peuvent être difficiles à interpréter et on ne sait pas si elles représentent de vraies différences ou des effets de hasard.
Figure 3 : Principaux événements liés au critère d'évaluation† au sein des sous-groupes démographiques
Néphropathie chez les patients diabétiques de type 2
L'étude RENAAL était une étude randomisée, contrôlée par placebo, en double aveugle et multicentrique menée dans le monde entier chez 1513 patients atteints de diabète de type 2 avec néphropathie (définie comme une créatinine sérique de 1,3 à 3,0 mg/dL chez les femmes ou les hommes ≤ 60 kg et 1,5 à 3,0 mg /dL chez les hommes > 60 kg et protéinurie [rapport albumine/créatinine urinaire ≥ 300 mg/g]).
Les patients ont été randomisés pour recevoir COZAAR 50 mg une fois par jour ou un placebo dans le cadre d'un traitement antihypertenseur conventionnel excluant les inhibiteurs de l'ECA et les antagonistes de l'angiotensine II. Après un mois, les investigateurs ont reçu pour instruction de titrer le médicament à l'étude à 100 mg une fois par jour si l'objectif de tension artérielle minimale (140/90 mmHg) n'était pas atteint. Dans l'ensemble, 72 % des patients ont reçu la dose quotidienne de 100 mg plus de 50 % du temps pendant lequel ils prenaient le médicament à l'étude. Étant donné que l'étude a été conçue pour obtenir un contrôle égal de la pression artérielle dans les deux groupes, d'autres agents antihypertenseurs (diurétiques, inhibiteurs calciques, alpha ou bêta-bloquants et agents à action centrale) pourraient être ajoutés au besoin dans les deux groupes. Les patients ont été suivis pendant une durée moyenne de 3,4 ans.
La population étudiée était diversifiée en termes de race (Asiatiques 16,7 %, Noirs 15,2 %, Hispaniques 18,3 %, Blancs 48,6 %). Au total, 63,2 % des patients étaient des hommes et 66,4 % avaient moins de 65 ans. Presque tous les patients (96,6 %) avaient des antécédents d'hypertension, et les patients sont entrés dans l'essai avec une créatinine sérique moyenne de 1,9 mg/dL et une protéinurie moyenne (albumine/créatinine urinaire) de 1 808 mg/g au départ.
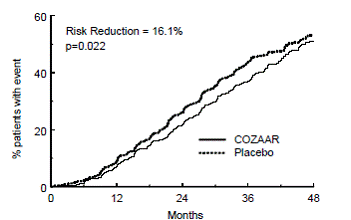
Le critère d'évaluation principal de l'étude était le délai avant la première apparition de l'un des événements suivants : doublement de la créatinine sérique, insuffisance rénale terminale (IRT) (nécessité d'une dialyse ou d'une transplantation) ou décès. Le traitement par COZAAR a entraîné une réduction du risque de 16 % pour ce paramètre (voir la figure 4 et le tableau 4). Le traitement avec COZAAR a également réduit la survenue d'un doublement soutenu de la créatinine sérique de 25 % et de l'IRT de 29 % en tant que critères d'évaluation distincts, mais n'a eu aucun effet sur la mortalité globale (voir tableau 4).
Les pressions sanguines initiales moyennes étaient de 152/82 mmHg pour COZAAR plus un traitement antihypertenseur conventionnel et de 153/82 mmHg pour le placebo plus un traitement antihypertenseur conventionnel. A la fin de l'étude, les pressions artérielles moyennes étaient de 143/76 mmHg pour le groupe traité par COZAAR 100mg et de 146/77 mmHg pour le groupe traité par placebo.
Figure 4 : Courbe de Kaplan-Meier pour le critère principal composite de doublement de la créatinine sérique, d'insuffisance rénale terminale (nécessité d'une dialyse ou d'une transplantation) ou du décès
Les critères d'évaluation secondaires de l'étude étaient la modification de la protéinurie, la modification du taux de progression de la maladie rénale et le composite de la morbidité et de la mortalité par causes cardiovasculaires (hospitalisation pour insuffisance cardiaque, infarctus du myocarde, revascularisation, accident vasculaire cérébral, hospitalisation pour angor instable ou maladie cardiovasculaire). Comparativement au placebo, COZAAR a significativement réduit la protéinurie de 34 % en moyenne, un effet qui s'est manifesté dans les 3 mois suivant le début du traitement, et a considérablement réduit le taux de déclin du taux de filtration glomérulaire au cours de l'étude de 13 %, tel que mesuré par l'inverse de la concentration de créatinine sérique. Il n'y avait pas de différence significative dans l'incidence du critère composite de morbi-mortalité cardiovasculaire.
Les effets favorables de COZAAR ont été observés chez des patients prenant également d'autres médicaments antihypertenseurs (les antagonistes des récepteurs de l'angiotensine II et les inhibiteurs de l'enzyme de conversion de l'angiotensine n'étaient pas autorisés), des hypoglycémiants oraux et des hypolipémiants.
Pour le critère principal et l'IRT, les effets de COZAAR dans des sous-groupes de patients définis par l'âge, le sexe et la race sont présentés dans le tableau 5 ci-dessous. Les analyses de sous-groupes peuvent être difficiles à interpréter et on ne sait pas s'il s'agit de véritables différences ou d'effets aléatoires.
INFORMATIONS PATIENTS
COZAAR® (CO-zar) (comprimés de losartan potassique) 25 mg, 50 mg, 100 mg
Lisez les informations destinées aux patients fournies avec COZAAR avant de commencer à le prendre et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Cette notice ne remplace pas une discussion avec votre médecin au sujet de votre état et de votre traitement.
Quelle est l'information la plus importante que je devrais connaître sur COZAAR ?
- COZAAR peut causer des dommages ou la mort d'un bébé à naître.
- Discutez avec votre médecin d'autres moyens d'abaisser votre tension artérielle si vous envisagez de devenir enceinte.
- Si vous tombez enceinte pendant que vous prenez COZAAR, informez-en immédiatement votre médecin.
Qu'est-ce que COZAAR 100mg ?
COZAAR 100 mg est un médicament délivré sur ordonnance appelé antagoniste des récepteurs de l'angiotensine (ARA). C'est utilisé:
- seul ou avec d'autres médicaments contre l'hypertension pour abaisser la pression artérielle (hypertension).
- pour réduire le risque d'accident vasculaire cérébral chez les patients souffrant d'hypertension artérielle et d'un problème cardiaque appelé hypertrophie ventriculaire gauche. COZAAR peut ne pas aider les patients noirs avec ce problème.
- pour ralentir l'aggravation de la néphropathie diabétique (néphropathie) chez les patients atteints de diabète de type 2 qui souffrent ou ont souffert d'hypertension artérielle.
COZAAR 25 mg n'a pas été étudié chez les enfants de moins de 6 ans ou chez les enfants souffrant de certains problèmes rénaux.
Hypertension artérielle (hypertension) La tension artérielle est la force dans vos vaisseaux sanguins lorsque votre cœur bat et lorsque votre cœur se repose. Vous souffrez d'hypertension lorsque la force est trop forte. COZAAR 25 mg peut aider vos vaisseaux sanguins à se détendre afin que votre tension artérielle soit plus basse.
Hypertrophie ventriculaire gauche (HVG) est un agrandissement des parois de la chambre gauche du cœur (chambre de pompage principale du cœur). L'HVG peut se produire à partir de plusieurs choses. L'hypertension artérielle est la cause la plus fréquente d'HVG.
Diabète de type 2 avec néphropathie . Le diabète de type 2 est un type de diabète qui survient principalement chez les adultes. Si vous souffrez de néphropathie diabétique, cela signifie que vos reins ne fonctionnent pas correctement à cause des dommages causés par le diabète.
Qui ne devrait pas prendre COZAAR 100mg ?
- Ne prenez pas COZAAR 25 mg si vous êtes allergique à l'un des ingrédients de COZAAR . Voir la fin de cette notice pour une liste complète des ingrédients de COZAAR.
- Ne prenez pas COZAAR si vous êtes diabétique et que vous prenez un médicament appelé aliskirène pour réduire la tension artérielle.
Que dois-je dire à mon médecin avant de prendre COZAAR 50 mg ?
Informez votre médecin de toutes vos conditions médicales, y compris si vous :
- êtes enceinte ou planifiez une grossesse. Voir " Quelle est l'information la plus importante que je devrais connaître sur COZAAR 25mg ? "
- allaitent . On ne sait pas si COZAAR 50 mg passe dans votre lait maternel. Vous devez choisir soit de prendre COZAAR 50 mg, soit d'allaiter, mais pas les deux.
- vomissez beaucoup ou avez beaucoup de diarrhée
- avoir des problèmes de foie
- avoir des problèmes rénaux
Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. COZAAR et certains autres médicaments peuvent interagir les uns avec les autres. Dites surtout à votre médecin si vous prenez :
- suppléments de potassium
- substituts de sel contenant du potassium
- autres médicaments susceptibles d'augmenter la kaliémie
- pilules d'eau (diurétiques)
- lithium (un médicament utilisé pour traiter un certain type de dépression)
- médicaments utilisés pour traiter la douleur et l'arthrite, appelés anti-inflammatoires non stéroïdiens (AINS), y compris les inhibiteurs de la COX-2
- autres médicaments pour réduire la tension artérielle
Comment dois-je prendre COZAAR 25mg ?
- Prenez COZAAR 100mg exactement comme prescrit par votre médecin. Votre médecin peut modifier votre dose si nécessaire.
- COZAAR 50 mg peut être pris avec ou sans nourriture.
- Si vous oubliez une dose, prenez-la dès que vous vous en souvenez. S'il est proche de votre prochaine dose, ne prenez pas la dose oubliée. Prenez simplement la dose suivante à l'heure habituelle.
- Si vous avez pris trop de COZAAR, appelez votre médecin ou le centre antipoison, ou rendez-vous immédiatement aux urgences de l'hôpital le plus proche.
Quels sont les effets secondaires possibles de COZAAR ?
COZAAR 25mg peut provoquer les effets secondaires suivants qui peuvent être graves :
- Blessure ou décès de bébés à naître. Voir " Quelles sont les informations les plus importantes que je devrais connaître sur COZAAR ? "
- Réaction allergique Les symptômes d'une réaction allergique sont un gonflement du visage, des lèvres, de la gorge ou de la langue. Obtenez immédiatement une aide médicale d'urgence et arrêtez de prendre COZAAR.
- Pression artérielle basse (hypotension) . Une pression artérielle basse peut provoquer des évanouissements ou des étourdissements. Allongez-vous si vous vous sentez faible ou étourdi. Appelez immédiatement votre médecin.
- Pour les personnes qui ont déjà des problèmes rénaux, vous pouvez constater une aggravation du fonctionnement de vos reins. Appelez votre médecin si vous avez un gonflement des pieds, des chevilles ou des mains, ou une prise de poids inexpliquée.
- Niveaux élevés de potassium dans le sang
Les effets secondaires les plus courants de COZAAR 50 mg chez les personnes souffrant d'hypertension artérielle sont :
- « rhume » (infection des voies respiratoires supérieures)
- vertiges
- nez encombré
- mal au dos
Les effets secondaires les plus courants de COZAAR 50 mg chez les personnes atteintes de diabète de type 2 avec une maladie rénale diabétique sont :
- diarrhée
- fatigue
- hypoglycémie
- douleur thoracique
- potassium sanguin élevé
- Pression artérielle faible
Informez votre médecin si vous ressentez un effet indésirable qui vous dérange ou qui ne disparaît pas.
C'est ne pas une liste complète des effets secondaires. Pour une liste complète, demandez à votre médecin ou à votre pharmacien.
Comment conserver COZAAR 100mg ?
- Conservez les comprimés COZAAR entre 59 °F et 86 °F (15 °C et 30 °C).
- Conservez COZAAR dans un récipient hermétiquement fermé qui protège le médicament de la lumière.
- Gardez COZAAR et tous les médicaments hors de la portée des enfants.
Informations générales sur COZAAR
Des médicaments sont parfois prescrits pour des affections qui ne sont pas mentionnées dans les notices d'information destinées aux patients. N'utilisez pas COZAAR pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas COZAAR à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Cette notice résume les informations les plus importantes sur COZAAR. Si vous souhaitez plus d'informations, parlez-en à votre médecin. Vous pouvez demander à votre pharmacien ou à votre médecin des informations sur COZAAR rédigées à l'intention des professionnels de la santé.
Quels sont les ingrédients de COZAAR 25mg ?
Ingrédients actifs: losartan potassique
Ingrédients inactifs:
cellulose microcristalline, lactose hydraté, amidon prégélatinisé, stéarate de magnésium, hydroxypropylcellulose, hypromellose et dioxyde de titane. COZAAR 25 mg, COZAAR 50 mg et COZAAR 100 mg peuvent également contenir de la cire de carnauba.
