Isoptin Sr 120mg, 240mg Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Isoptin et comment est-il utilisé ?
Isoptin est un médicament d'ordonnance utilisé pour traiter les symptômes de la douleur thoracique (angine), de l'hypertension artérielle (hypertension) et de certains troubles du rythme cardiaque. Isoptin peut être utilisé seul ou avec d'autres médicaments.
- Isoptin appartient à une classe de médicaments appelés Antidysrhythmics, IV; Bloqueurs de canaux calciques; Bloqueurs des canaux calciques et non-dihydropyridine.
- On ne sait pas si Isoptin est sûr et efficace chez les enfants de moins de 1 an.
Quels sont les effets secondaires possibles d'Isoptin ?
- douleur thoracique,
- rythme cardiaque rapide ou lent,
- étourdissement,
- essoufflement,
- gonflement,
- prise de poids rapide,
- fièvre,
- douleur dans le haut du ventre,
- Ne pas se sentir bien,
- anxiété,
- transpiration,
- peau pâle,
- respiration sifflante,
- à bout de souffle, et
- toux avec mucus mousseux
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Isoptin incluent:
- nausée,
- constipation,
- mal de tête,
- des étourdissements et
- Pression artérielle faible
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Isoptin. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
ISOPTIN® SR (chlorhydrate de vérapamil) est un inhibiteur de l'influx d'ions calcium (bloqueur des canaux lents ou antagoniste des ions calcium). ISOPTIN SR 240 mg est disponible pour administration orale sous forme de comprimés pelliculés vert clair, en forme de capsule, sécables contenant 240 mg de chlorhydrate de vérapamil, sous forme de comprimés pelliculés rose clair, de forme ovale, sécables et pelliculés contenant 180 mg de chlorhydrate de vérapamil et sous forme de violet clair. , comprimés pelliculés ovales contenant 120 mg de chlorhydrate de vérapamil. Les comprimés sont conçus pour la libération prolongée du médicament dans le tractus gastro-intestinal, les caractéristiques de libération prolongée ne sont pas modifiées lorsque le comprimé est divisé en deux.
La formule structurelle du vérapamil HCl est donnée ci-dessous
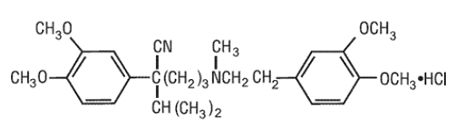 C27H38N2O4•HCl.............MW 491.08
C27H38N2O4•HCl.............MW 491.08 Benzèneacétonitrile, chlorhydrate d'α[3-[[2-(3,4-diméthoxyphényl)éthyl]méthylamino]propyl]-3,4diméthoxy-α-(1-méthyléthyl)
Le chlorhydrate de vérapamil est une poudre cristalline presque blanche, pratiquement inodore, avec un goût amer. Il est soluble dans l'eau, le chloroforme et le méthanol. Le chlorhydrate de vérapamil n'est pas lié chimiquement à d'autres médicaments cardioactifs.
En plus du vérapamil HCl, le comprimé ISOPTIN SR 240 mg contient les ingrédients suivants : alginate, hypromellose, stéarate de magnésium, cellulose microcristalline, polyéthylène glycol, polyvinyl pyrrolidone, talc et dioxyde de titane. Voici les additifs de couleur par force de comprimé :
LES INDICATIONS
ISOPTIN SR (chlorhydrate de vérapamil) est indiqué pour la prise en charge de l'hypertension artérielle essentielle.
DOSAGE ET ADMINISTRATION
L'hypertension artérielle essentielle
La dose d'ISOPTIN SR 120 mg doit être individualisée par titration et le médicament doit être administré avec de la nourriture. Initier le traitement avec 180 mg de chlorhydrate de vérapamil à libération prolongée, ISOPTIN SR, administré le matin. Des doses initiales plus faibles de 120 mg par jour peuvent être justifiées chez les patients qui peuvent avoir une réponse accrue au vérapamil (par exemple, les personnes âgées ou de petite taille, etc.). L'augmentation de la dose doit être basée sur l'efficacité thérapeutique et l'innocuité évaluées chaque semaine et environ 24 heures après la dose précédente. Les effets antihypertenseurs d'ISOPTIN SR sont évidents dès la première semaine de traitement.
Si une réponse adéquate n'est pas obtenue avec 180 mg d'ISOPTIN SR 240 mg, la dose peut être augmentée de la manière suivante :
Lors du passage d'ISOPTIN à libération immédiate à ISOPTIN SR, la dose quotidienne totale en milligrammes peut rester la même.
COMMENT FOURNIE
ISOPTIN® SR 240 mg Les comprimés sont fournis sous forme de comprimés pelliculés vert clair, en forme de capsule, sécables contenant 240 mg de chlorhydrate de vérapamil. Le comprimé est gravé « pp » d'un côté et « ST » de l'autre côté. Les comprimés ISOPTIN® SR à 180 mg sont fournis sous forme de comprimés pelliculés rose pâle, ovales, sécables contenant 180 mg de chlorhydrate de vérapamil. La tablette est gravée « pp » d'un côté et « SK » de l'autre côté. Les comprimés ISOPTIN® SR 120 mg sont fournis sous forme de comprimés pelliculés violet clair, de forme ovale, contenant 120 mg de chlorhydrate de vérapamil. La tablette est gravée d'un « p » d'un côté et de « SC » de l'autre.
240mg (vert clair)- Flacon de 100- CDN # 10631-490-01 Bouteille de 500- CDN # 10631-490-05 180mg (rose clair)- Flacon de 100- CDN # 10631-489-01 120mg (violet clair)- Flacon de 100- CDN # 10631-488-01
Stockage
Conserver à 25 °C (77 °F); excursions autorisées à 15 °–30 ° C (59 °– 86 ° F) [voir Température ambiante contrôlée USP ].
Protégez de la lumière et de l'humidité.
Dispenser dans un récipient étanche et résistant à la lumière tel que défini dans l'USP.
Vous pouvez signaler les effets secondaires à la FDA à 1-800-FDA-1088.
Fabriqué par : Halo Pharmaceutical Inc. Whippany, NJ 07981, USA Fabriqué pour : Ranbaxy Laboratories Inc. Jacksonville, FL 32257 USA. Octobre 2011
EFFETS SECONDAIRES
Les effets indésirables graves sont rares lorsque le traitement par vérapamil est initié avec une augmentation de la dose dans les limites de la dose quotidienne unique et totale recommandée. Voir AVERTISSEMENTS pour discuter de l'insuffisance cardiaque, de l'hypotension, des enzymes hépatiques élevées, du bloc AV et de la réponse ventriculaire rapide. Un iléus paralytique non obstructif réversible (à l'arrêt du vérapamil) a été rarement signalé en association avec l'utilisation du vérapamil. Les réactions suivantes au vérapamil administré par voie orale se sont produites à des taux supérieurs à 1,0 % ou sont survenues à des taux inférieurs, mais sont apparues clairement liées au médicament dans les essais cliniques chez 4 954 patients.
Enzymes hépatiques élevées
(voir AVERTISSEMENTS )
Dans les essais cliniques portant sur le contrôle de la réponse ventriculaire chez des patients digitalisés qui avaient une fibrillation auriculaire ou un flutter auriculaire, des fréquences ventriculaires inférieures à 50/min au repos sont survenues chez 15 % des patients et une hypotension asymptomatique est survenue chez 5 % des patients.
Les réactions suivantes, signalées chez 1,0 % ou moins des patients, sont survenues dans des conditions (essais ouverts, expérience de commercialisation) où une relation causale est incertaine ; ils sont répertoriés pour alerter le médecin d'une éventuelle relation.
Cardiovasculaire: angine de poitrine, dissociation auriculo-ventriculaire, douleur thoracique, claudication, infarctus du myocarde, palpitations, purpura (vascularite), syncope.
Système digestif: diarrhée, bouche sèche, détresse gastro-intestinale, hyperplasie gingivale.
Hémique et Lymphatique : ecchymoses ou contusions.
Système nerveux: accident vasculaire cérébral, confusion, troubles de l'équilibre, insomnie, crampes musculaires, paresthésie, symptômes psychotiques, tremblements, somnolence, symptômes extrapyramidaux.
Peau: arthralgie et éruption cutanée, exanthème, perte de cheveux, hyperkératose, macules, sudation, urticaire, syndrome de Stevens-Johnson, érythème polymorphe.
Sens spéciaux : vision floue, acouphènes.
Urogénital: gynécomastie, impuissance, galactorrhée/hyperprolactinémie, augmentation de la miction, menstruations irrégulières.
Traitement des effets indésirables cardiovasculaires aigus
La fréquence des effets indésirables cardiovasculaires nécessitant un traitement est rare, par conséquent, l'expérience de leur traitement est limitée. Chaque fois qu'une hypotension sévère ou un bloc AV complet survient après l'administration orale de vérapamil, les mesures d'urgence appropriées doivent être appliquées immédiatement, par exemple, administration intraveineuse de chlorhydrate d'isoprotérénol, de bitartrate de noradrénaline, de sulfate d'atropine (tous aux doses habituelles) ou de gluconate de calcium (solution à 10 %). ). Chez les patients atteints de cardiomyopathie hypertrophique (IHSS), des agents alpha-adrénergiques (chlorhydrate de phényléphrine, bitartrate de métaraminol ou chlorhydrate de méthoxamine) doivent être utilisés pour maintenir la pression artérielle, et l'isoprotérénol et la noradrénaline doivent être évités. Si un soutien supplémentaire est nécessaire, (dopamine HCl ou dobutamine HCl) peut être administré. Le traitement et la posologie réels doivent dépendre de la gravité de la situation clinique ainsi que du jugement et de l'expérience du médecin traitant.
INTERACTIONS MÉDICAMENTEUSES
Une hypotension et des bradyarythmies ont été observées chez des patients recevant simultanément de la téléthromycine, un antibiotique de la classe des antibiotiques kétolide.
Inhibiteurs de l'HMG-CoA réductase
L'utilisation d'inhibiteurs de l'HMG-CoA réductase qui sont des substrats du CYP3A4 en association avec le vérapamil a été associée à des cas de myopathie/rhabdomyolyse.
La co-administration de doses multiples de 10 mg de vérapamil avec 80 mg de simvastatine a entraîné une exposition à la simvastatine 2,5 fois plus élevée qu'après la simvastatine seule. Limitez la dose de simvastatine chez les patients sous vérapamil à 10 mg par jour. Limitez la dose quotidienne de lovastatine à 40 mg. Des doses initiales et d'entretien plus faibles d'autres substrats du CYP3A4 (par exemple, l'atorvastatine) peuvent être nécessaires car le vérapamil peut augmenter la concentration plasmatique de ces médicaments.
Clonidine
Une bradycardie sinusale entraînant une hospitalisation et l'insertion d'un stimulateur cardiaque a été rapportée en association avec l'utilisation concomitante de clonidine et de vérapamil. Surveiller la fréquence cardiaque chez les patients recevant simultanément du vérapamil et de la clonidine.
Inducteurs/inhibiteurs du cytochrome
Des études métaboliques in vitro indiquent que le vérapamil est métabolisé par le cytochrome P450 CYP3A4, CYP1A2, CYP2C8, CYP2C9 et CYP2C18. Des interactions cliniquement significatives ont été rapportées avec des inhibiteurs du CYP3A4 (par exemple, l'érythromycine, le ritonavir) provoquant une élévation des taux plasmatiques de vérapamil, tandis que des inducteurs du CYP3A4 (par exemple, la rifampicine) ont provoqué une baisse des taux plasmatiques de vérapamil. Par conséquent, les patients doivent être surveillés pour détecter toute interaction médicamenteuse. .
Aspirine
Dans quelques cas signalés, l'administration concomitante de vérapamil et d'aspirine a entraîné une augmentation du temps de saignement supérieure à celle observée avec l'aspirine seule.
Jus de pamplemousse
La consommation de jus de pamplemousse peut augmenter les taux de vérapamil.
Bêta-bloquants
Un traitement concomitant par des bêta-bloquants et du vérapamil peut entraîner des effets négatifs additifs sur la fréquence cardiaque, la conduction auriculo-ventriculaire et/ou la contractilité cardiaque. L'association de vérapamil à libération prolongée et de bêta-bloquants n'a pas été étudiée. Cependant, des cas de bradycardie excessive et de bloc AV, y compris un bloc cardiaque complet, ont été rapportés lorsque l'association a été utilisée pour le traitement de l'hypertension. Pour les patients hypertendus, les risques d'un traitement combiné peuvent l'emporter sur les avantages potentiels. L'association ne doit être utilisée qu'avec prudence et sous surveillance étroite.
Une bradycardie asymptomatique (36 battements/min) avec stimulation auriculaire errante a été observée chez un patient recevant en même temps du timolol (un bêta-bloquant) en collyre et du vérapamil par voie orale.
Une diminution de la clairance du métoprolol et du propranolol a été observée lorsque l'un ou l'autre médicament est administré en même temps que le vérapamil. Un effet variable a été observé lorsque le vérapamil et l'aténolol étaient administrés ensemble.
Digitale
L'utilisation clinique du vérapamil chez les patients digitalisés a montré que l'association était bien tolérée si les doses de digoxine étaient correctement ajustées. Un traitement chronique au vérapamil peut augmenter les taux sériques de digoxine de 50 à 75 % au cours de la première semaine de traitement, ce qui peut entraîner une toxicité digitalique. Chez les patients atteints de cirrhose hépatique, l'influence du vérapamil sur la cinétique de la digoxine est amplifiée. Le vérapamil peut réduire la clairance corporelle totale et la clairance extrarénale de la digitoxine de 27 % et 29 %, respectivement. Les doses d'entretien et de numérisation doivent être réduites lorsque le vérapamil est administré, et le patient doit être étroitement surveillé pour éviter une sur ou une sous-numérisation. Chaque fois qu'une surnumérisation est suspectée, la dose quotidienne de digitaline doit être réduite ou temporairement interrompue. À l'arrêt d'ISOPTIN (chlorhydrate de vérapamil), le patient doit être réévalué pour éviter une sous-numérisation.
Agents antihypertenseurs
Le vérapamil administré en concomitance avec des agents antihypertenseurs oraux (p. ex., vasodilatateurs, inhibiteurs de l'enzyme de conversion de l'angiotensine, diurétiques, bêtabloquants) aura généralement un effet additif sur la baisse de la pression artérielle. Les patients recevant ces associations doivent faire l'objet d'une surveillance appropriée. L'utilisation concomitante d'agents qui atténuent la fonction alpha-adrénergique avec le vérapamil peut entraîner une réduction de la pression artérielle excessive chez certains patients. Un tel effet a été observé dans une étude suite à l'administration concomitante de vérapamil et de prazosine.
Agents antiarythmiques
Disopyramide
Jusqu'à ce que des données sur les interactions possibles entre le vérapamil et le phosphate de disopyramide soient obtenues, le disopyramide ne doit pas être administré dans les 48 heures avant ou 24 heures après l'administration de vérapamil.
Flécaïnide
Une étude sur des volontaires sains a montré que l'administration concomitante de flécaïnide et de vérapamil peut avoir des effets additifs sur la contractilité myocardique, la conduction AV et la repolarisation. L'administration concomitante de flécaïnide et de vérapamil peut entraîner un effet inotrope négatif additif et un allongement de la conduction auriculo-ventriculaire.
Quinidine
Chez un petit nombre de patients atteints de cardiomyopathie hypertrophique (IHSS), l'utilisation concomitante de vérapamil et de quinidine a entraîné une hypotension importante. Jusqu'à ce que de nouvelles données soient obtenues, la thérapie combinée de vérapamil et de quinidine chez les patients atteints de cardiomyopathie hypertrophique devrait probablement être évitée.
Les effets électrophysiologiques de la quinidine et du vérapamil sur la conduction AV ont été étudiés chez 8 patients. Le vérapamil a contrecarré de manière significative les effets de la quinidine sur la conduction AV. Il y a eu un rapport d'augmentation des niveaux de quinidine pendant le traitement par le vérapamil.
Nitrates
Le vérapamil a été administré en concomitance avec des nitrates à courte et longue durée d'action sans aucune interaction médicamenteuse indésirable. Le profil pharmacologique des deux médicaments et l'expérience clinique suggèrent des interactions bénéfiques.

Autre
De l'alcool
Le vérapamil s'est avéré inhiber de manière significative l'élimination de l'éthanol, ce qui entraîne des concentrations élevées d'éthanol dans le sang qui peuvent prolonger les effets intoxicants de l'alcool. (Voir PHARMACOLOGIE CLINIQUE , Pharmacocinétique et métabolisme ).
Cimétidine
L'interaction entre la cimétidine et le vérapamil administré de manière chronique n'a pas été étudiée. Des résultats variables sur la clairance ont été obtenus dans des études aiguës sur des volontaires sains ; la clairance du vérapamil était soit réduite, soit inchangée.
Lithium
Une sensibilité accrue aux effets du lithium (neurotoxicité) a été rapportée lors d'un traitement concomitant par vérapamil-lithium ; on a observé que les niveaux de lithium augmentaient parfois, diminuaient parfois et restaient parfois inchangés. Les patients recevant les deux médicaments doivent être surveillés attentivement.
Carbamazépine
Le vérapamil peut augmenter les concentrations de carbamazépine pendant le traitement combiné. Cela peut produire des effets secondaires de la carbamazépine tels que diplopie, maux de tête, ataxie ou étourdissements.
Rifampine
Le traitement par la rifampicine peut réduire considérablement la biodisponibilité du vérapamil par voie orale.
Phénobarbital
Le traitement au phénobarbital peut augmenter la clairance du vérapamil.
Ciclosporine
Le traitement par le vérapamil peut augmenter les taux sériques de cyclosporine.
Théophylline
Le traitement par le vérapamil peut inhiber la clairance et augmenter les taux plasmatiques de théophylline.
Anesthésiques par inhalation
Des expériences sur des animaux ont montré que les anesthésiques par inhalation dépriment l'activité cardiovasculaire en diminuant le mouvement vers l'intérieur des ions calcium. Lorsqu'ils sont utilisés simultanément, les anesthésiques par inhalation et les antagonistes du calcium, tels que le vérapamil, doivent chacun être titrés avec soin pour éviter une dépression cardiovasculaire excessive.
Agents bloquants neuromusculaires
Les données cliniques et les études animales suggèrent que le vérapamil peut potentialiser l'activité des agents bloquants neuromusculaires (de type curare et dépolarisants). Il peut être nécessaire de diminuer la dose de vérapamil et/ou la dose de l'agent de blocage neuromusculaire lorsque les médicaments sont utilisés de façon concomitante.
AVERTISSEMENTS
Insuffisance cardiaque
Le vérapamil a un effet inotrope négatif qui, chez la plupart des patients, est compensé par ses propriétés de réduction de la postcharge (diminution de la résistance vasculaire systémique) sans altération nette des performances ventriculaires. Dans l'expérience clinique avec 4 954 patients, 87 (1,8 %) ont développé une insuffisance cardiaque congestive ou un œdème pulmonaire. Le vérapamil doit être évité chez les patients présentant une dysfonction ventriculaire gauche sévère (par exemple, une fraction d'éjection inférieure à 30 % ou des symptômes modérés à sévères d'insuffisance cardiaque) et chez les patients présentant un dysfonctionnement ventriculaire de tout degré s'ils reçoivent un bêta-bloquant (voir INTERACTIONS MÉDICAMENTEUSES ). Les patients présentant une dysfonction ventriculaire plus légère doivent, si possible, être contrôlés avec des doses optimales de digitaliques et/ou de diurétiques avant le traitement par le vérapamil (Notez les interactions avec la digoxine sous : PRÉCAUTIONS).
Hypotension
Occasionnellement, l'action pharmacologique du vérapamil peut produire une diminution de la pression artérielle en dessous des niveaux normaux, ce qui peut entraîner des étourdissements ou une hypotension symptomatique. L'incidence de l'hypotension observée chez 4 954 patients inclus dans les essais cliniques était de 2,5 %. Chez les patients hypertendus, les diminutions de la pression artérielle en dessous de la normale sont inhabituelles. Les tests sur table inclinable (60 degrés) n'ont pas pu induire d'hypotension orthostatique.
Enzymes hépatiques élevées
Des élévations des transaminases avec et sans élévations concomitantes de la phosphatase alcaline et de la bilirubine ont été rapportées. De telles élévations ont parfois été transitoires et peuvent disparaître même face à un traitement continu au vérapamil. Plusieurs cas de lésions hépatocellulaires liées au vérapamil ont été prouvés par rechallenge ; la moitié d'entre eux présentaient des symptômes cliniques (malaise, fièvre et/ou douleur dans le quadrant supérieur droit) en plus d'élévations du SGOT, du SGPT et de la phosphatase alcaline. Une surveillance périodique de la fonction hépatique chez les patients recevant du vérapamil est donc prudente.
Voie de contournement accessoire (Wolff-Parkinson-White ou Lown-Ganong-Levine)
Certains patients atteints de fibrillation auriculaire paroxystique et/ou chronique ou de flutter auriculaire et d'une voie AV accessoire coexistante ont développé une conduction antérograde accrue à travers la voie accessoire en contournant le nœud AV, produisant une réponse ventriculaire très rapide ou une fibrillation ventriculaire après avoir reçu du vérapamil intraveineux (ou digitaline) . Bien que le risque que cela se produise avec le vérapamil par voie orale n'a pas été établi, les patients recevant du vérapamil par voie orale peuvent être à risque et son utilisation chez ces patients est contre-indiquée (voir CONTRE-INDICATIONS ). Le traitement est généralement la cardioversion DC. La cardioversion a été utilisée de manière sûre et efficace après ISOPTIN oral.
Bloc auriculo-ventriculaire
L'effet du vérapamil sur la conduction AV et le nœud SA peut provoquer un bloc AV asymptomatique du premier degré et une bradycardie transitoire, parfois accompagnée de rythmes d'échappement nodaux. L'allongement de l'intervalle PR est corrélé aux concentrations plasmatiques de vérapamil, en particulier pendant les premières phases de titration du traitement. Cependant, des degrés plus élevés de bloc AV ont été rarement observés (0,8 %). Un bloc marqué du premier degré ou une évolution progressive vers un bloc AV du deuxième ou du troisième degré nécessite une réduction de la posologie ou, dans de rares cas, l'arrêt du vérapamil HCI et l'instauration d'un traitement approprié en fonction de la situation clinique.
Patients atteints de cardiomyopathie hypertrophique (IHSS)
Chez 120 patients atteints de cardiomyopathie hypertrophique (la plupart d'entre eux réfractaires ou intolérants au propranolol) ayant reçu un traitement par vérapamil à des doses allant jusqu'à 720 mg/jour, divers effets indésirables graves ont été observés. Trois patients sont décédés d'un œdème pulmonaire ; tous avaient une obstruction sévère de l'éjection ventriculaire gauche et des antécédents de dysfonctionnement ventriculaire gauche. Huit autres patients avaient un œdème pulmonaire et/ou une hypotension sévère ; une pression pulmonaire anormalement élevée (supérieure à 20 mmHg) et une obstruction marquée de l'éjection du ventricule gauche étaient présentes chez la plupart de ces patients. Administration concomitante de quinidine (voir INTERACTIONS MÉDICAMENTEUSES a précédé l'hypotension sévère chez 3 des 8 patients (dont 2 ont développé un œdème pulmonaire). Une bradycardie sinusale est survenue chez 11 % des patients, un bloc AV du second degré chez 4 % et un arrêt sinusal chez 2 %. Il faut comprendre que ce groupe de patients avait une maladie grave avec un taux de mortalité élevé. La plupart des effets indésirables ont bien répondu à la réduction de la dose et le vérapamil n'a dû être arrêté que rarement.
PRÉCAUTIONS
Général
Utilisation chez les patients présentant des fonctions hépatiques altérées
Étant donné que le vérapamil est hautement métabolisé par le foie, il doit être administré avec prudence aux patients présentant une fonction hépatique altérée. Un dysfonctionnement hépatique sévère prolonge la demi-vie d'élimination du vérapamil à libération immédiate à environ 14 à 16 heures; par conséquent, environ 30 % de la dose administrée aux patients ayant une fonction hépatique normale doit être administrée à ces patients. Une surveillance attentive de l'allongement anormal de l'intervalle PR ou d'autres signes d'effets pharmacologiques excessifs (voir SURDOSAGE ) doit être effectuée.
Utilisation chez les patients présentant une transmission neuromusculaire atténuée (diminuée)
Il a été rapporté que le vérapamil diminue la transmission neuromusculaire chez les patients atteints de dystrophie musculaire de Duchenne, prolonge la récupération du vécuronium, un agent bloquant neuromusculaire, et provoque une aggravation de la myasthénie grave. Il peut être nécessaire de diminuer la posologie du vérapamil lorsqu'il est administré à des patients présentant une transmission neuromusculaire atténuée.
Utilisation chez les patients présentant une fonction rénale altérée
Environ 70 % d'une dose administrée de vérapamil est excrétée sous forme de métabolites dans l'urine. Le vérapamil n'est pas éliminé par hémodialyse. Jusqu'à ce que de nouvelles données soient disponibles, le vérapamil doit être administré avec prudence aux patients présentant une insuffisance rénale. Ces patients doivent être étroitement surveillés afin de détecter un allongement anormal de l'intervalle PR ou d'autres signes de surdosage (voir SURDOSAGE ).
Carcinogenèse, mutagenèse, altération de la fertilité
Une étude de toxicité de 18 mois chez le rat, à un faible multiple (6 fois) de la dose humaine maximale recommandée, et non à la dose maximale tolérée, n'a pas suggéré de potentiel tumorigène. Il n'y avait aucune preuve d'un potentiel carcinogène du vérapamil administré dans l'alimentation des rats pendant deux ans à des doses de 10, 35 et 120 mg/kg par jour ou environ 1x, 3,5x et 12x, respectivement, la dose quotidienne maximale recommandée pour l'homme. dose (480 mg par jour ou 9,6 mg/kg/jour).
Le vérapamil n'a pas été mutagène au test d'Ames sur 5 souches testées à 3 mg par boîte, avec ou sans activation métabolique.
Des études chez des rats femelles à des doses alimentaires quotidiennes allant jusqu'à 5,5 fois (55 mg/kg/jour) la dose maximale recommandée chez l'homme n'ont pas montré d'altération de la fertilité. Les effets sur la fertilité masculine n'ont pas été déterminés.
Grossesse
Catégorie de grossesse C Des études de reproduction ont été réalisées chez des lapins et des rats à des doses orales allant jusqu'à 1,5 (15 mg/kg/jour) et 6 (60 mg/kg/jour) fois la dose quotidienne orale humaine, respectivement, et n'ont révélé aucun signe de tératogénicité. Chez le rat, cependant, ce multiple de la dose humaine était embryocide et a retardé la croissance et le développement du fœtus, probablement en raison d'effets maternels indésirables reflétés dans les gains de poids réduits des mères. Il a également été démontré que cette dose orale provoque une hypotension chez le rat. Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue. Le vérapamil traverse la barrière placentaire et peut être détecté dans le sang de la veine ombilicale lors de l'accouchement.
Travail et accouchement
On ne sait pas si l'utilisation de vérapamil pendant le travail ou l'accouchement a des effets indésirables immédiats ou différés sur le fœtus, ou si elle prolonge la durée du travail ou augmente la nécessité d'un accouchement par forceps ou d'une autre intervention obstétricale. De tels effets indésirables n'ont pas été rapportés dans la littérature, malgré une longue histoire d'utilisation du vérapamil en Europe dans le traitement des effets secondaires cardiaques des agents agonistes bêta-adrénergiques utilisés pour traiter le travail prématuré.
Mères allaitantes
Le vérapamil est excrété dans le lait maternel. En raison du risque d'effets indésirables du vérapamil chez les nourrissons, l'allaitement doit être interrompu pendant l'administration de vérapamil.
Utilisation pédiatrique
La sécurité et l'efficacité des comprimés d'ISOPTIN chez les patients pédiatriques de moins de 18 ans n'ont pas été établies.
SURDOSAGE
Un surdosage de vérapamil peut entraîner une hypotension prononcée, une bradycardie et des anomalies du système de conduction (p. ex., rythme jonctionnel avec dissociation AV et bloc AV de haut degré, y compris asystole). D'autres symptômes secondaires à l'hypoperfusion (p. ex., acidose métabolique, hyperglycémie, hyperkaliémie, dysfonctionnement rénal et convulsions) peuvent être évidents.
Traiter tous les surdosages de vérapamil comme graves et maintenir l'observation pendant au moins 48 heures [en particulier ISOPTIN® SR (chlorhydrate de vérapamil)] de préférence sous soins hospitaliers continus. Des conséquences pharmacodynamiques retardées peuvent survenir avec la formulation à libération prolongée. Le vérapamil est connu pour diminuer le temps de transit gastro-intestinal.
En cas de surdosage, les comprimés d'ISOPTIN SR 240 mg ont parfois été rapportés pour former des concrétions dans l'estomac ou les intestins. Ces concrétions n'ont pas été visibles sur les radiographies simples de l'abdomen, et aucun moyen médical de vidange gastro-intestinale n'est d'une efficacité prouvée pour les éliminer. L'endoscopie peut raisonnablement être envisagée en cas de surdosage massif lorsque les symptômes se prolongent de façon inhabituelle.
Le traitement du surdosage doit être de soutien. La stimulation bêta-adrénergique ou l'administration parentérale de solutions de calcium peuvent augmenter le flux d'ions calcium à travers le canal lent et ont été utilisées efficacement dans le traitement d'un surdosage délibéré de vérapamil. Un traitement continu avec de fortes doses de calcium peut produire une réponse. Dans quelques cas rapportés, un surdosage avec des inhibiteurs calciques initialement réfractaires à l'atropine est devenu plus réactif à ce traitement lorsque les patients ont reçu de fortes doses (près de 1 gramme/heure pendant plus de 24 heures) de chlorure de calcium. Le vérapamil ne peut pas être éliminé par hémodialyse. Les réactions hypotensives cliniquement significatives ou un bloc AV de haut degré doivent être traités respectivement par des agents vasopresseurs ou une stimulation cardiaque. L'asystolie doit être traitée par les mesures habituelles, y compris la réanimation cardiorespiratoire.
CONTRE-INDICATIONS
Le chlorhydrate de vérapamil est contre-indiqué dans :
PHARMACOLOGIE CLINIQUE
ISOPTIN (vérapamil HCl) est un inhibiteur de l'influx d'ions calcium (bloqueur lent des canaux ou antagoniste des ions calcium) qui exerce ses effets pharmacologiques en modulant l'influx de calcium ionique à travers la membrane cellulaire du muscle lisse artériel ainsi que dans les cellules myocardiques conductrices et contractiles. .
Mécanisme d'action
L'hypertension artérielle essentielle
ISOPTIN exerce des effets antihypertenseurs en diminuant la résistance vasculaire systémique, généralement sans diminution orthostatique de la pression artérielle ni tachycardie réflexe ; la bradycardie (fréquence inférieure à 50 battements/min) est rare (1,4 %). Lors d'exercices isométriques ou dynamiques, ISOPTIN n'altère pas la fonction cardiaque systolique chez les patients ayant une fonction ventriculaire normale. ISOPTIN ne modifie pas les taux de calcium sérique total. Cependant, un rapport a suggéré que des taux de calcium supérieurs à la normale pourraient altérer l'effet thérapeutique d'ISOPTIN.
Les autres actions pharmacologiques d'ISOPTIN comprennent les suivantes
ISOPTIN (chlorhydrate de vérapamil) dilate les principales artères coronaires et artérioles coronaires, tant dans les régions normales qu'ischémiques, et est un puissant inhibiteur des spasmes des artères coronaires, qu'ils soient spontanés ou induits par l'ergonovine. Cette propriété augmente l'apport d'oxygène au myocarde chez les patients atteints de spasme de l'artère coronaire et est responsable de l'efficacité d'ISOPTIN dans la vasospastique (Prinzmetal ou variante) ainsi que dans l'angor instable au repos. Il n'est pas clair si cet effet joue un rôle dans l'angor d'effort classique, mais les études sur la tolérance à l'exercice n'ont pas montré d'augmentation du produit fréquence d'exercice maximale-pression, une mesure largement acceptée de l'utilisation de l'oxygène. Cela suggère qu'en général, le soulagement des spasmes ou la dilatation des artères coronaires n'est pas un facteur important dans l'angor classique.
ISOPTIN réduit régulièrement la résistance systémique totale (postcharge) contre laquelle travaille le cœur tant au repos qu'à un niveau d'effort donné en dilatant les artérioles périphériques.
L'activité électrique à travers le nœud AV dépend, à un degré significatif, de l'influx de calcium à travers le canal lent. En diminuant l'afflux de calcium, ISOPTIN prolonge la période réfractaire effective dans le nœud AV et ralentit la conduction AV d'une manière liée à la fréquence.
Le rythme sinusal normal n'est généralement pas affecté, mais chez les patients atteints de maladie des sinus, ISOPTIN peut interférer avec la génération d'impulsions du nœud sinusal et peut induire un arrêt sinusal ou un bloc sino-auriculaire. Un bloc auriculo-ventriculaire peut survenir chez des patients sans défaut de conduction préexistant (voir AVERTISSEMENTS ).
ISOPTIN ne modifie pas le potentiel d'action auriculaire normal ni le temps de conduction intraventriculaire, mais diminue l'amplitude, la vitesse de dépolarisation et la conduction dans les fibres auriculaires déprimées. ISOPTIN peut raccourcir la période réfractaire effective antérograde des pontages accessoires. Une accélération de la fréquence ventriculaire et/ou de la fibrillation ventriculaire a été rapportée chez des patients présentant un flutter auriculaire ou une fibrillation auriculaire et une voie AV accessoire coexistante après l'administration de vérapamil (voir AVERTISSEMENTS ).
ISOPTIN a une action anesthésique locale qui est 1,6 fois supérieure à celle de la procaïne sur une base équimolaire. On ne sait pas si cette action est importante aux doses utilisées chez l'homme.
Pharmacocinétique et métabolisme
Avec la formulation à libération immédiate, plus de 90 % de la dose d'ISOPTIN administrée par voie orale est absorbée. En raison de la biotransformation rapide du vérapamil lors de son premier passage dans la circulation porte, la biodisponibilité varie de 20 % à 35 %. Les concentrations plasmatiques maximales sont atteintes entre 1 et 2 heures après administration orale. L'administration orale chronique de 120 mg d'ISOPTIN toutes les 6 heures a entraîné des taux plasmatiques de vérapamil allant de 125 à 400 ng/mL avec des valeurs plus élevées signalées occasionnellement. Il existe une corrélation non linéaire entre la dose de vérapamil administrée et les taux plasmatiques de vérapamil.
Lors d'un titrage précoce de la dose de vérapamil, il existe une relation entre les concentrations plasmatiques de vérapamil et l'allongement de l'intervalle PR. Cependant, lors d'une administration chronique, cette relation peut disparaître. La demi-vie d'élimination moyenne dans les études à dose unique variait de 2,8 à 7,4 heures. Dans ces mêmes études, après administration répétée, la demi-vie a augmenté jusqu'à une plage de 4,5 à 12,0 heures (après moins de 10 doses consécutives administrées à 6 heures d'intervalle). La demi-vie du vérapamil peut augmenter pendant la titration. Aucune relation n'a été établie entre la concentration plasmatique de vérapamil et une diminution de la pression artérielle.
Le vieillissement peut affecter la pharmacocinétique du vérapamil. La demi-vie d'élimination peut être prolongée chez les personnes âgées.
Dans des études à doses multiples à jeun, la biodisponibilité mesurée par l'ASC d'ISOPTIN SR 240 mg était similaire à celle d'ISOPTIN à libération immédiate ; les taux d'absorption étaient, bien entendu, différents. Dans une étude randomisée, à dose unique et croisée chez des volontaires sains, l'administration de 240 mg d'ISOPTIN SR avec de la nourriture a produit des concentrations plasmatiques maximales de vérapamil de 79 ng/mL, un temps pour atteindre la concentration plasmatique maximale de vérapamil de 7,71 heures et une ASC (0-24 h ) de 841 ng-h/mL. Lorsqu'ISOPTIN SR a été administré à des sujets à jeun, la concentration plasmatique maximale de vérapamil était de 164 ng/mL ; le temps nécessaire pour atteindre le pic de concentration plasmatique de vérapamil était de 5,21 heures ; et l'ASC (0-24 h) était de 1 478 ng-h/mL. Des résultats similaires ont été démontrés pour le norvérapamil plasmatique. La nourriture produit ainsi une diminution de la biodisponibilité (AUC) mais un rapport pic/creux plus étroit. Une bonne corrélation entre la dose et la réponse n'est pas disponible, mais des études contrôlées d'ISOPTIN SR 120 mg ont montré une efficacité à des doses similaires aux doses efficaces d'ISOPTIN (libération immédiate).
Chez l'homme en bonne santé, ISOPTIN administré par voie orale subit un métabolisme important dans le foie. Douze métabolites ont été identifiés dans le plasma ; tous sauf le norvérapamil ne sont présents qu'à l'état de traces. Le norvérapamil peut atteindre des concentrations plasmatiques à l'état d'équilibre approximativement égales à celles du vérapamil lui-même. L'activité cardiovasculaire du norvérapamil semble être d'environ 20 % de celle du vérapamil. Environ 70 % d'une dose administrée est excrétée sous forme de métabolites dans l'urine et 16 % ou plus dans les fèces dans les 5 jours. Environ 3 à 4 % sont excrétés dans l'urine sous forme inchangée. Environ 90 % sont liés aux protéines plasmatiques. Chez les insuffisants hépatiques, le métabolisme du vérapamil à libération immédiate est retardé et la demi-vie d'élimination prolongée jusqu'à 14 à 16 heures (voir PRÉCAUTIONS ); le volume de distribution est augmenté et la clairance plasmatique réduite à environ 30 % de la normale. Les valeurs de clairance du vérapamil suggèrent que les patients présentant un dysfonctionnement hépatique peuvent atteindre des concentrations plasmatiques thérapeutiques de vérapamil avec un tiers de la dose quotidienne orale requise pour les patients ayant une fonction hépatique normale.
Après quatre semaines d'administration orale (120 mg qid), des niveaux de vérapamil et de norvérapamil ont été notés dans le liquide céphalo-rachidien avec un coefficient de partage estimé de 0,06 pour le vérapamil et de 0,04 pour le norvérapamil.
Chez dix hommes en bonne santé, l'administration de vérapamil par voie orale (80 mg toutes les 8 heures pendant 6 jours) et d'une dose orale unique d'éthanol (0,8 g/kg) a entraîné une augmentation de 17 % des pics moyens de concentration d'éthanol (106,45 ± 21,40 à 124,23 ± 24,74 mg•h/dL) par rapport au placebo. L'aire sous la courbe de concentration d'éthanol sanguin en fonction du temps (ASC sur 12 heures) a augmenté de 30 % (365,67 ± 93,52 à 475,07 ± 97,24 mg•h/dL). Les ASC du vérapamil étaient positivement corrélées (r = 0,71) à l'augmentation des valeurs d'ASC de l'éthanol dans le sang. (Voir PRÉCAUTIONS : INTERACTIONS MÉDICAMENTEUSES .)
Hémodynamique et métabolisme myocardique
ISOPTIN réduit la postcharge et la contractilité myocardique. Une amélioration de la fonction diastolique ventriculaire gauche chez les patients atteints d'IHSS et ceux atteints de maladie coronarienne a également été observée avec le traitement ISOPTIN. Chez la plupart des patients, y compris ceux atteints d'une maladie cardiaque organique, l'action inotrope négative d'ISOPTIN est contrée par la réduction de la postcharge et l'index cardiaque n'est généralement pas réduit. Cependant, chez les patients présentant une dysfonction ventriculaire gauche sévère (p. ex., pression de coin pulmonaire supérieure à 20 mmHg ou fraction d'éjection inférieure à 30 %), ou chez les patients prenant des bêta-bloquants ou d'autres médicaments cardiodépresseurs, une détérioration de la fonction ventriculaire peut survenir (voir INTERACTIONS MÉDICAMENTEUSES ).
Fonction pulmonaire
ISOPTIN n'induit pas de bronchoconstriction et n'altère donc pas la fonction ventilatoire.
Pharmacologie animale et/ou toxicologie animale
Dans des études de toxicologie chronique chez l'animal, le vérapamil a provoqué des changements lenticulaires et/ou de la ligne de suture à 30 mg/kg/jour ou plus et des cataractes franches à 62,5 mg/kg/jour ou plus chez le chien beagle mais pas chez le rat. Le développement de cataractes dues au vérapamil n'a pas été rapporté chez l'homme.
INFORMATIONS PATIENTS
Aucune information fournie. Veuillez vous référer au AVERTISSEMENTS et PRÉCAUTIONS sections.
