Procardia 30mg Nifedipine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Procardia 30 mg et comment est-il utilisé ?
Procardia est un médicament d'ordonnance utilisé pour traiter les symptômes de la douleur thoracique (angine), de l'hypertension artérielle (hypertension) et de l'hypertension pulmonaire. Procardia 30 mg peut être utilisé seul ou avec d'autres médicaments.
Procardia appartient à une classe de médicaments appelés inhibiteurs calciques ; Bloqueurs des canaux calciques, dihydrophyridine.
On ne sait pas si Procardia est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Procardia ?
Procardia peut provoquer des effets secondaires graves, notamment :
- fièvre,
- mal de gorge,
- Yeux brûlants,
- douleurs cutanées,
- éruption cutanée rouge ou violette avec cloques et desquamation,
- aggravation des douleurs thoraciques,
- des battements de cœur battants,
- flottant dans ta poitrine,
- étourdissement,
- gonflement des mains ou des jambes,
- douleur dans le haut de l'estomac et
- jaunissement de la peau ou des yeux (jaunisse)
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Procardia 30 mg incluent :
- gonflement,
- bouffées vasomotrices (chaleur. rougeur ou sensation de picotement),
- mal de tête,
- vertiges,
- nausée,
- brûlures d'estomac, et
- se sentir faible ou fatigué
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Procardia. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
LA DESCRIPTION
PROCARDIA® (nifédipine) est un médicament anti-angineux appartenant à une classe d'agents pharmacologiques, les inhibiteurs calciques. La nifédipine est l'acide 3,5-pyridinedicarboxylique, 1,4-dihydro-2,6-diméthyl-4-(2- nitrophényl)-, ester diméthylique, C17H18N2O6, et a la formule structurale :
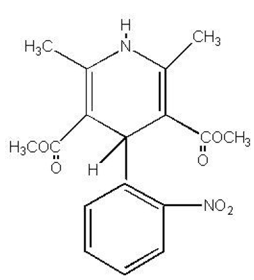
La nifédipine est une substance cristalline jaune, pratiquement insoluble dans l'eau mais soluble dans l'éthanol. Il a un poids moléculaire de 346,3. Les capsules PROCARDIA sont formulées sous forme de capsules de gélatine molle pour administration orale, contenant chacune 10 mg de nifédipine.
Les ingrédients inertes de la formulation sont : la glycérine ; huile de menthe poivrée; polyéthylène glycol; capsules de gélatine molle (qui contiennent du jaune 6 et peuvent contenir de l'oxyde de fer rouge et d'autres ingrédients inertes); et de l'eau. Les gélules de 10 mg contiennent également de la saccharine sodique.
LES INDICATIONS
Angine vasospastique
PROCARDIA (nifédipine) est indiqué pour la prise en charge de l'angor vasospastique confirmé par l'un des critères suivants : 1) schéma classique d'angor au repos accompagné d'un sus-décalage du segment ST, 2) angor ou spasme des artères coronaires provoqués par l'ergonovine, ou 3) démontré par angiographie spasme de l'artère coronaire. Chez les patients qui ont subi une angiographie, la présence d'une maladie obstructive fixe importante n'est pas incompatible avec le diagnostic d'angor vasospastique, à condition que les critères ci-dessus soient satisfaits. PROCARDIA 30 mg peut également être utilisé lorsque la présentation clinique suggère une possible composante vasospastique mais lorsque le vasospasme n'a pas été confirmé, par exemple lorsque la douleur a un seuil variable à l'effort ou lorsque l'angor est réfractaire aux nitrates et/ou à des doses adéquates de bêta-bloquants.
Angine chronique stable (angine classique associée à l'effort)
PROCARDIA 30 mg est indiqué dans la prise en charge de l'angor chronique stable (angor d'effort) sans signe de vasospasme chez les patients qui restent symptomatiques malgré des doses adéquates de bêta-bloquants et/ou de nitrates organiques ou qui ne tolèrent pas ces agents.
Dans l'angor stable chronique (angor associé à l'effort), PROCARDIA a été efficace dans des essais contrôlés d'une durée allant jusqu'à huit semaines pour réduire la fréquence de l'angor et augmenter la tolérance à l'exercice, mais la confirmation de l'efficacité soutenue et l'évaluation de l'innocuité à long terme chez ces patients sont incomplètes .
Des études contrôlées portant sur un petit nombre de patients suggèrent que l'utilisation concomitante de PROCARDIA 30 mg et d'agents bêtabloquants peut être bénéfique chez les patients souffrant d'angor stable chronique, mais les informations disponibles ne sont pas suffisantes pour prédire avec certitude les effets d'un traitement concomitant, en particulier chez les patients dont la fonction ventriculaire gauche est altérée. ou anomalies de la conduction cardiaque. Lors de l'introduction d'un tel traitement concomitant, des précautions doivent être prises pour surveiller étroitement la pression artérielle car une hypotension sévère peut survenir à cause des effets combinés des médicaments. (Voir AVERTISSEMENTS .)
DOSAGE ET ADMINISTRATION
La posologie de PROCARDIA 30mg nécessaire à la suppression de l'angor et pouvant être tolérée par le patient doit être établie par titration. Des doses excessives peuvent entraîner une hypotension.
Le traitement doit être initié avec la gélule de 10 mg. La dose initiale est d'une gélule de 10 mg, avalée entière, 3 fois/jour. La gamme de doses efficaces habituelles est de 10 à 20 mg trois fois par jour. Certains patients, en particulier ceux présentant des signes de spasme de l'artère coronaire, ne répondent qu'à des doses plus élevées, à une administration plus fréquente ou aux deux. Chez ces patients, des doses de 20 à 30 mg trois ou quatre fois par jour peuvent être efficaces. Des doses supérieures à 120 mg par jour sont rarement nécessaires. Plus de 180 mg par jour n'est pas recommandé.
Dans la plupart des cas, la titration de PROCARDIA doit se dérouler sur une période de 7 à 14 jours afin que le médecin puisse évaluer la réponse à chaque niveau de dose et surveiller la tension artérielle avant de passer à des doses plus élevées.
Si les symptômes le justifient, la titration peut se dérouler plus rapidement à condition que le patient soit évalué fréquemment. En fonction du niveau d'activité physique du patient, de la fréquence des crises et de la consommation sublinguale de nitroglycérine, la dose de PROCARDIA 30 mg peut être augmentée de 10 mg tid à 20 mg tid puis à 30 mg tid sur une période de trois jours.
Chez les patients hospitalisés sous surveillance étroite, la dose peut être augmentée par paliers de 10 mg sur des périodes de quatre à six heures selon les besoins pour contrôler la douleur et les arythmies dues à l'ischémie. Une dose unique doit rarement dépasser 30 mg.
Eviter la co-administration de nifédipine avec du jus de pamplemousse (voir PHARMACOLOGIE CLINIQUE et INTERACTIONS MÉDICAMENTEUSES ).
Aucun « effet rebond » n'a été observé à l'arrêt de PROCARDIA. Cependant, si l'arrêt de PROCARDIA est nécessaire, une bonne pratique clinique suggère que la posologie doit être diminuée progressivement sous la surveillance étroite d'un médecin.
Co-administration avec d'autres médicaments anti-angineux
La nitroglycérine sublinguale peut être prise au besoin pour le contrôle des manifestations aiguës de l'angor, en particulier pendant la titration de PROCARDIA. Voir INTERACTIONS MÉDICAMENTEUSES , pour des informations sur la co-administration de PROCARDIA 30mg avec des bêta-bloquants ou des nitrates à action prolongée.
COMMENT FOURNIE
PROCARDIA les capsules de gélatine molle sont fournies dans :
Flacons de 100 : 10 mg ( CDN 0069-2600-66)
Les gélules doivent être protégées de la lumière et de l'humidité et conservées à température ambiante contrôlée, entre 59 et 77 °F (15 et 25 °C) dans le contenant d'origine du fabricant.
Distribué par : Pfizer Labs, Division of Pfizer Inc, NY, NY 10017. Révisé : juillet 2016
EFFETS SECONDAIRES
Dans des études à doses multiples contrôlées aux États-Unis et à l'étranger dans lesquelles des effets indésirables ont été signalés spontanément, les effets indésirables étaient fréquents mais généralement sans gravité et ont rarement nécessité l'arrêt du traitement ou un ajustement posologique. La plupart étaient des conséquences attendues des effets vasodilatateurs de PROCARDIA.
Il existe également une grande expérience non contrôlée chez plus de 2100 patients aux États-Unis. La plupart des patients avaient une angine de poitrine vasospastique ou résistante, et environ la moitié recevaient un traitement concomitant par des agents bêta-bloquants. Les événements indésirables les plus fréquents étaient :
Incidence Environ 10 %
Cardiovasculaire: œdème périphérique
Système nerveux central: étourdissements ou étourdissements
Gastro-intestinal : nausée
Systémique : maux de tête et bouffées vasomotrices, faiblesse
Incidence Environ 5 %
Cardiovasculaire: hypotension transitoire
Incidence 2 % ou moins
Cardiovasculaire: palpitation
Respiratoire: congestion nasale et thoracique, essoufflement
Gastro-intestinal : diarrhée, constipation, crampes, flatulences
Musculo-squelettique : inflammation, raideur articulaire, crampes musculaires
Système nerveux central: tremblements, nervosité, nervosité, troubles du sommeil, vision floue, troubles de l'équilibre
Autre: dermatite, prurit, urticaire, fièvre, sudation, frissons, difficultés sexuelles
Incidence Environ 0,5 %
Cardiovasculaire: syncope (principalement avec la dose initiale et/ou une augmentation de la dose), érythromélalgie
Incidence inférieure à 0,5 %
Hématologique : thrombocytopénie, anémie, leucopénie, purpura
Gastro-intestinal : hépatite allergique
Visage et Gorge : œdème de Quincke (principalement œdème oropharyngé avec difficulté respiratoire chez quelques patients), hyperplasie gingivale
SNC : dépression, syndrome paranoïaque
Sens spéciaux : cécité transitoire au pic du niveau plasmatique, acouphènes
Urogénital: nycturie, polyurie
Autre: arthrite avec ANA (+), dermatite exfoliative, gynécomastie
Musculo-squelettique : myalgie
Plusieurs de ces effets secondaires semblent liés à la dose. Un œdème périphérique est survenu chez environ un patient sur 25 à des doses inférieures à 60 mg par jour et chez environ un patient sur huit à 120 mg par jour ou plus. Une hypotension transitoire, généralement d'intensité légère à modérée et nécessitant rarement l'arrêt du traitement, est survenue chez l'un des 50 patients recevant moins de 60 mg par jour et chez l'un des 20 patients recevant 120 mg par jour ou plus.
Très rarement, l'introduction du traitement par PROCARDIA 30 mg a été associée à une augmentation des douleurs angineuses, possiblement due à une hypotension associée. Une perte de vision unilatérale transitoire s'est également produite.
De plus, des événements indésirables plus graves ont été observés, difficilement distinguables de l'histoire naturelle de la maladie chez ces patients. Il reste possible, cependant, que certains ou plusieurs de ces événements aient été liés à la drogue. Un infarctus du myocarde est survenu chez environ 4 % des patients et une insuffisance cardiaque congestive ou un œdème pulmonaire chez environ 2 %. Des arythmies ventriculaires ou des troubles de la conduction sont survenus chez moins de 0,5 % des patients.
Dans un sous-groupe de plus de 1000 patients recevant PROCARDIA 30 mg avec un traitement concomitant par bêta-bloquants, le schéma et l'incidence des effets indésirables n'étaient pas différents de ceux de l'ensemble du groupe de patients traités par PROCARDIA (nifédipine). (Voir PRÉCAUTIONS .)
Dans un sous-groupe d'environ 250 patients ayant reçu un diagnostic d'insuffisance cardiaque congestive et d'angine de poitrine (environ 10 % de la population totale de patients), des étourdissements ou des étourdissements, un œdème périphérique, des maux de tête ou des bouffées vasomotrices sont survenus chez un patient sur huit. Une hypotension est survenue chez environ un patient sur 20. Une syncope est survenue chez environ un patient sur 250. Un infarctus du myocarde ou des symptômes d'insuffisance cardiaque congestive sont survenus chacun chez environ un patient sur 15. Des arythmies auriculaires ou ventriculaires sont survenues chacune chez environ un patient sur 150.
Dans l'expérience post-commercialisation, de rares cas de dermatite exfoliative causée par la nifédipine ont été signalés. De rares cas d'effets indésirables cutanés exfoliatifs ou bulleux (tels que l'érythème polymorphe, le syndrome de Stevens-Johnson et la nécrolyse épidermique toxique) et de réactions de photosensibilité ont été signalés. Une pustulose exanthématique aiguë généralisée a également été rapportée.
INTERACTIONS MÉDICAMENTEUSES
Agents bloquants bêta-adrénergiques
(Voir INDICATIONS ET USAGE et AVERTISSEMENTS .) L'expérience de plus de 1400 patients dans un essai clinique non comparatif a montré que l'administration concomitante de PROCARDIA 30 mg et d'agents bêta-bloquants est généralement bien tolérée, mais il y a eu des rapports occasionnels dans la littérature suggérant que l'association peut augmenter le risque d'insuffisance cardiaque congestive, hypotension grave ou exacerbation de l'angine de poitrine.
Nitrates à action prolongée
PROCARDIA 30 mg peut être co-administré en toute sécurité avec des nitrates, mais il n'y a pas eu d'études contrôlées pour évaluer l'efficacité anti-angineuse de cette association.
Digitale
Étant donné qu'il y a eu des rapports isolés de patients présentant des taux élevés de digoxine et qu'il existe une interaction possible entre la digoxine et la nifédipine, il est recommandé de surveiller les taux de digoxine lors de l'initiation, de l'ajustement et de l'arrêt de la nifédipine afin d'éviter une éventuelle sur ou sous-numérisation. .
Quinidine
De rares cas d'interaction entre la quinidine et la nifédipine (avec une diminution du taux plasmatique de quinidine) ont été rapportés.
Anticoagulants coumariniques
De rares cas d'augmentation du temps de prothrombine ont été signalés chez des patients prenant des anticoagulants coumariniques auxquels PROCARDIA a été administré. Cependant, la relation avec le traitement par PROCARDIA est incertaine.
Cimétidine
Une étude menée sur six volontaires sains a montré une augmentation significative des concentrations plasmatiques maximales de nifédipine (80 %) et de l'aire sous la courbe (74 %) après une cure d'une semaine de cimétidine à 1 000 mg par jour et de nifédipine à 40 mg par jour. journée. La ranitidine a produit des augmentations plus petites et non significatives. L'effet peut être médié par l'inhibition connue de la cimétidine sur le cytochrome hépatique P-450, le système enzymatique probablement responsable du métabolisme de premier passage de la nifédipine. Si un traitement par nifédipine est initié chez un patient recevant actuellement de la cimétidine, une titration prudente est conseillée.
La nifédipine est métabolisée par le CYP3A4. La co-administration de nifédipine avec la phénytoïne, un inducteur du CYP3A4, réduit l'exposition systémique à la nifédipine d'environ 70 %. Éviter la co-administration de nifédipine avec la phénytoïne ou tout inducteur connu du CYP3A4 ou envisager un traitement antihypertenseur alternatif.
Les inhibiteurs du CYP3A tels que le fluconazole, l'itraconazole, la clarithromycine, l'érythromycine, la néfazodone, la fluoxétine, le saquinavir, l'indinavir et le nelfinavir peuvent entraîner une exposition accrue à la nifédipine en cas d'administration concomitante. Une surveillance attentive et un ajustement posologique peuvent être nécessaires ; envisager d'initier la nifédipine à la dose la plus faible disponible si elle est administrée en concomitance avec ces médicaments.
Autres interactions
Jus de pamplemousse
La co-administration de nifédipine avec du jus de pamplemousse a entraîné un doublement environ de l'ASC et de la Cmax de la nifédipine sans modification de la demi-vie. L'augmentation des concentrations plasmatiques résulte très probablement de l'inhibition du métabolisme de premier passage lié au CYP 3A4. Évitez l'ingestion de pamplemousse et de jus de pamplemousse pendant que vous prenez de la nifédipine.
AVERTISSEMENTS
Hypotension excessive
Bien que, chez la plupart des patients, l'effet hypotenseur de PROCARDIA 30 mg soit modeste et bien toléré, des patients occasionnels ont eu une hypotension excessive et mal tolérée. Ces réponses sont généralement survenues lors de la titration initiale ou lors d'un ajustement ultérieur de la posologie vers le haut. Bien que les patients aient rarement présenté une hypotension excessive sous PROCARDIA 30 mg seul, cela peut être plus fréquent chez les patients sous traitement concomitant par bêta-bloquants. Bien qu'ils ne soient pas approuvés à cette fin, PROCARDIA et d'autres gélules de nifédipine à libération immédiate ont été utilisées (par voie orale et sublinguale) pour la réduction aiguë de la pression artérielle. Plusieurs rapports bien documentés décrivent des cas d'hypotension profonde, d'infarctus du myocarde et de décès lorsque la nifédipine à libération immédiate a été utilisée de cette manière. Les gélules de PROCARDIA ne doivent pas être utilisées pour la réduction aiguë de la tension artérielle.
Une hypotension sévère et/ou une augmentation des besoins en volume de liquide ont été rapportées chez des patients recevant PROCARDIA 30 mg en association avec un agent bêta-bloquant et ayant subi un pontage aorto-coronarien sous anesthésie à forte dose de fentanyl. L'interaction avec le fentanyl à forte dose semble être due à l'association de PROCARDIA et d'un bêta-bloquant, mais la possibilité qu'elle puisse se produire avec PROCARDIA 30 mg seul, avec de faibles doses de fentanyl, dans d'autres interventions chirurgicales ou avec d'autres analgésiques narcotiques ne peut être exclu. Chez les patients traités par PROCARDIA chez qui une intervention chirurgicale utilisant une anesthésie à forte dose de fentanyl est envisagée, le médecin doit être conscient de ces problèmes potentiels et, si l'état du patient le permet, un délai suffisant (au moins 36 heures) doit être accordé pour que PROCARDIA 30 mg soit lavé de le corps avant la chirurgie.
Augmentation de l'angine de poitrine et/ou de l'infarctus du myocarde
Rarement, les patients, en particulier ceux qui ont une maladie coronarienne obstructive sévère, ont développé une augmentation bien documentée de la fréquence, de la durée et/ou de la gravité de l'angor ou de l'infarctus aigu du myocarde au début de PROCARDIA 30 mg ou au moment de l'augmentation de la posologie. Le mécanisme de cet effet n'est pas établi.
Plusieurs essais randomisés bien contrôlés ont étudié l'utilisation de la nifédipine à libération immédiate chez des patients qui venaient de subir un infarctus du myocarde. Dans aucun de ces essais, la nifédipine à libération immédiate n'a semblé apporter de bénéfice. Dans certains des essais, les patients qui ont reçu de la nifédipine à libération immédiate ont eu des résultats significativement moins bons que les patients qui ont reçu un placebo. Les gélules de PROCARDIA 30 mg ne doivent pas être administrées au cours de la première semaine ou des deux premières semaines après un infarctus du myocarde, et elles doivent également être évitées dans le cadre d'un syndrome coronarien aigu (lorsque l'infarctus peut être imminent).
Utilisation dans l'hypertension essentielle
PROCARDIA 30 mg et d'autres gélules de nifédipine à libération immédiate ont également été utilisés pour le contrôle à long terme de l'hypertension essentielle, bien que les gélules de PROCARDIA 30 mg n'aient pas été approuvées à cette fin et qu'aucune étude correctement contrôlée n'ait été menée pour définir une dose ou un intervalle de dose approprié. pour un tel traitement. PROCARDIA 30mg gélules ne doit pas être utilisé pour le contrôle de l'hypertension artérielle essentielle.
Retrait du bêta-bloquant
Les patients récemment arrêtés de bêta-bloquants peuvent développer un syndrome de sevrage avec augmentation de l'angor, probablement lié à une sensibilité accrue aux catécholamines. L'initiation du traitement par PROCARDIA 30 mg n'empêchera pas cet événement et on peut s'attendre à ce qu'il l'exacerbe en provoquant une libération réflexe de catécholamines. Il y a eu des rapports occasionnels d'angor accru dans un contexte de sevrage de bêta-bloquant et d'initiation à PROCARDIA. Il est important de diminuer les bêta-bloquants si possible, plutôt que de les arrêter brusquement avant de commencer PROCARDIA.
Insuffisance cardiaque congestive
Rarement, des patients, généralement ceux recevant un bêta-bloquant, ont développé une insuffisance cardiaque après avoir commencé PROCARDIA. Les patients présentant une sténose aortique serrée peuvent être plus à risque d'un tel événement, car l'effet de décharge de PROCARDIA 30 mg devrait être moins bénéfique pour ces patients, en raison de leur impédance fixe à traverser la valve aortique.
PRÉCAUTIONS
Général
Hypotension
Étant donné que PROCARDIA diminue la résistance vasculaire périphérique, une surveillance attentive de la pression artérielle lors de l'administration initiale et de la titration de PROCARDIA 30 mg est suggérée. Une surveillance étroite est particulièrement recommandée pour les patients qui prennent déjà des médicaments connus pour abaisser la tension artérielle. (Voir AVERTISSEMENTS .)
Œdème périphérique
Un œdème périphérique léger à modéré, généralement associé à une vasodilatation artérielle et non dû à un dysfonctionnement ventriculaire gauche, survient chez environ un patient sur dix traités par PROCARDIA (nifédipine). Cet œdème survient principalement dans les membres inférieurs et répond généralement à un traitement diurétique. Chez les patients dont l'angor est compliqué d'une insuffisance cardiaque congestive, il faut veiller à différencier cet œdème périphérique des effets d'une dysfonction ventriculaire gauche croissante.
Tests de laboratoire
Des élévations rares, généralement transitoires mais parfois significatives d'enzymes telles que la phosphatase alcaline, la CPK, la LDH, la SGOT et la SGPT ont été notées. La relation avec le traitement par PROCARDIA est incertaine dans la plupart des cas, mais probable dans certains cas. Ces anomalies de laboratoire ont rarement été associées à des symptômes cliniques ; cependant, une cholestase avec ou sans ictère a été rapportée. De rares cas d'hépatite allergique ont été rapportés.
PROCARDIA 30mg, comme les autres inhibiteurs calciques, diminue l'agrégation plaquettaire in vitro. Des études cliniques limitées ont démontré une diminution modérée mais statistiquement significative de l'agrégation plaquettaire et une augmentation du temps de saignement chez certains patients sous PROCARDIA. On pense que cela est une fonction de l'inhibition du transport du calcium à travers la membrane plaquettaire. Aucune signification clinique de ces résultats n'a été démontrée.
Des résultats positifs au test de Coombs direct avec/sans anémie hémolytique ont été rapportés, mais une relation causale entre l'administration de PROCARDIA et la positivité de ce test de laboratoire, y compris l'hémolyse, n'a pas pu être déterminée.
Bien que PROCARDIA 30 mg ait été utilisé en toute sécurité chez des patients atteints de dysfonctionnement rénal et qu'il ait été rapporté qu'il exerçait un effet bénéfique, dans certains cas, de rares élévations réversibles de l'azote uréique sanguin et de la créatinine sérique ont été rapportées chez des patients présentant une insuffisance rénale chronique préexistante. La relation avec le traitement par PROCARDIA est incertaine dans la plupart des cas, mais probable dans certains cas.
Carcinogenèse, mutagenèse, altération de la fertilité
La nifédipine a été administrée par voie orale à des rats pendant deux ans et ne s'est pas avérée cancérigène. Lorsqu'elle a été administrée à des rats avant l'accouplement, la nifédipine a provoqué une réduction de la fertilité à une dose d'environ 5 fois la dose humaine maximale recommandée. Il existe un rapport de la littérature sur la réduction réversible de la capacité du sperme humain obtenu à partir d'un nombre limité d'hommes infertiles prenant les doses recommandées de nifédipine à se lier à un ovule et à le féconder in vitro. Les études de mutagénicité in vivo se sont révélées négatives.
Grossesse
Il a été démontré que la nifédipine produit des effets tératogènes chez le rat et le lapin, y compris des anomalies digitales similaires à celles rapportées pour la phénytoïne. Des anomalies digitales ont été signalées chez d'autres membres de la classe des dihydropyridines et sont peut-être le résultat d'un débit sanguin utérin compromis. L'administration de nifédipine a été associée à une variété d'effets embryotoxiques, placentotoxiques et fœtotoxiques, y compris des fœtus rabougris (rats, souris, lapins), des déformations des côtes (souris), une fente palatine (souris), de petits placentas et des villosités choriales sous-développées (singes), des et mort fœtale (rats, souris, lapins) et grossesse prolongée/diminution de la survie néonatale (rats ; non évalué chez d'autres espèces). En mg/kg, toutes les doses associées aux effets tératogènes embryotoxiques ou fœtotoxiques chez l'animal étaient supérieures (de 5 à 50 fois) à la dose humaine maximale recommandée de 120 mg/jour. Sur une base en mg/m², certaines doses étaient supérieures et d'autres inférieures à la dose humaine maximale recommandée, mais toutes se situaient dans un ordre de grandeur de celle-ci. Les doses associées à des effets placentotoxiques chez les singes étaient équivalentes ou inférieures à la dose maximale recommandée chez l'homme exprimée en mg/m².
Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. PROCARDIA ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel.
Lactation
La nifédipine est transférée par le lait maternel. PROCARDIA ne doit être utilisé pendant l'allaitement que si le bénéfice potentiel justifie le risque potentiel.
Utilisation pédiatrique
L'innocuité et l'efficacité chez les patients pédiatriques n'ont pas été établies. L'utilisation dans la population pédiatrique n'est pas recommandée.
Utilisation gériatrique
L'âge semble avoir un effet significatif sur la pharmacocinétique de la nifédipine. La clairance est diminuée entraînant une ASC plus élevée chez les personnes âgées. Ces modifications ne sont pas dues à des modifications de la fonction rénale (voir PHARMACOLOGIE CLINIQUE , Pharmacocinétique ).
SURDOSAGE
L'expérience avec le surdosage de nifédipine est limitée. En règle générale, un surdosage de nifédipine entraînant une hypotension prononcée nécessite un soutien cardiovasculaire actif comprenant une surveillance de la fonction cardiovasculaire et respiratoire, une élévation des extrémités et une utilisation judicieuse d'une perfusion de calcium, d'agents vasopresseurs et de liquides. On s'attendrait à ce que la clairance de la nifédipine soit prolongée chez les patients présentant une fonction hépatique altérée. Étant donné que la nifédipine est fortement liée aux protéines, la dialyse ne présentera probablement aucun avantage; cependant, la plasmaphérèse peut être bénéfique.
CONTRE-INDICATIONS
Réaction d'hypersensibilité connue à PROCARDIA.
PHARMACOLOGIE CLINIQUE
PROCARDIA est un inhibiteur de l'influx d'ions calcium (inhibiteur des canaux lents ou antagoniste des ions calcium) et inhibe l'influx transmembranaire d'ions calcium dans le muscle cardiaque et le muscle lisse. Les processus contractiles du muscle cardiaque et du muscle lisse vasculaire dépendent du mouvement des ions calcium extracellulaires dans ces cellules par des canaux ioniques spécifiques. PROCARDIA 30 mg inhibe sélectivement l'influx d'ions calcium à travers la membrane cellulaire du muscle cardiaque et du muscle lisse vasculaire sans modifier les concentrations sériques de calcium.
Mécanisme d'action
Les moyens précis par lesquels cette inhibition soulage l'angine de poitrine n'ont pas été entièrement déterminés, mais comprennent au moins les deux mécanismes suivants :
Relaxation et prévention du spasme de l'artère coronaire
PROCARDIA dilate les principales artères coronaires et les artérioles coronaires, tant dans les régions normales qu'ischémiques, et est un puissant inhibiteur des spasmes des artères coronaires, qu'ils soient spontanés ou induits par l'ergonovine. Cette propriété augmente l'apport d'oxygène au myocarde chez les patients atteints de spasme de l'artère coronaire et est responsable de l'efficacité de PROCARDIA 30 mg dans l'angor vasospastique (de Prinzmetal ou variante). Il n'est pas clair si cet effet joue un rôle dans l'angor classique, mais les études sur la tolérance à l'exercice n'ont pas montré d'augmentation du produit fréquence d'exercice maximale-pression, une mesure largement acceptée de l'utilisation de l'oxygène. Cela suggère qu'en général, le soulagement des spasmes ou la dilatation des artères coronaires n'est pas un facteur important dans l'angor classique.
Réduction de l'utilisation de l'oxygène
PROCARDIA réduit régulièrement la pression artérielle au repos et à un niveau d'exercice donné en dilatant les artérioles périphériques et en réduisant la résistance périphérique totale (postcharge) contre laquelle travaille le cœur. Cette décharge du cœur réduit la consommation d'énergie du myocarde et les besoins en oxygène et explique probablement l'efficacité de PROCARDIA dans l'angor stable chronique.
Pharmacocinétique et métabolisme
PROCARDIA est rapidement et complètement absorbé après administration orale. Le médicament est détectable dans le sérum 10 minutes après l'administration orale et les concentrations sanguines maximales se produisent en 30 minutes environ. La biodisponibilité est proportionnelle à la dose de 10 à 30 mg ; la demi-vie ne change pas significativement avec la dose. Il y a peu de différence dans la biodisponibilité relative lorsque les gélules de PROCARDIA sont administrées par voie orale et soit avalées entières, mordues et avalées, soit mordues et tenues par voie sublinguale. Cependant, mordre la gélule avant de l'avaler entraîne des concentrations plasmatiques légèrement plus précoces (27 ng/mL 10 minutes après 10 mg) que si les gélules sont avalées intactes. PROCARDIA 30mg est fortement lié aux protéines sériques. PROCARDIA est largement converti en métabolites inactifs et environ 80 % de PROCARDIA 30 mg et de ses métabolites sont éliminés par les reins. La demi-vie d'élimination de la nifédipine est d'environ deux heures. Étant donné que la biotransformation hépatique est la principale voie d'élimination de la nifédipine, la pharmacocinétique peut être modifiée chez les patients atteints d'une maladie hépatique chronique. Les patients atteints d'insuffisance hépatique (cirrhose du foie) ont une demi-vie de disposition plus longue et une biodisponibilité de la nifédipine plus élevée que les volontaires sains. Le degré de liaison aux protéines sériques de la nifédipine est élevé (92-98%). La liaison aux protéines peut être fortement réduite chez les patients atteints d'insuffisance rénale ou hépatique.
Après administration intraveineuse, la clairance de la nifédipine a diminué de 33 % chez les sujets sains âgés par rapport aux jeunes sujets sains.
Hémodynamique
Comme les autres inhibiteurs des canaux lents, PROCARDIA exerce un effet inotrope négatif sur le tissu myocardique isolé. Ceci est rarement, voire jamais, observé chez les animaux intacts ou l'homme, probablement en raison de réponses réflexes à ses effets vasodilatateurs. Chez l'homme, PROCARDIA 30mg provoque une diminution des résistances vasculaires périphériques et une chute des pressions systolique et diastolique, généralement modeste (5-10 mm Hg systolique), mais parfois plus importante. Il y a généralement une petite augmentation de la fréquence cardiaque, une réponse réflexe à la vasodilatation. Les mesures de la fonction cardiaque chez les patients ayant une fonction ventriculaire normale ont généralement trouvé une petite augmentation de l'index cardiaque sans effets majeurs sur la fraction d'éjection, la pression télédiastolique ventriculaire gauche (LVEDP) ou le volume (LVEDV). Chez les patients dont la fonction ventriculaire est altérée, la plupart des études aiguës ont montré une certaine augmentation de la fraction d'éjection et une réduction de la pression de remplissage ventriculaire gauche.
Effets électrophysiologiques
Bien que, comme les autres membres de sa classe, PROCARDIA diminue la fonction du nœud sino-auriculaire et la conduction auriculo-ventriculaire dans des préparations myocardiques isolées, de tels effets n'ont pas été observés dans des études chez des animaux intacts ou chez l'homme. Dans des études électrophysiologiques formelles, principalement chez des patients ayant des systèmes de conduction normaux, PROCARDIA 30 mg n'a eu aucune tendance à prolonger la conduction auriculo-ventriculaire, à prolonger le temps de récupération du nœud sinusal ou à ralentir la fréquence sinusale.
INFORMATIONS PATIENTS
Aucune information fournie. Veuillez vous référer au AVERTISSEMENTS et PRÉCAUTIONS sections.
