Catapres 100mcg Clonidine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Catapres et comment est-il utilisé ?
Catapres est un médicament d'ordonnance utilisé pour traiter les symptômes de l'hypertension artérielle, du trouble déficitaire de l'attention avec hyperactivité (TDAH) et de la douleur cancéreuse. Catapres 100mcg peut être utilisé seul ou avec d'autres médicaments.
Catapres 100mcg appartient à une classe de médicaments appelés agonistes Alpha2, agents à action centrale, TDAH.
On ne sait pas si Catapres 100mcg est sûr et efficace chez les enfants de moins de 12 ans.
Quels sont les effets secondaires possibles de Catapres ?
Catapres peut provoquer des effets secondaires graves, notamment :
- les symptômes de sevrage,
- nervosité,
- agitation,
- mal de tête,
- tremblement, et
- augmentation rapide de la pression artérielle
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Catapres 100mcg incluent :
- bouche sèche,
- vertiges,
- somnolence,
- fatigue,
- constipation,
- mal de tête,
- des nausées et
- troubles du sommeil (insomnie)
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Catapres. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
Catapres® (chlorhydrate de clonidine, USP) est un agent hypotenseur alpha-agoniste à action centrale disponible sous forme de comprimés pour administration orale en trois dosages : 0,1 mg, 0,2 mg et 0,3 mg. Le comprimé de 0,1 mg équivaut à 0,087 mg de base libre.
Les ingrédients inactifs sont le dioxyde de silicium colloïdal, l'amidon de maïs, le phosphate de calcium dibasique, le jaune FD&C n° 6, la gélatine, la glycérine, le lactose et le stéarate de magnésium. Le comprimé Catapres 0,1 mg contient également FD&C Blue No.1 et FD&C Red No.3.
Le chlorhydrate de clonidine est un dérivé de l'imidazoline et existe sous forme de composé mésomère. Le nom chimique est le chlorhydrate de 2-(2,6-dichlorophénylamino)-2-imidazoline. Voici la formule structurale :
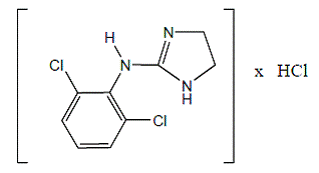 C9H9Cl2N3 · HCl Mol. Poids 266,56
C9H9Cl2N3 · HCl Mol. Poids 266,56 Le chlorhydrate de clonidine est une substance cristalline inodore, amère, blanche, soluble dans l'eau et l'alcool.
LES INDICATIONS
Les comprimés CATAPRES sont indiqués dans le traitement de l'hypertension. Les comprimés CATAPRES peuvent être utilisés seuls ou en association avec d'autres agents antihypertenseurs.
DOSAGE ET ADMINISTRATION
Adultes
La dose de comprimés Catapres® (chlorhydrate de clonidine, USP) doit être ajustée en fonction de la réponse tensionnelle individuelle du patient. Voici un guide général de son administration.
Dose initiale
Comprimé à 0,1 mg deux fois par jour (matin et coucher). Les patients âgés peuvent bénéficier d'une dose initiale plus faible.
Dose d'entretien
Des augmentations supplémentaires de 0,1 mg par jour peuvent être effectuées à des intervalles hebdomadaires si nécessaire jusqu'à ce que la réponse souhaitée soit atteinte. La prise de la plus grande partie de la dose orale quotidienne au coucher peut minimiser les effets d'adaptation transitoires de la bouche sèche et de la somnolence. Les doses thérapeutiques les plus couramment employées vont de 0,2 mg à 0,6 mg par jour administrées en doses fractionnées. Des études ont indiqué que 2,4 mg est la dose quotidienne efficace maximale, mais des doses aussi élevées ont rarement été utilisées.
Insuffisance rénale
Les patients atteints d'insuffisance rénale peuvent bénéficier d'une dose initiale plus faible. Les patients doivent être étroitement surveillés. Étant donné que seule une quantité minimale de clonidine est éliminée au cours de l'hémodialyse de routine, il n'est pas nécessaire de donner de la clonidine supplémentaire après la dialyse.
COMMENT FOURNIE
Les comprimés Catapres® (chlorhydrate de clonidine, USP) sont fournis comme suit :
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15°-30°C (59°-86°F) [voir Température ambiante contrôlée USP ].
Distribuer dans un récipient étanche et résistant à la lumière.
Distribué par : Boehringer Ingelheim Pharmaceuticals, Inc., Ridgefield, CT 06877 États-Unis. Fabriqué par : Boehringer Ingelheim Promeco SA de CV, Mexico, Mexique. Autorisé par : Boehringer Ingelheim, International GmbH Révisé : Mai 2012
EFFETS SECONDAIRES
La plupart des effets indésirables sont légers et ont tendance à diminuer avec la poursuite du traitement. Les plus fréquents (qui semblent liés à la dose) sont la bouche sèche, survenant chez environ 40 patients sur 100 ; somnolence, environ 33 sur 100 ; étourdissements, environ 16 sur 100 ; constipation et sédation, chacun environ 10 sur 100.
Les effets indésirables moins fréquents suivants ont également été signalés chez des patients recevant des comprimés de CATAPRES 100 mcg, mais dans de nombreux cas, les patients recevaient des médicaments concomitants et une relation causale n'a pas été établie.
Corps dans son ensemble : Fatigue, fièvre, maux de tête, pâleur, faiblesse et syndrome de sevrage. Un test de Coombs faiblement positif et une sensibilité accrue à l'alcool ont également été signalés.
Cardiovasculaire: Bradycardie, insuffisance cardiaque congestive, anomalies électrocardiographiques (c.-à-d. arrêt du nœud sinusal, bradycardie jonctionnelle, bloc AV de haut degré et arythmies), symptômes orthostatiques, palpitations, phénomène de Raynaud, syncope et tachycardie. Des cas de bradycardie sinusale et de bloc auriculo-ventriculaire ont été rapportés, avec et sans l'utilisation concomitante de digitaliques.
Système nerveux central: Agitation, anxiété, délire, perception délirante, hallucinations (y compris visuelles et auditives), insomnie, dépression mentale, nervosité, autres changements de comportement, paresthésie, agitation, troubles du sommeil et rêves ou cauchemars intenses.
Dermatologique : Alopécie, œdème de Quincke, urticaire, prurit, rash et urticaire.
Gastro-intestinal : Douleurs abdominales, anorexie, constipation, hépatite, malaise, anomalies transitoires légères des tests de la fonction hépatique, nausées, parotidite, pseudo-obstruction (y compris pseudo-obstruction colique), douleur des glandes salivaires et vomissements.
Génito-urinaire : Diminution de l'activité sexuelle, difficulté à uriner, dysfonction érectile, perte de libido, nycturie et rétention urinaire.
Hématologique : Thrombocytopénie.
Métabolique: Gynécomastie, élévation transitoire de la glycémie ou de la créatine phosphokinase sérique et prise de poids.
Musculo-squelettique : Crampes dans les jambes et douleurs musculaires ou articulaires.
Oro-oto-rhino-laryngé : Sécheresse de la muqueuse nasale.
Ophtalmologique : Trouble de l'accommodation, vision floue, brûlure des yeux, diminution du larmoiement et sécheresse des yeux.
INTERACTIONS MÉDICAMENTEUSES
La clonidine peut potentialiser les effets dépressifs sur le SNC de l'alcool, des barbituriques ou d'autres médicaments sédatifs. Si un patient recevant du chlorhydrate de clonidine prend également des antidépresseurs tricycliques, l'effet hypotenseur de la clonidine peut être réduit, nécessitant une augmentation de la dose de clonidine. Si un patient recevant de la clonidine prend également des neuroleptiques, des troubles de la régulation orthostatique (par exemple, hypotension orthostatique, étourdissements, fatigue) peuvent être induits ou exacerbés.
Surveiller la fréquence cardiaque chez les patients recevant de la clonidine en même temps que des agents connus pour affecter la fonction du nœud sinusal ou la conduction du nœud AV, par exemple, la digitaline, les inhibiteurs calciques et les bêta-bloquants. Une bradycardie sinusale entraînant une hospitalisation et l'insertion d'un stimulateur cardiaque a été rapportée en association avec l'utilisation concomitante de clonidine et de diltiazem ou de vérapamil.
L'amitriptyline en association avec la clonidine augmente la manifestation des lésions cornéennes chez le rat (voir Toxicologie ).
Sur la base d'observations chez des patients en état de délire alcoolique, il a été suggéré que des doses intraveineuses élevées de clonidine peuvent augmenter le potentiel arythmogène (allongement de l'intervalle QT, fibrillation ventriculaire) de fortes doses intraveineuses d'halopéridol. La relation causale et la pertinence des comprimés oraux de clonidine n'ont pas été établies.
AVERTISSEMENTS
Retrait
Les patients doivent être informés de ne pas interrompre le traitement sans consulter leur médecin. L'arrêt brutal du traitement par la clonidine a, dans certains cas, entraîné des symptômes tels que nervosité, agitation, céphalées et tremblements accompagnés ou suivis d'une augmentation rapide de la pression artérielle et de concentrations élevées de catécholamines dans le plasma. La probabilité de telles réactions à l'arrêt du traitement par la clonidine semble être plus élevée après l'administration de doses plus élevées ou la poursuite d'un traitement bêta-bloquant concomitant et une prudence particulière est donc recommandée dans ces situations. De rares cas d'encéphalopathie hypertensive, d'accidents vasculaires cérébraux et de décès ont été signalés après l'arrêt de la clonidine. Lors de l'arrêt du traitement par les comprimés CATAPRES, le médecin doit réduire progressivement la dose sur 2 à 4 jours pour éviter les symptômes de sevrage.
Une augmentation excessive de la pression artérielle après l'arrêt du traitement par les comprimés CATAPRES 100 mcg peut être inversée par l'administration de chlorhydrate de clonidine par voie orale ou par la phentolamine intraveineuse. Si le traitement doit être interrompu chez les patients recevant simultanément un bêta-bloquant et de la clonidine, le bêta-bloquant doit être arrêté plusieurs jours avant l'arrêt progressif des comprimés CATAPRES 100 mcg.
Étant donné que les enfants souffrent généralement de maladies gastro-intestinales entraînant des vomissements, ils peuvent être particulièrement sensibles aux épisodes d'hypertension résultant d'une incapacité soudaine à prendre des médicaments.
PRÉCAUTIONS
Général
Chez les patients qui ont développé une sensibilisation de contact localisée à Catapres-TTS® (clonidine), la poursuite de Catapres-TTS ou la substitution d'un traitement oral au chlorhydrate de clonidine peut être associée au développement d'une éruption cutanée généralisée.
Chez les patients qui développent une réaction allergique à Catapres-TTS, la substitution du chlorhydrate de clonidine par voie orale peut également provoquer une réaction allergique (notamment éruption cutanée généralisée, urticaire ou œdème de Quincke).
L'action sympatholytique de la clonidine peut aggraver le dysfonctionnement du nœud sinusal et le bloc auriculo-ventriculaire (AV), en particulier chez les patients prenant d'autres médicaments sympatholytiques. Il existe des rapports post-commercialisation de patients présentant des anomalies de la conduction et/ou prenant d'autres médicaments sympatholytiques qui ont développé une bradycardie sévère nécessitant de l'atropine IV, de l'isoprotérénol IV et une stimulation cardiaque temporaire pendant qu'ils prenaient de la clonidine.
Dans l'hypertension artérielle causée par un phéochromocytome, aucun effet thérapeutique des comprimés CATAPRES 100 mcg ne peut être attendu.
Utilisation périopératoire
L'administration de comprimés Catapres® (chlorhydrate de clonidine, USP) doit être poursuivie dans les 4 heures suivant la chirurgie et reprise dès que possible par la suite. La pression artérielle doit être soigneusement surveillée pendant la chirurgie et des mesures supplémentaires pour contrôler la pression artérielle doivent être disponibles si nécessaire.
Carcinogenèse, mutagenèse, altération de la fertilité
L'administration alimentaire chronique de clonidine n'a pas été cancérogène pour les rats (132 semaines) ou les souris (78 semaines) dosés, respectivement, jusqu'à 46 ou 70 fois la dose humaine quotidienne maximale recommandée en mg/kg (9 ou 6 fois la MRDHD sur un mg/m²). Il n'y avait aucune preuve de génotoxicité dans le test d'Ames pour la mutagénicité ou le test du micronoyau de souris pour la clastogénicité.
La fertilité des rats mâles ou femelles n'a pas été affectée par des doses de clonidine aussi élevées que 150 μg/kg (environ 3 fois le MRDHD). Dans une expérience distincte, la fertilité des rats femelles a semblé être affectée à des niveaux de dose de 500 à 2000 μg/kg (10 à 40 fois le MRDHD oral sur une base mg/kg ; 2 à 8 fois le MRDHD sur une base mg/m² ).
Grossesse
Effets tératogènes
Catégorie de grossesse C
Les études de reproduction réalisées chez des lapins à des doses allant jusqu'à environ 3 fois la dose humaine quotidienne maximale recommandée par voie orale (MRDHD) de comprimés Catapres® (chlorhydrate de clonidine, USP) n'ont produit aucune preuve d'un potentiel tératogène ou embryotoxique chez le lapin. Chez les rats, cependant, des doses aussi faibles que 1/3 du MRDHD oral (1/15 du MRDHD sur une base mg/m²) de clonidine ont été associées à une augmentation des résorptions dans une étude dans laquelle les mères ont été traitées en continu à partir de 2 mois avant l'accouplement. . Des résorptions accrues n'ont pas été associées au traitement en même temps ou à des doses plus élevées (jusqu'à 3 fois le MRDHD oral) lorsque les mères ont été traitées les jours de gestation 6 à 15. Des augmentations de la résorption ont été observées à des doses beaucoup plus élevées (40 fois la MRDHD orale sur une base de mg/kg ; 4 à 8 fois la MRDHD sur une base de mg/m²) chez les souris et les rats traités les jours de gestation 1 à 14 (la dose la plus faible employée dans l'étude était de 500 μg/kg).
Aucune étude adéquate et bien contrôlée n'a été menée chez la femme enceinte. La clonidine traverse la barrière placentaire (voir PHARMACOLOGIE CLINIQUE , Pharmacocinétique ). Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Mères allaitantes
Comme le chlorhydrate de clonidine est excrété dans le lait maternel, la prudence s'impose lorsque les comprimés de CATAPRES 100 mcg sont administrés à une femme qui allaite.
Utilisation pédiatrique
L'innocuité et l'efficacité chez les patients pédiatriques n'ont pas été établies dans des essais adéquats et bien contrôlés (voir AVERTISSEMENTS , Retrait ).
SURDOSAGE
L'hypertension peut se développer tôt et peut être suivie d'hypotension, de bradycardie, de dépression respiratoire, d'hypothermie, de somnolence, de réflexes diminués ou absents, de faiblesse, d'irritabilité et de myosis. La fréquence de la dépression du SNC peut être plus élevée chez les enfants que chez les adultes. Des surdosages importants peuvent entraîner des troubles réversibles de la conduction cardiaque ou des troubles du rythme, de l'apnée, un coma et des convulsions. Les signes et symptômes de surdosage apparaissent généralement dans les 30 minutes à deux heures suivant l'exposition. Aussi peu que 0,1 mg de clonidine a produit des signes de toxicité chez les enfants.
Il n'y a pas d'antidote spécifique pour le surdosage de clonidine. Le surdosage de clonidine peut entraîner le développement rapide d'une dépression du SNC ; par conséquent, l'induction de vomissements avec du sirop d'ipéca n'est pas recommandée. Un lavage gastrique peut être indiqué après des ingestions récentes et/ou importantes. L'administration de charbon activé et/ou d'un cathartique peut être bénéfique. Les soins de soutien peuvent inclure du sulfate d'atropine pour la bradycardie, des fluides intraveineux et/ou des agents vasopresseurs pour l'hypotension et des vasodilatateurs pour l'hypertension. La naloxone peut être un complément utile pour la prise en charge de la dépression respiratoire induite par la clonidine, de l'hypotension et/ou du coma ; la pression artérielle doit être surveillée car l'administration de naloxone a parfois entraîné une hypertension paradoxale. Il est peu probable que la dialyse améliore de manière significative l'élimination de la clonidine.
La plus grande surdose signalée à ce jour concernait un homme de 28 ans qui avait ingéré 100 mg de poudre de chlorhydrate de clonidine. Ce patient a développé une hypertension suivie d'hypotension, de bradycardie, d'apnée, d'hallucinations, de semi-coma et de contractions ventriculaires prématurées. Le patient a complètement récupéré après un traitement intensif. Les taux plasmatiques de clonidine étaient de 60 ng/ml après 1 heure, 190 ng/ml après 1,5 heure, 370 ng/ml après 2 heures et 120 ng/ml après 5,5 et 6,5 heures. Chez la souris et le rat, la DL50 orale de la clonidine est respectivement de 206 et 465 mg/kg.
CONTRE-INDICATIONS
Les comprimés Catapres® (chlorhydrate de clonidine, USP) ne doivent pas être utilisés chez les patients présentant une hypersensibilité connue à la clonidine (voir PRÉCAUTIONS ).
PHARMACOLOGIE CLINIQUE
La clonidine stimule les récepteurs alpha-adrénergiques dans le tronc cérébral. Cette action entraîne une diminution du débit sympathique du système nerveux central et une diminution de la résistance périphérique, de la résistance vasculaire rénale, de la fréquence cardiaque et de la tension artérielle. Les comprimés CATAPRES 100mcg agissent relativement rapidement. La tension artérielle du patient diminue dans les 30 à 60 minutes après une dose orale, la diminution maximale se produisant dans les 2 à 4 heures. Le débit sanguin rénal et le taux de filtration glomérulaire restent essentiellement inchangés. Les réflexes posturaux normaux sont intacts; par conséquent, les symptômes orthostatiques sont légers et peu fréquents.
Des études aiguës avec le chlorhydrate de clonidine chez l'homme ont démontré une réduction modérée (15 % à 20 %) du débit cardiaque en décubitus dorsal sans modification de la résistance périphérique : à une inclinaison de 45 °, il y a une réduction plus faible du débit cardiaque et une diminution de résistance périphérique. Au cours d'un traitement à long terme, le débit cardiaque a tendance à revenir aux valeurs de contrôle, tandis que la résistance périphérique reste diminuée. Un ralentissement du pouls a été observé chez la plupart des patients recevant de la clonidine, mais le médicament ne modifie pas la réponse hémodynamique normale à l'exercice.
Une tolérance à l'effet antihypertenseur peut se développer chez certains patients, nécessitant une réévaluation du traitement.
D'autres études chez des patients ont mis en évidence une réduction de l'activité rénine plasmatique et de l'excrétion d'aldostérone et de catécholamines. La relation exacte entre ces actions pharmacologiques et l'effet antihypertenseur de la clonidine n'a pas été entièrement élucidée.
La clonidine stimule de manière aiguë la libération de l'hormone de croissance chez les enfants et les adultes, mais ne produit pas d'élévation chronique de l'hormone de croissance lors d'une utilisation à long terme.
Pharmacocinétique
La pharmacocinétique de la clonidine est proportionnelle à la dose dans la plage de 100 à 600 μg. La biodisponibilité absolue de la clonidine par voie orale est de 70 % à 80 %. Les concentrations plasmatiques maximales de clonidine sont atteintes en environ 1 à 3 heures.
Après administration intraveineuse, la clonidine présente une disposition biphasique avec une demi-vie de distribution d'environ 20 minutes et une demi-vie d'élimination allant de 12 à 16 heures. La demi-vie augmente jusqu'à 41 heures chez les patients présentant une insuffisance rénale sévère. La clonidine traverse la barrière placentaire. Il a été démontré qu'il traverse la barrière hémato-encéphalique chez le rat.
Après administration orale, environ 40 à 60 % de la dose absorbée sont récupérés dans les urines sous forme inchangée en 24 heures. Environ 50 % de la dose absorbée est métabolisée dans le foie. Ni la nourriture ni la race du patient n'influencent la pharmacocinétique de la clonidine.
L'effet antihypertenseur est atteint à des concentrations plasmatiques comprises entre environ 0,2 et 2,0 ng/mL chez les patients ayant une fonction excrétrice normale. Une augmentation supplémentaire des taux plasmatiques n'augmentera pas l'effet antihypertenseur.
Toxicologie
Dans plusieurs études avec le chlorhydrate de clonidine par voie orale, une augmentation dose-dépendante de l'incidence et de la gravité de la dégénérescence rétinienne spontanée a été observée chez des rats albinos traités pendant six mois ou plus. Des études de distribution tissulaire chez le chien et le singe ont montré une concentration de clonidine dans la choroïde.
Compte tenu de la dégénérescence rétinienne observée chez les rats, des examens oculaires ont été effectués au cours des essais cliniques chez 908 patients avant et périodiquement après le début du traitement par la clonidine. Chez 353 de ces 908 patients, les examens de la vue ont été effectués sur des périodes de 24 mois ou plus. À l'exception d'une certaine sécheresse des yeux, aucun résultat ophtalmologique anormal lié au médicament n'a été enregistré et, selon des tests spécialisés tels que l'électrorétinographie et l'éblouissement maculaire, la fonction rétinienne était inchangée.
En association avec l'amitriptyline, l'administration de chlorhydrate de clonidine a entraîné le développement de lésions cornéennes chez le rat dans les 5 jours.
INFORMATIONS PATIENTS
Les patients doivent être avertis de ne pas interrompre le traitement par CATAPRES 100 mcg comprimés sans l'avis de leur médecin.
Étant donné que les patients peuvent ressentir un effet sédatif, des étourdissements ou un trouble de l'accommodation avec l'utilisation de la clonidine, avertissez les patients de s'engager dans des activités telles que la conduite d'un véhicule ou l'utilisation d'appareils ou de machines. Informez également les patients que cet effet sédatif peut être augmenté par l'utilisation concomitante d'alcool, de barbituriques ou d'autres médicaments sédatifs.
Les patients qui portent des lentilles de contact doivent être avertis que le traitement avec les comprimés CATAPRES peut provoquer une sécheresse des yeux.
