Coreg 3.12mg, 6.25mg, 12.5mg, 25mg Carvedilol Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Coreg 25 mg et comment est-il utilisé ?
Coreg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de l'insuffisance cardiaque et de l'hypertension artérielle (hypertension). Coreg 25 mg peut être utilisé seul ou avec d'autres médicaments.
Coreg appartient à une classe de médicaments appelés bêta-bloquants, activité alpha.
On ne sait pas si Coreg 25 mg est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Coreg ?
Coreg peut provoquer des effets secondaires graves, notamment :
- étourdissement,
- battements cardiaques lents ou irréguliers,
- sensation de froid ou engourdissement dans les doigts ou les orteils,
- douleur thoracique,
- toux sèche,
- respiration sifflante,
- oppression thoracique,
- gonflement,
- prise de poids rapide,
- sensation d'essoufflement,
- augmentation de la soif,
- augmentation de la miction,
- bouche sèche et
- odeur d'haleine fruitée
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Coreg 6,25 mg incluent :
- vertiges,
- battements de coeur lents,
- diarrhée,
- gain de poids,
- yeux secs et
- difficulté à utiliser des lentilles de contact
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Coreg. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
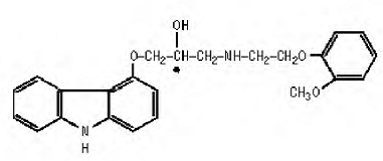
Le carvédilol est un agent bloquant β-adrénergique non sélectif avec une activité α1-bloquante. Il s'agit du (±)-1(Carbazol-4-yloxy)-3-[[2-(o-méthoxyphénoxy)éthyl]amino]-2-propanol. Le carvédilol est un mélange racémique dont la structure est la suivante :
COREG 6,25 mg est un comprimé blanc, ovale et pelliculé contenant 3,125 mg, 6,25 mg, 12,5 mg ou 25 mg de carvédilol. Les comprimés de 6,25 mg, 12,5 mg et 25 mg sont des comprimés TILTAB. Les ingrédients inactifs sont le dioxyde de silicium colloïdal, la crospovidone, l'hypromellose, le lactose, le stéarate de magnésium, le polyéthylène glycol, le polysorbate 80, la povidone, le saccharose et le dioxyde de titane.
Le carvédilol est une poudre blanche à blanc cassé avec un poids moléculaire de 406,5 et une formule moléculaire de C24H26N2O4. Il est librement soluble dans le diméthylsulfoxyde ; soluble dans le chlorure de méthylène et le méthanol; peu soluble dans l'éthanol à 95 % et l'isopropanol; légèrement soluble dans l'éther éthylique; et pratiquement insoluble dans l'eau, le liquide gastrique (simulé, TS, pH 1,1) et le liquide intestinal (simulé, TS sans pancréatine, pH 7,5).
LES INDICATIONS
Insuffisance cardiaque
COREG est indiqué pour le traitement de l'insuffisance cardiaque chronique légère à sévère d'origine ischémique ou cardiomyopathique, généralement en complément des diurétiques, des inhibiteurs de l'ECA et de la digitaline, pour augmenter la survie et, également, pour réduire le risque d'hospitalisation [voir INTERACTIONS MÉDICAMENTEUSES , Etudes cliniques ].
Dysfonctionnement ventriculaire gauche après un infarctus du myocarde
COREG est indiqué pour réduire la mortalité cardiovasculaire chez les patients cliniquement stables qui ont survécu à la phase aiguë d'un infarctus du myocarde et qui ont une fraction d'éjection ventriculaire gauche inférieure ou égale à 40 % (avec ou sans insuffisance cardiaque symptomatique) [voir Etudes cliniques ].
Hypertension
COREG 25 mg est indiqué pour la prise en charge de l'hypertension essentielle [voir Etudes cliniques ]. Il peut être utilisé seul ou en association avec d'autres antihypertenseurs, notamment les diurétiques de type thiazidique [voir INTERACTIONS MÉDICAMENTEUSES ].
DOSAGE ET ADMINISTRATION
COREG doit être pris avec de la nourriture pour ralentir le taux d'absorption et réduire l'incidence des effets orthostatiques.
Insuffisance cardiaque
LE DOSAGE DOIT ÊTRE INDIVIDUALISÉ ET SURVEILLÉ ÉTROITEMENT PAR UN MÉDECIN PENDANT L'APTITUDE. Avant l'initiation de COREG 12,5 mg, il est recommandé de minimiser la rétention d'eau. La dose initiale recommandée de COREG est de 3,125 mg deux fois par jour pendant 2 semaines. Si toléré, les patients peuvent voir leur dose augmentée à 6,25, 12,5 et 25 mg deux fois par jour sur des intervalles successifs d'au moins 2 semaines. Les patients doivent être maintenus à des doses plus faibles si des doses plus élevées ne sont pas tolérées. Une dose maximale de 50 mg deux fois par jour a été administrée à des patients souffrant d'insuffisance cardiaque légère à modérée pesant plus de 85 kg (187 lb).
Les patients doivent être informés que l'initiation du traitement et (dans une moindre mesure) les augmentations de la posologie peuvent être associées à des symptômes transitoires d'étourdissements ou d'étourdissements (et rarement de syncope) dans la première heure suivant l'administration. Pendant ces périodes, les patients doivent éviter les situations telles que la conduite automobile ou les tâches dangereuses, où les symptômes pourraient entraîner des blessures. Les symptômes vasodilatateurs ne nécessitent souvent pas de traitement, mais il peut être utile de séparer le moment de l'administration de COREG 6,25 mg de celui de l'inhibiteur de l'ECA ou de réduire temporairement la dose de l'inhibiteur de l'ECA. La dose de COREG 12,5 mg ne doit pas être augmentée tant que les symptômes d'aggravation de l'insuffisance cardiaque ou de vasodilatation ne se sont pas stabilisés.
La rétention d'eau (avec ou sans aggravation transitoire des symptômes d'insuffisance cardiaque) doit être traitée par une augmentation de la dose de diurétiques.
La dose de COREG doit être réduite si les patients connaissent une bradycardie (fréquence cardiaque inférieure à 55 battements par minute).
Les épisodes de vertiges ou de rétention d'eau pendant l'initiation de COREG 3,12 mg peuvent généralement être gérés sans interruption du traitement et n'empêchent pas une titration réussie ultérieure ou une réponse favorable au carvédilol.
Dysfonctionnement ventriculaire gauche après un infarctus du myocarde
LE DOSAGE DOIT ÊTRE INDIVIDUALISÉ ET CONTRÔLÉ PENDANT LA TITRATION. Le traitement avec COREG peut être commencé en tant que patient hospitalisé ou ambulatoire et doit être commencé après que le patient est hémodynamiquement stable et que la rétention d'eau a été minimisée. Il est recommandé de commencer COREG 3,12 mg à 6,25 mg deux fois par jour et d'augmenter après 3 à 10 jours, en fonction de la tolérance, à 12,5 mg deux fois par jour, puis à nouveau à la dose cible de 25 mg deux fois par jour. Une dose initiale plus faible peut être utilisée (3,125 mg deux fois par jour) et/ou la vitesse d'augmentation de la dose peut être ralentie si cela est cliniquement indiqué (p. Les patients doivent être maintenus à des doses plus faibles si des doses plus élevées ne sont pas tolérées. Le schéma posologique recommandé n'a pas besoin d'être modifié chez les patients qui ont reçu un traitement par un β-bloquant IV ou oral pendant la phase aiguë de l'infarctus du myocarde.
Hypertension
LE DOSAGE DOIT ÊTRE INDIVIDUALISÉ. La dose initiale recommandée de COREG 6,25 mg est de 6,25 mg deux fois par jour. Si cette dose est tolérée, en utilisant la pression systolique debout mesurée environ 1 heure après l'administration comme guide, la dose doit être maintenue pendant 7 à 14 jours, puis augmentée à 12,5 mg deux fois par jour si nécessaire, en fonction de la pression artérielle minimale, en utilisant à nouveau pression systolique debout 1 heure après l'administration comme guide de tolérance. Cette dose doit également être maintenue pendant 7 à 14 jours et peut ensuite être ajustée à la hausse jusqu'à 25 mg deux fois par jour si elle est tolérée et nécessaire. Le plein effet antihypertensive de COREG 6.25mg est vu au cours de 7 à 14 jours. La dose quotidienne totale ne doit pas dépasser 50 mg.
On peut s'attendre à ce que l'administration concomitante avec un diurétique produise des effets additifs et exagère la composante orthostatique de l'action du carvédilol.
Insuffisance hépatique
COREG 25 mg ne doit pas être administré aux patients présentant une insuffisance hépatique sévère [voir CONTRE-INDICATIONS ].
COMMENT FOURNIE
Posologie et points forts
Les comprimés blancs, ovales et pelliculés sont disponibles dans les dosages suivants :
- 3,125 mg – gravé « 39 » et « SB »
- 6,25 mg – gravé « 4140 » et « SB »
- 12,5 mg – gravé « 4141 » et « SB »
- 25 mg – gravé « 4142 » et « SB »
Stockage et manutention
Les comprimés blancs, ovales et pelliculés sont disponibles dans les dosages suivants :
- 3,125 mg – gravé « 39 » et « SB »
- 6,25 mg – gravé « 4140 » et « SB »
- 12,5 mg – gravé « 4141 » et « SB »
- 25 mg – gravé « 4142 » et « SB »
Les comprimés de 6,25 mg, 12,5 mg et 25 mg sont des comprimés TILTAB.
- 3,125 mg flacons de 100 : CDN 0007-4139-20
- 6,25 mg flacons de 100 : CDN 0007-4140-20
- Flacons de 12,5 mg de 100 : CDN 0007-4141-20
- 25 mg flacons de 100 : CDN 0007-4142-20
Conserver en dessous de 30°C (86°F). Protéger de l'humidité. Distribuer dans un récipient étanche et résistant à la lumière.
Fabriqué pour : GlaxoSmithKline Research Triangle Park, NC 27709. Révisé : septembre 2017.
EFFETS SECONDAIRES
Expérience des études cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
COREG 25 mg a été évalué pour la sécurité chez les sujets souffrant d'insuffisance cardiaque (légère, modérée et sévère), chez les sujets présentant un dysfonctionnement ventriculaire gauche suite à un infarctus du myocarde et chez les sujets hypertendus. Le profil d'effets indésirables observés correspondait à la pharmacologie du médicament et à l'état de santé des sujets des essais cliniques. Les événements indésirables rapportés pour chacune de ces populations de patients sont présentés ci-dessous. Sont exclus les événements indésirables considérés comme trop généraux pour être informatifs, et ceux qui ne sont pas raisonnablement associés à l'utilisation du médicament parce qu'ils étaient associés à la condition traitée ou sont très fréquents dans la population traitée. Les taux d'événements indésirables étaient généralement similaires dans tous les sous-ensembles démographiques (hommes et femmes, personnes âgées et non âgées, noirs et non noirs).
Insuffisance cardiaque
COREG 12,5 mg a été évalué pour l'innocuité dans l'insuffisance cardiaque chez plus de 4 500 sujets dans le monde, dont plus de 2 100 ont participé à des essais cliniques contrôlés par placebo. Environ 60 % de la population traitée totale dans les essais cliniques contrôlés par placebo ont reçu COREG 3,12 mg pendant au moins 6 mois et 30 % ont reçu COREG pendant au moins 12 mois. Dans l'essai COMET, 1 511 sujets atteints d'insuffisance cardiaque légère à modérée ont été traités par COREG pendant une période allant jusqu'à 5,9 ans (moyenne : 4,8 ans). Tant dans les essais cliniques américains sur l'insuffisance cardiaque légère à modérée qui comparaient COREG 3,12 mg à des doses quotidiennes allant jusqu'à 100 mg (n = 765) avec un placebo (n = 437), que dans un essai clinique multinational sur l'insuffisance cardiaque sévère (COPERNICUS ) qui comparait COREG à des doses quotidiennes allant jusqu'à 50 mg (n = 1 156) avec un placebo (n = 1 133), les taux d'abandon pour effets indésirables étaient similaires chez les sujets carvédilol et placebo. Dans les essais cliniques contrôlés par placebo, la seule cause d'arrêt supérieur à 1 % et survenant plus souvent sous carvédilol était les étourdissements (1,3 % sous carvédilol, 0,6 % sous placebo dans l'essai COPERNICUS).
Le tableau 1 montre les événements indésirables signalés chez les sujets atteints d'insuffisance cardiaque légère à modérée inscrits dans des essais cliniques contrôlés par placebo aux États-Unis et chez les sujets atteints d'insuffisance cardiaque grave inscrits dans l'essai COPERNICUS. Sont présentés les événements indésirables survenus plus fréquemment chez les sujets traités par le médicament que chez les sujets traités par placebo avec une incidence supérieure à 3 % chez les sujets traités par le carvédilol, quelle qu'en soit la cause. L'exposition médiane aux médicaments à l'essai était de 6,3 mois pour les sujets traités au carvédilol et au placebo dans les essais sur l'insuffisance cardiaque légère à modérée et de 10,4 mois dans l'essai sur les sujets atteints d'insuffisance cardiaque sévère. Le profil d'effets indésirables de COREG 3,12 mg observé dans l'essai COMET à long terme était généralement similaire à celui observé dans les essais américains sur l'insuffisance cardiaque.
L'insuffisance cardiaque et la dyspnée ont également été signalées dans ces essais, mais les taux étaient égaux ou supérieurs chez les sujets ayant reçu le placebo.
Les événements indésirables suivants ont été signalés avec une fréquence supérieure à 1 % mais inférieure ou égale à 3 % et plus fréquemment avec COREG 3,12 mg dans les essais contrôlés par placebo aux États-Unis chez des sujets atteints d'insuffisance cardiaque légère à modérée ou chez des sujets avec une insuffisance cardiaque sévère dans l'essai COPERNICUS.
Incidence supérieure à 1 % à inférieure ou égale à 3 %
Corps dans son ensemble : Allergie, malaise, hypovolémie, fièvre, œdème des jambes.
Cardiovasculaire: Surcharge liquidienne, hypotension orthostatique, aggravation de l'angine de poitrine, bloc AV, palpitations, hypertension.
Système nerveux central et périphérique : Hyperesthésie, vertige, paresthésie.
Gastro-intestinal : Méléna, parodontite.
Système hépatique et biliaire : SGPT augmenté, SGOT augmenté.
Métabolique et Nutritionnel : Hyperuricémie, hypoglycémie, hyponatrémie, augmentation de la phosphatase alcaline, glycosurie, hypervolémie, diabète sucré, augmentation de la GGT, perte de poids, hyperkaliémie, augmentation de la créatinine.
Musculo-squelettique : Crampes musculaires.
Plaquettes, saignements et coagulation : Diminution de la prothrombine, purpura, thrombocytopénie.
Psychiatrique: Somnolence.
Reproducteur, mâle : Impuissance.
Sens spéciaux : Vision floue.
Système urinaire: Insuffisance rénale, albuminurie, hématurie.
Dysfonctionnement ventriculaire gauche après un infarctus du myocarde
COREG a été évalué pour la sécurité chez les survivants d'un infarctus aigu du myocarde avec dysfonction ventriculaire gauche dans l'essai CAPRICORN qui a impliqué 969 sujets qui ont reçu COREG 6,25 mg et 980 qui ont reçu un placebo. Environ 75 % des sujets ont reçu COREG 25 mg pendant au moins 6 mois et 53 % ont reçu COREG 12,5 mg pendant au moins 12 mois. Les sujets ont été traités pendant une moyenne de 12,9 mois et 12,8 mois avec COREG 12,5 mg et un placebo, respectivement.
Les événements indésirables les plus courants signalés avec COREG 25 mg dans l'essai CAPRICORN correspondaient au profil du médicament dans les essais sur l'insuffisance cardiaque aux États-Unis et l'essai COPERNICUS. Les seuls événements indésirables supplémentaires signalés dans CAPRICORN chez plus de 3 % des sujets et plus fréquemment sous carvédilol étaient la dyspnée, l'anémie et l'œdème pulmonaire. Les événements indésirables suivants ont été signalés avec une fréquence supérieure à 1 % mais inférieure ou égale à 3 % et plus fréquemment avec COREG : syndrome grippal, accident vasculaire cérébral, trouble vasculaire périphérique, hypotonie, dépression, douleur gastro-intestinale, arthrite et goutte. Les taux globaux d'abandons en raison d'événements indésirables étaient similaires dans les deux groupes de sujets. Dans cette base de données, la seule cause d'arrêt supérieure à 1 % et survenant plus souvent sous carvédilol était l'hypotension (1,5 % sous carvédilol, 0,2 % sous placebo).
Hypertension
COREG a été évalué pour l'innocuité dans l'hypertension chez plus de 2 193 sujets dans des essais cliniques américains et chez 2 976 sujets dans des essais cliniques internationaux. Environ 36 % de la population traitée totale ont reçu COREG pendant au moins 6 mois. La plupart des événements défavorables ont annoncé pendant la thérapie avec COREG 25mg étaient de gravité légère à modérée. Dans les essais cliniques contrôlés américains comparant directement COREG 12,5 mg à des doses allant jusqu'à 50 mg (n = 1 142) avec un placebo (n = 462), 4,9 % des sujets recevant COREG 6,25 mg ont arrêté pour des événements indésirables contre 5,2 % des sujets placebo. Bien qu'il n'y ait pas eu de différence globale dans les taux d'abandon, les arrêts étaient plus fréquents dans le groupe carvédilol pour hypotension orthostatique (1 % contre 0). L'incidence totale d'événements défavorables dans les procès contrôlés du placebo américains a augmenté avec la dose croissante de COREG. Pour les événements indésirables individuels, cela n'a pu être distingué que pour les étourdissements, dont la fréquence a augmenté de 2 % à 5 % lorsque la dose quotidienne totale a augmenté de 6,25 mg à 50 mg.
Le tableau 2 montre les événements indésirables dans les essais cliniques contrôlés par placebo aux États-Unis pour l'hypertension qui se sont produits avec une incidence supérieure ou égale à 1 %, quelle que soit la causalité, et qui étaient plus fréquents chez les sujets traités par le médicament que chez les sujets traités par placebo.
La dyspnée et la fatigue ont également été rapportées dans ces essais, mais les taux étaient égaux ou supérieurs chez les sujets ayant reçu le placebo.
Les événements indésirables suivants non décrits ci-dessus ont été signalés comme éventuellement ou probablement liés à COREG 25 mg dans des essais mondiaux ouverts ou contrôlés avec COREG 12,5 mg chez des sujets souffrant d'hypertension ou d'insuffisance cardiaque.
Incidence supérieure à 0,1 % à inférieure ou égale à 1 %
Cardiovasculaire: Ischémie périphérique, tachycardie.
Système nerveux central et périphérique m : Hypokinésie.
Gastro-intestinal : Bilirubinémie, augmentation des enzymes hépatiques (0,2 % des patients hypertendus et 0,4 % des patients souffrant d'insuffisance cardiaque ont arrêté le traitement en raison d'une augmentation des enzymes hépatiques) [voir Expérience post-commercialisation ].
Psychiatrique: Nervosité, trouble du sommeil, dépression aggravée, troubles de la concentration, troubles de la pensée, paroniria, labilité émotionnelle.
Système respiratoire: Asthme [voir CONTRE-INDICATIONS ].
Reproducteur, mâle : Diminution de la libido.
Peau et appendices : Prurit, rash érythémateux, rash maculopapulaire, rash psoriaforme, réaction de photosensibilité.
Sens spéciaux : Acouphène.
Système urinaire: La fréquence des mictions a augmenté.
Système nerveux autonome: Bouche sèche, transpiration accrue.
Métabolique et Nutritionnel : Hypokaliémie, hypertriglycéridémie.
Hématologique : Anémie, leucopénie.
Les événements suivants ont été rapportés chez moins de ou égal à 0,1 % des sujets et sont potentiellement importants : bloc AV complet, bloc de branche, ischémie myocardique, trouble cérébrovasculaire, convulsions, migraine, névralgie, parésie, réaction anaphylactoïde, alopécie, dermatite exfoliative, amnésie, hémorragie gastro-intestinale, bronchospasme, œdème pulmonaire, diminution de l'ouïe, alcalose respiratoire, augmentation de l'azote uréique sanguin, diminution du HDL, pancytopénie et lymphocytes atypiques.
Anomalies de laboratoire
Des élévations réversibles des transaminases sériques (ALT ou AST) ont été observées pendant le traitement par COREG. Les taux d'élévations des transaminases (2 à 3 fois la limite supérieure de la normale) observés pendant les essais cliniques contrôlés ont généralement été similaires entre les sujets traités avec COREG et ceux traités avec un placebo. Cependant, des élévations des transaminases, confirmées par un nouveau défi, ont été observées avec COREG. Dans un essai à long terme contrôlé par placebo sur l'insuffisance cardiaque sévère, les sujets traités par COREG 25 mg avaient des valeurs de transaminases hépatiques inférieures à celles des sujets traités par placebo, peut-être parce que les améliorations de la fonction cardiaque induites par COREG 6,25 mg entraînaient moins de congestion hépatique et/ou ou amélioration du flux sanguin hépatique.
COREG 25 mg n'a pas été associé à des changements cliniquement significatifs du potassium sérique, des triglycérides totaux, du cholestérol total, du cholestérol HDL, de l'acide urique, de l'azote uréique du sang ou de la créatinine. Aucun changement cliniquement pertinent n'a été noté dans la glycémie à jeun chez les patients hypertendus ; la glycémie à jeun n'a pas été évaluée dans les essais cliniques sur l'insuffisance cardiaque.
Expérience post-commercialisation
Les réactions défavorables suivantes ont été identifiées pendant l'utilisation de post-approbation de COREG. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Troubles du système sanguin et lymphatique
Anémie aplastique.
Troubles du système immunitaire
Hypersensibilité (p. ex., réactions anaphylactiques, œdème de Quincke, urticaire).
Troubles rénaux et urinaires
Incontinence urinaire.
Troubles respiratoires, thoraciques et médiastinaux
Pneumopathie interstitielle.
Troubles de la peau et du tissu sous-cutané
Syndrome de Stevens-Johnson, nécrolyse épidermique toxique, érythème polymorphe.
INTERACTIONS MÉDICAMENTEUSES
Inhibiteurs du CYP2D6 et métaboliseurs lents
Les interactions du carvédilol avec de puissants inhibiteurs de l'isoenzyme CYP2D6 (tels que la quinidine, la fluoxétine, la paroxétine et la propafénone) n'ont pas été étudiées, mais ces médicaments devraient augmenter les taux sanguins de l'énantiomère R(+) du carvédilol [voir PHARMACOLOGIE CLINIQUE ]. L'analyse rétrospective des effets secondaires dans les essais cliniques a montré que les métaboliseurs lents du 2D6 présentaient un taux plus élevé d'étourdissements pendant la titration, résultant vraisemblablement des effets vasodilatateurs des concentrations plus élevées de l'énantiomère R(+) α-bloquant.
Agents hypotenseurs
Les patients prenant un β-bloquant et un médicament pouvant dépléter les catécholamines (p. ex., la réserpine et les inhibiteurs de la monoamine oxydase) doivent être étroitement surveillés afin de détecter tout signe d'hypotension et/ou de bradycardie sévère.
L'administration concomitante de clonidine avec un β-bloquant peut provoquer une hypotension et une bradycardie. Lorsqu'un traitement concomitant par un β-bloquant et la clonidine doit être arrêté, le β-bloquant doit être arrêté en premier. Le traitement par la clonidine peut alors être interrompu quelques jours plus tard en diminuant progressivement la posologie.
Ciclosporine
Des augmentations modestes des concentrations minimales moyennes de cyclosporine ont été observées après le début du traitement par carvédilol chez 21 sujets transplantés rénaux souffrant de rejet vasculaire chronique. Chez environ 30 % des sujets, la dose de cyclosporine a dû être réduite afin de maintenir les concentrations de cyclosporine dans l'intervalle thérapeutique, tandis que chez les autres, aucun ajustement n'a été nécessaire. En moyenne pour le groupe, la dose de cyclosporine a été réduite d'environ 20 % chez ces sujets. En raison de la grande variabilité interindividuelle de l'adaptation posologique nécessaire, il est recommandé de surveiller étroitement les concentrations de cyclosporine après le début du traitement par carvédilol et d'ajuster la dose de cyclosporine en conséquence.
Digitalis Glycosides
Les glycosides digitaliques et les β-bloquants ralentissent la conduction auriculo-ventriculaire et diminuent la fréquence cardiaque. L'utilisation concomitante peut augmenter le risque de bradycardie. Les concentrations de digoxine sont augmentées d'environ 15 % lorsque la digoxine et le carvédilol sont administrés simultanément. Par conséquent, une surveillance accrue de la digoxine est recommandée lors de l'initiation, de l'ajustement ou de l'arrêt de COREG [voir PHARMACOLOGIE CLINIQUE ].
Inducteurs/inhibiteurs du métabolisme hépatique
La rifampicine a réduit les concentrations plasmatiques de carvédilol d'environ 70 % [voir PHARMACOLOGIE CLINIQUE ]. La cimétidine a augmenté l'ASC d'environ 30 % mais n'a provoqué aucune modification de la Cmax [voir PHARMACOLOGIE CLINIQUE ].
Amiodarone
L'amiodarone et son métabolite déséthyl amiodarone, les inhibiteurs du CYP2C9 et la glycoprotéine P ont augmenté d'au moins 2 fois les concentrations de l'énantiomère S(-) du carvédilol [voir PHARMACOLOGIE CLINIQUE ]. L'administration concomitante d'amiodarone ou d'autres inhibiteurs du CYP2C9 tels que le fluconazole avec COREG peut augmenter l'activité β-bloquante, entraînant un ralentissement supplémentaire de la fréquence cardiaque ou de la conduction cardiaque. Les patients doivent être surveillés pour des signes de bradycardie ou de bloc cardiaque, en particulier lorsqu'un agent est ajouté à un traitement préexistant avec l'autre.
Bloqueurs de canaux calciques
La perturbation de conduction (rarement avec le compromis hemodynamic) a été observée quand COREG 25mg est coadministered avec diltiazem. Comme avec d'autres β-bloquants, si COREG 25 mg est administré avec des inhibiteurs calciques de type vérapamil ou diltiazem, il est recommandé de surveiller l'ECG et la pression artérielle.
Insuline ou hypoglycémiants oraux
Les β-bloquants peuvent renforcer l'effet hypoglycémiant de l'insuline et des hypoglycémiants oraux. Par conséquent, chez les patients prenant de l'insuline ou des hypoglycémiants oraux, une surveillance régulière de la glycémie est recommandée [voir AVERTISSEMENTS ET PRECAUTIONS ].
Anesthésie
Si le traitement par COREG doit être poursuivi en période périopératoire, des précautions particulières doivent être prises lorsque des agents anesthésiques qui dépriment la fonction myocardique, tels que l'éther, le cyclopropane et le trichloroéthylène, sont utilisés [voir SURDOSAGE ].
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Arrêt de la thérapie
On devrait conseiller aux patients avec la maladie d'artère coronaire, qui sont traités avec COREG, contre la cessation brusque de thérapie. Une exacerbation sévère de l'angine de poitrine et la survenue d'un infarctus du myocarde et d'arythmies ventriculaires ont été rapportées chez des patients souffrant d'angine de poitrine suite à l'arrêt brutal du traitement par les β-bloquants. Les 2 dernières complications peuvent survenir avec ou sans exacerbation préalable de l'angine de poitrine. Comme avec d'autres β-bloquants, lorsque l'arrêt de COREG est prévu, les patients doivent être étroitement surveillés et conseillés de limiter l'activité physique au minimum. COREG devrait être arrêté sur 1 à 2 semaines chaque fois que possible. Si l'angine de poitrine s'aggrave ou si une insuffisance coronarienne aiguë se développe, il est recommandé de réinstituer rapidement COREG, au moins temporairement. Puisque la maladie d'artère coronaire est commune et peut être non reconnue, il peut être prudent de ne pas arrêter la thérapie avec COREG 3.12 mgs brusquement même dans les patients traités seulement pour l'hypertension ou l'arrêt du coeur.
Bradycardie
Dans les essais cliniques, COREG 25 mg a provoqué une bradycardie chez environ 2 % des sujets hypertendus, 9 % des sujets souffrant d'insuffisance cardiaque et 6,5 % des sujets souffrant d'infarctus du myocarde et de dysfonctionnement ventriculaire gauche. Si le pouls tombe en dessous de 55 battements par minute, la posologie doit être réduite.
Hypotension
Dans les essais cliniques d'insuffisance cardiaque principalement légère à modérée, une hypotension et une hypotension orthostatique sont survenues chez 9,7 % et une syncope chez 3,4 % des sujets recevant COREG, comparativement à 3,6 % et 2,5 % des sujets placebo, respectivement. Le risque pour ces événements était le plus élevé pendant les 30 premiers jours de dosage, correspondant à la période d'up-titration et était une cause pour la cessation de thérapie dans 0.7 % de sujets recevant COREG 12.5 mgs, comparé avec 0.4 % de sujets de placebo. Dans un procès à long terme, contrôlé du placebo dans l'arrêt du coeur sévère (COPERNICUS), l'hypotension et l'hypotension orthostatique se sont produites dans 15.1 % et la syncope dans 2.9 % de sujets d'insuffisance cardiaque recevant COREG comparé avec 8.7 % et 2.3 % de sujets de placebo, respectivement. Ces événements étaient une cause pour la cessation de thérapie dans 1.1 % de sujets recevant COREG, comparé avec 0.8 % de sujets de placebo.
Une hypotension orthostatique est survenue chez 1,8 % des sujets hypertendus et une syncope chez 0,1 % des sujets hypertendus, principalement après la dose initiale ou au moment de l'augmentation de la dose et a été une cause d'arrêt du traitement chez 1 % des sujets.
Dans l'essai CAPRICORN des survivants d'un infarctus aigu du myocarde, une hypotension ou une hypotension posturale s'est produite chez 20,2 % des sujets recevant COREG, comparativement à 12,6 % des sujets sous placebo. Une syncope a été signalée chez 3,9 % et 1,9 % des sujets, respectivement. Ces événements étaient une cause pour la cessation de thérapie dans 2.5 % de sujets recevant COREG, comparé avec 0.2 % de sujets de placebo.
Commencer par une faible dose, l'administration avec de la nourriture et une augmentation progressive de la dose devraient diminuer le risque de syncope ou d'hypotension excessive [voir DOSAGE ET ADMINISTRATION ]. Au début du traitement, le patient doit être averti d'éviter les situations telles que la conduite automobile ou les tâches dangereuses, pouvant entraîner des blessures en cas de syncope.
Insuffisance cardiaque/rétention d'eau
Une aggravation de l'insuffisance cardiaque ou de la rétention hydrique peut survenir lors de l'augmentation de la dose de carvédilol. Si de tels symptômes surviennent, les diurétiques doivent être augmentés et la dose de carvédilol ne doit pas être augmentée jusqu'à ce que la stabilité clinique reprenne [voir DOSAGE ET ADMINISTRATION ]. Parfois, il est nécessaire de réduire la dose de carvédilol ou de l'arrêter temporairement. De tels épisodes n'empêchent pas un titrage ultérieur réussi ou une réponse favorable au carvédilol. Dans un essai contrôlé contre placebo chez des sujets souffrant d'insuffisance cardiaque sévère, une aggravation de l'insuffisance cardiaque au cours des 3 premiers mois a été rapportée à un degré similaire avec le carvédilol et avec le placebo. Lorsque le traitement a été maintenu au-delà de 3 mois, une aggravation de l'insuffisance cardiaque a été rapportée moins fréquemment chez les sujets traités par carvédilol que sous placebo. L'aggravation de l'insuffisance cardiaque observée au cours d'un traitement à long terme est plus susceptible d'être liée à la maladie sous-jacente du patient qu'au traitement par le carvédilol.
Bronchospasme non allergique
Les patients atteints de maladie bronchospastique (p. ex., bronchite chronique, emphysème) ne doivent, en général, pas recevoir de β-bloquants. COREG peut être utilisé avec prudence, cependant, chez les patients qui ne répondent pas à, ou ne peuvent pas tolérer, d'autres agents antihypertenseurs. Il est prudent, si COREG est utilisé, d'utiliser la plus petite dose efficace, de sorte que l'inhibition des β-agonistes endogènes ou exogènes soit minimisée.
Dans les essais cliniques portant sur des sujets souffrant d'insuffisance cardiaque, les sujets atteints de maladie bronchospastique ont été recrutés s'ils n'avaient pas besoin de médicaments oraux ou inhalés pour traiter leur maladie bronchospastique. Chez ces patients, il est recommandé d'utiliser le carvédilol avec prudence. Les recommandations posologiques doivent être suivies de près et la dose doit être réduite si des signes de bronchospasme sont observés pendant la titration.
Contrôle glycémique dans le diabète de type 2
En général, les β-bloquants peuvent masquer certaines des manifestations de l'hypoglycémie, en particulier la tachycardie. Les β-bloquants non sélectifs peuvent potentialiser l'hypoglycémie induite par l'insuline et retarder la récupération des taux de glucose sérique. Les patients sujets à une hypoglycémie spontanée ou les patients diabétiques recevant de l'insuline ou des hypoglycémiants oraux doivent être avertis de ces possibilités.
Chez les patients insuffisants cardiaques et diabétiques, le carvédilol peut entraîner une aggravation de l'hyperglycémie, qui répond à l'intensification du traitement hypoglycémiant. Il est recommandé de surveiller la glycémie lorsque le dosage du carvédilol est initié, ajusté ou interrompu. Aucun essai visant à examiner les effets du carvédilol sur le contrôle glycémique chez les patients atteints de diabète et d'insuffisance cardiaque n'a été mené.
Dans un essai conçu pour examiner les effets du carvédilol sur le contrôle glycémique dans une population souffrant d'hypertension légère à modérée et de diabète sucré de type 2 bien contrôlé, le carvédilol n'a eu aucun effet indésirable sur le contrôle glycémique, d'après les mesures de l'HbA1c [voir Etudes cliniques ].
Une maladie vasculaire périphérique
Les β-bloquants peuvent précipiter ou aggraver les symptômes d'insuffisance artérielle chez les patients atteints d'une maladie vasculaire périphérique. La prudence s'impose chez ces personnes.
Détérioration de la fonction rénale
Rarement, l'utilisation de carvédilol chez des patients souffrant d'insuffisance cardiaque a entraîné une détérioration de la fonction rénale. Les patients à risque semblent être ceux qui ont une pression artérielle basse (pression artérielle systolique inférieure à 100 mm Hg), une cardiopathie ischémique et une maladie vasculaire diffuse, et/ou une insuffisance rénale sous-jacente. La fonction rénale est revenue à son état initial lorsque le carvédilol a été arrêté. Chez les patients présentant ces facteurs de risque, il est recommandé de surveiller la fonction rénale pendant l'augmentation de la dose de carvédilol et d'arrêter le médicament ou de réduire la posologie en cas d'aggravation de la fonction rénale.
Une intervention chirurgicale majeure
Le traitement β-bloquant administré de manière chronique ne doit pas être systématiquement interrompu avant une intervention chirurgicale majeure ; cependant, la capacité altérée du cœur à répondre aux stimuli adrénergiques réflexes peut augmenter les risques d'anesthésie générale et d'interventions chirurgicales.
Thyrotoxicose
Le blocage β-adrénergique peut masquer les signes cliniques d'hyperthyroïdie, tels que la tachycardie. L'arrêt brutal du β-blocage peut être suivi d'une exacerbation des symptômes de l'hyperthyroïdie ou peut précipiter une tempête thyroïdienne.
Phéochromocytome
Chez les patients atteints de phéochromocytome, un agent α-bloquant doit être initié avant l'utilisation de tout agent β-bloquant. Bien que le carvédilol ait à la fois des activités pharmacologiques α-bloquantes et β-bloquantes, il n'existe aucune expérience de son utilisation dans cette affection. Par conséquent, des précautions doivent être prises lors de l'administration de carvédilol à des patients suspectés d'avoir un phéochromocytome.
Angine variante de Prinzmetal
Les agents ayant une activité β-bloquante non sélective peuvent provoquer des douleurs thoraciques chez les patients atteints de la variante de l'angor de Prinzmetal. Il n'y a pas eu d'expérience clinique avec le carvédilol chez ces patients bien que l'activité α-bloquante puisse prévenir de tels symptômes. Cependant, des précautions doivent être prises lors de l'administration de carvédilol à des patients suspectés d'être atteints de la variante de l'angor de Prinzmetal.
Risque de réaction anaphylactique
Tout en prenant des β-bloquants, les patients ayant des antécédents de réaction anaphylactique sévère à divers allergènes peuvent être plus réactifs à des provocations répétées, qu'elles soient accidentelles, diagnostiques ou thérapeutiques. Ces patients peuvent ne pas répondre aux doses habituelles d'épinéphrine utilisées pour traiter les réactions allergiques.
Syndrome de l'iris souple peropératoire
Le syndrome de l'iris flasque peropératoire (IFIS) a été observé lors d'une chirurgie de la cataracte chez certains patients traités par des alpha-1 bloquants (COREG est un alpha/bêta bloquant). Cette variante du syndrome de la petite pupille est caractérisée par la combinaison d'un iris flasque qui gonfle en réponse aux courants d'irrigation peropératoires, d'un myosis peropératoire progressif malgré une dilatation préopératoire avec des médicaments mydriatiques standard et d'un prolapsus potentiel de l'iris vers les incisions de phacoémulsification. L'ophtalmologiste du patient doit être préparé à d'éventuelles modifications de la technique chirurgicale, telles que l'utilisation de crochets d'iris, d'anneaux dilatateurs d'iris ou de substances viscoélastiques. Il ne semble pas y avoir d'avantage à arrêter le traitement par alpha-1 bloquant avant la chirurgie de la cataracte.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( INFORMATIONS PATIENTS ).
Les patients prenant COREG devraient être informés de ce qui suit :
- Les patients devraient prendre COREG avec de la nourriture.
- Les patients ne doivent pas interrompre ou cesser d'utiliser COREG 25 mg sans l'avis d'un médecin.
- Les patients souffrant d'insuffisance cardiaque doivent consulter leur médecin s'ils présentent des signes ou des symptômes d'aggravation de l'insuffisance cardiaque tels qu'une prise de poids ou un essoufflement croissant.
- Les patients peuvent ressentir une baisse de la pression artérielle en position debout, entraînant des étourdissements et, rarement, des évanouissements. Les patients doivent s'asseoir ou s'allonger lorsque ces symptômes d'abaissement de la tension artérielle se manifestent.
- En cas d'étourdissements ou de fatigue, les patients doivent éviter de conduire ou d'accomplir des tâches dangereuses.
- Les patients doivent consulter un médecin s'ils ressentent des étourdissements ou des évanouissements, au cas où la posologie devrait être ajustée.
- Les patients diabétiques doivent signaler tout changement de leur glycémie à leur médecin.
- Les porteurs de lentilles de contact peuvent ressentir une diminution du larmoiement.
COREG 25 mg, COREG 3,12 mg CR et TILTAB sont des marques déposées détenues ou sous licence par le groupe de sociétés GSK.
L'autre marque répertoriée est une marque de commerce détenue ou concédée sous licence à son propriétaire et n'est pas détenue ou concédée sous licence au groupe de sociétés GSK. Le fabricant de cette marque n'est pas affilié et ne cautionne pas le groupe de sociétés GSK ou ses produits.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Dans des études de 2 ans menées chez des rats ayant reçu du carvédilol à des doses allant jusqu'à 75 mg par kg par jour (12 fois la MRHD en mg par m2) ou chez des souris ayant reçu jusqu'à 200 mg par kg par jour (16 fois la MRHD en mg par m2), le carvédilol n'a eu aucun effet cancérigène.
Le carvédilol s'est révélé négatif lorsqu'il a été testé dans une batterie de tests de génotoxicité, y compris les tests Ames et CHO/HGPRT pour la mutagénicité et les tests in vitro sur le micronoyau de hamster et in vivo sur les cellules lymphocytaires humaines pour la clastogénicité.
Dans une étude combinée de fertilité/développement/toxicité post-natale, des rats ont reçu du carvédilol (12, 60, 300 mg par kg par jour) par voie orale par gavage pendant 2 semaines avant l'accouplement et pendant l'accouplement, la gestation et le sevrage pour les femelles et pendant 62 jours avant et pendant l'accouplement pour les mâles. A une dose de 300 mg par kg par jour (supérieure ou égale à 50 fois la MRHD en mg par m2), le carvédilol était toxique pour les rats adultes (sédation, réduction de la prise de poids) et était associé à un nombre réduit d'accouplements réussis, à une prolongation temps d'accouplement, moins de corps jaunes et d'implants par mère, moins de petits vivants par portée et des retards dans la croissance/le développement physique. Le niveau sans effet pour la toxicité manifeste et l'altération de la fertilité était de 60 mg par kg par jour (10 fois la MRHD en mg par m2).
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Les données disponibles concernant l'utilisation de COREG 12,5 mg chez les femmes enceintes sont insuffisantes pour déterminer s'il existe des risques associés au médicament d'effets indésirables sur le développement. Il existe des risques pour la mère et le fœtus associés à une hypertension mal contrôlée pendant la grossesse. L'utilisation de bêta-bloquants au cours du troisième trimestre de la grossesse peut augmenter le risque d'hypotension, de bradycardie, d'hypoglycémie et de dépression respiratoire chez le nouveau-né. voir Considérations cliniques ]. Dans les études de reproduction chez l'animal, il n'y avait aucune preuve d'effets indésirables sur le développement à des doses cliniquement pertinentes [ voir Données ]. L'administration orale de carvédilol à des rats gravides pendant l'organogenèse a entraîné une perte post-implantation, une diminution du poids corporel du fœtus et une fréquence accrue de développement squelettique fœtal retardé à des doses maternellement toxiques qui étaient 50 fois la dose humaine recommandée maximale (MRHD). De plus, l'administration orale de carvédilol à des lapines gestantes pendant l'organogenèse a entraîné une augmentation des pertes post-implantation à des doses 25 fois supérieures à la MRHD [ voir Données ].
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour les populations indiquées est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
L'hypertension pendant la grossesse augmente le risque maternel de prééclampsie, de diabète gestationnel, d'accouchement prématuré et de complications à l'accouchement (p. ex., nécessité d'une césarienne et hémorragie post-partum). L'hypertension augmente le risque fœtal de retard de croissance intra-utérin et de mort intra-utérine. Les femmes enceintes souffrant d'hypertension doivent être étroitement surveillées et prises en charge en conséquence.
Effets indésirables fœtaux/néonatals
Les nouveau-nés de femmes hypertendues traitées par des bêta-bloquants au cours du troisième trimestre de la grossesse peuvent présenter un risque accru d'hypotension, de bradycardie, d'hypoglycémie et de dépression respiratoire. Observez les nouveau-nés pour des symptômes d'hypotension, de bradycardie, d'hypoglycémie et de dépression respiratoire et gérez-les en conséquence.
Données
Données animales
Des études réalisées chez des rats et des lapins ayant reçu du carvédilol au cours de l'organogenèse fœtale ont révélé une augmentation des pertes post-implantation chez le rat à une dose maternellement toxique de 300 mg par kg par jour (50 fois la MRHD en mg par m2) et chez le lapin (en l'absence de toxicité) à des doses de 75 mg par kg par jour (25 fois la MRHD en mg par m2). Chez les rats, il y avait aussi une diminution du poids corporel du fœtus à 300 mg par kg par jour (50 fois la MRHD en mg par m2) accompagnée d'une incidence accrue de fœtus avec un développement squelettique retardé. Chez les rats, le niveau sans effet pour la toxicité embryo-fœtale était de 60 mg par kg par jour (10 fois la MRHD en mg par m2) ; chez le lapin, elle était de 15 mg par kg par jour (5 fois la MRHD en mg par m2). Dans une étude sur le développement prénatal et postnatal chez des rats ayant reçu du carvédilol de la fin de la gestation à la lactation, une augmentation de la létalité embryonnaire a été observée à une dose maternellement toxique de 200 mg par kg par jour (environ 32 fois la MRHD en mg par m2), et la mortalité des petits et les retards de croissance/développement physiques ont été observés à 60 mg par kg par jour (10 fois la MRHD en mg par m2) en l'absence de toxicité maternelle. Le niveau sans effet était de 12 mg par kg par jour (2 fois la MRHD en mg par m2). Le carvédilol était présent dans les tissus fœtaux du rat.
Lactation
Résumé des risques
Il n'y a pas de données sur la présence de carvédilol dans le lait maternel, les effets sur le nourrisson allaité ou les effets sur la production de lait. Le carvédilol est présent dans le lait des rates allaitantes. Les avantages pour le développement et la santé de l'allaitement doivent être pris en compte avec le besoin clinique de COREG de la mère et tout effet indésirable potentiel sur le nourrisson allaité à partir de COREG 3,12 mg ou de l'état maternel sous-jacent.
Utilisation pédiatrique
L'efficacité de COREG 3,12 mg chez les patients de moins de 18 ans n'a pas été établie.
Dans un essai en double aveugle, 161 enfants (âge moyen : 6 ans ; intervalle : 2 mois à 17 ans ; 45 % de moins de 2 ans) atteints d'insuffisance cardiaque chronique [classe II-IV de la NYHA, fraction d'éjection ventriculaire gauche inférieure à 40 % pour les enfants avec un ventricule gauche systémique (LV) et une dysfonction ventriculaire modérée à sévère qualitativement par écho pour ceux avec un ventricule systémique qui n'était pas un VG] qui recevaient un traitement de fond standard ont été randomisés pour recevoir un placebo ou 2 niveaux de dose de carvédilol. Ces niveaux de dose ont produit une réduction de la fréquence cardiaque corrigée par le placebo de 4 à 6 battements cardiaques par minute, indiquant une activité β-bloquante. L'exposition semble être plus faible chez les sujets pédiatriques que chez les adultes. Après 8 mois de suivi, il n'y avait aucun effet significatif du traitement sur les résultats cliniques. Les effets indésirables dans cet essai qui se sont produits chez plus de 10 % des sujets traités avec COREG et à deux fois le taux de sujets traités par placebo comprenaient des douleurs thoraciques (17 % contre 6 %), des étourdissements (13 % contre 2 %) et de la dyspnée ( 11 % contre 0 %).
Utilisation gériatrique
Des 765 sujets avec l'arrêt du coeur randomisés à COREG 6.25mg dans les essais cliniques américains, 31 % (235) étaient âgés 65 ans ou plus vieux et 7.3 % (56) étaient âgés 75 ans ou plus vieux. Parmi les 1 156 sujets randomisés pour recevoir COREG 3,12 mg dans un essai à long terme contrôlé par placebo dans l'insuffisance cardiaque sévère, 47 % (547) étaient âgés de 65 ans ou plus et 15 % (174) étaient âgés de 75 ans ou plus. Sur 3 025 sujets recevant COREG 6,25 mg dans des essais sur l'insuffisance cardiaque dans le monde, 42 % étaient âgés de 65 ans ou plus.
Des 975 sujets avec l'infarctus myocardique randomisés à COREG dans le procès CAPRICORN, 48 % (468) étaient âgés 65 ans ou plus vieux et 11 % (111) étaient âgés 75 ans ou plus vieux.
Des 2 065 sujets hypertendus dans les essais cliniques américains d'efficacité ou de sécurité qui ont été traités avec COREG 25 mg, 21 % (436) étaient âgés de 65 ans ou plus. De 3 722 sujets recevant COREG dans les essais cliniques d'hypertension menés dans le monde entier, 24 % étaient âgés de 65 ans ou plus vieux.
À l'exception des étourdissements chez les sujets hypertendus (incidence de 8,8 % chez les personnes âgées contre 6 % chez les sujets plus jeunes), aucune différence globale de sécurité ou d'efficacité (voir les figures 2 et 4) n'a été observée entre les sujets âgés et les sujets plus jeunes dans chacune des ces populations. De même, d'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les sujets âgés et les sujets plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue.
SURDOSAGE
Un surdosage peut provoquer une hypotension sévère, une bradycardie, une insuffisance cardiaque, un choc cardiogénique et un arrêt cardiaque. Des problèmes respiratoires, des bronchospasmes, des vomissements, des pertes de conscience et des convulsions généralisées peuvent également survenir.
Le patient doit être placé en décubitus dorsal et, si nécessaire, maintenu en observation et traité dans des conditions de soins intensifs. Les agents suivants peuvent être administrés :
En cas de bradycardie excessive : Atropine, 2 mg IV.
Pour soutenir la fonction cardiovasculaire Glucagon, 5 à 10 mg IV rapidement en 30 secondes, suivi d'une perfusion continue de 5 mg par heure ; sympathomimétiques (dobutamine, isoprénaline, adrénaline) à des doses en fonction du poids corporel et de l'effet.
Si la vasodilatation périphérique domine, il peut être nécessaire d'administrer de l'adrénaline ou de la noradrénaline avec une surveillance continue des conditions circulatoires. Pour la bradycardie résistante au traitement, un traitement par stimulateur cardiaque doit être effectué. Pour le bronchospasme, des β-sympathomimétiques (en aérosol ou IV) ou de l'aminophylline IV doivent être administrés. En cas de convulsions, une injection IV lente de diazépam ou de clonazépam est recommandée.
REMARQUE : En cas d'intoxication sévère accompagnée de symptômes de choc, le traitement par antidotes doit être poursuivi pendant une durée suffisamment longue compatible avec la demi-vie de 7 à 10 heures du carvédilol.
Des cas de surdosage avec COREG 3,12 mg seul ou en association avec d'autres médicaments ont été signalés. Les quantités ingérées dans certains cas dépassaient 1 000 milligrammes. Les symptômes ressentis comprenaient une pression artérielle basse et une fréquence cardiaque basse. Un traitement de soutien standard a été fourni et les personnes se sont rétablies.
CONTRE-INDICATIONS
COREG 25mg est contre-indiqué dans les conditions suivantes :
- Asthme bronchique ou affections bronchospastiques apparentées. Les morts du statut asthmaticus ont été annoncées suite aux doses simples de COREG.
- Bloc AV du deuxième ou du troisième degré.
- Maladie du sinus.
- Bradycardie sévère (sauf si un stimulateur cardiaque permanent est en place).
- Patients présentant un choc cardiogénique ou une insuffisance cardiaque décompensée nécessitant l'utilisation d'un traitement inotrope intraveineux. De tels patients devraient d'abord être sevrés de la thérapie intraveineuse avant de lancer COREG.
- Patients atteints d'insuffisance hépatique sévère.
- Patients ayant des antécédents de réaction d'hypersensibilité grave (p. ex., syndrome de Stevens-Johnson, réaction anaphylactique, œdème de Quincke) à l'un des composants de ce médicament ou à d'autres médicaments contenant du carvédilol.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
COREG 3,12 mg est un mélange racémique dans lequel une activité de blocage non sélective des récepteurs β-adrénergiques est présente dans l'énantiomère S(-) et une activité de blocage α1-adrénergique est présente dans les énantiomères R(+) et S(-) à puissance égale. COREG 6,25 mg n'a pas d'activité sympathomimétique intrinsèque.
Pharmacodynamie
Insuffisance cardiaque
La base des effets bénéfiques de COREG dans l'insuffisance cardiaque n'est pas établie.
Deux essais contrôlés par placebo ont comparé les effets hémodynamiques aigus de COREG avec des mesures de base chez 59 et 49 sujets atteints d'insuffisance cardiaque de classe NYHA II-IV recevant des diurétiques, des inhibiteurs de l'ECA et des digitaliques. Il y avait des réductions significatives de la pression artérielle systémique, de la pression artérielle pulmonaire, de la pression capillaire pulmonaire et de la fréquence cardiaque. Les effets initiaux sur le débit cardiaque, l'indice de volume d'éjection systolique et la résistance vasculaire systémique étaient faibles et variables.
Ces essais ont de nouveau mesuré les effets hémodynamiques entre 12 et 14 semaines. COREG 25 mg a réduit de manière significative la pression artérielle systémique, la pression artérielle pulmonaire, la pression auriculaire droite, la résistance vasculaire systémique et la fréquence cardiaque, tandis que l'indice de volume d'éjection systolique a été augmenté.
Parmi 839 sujets atteints d'insuffisance cardiaque de classe NYHA II-III traités pendant 26 à 52 semaines dans 4 essais contrôlés par placebo aux États-Unis, la fraction d'éjection ventriculaire gauche moyenne (FE) mesurée par ventriculographie radionucléide a augmenté de 9 unités EF (%) chez les sujets recevant COREG 6.25 mg et de 2 unités EF chez les sujets placebo à une dose cible de 25 à 50 mg deux fois par jour. Les effets du carvédilol sur la fraction d'éjection étaient liés à la dose. Des doses de 6,25 mg deux fois par jour, 12,5 mg deux fois par jour et 25 mg deux fois par jour ont été associées à des augmentations corrigées par placebo de la FE de 5 unités EF, 6 unités EF et 8 unités EF, respectivement ; chacun de ces effets était nominalement statistiquement significatif.
Dysfonctionnement ventriculaire gauche après un infarctus du myocarde
La base des effets bénéfiques de COREG 25 mg chez les patients atteints de dysfonctionnement ventriculaire gauche suite à un infarctus aigu du myocarde n'est pas établie.
Hypertension
Le mécanisme par lequel le β-blocage produit un effet antihypertenseur n'a pas été établi.
L'activité de blocage des récepteurs β-adrénergiques a été démontrée dans des études animales et humaines montrant que le carvédilol (1) réduit le débit cardiaque chez les sujets normaux, (2) réduit la tachycardie induite par l'exercice et/ou l'isoprotérénol et (3) réduit la tachycardie orthostatique réflexe. Un effet significatif de blocage des récepteurs β-adrénergiques est généralement observé dans l'heure suivant l'administration du médicament.
L'activité de blocage des récepteurs α1-adrénergiques a été démontrée dans des études humaines et animales, montrant que le carvédilol (1) atténue les effets presseurs de la phényléphrine, (2) provoque une vasodilatation et (3) réduit la résistance vasculaire périphérique. Ces effets contribuent à la réduction de la pression artérielle et sont généralement observés dans les 30 minutes suivant l'administration du médicament.
En raison de l'activité de blocage des récepteurs α1 du carvédilol, la tension artérielle est plus abaissée en position debout qu'en position couchée et des symptômes d'hypotension orthostatique (1,8 %), y compris de rares cas de syncope, peuvent survenir. Suite à l'administration orale, lorsqu'une hypotension orthostatique s'est produite, elle a été transitoire et est peu fréquente lorsque COREG est administré avec de la nourriture à la dose initiale recommandée et que les augmentations de titration sont suivies de près [voir DOSAGE ET ADMINISTRATION ].
Dans les patients hypertendus avec la fonction rénale normale, les doses thérapeutiques de COREG ont diminué la résistance vasculaire rénale sans changement de taux de filtration glomerular ou d'écoulement de plasma rénal. Les changements dans l'excrétion de sodium, de potassium, d'acide urique et de phosphore chez les patients hypertendus avec une fonction rénale normale étaient similaires après COREG et placebo.
COREG 3,12 mg a peu d'effet sur les catécholamines plasmatiques, l'aldostérone plasmatique ou les taux d'électrolytes, mais il réduit considérablement l'activité de la rénine plasmatique lorsqu'il est administré pendant au moins 4 semaines. Il augmente également les niveaux de peptide natriurétique auriculaire.
Pharmacocinétique
COREG est rapidement et largement absorbé après administration orale, avec une biodisponibilité absolue d'environ 25 % à 35 % en raison d'un degré significatif de métabolisme de premier passage. Après administration orale, la demi-vie d'élimination terminale moyenne apparente du carvédilol varie généralement de 7 à 10 heures. Les concentrations plasmatiques atteintes sont proportionnelles à la dose orale administrée. Lorsqu'il est administré avec de la nourriture, le taux d'absorption est ralenti, comme en témoigne un délai pour atteindre les concentrations plasmatiques maximales, sans différence significative dans l'étendue de la biodisponibilité. La prise de COREG avec de la nourriture devrait minimiser le risque d'hypotension orthostatique.
Le carvédilol est largement métabolisé. Après administration orale de carvédilol radiomarqué à des volontaires sains, le carvédilol ne représentait qu'environ 7 % de la radioactivité totale dans le plasma, mesurée par l'aire sous la courbe (ASC). Moins de 2 % de la dose a été excrétée sous forme inchangée dans l'urine. Le carvédilol est métabolisé principalement par oxydation du cycle aromatique et glucuronidation.
Les métabolites oxydatifs sont ensuite métabolisés par conjugaison via la glucuronidation et la sulfatation. Les métabolites du carvédilol sont principalement excrétés par la bile dans les fèces. La déméthylation et l'hydroxylation au niveau du cycle phénol produisent 3 métabolites actifs ayant une activité de blocage des récepteurs β. D'après des études précliniques, le métabolite 4'-hydroxyphényl est environ 13 fois plus puissant que le carvédilol pour le β-blocage.
Par rapport au carvédilol, les 3 métabolites actifs présentent une faible activité vasodilatatrice. Les concentrations plasmatiques des métabolites actifs représentent environ un dixième de celles observées pour le carvédilol et ont une pharmacocinétique similaire à celle du parent.
Le carvédilol subit un métabolisme de premier passage stéréosélectif avec des taux plasmatiques de R(+)-carvédilol environ 2 à 3 fois supérieurs à ceux du S(-)-carvédilol après administration orale chez des sujets sains. Les demi-vies d'élimination terminales apparentes moyennes du R(+)-carvédilol varient de 5 à 9 heures contre 7 à 11 heures pour l'énantiomère S(-).
Les principales enzymes P450 responsables du métabolisme du R(+) et du S(-)-carvédilol dans les microsomes hépatiques humains étaient CYP2D6 et CYP2C9 et, dans une moindre mesure, CYP3A4, 2C19, 1A2 et 2E1. On pense que le CYP2D6 est l'enzyme majeure dans la 4'- et 5'-hydroxylation du carvédilol, avec une contribution potentielle du 3A4. On pense que le CYP2C9 est d'une importance primordiale dans la voie de O-méthylation du S(-)-carvédilol.
Le carvédilol est sujet aux effets du polymorphisme génétique, les métaboliseurs lents de la débrisoquine (un marqueur du cytochrome P450 2D6) présentant des concentrations plasmatiques de R(+)-carvédilol 2 à 3 fois plus élevées que les métaboliseurs rapides. En revanche, les taux plasmatiques de S(-)-carvédilol n'augmentent que d'environ 20 % à 25 % chez les métaboliseurs lents, ce qui indique que cet énantiomère est métabolisé dans une moindre mesure par le cytochrome P450 2D6 que le R(+)-carvédilol. La pharmacocinétique du carvédilol ne semble pas différente chez les métaboliseurs lents de la S-méphénytoïne (patients déficients en cytochrome P450 2C19).
Le carvédilol est lié à plus de 98 % aux protéines plasmatiques, principalement à l'albumine. La liaison plasma-protéine est indépendante de la concentration dans l'intervalle thérapeutique. Le carvédilol est un composé lipophile basique avec un volume de distribution à l'état d'équilibre d'environ 115 L, indiquant une distribution substantielle dans les tissus extravasculaires. La clairance plasmatique varie de 500 à 700 mL/min.
Populations spécifiques
Insuffisance cardiaque
Les concentrations plasmatiques à l'état d'équilibre du carvédilol et de ses énantiomères ont augmenté proportionnellement dans l'intervalle de doses de 6,25 à 50 mg chez les sujets souffrant d'insuffisance cardiaque. Comparativement aux sujets sains, les sujets atteints d'insuffisance cardiaque présentaient des valeurs moyennes d'ASC et de Cmax accrues pour le carvédilol et ses énantiomères, avec des valeurs jusqu'à 50 % à 100 % plus élevées observées chez 6 sujets atteints d'insuffisance cardiaque de classe IV de la NYHA. La demi-vie d'élimination terminale apparente moyenne du carvédilol était similaire à celle observée chez les sujets sains.
Gériatrique
Les taux plasmatiques de carvédilol sont en moyenne environ 50 % plus élevés chez les personnes âgées que chez les sujets jeunes. Insuffisance hépatique Comparativement aux sujets sains, les patients atteints d'insuffisance hépatique grave (cirrhose) présentent une augmentation de 4 à 7 fois des taux de carvédilol. Le carvédilol est contre-indiqué chez les patients présentant une insuffisance hépatique sévère.
Insuffisance rénale
Bien que le carvédilol soit principalement métabolisé par le foie, il a été rapporté que les concentrations plasmatiques de carvédilol étaient augmentées chez les patients insuffisants rénaux. D'après les données de l'ASC moyenne, des concentrations plasmatiques de carvédilol supérieures d'environ 40 à 50 % ont été observées chez les sujets souffrant d'hypertension et d'insuffisance rénale modérée à sévère par rapport à un groupe témoin de sujets souffrant d'hypertension et d'une fonction rénale normale. Cependant, les plages de valeurs de l'ASC étaient similaires pour les deux groupes. Les variations des concentrations plasmatiques maximales moyennes étaient moins prononcées, environ 12 % à 26 % plus élevées chez les sujets présentant une insuffisance rénale.
Conformément à son degré élevé de liaison aux protéines plasmatiques, le carvédilol ne semble pas être éliminé de manière significative par hémodialyse.
Interactions médicament-médicament
Étant donné que le carvédilol subit un métabolisme oxydatif important, le métabolisme et la pharmacocinétique du carvédilol peuvent être affectés par l'induction ou l'inhibition des enzymes du cytochrome P450.
Amiodarone
Dans un essai pharmacocinétique mené chez 106 sujets japonais souffrant d'insuffisance cardiaque, l'administration concomitante de petites doses de charge et d'entretien d'amiodarone avec du carvédilol a entraîné une augmentation d'au moins 2 fois des concentrations minimales à l'état d'équilibre du S(-)-carvédilol [voir INTERACTIONS MÉDICAMENTEUSES ].
Cimétidine
Dans un essai pharmacocinétique mené chez 10 sujets sains de sexe masculin, la cimétidine (1 000 mg par jour) a augmenté l'ASC à l'état d'équilibre du carvédilol de 30 % sans modification de la Cmax [voir INTERACTIONS MÉDICAMENTEUSES ].
Digoxine
Suite à l'administration concomitante de carvédilol (25 mg une fois par jour) et de digoxine (0,25 mg une fois par jour) pendant 14 jours, l'ASC à l'état d'équilibre et les concentrations minimales de digoxine ont augmenté de 14 % et 16 %, respectivement, chez 12 sujets souffrant d'hypertension [voir INTERACTIONS MÉDICAMENTEUSES ].
Glyburide
Chez 12 sujets sains, l'administration combinée de carvédilol (25 mg une fois par jour) et d'une dose unique de glyburide n'a pas entraîné d'interaction pharmacocinétique cliniquement pertinente pour l'un ou l'autre composé.
Hydrochlorothiazide
Une dose orale unique de carvédilol 25 mg n'a pas modifié la pharmacocinétique d'une dose orale unique d'hydrochlorothiazide 25 mg chez 12 sujets souffrant d'hypertension. De même, l'hydrochlorothiazide n'a eu aucun effet sur la pharmacocinétique du carvédilol.
Rifampine
Dans un essai pharmacocinétique mené chez 8 hommes sains, la rifampicine (600 mg par jour pendant 12 jours) a diminué l'ASC et la Cmax du carvédilol d'environ 70 % [voir INTERACTIONS MÉDICAMENTEUSES ].
Torsémide
Dans un essai portant sur 12 sujets sains, l'administration orale combinée de carvédilol 25 mg une fois par jour et de torsémide 5 mg une fois par jour pendant 5 jours n'a entraîné aucune différence significative de leur pharmacocinétique par rapport à l'administration des médicaments seuls.
Warfarine
Le carvédilol (12,5 mg deux fois par jour) n'a pas eu d'effet sur les rapports de temps de prothrombine à l'état d'équilibre et n'a pas modifié la pharmacocinétique de la warfarine R(+) et S(-) après administration concomitante avec la warfarine chez 9 volontaires sains.
Etudes cliniques
Insuffisance cardiaque
Au total, 6 975 sujets atteints d'insuffisance cardiaque légère à sévère ont été évalués dans des essais contrôlés par placebo sur le carvédilol.
Insuffisance cardiaque légère à modérée
Le carvédilol a été étudié dans 5 essais multicentriques contrôlés par placebo et dans 1 essai contrôlé contre comparateur actif (essai COMET) impliquant des sujets atteints d'insuffisance cardiaque légère à modérée.
Quatre essais américains multicentriques, à double insu et contrôlés par placebo ont recruté 1 094 sujets (696 randomisés pour recevoir du carvédilol) atteints d'insuffisance cardiaque de classe NYHA II-III et d'une fraction d'éjection inférieure ou égale à 0,35. La grande majorité étaient sous digitaliques, diurétiques et un inhibiteur de l'ECA au début de l'essai. Les patients ont été affectés aux essais en fonction de leur capacité à faire de l'exercice. Un essai contrôlé par placebo en double aveugle entre l'Australie et la Nouvelle-Zélande a recruté 415 sujets (la moitié randomisés pour recevoir du carvédilol) souffrant d'insuffisance cardiaque moins grave. Tous les protocoles excluaient les sujets devant subir une transplantation cardiaque au cours des 7,5 à 15 mois de suivi en double aveugle. Tous les sujets randomisés avaient toléré un cours de 2 semaines sur le carvédilol 6,25 mg deux fois par jour.
Dans chaque essai, il y avait un critère d'évaluation principal, soit la progression de l'insuffisance cardiaque (1 essai américain) ou la tolérance à l'effort (2 essais américains atteignant les objectifs de recrutement et l'essai Australie-Nouvelle-Zélande). De nombreux critères d'évaluation secondaires ont été spécifiés dans ces essais, notamment la classification NYHA, les évaluations globales des patients et des médecins et l'hospitalisation cardiovasculaire. D'autres analyses non planifiées prospectivement comprenaient la somme des décès et le nombre total d'hospitalisations cardiovasculaires. Dans les situations où les principaux critères d'évaluation d'un essai ne montrent pas un bénéfice significatif du traitement, l'attribution de valeurs de signification aux autres résultats est complexe, et ces valeurs doivent être interprétées avec prudence.
Les résultats des essais américains et australo-néo-zélandais étaient les suivants :
Ralentir la progression de l'insuffisance cardiaque
Un essai multicentrique américain (366 sujets) avait comme critère d'évaluation principal la somme de la mortalité cardiovasculaire, des hospitalisations cardiovasculaires et de l'augmentation soutenue des médicaments contre l'insuffisance cardiaque. La progression de l'insuffisance cardiaque a été réduite, au cours d'un suivi moyen de 7 mois, de 48 % (P = 0,008).
Dans l'essai Australie-Nouvelle-Zélande, les décès et les hospitalisations totales ont été réduits d'environ 25 % sur une période de 18 à 24 mois. Dans les 3 plus grands essais américains, les décès et les hospitalisations totales ont été réduits de 19 %, 39 % et 49 %, ce qui est statistiquement significatif dans les 2 derniers essais. Les résultats Australie-Nouvelle-Zélande étaient statistiquement limites.
Mesures fonctionnelles
Aucun des essais multicentriques n'avait la classification NYHA comme critère d'évaluation principal, mais tous ces essais l'avaient comme critère d'évaluation secondaire. Il y avait au moins une tendance à l'amélioration de la classe NYHA dans tous les essais. La tolérance à l'effort était le critère d'évaluation principal dans 3 essais ; aucun effet statistiquement significatif n'a été trouvé.
Mesures subjectives
La qualité de vie liée à la santé, telle que mesurée à l'aide d'un questionnaire standard (critère d'évaluation principal dans 1 essai), n'a pas été affectée par le carvédilol. Cependant, les évaluations globales des patients et des investigateurs ont montré une amélioration significative dans la plupart des essais.
Mortalité
La mort n'était pas un point final pré-spécifié dans aucun essai, mais a été analysée dans tous les essais. Dans l'ensemble, dans ces 4 essais américains, la mortalité a été réduite, de manière nominalement significative dans 2 essais.
L'essai COMET
Dans cet essai en double aveugle, 3 029 sujets atteints d'insuffisance cardiaque de classe NYHA II-IV (fraction d'éjection ventriculaire gauche inférieure ou égale à 35 %) ont été randomisés pour recevoir soit du carvédilol (dose cible : 25 mg deux fois par jour) soit du métoprolol à libération immédiate. tartrate (dose cible : 50 mg deux fois par jour). L'âge moyen des sujets était d'environ 62 ans, 80 % étaient des hommes et la fraction d'éjection ventriculaire gauche moyenne au départ était de 26 %. Environ 96 % des sujets présentaient une insuffisance cardiaque de classe NYHA II ou III. Le traitement concomitant comprenait des diurétiques (99 %), des inhibiteurs de l'ECA (91 %), des digitaliques (59 %), des antagonistes de l'aldostérone (11 %) et des hypolipémiants « statines » (21 %). La durée moyenne de suivi était de 4,8 ans. La dose moyenne de carvédilol était de 42 mg par jour.
L'essai avait 2 critères d'évaluation principaux : la mortalité toutes causes confondues et le composite décès plus hospitalisation pour quelque raison que ce soit. Les résultats de COMET sont présentés dans le tableau 3 ci-dessous. La mortalité toutes causes confondues portait la majeure partie du poids statistique et était le principal déterminant de la taille de l'essai. La mortalité toutes causes confondues était de 34 % chez les sujets traités par carvédilol et de 40 % dans le groupe métoprolol à libération immédiate (P = 0,0017 ; risque relatif = 0,83, IC à 95 % : 0,74 à 0,93). L'effet sur la mortalité était principalement dû à une réduction de la mortalité cardiovasculaire. La différence entre les 2 groupes par rapport au critère composite n'était pas significative (P = 0,122). La survie moyenne estimée était de 8,0 ans avec le carvédilol et de 6,6 ans avec le métoprolol à libération immédiate.
On ne sait pas si cette formulation de métoprolol à n'importe quelle dose ou cette faible dose de métoprolol dans n'importe quelle formulation a un effet sur la survie ou l'hospitalisation chez les patients souffrant d'insuffisance cardiaque. Ainsi, cet essai prolonge la durée pendant laquelle le carvédilol manifeste des avantages sur la survie dans l'insuffisance cardiaque, mais il n'est pas prouvé que le carvédilol améliore les résultats par rapport à la formulation du métoprolol (TOPROL-XL) avec des avantages dans l'insuffisance cardiaque.
Insuffisance cardiaque sévère (COPERNICUS)
Dans un essai en double aveugle (COPERNICUS), 2 289 sujets souffrant d'insuffisance cardiaque au repos ou avec un effort minimal et une fraction d'éjection ventriculaire gauche inférieure à 25 % (moyenne 20 %), malgré la digitaline (66 %), les diurétiques (99 %) et Les inhibiteurs de l'ECA (89 %) ont été randomisés pour recevoir un placebo ou du carvédilol. Le carvédilol a été titré à partir d'une dose initiale de 3,125 mg deux fois par jour jusqu'à la dose maximale tolérée ou jusqu'à 25 mg deux fois par jour sur un minimum de 6 semaines. La plupart des sujets ont atteint la dose cible de 25 mg. L'essai a été mené en Europe de l'Est et de l'Ouest, aux États-Unis, en Israël et au Canada. Des nombres similaires de sujets par groupe (environ 100) se sont retirés pendant la période de titration.
Le principal critère d'évaluation de l'essai était la mortalité toutes causes confondues, mais la mortalité par cause spécifique et le risque de décès ou d'hospitalisation (total, cardiovasculaire [CV] ou insuffisance cardiaque [IC]) ont également été examinés. Les données d'essai en développement ont été suivies par un comité de surveillance des données, et les analyses de mortalité ont été ajustées pour ces multiples regards. L'essai a été arrêté après un suivi médian de 10 mois en raison d'une réduction observée de 35 % de la mortalité (de 19,7 % par patient-année sous placebo à 12,8 % sous carvédilol ; risque relatif 0,65, IC à 95 % : 0,52 à 0,81, P = 0,0014, ajusté) (voir Figure 1). Les résultats de COPERNICUS sont présentés dans le tableau 4.
Figure 1. Analyse de survie pour COPERNICUS (intention de traiter) 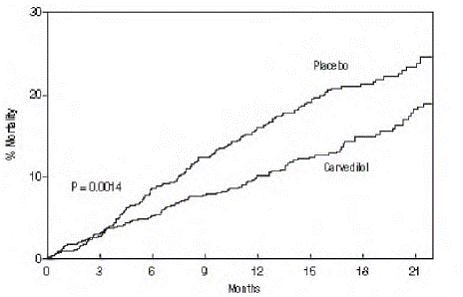
L'effet sur la mortalité résultait principalement d'une réduction du taux de mort subite chez les sujets sans aggravation de l'insuffisance cardiaque.
Les évaluations globales des patients, dans lesquelles les sujets traités par le carvédilol ont été comparés à un placebo, étaient basées sur des auto-évaluations périodiques prédéfinies des patients concernant l'amélioration, l'aggravation ou l'absence de changement de l'état clinique après le traitement par rapport à la valeur initiale. Les sujets traités avec du carvédilol ont montré des améliorations significatives dans les évaluations globales par rapport à ceux traités avec un placebo dans COPERNICUS.
Le protocole précisait également que les hospitalisations seraient évaluées. Moins de sujets sous COREG 6,25 mg que sous placebo ont été hospitalisés pour une raison quelconque (372 contre 432, P = 0,0029), pour des raisons cardiovasculaires (246 contre 314, P = 0,0003) ou pour une aggravation de l'insuffisance cardiaque (198 contre 268, P = 0,0001 ).
COREG 6,25 mg a eu un effet constant et bénéfique sur la mortalité toutes causes confondues ainsi que sur les critères d'évaluation combinés de la mortalité toutes causes plus hospitalisation (totale, CV ou pour insuffisance cardiaque) dans la population globale de l'essai et dans tous les sous-groupes examinés, y compris hommes et femmes, personnes âgées et non âgées, noirs et non noirs, diabétiques et non diabétiques (voir la figure 2).
Figure 2. Effets sur la mortalité pour les sous-groupes dans COPERNICUS 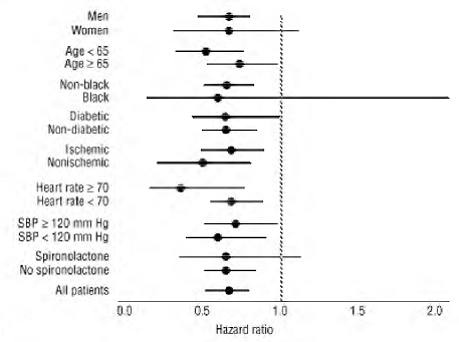
Dysfonctionnement ventriculaire gauche après un infarctus du myocarde
CAPRICORN était un essai en double aveugle comparant le carvédilol et un placebo chez 1 959 sujets ayant un infarctus du myocarde récent (dans les 21 jours) et une fraction d'éjection ventriculaire gauche inférieure ou égale à 40 %, avec (47 %) ou sans symptômes d'insuffisance cardiaque. Les sujets ayant reçu du carvédilol ont reçu 6,25 mg deux fois par jour, titrés selon la tolérance à 25 mg deux fois par jour. Les sujets devaient avoir une pression artérielle systolique supérieure à 90 mm Hg, une fréquence cardiaque en position assise supérieure à 60 battements par minute et aucune contre-indication à l'utilisation des bêta-bloquants. Le traitement de l'infarctus index comprenait de l'aspirine (85 %), des bêta-bloquants IV ou oraux (37 %), des nitrates (73 %), de l'héparine (64 %), des thrombolytiques (40 %) et une angioplastie aiguë (12 %). Le traitement de fond comprenait des inhibiteurs de l'ECA ou des antagonistes des récepteurs de l'angiotensine (97 %), des anticoagulants (20 %), des agents hypolipémiants (23 %) et des diurétiques (34 %). Les caractéristiques de base de la population comprenaient un âge moyen de 63 ans, 74 % d'hommes, 95 % de race blanche, une tension artérielle moyenne de 121/74 mm Hg, 22 % de diabète et 54 % d'antécédents d'hypertension. La dose moyenne obtenue de carvédilol était de 20 mg deux fois par jour ; la durée moyenne de suivi était de 15 mois.
La mortalité toutes causes confondues était de 15 % dans le groupe placebo et de 12 % dans le groupe carvédilol, indiquant une réduction du risque de 23 % chez les sujets traités par carvédilol (IC à 95 % : 2 % à 40 %, P = 0,03), comme le montre la figure 3. Les effets sur la mortalité dans divers sous-groupes sont illustrés à la figure 4. Presque tous les décès étaient cardiovasculaires (qui ont été réduits de 25 % par le carvédilol), et la plupart de ces décès étaient soudains ou liés à une défaillance de la pompe (les deux types de décès ont été réduits par le carvédilol). Un autre critère d'évaluation de l'essai, la mortalité totale et l'hospitalisation toutes causes confondues, n'a pas montré d'amélioration significative.
Une réduction significative de 40 % des infarctus du myocarde mortels ou non mortels a également été observée dans le groupe traité par le carvédilol (IC à 95 % : 11 % à 60 %, P = 0,01). Une réduction similaire du risque d'infarctus du myocarde a également été observée dans une méta-analyse d'essais contrôlés par placebo sur le carvédilol dans l'insuffisance cardiaque.
Figure 3. Analyse de survie pour CAPRICORN (intention de traiter) 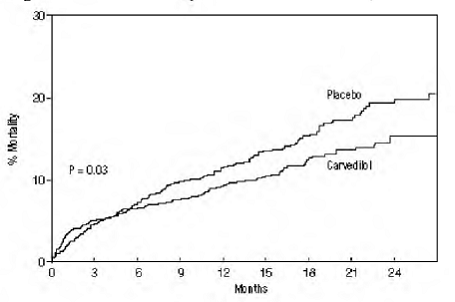
Figure 4. Effets sur la mortalité pour les sous-groupes de CAPRICORNE 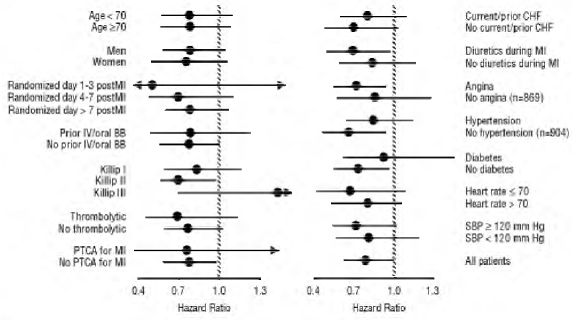
Hypertension
COREG 25mg a été étudié dans 2 procès contrôlés du placebo qui ont utilisé le dosage biquotidien aux doses quotidiennes totales de 12.5 à 50 mgs. Dans ces essais et d'autres, la dose initiale ne dépassait pas 12,5 mg. À 50 mg par jour, COREG a réduit la tension artérielle en position assise (12 heures) d'environ 9/5,5 mm Hg ; à 25 mg par jour, l'effet était d'environ 7,5/3,5 mm Hg. Les comparaisons de la pression artérielle entre le creux et le pic ont montré un rapport entre le creux et le pic pour la réponse de la pression artérielle d'environ 65 %. La fréquence cardiaque a chuté d'environ 7,5 battements par minute à 50 mg par jour. En général, comme c'est le cas pour les autres β-bloquants, les réponses étaient plus faibles chez les sujets noirs que chez les sujets non noirs. Il n'y avait pas de différences liées à l'âge ou au sexe dans la réponse.
L'effet antihypertenseur maximal s'est produit 1 à 2 heures après une dose. La réponse tensionnelle dose-dépendante s'est accompagnée d'une augmentation dose-dépendante des effets indésirables [voir EFFETS INDÉSIRABLES ].
Hypertension avec diabète sucré de type 2
Dans un essai en double aveugle (GEMINI), COREG 25 mg, ajouté à un inhibiteur de l'ECA ou à un bloqueur des récepteurs de l'angiotensine, a été évalué dans une population souffrant d'hypertension légère à modérée et de diabète sucré de type 2 bien contrôlé. L'HbA1c moyenne à l'inclusion était de 7,2 %. COREG a été titré à une dose moyenne de 17,5 mg deux fois par jour et maintenu pendant 5 mois. COREG n'a eu aucun effet indésirable sur le contrôle glycémique, sur la base des mesures de l'HbA1c (changement moyen par rapport au départ de 0,02 %, IC à 95 % : -0,06 à 0,10, P = NS) [voir AVERTISSEMENTS ET PRECAUTIONS ].
INFORMATIONS PATIENTS
COREG (Co-REG) (carvédilol) Comprimés
Lisez les informations patient fournies avec COREG avant de commencer à le prendre et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre médecin au sujet de votre état de santé ou de votre traitement. Si vous avez des questions sur COREG 3,12 mg, interrogez votre médecin ou votre pharmacien.
Qu'est-ce que COREG 3,12 mg ?
COREG est un médicament délivré sur ordonnance qui appartient à un groupe de médicaments appelés « bêta-bloquants ». COREG 6,25 mg est utilisé, souvent avec d'autres médicaments, pour les affections suivantes :
- pour traiter les patients atteints de certains types d'insuffisance cardiaque
- pour traiter les patients qui ont eu une crise cardiaque qui a aggravé la façon dont le cœur pompe
- pour traiter les patients souffrant d'hypertension artérielle (hypertension)
COREG n'est pas approuvé pour une utilisation chez les enfants de moins de 18 ans.
Qui ne devrait pas prendre COREG ?
Ne prenez pas COREG 6,25 mg si vous :
- avez une insuffisance cardiaque grave et êtes hospitalisé en unité de soins intensifs ou avez besoin de certains médicaments intraveineux qui aident à soutenir la circulation (médicaments inotropes).
- sont sujets à l'asthme ou à d'autres problèmes respiratoires.
- avoir un rythme cardiaque lent ou un cœur qui saute un battement (rythme cardiaque irrégulier).
- avoir des problèmes de foie.
- êtes allergique à l'un des ingrédients de COREG. L'ingrédient actif est le carvédilol. Voir la fin de cette notice pour une liste de tous les ingrédients de COREG.
Que dois-je dire à mon médecin avant de prendre COREG ?
Informez votre médecin de toutes vos conditions médicales, y compris si vous :
- avez de l'asthme ou d'autres problèmes pulmonaires (tels que la bronchite ou l'emphysème).
- avez des problèmes de circulation sanguine dans les pieds et les jambes (maladie vasculaire périphérique). COREG 3,12 mg peut aggraver certains de vos symptômes.
- avoir le diabète.
- avoir des problèmes de thyroïde.
- avoir une maladie appelée phéochromocytome.
- ont eu des réactions allergiques graves.
- êtes enceinte ou essayez de devenir enceinte. On ne sait pas si COREG est sans danger pour votre bébé à naître. Vous et votre médecin devriez discuter de la meilleure façon de contrôler votre hypertension pendant la grossesse.
- allaitent. On ne sait pas si COREG passe dans votre lait maternel. Discutez avec votre médecin de la meilleure façon de nourrir votre bébé si vous prenez COREG.
- doivent subir une intervention chirurgicale et recevront des agents anesthésiques.
- sont programmés pour la chirurgie de cataracte et ont pris ou prennent actuellement COREG.
- prenez des médicaments sur ordonnance ou en vente libre, des vitamines et des suppléments à base de plantes. COREG et certains autres médicaments peuvent s'affecter et provoquer des effets secondaires graves. COREG 3,12 mg peut affecter le fonctionnement d'autres médicaments. En outre, d'autres médicaments peuvent affecter l'efficacité de COREG 25 mg.
Gardez une liste de tous les médicaments que vous prenez. Montrez cette liste à votre médecin et à votre pharmacien avant de commencer un nouveau médicament.
Comment devrais-je prendre COREG?
Il est important que vous preniez votre médicament chaque jour selon les directives de votre médecin. Si vous arrêtez de prendre COREG soudainement, vous pourriez avoir des douleurs thoraciques et/ou une crise cardiaque. Si votre docteur décide que vous devriez arrêter de prendre COREG 6.25mg, votre docteur peut abaisser lentement votre dose sur une période de temps avant de l'arrêter complètement.
- Prenez COREG exactement comme prescrit. Votre médecin vous dira combien de comprimés prendre et à quelle fréquence. Afin de minimiser les effets secondaires possibles, votre médecin peut commencer par une faible dose, puis augmenter lentement la dose.
- N'arrêtez pas de prendre COREG et ne changez pas la quantité de COREG que vous prenez sans parler à votre docteur.
- Informez votre médecin si vous prenez du poids ou si vous avez du mal à respirer pendant que vous prenez COREG.
- Prenez COREG avec de la nourriture.
- Si vous manquez une dose de COREG 3.12mg, prenez votre dose dès que vous vous souvenez, à moins qu'il soit temps de prendre votre prochaine dose. Prenez votre prochaine dose à l'heure habituelle. Ne prenez pas 2 doses en même temps.
- Si vous avez pris trop de COREG 25 mg, appelez immédiatement votre médecin ou votre centre antipoison.
Que dois-je éviter en prenant COREG 3,12 mg ?
- COREG peut provoquer des étourdissements, de la fatigue ou des évanouissements. Ne conduisez pas de voiture, n'utilisez pas de machines ou ne faites rien qui nécessite que vous soyez vigilant si vous présentez ces symptômes.
Quels sont les effets secondaires possibles de COREG?
- Pression artérielle basse (pouvant provoquer des étourdissements ou des évanouissements lorsque vous vous levez). Si cela se produit, asseyez-vous ou allongez-vous immédiatement et parlez-en à votre médecin.
- Fatigue. Si vous vous sentez fatigué ou étourdi, vous ne devez pas conduire, utiliser de machines ou faire quoi que ce soit qui nécessite votre vigilance.
- Rythme cardiaque lent.
- Changements dans votre glycémie. Si vous souffrez de diabète, informez votre médecin si vous constatez des changements dans votre glycémie.
- COREG peut masquer certains des symptômes de l'hypoglycémie, en particulier un rythme cardiaque rapide.
- COREG peut masquer les symptômes de l'hyperthyroïdie (thyroïde hyperactive).
- Aggravation des réactions allergiques sévères.
- Des réactions allergiques rares mais graves (y compris de l'urticaire ou un gonflement du visage, des lèvres, de la langue et/ou de la gorge pouvant entraîner des difficultés à respirer ou à avaler) se sont produites chez des patients sous COREG. Ces réactions peuvent mettre la vie en danger.
Les autres effets secondaires de COREG comprennent l'essoufflement, la prise de poids, la diarrhée et moins de larmes ou de sécheresse oculaire qui deviennent gênants si vous portez des lentilles de contact.
Appelez votre médecin si vous avez des effets secondaires qui vous dérangent ou qui ne disparaissent pas.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA1088.
Comment dois-je conserver COREG 6,25 mg ?
- Conservez COREG à moins de 86°F (30°C). Gardez les comprimés au sec.
- En toute sécurité, jetez COREG qui est obsolète ou qui n'est plus nécessaire.
- Gardez COREG 6,25 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur COREG
Des médicaments sont parfois prescrits pour des affections autres que celles décrites dans les notices d'information destinées aux patients. N'utilisez pas COREG 3,12 mg pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas COREG à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Cette brochure résume les informations les plus importantes sur COREG. Si vous souhaitez plus d'informations, parlez-en à votre médecin. Vous pouvez demander à votre médecin ou à votre pharmacien des informations sur COREG 6,25 mg destinées aux professionnels de la santé.
Quels sont les ingrédients de COREG ?
Ingrédient actif : carvédilol.
Ingrédients inactifs : dioxyde de silicium colloïdal, crospovidone, hypromellose, lactose, stéarate de magnésium, polyéthylèneglycol, polysorbate 80, povidone, saccharose et dioxyde de titane.
Les comprimés de carvédilol sont disponibles dans les dosages suivants : 3,125 mg, 6,25 mg, 12,5 mg, 25 mg.
Qu'est-ce que l'hypertension artérielle (hypertension) ?
La tension artérielle est la force du sang dans vos vaisseaux sanguins lorsque votre cœur bat et lorsque votre cœur se repose. Vous avez une pression artérielle élevée lorsque la force est trop forte. L'hypertension artérielle oblige le cœur à travailler plus fort pour pomper le sang dans le corps et endommage les vaisseaux sanguins. COREG peut aider vos vaisseaux sanguins à se détendre afin que votre tension artérielle soit plus basse. Les médicaments qui abaissent la tension artérielle peuvent réduire votre risque d'avoir un accident vasculaire cérébral ou une crise cardiaque.
