Hyzaar 12.5mg Hydrochlorothiazide Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Hyzaar et comment est-il utilisé ?
Hyzaar 12,5 mg est un médicament d'ordonnance utilisé pour traiter les symptômes de l'hypertension artérielle (hypertension). Hyzaar peut être utilisé seul ou avec d'autres médicaments.
Hyzaar appartient à une classe de médicaments appelée ARB/HCTZ Combos.
On ne sait pas si Hyzaar est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Hyzaar 12,5 mg ?
Hyzaar peut provoquer des effets secondaires graves, notamment :
- étourdissement,
- battements cardiaques irréguliers,
- douleur oculaire,
- problèmes de vue,
- peu ou pas de miction,
- prise de poids rapide,
- gonflement des mains, des pieds ou des chevilles,
- douleur articulaire,
- éruption cutanée sur les joues ou les bras qui s'aggrave au soleil,
- augmentation de la soif,
- augmentation de la miction,
- confusion,
- vomissement,
- constipation,
- douleur musculaire,
- crampes dans les jambes,
- grande faiblesse,
- engourdissement ou fourmillement,
- perte de mouvement, et
- se sentir nerveux ou instable
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Hyzaar incluent :
- vertiges,
- maux de dos, et
- symptômes du rhume (nez bouché, éternuements, mal de gorge)
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Hyzaar. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
TOXICITÉ FŒTALE
Lorsqu'une grossesse est détectée, arrêtez HYZAAR dès que possible. Les médicaments qui agissent directement sur le système rénine-angiotensine peuvent causer des lésions et la mort du fœtus en développement [voir AVERTISSEMENTS ET PRECAUTIONS ].
LA DESCRIPTION
Les comprimés HYZAAR 50/12.5 (losartan potassique-hydrochlorothiazide), HYZAAR 100/12.5 (losartan potassique hydrochlorothiazide) et HYZAAR 100/25 (losartan potassique-hydrochlorothiazide) associent un antagoniste des récepteurs de l'angiotensine II agissant sur le sous-type des récepteurs AT1 et un diurétique, l'hydrochlorothiazide.
Le losartan potassique, une molécule non peptidique, est chimiquement décrit comme le sel monopotassique de 2-butyl-4-chloro-1-[p-(o-1H-tétrazol-5-ylphényl)benzyl]imidazole-5-méthanol. Sa formule empirique est C22H22ClKN6O et sa formule structurale est :
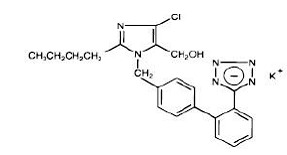
Le losartan potassique est une poudre cristalline fluide blanche à blanc cassé d'un poids moléculaire de 461,01. Il est librement soluble dans l'eau, soluble dans les alcools et légèrement soluble dans les solvants organiques courants, tels que l'acétonitrile et la méthyléthylcétone.
L'oxydation du groupe 5-hydroxyméthyle sur le cycle imidazole donne le métabolite actif du losartan.
L'hydrochlorothiazide est le 6-chloro-3,4-dihydro-2H-1,2,4-benzothiadiazine-7-sulfonamide 1,1-dioxyde. Sa formule empirique est C7H8ClN3O4S2 et sa formule structurale est :
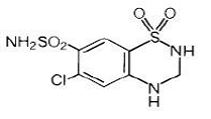
L'hydrochlorothiazide est une poudre cristalline blanche ou pratiquement blanche d'un poids moléculaire de 297,74, légèrement soluble dans l'eau, mais librement soluble dans une solution d'hydroxyde de sodium.
HYZAAR est disponible pour l'administration orale en trois combinaisons de comprimés de losartan et d'hydrochlorothiazide. HYZAAR 50/12,5 contient 50 mg de losartan potassique et 12,5 mg d'hydrochlorothiazide. HYZAAR 100/12,5 contient 100 mg de losartan potassique et 12,5 mg d'hydrochlorothiazide. HYZAAR 100/25 contient 100 mg de losartan potassique et 25 mg d'hydrochlorothiazide. Les ingrédients inactifs sont la cellulose microcristalline, le lactose hydraté, l'amidon prégélatinisé, le stéarate de magnésium, l'hydroxypropylcellulose, l'hypromellose et le dioxyde de titane.
HYZAAR 50/12.5 et HYZAAR 100/25 contiennent également de la laque d'aluminium D&C jaune n° 10. HYZAAR 50/12.5, HYZAAR 100/12.5 et HYZAAR 100/25 peuvent également contenir de la cire de carnauba.
HYZAAR 50/12.5 contient 4,24 mg (0,108 mEq) de potassium, HYZAAR 100/12,5 contient 8,48 mg (0,216 mEq) de potassium et HYZAAR 100/25 contient 8,48 mg (0,216 mEq) de potassium.
LES INDICATIONS
Hypertension
HYZAAR® est indiqué pour le traitement de l'hypertension, pour abaisser la tension artérielle. L'abaissement de la pression artérielle réduit le risque d'événements cardiovasculaires (CV) mortels et non mortels, principalement des accidents vasculaires cérébraux et des infarctus du myocarde. Ces avantages ont été observés dans des essais contrôlés de médicaments antihypertenseurs appartenant à une grande variété de classes pharmacologiques, notamment le losartan et l'hydrochlorothiazide.
Le contrôle de l'hypertension artérielle doit faire partie d'une gestion globale des risques cardiovasculaires, y compris, le cas échéant, le contrôle des lipides, la gestion du diabète, la thérapie antithrombotique, l'arrêt du tabac, l'exercice et un apport limité en sodium. De nombreux patients auront besoin de plus d'un médicament pour atteindre leurs objectifs de tension artérielle. Pour des conseils spécifiques sur les objectifs et la gestion, consultez les directives publiées, telles que celles du Comité national mixte sur la prévention, la détection, l'évaluation et le traitement de l'hypertension artérielle (JNC) du National High Blood Pressure Education Program.
De nombreux médicaments antihypertenseurs, appartenant à une variété de classes pharmacologiques et avec différents mécanismes d'action, ont été montrés dans des essais contrôlés randomisés pour réduire la morbidité et la mortalité cardiovasculaires, et on peut conclure qu'il s'agit de la réduction de la pression artérielle, et non d'une autre propriété pharmacologique de les médicaments, qui est en grande partie responsable de ces avantages. Le bénéfice cardiovasculaire le plus important et le plus constant a été une réduction du risque d'accident vasculaire cérébral, mais des réductions de l'infarctus du myocarde et de la mortalité cardiovasculaire ont également été observées régulièrement.
Une pression systolique ou diastolique élevée entraîne un risque cardiovasculaire accru, et l'augmentation du risque absolu par mmHg est plus importante à des pressions artérielles plus élevées, de sorte que même des réductions modestes de l'hypertension sévère peuvent apporter des avantages substantiels. La réduction du risque relatif de la réduction de la pression artérielle est similaire dans les populations avec un risque absolu variable, de sorte que le bénéfice absolu est plus important chez les patients qui présentent un risque plus élevé indépendamment de leur hypertension (par exemple, les patients atteints de diabète ou d'hyperlipidémie), et ces patients seraient attendus bénéficier d'un traitement plus agressif à un objectif de tension artérielle plus basse.
Certains médicaments antihypertenseurs ont des effets plus faibles sur la pression artérielle (en monothérapie) chez les patients noirs, et de nombreux médicaments antihypertenseurs ont des indications et des effets supplémentaires approuvés (par exemple, sur l'angine de poitrine, l'insuffisance cardiaque ou la maladie rénale diabétique). Ces considérations peuvent guider le choix du traitement.
Cette association à dose fixe n'est pas indiquée pour le traitement initial de l'hypertension, sauf lorsque l'hypertension est suffisamment grave pour que l'intérêt d'obtenir un contrôle rapide de la pression artérielle dépasse le risque d'initier une thérapie d'association chez ces patients [voir Etudes cliniques et DOSAGE ET ADMINISTRATION ].
HYZAAR peut être administré avec d'autres antihypertenseurs.
Patients hypertendus avec hypertrophie ventriculaire gauche
HYZAAR est indiqué pour réduire le risque d'accident vasculaire cérébral chez les patients souffrant d'hypertension et d'hypertrophie ventriculaire gauche, mais il existe des preuves que cet avantage ne s'applique pas aux patients noirs. [Voir Utilisation dans des populations spécifiques , PHARMACOLOGIE CLINIQUE , et DOSAGE ET ADMINISTRATION .]
DOSAGE ET ADMINISTRATION
Hypertension
La dose initiale habituelle d'HYZAAR est de 50/12,5 (losartan 50 mg/hydrochlorothiazide 12,5 mg) une fois par jour. La posologie peut être augmentée après 3 semaines de traitement jusqu'à un maximum de 100/25 (losartan 100 mg/hydrochlorothiazide 25 mg) une fois par jour selon les besoins pour contrôler la pression artérielle [voir Etudes cliniques ].
Initier un patient dont la tension artérielle n'est pas suffisamment contrôlée avec losart une monothérapie de 50 mg avec HYZAAR 50/12,5 une fois par jour. Si la pression artérielle reste incontrôlée après environ 3 semaines de traitement, la posologie peut être augmentée à deux comprimés de HYZAAR 50/12,5 une fois par jour ou à un comprimé de HYZAAR 100/25 une fois par jour.
Initier un patient dont la tension artérielle n'est pas suffisamment contrôlée par le losartan 100 mg en monothérapie avec HYZAAR 100/12,5 (losartan 100 mg/hydrochlorothiazide 12,5 mg) une fois par jour. Si la pression artérielle reste incontrôlée après environ 3 semaines de traitement, augmentez la dose à deux comprimés de HYZAAR 50/12,5 une fois par jour ou à un comprimé de HYZAAR 100/25 une fois par jour.
Initier un patient dont la pression artérielle est insuffisamment contrôlée avec de l'hydrochlorothiazide 25 mg une fois par jour, ou est contrôlée mais qui présente une hypokaliémie avec ce régime, sur HYZAAR 50/12,5 une fois par jour, en réduisant la dose d'hydrochlorothiazide sans réduire la réponse antihypertensive globale attendue. Évaluez la réponse clinique à HYZAAR 50/12,5 et, si la pression artérielle reste incontrôlée après environ 3 semaines de traitement, augmentez la dose à deux comprimés de HYZAAR 50/12,5 une fois par jour ou à un comprimé de HYZAAR 100/25 une fois par jour.
Patients hypertendus avec hypertrophie ventriculaire gauche
Chez les patients dont la tension artérielle n'est pas suffisamment contrôlée avec 50 mg de losartan potassique, initier un traitement par HYZAAR 50/12,5. Si une réduction supplémentaire de la pression artérielle est nécessaire, augmentez la dose à HYZAAR 100/12,5, suivi de HYZAAR 100/25. Pour une réduction supplémentaire de la pression artérielle, ajouter d'autres antihypertenseurs [voir Etudes cliniques ].
COMMENT FOURNIE
Formes posologiques et points forts
- HYZAAR 50/12,5 sont des comprimés pelliculés jaunes, ovales, portant le code 717 sur une face.
- HYZAAR 100/12,5 sont des comprimés pelliculés blancs, ovales, portant le code 745 sur une face.
- HYZAAR 100/25 sont des comprimés pelliculés jaune clair, ovales, avec le code 747 sur une face.
Stockage et manutention
HYZAAR est fourni sous forme de comprimé pelliculé.
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15-30°C (59-86°F) [voir Température ambiante contrôlée USP ]. Conserver le récipient bien fermé. Protéger de la lumière.
Fabriqué pour : Organon LLC, une filiale d'ORGANON & Co., Jersey City, NJ 07302, USA. Révisé : juin 2021
EFFETS SECONDAIRES
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
L'hydrochlorothiazide potassique de losartan a été évalué pour l'innocuité chez 858 patients traités pour une hypertension essentielle et 3889 patients traités pour une hypertension et une hypertrophie ventriculaire gauche. La plupart des effets indésirables ont été légers et transitoires et n'ont pas nécessité l'arrêt du traitement. Dans les essais cliniques contrôlés, l'arrêt du traitement en raison d'événements indésirables cliniques n'a été nécessaire que chez 2,8 % et 2,3 % des patients traités respectivement par l'association et le placebo.
Dans ces essais cliniques contrôlés en double aveugle, les effets indésirables survenus chez plus de 2 % des sujets traités par losartan-hydrochlorothiazide et à un taux supérieur à celui du placebo étaient : douleurs dorsales (2,1 % contre 0,6 %), étourdissements (5,7 % contre 2,9 %) , et infection des voies respiratoires supérieures (6,1 % contre 4,6 %).
Les réactions défavorables additionnelles suivantes ont été annoncées dans les essais cliniques avec HYZAAR et/ou les composantes individuelles :
Affections hématologiques et du système lymphatique : Anémie, anémie aplasique, anémie hémolytique, leucopénie, agranulocytose.
Troubles du métabolisme et de la nutrition : Anorexie, hyperglycémie, hyperuricémie, déséquilibre électrolytique, y compris hyponatrémie et hypokaliémie.
Troubles psychiatriques: Insomnie, agitation.
Troubles du système nerveux : Dysgueusie, céphalées, migraine, paresthésies.
Troubles oculaires : Xanthopsie, vision trouble transitoire.
Troubles cardiaques : Palpitations, tachycardie.
Affections vasculaires : Effets orthostatiques liés à la dose, angéite nécrosante (vascularite, vascularite cutanée).
Troubles respiratoires, thoraciques et médiastinaux : Congestion nasale.
Problèmes gastro-intestinaux: Dyspepsie, douleurs abdominales, irritation gastrique, crampes, nausées, vomissements, pancréatite, sialoadénite.
Affections hépato-biliaires : Ictère (ictère cholestatique intrahépatique).
Affections de la peau et du tissu sous-cutané : Rash, prurit, purpura, nécrolyse épidermique toxique, urticaire, photosensibilité, lupus érythémateux cutané.
Troubles musculo-squelettiques et du tissu conjonctif : Crampes musculaires, spasmes musculaires.
Troubles rénaux et urinaires : Glycosurie, dysfonctionnement rénal, néphrite interstitielle, insuffisance rénale.
Troubles de l'appareil reproducteur et des seins : Dysfonction érectile/impuissance.
Troubles généraux et anomalies au site d'administration : Douleur thoracique, malaise, faiblesse.
Enquêtes : Anomalies de la fonction hépatique.
Toux
Une toux sèche persistante a été associée à l'utilisation d'inhibiteurs de l'ECA et, dans la pratique, peut être une cause d'arrêt du traitement par les inhibiteurs de l'ECA. Deux essais prospectifs, à groupes parallèles, à double insu, randomisés et contrôlés ont été menés pour évaluer les effets du losartan sur l'incidence de la toux chez les patients hypertendus qui avaient toussé pendant qu'ils recevaient un traitement par inhibiteur de l'ECA. Les patients qui présentaient une toux typique d'un inhibiteur de l'ECA lors d'une provocation avec du lisinopril, dont la toux a disparu sous placebo, ont été randomisés pour recevoir du losartan 50 mg, du lisinopril 20 mg ou un placebo (une étude, n = 97) ou de l'hydrochlorothiazide 25 mg (n = 135). La période de traitement en double aveugle a duré jusqu'à 8 semaines. L'incidence de la toux est indiquée dans le tableau 1 ci-dessous.
Ces études démontrent que l'incidence de la toux associée au traitement par le losartan, dans une population qui avait tous de la toux associée au traitement par inhibiteur de l'ECA, est similaire à celle associée au traitement par l'hydrochlorothiazide ou un placebo.
Des cas de toux, y compris des reprises positives, ont été rapportés avec l'utilisation du losartan depuis la commercialisation.
Expérience post-commercialisation
Les réactions défavorables suivantes ont été identifiées pendant l'utilisation de post-approbation de HYZAAR. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer leur fréquence de manière fiable ou d'établir une relation causale avec l'exposition au médicament.
Digestif: De rares cas d'hépatite ont été rapportés chez des patients traités par le losartan.
Hématologique : Thrombocytopénie.
Hypersensibilité : Un œdème de Quincke, y compris un gonflement du larynx et de la glotte, provoquant une obstruction des voies respiratoires et/ou un gonflement du visage, des lèvres, du pharynx et/ou de la langue, a été rarement rapporté chez des patients traités par losartan ; certains de ces patients ont déjà présenté un œdème de Quincke avec d'autres médicaments, y compris des inhibiteurs de l'ECA. Des vascularites, y compris le purpura de Henoch-Schönlein, ont été rapportées avec le losartan. Des réactions anaphylactiques ont été rapportées.
Musculo-squelettique : Rhabdomyolyse.
Peau: Érythrodermie.
Cancer de la peau autre que le mélanome : L'hydrochlorothiazide est associé à un risque accru de cancer de la peau autre que le mélanome. Dans une étude menée dans le système Sentinel, le risque accru était principalement pour le carcinome épidermoïde (SCC) et chez les patients blancs prenant de fortes doses cumulatives. Le risque accru de SCC dans la population globale était d'environ 1 cas supplémentaire pour 16 000 patients par an, et pour les patients blancs prenant une dose cumulée de ≥ 50 000 mg, l'augmentation du risque était d'environ 1 cas supplémentaire de SCC pour 6 700 patients par an.
INTERACTIONS MÉDICAMENTEUSES
Agents augmentant le potassium sérique
L'administration concomitante de losartan avec d'autres médicaments qui augmentent les taux sériques de potassium peut entraîner une hyperkaliémie. Surveiller le potassium sérique chez ces patients.
Lithium
Des augmentations des concentrations sériques de lithium et de la toxicité du lithium ont été rapportées lors de l'utilisation concomitante d'antagonistes des récepteurs de l'angiotensine II ou de diurétiques thiazidiques. Surveiller les niveaux de lithium chez les patients recevant HYZAAR 12,5 mg et du lithium.
Agents anti-inflammatoires non stéroïdiens comprenant des inhibiteurs sélectifs de la cyclooxygénase-2
Potassium de losartan
Chez les patients âgés, hypovolémiques (y compris ceux sous traitement diurétique) ou dont la fonction rénale est altérée, la co-administration d'AINS, y compris les inhibiteurs sélectifs de la COX-2, avec des antagonistes des récepteurs de l'angiotensine II (y compris le losartan) peut entraîner une détérioration de la fonction rénale. fonction rénale, y compris une éventuelle insuffisance rénale aiguë. Ces effets sont généralement réversibles. Surveillez périodiquement la fonction rénale chez les patients recevant du losartan et un traitement par AINS.
L'effet antihypertenseur des antagonistes des récepteurs de l'angiotensine II, y compris le losartan, peut être atténué par les AINS, y compris les inhibiteurs sélectifs de la COX-2.
Hydrochlorothiazide
L'administration d'un agent anti-inflammatoire non stéroïdien comprenant un inhibiteur sélectif de la COX-2 peut réduire les effets diurétiques, natriurétiques et antihypertenseurs des diurétiques de l'anse, d'épargne potassique et thiazidiques. Par conséquent, lorsque HYZAAR et des agents anti-inflammatoires non stéroïdiens, y compris des inhibiteurs sélectifs de la COX-2, sont utilisés simultanément, observez attentivement pour déterminer si l'effet souhaité du diurétique est obtenu.
Chez les patients recevant un traitement diurétique, la co-administration d'AINS avec des inhibiteurs des récepteurs de l'angiotensine, y compris le losartan, peut entraîner une détérioration de la fonction rénale, y compris une éventuelle insuffisance rénale aiguë. Ces effets sont généralement réversibles. Surveiller périodiquement la fonction rénale chez les patients recevant un traitement par hydrochlorothiazide, losartan et AINS.
Double blocage du système rénine-angiotensine (RAS)
Le double blocage du SRA avec les inhibiteurs des récepteurs de l'angiotensine, les inhibiteurs de l'ECA ou l'aliskirène est associé à des risques accrus d'hypotension, de syncope, d'hyperkaliémie et de modifications de la fonction rénale (y compris l'insuffisance rénale aiguë) par rapport à la monothérapie.
L'essai Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) a recruté 1 448 patients atteints de diabète de type 2, présentant un rapport albumine/créatinine urinaire élevé et une diminution du débit de filtration glomérulaire estimé (DFG de 30 à 89,9 mL/min), les a randomisés pour lisinopril ou un placebo sur fond de traitement par losartan et les a suivis pendant une durée médiane de 2,2 ans. Les patients recevant l'association de losartan et de lisinopril n'ont obtenu aucun bénéfice supplémentaire par rapport à la monothérapie pour le critère combiné de diminution du DFG, d'insuffisance rénale terminale ou de décès, mais ont présenté une incidence accrue d'hyperkaliémie et d'insuffisance rénale aiguë par rapport à la monothérapie groupe.
Surveillez étroitement la pression artérielle, la fonction rénale et les électrolytes chez les patients sous HYZAAR 12,5 mg et d'autres agents qui affectent le SRA.
Ne pas co-administrer l'aliskirène avec HYZAAR 12,5 mg chez les patients diabétiques. Éviter l'utilisation d'aliskirène avec HYZAAR 12,5 mg chez les patients présentant une insuffisance rénale (DFG
L'utilisation de l'hydrochlorothiazide avec d'autres médicaments
Lorsqu'ils sont administrés simultanément, les médicaments suivants peuvent interagir avec les diurétiques thiazidiques [voir PHARMACOLOGIE CLINIQUE ] :
Médicaments antidiabétiques (agents oraux et insuline) - un ajustement posologique du médicament antidiabétique peut être nécessaire.
Résines de cholestyramine et de colestipol - L'absorption de l'hydrochlorothiazide est altérée en présence de résines échangeuses d'anioniques. Des doses uniques de résines de cholestyramine ou de colestipol se lient à l'hydrochlorothiazide et réduisent son absorption par le tractus gastro-intestinal jusqu'à 85 et 43 %, respectivement.
Décaler le dosage de l'hydrochlorothiazide et de la résine de manière à ce que l'hydrochlorothiazide soit administré au moins 4 heures avant ou 4 à 6 heures après l'administration de la résine.
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Toxicité fœtale
L'utilisation de médicaments qui agissent sur le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales. L'oligohydramnios qui en résulte peut être associé à une hypoplasie pulmonaire fœtale et à des déformations squelettiques. Les effets indésirables néonataux potentiels comprennent l'hypoplasie crânienne, l'anurie, l'hypotension, l'insuffisance rénale et la mort. Lorsqu'une grossesse est détectée, arrêtez HYZAAR 12,5 mg dès que possible.
Les thiazides traversent la barrière placentaire et apparaissent dans le sang de cordon. Les effets indésirables incluent la jaunisse fœtale ou néonatale, la thrombocytopénie [voir Utilisation dans des populations spécifiques ].
Hypotension chez les patients présentant une déplétion volumique ou sodée
Chez les patients dont le système rénine-angiotensine est activé, tels que les patients présentant une déplétion volémique ou sodée (p. ex., ceux traités par de fortes doses de diurétiques), une hypotension symptomatique peut survenir après le début du traitement par HYZAAR. Corrigez le volume ou l'épuisement de sel avant l'administration d'HYZAAR. Ne pas utiliser HYZAAR comme traitement initial chez les patients présentant une déplétion du volume intravasculaire.
Fonction rénale altérée
Des modifications de la fonction rénale, y compris une insuffisance rénale aiguë, peuvent être causées par des médicaments qui inhibent le système rénine-angiotensine et par des diurétiques. Les patients dont la fonction rénale peut dépendre en partie de l'activité du système rénine-angiotensine (p. ex., les patients présentant une sténose de l'artère rénale, une maladie rénale chronique, une insuffisance cardiaque congestive sévère ou une déplétion volémique) peuvent présenter un risque particulier de développer une insuffisance rénale aiguë sur HYZAAR. Surveiller périodiquement la fonction rénale chez ces patients. Envisagez de suspendre ou d'arrêter le traitement chez les patients qui développent une diminution cliniquement significative de la fonction rénale sous HYZAAR [voir INTERACTIONS MÉDICAMENTEUSES et Utilisation dans des populations spécifiques ].
Hypersensibilité
Des réactions d'hypersensibilité à l'hydrochlorothiazide peuvent survenir chez les patients avec ou sans antécédents d'allergie ou d'asthme bronchique, mais sont plus probables chez les patients ayant de tels antécédents.
Effets électrolytiques et métaboliques
Dans des essais cliniques en double aveugle portant sur diverses doses de losartan potassique et d'hydrochlorothiazide, l'incidence de patients hypertendus ayant développé une hypokaliémie (potassium sérique 5,7 mEq/L) était de 0,4 % contre 0 % pour le placebo.
HYZAAR contient de l'hydrochlorothiazide qui peut provoquer une hypokaliémie, une hyponatrémie et une hypomagnésémie. L'hypomagnésémie peut entraîner une hypokaliémie qui peut être difficile à traiter malgré la réplétion potassique. HYZAAR 12,5 mg contient également du losartan qui peut provoquer une hyperkaliémie. Surveiller périodiquement les électrolytes sériques [voir INTERACTIONS MÉDICAMENTEUSES ].
L'utilisation concomitante d'autres médicaments susceptibles d'augmenter la kaliémie peut entraîner une hyperkaliémie [voir INTERACTIONS MÉDICAMENTEUSES ].
L'hydrochlorothiazide peut altérer la tolérance au glucose et augmenter les taux sériques de cholestérol et de triglycérides.
Une hyperuricémie peut survenir ou une goutte franche peut être précipitée chez les patients recevant un traitement thiazidique. Étant donné que le losartan diminue l'acide urique, le losartan en association avec l'hydrochlorothiazide atténue l'hyperuricémie induite par les diurétiques.
L'hydrochlorothiazide diminue l'excrétion urinaire de calcium et peut provoquer des élévations de la calcémie. Surveillez les niveaux de calcium.
Myopie aiguë et glaucome secondaire à angle fermé
L'hydrochlorothiazide, un sulfamide, peut provoquer une réaction idiosyncrasique, entraînant une myopie aiguë transitoire et un glaucome aigu à angle fermé. Les symptômes comprennent l'apparition aiguë d'une diminution de l'acuité visuelle ou de douleurs oculaires et surviennent généralement quelques heures à quelques semaines après l'initiation du médicament. Un glaucome aigu à angle fermé non traité peut entraîner une perte de vision permanente. Le traitement principal consiste à arrêter l'hydrochlorothiazide le plus rapidement possible. Des traitements médicaux ou chirurgicaux rapides peuvent devoir être envisagés si la pression intraoculaire reste incontrôlée. Les facteurs de risque de développer un glaucome aigu à angle fermé peuvent inclure des antécédents d'allergie aux sulfamides ou à la pénicilline.
Le lupus érythémateux disséminé
Il a été rapporté que les diurétiques thiazidiques provoquent une exacerbation ou une activation du lupus érythémateux disséminé.
Patients post-sympathectomie
Les effets antihypertenseurs du médicament peuvent être renforcés chez le patient post-sympathectomie.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( INFORMATIONS PATIENTS ).
Grossesse
Informer les patientes en âge de procréer des conséquences d'une exposition à HYZAAR 12,5 mg pendant la grossesse. Discutez des options de traitement avec les femmes qui envisagent de devenir enceintes. Dites aux patientes de signaler les grossesses à leur médecin dès que possible [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].

Hypotension symptomatique
Informez les patients que des étourdissements peuvent survenir, en particulier pendant les premiers jours de traitement, et de signaler ce symptôme à un professionnel de la santé. Informez les patients que la déshydratation due à un apport hydrique insuffisant, une transpiration excessive, des vomissements ou une diarrhée peut entraîner une chute excessive de la pression artérielle. En cas de syncope, conseiller aux patients de contacter leur professionnel de la santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Suppléments de potassium
Conseillez aux patients de ne pas utiliser de suppléments de potassium ou de substituts de sel contenant du potassium sans consulter leur fournisseur de soins de santé [voir INTERACTIONS MÉDICAMENTEUSES ].
Myopie aiguë et glaucome secondaire à angle fermé
Conseillez aux patients d'arrêter HYZAAR 12,5 mg et de consulter immédiatement un médecin s'ils présentent des symptômes de myopie aiguë ou de glaucome à angle fermé secondaire [voir AVERTISSEMENTS ET PRECAUTIONS ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Losartan Potassium-Hydrochlorothiazide
Aucune étude de cancérogénicité n'a été menée avec l'association losartan potassique-hydrochlorothiazide.
L'hydrochlorothiazide potassique de losartan, lorsqu'il a été testé à un rapport pondéral de 4:1, s'est révélé négatif dans le test de mutagenèse microbienne d'Ames et le test de mutagenèse sur cellules pulmonaires de hamster chinois V-79. De plus, il n'y avait aucune preuve de génotoxicité directe dans le test d'élution alcaline in vitro sur des hépatocytes de rat et le test d'aberration chromosomique in vitro sur des cellules ovariennes de hamster chinois à des concentrations non cytotoxiques.
Le losartan potassique, co-administré avec l'hydrochlorothiazide, n'a eu aucun effet sur la fertilité ou le comportement d'accouplement des rats mâles à des doses allant jusqu'à 135 mg/kg/jour de losartan et 33,75 mg/kg/jour d'hydrochlorothiazide. Il a été démontré que ces doses fournissent des expositions systémiques respectives (ASC) pour le losartan, son métabolite actif et l'hydrochlorothiazide qui sont environ 60, 60 et 30 fois supérieures à celles obtenues chez l'homme avec 100 mg de losartan potassique en association avec 25 mg d'hydrochlorothiazide. Chez les rats femelles, cependant, la co-administration de doses aussi faibles que 10 mg/kg/jour de losartan et 2,5 mg/kg/jour d'hydrochlorothiazide a été associée à des diminutions légères mais statistiquement significatives des indices de fécondité et de fertilité. Les valeurs d'ASC pour le losartan, son métabolite actif et l'hydrochlorothiazide, extrapolées à partir des données obtenues avec le losartan administré à des rats à une dose de 50 mg/kg/jour en association avec 12,5 mg/kg/jour d'hydrochlorothiazide, étaient d'environ 6, 2 et 2 fois supérieures à celles obtenues chez l'homme avec 100 mg de losartan en association avec 25 mg d'hydrochlorothiazide.
Potassium de losartan
Le losartan potassique n'a pas été cancérigène lorsqu'il a été administré à des doses maximales tolérées à des rats et à des souris pendant 105 et 92 semaines, respectivement. Les rats femelles ayant reçu la dose la plus élevée (270 mg/kg/jour) présentaient une incidence légèrement plus élevée d'adénome acineux pancréatique. Les doses maximales tolérées (270 mg/kg/jour chez le rat, 200 mg/kg/jour chez la souris) ont fourni des expositions systémiques au losartan et à son métabolite pharmacologiquement actif qui étaient environ 160 et 90 fois (rats) et 30 et 15 fois (souris ) l'exposition d'un être humain de 50 kg recevant 100 mg par jour.
Le losartan potassique était négatif dans les tests de mutagenèse microbienne et de mutagenèse sur cellules de mammifères V-79, ainsi que dans les tests d'élution alcaline in vitro et les tests d'aberration chromosomique in vitro et in vivo. De plus, le métabolite actif n'a montré aucun signe de génotoxicité dans les essais de mutagenèse microbienne, d'élution alcaline in vitro et d'aberration chromosomique in vitro.
La fertilité et la performance reproductrice n'ont pas été affectées dans les études avec les rats masculins donnés les doses orales de potassium losartan jusqu'à environ 150 mgs/kg/jours. L'administration de doses toxiques chez les femelles (300/200 mg/kg/jour) a été associée à une diminution significative (p
Hydrochlorothiazide
Des études d'alimentation de deux ans chez des souris et des rats menées sous les auspices du National Toxicology Program (NTP) n'ont révélé aucune preuve d'un potentiel carcinogène de l'hydrochlorothiazide chez les souris femelles (à des doses allant jusqu'à environ 600 mg/kg/jour) ou chez les mâles. et les rats femelles (à des doses allant jusqu'à environ 100 mg/kg/jour). Le NTP, cependant, a trouvé des preuves équivoques d'hépatocarcinogénicité chez les souris mâles.
L'hydrochlorothiazide n'était pas génotoxique in vitro dans le test de mutagénicité d'Ames sur les souches de Salmonella typhimurium TA 98, TA 100, TA 1535, TA 1537 et TA 1538 et dans le test des ovaires de hamster chinois (CHO) pour les aberrations chromosomiques, ou in vivo dans les tests utilisant les chromosomes des cellules germinales de la souris, les chromosomes de la moelle osseuse du hamster chinois et le gène du trait létal récessif lié au sexe de la drosophile. Des résultats de test positifs ont été obtenus uniquement dans les tests in vitro CHO Sister Chromatid Exchange (clastogénicité) et dans les tests Mouse Lymphoma Cell (mutagénicité), en utilisant des concentrations d'hydrochlorothiazide de 43 à 1300 mcg/mL, et dans le test de non-disjonction d'Aspergillus nidulans à une concentration indéterminée.
L'hydrochlorothiazide n'a eu aucun effet indésirable sur la fertilité des souris et des rats des deux sexes dans des études au cours desquelles ces espèces ont été exposées, via leur régime alimentaire, à des doses allant jusqu'à 100 et 4 mg/kg, respectivement, avant l'accouplement et tout au long de la gestation.
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse D
L'utilisation de médicaments qui agissent sur le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales. L'oligohydramnios qui en résulte peut être associé à une hypoplasie pulmonaire fœtale et à des déformations squelettiques. Les effets indésirables néonataux potentiels comprennent l'hypoplasie crânienne, l'anurie, l'hypotension, l'insuffisance rénale et la mort. Lorsqu'une grossesse est détectée, arrêtez le losartan dès que possible. Ces effets indésirables sont généralement associés à l'utilisation de ces médicaments au cours des deuxième et troisième trimestres de la grossesse. La plupart des études épidémiologiques examinant les anomalies fœtales après exposition à l'utilisation d'antihypertenseurs au cours du premier trimestre n'ont pas distingué les médicaments affectant le système rénine-angiotensine des autres agents antihypertenseurs. La prise en charge appropriée de l'hypertension maternelle pendant la grossesse est importante pour optimiser les résultats pour la mère et le fœtus.
Dans le cas inhabituel où il n'y a pas d'alternative appropriée au traitement par des médicaments affectant le système rénine-angiotensine pour un patient particulier, informer la mère du risque potentiel pour le fœtus. Effectuer des examens échographiques en série pour évaluer l'environnement intra-amniotique. Si un oligohydramnios est observé, arrêtez HYZAAR, à moins qu'il ne soit considéré comme salvateur pour la mère. Des tests fœtaux peuvent être appropriés, en fonction de la semaine de grossesse. Les patients et les médecins doivent toutefois savoir que l'oligohydramnios peut n'apparaître qu'après que le fœtus a subi une lésion irréversible. Observez attentivement les nourrissons ayant des antécédents d'exposition in utero à HYZAAR 12,5 mg pour l'hypotension, l'oligurie et l'hyperkaliémie [voir Utilisation pédiatrique ].
Il n'y a eu aucun signe de tératogénicité chez les rats ou les lapins traités avec une dose maximale de losartan potassique de 10 mg/kg/jour en association avec 2,5 mg/kg/jour d'hydrochlorothiazide. À ces doses, les expositions respectives (ASC) du losartan, de son métabolite actif et de l'hydrochlorothiazide chez le lapin étaient d'environ 5, 1,5 et 1,0 fois celles obtenues chez l'homme avec 100 mg de losartan en association avec 25 mg d'hydrochlorothiazide. Les valeurs d'ASC pour le losartan, son métabolite actif et l'hydrochlorothiazide, extrapolées à partir des données obtenues avec le losartan administré à des rats à une dose de 50 mg/kg/jour en association avec 12,5 mg/kg/jour d'hydrochlorothiazide, étaient d'environ 6, 2 et 2 fois supérieures à celles obtenues chez l'homme avec 100 mg de losartan en association avec 25 mg d'hydrochlorothiazide. Une toxicité fœtale chez le rat, mise en évidence par une légère augmentation des côtes surnuméraires, a été observée lorsque les femelles ont été traitées avant et pendant toute la gestation avec 10 mg/kg/jour de losartan en association avec 2,5 mg/kg/jour d'hydrochlorothiazide. Comme également observé dans les études sur le losartan seul, des effets indésirables sur le fœtus et le nouveau-né, notamment une diminution du poids corporel, une toxicité rénale et la mortalité, sont survenus lorsque des rates gravides étaient traitées en fin de gestation et/ou en lactation avec 50 mg/kg/jour de losartan en association avec 12,5 mg/kg/jour d'hydrochlorothiazide. Les ASC respectives du losartan, de son métabolite actif et de l'hydrochlorothiazide à ces doses chez le rat étaient environ 35, 10 et 10 fois supérieures à celles obtenues chez l'homme avec l'administration de 100 mg de losartan en association avec 25 mg d'hydrochlorothiazide. Lorsque l'hydrochlorothiazide a été administré sans losartan à des souris et des rats gravides pendant leurs périodes respectives d'organogénèse majeure, à des doses allant jusqu'à 3 000 et 1 000 mg/kg/jour, respectivement, il n'y a eu aucun signe d'effet nocif pour le fœtus.
Les thiazides traversent la barrière placentaire et apparaissent dans le sang de cordon. Il existe un risque d'ictère fœtal ou néonatal, de thrombocytopénie et éventuellement d'autres effets indésirables survenus chez l'adulte.
Mères allaitantes
On ne sait pas si le losartan est excrété dans le lait maternel, mais des niveaux significatifs de losartan et de son métabolite actif se sont avérés présents dans le lait de rat. Les thiazides apparaissent dans le lait maternel. En raison du potentiel d'effets indésirables sur le nourrisson, une décision doit être prise soit d'interrompre l'allaitement soit d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère.
Utilisation pédiatrique
L'innocuité et l'efficacité d'HYZAAR chez les patients pédiatriques n'ont pas été établies.
Nouveau-nés ayant des antécédents d'exposition in utero à HYZAAR
En cas d'oligurie ou d'hypotension, diriger l'attention vers le soutien de la pression artérielle et de la perfusion rénale. L'exsanguinotransfusion ou la dialyse peuvent être nécessaires pour inverser l'hypotension et/ou remplacer les troubles de la fonction rénale.
Utilisation gériatrique
Dans une étude clinique contrôlée portant sur la réduction du risque combiné de décès cardiovasculaire, d'accident vasculaire cérébral et d'infarctus du myocarde chez des patients hypertendus présentant une hypertrophie ventriculaire gauche, 2857 patients (62 %) avaient 65 ans et plus, tandis que 808 patients (18 %) avaient 75 ans et plus. Dans le but de contrôler la tension artérielle dans cette étude, les patients ont reçu en association du losartan et de l'hydrochlorothiazide pendant 74 % du temps total pendant lequel ils ont pris le médicament à l'étude. Aucune différence globale d'efficacité n'a été observée entre ces patients et les patients plus jeunes. Les événements indésirables étaient un peu plus fréquents chez les patients âgés que chez les patients non âgés, tant pour le groupe losartan-hydrochlorothiazide que pour le groupe témoin [voir PHARMACOLOGIE CLINIQUE ].
Course
Dans l'étude LIFE (Losartan Intervention For Endpoint reduction in hypertension), les patients noirs souffrant d'hypertension et d'hypertrophie ventriculaire gauche traités par l'aténolol présentaient un risque d'accident vasculaire cérébral, le critère d'évaluation composite principal, par rapport aux patients noirs traités par le losartan (tous deux cotraités par l'hydrochlorothiazide chez la majorité des patients). Dans le sous-groupe de patients noirs (n = 533, 6 % des patients de l'étude LIFE), il y avait 29 critères principaux parmi 263 patients sous aténolol (11 %, 26 pour 1 000 années-patients) et 46 critères principaux parmi 270 patients (17 %, 42 pour 1000 patients-années) sous losartan. Ce résultat n'a pas pu être expliqué sur la base de différences dans les populations autres que la race ou de tout déséquilibre entre les groupes de traitement. De plus, les réductions de la pression artérielle dans les deux groupes de traitement étaient cohérentes entre les patients noirs et non noirs. Étant donné la difficulté d'interpréter les différences de sous-ensembles dans les grands essais, on ne peut pas savoir si la différence observée est le résultat du hasard. Cependant, l'étude LIFE ne fournit aucune preuve que les bénéfices du losartan sur la réduction du risque d'événements cardiovasculaires chez les patients hypertendus présentant une hypertrophie ventriculaire gauche s'appliquent aux patients noirs [voir PHARMACOLOGIE CLINIQUE ].
Insuffisance hépatique
L'initiation d'HYZAAR 12,5 mg n'est pas recommandée chez les patients atteints d'insuffisance hépatique car la dose initiale appropriée de losartan, 25 mg, n'est pas disponible.
Insuffisance rénale
Des modifications de la fonction rénale ont été signalées chez des personnes sensibles [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS , et PHARMACOLOGIE CLINIQUE ]. L'innocuité et l'efficacité d'HYZAAR chez les patients atteints d'insuffisance rénale grave (clairance de la créatinine
SURDOSAGE
Potassium de losartan
Une létalité significative a été observée chez les souris et les rats après administration orale de 1 000 mg/kg et 2 000 mg/kg, respectivement, soit environ 44 et 170 fois la dose humaine maximale recommandée sur une base en mg/m2.
Des données limitées sont disponibles concernant le surdosage chez l'homme. La manifestation la plus probable d'un surdosage serait l'hypotension et la tachycardie; la bradycardie pourrait survenir à la suite d'une stimulation parasympathique (vagale). En cas d'hypotension symptomatique, un traitement de soutien doit être institué.
Ni le losartan ni son métabolite actif ne peuvent être éliminés par hémodialyse.
Hydrochlorothiazide
La DL orale de l'hydrochlorothiazide est supérieure à 10 g/kg chez la souris et le rat. Les signes et symptômes les plus fréquemment observés sont ceux causés par une déplétion électrolytique (hypokaliémie, hypochlorémie, hyponatrémie) et une déshydratation résultant d'une diurèse excessive. Si de la digitaline a également été administrée, l'hypokaliémie peut accentuer les arythmies cardiaques. Le degré d'élimination de l'hydrochlorothiazide par hémodialyse n'a pas été établi.
CONTRE-INDICATIONS
HYZAAR 12,5 mg est contre-indiqué :
- Chez les patients hypersensibles à l'un des composants de ce produit.
- Chez les patients souffrant d'anurie
- Pour la co-administration avec l'aliskirène chez les patients diabétiques
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Potassium de losartan
L'angiotensine II [formée à partir de l'angiotensine I lors d'une réaction catalysée par l'enzyme de conversion de l'angiotensine (ECA, kininase II)] est un puissant vasoconstricteur, la principale hormone vasoactive du système rénine-angiotensine et un composant important de la physiopathologie de l'hypertension. Il stimule également la sécrétion d'aldostérone par le cortex surrénalien. Le losartan et son principal métabolite actif bloquent les effets vasoconstricteurs et sécréteurs d'aldostérone de l'angiotensine II en bloquant sélectivement la liaison de l'angiotensine II au récepteur AT1 présent dans de nombreux tissus (p. ex., muscle lisse vasculaire, glande surrénale). Il existe également un récepteur AT2 présent dans de nombreux tissus, mais on ne sait pas qu'il soit associé à l'homéostasie cardiovasculaire. Ni le losartan ni son principal métabolite actif ne présentent d'activité agoniste partielle au niveau du récepteur AT1, et tous deux ont une affinité beaucoup plus grande (environ 1000 fois) pour le récepteur AT1 que pour le récepteur AT2. Des études de liaison in vitro indiquent que le losartan est un inhibiteur compétitif réversible du récepteur AT1. Le métabolite actif est 10 à 40 fois plus puissant en poids que le losartan et semble être un inhibiteur réversible et non compétitif du récepteur AT1.
Ni le losartan ni son métabolite actif n'inhibent l'ECA (kininase II, l'enzyme qui convertit l'angiotensine I en angiotensine II et dégrade la bradykinine), ni ne se lient ou ne bloquent d'autres récepteurs hormonaux ou canaux ioniques connus pour être importants dans la régulation cardiovasculaire.
Hydrochlorothiazide
L'hydrochlorothiazide est un diurétique thiazidique. Les thiazides affectent les mécanismes tubulaires rénaux de la réabsorption des électrolytes, augmentant directement l'excrétion de sodium et de chlorure en quantités approximativement équivalentes. Indirectement, l'action diurétique de l'hydrochlorothiazide réduit le volume plasmatique, avec pour conséquence une augmentation de la réinactivité plasmatique, une augmentation de la sécrétion d'aldostérone, une augmentation de la perte urinaire de potassium et une diminution de la kaliémie. La liaison rénine-aldostérone est médiée par l'angiotensine II, de sorte que la co-administration d'un antagoniste des récepteurs de l'angiotensine II tend à inverser la perte de potassium associée à ces diurétiques. Le mécanisme de l'effet antihypertenseur des thiazides est inconnu.
Pharmacodynamie
Potassium de losartan
Le losartan inhibe l'effet vasopresseur des perfusions d'angiotensine II (ainsi que d'angiotensine I). Une dose de 100 mg inhibe l'effet presseur d'environ 85 % au maximum avec une inhibition de 25 à 40 % persistant pendant 24 heures. L'élimination de la rétroaction négative de l'angiotensine II provoque un doublement ou un triplement de l'activité de la rénine plasmatique et une augmentation consécutive de la concentration plasmatique de l'angiotensine II chez les patients hypertendus. Le losartan n'affecte pas la réponse à la bradykinine, alors que les inhibiteurs de l'ECA augmentent la réponse à la bradykinine. Les concentrations plasmatiques d'aldostérone chutent après l'administration de losartan. Malgré l'effet du losartan sur la sécrétion d'aldostérone, très peu d'effet sur le potassium sérique a été observé.
L'effet du losartan est sensiblement présent en une semaine, mais dans certaines études, l'effet maximal s'est produit en 3 à 6 semaines. Dans les études de suivi à long terme (avec contrôle contre placebo), l'effet du losartan a semblé se maintenir jusqu'à un an. Il n'y a pas d'effet rebond apparent après l'arrêt brutal du losartan. Il n'y avait pratiquement aucun changement dans la fréquence cardiaque moyenne chez les patients traités par losartan dans les essais contrôlés.
Hydrochlorothiazide
Après administration orale d'hydrochlorothiazide, la diurèse commence dans les 2 heures, culmine en 4 heures environ et dure environ 6 à 12 heures.
Interactions médicamenteuses
Hydrochlorothiazide
Alcool, barbituriques ou narcotiques - une potentialisation de l'hypotension orthostatique peut survenir.
Autres antihypertenseurs - effet additif ou potentialisation.
Relaxants des muscles squelettiques, non dépolarisants (p. ex., tubocurarine) - augmentation possible de la réponse au myorelaxant.
Corticostéroïdes, ACTH ou glycyrrhizine (présents dans la réglisse) - déplétion électrolytique intensifiée, en particulier hypokaliémie.
Amines vasopressives (p. ex. noradrénaline) - diminution possible de la réponse aux amines vasopressives, mais pas suffisante pour empêcher leur utilisation.
Pharmacocinétique
Potassium de losartan
Absorption
Après administration orale, le losartan est bien absorbé et subit un important métabolisme de premier passage. La biodisponibilité systémique du losartan est d'environ 33 %. Les concentrations maximales moyennes de losartan et de son métabolite actif sont atteintes en 1 heure et en 3-4 heures, respectivement. Alors que les concentrations plasmatiques maximales de losartan et de son métabolite actif sont approximativement égales, l'ASC (aire sous la courbe) du métabolite est environ 4 fois plus élevée que celle du losartan. Un repas ralentit l'absorption du losartan et diminue sa Cmax mais n'a que des effets mineurs sur l'ASC du losartan ou sur l'ASC du métabolite (diminution d'environ 10 %). La pharmacocinétique du losartan et de son métabolite actif est linéaire avec des doses orales de losartan allant jusqu'à 200 mg et ne change pas avec le temps.
Distribution
Le volume de distribution du losartan et du métabolite actif est d'environ 34 litres et 12 litres, respectivement. Le losartan et son métabolite actif sont fortement liés aux protéines plasmatiques, principalement l'albumine, avec des fractions plasmatiques libres de 1,3 % et 0,2 %, respectivement. La liaison aux protéines plasmatiques est constante sur la plage de concentration atteinte avec les doses recommandées. Des études chez le rat indiquent que le losartan traverse mal, voire pas du tout, la barrière hémato-encéphalique.
Métabolisme
Le losartan est un agent actif par voie orale qui subit un important métabolisme de premier passage par les enzymes du cytochrome P450. Il est converti, en partie, en un métabolite acide carboxylique actif qui est responsable de la majeure partie de l'antagonisme des récepteurs de l'angiotensine II qui suit le traitement par le losartan. Environ 14 % d'une dose de losartan administrée par voie orale sont convertis en métabolite actif. En plus du métabolite acide carboxylique actif, plusieurs métabolites inactifs sont formés. Des études in vitro indiquent que les cytochromes P450 2C9 et 3A4 sont impliqués dans la biotransformation du losartan en ses métabolites.
Élimination
La clairance plasmatique totale du losartan et du métabolite actif est d'environ 600 ml/min et 50 ml/min, respectivement, avec une clairance rénale d'environ 75 ml/min et 25 ml/min, respectivement. La demi-vie terminale du losartan est d'environ 2 heures et celle du métabolite est d'environ 6 à 9 heures. Après des doses uniques de losartan administrées par voie orale, environ 4 % de la dose sont excrétés sous forme inchangée dans les urines et environ 6 % sont excrétés dans les urines sous forme de métabolite actif. L'excrétion biliaire contribue à l'élimination du losartan et de ses métabolites. Après administration orale de losartan marqué au 14C, environ 35 % de la radioactivité est récupérée dans les urines et environ 60 % dans les fèces. Après une dose intraveineuse de losartan marqué au 14C, environ 45 % de la radioactivité est récupérée dans l'urine et 50 % dans les fèces. Ni le losartan ni son métabolite ne s'accumulent dans le plasma lors d'administrations répétées une fois par jour.
Hydrochlorothiazide
L'hydrochlorothiazide n'est pas métabolisé mais est rapidement éliminé par les reins. Lorsque les taux plasmatiques ont été suivis pendant au moins 24 heures, la demi-vie plasmatique varie entre 5,6 et 14,8 heures. Au moins 61 % de la dose orale sont éliminés sous forme inchangée dans les 24 heures. L'hydrochlorothiazide traverse la barrière placentaire mais pas la barrière hémato-encéphalique et est excrété dans le lait maternel.
Populations spécifiques
Gériatrie et genre
La pharmacocinétique du losartan a été étudiée chez les personnes âgées (65-75 ans) et chez les deux sexes. Les concentrations plasmatiques de losartan et de son métabolite actif sont similaires chez les hypertendus âgés et jeunes. Les concentrations plasmatiques de losartan étaient environ deux fois plus élevées chez les femmes hypertendues que chez les hommes hypertendus, mais les concentrations du métabolite actif étaient similaires chez les hommes et les femmes.
Course
Les différences pharmacocinétiques dues à la race n'ont pas été étudiées [voir aussi Utilisation dans des populations spécifiques ].
Insuffisance hépatique
Après administration orale chez des patients atteints de cirrhose alcoolique légère à modérée du foie, les concentrations plasmatiques de losartan et de son métabolite actif étaient, respectivement, 5 fois et environ 1,7 fois celles des jeunes volontaires de sexe masculin. Comparativement aux sujets normaux, la clairance plasmatique totale du losartan chez les patients insuffisants hépatiques était inférieure d'environ 50 % et la biodisponibilité orale était environ doublée. La dose de départ inférieure de losartan recommandée pour l'utilisation dans les patients avec l'affaiblissement hépatique ne peut pas être donnée en utilisant HYZAAR. Son utilisation chez ces patients comme moyen de titration du losartan n'est donc pas recommandée [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Insuffisance rénale
Losartan
Après administration orale, les concentrations plasmatiques et les ASC du losartan et de son métabolite actif sont augmentées de 50 à 90 % chez les patients présentant une insuffisance rénale légère (clairance de la créatinine de 50 à 74 mL/min) ou modérée (clairance de la créatinine de 30 à 49 mL/min). Dans cette étude, la clairance rénale a été réduite de 55 à 85 % pour le losartan et son métabolite actif chez les patients présentant une insuffisance rénale légère ou modérée. Ni le losartan ni son métabolite actif ne peuvent être éliminés par hémodialyse.
Hydrochlorothiazide
Après administration orale, l'ASC de l'hydrochlorothiazide est augmentée de 70 et 700 % respectivement chez les patients présentant une insuffisance rénale légère et modérée. Dans cette étude, la clairance rénale de l'hydrochlorothiazide a diminué de 45 et 85 % chez les patients atteints d'insuffisance rénale légère et modérée, respectivement.
Utilisez les schémas thérapeutiques habituels avec HYZAAR tant que la clairance de la créatinine du patient est supérieure à 30 ml/min. L'innocuité et l'efficacité de HYZAAR 12,5 mg chez les patients hospitalisés atteints d'insuffisance rénale grave (clairance de la créatinine inférieure à 30 mL/min) n'ont pas été établies [voir Utilisation dans des populations spécifiques ].
Interactions médicamenteuses
Potassium de losartan
Aucune interaction médicamenteuse cliniquement significative n'a été trouvée dans les études sur le losartan potassique avec l'hydrochlorothiazide, la digoxine, la warfarine, la cimétidine et le phénobarbital. Le fluconazole, un inhibiteur du cytochrome P450 2C9, a diminué l'ASC du métabolite actif d'environ 40 %, mais a augmenté l'ASC du losartan d'environ 70 % après des doses multiples. La conversion du losartan en son métabolite actif après administration intraveineuse n'est pas affectée par le kétoconazole, un inhibiteur du P450 3A4. 30 %.
Les conséquences pharmacodynamiques de l'utilisation concomitante de losartan et d'inhibiteurs de P450 2C9 n'ont pas été étudiées. Il a été démontré que les sujets qui ne métabolisent pas le losartan en métabolite actif présentent un défaut spécifique et rare du cytochrome P450 2C9. Ces données suggèrent que la conversion du losartan en son métabolite actif est médiée principalement par le P450 2C9 et non par le P450 3A4.
Etudes cliniques
Monothérapie au losartan
Réduction du risque d'AVC
L'étude LIFE était une étude multinationale en double aveugle comparant le losartan et l'aténolol chez 9193 patients hypertendus présentant une hypertrophie ventriculaire gauche documentée par ECG. Les patients ayant subi un infarctus du myocarde ou un accident vasculaire cérébral dans les six mois précédant la randomisation ont été exclus. Les patients ont été randomisés pour recevoir une fois par jour du losartan 50 mg ou de l'aténolol 50 mg. Si la pression artérielle cible (
Dans le but de contrôler la pression artérielle, les patients des deux bras de l'étude LIFE ont reçu de l'hydrochlorothiazide en concomitance la plupart du temps qu'ils prenaient le médicament à l'étude (73,9 % et 72,4 % des jours dans les bras losartan et aténolol, respectivement).
Parmi les patients randomisés, 4 963 (54 %) étaient des femmes et 533 (6 %) étaient des Noirs. L'âge moyen était de 67 ans avec 5704 (62 %) âge ≥ 65 ans. Au départ, 1 195 (13 %) étaient diabétiques, 1 326 (14 %) avaient une hypertension systolique isolée, 1 469 (16 %) avaient une maladie coronarienne et 728 (8 %) avaient une maladie cérébrovasculaire. La pression artérielle moyenne initiale était de 174/98 mmHg dans les deux groupes de traitement. La durée moyenne de suivi était de 4,8 ans. À la fin de l'étude ou lors de la dernière visite avant un critère d'évaluation principal, 77 % du groupe traité par le losartan et 73 % du groupe traité par l'aténolol prenaient toujours le médicament à l'étude. Parmi les patients qui prenaient encore le médicament à l'étude, les doses moyennes de losartan et d'aténolol étaient toutes deux d'environ 80 mg/jour, et 15 % prenaient de l'aténolol ou du losartan en monothérapie, tandis que 77 % recevaient également de l'hydrochlorothiazide (à une dose moyenne de 20 mg/jour chez chaque groupe). La réduction de la pression artérielle mesurée au creux était similaire pour les deux groupes de traitement, mais la pression artérielle n'a été mesurée à aucun autre moment de la journée. A la fin de l'étude ou à la dernière visite avant un critère principal, les pressions artérielles moyennes étaient de 144,1/81,3 mmHg pour le groupe traité par losartan et de 145,4/80,9 mmHg pour le groupe traité par aténolol [la différence de PAS de 1,3 mmHg était significative (p
Le critère d'évaluation principal était la première occurrence d'un décès cardiovasculaire, d'un accident vasculaire cérébral non mortel ou d'un infarctus du myocarde non mortel. Les patients présentant des événements non mortels sont restés dans l'essai, de sorte qu'il y avait également un examen du premier événement de chaque type même s'il ne s'agissait pas du premier événement (par exemple, un AVC faisant suite à un infarctus du myocarde initial serait compté dans l'analyse de l'AVC) . Le traitement par losartan a entraîné une réduction de 13 % (p = 0,021) du risque du critère d'évaluation principal par rapport au groupe aténolol ; cette différence était principalement le résultat d'un effet sur les accidents vasculaires cérébraux mortels et non mortels. Le traitement par losartan a réduit le risque d'AVC de 25 % par rapport à l'aténolol (p = 0,001).
Losartan Potassium-Hydrochlorothiazide
Les 3 études contrôlées du losartan et de l'hydrochlorothiazide ont inclus plus de 1300 patients évaluant l'efficacité antihypertensive de différentes doses de losartan (25, 50 et 100 mg) et d'hydrochlorothiazide concomitant (6,25, 12,5 et 25 mg). Une étude factorielle a comparé l'association losartan/hydrochlorothiazide 50/12,5 mg avec ses composants et un placebo. L'association losartan/hydrochlorothiazide 50/12,5 mg a entraîné une réponse systolique/diastolique ajustée au placebo approximativement additive (15,5/9,0 mmHg pour l'association par rapport à 8,5/5,0 mmHg pour le losartan seul et 7,0/3,0 mmHg pour l'hydrochlorothiazide seul). Une autre étude a examiné la relation dose-réponse de diverses doses d'hydrochlorothiazide (6,25, 12,5 et 25 mg) ou de placebo sur un fond de losartan (50 mg) chez des patients insuffisamment contrôlés (pression artérielle diastolique en position assise [SiDBP] 93-120 mmHg) sur losartan (50 mg) seul. La troisième étude a étudié la relation dose-réponse de différentes doses de losartan (25, 50 et 100 mg) ou de placebo sur un fond d'hydrochlorothiazide (25 mg) chez des patients insuffisamment contrôlés (SiDBP93-120 mmHg) sous hydrochlorothiazide (25 mg) seul. Ces études ont montré une réponse antihypertensive supplémentaire au creux (24 heures après l'administration) de l'hydrochlorothiazide 12,5 ou 25 mg ajouté au losartan 50 mg de 5,5/3,5 et 10,0/6,0 mmHg, respectivement. De même, il y a eu une réponse antihypertensive supplémentaire lorsque le losartan 50 ou 100 mg a été ajouté à l'hydrochlorothiazide 25 mg de 9,0/5,5 et 12,5/6,5 mmHg, respectivement. Il n'y avait pas d'effet significatif sur la fréquence cardiaque.
Il n'y avait pas de différence de réponse entre les hommes et les femmes ou chez les patients de plus ou de moins de 65 ans.
Les patients noirs ont eu une réponse plus importante à l'hydrochlorothiazide que les patients non noirs et une réponse plus faible au losartan. La réponse globale à la combinaison était similaire pour les patients noirs et non noirs.
Hypertension sévère (SiDBP ≥110 mmHg)
L'innocuité et l'efficacité d'HYZAAR en tant que traitement initial de l'hypertension sévère (définie comme une SiDBP moyenne ≥ 110 mmHg confirmée à 2 reprises en dehors de tout traitement antihypertenseur) ont été étudiées dans une étude multicentrique randomisée en double aveugle de 6 semaines. Les patients ont été randomisés pour recevoir soit du losartan et de l'hydrochlorothiazide (50/12,5 mg, une fois par jour) soit du losartan (50 mg, une fois par jour) et ont été suivis pour la réponse tensionnelle. Les patients ont été titrés à des intervalles de 2 semaines si leur SiDBP n'a pas atteint l'objectif (
L'étude a recruté 585 patients, dont 264 (45 %) femmes, 124 (21 %) noirs et 21 (4 %) âgés de ≥ 65 ans. La pression artérielle moyenne au départ pour la population totale était de 171/113 mmHg. L'âge moyen était de 53 ans. Après 4 semaines de traitement, la SiDBP moyenne était inférieure de 3,1 mmHg et la SiSBP moyenne était inférieure de 5,6 mmHg dans le groupe traité par HYZAAR. En conséquence, une plus grande proportion de patients sous HYZAAR 12,5 mg ont atteint la tension artérielle diastolique cible (17,6 % pour HYZAAR 12,5 mg, 9,4 % pour le losartan ; p = 0,006). Des tendances similaires ont été observées lorsque les patients ont été regroupés selon le sexe, la race ou l'âge (
Après 6 semaines de traitement, plus de patients ayant reçu le régime combiné ont atteint la tension artérielle diastolique cible que ceux ayant reçu le régime en monothérapie (29,8 % contre 12,5 %).
INFORMATIONS PATIENTS
HYZAAR® (HY-zar) (comprimés de losartan potassique et d'hydrochlorothiazide)50/12,5 mg, 100/12,5 mg, 100/25 mg
Lisez les renseignements destinés aux patients qui accompagnent HYZAAR ® avant de commencer à le prendre et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Cette notice ne remplace pas une discussion avec votre médecin au sujet de votre état et de votre traitement.
Quelle est l'information la plus importante que je devrais connaître sur HYZAAR ?
- HYZAAR peut causer des dommages ou la mort d'un bébé à naître.
- Discutez avec votre médecin d'autres moyens d'abaisser votre tension artérielle si vous envisagez de devenir enceinte.
- Si vous tombez enceinte pendant que vous prenez HYZAAR 12,5 mg, informez immédiatement votre médecin.
Qu'est-ce que HYZAAR 12,5 mg ?
HYZAAR 12,5 mg contient 2 médicaments délivrés sur ordonnance, un antagoniste des récepteurs de l'angiotensine (ARB) et un diurétique (diurétique). Il est utilisé pour :
- abaisser l'hypertension artérielle (hypertension). HYZAAR n'est généralement pas le premier médicament utilisé pour traiter l'hypertension artérielle.
- réduire le risque d'accident vasculaire cérébral chez les patients souffrant d'hypertension artérielle et d'un problème cardiaque appelé hypertrophie ventriculaire gauche (HVG). HYZAAR peut ne pas aider les patients noirs avec ce problème.
HYZAAR n'a pas été étudié chez les enfants de moins de 18 ans.
Hypertension artérielle (hypertension). La tension artérielle est la force dans vos vaisseaux sanguins lorsque votre cœur bat et lorsque votre cœur se repose. Vous avez une pression artérielle élevée lorsque la force est trop forte. L'ingrédient losartan contenu dans HYZAAR 12,5 mg peut aider vos vaisseaux sanguins à se détendre afin que votre tension artérielle soit plus basse. L'hydrochlorothiazide contenu dans gredientin HYZAAR agit en faisant passer plus d'eau et de sel par vos reins.
Hypertrophie ventriculaire gauche (HVG) est un agrandissement des parois de la chambre gauche du cœur (chambre de pompage principale du cœur). L'HVG peut provenir de plusieurs choses. L'hypertension artérielle est la cause la plus fréquente d'HVG.
Qui ne devrait pas prendre HYZAAR ?
Ne prenez pas HYZAAR 12,5 mg si vous :
- êtes allergique à l'un des ingrédients contenus dans HYZAAR. Voir la liste complète des ingrédients de HYZAAR à la fin de cette notice.
- n'urinent pas.
- avez le diabète et prenez un médicament appelé aliskirène pour réduire la tension artérielle.
Que dois-je dire à mon médecin avant de prendre HYZAAR ?
Informez votre médecin de toutes vos conditions médicales, y compris si vous :
- êtes enceinte ou planifiez une grossesse. Voir "Quelles sont les informations les plus importantes que je devrais connaître sur HYZAAR ?"
- allaitez ou envisagez d'allaiter. HYZAAR peut passer dans votre lait et nuire à votre bébé. Vous et votre médecin devez décider si vous allez prendre HYZAAR ou allaiter. Vous ne devriez pas faire les deux.
- avez vomi (vomis), avez la diarrhée, transpirez beaucoup ou ne buvez pas assez de liquides. Ceux-ci pourraient vous amener à avoir une pression artérielle basse.
- avoir des problèmes de foie
- avoir des problèmes rénaux
- souffrez de lupus érythémateux disséminé (Lupus ; LED)
- avoir le diabète
- avoir la goutte
- avez des allergies
- avez eu un cancer de la peau ou si vous développez une nouvelle lésion cutanée pendant le traitement. Le traitement par l'hydrochlorothiazide peut augmenter le risque de certains types de cancer de la peau (cancer de la peau autre que le mélanome). Discutez avec votre médecin de la façon de protéger votre peau contre l'exposition au soleil et de la fréquence à laquelle vous devriez subir un dépistage du cancer de la peau.
Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
HYZAAR 12,5 mg et certains autres médicaments peuvent interagir entre eux. Dites surtout à votre médecin si vous prenez :
- suppléments de potassium
- substituts de sel contenant du potassium
- autres médicaments susceptibles d'augmenter la kaliémie
- pilules d'eau (diurétiques)
- lithium (un médicament utilisé pour traiter un certain type de dépression)
- médicaments utilisés pour traiter la douleur et l'arthrite, appelés anti-inflammatoires non stéroïdiens (AINS), y compris les inhibiteurs de la COX-2
- d'autres médicaments pour réduire la tension artérielle.
Connaissez les médicaments que vous prenez. Conservez une liste de vos médicaments et montrez-la à votre médecin et à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je prendre HYZAAR 12,5 mg ?
- Prenez HYZAAR 12,5 mg exactement comme prescrit par votre médecin. Votre médecin peut modifier votre dose si nécessaire.
- HYZAAR peut être pris avec ou sans nourriture.
- Si vous oubliez une dose, prenez-la dès que vous vous en souvenez. S'il est proche de votre prochaine dose, ne prenez pas la dose oubliée. Prenez simplement la dose suivante à l'heure habituelle.
- Si vous avez pris trop de HYZAAR 12,5 mg, appelez votre médecin ou le centre antipoison, ou rendez-vous immédiatement aux urgences de l'hôpital le plus proche.
- Votre médecin peut effectuer des tests sanguins de temps à autre pendant que vous prenez HYZAAR.
Quels sont les effets secondaires possibles de HYZAAR ?
HYZAAR peut provoquer les effets secondaires suivants qui peuvent être graves :
- Blessure ou décès de bébés à naître. Voir "Quelles sont les informations les plus importantes que je devrais connaître sur HYZAAR ?"
- Réaction allergique. Les symptômes d'une réaction allergique sont un gonflement du visage, des lèvres, de la gorge ou de la langue. Obtenez immédiatement une aide médicale d'urgence et arrêtez de prendre HYZAAR.
- Pression artérielle basse (hypotension). Une pression artérielle basse peut provoquer des évanouissements ou des étourdissements. Allongez-vous si vous vous sentez faible ou étourdi. Appelez immédiatement votre médecin.
- Si vous avez des problèmes rénaux, vous pouvez constater une aggravation du fonctionnement de vos reins. Appelez votre médecin si vous avez un gonflement des pieds, des chevilles ou des mains, ou une prise de poids inexpliquée.
- Une affection nouvelle ou qui s'aggrave appelée lupus érythémateux disséminé (Lupus ; LED)
- Problèmes oculaires. L'un des médicaments contenus dans HYZAAR 12,5 mg peut provoquer des problèmes oculaires qui, s'ils ne sont pas traités, peuvent entraîner une perte de vision. Les symptômes de problèmes oculaires peuvent survenir quelques heures à quelques semaines après le début de HYZAAR. Informez immédiatement votre médecin si vous avez :
- diminution de la vision
- douleur oculaire
- Sensibilité de la peau au soleil et risque de cancer de la peau.
Les effets indésirables les plus courants de HYZAAR 12,5 mg chez les personnes souffrant d'hypertension artérielle sont :
- « rhume » (infection des voies respiratoires supérieures)
- vertiges
- nez encombré
- mal au dos
Informez votre médecin si vous ressentez un effet indésirable qui vous dérange ou qui ne disparaît pas. Ce n'est pas une liste complète des effets secondaires. Pour une liste complète, demandez à votre médecin ou à votre pharmacien.
Comment dois-je conserver HYZAAR 12,5 mg ?
- Conservez HYZAAR à la température ambiante à 59°F à 86°F (15°C à 30°C).
- Gardez HYZAAR dans un récipient hermétiquement fermé et gardez HYZAAR hors de la lumière.
- Gardez HYZAAR 12,5 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur HYZAAR
Des médicaments sont parfois prescrits pour des affections qui ne sont pas mentionnées dans les notices d'information destinées aux patients. N'utilisez pas HYZAAR pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas HYZAAR à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Cette notice résume les informations les plus importantes sur HYZAAR. Si vous souhaitez plus d'informations, parlez-en à votre médecin. Vous pouvez demander à votre pharmacien ou à votre médecin des informations destinées aux professionnels de la santé.
Quels sont les ingrédients de HYZAAR ?
Ingrédients actifs: losartan potassique, hydrochlorothiazide
Ingrédients inactifs:
cellulose microcristalline, lactose hydraté, amidon prégélatinisé, stéarate de magnésium, hydroxypropylcellulose, hypromellose, dioxyde de titane. HYZAAR 50/12.5 et HYZAAR 100/25 contiennent également de la laque d'aluminium D&C jaune n° 10.
HYZAAR 50/12.5, HYZAAR 100/12.5 et HYZAAR 100/25 peuvent également contenir de la cire de carnauba.
