Prinivil 2.5mg, 5mg, 10mg Lisinopril Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Prinivil 2,5 mg et comment est-il utilisé ?
Prinivil est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de l'hypertension artérielle après une crise cardiaque ou une insuffisance cardiaque. Prinivil peut être utilisé seul ou avec d'autres médicaments.
- Prinivil appartient à une classe de médicaments appelés inhibiteurs de l'ECA.
- On ne sait pas si Prinivil est sûr et efficace chez les enfants de moins de 6 ans.
Quels sont les effets secondaires possibles de Prinivil ?
Prinivil peut provoquer des effets secondaires graves, notamment :
- étourdissement,
- fièvre,
- mal de gorge,
- nausée,
- la faiblesse,
- sensation de picotement,
- douleur thoracique,
- battements cardiaques irréguliers,
- perte de mouvement,
- peu ou pas de miction,
- gonflement des pieds ou des chevilles,
- se sentir fatigué,
- à bout de souffle,
- douleur dans le haut du ventre,
- démangeaison,
- sensation de fatigue,
- perte d'appétit,
- urine foncée,
- selles de couleur argile, et
- jaunissement de la peau ou des yeux (jaunisse)
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Prinivil 5mg incluent :
- mal de tête,
- vertiges,
- toux, et
- douleur thoracique
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Prinivil. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
TOXICITÉ FŒTALE
- Lorsqu'une grossesse est détectée, arrêter PRINIVIL dès que possible [voir MISES EN GARDE ET PRÉCAUTIONS].
- Les médicaments qui agissent directement sur le système rénine-angiotensine peuvent causer des lésions et la mort du fœtus en développement [voir MISES EN GARDE ET PRÉCAUTIONS].
LA DESCRIPTION
PRINIVIL contient du lisinopril, un dérivé peptidique synthétique, et un inhibiteur oral de l'enzyme de conversion de l'angiotensine à action prolongée. Lisinopril est chimiquement décrit comme (S)-1-[N2-(1-carboxy-3-phénylpropyl)-Llysyl]-L-proline dihydraté. Sa formule empirique est C21H31N3O5•2H2O et sa formule structurale est :
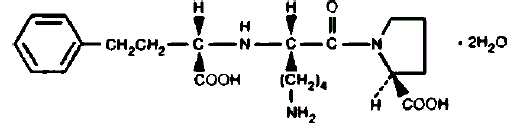
Le lisinopril est une poudre cristalline blanche à blanc cassé, d'un poids moléculaire de 441,52. Il est soluble dans l'eau et peu soluble dans le méthanol et pratiquement insoluble dans l'éthanol.
PRINIVIL 10 mg est fourni sous forme de comprimés de 5 mg, 10 mg et 20 mg pour administration orale. En plus de l'ingrédient actif, le lisinopril, chaque comprimé contient les ingrédients inactifs suivants : phosphate de calcium, mannitol, stéarate de magnésium et amidon. Les comprimés de 10 mg et 20 mg contiennent également de l'oxyde de fer.
LES INDICATIONS
Hypertension
PRINIVIL est indiqué pour le traitement de l'hypertension chez les patients adultes et les patients pédiatriques de 6 ans et plus pour abaisser la tension artérielle. L'abaissement de la pression artérielle réduit le risque d'événements cardiovasculaires mortels et non mortels, principalement des accidents vasculaires cérébraux et des infarctus du myocarde. Ces avantages ont été observés dans des essais contrôlés de médicaments antihypertenseurs appartenant à une grande variété de classes pharmacologiques.
Le contrôle de l'hypertension artérielle doit faire partie d'une gestion globale des risques cardiovasculaires, y compris, le cas échéant, le contrôle des lipides, la gestion du diabète, la thérapie antithrombotique, l'arrêt du tabac, l'exercice et un apport limité en sodium. De nombreux patients auront besoin de plus d'un médicament pour atteindre leurs objectifs de tension artérielle. Pour des conseils spécifiques sur les objectifs et la gestion, consultez les directives publiées, telles que celles du Comité national mixte sur la prévention, la détection, l'évaluation et le traitement de l'hypertension artérielle (JNC) du National High Blood Pressure Education Program.
De nombreux médicaments antihypertenseurs, appartenant à une variété de classes pharmacologiques et avec différents mécanismes d'action, ont été montrés dans des essais contrôlés randomisés pour réduire la morbidité et la mortalité cardiovasculaires, et on peut conclure qu'il s'agit de la réduction de la pression artérielle, et non d'une autre propriété pharmacologique de les médicaments, qui est en grande partie responsable de ces avantages. Le bénéfice cardiovasculaire le plus important et le plus constant a été une réduction du risque d'accident vasculaire cérébral, mais des réductions de l'infarctus du myocarde et de la mortalité cardiovasculaire ont également été observées régulièrement.
Une pression systolique ou diastolique élevée entraîne un risque cardiovasculaire accru, et l'augmentation du risque absolu par mmHg est plus importante à des pressions artérielles plus élevées, de sorte que même des réductions modestes de l'hypertension sévère peuvent apporter des avantages substantiels. La réduction du risque relatif de la réduction de la pression artérielle est similaire dans les populations avec un risque absolu variable, de sorte que le bénéfice absolu est plus important chez les patients qui présentent un risque plus élevé indépendamment de leur hypertension (par exemple, les patients atteints de diabète ou d'hyperlipidémie), et ces patients seraient attendus bénéficier d'un traitement plus agressif à un objectif de tension artérielle plus basse.
Certains médicaments antihypertenseurs ont des effets plus faibles sur la pression artérielle (en monothérapie) chez les patients noirs, et de nombreux médicaments antihypertenseurs ont des indications et des effets supplémentaires approuvés (par exemple, sur l'angine de poitrine, l'insuffisance cardiaque ou la maladie rénale diabétique). Ces considérations peuvent guider le choix du traitement.
PRINIVIL peut être administré seul ou avec d'autres agents antihypertenseurs [voir Etudes cliniques ].
Insuffisance cardiaque
PRINIVIL est indiqué pour réduire les signes et les symptômes d'insuffisance cardiaque chez les patients qui ne répondent pas de manière adéquate aux diurétiques et aux digitaliques [voir Etudes cliniques ].
Infarctus aigu du myocarde
PRINIVIL est indiqué pour la réduction de la mortalité chez les patients hémodynamiquement stables dans les 24 heures suivant un infarctus aigu du myocarde. Les patients doivent recevoir, le cas échéant, les traitements standard recommandés tels que les thrombolytiques, l'aspirine et les bêta-bloquants [voir Etudes cliniques ].
DOSAGE ET ADMINISTRATION
Hypertension
Traitement initial chez l'adulte : La dose initiale recommandée est de 10 mg une fois par jour. Ajuster la posologie en fonction de la réponse de la pression artérielle. La gamme posologique habituelle est de 20 à 40 mg par jour administrés en une seule dose quotidienne. Des doses allant jusqu'à 80 mg ont été utilisées mais ne semblent pas donner un effet plus important.
Utiliser avec des diurétiques chez les adultes
Si la pression artérielle n'est pas contrôlée avec PRINIVIL 10 mg seul, une faible dose d'un diurétique peut être ajoutée (par exemple, hydrochlorothiazide 12,5 mg).
La dose initiale recommandée chez les patients adultes hypertendus prenant des diurétiques est de 5 mg une fois par jour [voir INTERACTIONS MÉDICAMENTEUSES ].
Patients pédiatriques de 6 ans et plus souffrant d'hypertension
Pour les patients pédiatriques avec un débit de filtration glomérulaire > 30 ml/min/1,73 m², la dose initiale recommandée est de 0,07 mg/kg une fois par jour (jusqu'à 5 mg au total). La posologie doit être ajustée en fonction de la réponse tensionnelle jusqu'à un maximum de 0,61 mg/kg (jusqu'à 40 mg) une fois par jour. Les doses supérieures à 0,61 mg/kg (ou supérieures à 40 mg) n'ont pas été étudiées chez les patients pédiatriques [voir PHARMACOLOGIE CLINIQUE ].
PRINIVIL 2,5 mg n'est pas recommandé chez les patients pédiatriques Utilisation dans des populations spécifiques et Etudes cliniques ].
Insuffisance cardiaque
La dose initiale recommandée de PRINIVIL 2,5 mg, lorsqu'il est utilisé avec des diurétiques et (généralement) des digitaliques en tant que traitement adjuvant, est de 5 mg une fois par jour. La dose initiale recommandée chez ces patients atteints d'hyponatrémie (nade sérique
Il peut être nécessaire d'ajuster la dose de diurétique pour aider à minimiser l'hypovolémie, qui peut contribuer à l'hypotension [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ]. L'apparition d'une hypotension après la dose initiale de PRINIVIL n'empêche pas une titration prudente ultérieure de la dose avec le médicament, après une prise en charge efficace de l'hypotension.
Infarctus aigu du myocarde
Chez les patients hémodynamiquement stables dans les 24 heures suivant l'apparition des symptômes d'un infarctus aigu du myocarde, administrer PRINIVIL 5 mg par voie orale, suivi de 5 mg après 24 heures, 10 mg après 48 heures puis 10 mg une fois par jour. Le dosage doit se poursuivre pendant au moins 6 semaines.
Initier le traitement avec 2,5 mg chez les patients ayant une pression artérielle systolique basse (100-120 mmHg) pendant les 3 premiers jours après l'infarctus [voir AVERTISSEMENTS ET PRECAUTIONS ]. En cas d'hypotension (pression artérielle systolique ≤ 100 mmHg), envisager des doses de 2,5 ou 5 mg. En cas d'hypotension prolongée (pression artérielle systolique
Dose chez les patients atteints d'insuffisance rénale
Aucun ajustement posologique de PRINIVIL 2,5 mg n'est nécessaire chez les patients dont la clairance de la créatinine est > 30 mL/min. Chez les patients dont la clairance de la créatinine est de 10 à 30 ml/min, réduire la dose initiale de PRINIVIL à la moitié de la dose habituelle recommandée (c'est-à-dire, hypertension, 5 mg ; insuffisance cardiaque ou IM aigu, 2,5 mg). Pour les patients sous hémodialyse ou dont la clairance de la créatinine est Utilisation dans des populations spécifiques et PHARMACOLOGIE CLINIQUE ].
Préparation de la suspension
Pour préparer 200 ml d'une suspension à 1,0 mg/ml, ajouter 10 ml d'eau purifiée USP dans un flacon en polyéthylène téréphtalate (PET) contenant dix comprimés de 20 mg de PRINIVIL 5 mg et agiter pendant au moins une minute. Ajouter 30 ml de solution buvable de citrate de sodium et d'acide citrique ou de diluant Cytra-2 et 160 ml d'Ora-Sweet SF™ au concentré dans la bouteille en PET et agiter doucement pendant plusieurs secondes pour disperser les ingrédients. La suspension doit être conservée à une température égale ou inférieure à 25 °C (77 °F) et peut être conservée jusqu'à quatre semaines. Agiter la suspension avant chaque utilisation.
COMMENT FOURNIE
Formes posologiques et points forts
Les comprimés PRINIVIL, 5 mg, sont des comprimés blancs de forme ovale portant le code MSD 19 sur une face et sécables sur l'autre face.
Les comprimés PRINIVIL, 10 mg, sont des comprimés comprimés jaune clair, de forme ovale, portant le code MSD 106 sur une face et sécables sur l'autre face.
Les comprimés PRINIVIL, 20 mg, sont des comprimés pêche, de forme ovale, portant le code MSD 207 sur une face et sécables sur l'autre face.
Stockage et manutention
PRINIVIL 10 mg se présente sous forme de comprimés ovales, sécables sur une face.
Stockage
Conserver à température ambiante contrôlée, 15-30°C (59-86°F), et protéger de l'humidité.
Distribuer dans un récipient étanche, si l'emballage du produit est subdivisé.
Distribué par : Merck Sharp & Dohme Corp., une filiale de MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Révisé : novembre 2021
EFFETS SECONDAIRES
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les études cliniques d'un médicament ne peuvent pas être directement comparés aux taux des études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Hypertension
Les effets indésirables suivants (événements 2 % plus importants sous PRINIVIL 5 mg que sous placebo) ont été observés avec PRINIVIL 2,5 mg vs placebo : céphalées (5,7 % vs 1,9 %), étourdissements (5,4 % vs 1,9 %), toux (3,5 % vs 1,0 % ).
Insuffisance cardiaque
Dans des études contrôlées chez des patients insuffisants cardiaques, le traitement a été interrompu chez 8,1 % des patients traités par PRINIVIL 10 mg pendant 12 semaines, contre 7,7 % des patients traités par placebo pendant 12 semaines.
Les effets indésirables suivants (événements 2 % plus importants sous PRINIVIL 2,5 mg que sous placebo) ont été observés avec PRINIVIL vs placebo : hypotension (4,4 % vs 0,6 %), douleurs thoraciques (3,4 % vs 1,3 %).
Dans l'essai ATLAS [voir Etudes cliniques ] chez les patients insuffisants cardiaques, les abandons pour effets indésirables étaient similaires dans les groupes à faible et à forte dose. Les effets indésirables suivants, principalement liés à l'inhibition de l'ECA, ont été rapportés plus fréquemment dans le groupe à dose élevée :
Infarctus aigu du myocarde
Les patients de l'étude GISSI-3, traités par PRINIVIL 10 mg, ont présenté une incidence plus élevée d'hypotension (9,0 % vs 3,7 %) et d'insuffisance rénale (2,4 % vs 1,1 %) par rapport aux patients ne prenant pas PRINIVIL.
Les autres effets indésirables cliniques survenant chez 1 % ou plus des patients souffrant d'hypertension ou d'insuffisance cardiaque traités par PRINIVIL 2,5 mg dans des essais cliniques contrôlés et n'apparaissant pas dans d'autres rubriques de la notice sont énumérés ci-dessous :
Corps dans son ensemble : Fatigue, asthénie, effets orthostatiques.
Digestif: Pancréatite, constipation, flatulence, bouche sèche, diarrhée.
Hématologique : Rares cas d'aplasie médullaire, d'anémie hémolytique, de leucopénie/neutropénie et de thrombocytopénie.
Endocrine: Diabète sucré, sécrétion inappropriée d'hormone antidiurétique.
Métabolique: Goutte
Peau: Urticaire, alopécie, photosensibilité, érythème, bouffées vasomotrices, diaphorèse, pseudolymphome cutané, nécrolyse épidermique toxique, syndrome de Stevens-Johnson et prurit.
Sens spéciaux : Perte visuelle, diplopie, vision floue, acouphènes, photophobie, troubles du goût, troubles olfactifs.
Urogénital: Impuissance
Divers: Un complexe de symptômes a été rapporté qui peut inclure un ANA positif, une vitesse de sédimentation élevée des érythrocytes, une arthralgie/arthrite, une myalgie, de la fièvre, une vascularite, une éosinophilie, une leucocytose, une paresthésie et des vertiges. Une éruption cutanée, une photosensibilité ou d'autres manifestations dermatologiques peuvent survenir seules ou en combinaison avec ces symptômes.
Résultats des tests de laboratoire clinique
Potassium sérique
Dans les essais cliniques, une hyperkaliémie (kaliémie > 5,7 mEq/L) est survenue chez 2,2 % et 4,8 % des patients traités par PRINIVIL souffrant d'hypertension et d'insuffisance cardiaque, respectivement [voir AVERTISSEMENTS ET PRECAUTIONS ].
Créatinine, azote uréique du sang
Des augmentations mineures de l'azote uréique sanguin et de la créatinine sérique, réversibles à l'arrêt du traitement, ont été observées chez environ 2 % des patients hypertendus traités par PRINIVIL 5 mg seul. Les augmentations étaient plus fréquentes chez les patients recevant des diurétiques concomitants et chez les patients présentant une sténose de l'artère rénale [voir AVERTISSEMENTS ET PRECAUTIONS ]. Des augmentations mineures réversibles de l'azote uréique sanguin et de la créatinine sérique ont été observées chez 11,6 % des patients atteints d'insuffisance cardiaque sous traitement diurétique concomitant. Fréquemment, ces anomalies disparaissaient lorsque la posologie du diurétique était diminuée.
Les patients atteints d'infarctus aigu du myocarde dans l'essai GISSI-3 traités par PRINIVIL présentaient une incidence plus élevée (2,4 % contre 1,1 % dans le groupe placebo) de dysfonctionnement rénal à l'hôpital et à 6 semaines (augmentation de la concentration de créatinine à plus de 3 mg/dL ou un doublement ou plus de la concentration de créatinine sérique de base).
Hémoglobine et hématocrite
De petites diminutions de l'hémoglobine (moyenne de 0,4 mg/dL) et de l'hématocrite (moyenne de 1,3 %) sont fréquemment survenues chez les patients traités par PRINIVIL 5 mg, mais ont rarement eu une importance clinique chez les patients sans autre cause d'anémie. Dans les essais cliniques, moins de 0,1 % des patients ont interrompu le traitement contre l'anémie.
Des enzymes hépatiques
Rarement, des élévations des enzymes hépatiques et/ou de la bilirubine sérique se sont produites [voir AVERTISSEMENTS ET PRECAUTIONS ].
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation du lisinopril qui ne sont pas inclus dans d'autres sections de l'étiquetage. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament. D'autres réactions incluent:
Troubles du métabolisme et de la nutrition
Hyponatrémie [voir AVERTISSEMENTS ET PRECAUTIONS ], des cas d'hypoglycémie chez des patients diabétiques sous antidiabétiques oraux ou sous insuline [voir INTERACTIONS MÉDICAMENTEUSES ]
Système nerveux et troubles psychiatriques
Altérations de l'humeur (y compris symptômes dépressifs), confusion mentale
INTERACTIONS MÉDICAMENTEUSES
Diurétiques
L'initiation de PRINIVIL chez les patients sous diurétiques peut entraîner une réduction excessive de la pression artérielle. La possibilité d'effets hypotenseurs avec PRINIVIL peut être minimisée en diminuant ou en arrêtant le diurétique ou en augmentant la consommation de sel avant le début du traitement par PRINIVIL. Si cela n'est pas possible, réduire la dose initiale de PRINIVIL [voir DOSAGE ET ADMINISTRATION et AVERTISSEMENTS ET PRECAUTIONS ].
PRINIVIL 2,5 mg atténue les pertes potassiques induites par les diurétiques de type thiazidique. Les diurétiques épargneurs de potassium (spironolactone, amiloride, triamtérène et autres) ou d'autres médicaments susceptibles d'augmenter la kaliémie peuvent augmenter le risque d'hyperkaliémie. Par conséquent, si l'utilisation concomitante de tels agents est indiquée, surveiller fréquemment le potassium sérique du patient.
Antidiabétiques
L'administration concomitante de PRINIVIL 10 mg et de médicaments antidiabétiques (insulines, hypoglycémiants oraux) peut entraîner une majoration de l'effet hypoglycémiant avec risque d'hypoglycémie.
Agents anti-inflammatoires non stéroïdiens, y compris les inhibiteurs sélectifs de la cyclooxygénase-2 (inhibiteurs de la COX-2)
Chez les patients âgés, hypovolémiques (y compris ceux sous traitement diurétique) ou dont la fonction rénale est altérée, la co-administration d'AINS, y compris les inhibiteurs sélectifs de la COX-2, avec des inhibiteurs de l'ECA, y compris le lisinopril, peut entraîner une détérioration de la fonction rénale, y compris possible insuffisance rénale aiguë. Ces effets sont généralement réversibles. Surveillez périodiquement la fonction rénale chez les patients recevant du lisinopril et un traitement par AINS.
L'effet antihypertenseur des inhibiteurs de l'ECA, y compris le lisinopril, peut être atténué par les AINS.
Double blocage du système rénine-angiotensine (RAS)
Le double blocage du SRA avec des antagonistes des récepteurs de l'angiotensine, des inhibiteurs de l'ECA ou des inhibiteurs directs de la rénine (tels que l'aliskirène) est associé à des risques accrus d'hypotension, de syncope, d'hyperkaliémie et de modifications de la fonction rénale (y compris l'insuffisance rénale aiguë) par rapport à la monothérapie.
L'essai Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) a recruté 1 448 patients atteints de diabète de type 2, présentant un rapport albumine/créatinine urinaire élevé et une diminution du débit de filtration glomérulaire estimé (DFG de 30 à 89,9 ml/min), les a randomisés pour lisinopril ou un placebo sur fond de traitement par losartan et les a suivis pendant une durée médiane de 2,2 ans. Les patients recevant l'association de losartan et de lisinopril n'ont obtenu aucun bénéfice supplémentaire par rapport à la monothérapie pour le critère d'évaluation combiné de la diminution du DFG, de l'insuffisance rénale terminale ou du décès, mais ont présenté une incidence accrue d'hyperkaliémie et d'insuffisance rénale aiguë par rapport au groupe monothérapie .
En général, évitez l'utilisation combinée d'inhibiteurs du RAS. Surveiller la pression artérielle, la fonction rénale et les électrolytes chez les patients sous PRINIVIL 5 mg et d'autres agents qui affectent le SRA.
Ne pas co-administrer l'aliskiren avec PRINIVIL chez les patients diabétiques. Eviter l'utilisation d'aliskirène avec PRINIVIL 2,5 mg chez les insuffisants rénaux (DFG
Lithium
Une toxicité du lithium a été rapportée chez des patients recevant du lithium en concomitance avec des médicaments entraînant l'élimination du sodium, y compris des inhibiteurs de l'ECA. La toxicité du lithium était généralement réversible à l'arrêt du lithium et de l'inhibiteur de l'ECA. Surveiller les niveaux de lithium sérique pendant l'utilisation simultanée.
Or
Des réactions nitritoïdes (les symptômes incluent bouffées vasomotrices, nausées, vomissements et hypotension) ont été rarement rapportées chez des patients recevant un traitement par injection d'or (aurothiomalate de sodium) et un traitement concomitant par un inhibiteur de l'ECA, y compris PRINIVIL.
Cible mammifère des inhibiteurs de la rapamycine (mTOR)
Les patients prenant un traitement concomitant par un inhibiteur de mTOR (p. ex., temsirolimus, sirolimus, évérolimus) peuvent présenter un risque accru d'œdème de Quincke [voir AVERTISSEMENTS ET PRECAUTIONS ].
Inhibiteurs de la néprilysine
Les patients prenant un inhibiteur de la néprilysine en concomitance (par exemple, le sacubitril) peuvent être exposés à un risque accru d'œdème de Quincke [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Toxicité fœtale
PRINIVIL peut être nocif pour le fœtus lorsqu'il est administré à une femme enceinte. L'utilisation de médicaments qui agissent sur le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales. L'oligohydramnios qui en résulte peut être associé à une hypoplasie pulmonaire fœtale et à des déformations squelettiques. Les effets indésirables néonataux potentiels comprennent l'hypoplasie crânienne, l'anurie, l'hypotension, l'insuffisance rénale et la mort. Lorsqu'une grossesse est détectée, arrêter PRINIVIL dès que possible [voir Utilisation dans des populations spécifiques ].
Angiœdème et réactions anaphylactoïdes
Angiœdème
Angiœdème de la tête et du cou
Des œdèmes de Quincke du visage, des extrémités, des lèvres, de la langue, de la glotte et/ou du larynx, y compris certaines réactions fatales, sont survenus chez des patients traités par des inhibiteurs de l'enzyme de conversion de l'angiotensine, y compris PRINIVIL, à tout moment pendant le traitement. Les patients présentant une atteinte de la langue, de la glotte ou du larynx sont susceptibles de présenter une obstruction des voies respiratoires, en particulier ceux ayant des antécédents de chirurgie des voies respiratoires. PRINIVIL 5 mg doit être interrompu rapidement et un traitement et une surveillance appropriés doivent être assurés jusqu'à la résolution complète et durable des signes et symptômes d'angio-œdème.
Les patients ayant des antécédents d'œdème de Quincke non lié au traitement par un inhibiteur de l'ECA peuvent être exposés à un risque accru d'œdème de Quincke lorsqu'ils reçoivent un inhibiteur de l'ECA [voir CONTRE-INDICATIONS ]. Les inhibiteurs de l'ECA ont été associés à un taux plus élevé d'œdème de Quincke chez les patients noirs que chez les patients non noirs.
Les patients recevant un traitement concomitant par un inhibiteur de l'ECA et un inhibiteur de mTOR (mammalian target of rapamycin) (p. ex., temsirolimus, sirolimus, évérolimus) peuvent présenter un risque accru d'œdème de Quincke [voir INTERACTIONS MÉDICAMENTEUSES ].
Les patients recevant un traitement concomitant par un inhibiteur de l'ECA et un inhibiteur de la néprilysine peuvent présenter un risque accru d'œdème de Quincke [voir CONTRE-INDICATIONS et INTERACTIONS MÉDICAMENTEUSES ].
Angiœdème intestinal
Des œdèmes de Quincke intestinaux sont survenus chez des patients traités par des inhibiteurs de l'ECA. Ces patients présentaient des douleurs abdominales (avec ou sans nausées ou vomissements) ; dans certains cas, il n'y avait pas d'antécédent d'angio-œdème facial et les taux d'estérase C-1 étaient normaux. Dans certains cas, l'œdème de Quincke a été diagnostiqué par des procédures telles qu'une tomodensitométrie abdominale ou une échographie, ou lors d'une intervention chirurgicale, et les symptômes ont disparu après l'arrêt de l'inhibiteur de l'ECA.
Réactions anaphylactoïdes
Réactions anaphylactoïdes pendant la désensibilisation
Deux patients subissant un traitement de désensibilisation au venin d'hyménoptère tout en recevant des inhibiteurs de l'ECA ont subi des réactions anaphylactoïdes potentiellement mortelles.
Réactions anaphylactoïdes pendant la dialyse
Des réactions anaphylactoïdes soudaines et potentiellement mortelles sont survenues chez certains patients dialysés avec des membranes à haut débit et traités simultanément par un inhibiteur de l'ECA. Chez ces patients, la dialyse doit être arrêtée immédiatement et un traitement agressif des réactions anaphylactoïdes doit être instauré. Les symptômes n'ont pas été soulagés par les antihistaminiques dans ces situations. Chez ces patients, il faut envisager d'utiliser un autre type de membrane de dialyse ou une autre classe d'antihypertenseurs. Des réactions anaphylactoïdes ont également été rapportées chez des patients subissant une aphérèse des lipoprotéines de basse densité avec absorption de sulfate de dextran.
Fonction rénale altérée
Surveiller périodiquement la fonction rénale chez les patients traités par PRINIVIL. Des modifications de la fonction rénale, y compris une insuffisance rénale aiguë, peuvent être causées par des médicaments qui inhibent le système rénine-angiotensine. Les patients dont la fonction rénale peut dépendre en partie de l'activité du système rénine-angiotensine (p. ex., les patients présentant une sténose de l'artère rénale, une maladie rénale chronique, une insuffisance cardiaque congestive sévère, un infarctus du myocarde ou une déplétion volémique) peuvent présenter un risque particulier de développer insuffisance rénale aiguë sous PRINIVIL. Envisager de suspendre ou d'arrêter le traitement chez les patients qui développent une diminution cliniquement significative de la fonction rénale sous PRINIVIL [voir EFFETS INDÉSIRABLES et INTERACTIONS MÉDICAMENTEUSES ].
Hypotension
PRINIVIL peut provoquer une hypotension symptomatique, parfois compliquée d'oligurie, d'azotémie progressive, d'insuffisance rénale aiguë ou de décès. Les patients à risque d'hypotension excessive comprennent ceux qui présentent les conditions ou les caractéristiques suivantes : insuffisance cardiaque avec une pression artérielle systolique inférieure à 100 mmHg, cardiopathie ischémique, maladie cérébrovasculaire, hyponatrémie, traitement diurétique à forte dose, dialyse rénale ou déplétion volémique et/ou sodée sévère de toute étiologie.
Chez ces patients, commencer PRINIVIL sous surveillance médicale et suivre ces patients pendant les deux premières semaines de traitement et chaque fois que la dose de PRINIVIL et/ou de diurétique est augmentée. Éviter l'utilisation de PRINIVIL 2,5 mg chez les patients hémodynamiquement instables après un IDM aigu.
Une hypotension symptomatique est également possible chez les patients présentant une sténose aortique sévère ou une cardiomyopathie hypertrophique.
Chirurgie/Anesthésie
Chez les patients subissant une intervention chirurgicale majeure ou au cours d'une anesthésie avec des agents provoquant une hypotension, PRINIVIL peut bloquer la formation d'angiotensine II secondaire à la libération compensatoire de rénine. Si une hypotension survient et est considérée comme due à ce mécanisme, elle peut être corrigée par une expansion volémique.
Hyperkaliémie
Surveiller périodiquement la kaliémie chez les patients recevant PRINIVIL. Les médicaments qui inhibent le système rénine-angiotensine peuvent provoquer une hyperkaliémie. Les facteurs de risque de développement de l'hyperkaliémie comprennent l'insuffisance rénale, le diabète sucré et l'utilisation concomitante de diurétiques épargneurs de potassium, de suppléments de potassium, de substituts de sel contenant du potassium ou d'autres médicaments susceptibles d'augmenter le potassium sérique [voir INTERACTIONS MÉDICAMENTEUSES ].
Défaillance hépatique
Les inhibiteurs de l'ECA ont été associés à un syndrome qui commence par un ictère cholestatique ou une hépatite et évolue vers une nécrose hépatique fulminante et parfois la mort. Le mécanisme de ce syndrome n'est pas compris. Les patients recevant des inhibiteurs de l'ECA qui développent un ictère ou des élévations marquées des enzymes hépatiques doivent arrêter l'inhibiteur de l'ECA et recevoir un traitement médical approprié.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Aucun effet tumorigène n'a été observé lorsque le lisinopril a été administré pendant 105 semaines à des rats mâles et femelles à des doses allant jusqu'à 90 mg par kg par jour ou pendant 92 semaines à des souris mâles et femelles à des doses allant jusqu'à 135 mg par kg par jour. Ces doses sont 10 fois et 7 fois, respectivement, le MRHDD lorsqu'on les compare sur la base de la surface corporelle.
Le lisinopril n'a pas été mutagène dans le test de mutagène microbien d'Ames avec ou sans activation métabolique. Il était également négatif dans un test de mutation directe utilisant des cellules pulmonaires de hamster chinois. Le lisinopril n'a pas produit de ruptures d'ADN simple brin lors d'un test d'hépatocytes de rat par élution alcaline in vitro. De plus, le lisinopril n'a pas entraîné d'augmentation des aberrations chromosomiques dans un test in vitro sur des cellules ovariennes de hamster chinois ou dans une étude in vivo sur de la moelle osseuse de souris.
Il n'y a eu aucun effet indésirable sur la performance reproductive chez les rats mâles et femelles traités avec jusqu'à 300 mg/kg/jour de lisinopril (33 fois la MRHDD par rapport à la surface corporelle).
Des études chez le rat indiquent que le lisinopril traverse mal la barrière hémato-encéphalique. Des doses multiples de lisinopril chez le rat n'entraînent pas d'accumulation dans les tissus. Le lait des rats en lactation contient de la radioactivité suite à l'administration de lisinopril marqué au 14C. Par autoradiographie du corps entier, la radioactivité a été trouvée dans le placenta après l'administration du médicament marqué à des rates gravides, mais aucune n'a été trouvée chez les fœtus.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
PRINIVIL peut être nocif pour le fœtus lorsqu'il est administré à une femme enceinte. L'utilisation de médicaments qui agissent sur le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales. La plupart des études épidémiologiques examinant les anomalies fœtales après exposition à l'utilisation d'antihypertenseurs au cours du premier trimestre n'ont pas distingué les médicaments affectant le système rénine-angiotensine des autres agents antihypertenseurs. Lorsqu'une grossesse est détectée, arrêter PRINIVIL 5 mg dès que possible.
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 à 4 % et de 15 à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
L'hypertension pendant la grossesse augmente le risque maternel de prééclampsie, de diabète gestationnel, d'accouchement prématuré et de complications à l'accouchement (p. ex., nécessité d'une césarienne et hémorragie post-partum). L'hypertension augmente le risque fœtal de retard de croissance intra-utérin et de mort intra-utérine. Les femmes enceintes souffrant d'hypertension doivent être étroitement surveillées et prises en charge en conséquence.
Effets indésirables fœtaux/néonatals
L'oligohydramnios chez les femmes enceintes qui utilisent des médicaments affectant le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse peut entraîner ce qui suit : une fonction rénale fœtale réduite entraînant une anurie et une insuffisance rénale, une hypoplasie pulmonaire fœtale et des déformations du squelette, y compris une hypoplasie crânienne, une hypotension , et la mort. Dans le cas inhabituel où il n'y a pas de thérapie alternative appropriée aux médicaments affectant le système rénine-angiotensine pour un patient particulier, informez la mère du risque potentiel pour le fœtus.
Chez les patientes prenant PRINIVIL pendant la grossesse, effectuer des échographies en série pour évaluer l'environnement intra-amniotique. Des tests fœtaux peuvent être appropriés, en fonction de la semaine de gestation. Si un oligohydramnios est observé, arrêter PRINIVIL 10 mg, sauf si cela est considéré comme salvateur pour la mère. Les patients et les médecins doivent toutefois savoir que l'oligohydramnios peut n'apparaître qu'après que le fœtus a subi une lésion irréversible.
Observer étroitement les nourrissons ayant des antécédents d'exposition in utero à PRINIVIL pour l'hypotension, l'oligurie et l'hyperkaliémie. Chez les nouveau-nés ayant des antécédents d'exposition in utero à PRINIVIL, en cas d'oligurie ou d'hypotension, maintenir la tension artérielle et la perfusion rénale. Des exsanguinotransfusions ou une dialyse peuvent être nécessaires pour inverser l'hypotension et/ou remplacer les troubles de la fonction rénale.
Lactation
Résumé des risques
Aucune donnée n'est disponible concernant la présence de lisinopril dans le lait maternel ou les effets du lisinopril sur le nourrisson allaité ou sur la production de lait. Le lisinopril est présent dans le lait de rat. Étant donné que de nombreux médicaments sont sécrétés dans le lait maternel et en raison du risque d'effets indésirables graves chez les nourrissons allaités par les inhibiteurs de l'ECA, interrompez l'allaitement ou arrêtez PRINIVIL.
Utilisation pédiatrique
Les effets antihypertenseurs et la sécurité de PRINIVIL ont été établis chez les patients pédiatriques âgés de 6 à 16 ans [voir DOSAGE ET ADMINISTRATION et Etudes cliniques ]. Aucune différence pertinente entre le profil des effets indésirables des patients pédiatriques et des patients adultes n'a été identifiée.
La sécurité et l'efficacité de PRINIVIL n'ont pas été établies chez les patients pédiatriques de moins de 6 ans ou chez les patients pédiatriques avec un taux de filtration glomérulaire PHARMACOLOGIE CLINIQUE et Etudes cliniques ].
Utilisation gériatrique
Aucun ajustement posologique avec PRINIVIL 2,5 mg n'est nécessaire chez les patients âgés. Dans une étude clinique de PRINIVIL 10 mg chez des patients atteints d'infarctus du myocarde (essai GISSI-3), 4 413 (47 %) avaient 65 ans et plus, tandis que 1 656 (18 %) avaient 75 ans et plus. Dans cette étude, 4,8 % des patients âgés de 75 ans et plus ont arrêté le traitement par PRINIVIL 5 mg en raison d'un dysfonctionnement rénal contre 1,3 % des patients de moins de 75 ans. Aucune autre différence d'innocuité ou d'efficacité n'a été observée entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité chez certaines personnes âgées ne peut être exclue.
Course
Les inhibiteurs de l'ECA, dont PRINIVIL, ont un effet sur la tension artérielle moindre chez les patients noirs que chez les non-noirs.
Insuffisance rénale
Un ajustement posologique de PRINIVIL est nécessaire chez les patients sous hémodialyse ou dont la clairance de la créatinine est ≤ 30 mL/min. Aucun ajustement posologique de PRINIVIL 5 mg n'est nécessaire chez les patients dont la clairance de la créatinine est > 30 mL/min [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Après une dose orale unique de 20 g/kg, aucune létalité n'est survenue chez le rat et la mort est survenue chez l'une des 20 souris recevant la même dose. La manifestation la plus probable d'un surdosage serait l'hypotension, pour laquelle le traitement habituel serait une perfusion intraveineuse de solution saline normale.
Le lisinopril peut être éliminé par hémodialyse [voir AVERTISSEMENTS ET PRECAUTIONS ].
CONTRE-INDICATIONS
PRINIVIL 10 mg est contre-indiqué chez les patients présentant :
- des antécédents d'œdème de Quincke ou d'hypersensibilité liés à un traitement antérieur par un inhibiteur de l'enzyme de conversion de l'angiotensine
- œdème de Quincke héréditaire ou idiopathique.
Ne pas co-administrer l'aliskirène avec PRINIVIL 5 mg chez les patients diabétiques [voir INTERACTIONS MÉDICAMENTEUSES ]. PRINIVIL est contre-indiqué en association avec un inhibiteur de la néprilysine (par exemple, le sacubitril). Ne pas administrer PRINIVIL 2,5 mg dans les 36 heures suivant le passage au sacubitril/valsartan, un produit contenant un inhibiteur de la néprilysine [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le lisinopril inhibe l'enzyme de conversion de l'angiotensine (ECA) chez les sujets humains et les animaux. L'ACE est une peptidyl dipeptidase qui catalyse la conversion de l'angiotensine I en substance vasoconstrictrice, l'angiotensine II. L'angiotensine II stimule également la sécrétion d'aldostérone par le cortex surrénalien. Les effets bénéfiques du lisinopril dans l'hypertension et l'insuffisance cardiaque semblent résulter principalement de la suppression du système rénine-angiotensinaldostérone. L'inhibition de l'ECA entraîne une diminution de l'angiotensine II plasmatique, ce qui entraîne une diminution de l'activité vasopressive et une diminution de la sécrétion d'aldostérone. Cette dernière diminution peut entraîner une légère augmentation du potassium sérique. Chez les patients hypertendus ayant une fonction rénale normale traités par PRINIVIL 10 mg seul jusqu'à 24 semaines, l'augmentation moyenne de la kaliémie était d'environ 0,1 mEq/L ; cependant, environ 15 % des patients ont présenté des augmentations supérieures à 0,5 mEq/L et environ 6 % ont présenté une diminution supérieure à 0,5 mEq/L. Dans la même étude, les patients traités par PRINIVIL 2,5 mg et hydrochlorothiazide jusqu'à 24 semaines ont présenté une diminution moyenne de la kaliémie de 0,1 mEq/L ; environ 4 % des patients ont présenté des augmentations supérieures à 0,5 mEq/L et environ 12 % ont présenté une diminution supérieure à 0,5 mEq/L [voir AVERTISSEMENTS ET PRECAUTIONS ]. L'élimination de la rétroaction négative de l'angiotensine II sur la sécrétion de rénine entraîne une augmentation de l'activité de la rénine plasmatique.
L'ACE est identique à la kininase, une enzyme qui dégrade la bradykinine. Il reste à déterminer si des taux accrus de bradykinine, un puissant peptide vasodépresseur, jouent un rôle dans les effets thérapeutiques de PRINIVIL 5 mg.
Bien que l'on pense que le mécanisme par lequel PRINIVIL 2,5 mg abaisse la tension artérielle est principalement la suppression du système rénine-angiotensine-aldostérone, PRINIVIL est antihypertenseur même chez les patients présentant une hypertension à rénine basse. Bien que PRINIVIL 10 mg ait été antihypertenseur dans toutes les races étudiées, les patients noirs hypertendus (habituellement une population hypertendue à rénine basse) ont eu une réponse moyenne plus faible à la monothérapie que les patients non noirs.
L'administration concomitante de PRINIVIL 5 mg et d'hydrochlorothiazide a encore réduit la pression artérielle chez les patients noirs et non noirs et toute différence raciale dans la réponse de la pression artérielle n'était plus évidente.
Pharmacodynamie
Hypertension
Patients adultes
L'administration de PRINIVIL à des patients hypertendus entraîne une réduction de la tension artérielle en décubitus et en position debout à peu près dans la même mesure, sans tachycardie compensatoire. Une hypotension orthostatique symptomatique n'est généralement pas observée bien qu'elle puisse survenir et doit être anticipée chez les patients présentant une déplétion volémique et/ou sodée [voir AVERTISSEMENTS ET PRECAUTIONS ]. Lorsqu'ils sont administrés avec des diurétiques de type thiazidique, les effets hypotenseurs des deux médicaments sont approximativement additifs.
Chez la plupart des patients étudiés, le début de l'activité antihypertensive a été observé une heure après l'administration orale d'une dose individuelle de PRINIVIL, avec une réduction maximale de la pression artérielle atteinte au bout de 6 heures. Bien qu'un effet antihypertenseur ait été observé 24 heures après l'administration des doses quotidiennes uniques recommandées, l'effet était plus constant et l'effet moyen était considérablement plus important dans certaines études avec des doses de 20 mg ou plus qu'avec des doses plus faibles. Cependant, à toutes les doses étudiées, l'effet antihypertenseur moyen était considérablement plus faible 24 heures après l'administration qu'il ne l'était 6 heures après l'administration.
Les effets antihypertenseurs de PRINIVIL sont maintenus pendant un traitement au long cours. L'arrêt brutal de PRINIVIL 10 mg n'a pas été associé à une augmentation rapide de la pression artérielle ou à une augmentation significative de la pression artérielle par rapport aux niveaux de prétraitement.
Pharmacocinétique
Patients adultes
Après l'administration orale de PRINIVIL, les concentrations sériques maximales de lisinopril se produisent dans les 7 heures environ, bien qu'il y ait eu une tendance à un léger retard dans le temps nécessaire pour atteindre les concentrations sériques maximales chez les patients atteints d'infarctus aigu du myocarde. La baisse des concentrations sériques présente une phase terminale prolongée qui ne contribue pas à l'accumulation du médicament. Cette phase terminale représente probablement une liaison saturable à l'ECA et n'est pas proportionnelle à la dose. Lors d'administrations multiples, le lisinopril présente une demi-vie effective de 12 heures.
Le lisinopril ne semble pas être lié à d'autres protéines sériques. Le lisinopril ne subit pas de métabolisme et est excrété entièrement sous forme inchangée dans l'urine. Sur la base de la récupération urinaire, le degré moyen d'absorption du lisinopril est d'environ 25 %, avec une grande variabilité interindividuelle (6-60 %) à toutes les doses testées (5-80 mg). L'absorption du lisinopril n'est pas influencée par la présence d'aliments dans le tractus gastro-intestinal. La biodisponibilité absolue du lisinopril est réduite à environ 16 % chez les patients atteints d'insuffisance cardiaque congestive stable de classe NYHA II-IV, et le volume de distribution semble être légèrement inférieur à celui des sujets normaux.
La biodisponibilité orale du lisinopril chez les patients présentant un infarctus aigu du myocarde est similaire à celle des volontaires sains.
L'insuffisance rénale diminue l'élimination du lisinopril, qui est principalement excrété par les reins, mais cette diminution ne devient cliniquement importante que lorsque le débit de filtration glomérulaire est inférieur à 30 mL/min. Au-dessus de ce taux de filtration glomérulaire, la demi-vie d'élimination est peu modifiée. Cependant, avec une altération plus importante, les concentrations maximales et minimales de lisinopril augmentent, le temps nécessaire pour atteindre la concentration maximale augmente et le temps nécessaire pour atteindre l'état d'équilibre est prolongé. En moyenne, les patients plus âgés ont (environ doublé) des taux sanguins et une aire sous la courbe de concentration plasmatique (ASC) plus élevés que les patients plus jeunes [voir DOSAGE ET ADMINISTRATION ]. Le lisinopril peut être éliminé par hémodialyse.
Des études chez le rat indiquent que le lisinopril traverse mal la barrière hémato-encéphalique. Des doses multiples de lisinopril chez le rat n'entraînent pas d'accumulation dans les tissus. Le lait des rats en lactation contient de la radioactivité suite à l'administration de lisinopril marqué au 14C. Par autoradiographie du corps entier, la radioactivité a été trouvée dans le placenta après l'administration du médicament marqué à des rates gravides, mais aucune n'a été trouvée chez les fœtus.
Patients pédiatriques
La pharmacocinétique du lisinopril a été étudiée chez 29 patients pédiatriques hypertendus âgés de 6 à 16 ans avec un débit de filtration glomérulaire > 30 mL/min/1,73 m². Après des doses de 0,1 à 0,2 mg/kg, les concentrations plasmatiques maximales à l'état d'équilibre du lisinopril se sont produites dans les 6 heures et le degré d'absorption basé sur la récupération urinaire était d'environ 28 %. Ces valeurs sont similaires à celles obtenues précédemment chez l'adulte. La valeur typique de la clairance orale du lisinopril (clairance systémique/biodisponibilité absolue) chez un enfant pesant 30 kg est de 10 L/h, qui augmente proportionnellement à la fonction rénale.
Etudes cliniques
Hypertension
Patients adultes
Deux études dose-réponse utilisant un régime une fois par jour ont été menées chez 438 patients hypertendus légers à modérés ne prenant pas de diurétique. La tension artérielle a été mesurée 24 heures après l'administration. Un effet antihypertenseur de PRINIVIL a été observé avec 5 mg chez certains patients. Cependant, dans les deux études, la réduction de la pression artérielle est survenue plus tôt et était plus importante chez les patients traités par 10, 20 ou 80 mg de PRINIVIL. Dans des études cliniques contrôlées chez des patients souffrant d'hypertension légère à modérée, PRINIVIL 20-80 mg a été comparé à l'hydrochlorothiazide 12,5-50 mg et à l'aténolol 50-500 mg, et chez les patients souffrant d'hypertension modérée à sévère au métoprolol 100-200 mg. Il était supérieur à l'hydrochlorothiazide en termes d'effets sur la tension artérielle systolique et diastolique dans une population à 75 % caucasienne. PRINIVIL 10 mg était approximativement équivalent à l'aténolol et au métoprolol en termes d'effets sur la tension artérielle diastolique et avait des effets un peu plus importants sur la tension artérielle systolique.
PRINIVIL a eu une efficacité et des effets indésirables similaires chez les patients plus jeunes et plus âgés (> 65 ans). Il était moins efficace chez les Noirs que chez les Caucasiens.
Dans les études hémodynamiques de PRINIVIL 5 mg chez des patients souffrant d'hypertension artérielle essentielle, la réduction de la pression artérielle s'est accompagnée d'une réduction de la résistance artérielle périphérique avec peu ou pas de modification du débit cardiaque et de la fréquence cardiaque. Dans une étude chez neuf patients hypertendus, suite à l'administration de PRINIVIL 5mg, il y a eu une augmentation du débit sanguin rénal moyen non significative. Les données de plusieurs petites études sont incohérentes en ce qui concerne l'effet du lisinopril sur le taux de filtration glomérulaire chez les patients hypertendus ayant une fonction rénale normale, mais suggèrent que les changements, s'il y en a, ne sont pas importants.
Chez les patients souffrant d'hypertension rénovasculaire, PRINIVIL s'est avéré bien toléré et efficace pour réduire la pression artérielle [voir AVERTISSEMENTS ET PRECAUTIONS ].
Patients pédiatriques
Dans une étude clinique portant sur 115 patients pédiatriques hypertendus âgés de 6 à 16 ans, les patients pesant 1,25 mg (0,02 mg/kg). Cet effet a été confirmé dans une phase de sevrage, où la pression diastolique a augmenté d'environ 9 mmHg de plus chez les patients randomisés au placebo que chez les patients randomisés pour rester sur les doses moyennes et élevées de lisinopril. L'effet antihypertenseur dose-dépendant du lisinopril était constant dans plusieurs sous-groupes démographiques : âge, stade de Tanner, sexe et race. Dans cette étude, le lisinopril a été généralement bien toléré.
Dans les études pédiatriques ci-dessus, le lisinopril a été administré soit sous forme de comprimés, soit en suspension chez les enfants et les nourrissons incapables d'avaler des comprimés ou nécessitant une dose plus faible que celle disponible sous forme de comprimés [voir DOSAGE ET ADMINISTRATION ].
Insuffisance cardiaque
Dans deux études cliniques contrôlées par placebo, d'une durée de 12 semaines, ont comparé l'ajout de PRINIVIL 2,5 mg jusqu'à 20 mg par jour à la digitaline et aux diurétiques seuls. L'association de PRINIVIL, digitaliques et diurétiques a réduit les signes et symptômes suivants d'insuffisance cardiaque : œdème, râles, dyspnée paroxystique nocturne et distension veineuse jugulaire. Dans l'une des études, l'association de PRINIVIL 2,5 mg, de digitaliques et de diurétiques a réduit l'orthopnée, la présence d'un troisième bruit cardiaque et le nombre de patients classés en classe NYHA III et IV, et a amélioré la tolérance à l'effort. Une grande étude de survie (plus de 3000 patients), l'essai ATLAS, comparant 2,5 et 35 mg de lisinopril chez des patients atteints d'insuffisance cardiaque systolique, a montré que la dose la plus élevée de lisinopril avait des résultats au moins aussi favorables que la dose la plus faible. Au cours des essais cliniques contrôlés à l'inclusion, chez des patients recevant des digitaliques et des diurétiques, des doses uniques de PRINIVIL 5 mg ont entraîné une diminution de la pression capillaire pulmonaire, de la résistance vasculaire systémique et de la pression artérielle, accompagnée d'une augmentation du débit cardiaque et d'une absence de modification de la fréquence cardiaque.
Infarctus aigu du myocarde
L'étude Gruppo Italiano per lo Studio della Sopravvienza nell'Infarto Miocardico (GISSI-3) était un essai clinique multicentrique, contrôlé, randomisé et sans insu mené auprès de 19 394 patients atteints d'un infarctus aigu du myocarde (IM) admis dans une unité de soins coronariens. Il a été conçu pour examiner les effets d'un traitement à court terme (6 semaines) avec du lisinopril, des nitrates, leur association ou l'absence de traitement sur la mortalité à court terme (6 semaines) et sur la mort à long terme et la fonction cardiaque nettement altérée. Les patients hémodynamiquement stables se présentant dans les 24 heures suivant l'apparition des symptômes ont été randomisés, selon un plan factoriel 2 x 2, pour recevoir pendant 6 semaines 1) PRINIVIL seul (n=4841), 2) des nitrates seuls (n=4869), 3 ) PRINIVIL 2,5 mg plus nitrates (n=4841), ou 4) contrôle ouvert (n=4843). Tous les patients ont reçu des traitements de routine, y compris des thrombolytiques (72 %), de l'aspirine (84 %) et un bêta-bloquant (31 %), selon le cas, normalement utilisés chez les patients atteints d'infarctus aigu du myocarde (IM).
Le protocole excluait les patients souffrant d'hypotension (pression artérielle systolique ≤ 100 mmHg), d'insuffisance cardiaque sévère, de choc cardiogénique et de dysfonctionnement rénal (créatinine sérique > 2 mg/dL et/ou protéinurie > 500 mg par 24 h). Les patients randomisés pour recevoir PRINIVIL 5 mg ont reçu 5 mg dans les 24 heures suivant l'apparition des symptômes, 5 mg après 24 heures, puis 10 mg par jour par la suite. Les patients dont la tension artérielle systolique était inférieure à 120 mmHg au départ ont reçu 2,5 mg de PRINIVIL. En cas d'hypotension, la dose de PRINIVIL 10 mg a été réduite ou en cas d'hypotension sévère, PRINIVIL a été arrêté [voir DOSAGE ET ADMINISTRATION ].
Les critères de jugement principaux de l'essai étaient la mortalité globale à 6 semaines et un critère d'évaluation combiné à 6 mois après l'infarctus du myocarde, consistant en le nombre de patients décédés, ayant eu une insuffisance cardiaque congestive tardive (jour 4) ou une insuffisance ventriculaire gauche étendue. dommages définis comme une fraction d'éjection ≤ 35 %, ou un score akinétique-dyskinétique [AD] ≥ 45 %. Les patients recevant PRINIVIL (n = 9 646), seul ou avec des nitrates, avaient un risque de décès de 11 % inférieur (p = 0,04) par rapport aux patients n'ayant pas reçu PRINIVIL (n = 9 672) (6,4 % contre 7,2 %, respectivement) à 6 semaines. Bien que les patients randomisés pour recevoir PRINIVIL pendant une période allant jusqu'à 6 semaines se soient également mieux comportés numériquement sur le critère d'évaluation combiné à 6 mois, la nature ouverte de l'évaluation de l'insuffisance cardiaque, la perte substantielle lors de l'échocardiographie de suivi et l'utilisation excessive substantielle de PRINIVIL 10 mg, entre 6 semaines et 6 mois dans le groupe randomisé à 6 semaines de lisinopril, excluent toute conclusion sur ce critère.
Les patients ayant un infarctus aigu du myocarde, traités par PRINIVIL 10 mg, présentaient une incidence plus élevée (9,0 % versus 3,7 %) d'hypotension persistante (pression artérielle systolique EFFETS INDÉSIRABLES ].
INFORMATIONS PATIENTS
REMARQUE : Ces informations sont destinées à faciliter l'utilisation sûre et efficace de ce médicament. Il ne s'agit pas d'une divulgation de tous les effets indésirables ou intentionnels possibles.
Grossesse
Informer les patientes en âge de procréer des conséquences d'une exposition à PRINIVIL 10 mg pendant la grossesse. Discutez des options de traitement avec les femmes qui envisagent de devenir enceintes. Dites aux patients de signaler les grossesses à leur médecin dès que possible.
Angiœdème
L'œdème de Quincke, y compris l'œdème laryngé, peut survenir à tout moment pendant le traitement par les inhibiteurs de l'enzyme de conversion de l'angiotensine, y compris PRINIVIL. Dites aux patients de signaler immédiatement tout signe ou symptôme évoquant un œdème de Quincke (gonflement du visage, des extrémités, des yeux, des lèvres, de la langue, difficulté à avaler ou à respirer) et de ne plus prendre de médicament avant d'avoir consulté le médecin prescripteur.
Hypotension symptomatique
Dites aux patients de signaler les étourdissements, en particulier pendant les premiers jours de traitement. Si une véritable syncope survient, dites au patient d'arrêter le médicament jusqu'à ce qu'il ait consulté le médecin prescripteur.
Dites aux patients que la transpiration excessive et la déshydratation peuvent entraîner une chute excessive de la pression artérielle en raison de la réduction du volume de liquide. D'autres causes de déplétion volémique telles que les vomissements ou la diarrhée peuvent également entraîner une chute de la pression artérielle ; conseiller les patients en conséquence.
Hyperkaliémie
Dites aux patients de ne pas utiliser de substituts de sel contenant du potassium sans consulter leur médecin.
Hypoglycémie
Dites aux patients diabétiques traités avec des antidiabétiques oraux ou de l'insuline commençant un inhibiteur de l'ECA de surveiller étroitement l'hypoglycémie, en particulier pendant le premier mois d'utilisation combinée [voir INTERACTIONS MÉDICAMENTEUSES ].
Leucopénie/neutropénie
Dites aux patients de signaler rapidement tout signe d'infection (p. ex., mal de gorge, fièvre), qui peut être un signe de leucopénie/neutropénie.
