Myambutol 200mg, 400mg, 600mg, 800mg Ethambutol Hydrochloride Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Myambutol et comment est-il utilisé ?
Myambutol est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de la tuberculose. Myambutol 400 mg peut être utilisé seul ou avec d'autres médicaments.
Le myambutol appartient à une classe de médicaments appelés agents antituberculeux.
On ne sait pas si Myambutol 800 mg est sûr et efficace chez les enfants de moins de 13 ans.
Quels sont les effets secondaires possibles de Myambutol 800mg ?
Myambutol peut provoquer des effets secondaires graves, notamment :
- urticaire,
- difficulté à respirer,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- problèmes de vue,
- perte de vision qui peut être permanente,
- Vision floue,
- difficulté à se concentrer,
- perte de vision dans un œil qui dure une heure ou plus,
- sensibilité accrue de vos yeux à la lumière,
- perte de vision des couleurs,
- douleur au mouvement des yeux,
- douleur derrière les yeux,
- toux nouvelle ou aggravée avec fièvre,
- engourdissement ou picotements dans les mains ou les pieds,
- confusion,
- hallucinations,
- fièvre,
- glandes enflées,
- plaies buccales douloureuses,
- plaies cutanées,
- symptômes de rhume ou de grippe,
- malaise général,
- ecchymoses ou saignements faciles,
- saignements de nez,
- saignement des gencives,
- peu ou pas d'urine,
- douleur dans le haut du ventre,
- urine foncée,
- selles de couleur argile,
- jaunissement de la peau ou des yeux (jaunisse),
- mal de gorge,
- brûlant dans tes yeux,
- douleurs cutanées,
- éruption cutanée rouge ou violette qui s'étend (en particulier au visage ou au haut du corps) et provoque des cloques et une desquamation,
- douleurs thoraciques et
- essoufflement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Myambutol comprennent :
- démangeaison,
- éruption,
- douleur articulaire,
- mal de tête,
- vertiges,
- nausée,
- vomissement,
- Douleur d'estomac,
- indigestion, et
- perte d'appétit
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Myambutol. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
MYAMBUTOL (chlorhydrate d'éthambutol) est un agent chimiothérapeutique oral qui est spécifiquement efficace contre les micro-organismes en croissance active du genre Mycobacterium, y compris M. tuberculosis. La formule structurale est :
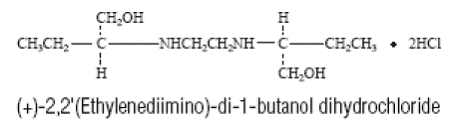
Les comprimés MYAMBUTOL (chlorhydrate d'éthambutol) à 100 et 400 mg contiennent les ingrédients inactifs suivants : gélatine, hydroxypropylméthylcellulose, stéarate de magnésium, laurylsulfate de sodium, sorbitol, acide stéarique, saccharose, dioxyde de titane et autres ingrédients.
LES INDICATIONS
MYAMBUTOL est indiqué dans le traitement de la tuberculose pulmonaire. Il ne doit pas être utilisé comme seul médicament antituberculeux, mais doit être utilisé en association avec au moins un autre médicament antituberculeux. La sélection du médicament compagnon doit être basée sur l'expérience clinique, des considérations d'innocuité comparative et des études de sensibilité in vitro appropriées. Chez les patients qui n'ont pas reçu de traitement antituberculeux antérieur, c'est-à-dire un traitement initial, les schémas thérapeutiques les plus fréquemment utilisés ont été les suivants :
MYAMBUTOL plus isoniazide
MYAMBUTOL 800mg plus isoniazide plus streptomycine.
Chez les patients ayant déjà reçu un traitement antituberculeux, la résistance des mycobactéries aux autres médicaments utilisés en traitement initial est fréquente. Par conséquent, chez ces patients en retraitement, MYAMBUTOL doit être associé à au moins un des médicaments de deuxième intention non administrés auparavant au patient et pour lesquels une sensibilité bactérienne a été indiquée par des études in vitro appropriées. Les médicaments antituberculeux utilisés avec MYAMBUTOL comprennent la cyclosérine, l'éthionamide, le pyrazinamide, la viomycine et d'autres médicaments. L'isoniazide, l'acide aminosalicylique et la streptomycine ont également été utilisés dans plusieurs schémas thérapeutiques. Des schémas thérapeutiques alternatifs ont également été utilisés.
DOSAGE ET ADMINISTRATION
MYAMBUTOL 200mg ne doit pas être utilisé seul, en traitement initial ou en retraitement. MYAMBUTOL 400 mg doit être administré une fois toutes les 24 heures uniquement. L'absorption n'est pas significativement modifiée par l'administration avec de la nourriture. Le traitement, en général, doit être poursuivi jusqu'à ce que la conversion bactériologique soit devenue permanente et qu'une amélioration clinique maximale se soit produite.
MYAMBUTOL n'est pas recommandé pour une utilisation chez les patients pédiatriques de moins de treize ans car les conditions d'utilisation sûres n'ont pas été établies.
Traitement initial : Chez les patients qui n'ont pas reçu de traitement antituberculeux antérieur, administrer MYAMBUTOL 15 mg/kg (7 mg/lb) de poids corporel, en une dose orale unique une fois toutes les 24 heures. Dans les études les plus récentes, l'isoniazide a été administré simultanément en une seule dose orale quotidienne.
Retraitement : Chez les patients ayant déjà reçu un traitement antituberculeux, administrer MYAMBUTOL 25 mg/kg (11 mg/lb) de poids corporel, en une dose orale unique une fois toutes les 24 heures. Administrer simultanément au moins un autre médicament antituberculeux auquel il a été démontré que les organismes sont sensibles par des tests in vitro appropriés. Les médicaments appropriés consistent habituellement en ceux qui n'ont pas été utilisés auparavant dans le traitement du patient. Après 60 jours d'administration de MYAMBUTOL 600 mg, diminuer la dose à 15 mg/kg (7 mg/lb) de poids corporel et administrer en une dose orale unique une fois toutes les 24 heures.
Pendant la période où un patient reçoit une dose quotidienne de 25 mg/kg, des examens oculaires mensuels sont conseillés.
Voir le tableau pour une sélection facile du ou des comprimés appropriés en fonction du poids.
Tableau poids-dose
COMMENT FOURNIE
Comprimés de chlorhydrate d'éthambutol USP
100mg – les comprimés pelliculés ronds, convexes, blancs, gravés E6 sur une face se présentent comme suit :
CDN 54879-001-01 - Flacon de 100 CDN 54879-001-00 - 10 Blisters x 10 comprimés
400mg – les comprimés pelliculés ronds, convexes, blancs, sécables et gravés du E à gauche et du 7 à droite du score sur une face sont fournis comme suit :
CDN 54879-002-01 - Bouteille de 100 CDN 54879-002-00 - 10 Blisters x 10 comprimés
Conserver à température ambiante contrôlée de 20 ° à 25 °C (68 ° à 77 °F).
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088
Fabriqué et distribué par : STI Pharma, LLC Langhorne, PA 19047. Révisé en mars 2013
EFFETS SECONDAIRES
MYAMBUTOL peut entraîner une diminution de l'acuité visuelle, y compris une cécité irréversible, qui semble être due à une névrite optique. La neuropathie optique, y compris la névrite optique ou la névrite rétrobulbaire, survenant en association avec un traitement à l'éthambutol peut être caractérisée par un ou plusieurs des événements suivants : diminution de l'acuité visuelle, scotome, daltonisme et/ou défaut visuel. Ces événements ont également été rapportés en l'absence de diagnostic de névrite optique ou rétrobulbaire.
Les patients doivent être avisés de signaler rapidement à leur médecin tout changement d'acuité visuelle.
Le changement d'acuité visuelle peut être unilatéral ou bilatéral et, par conséquent, chaque œil doit être testé séparément et les deux yeux testés ensemble. Des tests d'acuité visuelle doivent être effectués avant de commencer le traitement par MYAMBUTOL et périodiquement pendant l'administration du médicament, sauf qu'ils doivent être effectués une fois par mois lorsqu'un patient reçoit une dose de plus de 15 mg par kilogramme par jour. Les diagrammes oculaires de Snellen sont recommandés pour tester l'acuité visuelle. Des études ont montré qu'il existe des fluctuations nettes d'une ou deux lignes du diagramme de Snellen dans l'acuité visuelle de nombreux patients tuberculeux ne recevant pas MYAMBUTOL.

Le tableau suivant peut être utile pour interpréter les modifications possibles de l'acuité visuelle attribuables à MYAMBUTOL.
En général, les changements d'acuité visuelle inférieurs à ceux indiqués sous « Nombre significatif de lignes » et « Diminution du nombre de points » peuvent être dus à une variation fortuite, aux limites de la méthode de test ou à une variabilité physiologique. À l'inverse, des modifications de l'acuité visuelle égales ou supérieures à celles indiquées sous « Nombre significatif de lignes » et « Diminution du nombre de points » indiquent la nécessité d'un nouveau test et d'une évaluation minutieuse de l'état visuel du patient. Si une évaluation minutieuse confirme l'ampleur du changement visuel et ne parvient pas à révéler une autre cause, MYAMBUTOL 400 mg doit être arrêté et le patient réévalué à intervalles fréquents. Les diminutions progressives de l'acuité visuelle pendant le traitement doivent être considérées comme étant dues à MYAMBUTOL.
Si des lunettes correctrices sont utilisées avant le traitement, elles doivent être portées lors des tests d'acuité visuelle. Pendant 1 à 2 ans de traitement, une erreur de réfraction peut se développer et doit être corrigée afin d'obtenir des résultats de test précis. Tester l'acuité visuelle à travers un trou d'épingle élimine l'erreur de réfraction. Les patients développant une anomalie visuelle pendant le traitement par MYAMBUTOL 800 mg peuvent présenter des symptômes visuels subjectifs avant ou simultanément à la démonstration d'une diminution de l'acuité visuelle, et tous les patients recevant MYAMBUTOL doivent être interrogés périodiquement sur une vision floue et d'autres symptômes oculaires subjectifs.
La récupération de l'acuité visuelle se produit généralement sur une période de plusieurs semaines à plusieurs mois après l'arrêt du médicament. Certains patients ont de nouveau reçu MYAMBUTOL (chlorhydrate d'éthambutol) après une telle récupération sans récidive de perte d'acuité visuelle.
D'autres effets indésirables rapportés incluent : hypersensibilité, réaction anaphylactique/anaphylactoïde, dermatite, érythème polymorphe, prurit et douleurs articulaires ; anorexie, nausées, vomissements, troubles gastro-intestinaux et douleurs abdominales ; fièvre, malaise, maux de tête et étourdissements ; confusion mentale, désorientation et hallucinations possibles ; thrombocytopénie, leucopénie et neutropénie. Des engourdissements et des picotements des extrémités dus à une névrite périphérique ont été rapportés.
Des taux élevés d'acide urique sérique se produisent et une précipitation de goutte aiguë a été rapportée. Des infiltrats pulmonaires, avec ou sans éosinophilie, ont également été signalés au cours du traitement par MYAMBUTOL. Des toxicités hépatiques, y compris des décès, ont été signalées (voir AVERTISSEMENTS .) Étant donné que MYAMBUTOL 400 mg est recommandé pour un traitement en association avec un ou plusieurs autres médicaments antituberculeux, ces modifications peuvent être liées au traitement concomitant. Syndrome d'hypersensibilité consistant en une réaction cutanée (telle qu'une éruption cutanée ou une dermatite exfoliative), une éosinophilie et un ou plusieurs des éléments suivants : hépatite, pneumonite, néphrite, myocardite, péricardite. De la fièvre et des adénopathies peuvent être présentes.
INTERACTIONS MÉDICAMENTEUSES
Les résultats d'une étude de co-administration de MYAMBUTOL (50 mg/kg) avec un antiacide contenant de l'hydroxyde d'aluminium chez 13 patients tuberculeux ont montré une réduction des concentrations sériques moyennes et de l'excrétion urinaire d'éthambutol d'environ 20 % et 13 %, respectivement, suggérant que la l'absorption orale de l'éthambutol peut être réduite par ces produits antiacides. Il est recommandé d'éviter l'administration concomitante d'éthambutol avec de l'hydroxyde d'aluminium contenant des antiacides pendant au moins 4 heures après l'administration d'éthambutol.
AVERTISSEMENTS
MYAMBUTOL 600 mg peut produire des diminutions de l'acuité visuelle qui semblent être dues à une névrite optique. Cet effet peut être lié à la dose et à la durée du traitement. Cet effet est généralement réversible lorsque l'administration du médicament est interrompue rapidement. Cependant, une cécité irréversible a été rapportée. (Voir PRÉCAUTIONS et EFFETS INDÉSIRABLES ).
Des toxicités hépatiques, y compris mortelles, ont été signalées (voir EFFETS INDÉSIRABLES ). Une évaluation initiale et périodique de la fonction hépatique doit être effectuée.
PRÉCAUTIONS
L'utilisation de MYAMBUTOL 800 mg de chlorhydrate d'éthambutol n'est pas recommandée chez les patients pédiatriques de moins de treize ans, car les conditions d'utilisation sûres n'ont pas été établies.
Les patients dont la fonction rénale est diminuée doivent réduire la posologie en fonction des taux sériques de MYAMBUTOL, car la principale voie d'excrétion de ce médicament se fait par les reins.
Étant donné que ce médicament peut avoir des effets indésirables sur la vision, l'examen physique doit inclure une ophtalmoscopie, une périmétrie des doigts et des tests de discrimination des couleurs. Chez les patients présentant des défauts visuels tels que des cataractes, des affections inflammatoires récurrentes de l'œil, une névrite optique et une rétinopathie diabétique, l'évaluation des modifications de l'acuité visuelle est plus difficile et il convient de s'assurer que les variations de la vision ne sont pas dues à les conditions pathologiques sous-jacentes. Chez ces patients, il convient de tenir compte de la relation entre les bénéfices attendus et une éventuelle détérioration visuelle, car l'évaluation des changements visuels est difficile. (Pour les procédures recommandées, voir les prochains paragraphes sous EFFETS INDÉSIRABLES ).
Comme pour tout médicament puissant, une évaluation initiale et périodique des fonctions des systèmes organiques, y compris rénales, hépatiques et hématopoïétiques, doit être effectuée.
Grossesse
Effets tératogènes
Catégorie de grossesse C.
Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Des anomalies ophtalmiques ont été signalées chez des nourrissons nés de femmes sous traitement antituberculeux incluant MYAMBUTOL. MYAMBUTOL ne doit être utilisé pendant la grossesse que si le bénéfice justifie le risque potentiel pour le fœtus.
MYAMBUTOL 200 mg s'est avéré tératogène chez les souris et les lapins gestants lorsqu'il est administré à fortes doses. Lorsque des souris ou des lapines gestantes ont été traitées avec de fortes doses de chlorhydrate d'éthambutol, la mortalité fœtale a augmenté légèrement mais pas significativement (P> 0,05). Les rats femelles traités avec le chlorhydrate d'éthambutol ont présenté des diminutions légères mais non significatives (P > 0,05) de la fertilité et de la taille de la portée.
Chez les fœtus nés de souris traitées par de fortes doses de MYAMBUTOL 400 mg pendant la grossesse, une faible incidence de fente palatine, d'exencéphalie et d'anomalie de la colonne vertébrale a été observée. Des anomalies mineures de la vertèbre cervicale ont été observées chez le nouveau-né de rats traités avec de fortes doses de chlorhydrate d'éthambutol pendant la grossesse. Des lapines recevant de fortes doses de MYAMBUTOL pendant la grossesse ont donné naissance à deux fœtus atteints de monophtalmie, l'un avec un avant-bras droit raccourci accompagné d'une contracture bilatérale de l'articulation du poignet et l'autre avec un bec de lièvre et une fente palatine.
Mères allaitantes
MYAMBUTOL est excrété dans le lait maternel. L'utilisation de MYAMBUTOL ne doit être envisagée que si le bénéfice attendu pour la mère l'emporte sur le risque potentiel pour le nourrisson.
Utilisation pédiatrique
MYAMBUTOL (chlorhydrate d'éthambutol) n'est pas recommandé chez les patients pédiatriques de moins de treize ans, car les conditions d'utilisation sécuritaires n'ont pas été établies.
Utilisation gériatrique
Il existe des données limitées sur l'utilisation de l'éthambutol chez les personnes âgées. Une étude de 101 patients, âgés de 65 ans et plus, sous régimes antituberculeux à plusieurs médicaments comprenait 94 patients sous éthambutol. Aucune différence de sécurité ou de tolérabilité n'a été observée chez ces patients par rapport à celle rapportée chez les adultes en général. D'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue.
SURDOSAGE
Aucune information fournie
CONTRE-INDICATIONS
MYAMBUTOL est contre-indiqué chez les patients connus pour être hypersensibles à ce médicament. Il est également contre-indiqué chez les patients atteints de névrite optique connue à moins que le jugement clinique détermine qu'il peut être utilisé. MYAMBUTOL est contre-indiqué chez les patients incapables d'apprécier et de signaler les effets secondaires visuels ou les modifications de la vision (par exemple, les jeunes enfants, les patients inconscients).
PHARMACOLOGIE CLINIQUE
MYAMBUTOL 600 mg, après une dose orale unique de 25 mg/kg de poids corporel, atteint un pic de 2 à 5 mg/mL dans le sérum 2 à 4 heures après l'administration. Lorsque le médicament est administré quotidiennement pendant de plus longues périodes à cette dose, les taux sériques sont similaires. Le taux sérique de MYAMBUTOL tombe à des niveaux indétectables 24 heures après la dernière dose, sauf chez certains patients présentant une fonction rénale anormale. Les concentrations intracellulaires d'érythrocytes atteignent des valeurs maximales environ deux fois celles du plasma et maintiennent ce rapport tout au long des 24 heures.
Au cours de la période de 24 heures suivant l'administration orale de MYAMBUTOL, environ 50 % de la dose initiale sont excrétés sous forme inchangée dans l'urine, tandis que 8 à 15 % supplémentaires apparaissent sous forme de métabolites. La voie principale du métabolisme semble être une oxydation initiale de l'alcool en un intermédiaire aldéhydique, suivie d'une conversion en un acide dicarboxylique. De 20 à 22 % de la dose initiale sont excrétés dans les selles sous forme inchangée. Aucune accumulation de médicament n'a été observée avec des doses quotidiennes uniques consécutives de 25 mg/kg chez des patients ayant une fonction rénale normale, bien qu'une accumulation marquée ait été démontrée chez des patients insuffisants rénaux.
MYAMBUTOL se diffuse dans les cellules mycobactériennes en croissance active telles que les bacilles tuberculeux. MYAMBUTOL 800 mg semble inhiber la synthèse d'un ou plusieurs métabolites, entraînant ainsi une altération du métabolisme cellulaire, un arrêt de la multiplication et la mort cellulaire. Aucune résistance croisée avec d'autres agents antimycobactériens disponibles n'a été démontrée.
MYAMBUTOL 200 mg s'est avéré efficace contre les souches de Mycobacterium tuberculosis mais ne semble pas être actif contre les champignons, virus ou autres bactéries. Les souches de Mycobacterium tuberculosis précédemment non exposées à MYAMBUTOL ont été uniformément sensibles à des concentrations de 8 mcg/mL ou moins, selon la nature du milieu de culture. Lorsque MYAMBUTOL a été utilisé seul pour le traitement de la tuberculose, les bacilles tuberculeux de ces patients ont développé une résistance à MYAMBUTOL (chlorhydrate d'éthambutol) par des tests de sensibilité in vitro ; le développement de la résistance a été imprévisible et semble se produire par étapes. Aucune résistance croisée entre MYAMBUTOL et d'autres antituberculeux n'a été rapportée. MYAMBUTOL a réduit l'incidence de l'apparition d'une résistance mycobactérienne à l'isoniazide lorsque les deux médicaments ont été utilisés simultanément.
Un test microbiologique de diffusion sur gélose, basé sur l'inhibition de Mycobacterium smegmatis (ATCC 607), peut être utilisé pour déterminer les concentrations de MYAMBUTOL dans le sérum et l'urine.
Pharmacologie animale
Des études toxicologiques chez le chien à des doses élevées et prolongées ont mis en évidence des lésions et une défaillance du myocarde, ainsi qu'une dépigmentation du tapetum lucidum des yeux, dont la signification n'est pas connue. Des modifications dégénératives du système nerveux central, apparemment non liées à la dose, ont également été notées chez des chiens recevant du chlorhydrate d'éthambutol sur une période prolongée.
Chez le singe rhésus, des signes neurologiques sont apparus après un traitement à fortes doses administrées quotidiennement pendant plusieurs mois. Ceux-ci ont été corrélés avec des taux sériques spécifiques d'éthambutol et avec des modifications neuroanatomiques précises du système nerveux central. Une cardite interstitielle focale a également été notée chez des singes ayant reçu du chlorhydrate d'éthambutol à fortes doses pendant une période prolongée.
INFORMATIONS PATIENTS
Aucune information fournie. Veuillez vous référer au AVERTISSEMENTS et PRÉCAUTIONS sections.
