Flagyl 200mg, 400mg Metronidazole Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Flagyl et comment est-il utilisé ?
Flagyl est un médicament délivré sur ordonnance utilisé pour traiter les symptômes des infections bactériennes du vagin, de l'estomac, du foie, de la peau, des articulations, du cerveau et des voies respiratoires. Flagyl peut être utilisé seul ou avec d'autres médicaments.
Flagyl est un nitroimidazoles, inhibiteur du CYP3A4, modéré.
Quels sont les effets secondaires possibles de Flagyl 200mg ?
Flagyl 400 mg peut provoquer des effets secondaires graves, notamment :
- diarrhée,
- douleur ou difficulté à uriner,
- troubles du sommeil,
- la dépression,
- irritabilité,
- mal de tête,
- vertiges
- la faiblesse,
- étourdissement,
- ampoules ou ulcères dans la bouche,
- gencives rouges ou enflées, et
- difficulté à avaler
Informez votre médecin si vous ressentez des effets secondaires graves de Flagyl, notamment :
- engourdissement,
- picotements,
- douleur brûlante dans les mains ou les pieds,
- problèmes de vue,
- douleur derrière les yeux,
- voir des éclairs ou de la lumière,
- faiblesse musculaire,
- difficulté de coordination,
- difficulté à parler ou à comprendre ce qu'on vous dit,
- saisie,
- fièvre,
- raideur de la nuque et
- sensibilité accrue à la lumière
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Ce ne sont pas tous les effets secondaires possibles de Flagyl. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Afin de réduire le développement de bactéries résistantes aux médicaments et de maintenir l'efficacité de FLAGYL® et d'autres médicaments antibactériens, FLAGYL® ne doit être utilisé que pour traiter ou prévenir des infections avérées ou fortement suspectées d'être causées par des bactéries.
ATTENTION
Le métronidazole s'est avéré cancérigène chez la souris et le rat (voir PRÉCAUTIONS ). L'utilisation inutile du médicament doit être évitée. Son utilisation doit être réservée aux conditions décrites dans le INDICATIONS ET USAGE section ci-dessous.
LA DESCRIPTION
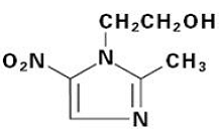
Les comprimés FLAGYL (métronidazole), 250 mg ou 500 mg, sont une formulation orale de l'antimicrobien synthétique nitroimidazole, le 2-méthyl-5-nitro-1H-imidazole-1-éthanol, qui a la formule structurelle suivante :
Les comprimés FLAGYL (métronidazole) contiennent 250 mg ou 500 mg de métronidazole. Les ingrédients inactifs comprennent la cellulose, la laque FD&C Blue No. 2, l'hydroxypropylcellulose, l'hypromellose, le polyéthylèneglycol, l'acide stéarique et le dioxyde de titane.
LES INDICATIONS
Trichomonase symptomatique. FLAGYL est indiqué pour le traitement de l'infection à T. vaginalis chez les femmes et les hommes lorsque la présence du trichomonas a été confirmée par des procédures de laboratoire appropriées (frottis humides et/ou cultures).
Trichomonase asymptomatique. FLAGYL 400 mg est indiqué dans le traitement de l'infection asymptomatique à T. vaginalis chez la femme lorsque l'organisme est associé à une endocervicite, une cervicite ou une érosion cervicale. Puisqu'il est prouvé que la présence du trichomonas peut interférer avec l'évaluation précise des frottis cytologiques anormaux, des frottis supplémentaires doivent être effectués après l'éradication du parasite.
Traitement des partenaires sexuels asymptomatiques. L'infection à T. vaginalis est une maladie vénérienne. Par conséquent, les partenaires sexuels asymptomatiques des patients traités doivent être traités simultanément si l'organisme a été trouvé, afin d'éviter une réinfection du partenaire. La décision de traiter un partenaire masculin asymptomatique qui a une culture négative ou pour qui aucune culture n'a été tentée est individuelle. En prenant cette décision, il convient de noter qu'il existe des preuves qu'une femme peut être réinfectée si son partenaire sexuel n'est pas traité. De plus, étant donné qu'il peut être très difficile d'isoler l'organisme du porteur masculin asymptomatique, les frottis et les cultures négatifs ne peuvent être invoqués à cet égard. Dans tous les cas, le partenaire sexuel doit être traité par FLAGYL en cas de réinfection.
Amibiase. FLAGYL est indiqué dans le traitement de l'amibiase intestinale aiguë (dysenterie amibienne) et de l'abcès amibien du foie.
Dans l'abcès amibien du foie, le traitement par FLAGYL n'évite pas la nécessité d'une aspiration ou d'un drainage du pus.
Infections bactériennes anaérobies. FLAGYL 200 mg est indiqué dans le traitement des infections graves dues à des bactéries anaérobies sensibles. Les interventions chirurgicales indiquées doivent être réalisées en association avec le traitement par FLAGYL. Dans une infection mixte aérobie et anaérobie, des antimicrobiens appropriés pour le traitement de l'infection aérobie doivent être utilisés en plus de FLAGYL.
INFECTIONS INTRA-ABDOMINALES, y compris péritonite, abcès intra-abdominal et abcès du foie, causées par des espèces de Bacteroides, y compris le groupe B. fragilis (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B. vulgatus), Clostridium espèces, les espèces Eubacterium, les espèces Peptococcus et les espèces Peptostreptococcus.
INFECTIONS DE LA PEAU ET DES STRUCTURES DE LA PEAU causées par les espèces de Bacteroides, y compris le groupe B. fragilis, les espèces de Clostridium, les espèces de Peptococcus, les espèces de Peptostreptococcus et les espèces de Fusobacterium.
INFECTIONS GYNÉCOLOGIQUES, y compris l'endométrite, l'endomyométrite, l'abcès tubo-ovarien et l'infection de la coiffe vaginale post-chirurgicale, causées par les espèces de Bacteroides, y compris le groupe B. fragilis, les espèces de Clostridium, les espèces de Peptococcus, les espèces de Peptostreptococcus et les espèces de Fusobacterium.
SEPTICÉMIE BACTÉRIENNE causée par les espèces Bacteroides, y compris le groupe B. fragilis et les espèces Clostridium.
INFECTIONS DES OS ET DES ARTICULATIONS (en tant que traitement d'appoint), causées par des espèces de Bacteroides, y compris le groupe B. fragilis.
INFECTIONS DU SYSTÈME NERVEUX CENTRAL (SNC), y compris la méningite et l'abcès cérébral, causées par des espèces de Bacteroides, y compris le groupe B. fragilis.
INFECTIONS DES VOIES RESPIRATOIRES INFÉRIEURES, y compris la pneumonie, l'empyème et l'abcès pulmonaire, causées par des espèces de Bacteroides, y compris le groupe B. fragilis.
ENDOCARDITE causée par des espèces de Bacteroides, y compris le groupe B. fragilis.
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l'efficacité de FLAGYL 400 mg et d'autres médicaments antibactériens, FLAGYL doit être utilisé uniquement pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu'elles sont causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte lors de la sélection ou de la modification du traitement antibactérien. En l'absence de telles données, l'épidémiologie locale et les schémas de sensibilité peuvent contribuer à la sélection empirique du traitement.
DOSAGE ET ADMINISTRATION
Trichomonase
Dans la femelle
Traitement d'un jour - deux grammes de FLAGYL, administrés soit en une dose unique, soit en deux doses fractionnées d'un gramme chacune, administrées le même jour.
Traitement de sept jours - 250 mg trois fois par jour pendant sept jours consécutifs. Des études comparatives contrôlées indiquent que les taux de guérison, déterminés par les frottis vaginaux et les signes et symptômes, peuvent être plus élevés après un traitement de sept jours qu'après un traitement d'un jour.
Le schéma posologique doit être individualisé. Un traitement à dose unique peut assurer l'observance, en particulier s'il est administré sous surveillance, chez les patients sur lesquels on ne peut pas compter pour continuer le régime de sept jours. Un traitement de sept jours peut minimiser la réinfection en protégeant le patient suffisamment longtemps pour que les contacts sexuels obtiennent un traitement approprié. De plus, certains patients peuvent mieux tolérer un régime de traitement qu'un autre.
Les patientes enceintes ne doivent pas être traitées pendant le premier trimestre (voir CONTRE-INDICATIONS ). Chez les patientes enceintes pour lesquelles un traitement alternatif a été inadéquat, le traitement d'un jour ne doit pas être utilisé, car il entraîne des taux sériques plus élevés qui peuvent atteindre la circulation fœtale (voir PRÉCAUTIONS , Grossesse ).
Lorsque des cures répétées du médicament sont nécessaires, il est recommandé qu'un intervalle de quatre à six semaines s'écoule entre les cures et que la présence du trichomonas soit reconfirmée par des mesures de laboratoire appropriées. Des numérations leucocytaires totales et différentielles doivent être effectuées avant et après le retraitement.
Chez l'homme : Le traitement doit être individualisé comme il l'est pour la femme.
Amibiase
Adultes
Pour l'amibiase intestinale aiguë (dysenterie amibienne aiguë) : 750 mg par voie orale trois fois par jour pendant 5 à 10 jours.
Pour l'abcès amibien du foie : 500 mg ou 750 mg par voie orale trois fois par jour pendant 5 à 10 jours.
Patients pédiatriques : 35 à 50 mg/kg/24 heures, répartis en trois prises, par voie orale pendant 10 jours.
Infections bactériennes anaérobies
Dans le traitement des infections anaérobies les plus graves, le métronidazole par voie intraveineuse est généralement administré initialement.
La posologie orale habituelle chez l'adulte est de 7,5 mg/kg toutes les six heures (environ 500 mg pour un adulte de 70 kg). Un maximum de 4 g ne doit pas être dépassé pendant une période de 24 heures.
La durée habituelle du traitement est de 7 à 10 jours ; cependant, les infections des os et des articulations, des voies respiratoires inférieures et de l'endocarde peuvent nécessiter un traitement plus long.
Ajustements posologiques
Patients atteints d'insuffisance hépatique sévère
Chez les patients présentant une insuffisance hépatique sévère (Child-Pugh C), la dose de FLAGYL doit être réduite de 50 % (voir PHARMACOLOGIE CLINIQUE et PRÉCAUTIONS ).
Patients sous hémodialyse
L'hémodialyse élimine des quantités importantes de métronidazole et de ses métabolites de la circulation systémique. La clairance du métronidazole dépendra du type de membrane de dialyse utilisée, de la durée de la séance de dialyse et d'autres facteurs. Si l'administration de métronidazole ne peut être séparée de la séance d'hémodialyse, une supplémentation de la dose de métronidazole après la séance d'hémodialyse doit être envisagée, en fonction de la situation clinique du patient (voir PHARMACOLOGIE CLINIQUE ).
COMMENT FOURNIE
FLAGYL 250 mg les comprimés sont ronds, bleus, pelliculés, avec SEARLE et 1831 en creux sur une face et FLAGYL et 250 sur l'autre face ; livrés en flacons de 50 et 100.
FLAGYL 500 mg les comprimés sont oblongs, bleus, pelliculés, portant l'inscription FLAGYL gravée sur une face et 500 sur l'autre face ; bouteilles de 50 et 100.
Stockage et stabilité
Conserver en dessous de 25°C (77°F) et protéger de la lumière.
Distribué par : Pfizer Labs, Division of Pfizre Inc., NY, NY 10017. Révisé : décembre 2021
EFFETS SECONDAIRES
Les réactions suivantes ont été rapportées au cours du traitement par le métronidazole :
Système nerveux central
Les effets indésirables les plus graves rapportés chez les patients traités par le métronidazole ont été des convulsions, une encéphalopathie, une méningite aseptique, une neuropathie optique et périphérique, cette dernière étant principalement caractérisée par un engourdissement ou une paresthésie d'un membre. Étant donné qu'une neuropathie périphérique persistante a été signalée chez certains patients recevant une administration prolongée de métronidazole, les patients doivent être spécifiquement avertis de ces réactions et doivent être informés d'arrêter le médicament et de signaler immédiatement à leur médecin tout symptôme neurologique. De plus, des patients ont signalé des maux de tête, des syncopes, des étourdissements, des vertiges, de l'incoordination, de l'ataxie, de la confusion, de la dysarthrie, de l'irritabilité, de la dépression, de la faiblesse et de l'insomnie (voir AVERTISSEMENTS ).
Gastro-intestinal
Les effets indésirables les plus fréquemment rapportés concernaient le tractus gastro-intestinal, en particulier les nausées, parfois accompagnées de maux de tête, d'anorexie et parfois de vomissements ; diarrhée; détresse épigastrique; et crampes abdominales et constipation.
Bouche
Un goût métallique vif et désagréable n'est pas inhabituel. Une langue poilue, une glossite et une stomatite se sont produites; ceux-ci peuvent être associés à une prolifération soudaine de Candida qui peut survenir pendant le traitement.
Dermatologique
Éruption érythémateuse et prurit.
Hématopoïétique
Neutropénie réversible (leucopénie); rarement, thrombocytopénie réversible.
Cardiovasculaire
Un allongement de l'intervalle QT a été signalé, en particulier lorsque le métronidazole était administré avec des médicaments susceptibles d'allonger l'intervalle QT. Un aplatissement de l'onde T peut être observé sur les tracés électrocardiographiques.
Hypersensibilité
Urticaire, éruption érythémateuse, syndrome de Stevens-Johnson, nécrolyse épidermique toxique, bouffées vasomotrices, congestion nasale, sécheresse de la bouche (ou du vagin ou de la vulve) et fièvre.
Rénal
Dysurie, cystite, polyurie, incontinence et sensation de pression pelvienne. Des cas d'urine foncée ont été rapportés par environ un patient sur 100 000. Bien que le pigment qui est probablement responsable de ce phénomène n'ait pas été formellement identifié, il s'agit presque certainement d'un métabolite du métronidazole et ne semble pas avoir de signification clinique.
Hépatique
Des cas d'hépatotoxicité sévère irréversible/d'insuffisance hépatique aiguë, y compris des cas d'issue fatale avec une apparition très rapide après le début de l'utilisation systémique du métronidazole, ont été rapportés chez des patients atteints du syndrome de Cockayne (latence entre le début du traitement et les signes d'insuffisance hépatique aussi courte que 2 jours ) (voir CONTRE-INDICATIONS ).
Autre
Prolifération de Candida dans le vagin, dyspareunie, diminution de la libido, rectite et douleurs articulaires passagères ressemblant parfois à la « maladie sérique ». De rares cas de pancréatite, qui ont généralement diminué à l'arrêt du médicament, ont été rapportés.
Les patients atteints de la maladie de Crohn sont connus pour avoir une incidence accrue de cancers gastro-intestinaux et de certains cancers extra-intestinaux. Il y a eu des rapports dans la littérature médicale sur le cancer du sein et du côlon chez les patients atteints de la maladie de Crohn qui ont été traités avec du métronidazole à fortes doses pendant de longues périodes. Une relation de cause à effet n'a pas été établie. La maladie de Crohn n'est pas une indication approuvée pour FLAGYL 200mg comprimés.
INTERACTIONS MÉDICAMENTEUSES
Disulfirame
Des réactions psychotiques ont été signalées chez des patients alcooliques qui utilisent simultanément du métronidazole et du disulfirame. Le métronidazole ne doit pas être administré aux patients qui ont pris du disulfirame au cours des deux dernières semaines (voir CONTRE-INDICATIONS ).
Boissons alcoolisées
Des crampes abdominales, des nausées, des vomissements, des maux de tête et des bouffées vasomotrices peuvent survenir si des boissons alcoolisées ou des produits contenant du propylène glycol sont consommés pendant ou après un traitement au métronidazole (voir CONTRE-INDICATIONS ).
Warfarine et autres anticoagulants oraux
Il a été rapporté que le métronidazole potentialise l'effet anticoagulant de la warfarine et d'autres anticoagulants coumariniques oraux, entraînant une prolongation du temps de prothrombine. Lorsque FLAGYL est prescrit chez des patients sous ce type de traitement anticoagulant, le temps de prothrombine et l'INR doivent être étroitement surveillés.

Lithium
Chez les patients stabilisés avec des doses relativement élevées de lithium, un traitement à court terme par le métronidazole a été associé à une élévation du lithium sérique et, dans quelques cas, à des signes de toxicité au lithium. Les taux sériques de lithium et de créatinine sérique doivent être mesurés plusieurs jours après le début du métronidazole pour détecter toute augmentation pouvant précéder les symptômes cliniques d'intoxication au lithium.
Busulfan
Il a été rapporté que le métronidazole augmente les concentrations plasmatiques de busulfan, ce qui peut entraîner un risque accru de toxicité grave du busulfan. Le métronidazole ne doit pas être administré en concomitance avec le busulfan à moins que le bénéfice ne l'emporte sur le risque. Si aucune alternative thérapeutique au métronidazole n'est disponible et que l'administration concomitante avec le busulfan est médicalement nécessaire, une surveillance fréquente de la concentration plasmatique du busulfan doit être effectuée et la dose de busulfan doit être ajustée en conséquence.
Médicaments qui inhibent les enzymes CYP450
L'administration simultanée de médicaments qui diminuent l'activité des enzymes hépatiques microsomales, comme la cimétidine, peut prolonger la demi-vie et diminuer la clairance plasmatique du métronidazole.
Médicaments qui induisent les enzymes CYP450
L'administration simultanée de médicaments qui induisent des enzymes hépatiques microsomales, comme la phénytoïne ou le phénobarbital, peut accélérer l'élimination du métronidazole, entraînant une réduction des taux plasmatiques ; une altération de la clairance de la phénytoïne a également été rapportée.
Médicaments qui allongent l'intervalle QT
Un allongement de l'intervalle QT a été signalé, en particulier lorsque le métronidazole était administré avec des médicaments susceptibles d'allonger l'intervalle QT.
AVERTISSEMENTS
Effets sur le système nerveux central et périphérique
Encéphalopathie et neuropathie périphérique : Des cas d'encéphalopathie et de neuropathie périphérique (y compris la neuropathie optique) ont été signalés avec le métronidazole.
Une encéphalopathie a été rapportée en association avec une toxicité cérébelleuse caractérisée par une ataxie, des étourdissements et une dysarthrie. Des lésions du SNC observées à l'IRM ont été décrites dans des rapports d'encéphalopathie. Les symptômes du SNC sont généralement réversibles en quelques jours à quelques semaines après l'arrêt du métronidazole. Les lésions du SNC observées en IRM ont également été décrites comme réversibles.
Une neuropathie périphérique, principalement de type sensoriel, a été rapportée et se caractérise par un engourdissement ou une paresthésie d'un membre.
Des crises convulsives ont été signalées chez des patients traités par le métronidazole.
Méningite aseptique : Des cas de méningite aseptique ont été signalés avec le métronidazole. Les symptômes peuvent survenir dans les heures suivant l'administration de la dose et disparaissent généralement après l'arrêt du traitement par le métronidazole.
L'apparition de signes et symptômes neurologiques anormaux nécessite une évaluation rapide du rapport bénéfice/risque de la poursuite du traitement (voir EFFETS INDÉSIRABLES ).
PRÉCAUTIONS
Général
Insuffisance hépatique
Les patients atteints d'insuffisance hépatique métabolisent lentement le métronidazole, ce qui entraîne une accumulation de métronidazole dans le plasma. Chez les patients présentant une insuffisance hépatique sévère (Child-Pugh C), une dose réduite de FLAGYL 400 mg est recommandée. Pour les patients présentant une insuffisance hépatique légère à modérée, aucun ajustement posologique n'est nécessaire, mais ces patients doivent être surveillés pour les événements indésirables associés au métronidazole (voir PHARMACOLOGIE CLINIQUE et DOSAGE ET ADMINISTRATION ).
Insuffisance rénale
Les patients atteints d'insuffisance rénale terminale peuvent excréter lentement du métronidazole et des métabolites dans l'urine, ce qui entraîne une accumulation importante de métabolites de métronidazole. La surveillance des événements indésirables associés au métronidazole est recommandée (voir PHARMACOLOGIE CLINIQUE ).
Surinfections fongiques
Une candidose connue ou non reconnue auparavant peut présenter des symptômes plus importants pendant le traitement par FLAGYL et nécessite un traitement avec un agent candidacide.
Utilisation chez les patients atteints de dyscrasie sanguine
Le métronidazole est un nitroimidazole et doit être utilisé avec prudence chez les patients présentant des signes ou des antécédents de dyscrasie sanguine. Une légère leucopénie a été observée lors de son administration ; cependant, aucune anomalie hématologique persistante attribuable au métronidazole n'a été observée dans les études cliniques. Une numération leucocytaire totale et différentielle est recommandée avant et après le traitement.
Bactéries et parasites résistants aux médicaments
La prescription de FLAGYL en l'absence d'infection bactérienne ou parasitaire avérée ou fortement suspectée ou d'indication prophylactique est peu susceptible d'apporter un bénéfice au patient et augmente le risque de développement de bactéries et parasites résistants aux médicaments.
Interactions médicament/test de laboratoire
Le métronidazole peut interférer avec certains types de déterminations des valeurs chimiques sériques, telles que l'aspartate aminotransférase (AST, SGOT), l'alanine aminotransférase (ALT, SGPT), la lactate déshydrogénase (LDH), les triglycérides et la glucose hexokinase. Des valeurs nulles peuvent être observées. Tous les tests dans lesquels une interférence a été rapportée impliquent un couplage enzymatique du test à l'oxydo-réduction du nicotinamide adénine dinucléotide (NAD + NADH). L'interférence est due à la similitude des pics d'absorbance du NADH (340 nm) et du métronidazole (322 nm) à pH 7.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Des tumeurs affectant le foie, les poumons, les tissus mammaires et lymphatiques ont été détectées dans plusieurs études sur le métronidazole chez le rat et la souris, mais pas chez le hamster.
Des tumeurs pulmonaires ont été observées dans les six études rapportées chez la souris, y compris une étude dans laquelle les animaux ont reçu une dose intermittente (administration toutes les quatre semaines uniquement). Les tumeurs malignes du foie ont augmenté chez les souris mâles traitées à environ 1500 mg/m² (similaire à la dose quotidienne maximale recommandée, basée sur des comparaisons de surface corporelle). Les lymphomes malins et les néoplasmes pulmonaires ont également augmenté avec l'alimentation à vie du médicament aux souris. Les tumeurs mammaires et hépatiques ont augmenté chez les rats femelles ayant reçu du métronidazole par voie orale par rapport aux témoins concurrents. Deux études de tumorigénicité à vie chez des hamsters ont été réalisées et rapportées comme étant négatives.
Le métronidazole a montré une activité mutagène dans les systèmes de dosage in vitro, y compris le test d'Ames. Les études chez les mammifères in vivo n'ont pas réussi à démontrer un potentiel de dommages génétiques.
Le métronidazole n'a produit aucun effet indésirable sur la fertilité ou la fonction testiculaire chez les rats mâles à des doses allant jusqu'à 400 mg/kg/jour (similaire à la dose clinique maximale recommandée, basée sur des comparaisons de surface corporelle) pendant 28 jours. Cependant, les rats traités à la même dose pendant 6 semaines ou plus étaient stériles et présentaient une dégénérescence sévère de l'épithélium séminifère dans les testicules ainsi que des diminutions marquées du nombre de spermatides testiculaires et du nombre de spermatozoïdes épididymaires. La fertilité a été restaurée chez la plupart des rats après une période de récupération sans médicament de huit semaines.
Grossesse
Effets tératogènes
Il n'y a pas d'études adéquates et bien contrôlées de FLAGYL chez les femmes enceintes. Il existe des données publiées provenant d'études cas-témoins, d'études de cohorte et de 2 méta-analyses qui incluent plus de 5000 femmes enceintes qui ont utilisé du métronidazole pendant la grossesse. De nombreuses études incluaient des expositions au cours du premier trimestre. Une étude a montré un risque accru de fente labiale, avec ou sans fente palatine, chez les nourrissons exposés au métronidazole in utero ; cependant, ces résultats n'ont pas été confirmés. En outre, plus de dix essais cliniques randomisés contrôlés par placebo ont recruté plus de 5000 femmes enceintes pour évaluer l'utilisation d'un traitement antibiotique (y compris le métronidazole) pour la vaginose bactérienne sur l'incidence de l'accouchement prématuré. La plupart des études n'ont pas montré de risque accru d'anomalies congénitales ou d'autres résultats fœtaux indésirables après une exposition au métronidazole pendant la grossesse. Trois études menées pour évaluer le risque de cancer infantile suite à une exposition au métronidazole pendant la grossesse n'ont pas montré de risque accru ; cependant, la capacité de ces études à détecter un tel signal était limitée.
Le métronidazole traverse la barrière placentaire et ses effets sur l'organogenèse fœtale humaine ne sont pas connus. Des études de reproduction ont été réalisées chez des rats, des lapins et des souris à des doses similaires à la dose humaine maximale recommandée sur la base de comparaisons de surface corporelle. Il n'y avait aucune preuve de préjudice pour le fœtus dû au métronidazole.
Mères allaitantes
Le métronidazole est présent dans le lait maternel à des concentrations similaires aux concentrations sériques maternelles, et les concentrations sériques infantiles peuvent être proches ou comparables aux concentrations thérapeutiques infantiles. En raison du potentiel de tumorigénicité démontré pour le métronidazole chez la souris et le rat
études, une décision doit être prise soit d'arrêter l'allaitement soit d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère. Alternativement, une mère qui allaite peut choisir de pomper et de jeter le lait maternel pendant la durée du traitement au métronidazole et pendant 24 heures après la fin du traitement et de nourrir son nourrisson avec du lait maternel ou du lait maternisé.
Utilisation gériatrique
Chez les patients gériatriques âgés, une surveillance des événements indésirables associés au métronidazole est recommandée (voir PHARMACOLOGIE CLINIQUE , PRÉCAUTIONS ). Une diminution de la fonction hépatique chez les patients gériatriques peut entraîner une augmentation des concentrations de métronidazole pouvant nécessiter un ajustement de la posologie de métronidazole (voir DOSAGE ET ADMINISTRATION ).
Utilisation pédiatrique
La sécurité et l'efficacité chez les patients pédiatriques n'ont pas été établies, sauf pour le traitement de l'amibiase.
SURDOSAGE
Des doses orales uniques de métronidazole, jusqu'à 15 g, ont été signalées dans des tentatives de suicide et des surdoses accidentelles. Les symptômes signalés comprennent des nausées, des vomissements et de l'ataxie.
Le métronidazole oral a été étudié en tant que sensibilisant aux rayonnements dans le traitement des tumeurs malignes. Des effets neurotoxiques, y compris des convulsions et une neuropathie périphérique, ont été rapportés après 5 à 7 jours de doses de 6 à 10,4 g tous les deux jours.
Traitement du surdosage
Il n'y a pas d'antidote spécifique pour le surdosage de métronidazole; par conséquent, la prise en charge du patient doit consister en une thérapie symptomatique et de soutien.
CONTRE-INDICATIONS
Hypersensibilité
FLAGYL Comprimés est contre-indiqué chez les patients ayant des antécédents d'hypersensibilité au métronidazole ou à d'autres dérivés du nitroimidazole.
Chez les patientes atteintes de trichomonase, FLAGYL 200 mg, comprimé est contre-indiqué pendant le premier trimestre de la grossesse (voir PRÉCAUTIONS ).
Réaction psychotique avec disulfiram
L'utilisation de métronidazole par voie orale est associée à des réactions psychotiques chez les patients alcooliques qui utilisaient simultanément du disulfirame. Ne pas administrer de métronidazole aux patients qui ont pris du disulfirame au cours des deux dernières semaines (voir PRÉCAUTIONS , INTERACTIONS MÉDICAMENTEUSES ).
Interaction avec l'alcool
L'utilisation de métronidazole par voie orale est associée à une réaction de type disulfirame à l'alcool, notamment des crampes abdominales, des nausées, des vomissements, des maux de tête et des bouffées vasomotrices. Cesser la consommation d'alcool ou de produits contenant du propylène glycol pendant et pendant au moins trois jours après le traitement par le métronidazole (voir PRÉCAUTIONS , INTERACTIONS MÉDICAMENTEUSES ).
Syndrome de Cockayne
FLAGYL 400mg Comprimés est contre-indiqué chez les patients atteints du syndrome de Cockayne. Une hépatotoxicité sévère irréversible/insuffisance hépatique aiguë avec issue fatale a été rapportée après l'initiation du métronidazole chez des patients atteints du syndrome de Cockayne (voir EFFETS INDÉSIRABLES ).
PHARMACOLOGIE CLINIQUE
Absorption
L'élimination du métronidazole dans le corps est similaire pour les formes posologiques orales et intraveineuses. Après administration orale, le métronidazole est bien absorbé, les concentrations plasmatiques maximales se produisant entre une et deux heures après l'administration.
Les concentrations plasmatiques de métronidazole sont proportionnelles à la dose administrée. L'administration orale de 250 mg, 500 mg ou 2 000 mg a produit des concentrations plasmatiques maximales de 6 mcg/mL, 12 mcg/mL et 40 mcg/mL, respectivement. Les études ne révèlent aucune différence significative de biodisponibilité entre les mâles et les femelles ; cependant, en raison des différences de poids, les concentrations plasmatiques résultantes chez les hommes sont généralement plus faibles.
Distribution
Le métronidazole est le principal composant apparaissant dans le plasma, des quantités moindres de métabolites étant également présentes. Moins de 20 % du métronidazole circulant est lié aux protéines plasmatiques. Le métronidazole apparaît dans le liquide céphalo-rachidien, la salive et le lait maternel à des concentrations similaires à celles trouvées dans le plasma. Des concentrations bactéricides de métronidazole ont également été détectées dans le pus d'abcès hépatiques.
Métabolisme/Excrétion
La principale voie d'élimination du métronidazole et de ses métabolites se fait par voie urinaire (60 % à 80 % de la dose), l'excrétion fécale représentant 6 % à 15 % de la dose. Les métabolites qui apparaissent dans l'urine résultent principalement de l'oxydation de la chaîne latérale [1-(ßhydroxyethyl)- 2-hydroxymethyl-5-nitroimidazole and 2-methyl-5-nitroimidazole-1-ylacetic acid] et de la conjugaison du glucuronide, avec le métronidazole inchangé. pour environ 20% du total. Le composé parent et le métabolite hydroxyle possèdent tous deux une activité antimicrobienne in vitro.
La clairance rénale du métronidazole est d'environ 10 mL/min/1,73 m². La demi-vie d'élimination moyenne du métronidazole chez les sujets sains est de huit heures.
Insuffisance rénale
La diminution de la fonction rénale ne modifie pas la pharmacocinétique d'une dose unique de métronidazole.
Les sujets atteints d'insuffisance rénale terminale (IRT ; CLCR = 8,1 ± 9,1 mL/min) et qui ont reçu une seule perfusion intraveineuse de 500 mg de métronidazole n'ont présenté aucun changement significatif dans la pharmacocinétique du métronidazole, mais avaient une Cmax d'hydroxy-métronidazole 2 fois plus élevée et 5 Cmax de l'acétate de métronidazole multipliée par trois, par rapport aux sujets sains ayant une fonction rénale normale (CLCR = 126±16 mL/min). Ainsi, compte tenu de l'accumulation potentielle de métabolites du métronidazole chez les patients atteints d'insuffisance rénale terminale, une surveillance des événements indésirables associés au métronidazole est recommandée (voir PRÉCAUTIONS ).
Effet de la dialyse
Après une perfusion intraveineuse unique ou une dose orale de métronidazole 500 mg, la clairance du métronidazole a été étudiée chez des sujets en insuffisance rénale terminale sous hémodialyse ou dialyse péritonéale continue ambulatoire (DPCA). Une séance d'hémodialyse d'une durée de 4 à 8 heures a éliminé 40 à 65 % de la dose de métronidazole administrée, selon le type de membrane de dialyseur utilisé et la durée de la séance de dialyse. Si l'administration de métronidazole ne peut être séparée de la séance de dialyse, une supplémentation en dose de métronidazole après l'hémodialyse doit être envisagée (voir DOSAGE ET ADMINISTRATION ). Une séance de dialyse péritonéale d'une durée de 7,5 heures a éliminé environ 10 % de la dose de métronidazole administrée. Aucun ajustement de la dose de métronidazole n'est nécessaire chez les patients atteints d'IRT subissant une CAPD.
Insuffisance hépatique
Après une seule perfusion intraveineuse de 500 mg de métronidazole, l'ASC24 moyenne du métronidazole était supérieure de 114 % chez les patients atteints d'insuffisance hépatique sévère (Child-Pugh C), et de 54 % et 53 % chez les patients atteints d'insuffisance hépatique légère (Child-Pugh A). et une insuffisance hépatique modérée (Child-Pugh B), respectivement, par rapport à des sujets témoins sains. Il n'y a pas eu de changements significatifs dans l'ASC24 de l'hydroxyl-métronidazole chez ces patients atteints d'insuffisance hépatique. Une réduction de 50 % de la posologie du métronidazole est recommandée chez les patients présentant une insuffisance hépatique sévère (Child-Pugh C) (voir DOSAGE ET ADMINISTRATION ). Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance hépatique légère à modérée. Les patients présentant une insuffisance hépatique légère à modérée doivent être surveillés afin de détecter tout effet indésirable associé au métronidazole (voir PRÉCAUTIONS et DOSAGE ET ADMINISTRATION ).
Patients gériatriques
Après une dose unique de 500 mg de métronidazole par voie orale ou intraveineuse, les sujets de plus de 70 ans sans dysfonctionnement rénal ou hépatique apparent avaient une ASC moyenne de l'hydroxy-métronidazole (métabolite actif) de 40 % à 80 % plus élevée, sans augmentation apparente de la moyenne. ASC du métronidazole (composé parent), comparée à de jeunes témoins sains âgés de moins de 40 ans. Chez les patients gériatriques, la surveillance des événements indésirables associés au métronidazole est recommandée (voir PRÉCAUTIONS ).
Patients pédiatriques
Dans une étude, les nouveau-nés semblaient démontrer une capacité réduite à éliminer le métronidazole. La demi-vie d'élimination, mesurée au cours des 3 premiers jours de vie, était inversement proportionnelle à l'âge gestationnel. Chez les nourrissons dont l'âge gestationnel se situait entre 28 et 40 semaines, les demi-vies d'élimination correspondantes variaient de 109 à 22,5 heures.
Microbiologie
Mécanisme d'action
Le métronidazole, un nitroimidazole, exerce des effets antibactériens dans un environnement anaérobie contre la plupart des anaérobies obligatoires. Une fois que le métronidazole pénètre dans l'organisme par diffusion passive et activé dans le cytoplasme des bactéries anaérobies sensibles, il est réduit ; ce processus comprend des protéines de transport d'électrons intracellulaires telles que la ferrédoxine , le transfert d'un électron au groupe nitro du métronidazole et la formation d'un radical libre nitroso de courte durée. En raison de cette altération de la molécule de métronidazole, un gradient de concentration est créé et maintenu qui favorise le transport intracellulaire du médicament. La forme réduite du métronidazole et des radicaux libres peut interagir avec l'ADN, entraînant une inhibition de la synthèse de l'ADN et une dégradation de l'ADN entraînant la mort de la bactérie. Le mécanisme d'action précis du métronidazole n'est pas clair.
La résistance
Il existe un potentiel de développement de résistance contre le métronidazole.
La résistance peut être due à plusieurs mécanismes, notamment une diminution de l'absorption du médicament, une efficacité de réduction altérée, une surexpression des pompes à efflux, une inactivation du médicament et/ou une réparation accrue des dommages à l'ADN.
Le métronidazole ne possède aucune activité cliniquement pertinente contre les anaérobies facultatifs ou les aérobies obligatoires.
Activité anti-microbienne
Le métronidazole s'est avéré actif contre la plupart des isolats des bactéries suivantes, à la fois in vitro et dans les infections cliniques, comme décrit dans la section INDICATIONS ET UTILISATION.
Anaérobies à Gram positif
Espèce Clostridium Espèce Eubacterium Espèce Peptococcus Espèce Peptostreptococcus
Aérobies à Gram négatif
Groupe Bacteroides fragilis (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B.vulgatus) Espèce Fusobacterium
Parasites protozoaires
Entamoeba histolytica Trichomonas vaginalis
Les données in vitro suivantes sont disponibles, mais leur signification clinique est inconnue :
Le métronidazole présente des concentrations inhibitrices minimales in vitro (CMI) de 8 mcg/mL ou moins contre la plupart (≥ 90 %) des isolats des bactéries suivantes ; cependant, l'innocuité et l'efficacité du métronidazole dans le traitement des infections cliniques dues à ces bactéries n'ont pas été établies dans des essais cliniques adéquats et bien contrôlés.
Anaérobies à Gram négatif
Groupe Bacteroides fragilis (B. caccae, B. uniformis) Espèces Prevotella (P. bivia, P. buccae, P. disiens)
Test de sensibilité
Pour des informations spécifiques concernant les critères d'interprétation des tests de sensibilité et les méthodes de test associées et les normes de contrôle qualité reconnues par la FDA pour ce médicament, veuillez consulter : https://www.fda.gov/STIC.
INFORMATIONS PATIENTS
Interaction avec l'alcool
Arrêtez la consommation de boissons alcoolisées ou de produits contenant du propylène glycol pendant la prise de FLAGYL 400 mg et pendant au moins trois jours après car des crampes abdominales, des nausées, des vomissements, des maux de tête et des bouffées vasomotrices peuvent survenir (voir CONTRE-INDICATIONS et PRÉCAUTIONS , INTERACTIONS MÉDICAMENTEUSES ).
Traitement des infections bactériennes et parasitaires
Les patients doivent être informés que FLAGYL 400 mg ne doit être utilisé que pour traiter les infections bactériennes et parasitaires. FLAGYL 400 mg ne traite pas les infections virales (par exemple, le rhume). Lorsque FLAGYL est prescrit pour traiter une infection bactérienne, les patients doivent être informés que même s'il est courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut (1) diminuer l'efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne puissent plus être traitées par FLAGYL 400 mg à l'avenir.
