Macrobid 50mg, 100mg Nitrofurantoin Monohydrate Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Macrobid 100 mg et comment est-il utilisé ?
Macrobid 50 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de l'infection des voies urinaires. Macrobid 100 mg peut être utilisé seul ou avec d'autres médicaments.
Macrobid est un antibiotique.
Quels sont les effets secondaires possibles de Macrobid ?
Macrobid peut provoquer des effets secondaires graves, notamment :
- fortes douleurs à l'estomac
- diarrhée aqueuse ou sanglante
- problèmes de vue
- fièvre
- des frissons
- toux
- douleur thoracique
- difficulté à respirer
- engourdissement, picotements ou sensation de brûlure dans les mains ou les pieds
- douleur intense derrière les yeux
- peau pâle
- la faiblesse
- douleurs articulaires ou gonflement avec fièvre
- glandes enflées
- douleurs musculaires
- douleur, rougeur ou gonflement de la mâchoire inférieure
- Maux de tête sévères
- sonner dans tes oreilles
- vertiges
- nausée
- douleur dans le haut de l'estomac (qui peut se propager à votre dos)
- vomissement
- urine foncée
- jaunissement de la peau ou des yeux (jaunisse)
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Macrobid incluent :
- mal de tête
- vertiges
- somnolence
- la faiblesse
- gaz
- indigestion
- perte d'appétit
- nausée
- vomissement
- douleurs musculaires ou articulaires
- éruption
- démangeaison
- perte de cheveux temporaire
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Macrobid. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l'efficacité de Macrobid 100 mg et d'autres médicaments antibactériens, Macrobid doit être utilisé uniquement pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu'elles sont causées par des bactéries.
LA DESCRIPTION
La nitrofurantoïne est un agent antibactérien spécifique des infections des voies urinaires. La marque Macrobid® de nitrofurantoïne est une enveloppe de capsule de gélatine dure contenant l'équivalent de 100 mg de nitrofurantoïne sous la forme de 25 mg de macrocristaux de nitrofurantoïne et de 75 mg de monohydrate de nitrofurantoïne.
Le nom chimique des macrocristaux de nitrofurantoïne est 1-[[[5-nitro-2-furanyl]méthylène] amino]-2,4-imidazolidinedione. La structure chimique est la suivante :
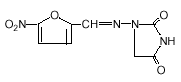 Poids moléculaire : 238,16
Poids moléculaire : 238,16 Le nom chimique du monohydrate de nitrofurantoïne est le monohydrate de 1-[[[5-nitro-2-furanyl]méthylène]amino]-2,4-imidazolidinedione. La structure chimique est la suivante :
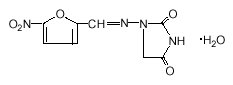 Poids moléculaire : 256,17
Poids moléculaire : 256,17 Ingrédients inactifs : chaque capsule contient du carbomère 934P, de l'amidon de maïs, du sucre compressible, du jaune D&C n° 10, de l'encre grise comestible, du bleu FD&C n° 1, du rouge FD&C n° 40, de la gélatine, du lactose, du stéarate de magnésium, de la povidone, du talc et du titane. dioxyde.
LES INDICATIONS
Macrobid est indiqué uniquement pour le traitement des infections aiguës non compliquées des voies urinaires (cystite aiguë) causées par des souches sensibles d'Escherichia coli ou de Staphylococcus saprophyticus.
La nitrofurantoïne n'est pas indiquée pour le traitement de la pyélonéphrite ou des abcès périnéphriques.
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l'efficacité de Macrobid et d'autres médicaments antibactériens, Macrobid 100 mg doit être utilisé uniquement pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu'elles sont causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte lors de la sélection ou de la modification du traitement antibactérien. En l'absence de telles données, l'épidémiologie locale et les schémas de sensibilité peuvent contribuer à la sélection empirique du traitement.
Les nitrofurantoïnes n'ont pas la distribution tissulaire plus large des autres agents thérapeutiques approuvés pour les infections des voies urinaires. Par conséquent, de nombreux patients traités par Macrobid 100 mg sont prédisposés à la persistance ou à la réapparition d'une bactériurie. (Voir Etudes cliniques .) Des échantillons d'urine pour la culture et les tests de sensibilité doivent être obtenus avant et après la fin du traitement. En cas de persistance ou de réapparition de la bactériurie après le traitement par Macrobid, d'autres agents thérapeutiques à distribution tissulaire plus large doivent être sélectionnés. Lors de l'examen de l'utilisation de Macrobid, des taux d'éradication plus faibles doivent être mis en balance avec le potentiel accru de toxicité systémique et de développement d'une résistance antimicrobienne lorsque des agents à distribution tissulaire plus large sont utilisés.
DOSAGE ET ADMINISTRATION
Les gélules de Macrobid doivent être prises avec de la nourriture.
Adultes et patients pédiatriques de plus de 12 ans : Une gélule de 100 mg toutes les 12 heures pendant sept jours.
COMMENT FOURNIE
Macrobid est disponible sous forme de gélules opaques noires et jaunes de 100 mg portant l'inscription « (bande) Macrobid (bande) » sur une moitié et « 52427-285 » sur l'autre.
CDN 52427-285-01 bouteille de 100
Conserver à température ambiante contrôlée (59° à 86°F ou 15° à 30°C).
Conforme au test de dissolution USP 2
RÉFÉRENCES
1. Institut des normes cliniques et de laboratoire. Méthodes de dilution des tests de sensibilité aux antimicrobiens pour les bactéries à croissance aérobie ; Approuvé Standard-huitième édition. Document CLSI M07-A8 [ISBN 1-56238-689-1]. Institut des normes cliniques et de laboratoire, 940 West Valley Road, Suite 1400, Wayne, Pennsylvanie 19087-1898 États-Unis, 2009.
2. Institut des normes cliniques et de laboratoire. Normes de performance pour les tests de sensibilité aux disques antimicrobiens ; Norme approuvée - Dixième édition. Document CLSI M02-A 10 [ISBN 1-56238-688-3]. Institut des normes cliniques et de laboratoire, 940 West Valley Road, Suite 1400, Wayne, Pennsylvanie 19087-1898 États-Unis, 2009.
3. Institut des normes cliniques et de laboratoire. Normes de performance pour les tests de sensibilité aux antimicrobiens ; Dix-neuvième supplément d'information. Document CLSI M100-S19 [ISBN 1-56238-716-2]. Institut des normes cliniques et de laboratoire, 940 West Valley Road, Suite 1400, Wayne, Pennsylvanie 19087-1898 États-Unis, 2010.
Distribué par : Almatica Pharma, Inc. Pine Brook, NJ 07058 États-Unis. Rév : 02/2013
EFFETS SECONDAIRES
Dans les essais cliniques de Macrobid, les événements indésirables cliniques les plus fréquents qui ont été signalés comme possiblement ou probablement liés au médicament étaient les nausées (8 %), les maux de tête (6 %) et les flatulences (1,5 %). D'autres événements indésirables cliniques rapportés comme possiblement ou probablement liés au médicament sont survenus chez moins de 1 % des patients étudiés et sont répertoriés ci-dessous dans chaque système corporel par ordre décroissant de fréquence :
Gastro-intestinal : Diarrhée, dyspepsie, douleurs abdominales, constipation, vomissements
Neurologique : Vertiges, somnolence, amblyopie
Respiratoire: Réaction d'hypersensibilité pulmonaire aiguë (voir AVERTISSEMENTS )
Allergique: Prurit, urticaire
Dermatologique : Alopécie
Divers: Fièvre, frissons, malaise
Les événements indésirables cliniques supplémentaires suivants ont été signalés avec l'utilisation de la nitrofurantoïne :
Gastro-intestinal : Sialadénite, pancréatite. Il y a eu des rapports sporadiques de colite pseudomembraneuse avec l'utilisation de nitrofurantoïne. L'apparition de symptômes de colite pseudomembraneuse peut survenir pendant ou après un traitement antimicrobien. (Voir AVERTISSEMENTS .)
Neurologique : Une neuropathie périphérique, qui peut devenir grave ou irréversible, s'est produite. Des décès ont été signalés. Des affections telles qu'une insuffisance rénale (clairance de la créatinine inférieure à 60 ml par minute ou créatinine sérique élevée cliniquement significative), anémie, diabète sucré, déséquilibre électrolytique, carence en vitamine B et maladies débilitantes peuvent augmenter le risque de neuropathie périphérique. (Voir AVERTISSEMENTS .)
Une asthénie, des vertiges et un nystagmus ont également été rapportés avec l'utilisation de la nitrofurantoïne.
De rares cas d'hypertension intracrânienne bénigne (pseudotumor cerebri), de confusion, de dépression, de névrite optique et de réactions psychotiques ont été rapportés. Des fontanelles bombées, signe d'hypertension intracrânienne bénigne chez les nourrissons, ont été rarement rapportées.
Respiratoire
DES RÉACTIONS D'HYPERSENSIBILITÉ PULMONAIRE CHRONIQUE, SUBAIGUË OU AIGUË PEUVENT SURVENIR AVEC L'UTILISATION DE NITROFURANTOÏNE.
LES RÉACTIONS PULMONAIRES CHRONIQUES SURVIENNENT GÉNÉRALEMENT CHEZ LES PATIENTS QUI ONT REÇU UN TRAITEMENT CONTINU PENDANT SIX MOIS OU PLUS. MALAISIE, DYSPNÉE À L'EFFORT, TOUX ET FONCTION PULMONAIRE ALTÉRÉE SONT DES MANIFESTATIONS COURANTES QUI PEUVENT SURVENIR DE FAÇON INSIDIENNE. LES CONSTATATIONS RADIOLOGIQUES ET HISTOLOGIQUES DE PNEUMONITE INTERSTITIELLE DIFFUSE OU DE FIBROSE, OU LES DEUX, SONT ÉGALEMENT DES MANIFESTATIONS COURANTES DE LA RÉACTION PULMONAIRE CHRONIQUE. LA FIÈVRE EST RAREMENT ÉLEVÉE
LA SÉVÉRITÉ DES RÉACTIONS PULMONAIRES CHRONIQUES ET LEUR DEGRÉ DE RÉSOLUTION SEMBLENT LIÉS À LA DURÉE DU TRAITEMENT APRÈS L'APPARITION DES PREMIERS SIGNES CLINIQUES. LA FONCTION PULMONAIRE PEUT ÊTRE ALTÉRÉE DE FAÇON PERMANENTE, MÊME APRÈS L'ARRÊT DU TRAITEMENT. LE RISQUE EST PLUS GRAND LORSQUE LES RÉACTIONS PULMONAIRES CHRONIQUES NE SONT PAS RECONNUES TÔT.
Dans les réactions pulmonaires subaiguës, la fièvre et l'éosinophilie surviennent moins souvent que dans la forme aiguë. À l'arrêt du traitement, la récupération peut nécessiter plusieurs mois. Si les symptômes ne sont pas reconnus comme étant liés au médicament et que le traitement à la nitrofurantoïne n'est pas arrêté, les symptômes peuvent s'aggraver.
Les réactions pulmonaires aiguës se manifestent couramment par de la fièvre, des frissons, de la toux, des douleurs thoraciques, une dyspnée, une infiltration pulmonaire avec condensation ou épanchement pleural à la radiographie et une éosinophilie. Les réactions aiguës surviennent généralement au cours de la première semaine de traitement et sont réversibles à l'arrêt du traitement. La résolution est souvent dramatique. (Voir AVERTISSEMENTS .)
Des modifications de l'électrocardiogramme (p. ex., modifications non spécifiques de l'onde ST/T, bloc de branche) ont été rapportées en association avec des réactions pulmonaires.
La cyanose a été signalée rarement.
Hépatique: Les réactions hépatiques, y compris l'hépatite, l'ictère cholestatique, l'hépatite chronique active et la nécrose hépatique, se produisent rarement. (Voir AVERTISSEMENTS .)
Allergique: Un syndrome pseudo-lupique associé à une réaction pulmonaire à la nitrofurantoïne a été rapporté. Aussi, œdème de Quincke ; éruptions maculopapuleuses, érythémateuses ou eczémateuses ; anaphylaxie; arthralgie; myalgie; fièvre médicamenteuse; des frissons; et des vascularites (parfois associées à des réactions pulmonaires) ont été rapportées. Les réactions d'hypersensibilité représentent les événements indésirables spontanément rapportés les plus fréquents dans l'expérience post-commercialisation mondiale avec les formulations de nitrofurantoïne.
Dermatologique : Une dermatite exfoliative et un érythème polymorphe (y compris le syndrome de Stevens-Johnson) ont été rarement rapportés.
Hématologique : De rares cas de cyanose secondaire à la méthémoglobinémie ont été rapportés.
Divers: Comme avec d'autres agents antimicrobiens, des surinfections causées par des organismes résistants, par exemple des espèces de Pseudomonas ou des espèces de Candida, peuvent survenir.
Dans les essais cliniques de Macrobid, les événements indésirables de laboratoire les plus fréquents (1 à 5 %), sans égard à la relation médicamenteuse, étaient les suivants : éosinophilie, augmentation de l'AST (SGOT), augmentation de l'ALT (SGPT), diminution de l'hémoglobine, augmentation du phosphore sérique. Les événements indésirables de laboratoire suivants ont également été rapportés avec l'utilisation de la nitrofurantoïne : anémie par déficit en glucose-6-phosphate déshydrogénase (voir AVERTISSEMENTS ), agranulocytose, leucopénie, granulocytopénie, anémie hémolytique, thrombocytopénie, anémie mégaloblastique. Dans la plupart des cas, ces anomalies hématologiques ont disparu après l'arrêt du traitement. L'anémie aplasique a rarement été rapportée.
INTERACTIONS MÉDICAMENTEUSES
Les antiacides contenant du trisilicate de magnésium, lorsqu'ils sont administrés en même temps que la nitrofurantoïne, réduisent à la fois la vitesse et l'étendue de l'absorption. Le mécanisme de cette interaction est probablement l'adsorption de la nitrofurantoïne sur la surface du trisilicate de magnésium.
Les médicaments uricosuriques, tels que le probénécide et la sulfinpyrazone, peuvent inhiber la sécrétion tubulaire rénale de nitrofurantoïne. L'augmentation résultante des taux sériques de nitrofurantoïne peut augmenter la toxicité, et la diminution des taux urinaires pourrait diminuer son efficacité en tant qu'antibactérien des voies urinaires.

Interactions médicament/test de laboratoire
En raison de la présence de nitrofurantoïne, une réaction faussement positive pour le glucose dans l'urine peut se produire. Ceci a été observé avec les solutions de Benedict et de Fehling mais pas avec le test enzymatique au glucose.
AVERTISSEMENTS
Réactions pulmonaires
DES RÉACTIONS PULMONAIRES AIGUËS, SUBAIGUËS OU CHRONIQUES ONT ÉTÉ OBSERVÉES CHEZ DES PATIENTS TRAITÉS PAR LA NITROFURANTOÏNE. SI CES RÉACTIONS SE PRODUISENT, MACROBID 100mg DOIT ÊTRE ARRÊTÉ ET DES MESURES APPROPRIÉES PRISES. DES RAPPORTS ONT CITE DES REACTIONS PULMONAIRES COMME UNE CAUSE CONtributive A LA MORT.
LES RÉACTIONS PULMONAIRES CHRONIQUES (PNEUMONITE INTERSTITIELLE DIFFUSE OU FIBROSE PULMONAIRE, OU LES DEUX) PEUVENT SE DÉVELOPPER INSIDIEUSEMENT. CES RÉACTIONS SURVENENT RAREMENT ET GÉNÉRALEMENT CHEZ LES PATIENTS RECEVANT UN TRAITEMENT PENDANT SIX MOIS OU PLUS. UNE SURVEILLANCE ÉTROITE DE L'ÉTAT PULMONAIRE DES PATIENTS RECEVANT UNE THÉRAPIE À LONG TERME EST GARANTIE ET EXIGE QUE LES BÉNÉFICES DE LA THÉRAPIE SONT PESÉS PAR RAPPORT AUX RISQUES POTENTIELS. (VOIR RÉACTIONS RESPIRATOIRES .)
Hépatotoxicité
Les réactions hépatiques, y compris l'hépatite, l'ictère cholestatique, l'hépatite chronique active et la nécrose hépatique, se produisent rarement. Des décès ont été signalés. L'apparition d'une hépatite chronique active peut être insidieuse et les patients doivent être surveillés périodiquement pour détecter des changements dans les tests biochimiques qui indiqueraient une lésion hépatique. En cas d'hépatite, le médicament doit être arrêté immédiatement et des mesures appropriées doivent être prises.
Neuropathie
Une neuropathie périphérique, qui peut devenir grave ou irréversible, s'est produite. Des décès ont été signalés. Des affections telles qu'une insuffisance rénale (clairance de la créatinine inférieure à 60 ml par minute ou créatinine sérique élevée cliniquement significative), anémie, diabète sucré, déséquilibre électrolytique, carence en vitamine B et maladie débilitante peuvent augmenter la survenue d'une neuropathie périphérique. Les patients recevant un traitement à long terme doivent être surveillés périodiquement pour détecter des modifications de la fonction rénale. De rares cas de névrite optique ont été rapportés depuis la commercialisation des formulations de nitrofurantoïne.
L'anémie hémolytique
Des cas d'anémie hémolytique du type sensibilité à la primaquine ont été induits par la nitrofurantoïne. L'hémolyse semble être liée à un déficit en glucose-6-phosphate déshydrogénase dans les globules rouges des patients atteints. Cette carence se retrouve chez 10 % des Noirs et un petit pourcentage des groupes ethniques d'origine méditerranéenne et proche-orientale. L'hémolyse est une indication d'arrêt de Macrobid ; l'hémolyse cesse lorsque le médicament est retiré.
Diarrhée associée à Clostridium difficile
Des diarrhées associées à Clostridium difficile (DACD) ont été signalées avec l'utilisation de presque tous les agents antibactériens, y compris la nitrofurantoïne, et leur gravité peut varier d'une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens altère la flore normale du côlon, entraînant une prolifération de C. difficile.
C. difficile produit les toxines A et B qui contribuent au développement de CDAD. Les souches de C. difficile productrices d'hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée suite à l'utilisation d'antibiotiques. Des antécédents médicaux minutieux sont nécessaires car il a été rapporté que la DACD survient plus de deux mois après l'administration d'agents antibactériens.
Si la DACD est suspectée ou confirmée, l'utilisation continue d'antibiotiques non dirigés contre C. difficile peut devoir être interrompue. Une gestion appropriée des liquides et des électrolytes, une supplémentation en protéines, un traitement antibiotique de C. difficile et une évaluation chirurgicale doivent être institués selon les indications cliniques.
PRÉCAUTIONS
Général
La prescription de Macrobid 50 mg en l'absence d'infection bactérienne avérée ou fortement suspectée ou d'indication prophylactique est peu susceptible d'apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes aux médicaments.
Carcinogenèse, mutagenèse, altération de la fertilité
La nitrofurantoïne n'était pas cancérigène lorsqu'elle était administrée à des rats femelles Holtzman pendant 44,5 semaines ou à des rats femelles Sprague-Dawley pendant 75 semaines. Deux essais biologiques chroniques sur des rongeurs utilisant des rats Sprague-Dawley mâles et femelles et deux essais biologiques chroniques sur des souris Swiss et des souris BDF1 n'ont révélé aucune preuve de cancérogénicité.
La nitrofurantoïne a présenté des preuves d'activité cancérogène chez les souris femelles B6C3F1, comme le montre l'incidence accrue d'adénomes tubulaires, de tumeurs mixtes bénignes et de tumeurs des cellules de la granulosa de l'ovaire. Chez les rats mâles F344/N, on a observé une incidence accrue de néoplasmes peu fréquents des cellules tubulaires rénales, d'ostéosarcomes osseux et de néoplasmes du tissu sous-cutané. Dans une étude portant sur l'administration sous-cutanée de 75 mg/kg de nitrofurantoïne à des souris femelles gravides, des adénomes papillaires pulmonaires d'importance inconnue ont été observés chez la génération F1.
Il a été démontré que la nitrofurantoïne induisait des mutations ponctuelles dans certaines souches de Salmonella typhimurium et des mutations directes dans les cellules de lymphome de souris L5178Y. La nitrofurantoïne a induit un nombre accru d'échanges de chromatides sœurs et d'aberrations chromosomiques dans les cellules ovariennes de hamster chinois, mais pas dans les cellules humaines en culture. Les résultats du test de létalité récessive liée au sexe chez la drosophile étaient négatifs après administration de nitrofurantoïne par alimentation ou par injection. La nitrofurantoïne n'a pas induit de mutation héréditaire dans les modèles de rongeurs examinés.
L'importance des résultats de cancérogénicité et de mutagénicité par rapport à l'utilisation thérapeutique de la nitrofurantoïne chez l'homme n'est pas connue.
L'administration de doses élevées de nitrofurantoïne à des rats provoque un arrêt spermatogène temporaire ; ceci est réversible à l'arrêt du médicament. Des doses de 10 mg/kg/jour ou plus chez des hommes humains en bonne santé peuvent, dans certains cas imprévisibles, produire un arrêt spermatogène léger à modéré avec une diminution du nombre de spermatozoïdes.
Grossesse
Effets tératogènes - Catégorie de grossesse B
Plusieurs études de reproduction ont été réalisées chez des lapins et des rats à des doses allant jusqu'à six fois la dose humaine et n'ont révélé aucun signe d'altération de la fertilité ou d'effet nocif sur le fœtus dû à la nitrofurantoïne. Dans une seule étude publiée menée chez des souris à 68 fois la dose humaine (basée sur mg/kg administré à la mère), un retard de croissance et une faible incidence de malformations mineures et courantes ont été observés. Cependant, à 25 fois la dose humaine, aucune malformation fœtale n'a été observée; la pertinence de ces découvertes pour l'homme est incertaine. Il n'y a cependant pas d'études adéquates et bien contrôlées chez les femmes enceintes. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Effets non tératogènes
Il a été démontré dans une étude publiée sur la cancérogénicité transplacentaire que la nitrofurantoïne induisait des adénomes papillaires pulmonaires chez les souris de la génération F1 à des doses 19 fois supérieures à la dose humaine sur une base en mg/kg. La relation entre cette découverte et la cancérogenèse humaine potentielle est actuellement inconnue. En raison de l'incertitude concernant les implications humaines de ces données animales, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Travail et accouchement
Voir CONTRE-INDICATIONS .
Mères allaitantes
La nitrofurantoïne a été détectée dans le lait maternel humain en quantités infimes. En raison du risque d'effets indésirables graves de la nitrofurantoïne chez les nourrissons de moins d'un mois, une décision doit être prise d'interrompre l'allaitement ou d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère. (Voir CONTRE-INDICATIONS .)
Utilisation pédiatrique
Macrobid 100 mg est contre-indiqué chez les nourrissons de moins d'un mois. (Voir CONTRE-INDICATIONS .) La sécurité et l'efficacité chez les patients pédiatriques de moins de douze ans n'ont pas été établies.
Utilisation gériatrique
Les études cliniques de Macrobid 50 mg n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment des sujets plus jeunes. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes. Des rapports spontanés suggèrent une proportion plus élevée de réactions pulmonaires, y compris des décès, chez les patients âgés ; ces différences semblent être liées à la proportion plus élevée de patients âgés recevant un traitement à long terme à la nitrofurantoïne. Comme chez les patients plus jeunes, des réactions pulmonaires chroniques sont généralement observées chez les patients recevant un traitement pendant six mois ou plus (voir AVERTISSEMENTS ). Des rapports spontanés suggèrent également une proportion accrue de réactions hépatiques sévères, y compris des décès, chez les patients âgés (voir AVERTISSEMENTS ).
En général, la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'autres traitements médicamenteux chez les patients âgés doit être prise en compte lors de la prescription de Macrobid. Ce médicament est connu pour être en grande partie excrété par les reins et le risque de réactions toxiques à ce médicament peut être plus élevé chez les patients présentant une insuffisance rénale. L'anurie, l'oligurie ou une altération significative de la fonction rénale (clairance de la créatinine inférieure à 60 ml par minute ou créatinine sérique élevée cliniquement significative) sont des contre-indications (voir CONTRE-INDICATIONS ). Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, il peut être utile de surveiller la fonction rénale.
SURDOSAGE
Des incidents occasionnels de surdosage aigu de nitrofurantoïne n'ont entraîné aucun symptôme spécifique autre que des vomissements. L'induction de vomissements est recommandée. Il n'y a pas d'antidote spécifique, mais un apport hydrique élevé doit être maintenu pour favoriser l'excrétion urinaire du médicament. La nitrofurantoïne est dialysable.
CONTRE-INDICATIONS
L'anurie, l'oligurie ou une altération significative de la fonction rénale (clairance de la créatinine inférieure à 60 ml par minute ou créatinine sérique élevée cliniquement significative) sont des contre-indications. Le traitement de ce type de patient comporte un risque accru de toxicité en raison d'une altération de l'excrétion du médicament.
En raison de la possibilité d'anémie hémolytique due à des systèmes enzymatiques érythrocytaires immatures (instabilité du glutathion), le médicament est contre-indiqué chez les patientes enceintes à terme (38 à 42 semaines de gestation), pendant le travail et l'accouchement, ou lorsque le début du travail est imminent. Pour la même raison, le médicament est contre-indiqué chez les nouveau-nés de moins d'un mois.
Macrobid 50 mg est contre-indiqué chez les patients ayant des antécédents d'ictère cholestatique/dysfonctionnement hépatique associé à la nitrofurantoïne.
Macrobid 100 mg est également contre-indiqué chez les patients présentant une hypersensibilité connue à la nitrofurantoïne.
PHARMACOLOGIE CLINIQUE
Chaque gélule Macrobid de 100 mg contient deux formes de nitrofurantoïne. Vingt-cinq pour cent sont de la nitrofurantoïne macrocristalline, qui a une dissolution et une absorption plus lentes que le monohydrate de nitrofurantoïne. Les 75 % restants sont du monohydrate de nitrofurantoïne contenu dans un mélange de poudres qui, lors d'une exposition aux fluides gastriques et intestinaux, forme une matrice de gel qui libère de la nitrofurantoïne au fil du temps. D'après les données pharmacocinétiques urinaires, l'étendue et le taux d'excrétion urinaire de la nitrofurantoïne de la gélule de Macrobid à 100 mg sont similaires à ceux de la gélule de Macrodantin® à 50 mg ou 100 mg (macrocristaux de nitrofurantoïne). Environ 20 à 25 % d'une dose unique de nitrofurantoïne sont récupérés sous forme inchangée dans l'urine en 24 heures.
Les concentrations plasmatiques de nitrofurantoïne après une dose orale unique de la gélule de Macrobid à 100 mg sont faibles, avec des pics généralement inférieurs à 1 mcg/mL. La nitrofurantoïne est très soluble dans l'urine, à laquelle elle peut donner une couleur brune. Lorsque Macrobid est administré avec de la nourriture, la biodisponibilité de la nitrofurantoïne est augmentée d'environ 40 %.
Microbiologie
La nitrofurantoïne est un agent antimicrobien nitrofurane ayant une activité contre certaines bactéries Gram-positives et Gram-négatives.
Mécanisme d'action
Le mécanisme de l'action antimicrobienne de la nitrofurantoïne est inhabituel parmi les antibactériens. La nitrofurantoïne est réduite par les flavoprotéines bactériennes en intermédiaires réactifs qui inactivent ou altèrent les protéines ribosomiques bactériennes et d'autres macromolécules. À la suite de telles inactivations, les processus biochimiques vitaux de la synthèse des protéines, du métabolisme énergétique aérobie, de la synthèse de l'ADN, de la synthèse de l'ARN et de la synthèse de la paroi cellulaire sont inhibés. La nitrofurantoïne est bactéricide dans les urines aux doses thérapeutiques. La nature large de ce mode d'action peut expliquer l'absence de résistance bactérienne acquise à la nitrofurantoïne, car les mutations multiples et simultanées nécessaires des macromolécules cibles seraient probablement mortelles pour les bactéries.
Interactions avec d'autres antibiotiques
Un antagonisme a été démontré in vitro entre la nitrofurantoïne et les antimicrobiens quinolones. La signification clinique de cette découverte est inconnue.
Développement de la résistance
Le développement de la résistance à la nitrofurantoïne n'a pas été un problème significatif depuis son introduction en 1953. Aucune résistance croisée avec les antibiotiques et les sulfamides n'a été observée, et la résistance transférable est, tout au plus, un phénomène très rare.
La nitrofurantoïne s'est avérée active contre la plupart des souches des bactéries suivantes à la fois in vitro et dans les infections cliniques [voir INDICATIONS ET USAGE ):
Micro-organismes aérobies et facultatifs à Gram positif
Staphylococcus saprophyticus
Micro-organismes Gram-négatifs aérobies et facultatifs
Escherichia coli
Au moins 90 % des micro-organismes suivants présentent une concentration minimale inhibitrice (CMI) in vitro inférieure ou égale au seuil de sensibilité pour la nitrofurantoïne. Cependant, l'efficacité de la nitrofurantoïne dans le traitement des infections cliniques dues à ces micro-organismes n'a pas été établie dans des essais adéquats et bien contrôlés.
Micro-organismes aérobies et facultatifs à Gram positif
Staphylocoques à coagulase négative (y compris Staphylococcus epidermidis) Enterococcus faecalis Staphylococcus aureus Streptococcus aga/actiae
Streptocoques du groupe 0
Streptocoques du groupe Viridans
Micro-organismes Gram-négatifs aérobies et facultatifs :
Citrobacter ama/onaticus Citrobacter diversus Citrobacter freundii Klebsiella oxytoca Klebsiella ozaenae
La nitrofurantoïne n'est pas active contre la plupart des souches des espèces Proteus ou Serratia. Il n'a aucune activité contre les espèces de Pseudomonas.
Méthodes de test de sensibilité
Lorsqu'ils sont disponibles, le laboratoire de microbiologie clinique doit fournir au médecin les résultats cumulatifs des résultats des tests de sensibilité in vitro pour les médicaments antimicrobiens utilisés dans les hôpitaux résidents sous forme de rapports périodiques décrivant le profil de sensibilité des agents pathogènes nosocomiaux et d'origine communautaire. Ces rapports devraient aider le médecin à choisir l'antimicrobien le plus efficace.
Techniques de dilution : Des méthodes quantitatives sont utilisées pour déterminer les concentrations minimales inhibitrices (CMI) des antimicrobiens. Ces CMI fournissent des estimations de la sensibilité des bactéries aux composés antimicrobiens. Les CMI doivent être déterminées à l'aide d'une procédure normalisée. Les procédures standardisées sont basées sur une méthode de dilution (bouillon ou gélose) (1) ou équivalent avec des concentrations d'inoculum standardisées et des concentrations standardisées de poudre de nitrofurantoïne. Les valeurs de CMI doivent être interprétées selon les critères fournis dans le tableau 1.
Technique de diffusion : Les méthodes quantitatives qui nécessitent la mesure des diamètres de zone fournissent également des estimations reproductibles de la sensibilité des bactéries aux composés antimicrobiens. Une telle procédure standardisée (2) nécessite l'utilisation de concentrations d'inoculum standardisées. Cette procédure utilise des disques de papier imprégnés de 300 pg de nitrofurantoïne pour tester la sensibilité des micro-organismes à la nitrofurantoïne. Les critères d'interprétation de la diffusion du disque sont fournis dans le tableau 1.
Un rapport de Susceptible indique que l'agent pathogène est susceptible d'être inhibé si le composé antimicrobien dans l'urine atteint les concentrations habituellement réalisables. Un rapport d'intermédiaire indique que le résultat doit être considéré comme équivoque et, si le micro-organisme n'est pas entièrement sensible aux médicaments alternatifs cliniquement réalisables, le test doit être répété. Cette catégorie implique une applicabilité clinique possible dans des sites corporels où le médicament est physiologiquement concentré ou dans des situations où une dose élevée de médicament peut être utilisée. Cette catégorie fournit également une zone tampon, qui empêche les petits facteurs techniques incontrôlés de provoquer des divergences majeures dans l'interprétation. Un rapport de résistant indique que l'agent pathogène n'est pas susceptible d'être inhibé si le composé antimicrobien dans l'urine atteint les concentrations habituellement réalisables ; un autre traitement doit être choisi.
Contrôle de qualité: Les procédures de test de sensibilité standardisées nécessitent l'utilisation de micro-organismes de contrôle de la qualité pour contrôler les aspects techniques des procédures de test (3). La poudre de nitrofurantoïne standard doit fournir la plage de valeurs suivante indiquée dans le tableau 2.
Etudes cliniques
Des essais cliniques contrôlés comparant Macrobid 100 mg po q12h et Macrodantin 50 mg po q6h dans le traitement des infections urinaires aiguës non compliquées ont démontré une éradication microbiologique d'environ 75 % des agents pathogènes sensibles dans chaque groupe de traitement.
INFORMATIONS PATIENTS
Il doit être conseillé aux patients de prendre Macrobid 100 mg avec de la nourriture (idéalement le petit-déjeuner et le dîner) pour améliorer encore la tolérance et améliorer l'absorption du médicament. Les patients doivent être informés qu'ils doivent suivre le traitement complet ; cependant, ils doivent être avisés de contacter leur médecin si des symptômes inhabituels surviennent pendant le traitement.
Les patients doivent être avertis de ne pas utiliser de préparations antiacides contenant du trisilicate de magnésium pendant la prise de Macrobid.
Les patients doivent être informés que les médicaments antibactériens, y compris Macrobid, ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsque Macrobid 100 mg est prescrit pour traiter une infection bactérienne, les patients doivent être informés que même s'il est courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut (1) diminuer l'efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne puissent pas être traitées par Macrobid ou d'autres médicaments antibactériens à l'avenir.
La diarrhée est un problème courant causé par les antibiotiques qui se termine généralement lorsque l'antibiotique est arrêté. Parfois, après le début du traitement aux antibiotiques, les patients peuvent développer des selles liquides et sanglantes (avec ou sans crampes d'estomac et fièvre) même deux mois ou plus après avoir pris la dernière dose de l'antibiotique. Si cela se produit, les patients doivent contacter leur médecin dès que possible.
