Biaxin 250mg, 500mg Clarithromycin Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Biaxin 500 mg et comment est-il utilisé ?
Biaxin est un médicament d'ordonnance utilisé pour traiter les symptômes de nombreuses infections bactériennes différentes, y compris les ulcères d'estomac et Helicobacter pylori. Biaxin peut être utilisé seul ou avec d'autres médicaments.
Biaxin 500mg est un antibiotique.
On ne sait pas si Biaxin est sûr et efficace chez les enfants de moins de 6 mois.
Quels sont les effets secondaires possibles de Biaxin 250mg ?
Biaxin 500 mg peut provoquer des effets secondaires graves, notamment :
- fortes douleurs à l'estomac,
- diarrhée contenant du sang,
- battements de cœur rapides ou battants,
- flottant dans ta poitrine,
- essoufflement,
- vertiges soudains,
- confusion,
- sensation de rotation,
- perte d'appétit,
- douleur dans le haut du ventre,
- fatigue,
- urine foncée,
- tabouret de couleur argile,
- jaunissement des yeux et de la peau (jaunisse),
- peu ou pas d'urine,
- gonflement des pieds ou des chevilles,
- se sentir fatigué,
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Biaxin incluent :
- Douleur d'estomac,
- nausée,
- vomissement,
- diarrhée,
- goût inhabituel ou désagréable dans la bouche,
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Biaxin. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
La clarithromycine est un antimicrobien macrolide semi-synthétique à usage oral. Chimiquement, il s'agit de la 6-0méthylérythromycine. La formule moléculaire est C38H69NO13 et le poids moléculaire est de 747,96. La formule structurale est :
Figure 1 : Structure de la clarithromycine
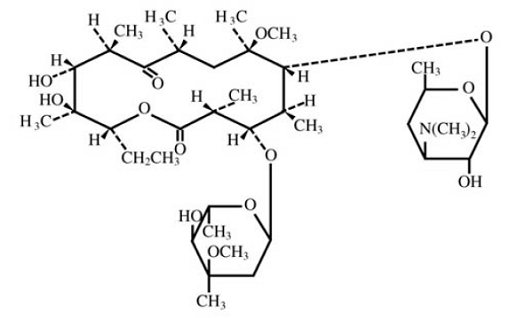
La clarithromycine est une poudre cristalline blanche à blanc cassé. Il est soluble dans l'acétone, légèrement soluble dans le méthanol, l'éthanol et l'acétonitrile, et pratiquement insoluble dans l'eau.
BIAXIN est disponible sous forme de comprimés à libération immédiate, de comprimés à libération prolongée et de granulés pour suspension buvable.
Chaque comprimé pelliculé jaune ovale à libération immédiate de BIAXIN Filmtab (comprimés de clarithromycine, USP) contient 250 mg ou 500 mg de clarithromycine et les ingrédients inactifs suivants :
- Comprimés de 250 mg : hypromellose, hydroxypropylcellulose, croscarmellose sodique, D&C jaune n° 10, FD&C bleu n° 1, stéarate de magnésium, cellulose microcristalline, povidone, amidon prégélatinisé, propylène glycol, dioxyde de silicium, acide sorbique, monooléate de sorbitan, acide stéarique, talc, dioxyde de titane et vanilline.
- Comprimés de 500 mg : hypromellose, hydroxypropylcellulose, dioxyde de silice colloïdale, croscarmellose sodique, D&C jaune n° 10, stéarate de magnésium, cellulose microcristalline, povidone, propylène glycol, acide sorbique, monooléate de sorbitan, dioxyde de titane et vanilline.
Chaque comprimé pelliculé ovale jaune BIAXIN XL Filmtab (comprimés à libération prolongée de clarithromycine) contient 500 mg de clarithromycine et les ingrédients inactifs suivants : polymères cellulosiques, D&C jaune n° 10, lactose monohydraté, stéarate de magnésium, propylène glycol, acide sorbique, sorbitan monooléate, talc, dioxyde de titane et vanilline.
Chaque 5 mL de suspension reconstituée BIAXIN 500 mg (clarithromycine pour suspension buvable, USP) contient 125 mg ou 250 mg de clarithromycine. Chaque bouteille de granules BIAXIN contient 1250 mg (format 50 mL), 2500 mg (formats 50 et 100 mL) ou 5000 mg (format 100 mL) de clarithromycine et les ingrédients inactifs suivants : carbomère, huile de ricin, acide citrique, phtalate d'hypromellose, maltodextrine, sorbate de potassium, povidone, dioxyde de silicium, saccharose, gomme xanthane, dioxyde de titane et arôme punch aux fruits.
LES INDICATIONS
Exacerbation bactérienne aiguë de la bronchite chronique
BIAXIN (Filmtab, Granules) et BIAXIN XL Filmtab sont indiqués chez les adultes pour le traitement des infections légères à modérées causées par des isolats sensibles dus à Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella catarrhalis ou Streptococcus pneumoniae [voir INDICATIONS ET USAGE ].
Sinusite maxillaire aiguë
BIAXIN (Filmtab, Granules) et BIAXIN 500 mg XL Filmtab (chez l'adulte) sont indiqués pour le traitement des infections légères à modérées causées par des isolats sensibles dus à Haemophilus influenzae, Moraxella catarrhalis ou Streptococcus pneumoniae [voir INDICATIONS ET USAGE ].
Pneumonie communautaire
BIAXIN (Filmtab, Granulés) et BIAXIN XL Filmtab sont indiqués [voir INDICATIONS ET USAGE ] pour le traitement des infections légères à modérées causées par des isolats sensibles dus à :
- Haemophilus influenzae (chez l'adulte)
- Haemophilus parainfluenzae (BIAXIN 500mg XL Filmtab chez l'adulte)
- Moraxella catarrhalis (BIAXIN 250mg XL Filmtab chez l'adulte)
- Mycoplasma pneumoniae, Streptococcus pneumoniae, Chlamydophila pneumoniae (BIAXIN 500mg XL Filmtab [chez l'adulte] ; BIAXIN Filmtab et BIAXIN Granules [chez l'adulte et l'enfant])
Pharyngite/amygdalite
BIAXIN 500mg Filmtab et BIAXIN 500mg Granules sont indiqués pour le traitement des infections légères à modérées causées par des isolats sensibles dus à Streptococcus pyogenes comme alternative chez les personnes qui ne peuvent pas utiliser le traitement de première ligne.
Infections non compliquées de la peau et des structures cutanées
BIAXIN Filmtab et BIAXIN Granules sont indiqués pour le traitement des infections légères à modérées causées par des isolats sensibles dus à Staphylococcus aureus ou Streptococcus pyogenes.
Otite moyenne aiguë
BIAXIN Filmtab et BIAXIN 250mg Granules sont indiqués chez les patients pédiatriques pour le traitement des infections légères à modérées causées par des isolats sensibles dus à Haemophilus influenzae, Moraxella catarrhalis ou Streptococcus pneumoniae [voir Etudes cliniques ].
Traitement et prophylaxie des infections mycobactériennes disséminées
BIAXIN 500mg Filmtab et BIAXIN 250mg Granules sont indiqués pour le traitement des infections légères à modérées causées par des isolats sensibles dus à Mycobacterium avium ou Mycobacterium intracellulare chez les patients présentant une infection à VIH avancée [voir Etudes cliniques ].
Infection à Helicobacter Pylori et ulcère duodénal
BIAXIN 250mg Filmtab est administré en association avec d'autres médicaments chez l'adulte comme décrit ci-dessous pour éradiquer H. pylori. Il a été démontré que l'éradication de H. pylori réduit le risque de récidive de l'ulcère duodénal [voir Etudes cliniques ].
- BIAXIN Filmtab en association avec l'amoxicilline et les gélules à libération retardée PREVACID (lansoprazole) ou PRILOSEC (oméprazole), en trithérapie, est indiqué pour le traitement des patients atteints d'une infection à H. pylori et d'un ulcère duodénal (actif ou ayant des antécédents de cinq ans d'infection duodénale). ulcère) pour éradiquer H. pylori.
- BIAXIN 250 mg Filmtab en association avec PRILOSEC (oméprazole) gélules est indiqué pour le traitement des patients présentant un ulcère duodénal actif associé à une infection à H. pylori. Les régimes qui contiennent BIAXIN 250mg Filmtab comme seul agent antibactérien sont plus susceptibles d'être associés au développement d'une résistance à la clarithromycine chez les patients qui échouent au traitement. Les schémas thérapeutiques contenant de la clarithromycine ne doivent pas être utilisés chez les patients présentant des isolats résistants à la clarithromycine connus ou suspectés, car l'efficacité du traitement est réduite dans ce contexte.
Limites d'utilisation
BIAXIN 500 mg XL Filmtab est indiqué uniquement pour la sinusite maxillaire aiguë, l'exacerbation bactérienne aiguë de la bronchite chronique et la pneumonie communautaire chez l'adulte. L'efficacité et la sécurité de BIAXIN 500 mg XL Filmtab dans le traitement d'autres infections pour lesquelles BIAXIN Filmtab et BIAXIN Granules sont approuvés n'ont pas été établies.
Il existe une résistance aux macrolides dans certaines infections bactériennes causées par Streptococcus pneumoniae et Staphylococcus aureus. Les tests de sensibilité doivent être effectués lorsqu'ils sont cliniquement indiqués.
Usage
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l'efficacité de BIAXIN et d'autres médicaments antibactériens, BIAXIN ne doit être utilisé que pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu'elles sont causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte lors de la sélection ou de la modification du traitement antibactérien. En l'absence de telles données, l'épidémiologie locale et les schémas de sensibilité peuvent contribuer à la sélection empirique du traitement.
DOSAGE ET ADMINISTRATION
Instructions d'administration importantes
BIAXIN Filmtab et BIAXIN 250mg Granules peuvent être administrés avec ou sans nourriture.
BIAXIN XL Filmtab doit être pris avec de la nourriture. Avalez BIAXIN 500mg XL Filmtab entier; ne pas mâcher, casser ou écraser BIAXIN 500mg XL Filmtab.
Posologie adulte
Les posologies recommandées de BIAXIN 250mg Filmtab et BIAXIN 250mg XL Filmtab pour le traitement des infections légères à modérées chez l'adulte sont listées dans le tableau 1.
Schémas posologiques combinés pour l'infection à H. pylori
- Trithérapie : BIAXIN 500mg Filmtab/lansoprazole/amoxicilline La posologie recommandée pour les adultes est de 500 mg de BIAXIN 500 mg Filmtab, 30 mg de lansoprazole et 1 gramme d'amoxicilline, tous administrés toutes les 12 heures pendant 10 ou 14 jours [voir INDICATIONS ET USAGE et Etudes cliniques ].
- Trithérapie : BIAXIN Filmtab/oméprazole/amoxicilline La posologie recommandée pour les adultes est de 500 mg de BIAXIN 250 mg Filmtab, 20 mg d'oméprazole et 1 gramme d'amoxicilline ; tous donnés toutes les 12 heures pendant 10 jours. Chez les patients présentant un ulcère au moment de l'initiation du traitement, 18 jours supplémentaires d'oméprazole 20 mg une fois par jour sont recommandés pour la cicatrisation de l'ulcère et le soulagement des symptômes [voir INDICATIONS ET USAGE et Etudes cliniques ].
- Bithérapie : BIAXIN 500mg Filmtab/oméprazole La posologie recommandée pour un adulte est de 500 mg de BIAXIN 250 mg Filmtab administré toutes les 8 heures et de 40 mg d'oméprazole administré une fois par matin pendant 14 jours. 14 jours supplémentaires d'oméprazole 20 mg une fois par jour sont recommandés pour la cicatrisation des ulcères et le soulagement des symptômes [voir INDICATIONS ET USAGE et Etudes cliniques ].
Posologie pédiatrique
La posologie quotidienne recommandée est de 15 mg/kg/jour répartis toutes les 12 heures pendant 10 jours (jusqu'à la dose adulte). Se référer aux schémas posologiques pour les infections mycobactériennes chez les patients pédiatriques pour des informations posologiques supplémentaires [voir Schémas posologiques pour les infections mycobactériennes ].
Schémas posologiques pour les infections mycobactériennes
Pour le traitement de l'infection disséminée due au complexe Mycobacterium avium (MAC), BIAXIN Filmtab et BIAXIN 500mg Granules sont recommandés comme agents principaux. BIAXIN Filmtab et BIAXIN Granules doivent être utilisés en association avec d'autres médicaments antimycobactériens (par exemple, l'éthambutol) qui ont montré une activité in vitro contre le MAC ou un bénéfice clinique dans le traitement du MAC [voir Etudes cliniques ].
Patients adultes
Pour le traitement et la prophylaxie des infections mycobactériennes chez l'adulte, la dose recommandée de BIAXIN est de 500 mg toutes les 12 heures.
Patients pédiatriques
Pour le traitement et la prophylaxie des infections mycobactériennes chez les patients pédiatriques, la dose recommandée est de 7,5 mg/kg toutes les 12 heures jusqu'à 500 mg toutes les 12 heures. [Voir Utilisation dans des populations spécifiques et Etudes cliniques ].
Le traitement par BIAXIN 250 mg doit être poursuivi si une réponse clinique est observée. BIAXIN peut être arrêté lorsque le patient est considéré comme à faible risque d'infection disséminée.
Ajustement posologique chez les patients atteints d'insuffisance rénale
Voir le tableau 2 pour l'ajustement posologique chez les patients présentant une insuffisance rénale modérée ou sévère avec ou sans traitement concomitant contenant de l'atazanavir ou du ritonavir [voir INTERACTIONS MÉDICAMENTEUSES ].
Ajustement posologique en raison d'interactions médicamenteuses
Diminuer la dose de BIAXIN 500 mg de 50 % en cas de co-administration avec l'atazanavir [voir INTERACTIONS MÉDICAMENTEUSES ]. Des ajustements posologiques pour d'autres médicaments lorsqu'ils sont co-administrés avec BIAXIN 250 mg peuvent être recommandés en raison d'interactions médicamenteuses [voir INTERACTIONS MÉDICAMENTEUSES ].
Reconstitution De Granules BIAXIN
Les granulés BIAXIN 250 mg fournis doivent être reconstitués avec de l'eau avant l'administration de BIAXIN pour suspension buvable. Le tableau 3 ci-dessous indique le volume d'eau à ajouter lors de la reconstitution. A reconstituer :
Bien agiter avant chaque utilisation. Après mélange, conserver entre 15° et 30°C (59° et 86°F) et utiliser dans les 14 jours. Ne pas réfrigérer.
COMMENT FOURNIE
Formes posologiques et points forts
BIAXIN 500mg est disponible en :
- BIAXIN 250mg Filmtab (comprimé pelliculé ovale jaune) :
- 250 mg : imprimé en bleu avec le logo « a » et KT
- 500 mg : gravé avec le logo « a » d'un côté et KL de l'autre côté
- BIAXIN XL Filmtab (comprimé pelliculé ovale jaune à libération prolongée) :
- 500 mg : gravé avec le logo « a » et KJ
- BIAXIN Granulés (granulés blancs à blanc cassé avant reconstitution ; suspension opaque blanche à blanc cassé après reconstitution) :
- Concentration de 125 mg/5 mL disponible en flacons de 50 mL et 100 mL
- Concentration de 250 mg/5 ml disponible en flacons de 50 ml et 100 ml
Stockage et manutention
BIAXIN 250mg Filmtab (comprimés de clarithromycine, USP) est fourni sous forme de comprimés pelliculés ovales jaunes dans les conditionnements suivants : Comprimés de 250 mg : (imprimés en bleu avec le logo « a » et KT)
Bouteilles de 60 ( CDN 0074-3368-60) et des paquets de bandelettes à dose unitaire de 100 ( CDN 0074-3368-11).
Conservez BIAXIN Filmtab 250 mg à température ambiante contrôlée entre 15° et 30°C (59° et 86°F) dans un récipient bien fermé. Protéger de la lumière.
Comprimés de 500 mg : (en creux avec le logo "a" d'un côté et KL de l'autre côté)
Flacons de 60 (NDC 0074-2586-60) et paquets de bandelettes à dose unitaire de 100 ( CDN 0074-2586-11).
Conservez BIAXIN Filmtab 500 mg à température ambiante contrôlée entre 20° et 25°C (68° et 77°F) dans un récipient bien fermé.
BIAXIN XL Filmtab (comprimés à libération prolongée de clarithromycine) est fourni sous forme de comprimés pelliculés ovales jaunes dans les conditionnements suivants :
Comprimés de 500 mg : (en creux avec le logo "a" et KJ)
Flacons de 60 (NDC 0074-3165-60), paquets de bandelettes à dose unitaire de 100 ( CDN 0074-3165-11), et BIAXIN XL PAC carton de 4 plaquettes thermoformées de 14 comprimés chacune ( CDN 0074-3165-41).
Conservez BIAXIN 500mg XL Filmtab entre 20° et 25°C (68° et 77°F). Excursions autorisées jusqu'à 15° à 30°C (59° à 86°F). [Voir Température ambiante contrôlée USP .]
BIAXIN 500mg Granulés (clarithromycine pour suspension buvable, USP) est fourni sous forme de granulés blancs à blanc cassé dans les dosages et tailles suivants :
Conservez BIAXIN 500mg Granules en dessous de 25°C (77°F) dans un récipient bien fermé. Ne pas réfrigérer les granules reconstituées de BIAXIN 500mg.
BIAXIN Filmtab 250 mg et 500 mg et BIAXIN 250 mg XL Filmtab 500 mg Mfd. par AbbVie LTD, Barceloneta, PR 00617. Granules BIAXIN, 125 mg/5 mL et 250 mg/5 mL Mfd. par AbbVie Inc., North Chicago, IL 60064 Pour AbbVie Inc., North Chicago, IL 60064, États-Unis Révision : novembre 2018.
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont décrits ci-dessous et ailleurs dans l'étiquetage :
- Réactions d'hypersensibilité aiguë [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Allongement de l'intervalle QT [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hépatotoxicité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions indésirables graves dues à l'utilisation concomitante avec d'autres médicaments [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Diarrhée associée à Clostridium difficile [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Exacerbation de la myasthénie grave [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les études cliniques sont menées dans des conditions très variables, les taux d'effets indésirables observés dans les études cliniques d'un médicament ne peuvent pas être directement comparés aux taux des études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Sur la base des données regroupées pour toutes les indications, les effets indésirables les plus fréquents chez les populations adultes et pédiatriques observés dans les essais cliniques sont les douleurs abdominales, la diarrhée, les nausées, les vomissements et la dysgueusie. Ont également été signalés de la dyspepsie, des tests de la fonction hépatique anormaux, une réaction anaphylactique, une candidose, des maux de tête, de l'insomnie et des éruptions cutanées.
Les sous-sections suivantes énumèrent les effets indésirables les plus courants pour la prophylaxie et le traitement des infections mycobactériennes et de l'ulcère duodénal associés à l'infection à H. pylori. En général, ces profils sont cohérents avec les données regroupées décrites ci-dessus.
Prophylaxie des infections mycobactériennes
Chez les patients atteints du SIDA traités avec BIAXIN pendant de longues périodes pour la prophylaxie contre M. avium, il était souvent difficile de distinguer les effets indésirables éventuellement associés à l'administration de BIAXIN d'une maladie à VIH sous-jacente ou d'une maladie intercurrente. La durée médiane de traitement a été de 10,6 mois pour le groupe BIAXIN et de 8,2 mois pour le groupe placebo.
Changements dans les valeurs de laboratoire
Des expériences indésirables de laboratoire sélectionnées qui ont été signalées au cours du traitement chez plus de 2 % des patients adultes traités par BIAXIN dans un essai clinique randomisé en double aveugle impliquant 682 patients sont présentées dans le tableau 5.
Chez les patients immunodéprimés recevant une prophylaxie contre M. avium, les évaluations des valeurs de laboratoire ont été faites en analysant les valeurs en dehors de la valeur sérieusement anormale (c'est-à-dire la limite haute ou basse extrême) pour le test spécifié.
Traitement des infections mycobactériennes
Les profils d'effets indésirables pour les schémas posologiques de 500 mg et de 1 000 mg deux fois par jour étaient similaires.
Chez les patients atteints du SIDA et d'autres patients immunodéprimés traités avec des doses plus élevées de BIAXIN pendant de longues périodes pour des infections mycobactériennes, il était souvent difficile de distinguer les effets indésirables éventuellement associés à l'administration de BIAXIN 250 mg des signes sous-jacents de la maladie à VIH ou d'une maladie intercurrente.
L'analyse suivante résume l'expérience au cours des 12 premières semaines de traitement par BIAXIN. Les données sont rapportées séparément pour l'essai 1 (randomisé, en double aveugle) et l'essai 2 (en ouvert, à usage compassionnel) et également combinées. Les effets indésirables ont été signalés moins fréquemment dans l'essai 2, ce qui peut être dû en partie aux différences de surveillance entre les deux études.
Chez les patients adultes recevant BIAXIN 500 mg deux fois par jour, les effets indésirables les plus fréquemment rapportés, considérés comme possiblement ou potentiellement liés au médicament à l'étude, avec une incidence de 5 % ou plus, sont énumérés ci-dessous (Tableau 6). Environ 8 % des patients ayant reçu 500 mg deux fois par jour et 12 % des patients ayant reçu 1 000 mg deux fois par jour ont arrêté le traitement en raison d'effets indésirables liés au médicament au cours des 12 premières semaines de traitement ; les effets indésirables ayant conduit à l'arrêt du traitement chez au moins 2 patients comprenaient des nausées, des vomissements, des douleurs abdominales, de la diarrhée, des éruptions cutanées et une asthénie.
Un nombre limité de patients pédiatriques atteints du SIDA ont été traités avec la suspension BIAXIN pour des infections mycobactériennes. Les effets indésirables les plus fréquemment rapportés, à l'exclusion de ceux dus aux affections concomitantes du patient, correspondaient à ceux observés chez les patients adultes.
Changements dans les valeurs de laboratoire
Au cours des 12 premières semaines suivant le début de BIAXIN 500 mg deux fois par jour, 3 % des patients ont des augmentations de SGOT et 2 % des patients ont des augmentations de SGPT > 5 fois la limite supérieure de la normale dans l'essai 2 (469 patients adultes inscrits) tandis que l'essai 1 (154 patients inclus) n'avaient pas d'élévation des transaminases. Cela inclut uniquement les patients dont les valeurs de base se situent dans la plage normale ou limite basse.
Ulcère duodénal associé à une infection à H. pylori
Dans les essais cliniques utilisant une association thérapeutique avec BIAXIN 500 mg plus oméprazole et amoxicilline, aucun effet indésirable spécifique à l'association de ces médicaments n'a été observé. Les effets indésirables survenus se sont limités à ceux qui ont été précédemment rapportés avec BIAXIN 250 mg, l'oméprazole ou l'amoxicilline.
Les profils d'effets indésirables sont présentés ci-dessous (tableau 7) pour quatre essais cliniques randomisés en double aveugle dans lesquels les patients ont reçu l'association de BIAXIN 500 mg trois fois par jour et d'oméprazole 40 mg par jour pendant 14 jours, suivis d'oméprazole 20 mg une fois par jour. jour (trois études) ou 40 mg une fois par jour (une étude) pendant 14 jours supplémentaires. Sur les 346 patients qui ont reçu l'association, 3,5 % des patients ont arrêté le médicament en raison d'effets indésirables.
Changements dans les valeurs de laboratoire
Les changements dans les valeurs de laboratoire avec une signification clinique possible chez les patients prenant BIAXIN et l'oméprazole dans quatre essais randomisés en double aveugle chez 945 patients sont les suivants :
Hépatique bilirubine directe élevée
Effets indésirables moins fréquents observés au cours des essais cliniques sur la clarithromycine
Sur la base des données regroupées pour toutes les indications, les effets indésirables suivants ont été observés dans les essais cliniques avec la clarithromycine à un taux inférieur à 1 % :
Troubles du système sanguin et lymphatique : Leucopénie, neutropénie, thrombocytémie, éosinophilie
Troubles cardiaques : Allongement de l'intervalle QT à l'électrocardiogramme, arrêt cardiaque, fibrillation auriculaire, extrasystoles, palpitations
Troubles de l'oreille et du labyrinthe : Vertiges, acouphènes, malentendants
Problèmes gastro-intestinaux: Stomatite, glossite, œsophagite, reflux gastro-œsophagien, gastrite, proctalgie, distension abdominale, constipation, bouche sèche, éructation, flatulence
Troubles généraux et conditions au site d'administration : Malaise, pyrexie, asthénie, douleurs thoraciques, frissons, fatigue
Troubles hépatobiliaires : Cholestase, hépatite
Troubles du système immunitaire : Hypersensibilité
Infections et infestations : Cellulite, gastro-entérite, infection, infection vaginale
Enquêtes : Augmentation de la bilirubine sanguine, augmentation de la phosphatase alcaline sanguine, augmentation de la lactate déshydrogénase sanguine, rapport albumine/globuline anormal
Troubles du métabolisme et de la nutrition : Anorexie, diminution de l'appétit
Troubles musculosquelettiques et du tissu conjonctif : Myalgies, spasmes musculaires, rigidité nucale
Troubles du système nerveux : Étourdissements, tremblements, perte de conscience, dyskinésie, somnolence
Troubles psychiatriques: Anxiété, nervosité
Troubles rénaux et urinaires : Augmentation de la créatinine sanguine, augmentation de l'urée sanguine
Troubles respiratoires, thoraciques et médiastinaux : Asthme, épistaxis, embolie pulmonaire
Troubles de la peau et du tissu sous-cutané : Urticaire, dermatite bulleuse, prurit, hyperhidrose, éruption maculo-papuleuse
Effets indésirables gastro-intestinaux
Dans les études sur l'exacerbation aiguë de la bronchite chronique et de la sinusite maxillaire aiguë, des effets indésirables gastro-intestinaux globaux ont été signalés par une proportion similaire de patients prenant BIAXIN 250 mg Filmtab ou BIAXIN 500 mg XL Filmtab ; cependant, les patients prenant BIAXIN 500 mg XL Filmtab ont signalé des symptômes gastro-intestinaux significativement moins graves que les patients prenant BIAXIN 250 mg Filmtab. De plus, les patients prenant BIAXIN 500 mg XL Filmtab ont eu significativement moins d'arrêts prématurés pour des effets indésirables gastro-intestinaux ou de goût anormal liés au médicament par rapport à BIAXIN Filmtab.
Mortalité toutes causes confondues chez les patients atteints de maladie coronarienne 1 à 10 ans après l'exposition à BIAXIN
Dans un essai clinique évaluant le traitement par la clarithromycine sur les résultats chez les patients atteints de maladie coronarienne, une augmentation du risque de mortalité toutes causes confondues a été observée chez les patients randomisés pour la clarithromycine. La clarithromycine pour le traitement de la coronaropathie n'est pas une indication approuvée. Les patients ont été traités avec de la clarithromycine ou un placebo pendant 14 jours et ont été observés pour les principaux événements (p. ex., mortalité toutes causes confondues ou événements cardiaques non mortels) pendant plusieurs années.1 observé avec un rapport de risque de 1,06 (intervalle de confiance à 95 % 0,98 à 1,14). Cependant, lors du suivi 10 ans après le traitement, il y a eu 866 (40 %) décès dans le groupe clarithromycine et 815 (37 %) décès dans le groupe placebo, ce qui représentait un risque relatif de mortalité toutes causes confondues de 1,10 (95 % intervalle de confiance 1,00 à 1,21). La différence dans le nombre de décès est apparue après un an ou plus après la fin du traitement.
La cause de la différence de mortalité toutes causes confondues n'a pas été établie. D'autres études épidémiologiques évaluant ce risque ont montré des résultats variables [voir AVERTISSEMENTS ET PRECAUTIONS ].
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de BIAXIN. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Système sanguin et lymphatique : Thrombocytopénie, agranulocytose
Cardiaque: Arythmie ventriculaire, tachycardie ventriculaire, torsades de pointes
Oreille et labyrinthe : La surdité a été signalée principalement chez les femmes âgées et était généralement réversible.
Gastro-intestinal : Une pancréatite aiguë, une décoloration de la langue, une décoloration des dents ont été signalées et étaient généralement réversibles avec un nettoyage professionnel à l'arrêt du médicament.
Des cas de BIAXIN 250mg XL Filmtab dans les selles ont été rapportés, dont beaucoup sont survenus chez des patients présentant des troubles gastro-intestinaux anatomiques (y compris iléostomie ou colostomie) ou fonctionnels avec des temps de transit GI raccourcis. Dans plusieurs rapports, des résidus de comprimés sont survenus dans le cadre de diarrhées. Il est recommandé que les patients qui présentent des résidus de comprimés dans les selles et aucune amélioration de leur état soient remplacés par une autre formulation de clarithromycine (par exemple une suspension) ou un autre médicament antibactérien.
Hépatobiliaire : Insuffisance hépatique, ictère hépatocellulaire. Des effets indésirables liés à un dysfonctionnement hépatique ont été rapportés avec la clarithromycine [voir AVERTISSEMENTS ET PRECAUTIONS ].
Infections et infestations : Colite pseudomembraneuse [voir AVERTISSEMENTS ET PRECAUTIONS ]
Système immunitaire: Réactions anaphylactiques, œdème de Quincke
Enquêtes : Temps de prothrombine prolongé, nombre de globules blancs diminué, rapport normalisé international augmenté. Une coloration anormale des urines a été rapportée, associée à une insuffisance hépatique.
Métabolisme et nutrition : Des cas d'hypoglycémie ont été signalés chez des patients prenant des hypoglycémiants oraux ou de l'insuline.
Tissu musculo-squelettique et conjonctif : Une rhabdomyolyse myopathique a été rapportée et dans certains rapports, la clarithromycine a été administrée en concomitance avec des statines, des fibrates, de la colchicine ou de l'allopurinol [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Système nerveux: Parosmie, anosmie, agueusie, paresthésie et convulsions
Psychiatrique: Comportement anormal, état confusionnel, dépersonnalisation, désorientation, hallucination, dépression, comportement maniaque, rêve anormal, trouble psychotique. Ces troubles disparaissent généralement à l'arrêt du médicament.
Rénal et urinaire : Néphrite interstitielle, insuffisance rénale
Peau et tissus sous-cutanés : Syndrome de Stevens-Johnson, nécrolyse épidermique toxique, éruption médicamenteuse avec éosinophilie et symptômes systémiques (DRESS), purpura d'Henoch-Schonlein, acné, pustulose exanthématique aiguë généralisée
Vasculaire: Hémorragie
INTERACTIONS MÉDICAMENTEUSES
La co-administration de BIAXIN 250 mg est connue pour inhiber le CYP3A, et un médicament principalement métabolisé par le CYP3A peut être associé à des élévations des concentrations du médicament qui pourraient augmenter ou prolonger les effets thérapeutiques et indésirables du médicament concomitant.
BIAXIN doit être utilisé avec prudence chez les patients recevant un traitement avec d'autres médicaments connus pour être des substrats enzymatiques du CYP3A, en particulier si le substrat du CYP3A a une marge de sécurité étroite (par exemple, la carbamazépine) et/ou si le substrat est largement métabolisé par cette enzyme. Ajuster la posologie si nécessaire et surveiller de près les concentrations sériques des médicaments principalement métabolisés par le CYP3A chez les patients recevant simultanément de la clarithromycine.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Réactions d'hypersensibilité aiguë
En cas de réactions d'hypersensibilité aiguës sévères, telles qu'anaphylaxie, syndrome de Stevens-Johnson, nécrolyse épidermique toxique, éruption médicamenteuse avec éosinophilie et symptômes systémiques (DRESS), purpura d'Henoch-Schonlein et pustulose exanthématique aiguë généralisée, interrompre immédiatement le traitement par BIAXIN 250 mg et mettre en place un traitement adapté.
Allongement de l'intervalle QT
BIAXIN 500 mg a été associé à un allongement de l'intervalle QT et à des cas peu fréquents d'arythmie. Des cas de torsades de pointes ont été rapportés spontanément lors de la surveillance post-commercialisation chez des patients recevant BIAXIN. Des décès ont été signalés.
Éviter BIAXIN chez les patients suivants :
- patients présentant un allongement connu de l'intervalle QT, une arythmie cardiaque ventriculaire, y compris des torsades de pointes
- les patients recevant des médicaments connus pour allonger l'intervalle QT [voir aussi CONTRE-INDICATIONS ]
- les patients présentant des affections proarythmiques en cours telles qu'une hypokaliémie ou une hypomagnésémie non corrigée, une bradycardie cliniquement significative et chez les patients recevant des antiarythmiques de classe IA (par exemple, quinidine, procaïnamide, disopyramide) ou de classe III (par exemple, dofétilide, amiodarone, sotalol).
Les patients âgés peuvent être plus sensibles aux effets associés aux médicaments sur l'intervalle QT [voir Utilisation dans des populations spécifiques ].
Hépatotoxicité
Un dysfonctionnement hépatique, y compris une augmentation des enzymes hépatiques et une hépatite hépatocellulaire et/ou cholestatique, avec ou sans ictère, ont été rapportés avec la clarithromycine. Ce dysfonctionnement hépatique peut être sévère et est généralement réversible. Dans certains cas, une insuffisance hépatique avec issue fatale a été signalée et a généralement été associée à des maladies sous-jacentes graves et/ou à des médicaments concomitants. Les symptômes de l'hépatite peuvent inclure l'anorexie, la jaunisse, l'urine foncée, le prurit ou l'abdomen douloureux. Arrêtez BIAXIN 500 mg immédiatement si des signes et symptômes d'hépatite apparaissent.
Réactions indésirables graves dues à l'utilisation concomitante avec d'autres médicaments
Médicaments métabolisés par le CYP3A4
Des effets indésirables graves ont été signalés chez des patients prenant BIAXIN en concomitance avec des substrats du CYP3A4. Ceux-ci incluent la toxicité de la colchicine avec la colchicine; rhabdomyolyse avec la simvastatine, la lovastatine et l'atorvastatine ; hypoglycémie et arythmies cardiaques (p. ex., torsades de pointes) avec le disopyramide ; hypotension et insuffisance rénale aiguë avec des inhibiteurs calciques métabolisés par le CYP3A4 (par exemple, vérapamil, amlodipine, diltiazem, nifédipine). La plupart des cas de lésions rénales aiguës avec des inhibiteurs calciques métabolisés par le CYP3A4 concernaient des patients âgés de 65 ans ou plus. Utilisez BIAXIN 500 mg avec prudence lorsqu'il est administré en même temps que des médicaments qui induisent l'enzyme cytochrome CYP3A4. L'utilisation de BIAXIN 250 mg avec la simvastatine, la lovastatine, l'ergotamine ou la dihydroergotamine est contre-indiquée [voir CONTRE-INDICATIONS et INTERACTIONS MÉDICAMENTEUSES ].
Colchicine
Des interactions médicamenteuses potentiellement mortelles et mortelles ont été signalées chez des patients traités par BIAXIN et la colchicine. La clarithromycine est un puissant inhibiteur du CYP3A4 et cette interaction peut se produire lors de l'utilisation des deux médicaments aux doses recommandées. Si la co-administration de BIAXIN et de colchicine est nécessaire chez des patients ayant une fonction rénale et hépatique normale, réduire la dose de colchicine. Surveiller les patients pour des symptômes cliniques de toxicité de la colchicine. L'administration concomitante de BIAXIN 500 mg et de colchicine est contre-indiquée chez les insuffisants rénaux ou hépatiques [voir CONTRE-INDICATIONS et INTERACTIONS MÉDICAMENTEUSES ].
Inhibiteurs de l'HMG-CoA réductase (statines)
L'utilisation concomitante de BIAXIN avec la lovastatine ou la simvastatine est contre-indiquée [voir CONTRE-INDICATIONS car ces statines sont largement métabolisées par le CYP3A4, et un traitement concomitant avec BIAXIN augmente leur concentration plasmatique, ce qui augmente le risque de myopathie, y compris de rhabdomyolyse. Des cas de rhabdomyolyse ont été rapportés chez des patients prenant BIAXIN en concomitance avec ces statines. Si le traitement par BIAXIN ne peut être évité, le traitement par la lovastatine ou la simvastatine doit être suspendu pendant la durée du traitement.
Soyez prudent lorsque vous prescrivez BIAXIN 250 mg avec de l'atorvastatine ou de la pravastatine. Dans les situations où l'utilisation concomitante de BIAXIN avec l'atorvastatine ou la pravastatine ne peut être évitée, la dose d'atorvastatine ne doit pas dépasser 20 mg par jour et la dose de pravastatine ne doit pas dépasser 40 mg par jour. L'utilisation d'une statine qui ne dépend pas du métabolisme du CYP3A (par exemple la fluvastatine) peut être envisagée. Il est recommandé de prescrire la dose la plus faible enregistrée si l'utilisation concomitante ne peut être évitée.
Agents hypoglycémiants oraux/Insuline
L'utilisation concomitante de BIAXIN 500 mg et d'hypoglycémiants oraux et/ou d'insuline peut entraîner une hypoglycémie importante. Avec certains médicaments hypoglycémiants tels que le natéglinide, la pioglitazone, le répaglinide et la rosiglitazone, l'inhibition de l'enzyme CYP3A par la clarithromycine peut être impliquée et entraîner une hypoglycémie en cas d'utilisation concomitante. Une surveillance attentive de la glycémie est recommandée [voir INTERACTIONS MÉDICAMENTEUSES ].
Quétiapine
Utiliser la quétiapine et la clarithromycine en concomitance avec prudence. La co-administration pourrait entraîner une augmentation de l'exposition à la quétiapine et des toxicités liées à la quétiapine telles que somnolence, hypotension orthostatique, altération de l'état de conscience, syndrome malin des neuroleptiques et allongement de l'intervalle QT. Se référer aux informations de prescription de la quétiapine pour des recommandations sur la réduction de la dose en cas de co-administration avec des inhibiteurs du CYP3A4 tels que la clarithromycine [voir INTERACTIONS MÉDICAMENTEUSES ].
Anticoagulants oraux
Il existe un risque d'hémorragie grave et d'élévations significatives de l'INR et du temps de prothrombine lorsque BIAXIN est co-administré avec la warfarine. Surveiller fréquemment l'INR et le temps de prothrombine pendant que les patients reçoivent simultanément BIAXIN et des anticoagulants oraux [voir INTERACTIONS MÉDICAMENTEUSES ].
Benzodiazépines
Une sédation accrue et une prolongation de la sédation ont été rapportées lors de l'administration concomitante de BIAXIN 250 mg et de triazolobenzodiazépines, telles que le triazolam et le midazolam [voir INTERACTIONS MÉDICAMENTEUSES ].
Mortalité toutes causes confondues chez les patients atteints de maladie coronarienne 1 à 10 ans après l'exposition à BIAXIN
Dans un essai clinique évaluant le traitement par la clarithromycine sur les résultats chez les patients atteints de maladie coronarienne, une augmentation du risque de mortalité toutes causes confondues un an ou plus après la fin du traitement a été observée chez les patients randomisés pour recevoir de la clarithromycine.1 La clarithromycine pour le traitement de la coronaropathie la maladie artérielle n'est pas une indication approuvée. La cause du risque accru n'a pas été établie. D'autres études épidémiologiques évaluant ce risque ont montré des résultats variables [voir EFFETS INDÉSIRABLES ]. Envisagez d'équilibrer ce risque potentiel avec les avantages du traitement lors de la prescription de BIAXIN chez les patients chez qui une maladie coronarienne est suspectée ou confirmée.
Diarrhée associée à Clostridium difficile
Des diarrhées associées à Clostridium difficile (DACD) ont été signalées avec l'utilisation de presque tous les agents antibactériens, y compris BIAXIN, et leur gravité peut varier d'une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens altère la flore normale du côlon, entraînant une prolifération de C. difficile.
C. difficile produit les toxines A et B qui contribuent au développement de CDAD. Les souches de C. difficile productrices d'hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée suite à l'utilisation d'antibactériens. Des antécédents médicaux minutieux sont nécessaires car il a été rapporté que la DACD survient plus de deux mois après l'administration d'agents antibactériens.
Si la CDAD est suspectée ou confirmée, l'utilisation continue d'antibactériens non dirigés contre C. difficile peut devoir être interrompue. Une gestion appropriée des liquides et des électrolytes, une supplémentation en protéines, un traitement antibactérien de C. difficile et une évaluation chirurgicale doivent être institués selon les indications cliniques.
Toxicité embryofœtale
La clarithromycine ne doit pas être utilisée chez la femme enceinte, sauf dans des circonstances cliniques où aucune autre thérapie n'est appropriée. Si BIAXIN 500 mg est utilisé pendant la grossesse, ou si une grossesse survient pendant que la patiente prend ce médicament, la patiente doit être informée du danger potentiel pour le fœtus. La clarithromycine a démontré des effets indésirables sur l'issue de la grossesse et/ou le développement embryo-fœtal chez les singes, les rats, les souris et les lapins à des doses produisant des taux plasmatiques de 2 à 17 fois les taux sériques atteints chez les humains traités aux doses humaines maximales recommandées [voir Utilisation dans des populations spécifiques ].
Exacerbation de la myasthénie grave
Une exacerbation des symptômes de la myasthénie grave et une nouvelle apparition des symptômes du syndrome myasthénique ont été signalées chez des patients recevant un traitement par BIAXIN à 250 mg.
Développement de bactéries résistantes aux médicaments
La prescription de BIAXIN en l'absence d'infection bactérienne avérée ou fortement suspectée ou d'indication prophylactique est peu susceptible d'apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes aux médicaments.

Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Les tests de mutagénicité in vitro suivants ont été menés avec la clarithromycine :
- Test de Salmonella/Mammifère Microsomes
- Test de fréquence de mutation bactérienne induite
- Test d'aberration chromosomique in vitro
- Essai de synthèse d'ADN d'hépatocytes de rat
- Test de lymphome de souris
- Étude létale dominante chez la souris
- Test du micronoyau de la souris
Tous les tests ont eu des résultats négatifs sauf le test d'aberration chromosomique in vitro qui a été positif dans un test et négatif dans un autre. De plus, un test de mutation bactérienne inverse (test d'Ames) a été réalisé sur les métabolites de la clarithromycine avec des résultats négatifs.
Altération de la fertilité
Des études de fertilité et de reproduction ont montré que des doses quotidiennes allant jusqu'à 160 mg/kg/ chez des rats mâles et femelles n'ont provoqué aucun effet indésirable sur le cycle œstral, la fertilité, la parturition ou le nombre et la viabilité de la progéniture. Les concentrations plasmatiques chez les rats après 150 mg/kg/jour étaient deux fois supérieures aux concentrations sériques humaines.
Une atrophie testiculaire s'est produite chez le rat à des doses 7 fois supérieures, chez le chien à des doses 3 fois supérieures et chez le singe à des doses 8 fois supérieures à la dose quotidienne maximale chez l'homme (sur la base de la surface corporelle).
Utilisation dans des populations spécifiques
Grossesse
Effets tératogènes
Catégorie de grossesse C
La clarithromycine ne doit pas être utilisée chez la femme enceinte, sauf dans des circonstances cliniques où aucune autre thérapie n'est appropriée. Si une grossesse survient pendant la prise de ce médicament, la patiente doit être informée du risque potentiel pour le fœtus [voir AVERTISSEMENTS ET PRECAUTIONS ].
Quatre études de tératogénicité chez le rat (trois avec des doses orales et une avec des doses intraveineuses jusqu'à 160 mg/kg/jour administrées pendant la période d'organogenèse majeure) et deux chez le lapin à des doses orales jusqu'à 125 mg/kg/jour (environ deux fois la dose humaine maximale recommandée basée sur mg/m²) ou des doses intraveineuses de 30 mg/kg/jour administrées pendant les jours de gestation 6 à 18 n'ont démontré aucune tératogénicité de la clarithromycine. Deux études orales supplémentaires chez une souche de rat différente à des doses similaires et dans des conditions similaires ont démontré une faible incidence d'anomalies cardiovasculaires à des doses de 150 mg/kg/jour administrées pendant les jours de gestation 6 à 15.
Les niveaux de plasma après 150 mgs/kg/jours étaient deux fois les niveaux de sérum humains. Quatre études chez la souris ont révélé une incidence variable de fente palatine après des doses orales de 1 000 mg/kg/jour (respectivement 2 et 4 fois la dose humaine maximale recommandée en mg/m²) pendant les jours de gestation 6 à 15. La fente palatine a également été vu à 500 mg/kg/jour. L'exposition de 1 000 mg/kg/jour a entraîné des concentrations plasmatiques 17 fois supérieures aux concentrations sériques humaines. Chez les singes, une dose orale de 70 mg/kg/jour a entraîné un retard de croissance fœtale à des taux plasmatiques deux fois supérieurs à ceux du sérum humain.
Mères allaitantes
La prudence s'impose lorsque BIAXIN est administré à des femmes qui allaitent. Le développement et les avantages pour la santé de l'alimentation au lait maternel doivent être pris en compte, ainsi que le besoin clinique de BIAXIN pour la mère et tout effet indésirable potentiel sur l'enfant nourri au lait maternel dû au médicament ou à l'affection maternelle sous-jacente.
La clarithromycine et son métabolite actif, la 14-hydroxy clarithromycine, sont excrétés dans le lait maternel. Des échantillons de sérum et de lait ont été obtenus après 3 jours de traitement, à l'état d'équilibre, à partir d'une étude publiée portant sur 12 femmes allaitantes qui prenaient BIAXIN 250 mg par voie orale deux fois par jour. Sur la base des données limitées de cette étude et en supposant une consommation de lait de 150 ml/kg/jour, un nourrisson nourri exclusivement au lait humain recevrait une moyenne estimée de 136 mcg/kg/jour de clarithromycine et de son métabolite actif, avec cette dose maternelle régime. Cela représente moins de 2 % de la dose maternelle ajustée en fonction du poids (7,8 mg/kg/jour, sur la base d'un poids maternel moyen de 64 kg) et moins de 1 % de la dose pédiatrique (15 mg/kg/jour) pour enfants de plus de 6 mois.
Une étude observationnelle prospective de 55 nourrissons allaités de mères prenant un antibactérien macrolide (6 ont été exposés à la clarithromycine) a été comparée à 36 nourrissons allaités de mères prenant de l'amoxicilline. Les effets indésirables étaient comparables dans les deux groupes. Des effets indésirables sont survenus chez 12,7 % des nourrissons exposés aux macrolides et comprenaient des éruptions cutanées, de la diarrhée, une perte d'appétit et de la somnolence.
Utilisation pédiatrique
L'innocuité et l'efficacité de BIAXIN Filmtab et de BIAXIN 500mg Granules ont été établies pour le traitement des affections ou maladies suivantes chez les patients pédiatriques de 6 mois et plus. L'utilisation dans ces indications est basée sur des essais cliniques chez des patients pédiatriques ou des études adéquates et bien contrôlées chez des adultes avec des données supplémentaires de pharmacocinétique et de sécurité chez des patients pédiatriques :
- Pharyngite/amygdalite
- Pneumonie communautaire
- Sinusite maxillaire aiguë
- Otite moyenne aiguë [voir Etudes cliniques ]
- Infections non compliquées de la peau et des tissus cutanés
L'innocuité et l'efficacité de BIAXIN 500mg Filmtab et BIAXIN 500mg Granules ont été établies pour la prévention de la maladie disséminée du complexe Mycobacterium avium (MAC) chez les patients pédiatriques de 20 mois et plus atteints d'une infection à VIH avancée. Aucune étude sur BIAXIN pour la prophylaxie du MAC n'a été réalisée dans des populations pédiatriques et les doses recommandées pour la prophylaxie sont dérivées d'études sur le traitement pédiatrique du MAC.
La sécurité et l'efficacité de BIAXIN 500 mg XL Filmtab dans le traitement des patients pédiatriques n'ont pas été établies.
La sécurité et l'efficacité de BIAXIN 250 mg chez les patients pédiatriques de moins de 6 mois n'ont pas été établies. La sécurité de BIAXIN 500mg n'a pas été étudiée chez les patients MAC âgés de moins de 20 mois.
Utilisation gériatrique
Dans une étude à l'état d'équilibre au cours de laquelle des sujets âgés en bonne santé (âgés de 65 à 81 ans) ont reçu 500 mg de BIAXIN toutes les 12 heures, les concentrations sériques maximales et l'aire sous les courbes de la clarithromycine et de la 14-OH clarithromycine ont été augmentées par rapport à ceux obtenus chez les jeunes adultes en bonne santé. Ces modifications de la pharmacocinétique sont parallèles aux diminutions connues de la fonction rénale liées à l'âge. Dans les essais cliniques, les patients âgés n'ont pas présenté une incidence accrue d'effets indésirables par rapport aux patients plus jeunes. Envisager un ajustement posologique chez les patients âgés présentant une insuffisance rénale sévère. Les patients âgés peuvent être plus susceptibles de développer des arythmies de torsades de pointes que les patients plus jeunes [voir AVERTISSEMENTS ET PRECAUTIONS ].
La plupart des rapports d'insuffisance rénale aiguë avec des inhibiteurs calciques métabolisés par le CYP3A4 (p. ex., vérapamil, amlodipine, diltiazem, nifédipine) concernaient des patients âgés de 65 ans ou plus [voir AVERTISSEMENTS ET PRECAUTIONS ].
En particulier chez les patients âgés, des cas de toxicité de la colchicine lors de l'utilisation concomitante de clarithromycine et de colchicine ont été rapportés, dont certains chez des patients insuffisants rénaux. Des décès ont été signalés chez certains patients [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Insuffisance rénale et hépatique
BIAXIN 500 mg est principalement excrété par le foie et les reins. BIAXIN peut être administré sans ajustement posologique aux patients présentant une insuffisance hépatique et une fonction rénale normale. Cependant, en présence d'insuffisance rénale sévère avec ou sans insuffisance hépatique coexistante, une diminution de la posologie ou des intervalles de dosage prolongés peuvent être appropriés [voir DOSAGE ET ADMINISTRATION ].
RÉFÉRENCES
1.Winkel P, Hilden J, Hansen JF, Kastrup J, Kolmos HJ, Kjøller E, et al. La clarithromycine pour les maladies coronariennes stables augmente la mortalité toutes causes confondues et cardiovasculaires et la morbidité cérébrovasculaire sur 10 ans dans l'essai clinique randomisé en aveugle CLARICOR. Int J Cardiol 2015;182:459-65.
SURDOSAGE
Un surdosage de BIAXIN peut provoquer des symptômes gastro-intestinaux tels que douleurs abdominales, vomissements, nausées et diarrhée.
Traiter les effets indésirables accompagnant le surdosage en éliminant rapidement le médicament non absorbé et en prenant des mesures de soutien. Comme avec d'autres macrolides, les concentrations sériques de BIAXIN ne devraient pas être sensiblement affectées par l'hémodialyse ou la dialyse péritonéale.
CONTRE-INDICATIONS
Hypersensibilité
BIAXIN est contre-indiqué chez les patients présentant une hypersensibilité connue à la clarithromycine, à l'érythromycine ou à l'un des médicaments antibactériens macrolides [voir AVERTISSEMENTS ET PRECAUTIONS ].
Arythmies cardiaques
L'administration concomitante de BIAXIN avec le cisapride et le pimozide est contre-indiquée [voir INTERACTIONS MÉDICAMENTEUSES ].
Il y a eu des rapports post-commercialisation d'interactions médicamenteuses lorsque la clarithromycine est co-administrée avec le cisapride ou le pimozide, entraînant des arythmies cardiaques (allongement de l'intervalle QT, tachycardie ventriculaire, fibrillation ventriculaire et torsades de pointes) probablement en raison de l'inhibition du métabolisme de ces médicaments par BIAXIN . Des décès ont été signalés.
Ictère cholestatique/dysfonctionnement hépatique
BIAXIN est contre-indiqué chez les patients ayant des antécédents d'ictère cholestatique ou de dysfonctionnement hépatique associés à une utilisation antérieure de clarithromycine.
Colchicine
L'administration concomitante de BIAXIN et de colchicine est contre-indiquée chez les insuffisants rénaux ou hépatiques.
Inhibiteurs de l'HMG-CoA réductase
Ne pas utiliser BIAXIN en concomitance avec des inhibiteurs de l'HMG-CoA réductase (statines) qui sont largement métabolisés par le CYP3A4 (lovastatine ou simvastatine), en raison du risque accru de myopathie, y compris de rhabdomyolyse [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ].
Alcaloïdes de l'ergot
L'administration concomitante de clarithromycine et d'ergotamine ou de dihydroergotamine est contre-indiquée [voir INTERACTIONS MÉDICAMENTEUSES ].
Contre-indications pour les médicaments co-administrés
Pour connaître les contre-indications des autres médicaments indiqués en association avec BIAXIN, se référer à leurs informations complètes de prescription (rubrique contre-indications).
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
La clarithromycine est un médicament antimicrobien macrolide [voir Microbiologie ].
Pharmacocinétique
Absorption
BIAXIN 250mg Filmtab Comprimés à Libération Immédiate
La biodisponibilité absolue des comprimés de clarithromycine à 250 mg était d'environ 50 %. Pour une dose unique de 500 mg de clarithromycine, la nourriture retarde légèrement le début de l'absorption de la clarithromycine, augmentant le temps de pointe d'environ 2 à 2,5 heures. La nourriture augmente également la concentration plasmatique maximale de clarithromycine d'environ 24 %, mais n'affecte pas le degré de biodisponibilité de la clarithromycine. La nourriture n'affecte pas le début de la formation du métabolite actif, la 14-OH clarithromycine ou sa concentration plasmatique maximale, mais diminue légèrement l'étendue de la formation du métabolite, indiquée par une diminution de 11 % de l'aire sous la courbe concentration plasmatique-temps (AUC) . Par conséquent, BIAXIN Filmtab peut être administré sans égard aux aliments. Chez des sujets humains sains non à jeun (hommes et femmes), les concentrations plasmatiques maximales ont été atteintes dans les 2 à 3 heures suivant l'administration orale.
BIAXIN 500 mg XL Filmtab Comprimés à libération prolongée
Les comprimés à libération prolongée de clarithromycine permettent une absorption prolongée de la clarithromycine par le tractus gastro-intestinal après administration orale. Par rapport à une dose quotidienne totale égale de comprimés de clarithromycine à libération immédiate, les comprimés à libération prolongée de clarithromycine fournissent des concentrations plasmatiques maximales à l'état d'équilibre plus faibles et plus tardives, mais des ASC sur 24 heures équivalentes pour la clarithromycine et son métabolite microbiologiquement actif, la 14-OH clarithromycine. Bien que l'étendue de la formation de 14-OH clarithromycine après l'administration de BIAXIN 500 mg XL Filmtab (2 comprimés de 500 mg une fois par jour) ne soit pas affectée par la nourriture, l'administration à jeun est associée à une diminution d'environ 30 % de l'ASC de la clarithromycine par rapport à l'administration avec de la nourriture. . Par conséquent, BIAXIN 250mg XL Filmtab doit être pris avec de la nourriture.
Figure 2 : Profils de concentration plasmatique de clarithromycine à l'état d'équilibre-temps 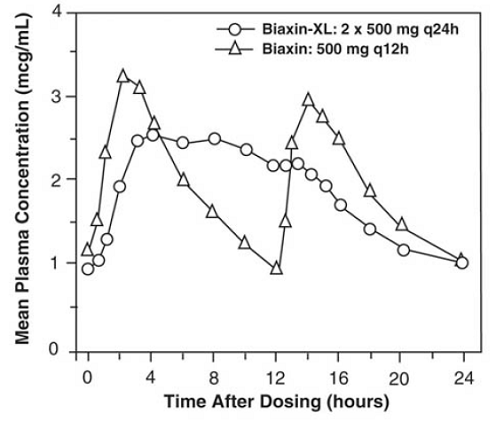
BIAXIN Granulés Pour Suspension Buvable
Lorsque des doses de 250 mg de clarithromycine sous forme de BIAXIN sous forme de suspension buvable ont été administrées à des sujets adultes en bonne santé à jeun, les concentrations plasmatiques maximales ont été atteintes environ 3 heures après l'administration.
Pour les patients adultes, la biodisponibilité de 10 ml de la suspension à 125 mg/5 ml ou de 10 ml de la suspension à 250 mg/5 ml est similaire à celle d'un comprimé à 250 mg ou 500 mg, respectivement.
Chez les adultes ayant reçu 250 mg de clarithromycine sous forme de suspension (n = 22), les aliments ont semblé diminuer les concentrations plasmatiques maximales moyennes de clarithromycine de 1,2 (± 0,4) mcg/mL à 1,0 (± 0,4) mcg/mL et le degré d'absorption de 7,2 (± 2,5) h•mcg/mL à 6,5 (± 3,7) h•mcg/mL.
Distribution
La clarithromycine et le métabolite 14-OH clarithromycine se répartissent facilement dans les tissus et les fluides corporels. Il n'y a pas de données disponibles sur la pénétration du liquide céphalo-rachidien. En raison des concentrations intracellulaires élevées, les concentrations tissulaires sont supérieures aux concentrations sériques. Des exemples de concentrations tissulaires et sériques sont présentés ci-dessous.
Métabolisme et élimination
BIAXIN 500mg Filmtab Comprimés à Libération Immédiate
Les concentrations plasmatiques maximales de clarithromycine à l'état d'équilibre ont été atteintes en 3 jours et étaient d'environ 1 mcg/mL à 2 mcg/mL avec une dose de 250 mg administrée toutes les 12 heures et de 3 mcg/mL à 4 mcg/mL avec une dose de 500 mg administrée toutes les 8 heures à 12 heures. La demi-vie d'élimination de la clarithromycine était d'environ 3 heures à 4 heures avec 250 mg administrés toutes les 12 heures mais augmentait à 5 heures à 7 heures avec 500 mg administrés toutes les 8 heures à 12 heures. La non-linéarité de la pharmacocinétique de la clarithromycine est faible aux doses recommandées de 250 mg et 500 mg administrées toutes les 8 heures à 12 heures. Avec une dose de 250 mg toutes les 12 heures, le principal métabolite, la 14-OH clarithromycine, atteint une concentration maximale à l'état d'équilibre d'environ 0,6 mcg/mL et a une demi-vie d'élimination de 5 heures à 6 heures. Avec une dose de 500 mg toutes les 8 heures à 12 heures, la concentration maximale à l'état d'équilibre de la 14-OH clarithromycine est légèrement plus élevée (jusqu'à 1 mcg/mL) et sa demi-vie d'élimination est d'environ 7 heures à 9 heures. Avec n'importe lequel de ces schémas posologiques, la concentration à l'état d'équilibre de ce métabolite est généralement atteinte en 3 à 4 jours.
Après un comprimé de 250 mg toutes les 12 heures, environ 20 % de la dose est excrétée dans l'urine sous forme de clarithromycine, tandis qu'après un comprimé de 500 mg toutes les 12 heures, l'excrétion urinaire de clarithromycine est un peu plus importante, environ 30 %. En comparaison, après une dose orale de 250 mg (125 mg/5 mL) de suspension toutes les 12 heures, environ 40 % sont excrétés dans l'urine sous forme de clarithromycine. La clairance rénale de la clarithromycine est cependant relativement indépendante de la dose et se rapproche du taux de filtration glomérulaire normal. Le principal métabolite trouvé dans l'urine est la 14-OH clarithromycine, qui représente 10 à 15 % supplémentaires de la dose avec un comprimé de 250 mg ou de 500 mg administré toutes les 12 heures.
BIAXIN 250 mg XL Filmtab Comprimés à libération prolongée
Chez des sujets humains en bonne santé, des concentrations plasmatiques maximales de clarithromycine à l'état d'équilibre d'environ 2 mcg/mL à 3 mcg/mL ont été atteintes environ 5 heures à 8 heures après l'administration orale de 1000 mg de BIAXIN 250 mg XL Filmtab une fois par jour ; pour la 14-OH clarithromycine, des concentrations plasmatiques maximales à l'état d'équilibre d'environ 0,8 mcg/mL ont été atteintes environ 6 à 9 heures après l'administration. Des concentrations plasmatiques maximales de clarithromycine à l'état d'équilibre d'environ 1 mcg/mL à 2 mcg/mL ont été atteintes environ 5 à 6 heures après l'administration orale d'un seul 500 mg de BIAXIN XL Filmtab une fois par jour ; pour la 14-OH clarithromycine, des concentrations plasmatiques maximales à l'état d'équilibre d'environ 0,6 mcg/mL ont été atteintes environ 6 heures après l'administration.
Les concentrations plasmatiques maximales à l'état d'équilibre ont été atteintes en 2 à 3 jours et étaient d'environ 2 mcg/mL pour la clarithromycine et de 0,7 mcg/mL pour la 14-OH clarithromycine lorsque des doses de 250 mg de la suspension de clarithromycine étaient administrées toutes les 12 heures. La demi-vie d'élimination de la clarithromycine (3 heures à 4 heures) et celle de la 14-OH clarithromycine (5 heures à 7 heures) ont été similaires à celles observées à l'état d'équilibre après administration de doses équivalentes de BIAXIN Filmtab.
Populations spécifiques pour les formulations de BIAXIN Filmtab, BIAXIN 500mg XL Filmtab et BIAXIN 250mg Granules
Granulés BIAXIN pour suspension orale chez les patients pédiatriques
La clarithromycine pénètre dans le liquide de l'oreille moyenne des patients pédiatriques atteints d'otite moyenne sécrétoire.
Lorsque des patients pédiatriques (n = 10) ont reçu une dose orale unique de 7,5 mg/kg de BIAXIN 500 mg sous forme de suspension buvable, la nourriture a augmenté les concentrations plasmatiques maximales moyennes de clarithromycine de 3,6 (± 1,5) mcg/mL à 4,6 (± 2,8) mcg/ mL et le degré d'absorption de 10,0 (± 5,5) h•mcg/mL à 14,2 (± 9,4) h•mcg/mL.
Chez les patients pédiatriques nécessitant un traitement antibactérien, l'administration de 7,5 mg/kg toutes les 12 heures de BIAXIN sous forme de suspension buvable a généralement entraîné des concentrations plasmatiques maximales à l'état d'équilibre de 3 mcg/mL à 7 mcg/mL pour la clarithromycine et de 1 mcg/mL à 2 mcg/mL pour la 14-OH clarithromycine.
Chez les patients pédiatriques infectés par le VIH prenant 15 mg/kg de BIAXIN sous forme de suspension orale toutes les 12 heures, les concentrations maximales de clarithromycine à l'état d'équilibre variaient généralement de 6 mcg/mL à 15 mcg/mL.
Infection par le VIH
Les concentrations à l'état d'équilibre de clarithromycine et de 14-OH clarithromycine observées après l'administration de doses de 500 mg de clarithromycine toutes les 12 heures à des patients adultes infectés par le VIH étaient similaires à celles observées chez des volontaires sains. Chez les patients adultes infectés par le VIH prenant des doses de 500 mg ou 1000 mg de clarithromycine toutes les 12 heures, les valeurs de la Cmax de la clarithromycine à l'état d'équilibre variaient de 2 mcg/mL à 4 mcg/mL et de 5 mcg/mL à 10 mcg/mL, respectivement .
Insuffisance hépatique
Les concentrations à l'état d'équilibre de la clarithromycine chez les sujets présentant une fonction hépatique altérée ne différaient pas de celles des sujets normaux ; cependant, les concentrations de 14-OH clarithromycine étaient plus faibles chez les sujets atteints d'insuffisance hépatique. La diminution de la formation de 14-OH clarithromycine a été au moins partiellement compensée par une augmentation de la clairance rénale de la clarithromycine chez les sujets présentant une fonction hépatique altérée par rapport aux sujets sains.
Insuffisance rénale
La pharmacocinétique de la clarithromycine a également été altérée chez les sujets présentant une insuffisance rénale [voir Utilisation dans des populations spécifiques et DOSAGE ET ADMINISTRATION ].
Interactions médicamenteuses
Fluconazole
Suite à l'administration de fluconazole 200 mg par jour et de clarithromycine 500 mg deux fois par jour à 21 volontaires sains, la Cmin et l'ASC de la clarithromycine à l'état d'équilibre ont augmenté de 33 % et 18 %, respectivement. Les expositions à la clarithromycine ont augmenté et les concentrations à l'état d'équilibre de 14-OH clarithromycine n'ont pas été significativement affectées par l'administration concomitante de fluconazole.
Colchicine
Lorsqu'une dose unique de colchicine 0,6 mg a été administrée avec de la clarithromycine 250 mg deux fois par jour pendant 7 jours, la Cmax de la colchicine a augmenté de 197 % et l'ASC0-∞ a augmenté de 239 % par rapport à l'administration de colchicine seule.
Atazanavir
Suite à l'administration de clarithromycine (500 mg deux fois par jour) avec l'atazanavir (400 mg une fois par jour), l'ASC de la clarithromycine a augmenté de 94 %, l'ASC de la 14-OH clarithromycine a diminué de 70 % et l'ASC de l'atazanavir a augmenté de 28 %.
Ritonavir
L'administration concomitante de clarithromycine et de ritonavir (n = 22) a entraîné une augmentation de 77 % de l'ASC de la clarithromycine et une diminution de 100 % de l'ASC de la 14-OH clarithromycine.
Saquinavir
Suite à l'administration de clarithromycine (500 mg bid) et de saquinavir (capsules de gélatine molle, 1200 mg tid) à 12 volontaires sains, l'ASC et la Cmax du saquinavir à l'état d'équilibre ont augmenté respectivement de 177 % et 187 % par rapport à l'administration de saquinavir seul. L'ASC et la Cmax de la clarithromycine ont augmenté de 45 % et 39 % respectivement, tandis que l'ASC et la Cmax de la 14-OH clarithromycine ont diminué de 24 % et 34 % respectivement, par rapport à l'administration avec la clarithromycine seule.
Didanosine
L'administration simultanée de comprimés de clarithromycine et de didanosine à 12 patients adultes infectés par le VIH n'a entraîné aucun changement statistiquement significatif de la pharmacocinétique de la didanosine.
Zidovudine
Suite à l'administration de comprimés de clarithromycine 500 mg deux fois par jour avec de la zidovudine 100 mg toutes les 4 heures, l'ASC de la zidovudine à l'état d'équilibre a diminué de 12 % par rapport à l'administration de zidovudine seule (n = 4). Les valeurs individuelles variaient d'une diminution de 34 % à une augmentation de 14 %. Lorsque les comprimés de clarithromycine ont été administrés deux à quatre heures avant la zidovudine, la Cmax de la zidovudine à l'état d'équilibre a augmenté de 100 % alors que l'ASC n'a pas été affectée (n = 24).
Oméprazole
La clarithromycine 500 mg toutes les 8 heures a été administrée en association avec l'oméprazole 40 mg par jour à des sujets adultes sains. Les concentrations plasmatiques d'oméprazole à l'état d'équilibre ont augmenté (Cmax, ASC0-24 et augmentations de t½ de 30 %, 89 % et 34 %, respectivement) par l'administration concomitante de clarithromycine.
Les taux plasmatiques de clarithromycine et de 14–OH clarithromycine ont été augmentés par l'administration concomitante d'oméprazole. Pour la clarithromycine, la Cmax moyenne était supérieure de 10 %, la Cmin moyenne était supérieure de 27 % et l'ASC0-8 moyenne était supérieure de 15 % lorsque la clarithromycine était administrée avec l'oméprazole que lorsque la clarithromycine était administrée seule. Des résultats similaires ont été observés pour la 14–OH clarithromycine, la Cmax moyenne était supérieure de 45 %, la Cmin moyenne était supérieure de 57 % et l'ASC0-8 moyenne était supérieure de 45 %. Les concentrations de clarithromycine dans le tissu gastrique et le mucus ont également été augmentées par l'administration concomitante d'oméprazole.
Concentrations tissulaires de clarithromycine 2 heures après la dose (mcg/mL)/(mcg/g)
Théophylline
Dans deux études au cours desquelles la théophylline a été administrée avec de la clarithromycine (une formulation à libération prolongée de théophylline a été dosée à 6,5 mg/kg ou 12 mg/kg avec 250 ou 500 mg q12h de clarithromycine), les taux à l'état d'équilibre de Cmax, Cmin, et l'aire sous la courbe de concentration sérique en fonction du temps (ASC) de la théophylline a augmenté d'environ 20 %.
Midazolam
Lorsqu'une dose unique de midazolam a été co-administrée avec des comprimés de clarithromycine (500 mg deux fois par jour pendant 7 jours), l'ASC du midazolam a augmenté de 174 % après administration intraveineuse de midazolam et de 600 % après administration orale.
Pour connaître les autres médicaments indiqués en association avec BIAXIN, se reporter à leurs informations complètes de prescription, PHARMACOLOGIE CLINIQUE section.
Microbiologie
Mécanisme d'action
La clarithromycine exerce son action antibactérienne en se liant à la sous-unité ribosomique 50S des bactéries sensibles, ce qui entraîne une inhibition de la synthèse des protéines.
La résistance
Les principales voies de résistance sont la modification de l'ARNr 23S dans la sous-unité ribosomale 50S à l'insensibilité ou aux pompes d'efflux de médicaments. La production de bêta-lactamase ne devrait avoir aucun effet sur l'activité de la clarithromycine.
La plupart des isolats de staphylocoques résistants à la méthicilline et à l'oxacilline sont résistants à la clarithromycine.
Si H. pylori n'est pas éradiqué après un traitement avec des combinaisons thérapeutiques contenant de la clarithromycine, les patients peuvent développer une résistance à la clarithromycine dans les isolats de H. pylori. Par conséquent, pour les patients qui échouent au traitement, des tests de sensibilité à la clarithromycine doivent être effectués, si possible. Les patients atteints d'H. pylori résistant à la clarithromycine ne doivent pas être traités par l'un des traitements suivants : bithérapie oméprazole/clarithromycine ; trithérapie oméprazole/clarithromycine/amoxicilline ; trithérapie lansoprazole/clarithromycine/amoxicilline ; ou d'autres régimes qui incluent la clarithromycine comme seul agent antibactérien.
Activité anti-microbienne
La clarithromycine s'est avérée active contre la plupart des isolats des micro-organismes suivants à la fois in vitro et dans les infections cliniques [voir INDICATIONS ET USAGE ].
Bactéries Gram-positives
- Staphylococcus aureus
- Streptococcus pneumoniae
- Streptococcus pyogènes
Bactéries Gram-négatives
- Haemophilus influenzae
- Haemophilus parainfluenzae
- Moraxella catarrhalis
Autres micro-organismes
- Chlamydophila pneumoniae
- Helicobacter pylori
- Complexe Mycobacterium avium (MAC) composé de M. avium et M. intracellulare
- Mycoplasme pneumoniae
Au moins 90 % des micro-organismes répertoriés ci-dessous présentent des concentrations minimales inhibitrices (CMI) in vitro inférieures ou égales au seuil critique de CMI sensible à la clarithromycine pour les organismes de type similaire à ceux indiqués dans le tableau 11. Cependant, l'efficacité de la clarithromycine dans le traitement des infections cliniques due à ces micro-organismes n'a pas été établie dans des essais cliniques adéquats et bien contrôlés.
Bactéries Gram-positives
- Streptococcus agalactie
- Streptocoques (Groupes C, F, G)
- Streptocoques du groupe Viridans
Bactéries Gram-négatives
- Legionella pneumophila
- Pasteurella multocida
Bactéries anaérobies
- Clostridium perfringens
- Peptocoque niger
- Prévotella melaninogenica
- Propionibacterium acnes
Test de sensibilité
Pour des informations spécifiques concernant les critères d'interprétation des tests de sensibilité, les méthodes de test associées et les normes de contrôle qualité reconnues par la FDA pour ce médicament, veuillez consulter : http://www.fda.gov/STIC.
Toxicologie animale et/ou pharmacologie
Une opacité cornéenne s'est produite chez les chiens à des doses 12 fois supérieures et chez les singes à des doses 8 fois supérieures à la dose quotidienne humaine maximale (sur la base de la surface corporelle). Une déplétion lymphoïde est survenue chez le chien à des doses 3 fois supérieures et chez le singe à des doses 2 fois supérieures à la dose quotidienne humaine maximale (sur la base de la surface corporelle).
Etudes cliniques
Infections mycobactériennes
Prophylaxie des infections mycobactériennes
Un essai clinique randomisé en double aveugle (essai 3) a comparé la clarithromycine 500 mg deux fois par jour à un placebo chez des patients atteints du SIDA défini par les CDC et dont le nombre de CD4 était inférieur à 100 cellules/μL. Cet essai a porté sur 682 patients de novembre 1992 à janvier 1994, avec un nombre médian de cellules CD4 à l'entrée de 30 cellules/mcL. La durée médiane de BIAXIN 500 mg était de 10,6 mois contre 8,2 mois pour le placebo. Plus de patients dans le bras placebo que dans le bras BIAXIN ont abandonné prématurément l'essai (75,6 % et 67,4 %, respectivement). Cependant, si les arrêts prématurés dus au complexe Mycobacterium avium (MAC) ou au décès sont exclus, des pourcentages approximativement égaux de patients de chaque bras (54,8 %) sous BIAXIN et 52,5 % sous placebo) ont arrêté le médicament à l'étude prématurément pour d'autres raisons. L'essai a été conçu pour évaluer les critères d'évaluation suivants :
Bactériémie MAC
Chez les patients randomisés pour BIAXIN, le risque de bactériémie MAC a été réduit de 69 % par rapport au placebo. La différence entre les groupes était statistiquement significative (p
Survie
Un bénéfice de survie statistiquement significatif de BIAXIN par rapport au placebo a été observé (voir Figure 3 et Tableau 13). Étant donné que l'analyse à 18 mois inclut les patients ne recevant plus de prophylaxie, le bénéfice de survie de BIAXIN 250 mg peut être sous-estimé.
Figure 3 : Survie de tous les patients atteints du SIDA randomisés au fil du temps dans l'essai 3 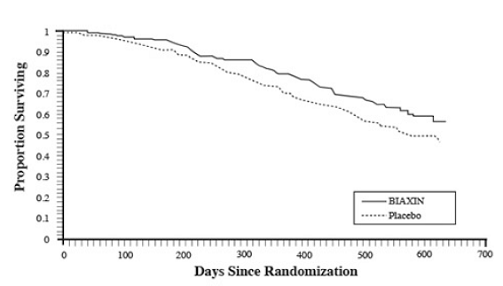
Maladie à MAC disséminée cliniquement significative
En association avec la diminution de l'incidence de la bactériémie à MAC, les patients du groupe randomisé pour BIAXIN ont montré une réduction des signes et des symptômes de la maladie disséminée à MAC, y compris la fièvre, les sueurs nocturnes, la perte de poids et l'anémie.
Traitement des infections mycobactériennes
Essais de monothérapie à dose variable chez des patients adultes atteints du SIDA atteints de MAC
Deux essais cliniques randomisés (Essais 1 et 2) ont comparé différentes doses de BIAXIN chez des patients atteints du SIDA défini par les CDC et dont le nombre de CD4 était inférieur à 100 cellules/mcL. Ces essais ont porté sur des patients de mai 1991 à mars 1992. L'essai 500 était un essai randomisé en double aveugle ; l'essai 577 était un essai ouvert d'utilisation compassionnelle. Les deux essais ont utilisé des doses de 500 mg et 1000 mg deux fois par jour de BIAXIN ; l'essai 1 comportait également un groupe de 2000 mg de BIAXIN 500 mg deux fois par jour. L'essai 1 a recruté 154 patients adultes et l'essai 2 a recruté 469 patients adultes. La majorité des patients avaient un nombre de cellules CD4 inférieur à 50 cellules/mcL à l'entrée dans l'étude. Les essais ont été conçus pour évaluer les critères d'évaluation suivants :
Les résultats de l'essai 1 sont décrits ci-dessous. Les résultats de l'essai 2 étaient similaires à ceux de l'essai 1.
Bactériémie MAC
Des diminutions de la bactériémie MAC ou des hémocultures négatives ont été observées chez la majorité des patients dans tous les groupes posologiques de BIAXIN 500 mg. Les réductions moyennes des unités formant colonies (UFC) de MAC par rapport aux valeurs initiales après 4 semaines de traitement dans les schémas thérapeutiques à 1 000 mg (n=32) deux fois par jour et à 2 000 mg (n=26) deux fois par jour étaient de 2,3 log UFC par rapport à 1,5 log UFC dans le schéma BIAXIN 500 mg deux fois par jour (n = 35). Un essai distinct avec un régime à quatre médicaments2 (ciprofloxacine, éthambutol, rifampicine et clofazimine) a entraîné une réduction moyenne de 1,4 log UFC.
Les résultats cliniques évalués avec les différents schémas posologiques de clarithromycine en monothérapie sont présentés dans le tableau 14. Les doses de 1000 mg et 2000 mg deux fois par jour ont montré un contrôle significativement meilleur de la bactériémie au cours des quatre premières semaines de traitement. Aucune différence significative n'a été observée au-delà de ce point. Tous les isolats avaient une CMI inférieure à 8 mcg/mL au prétraitement. La rechute était presque toujours accompagnée d'une augmentation de la CMI.
Maladie à MAC disséminée cliniquement significative
Parmi les patients souffrant de sueurs nocturnes avant le traitement, 84 % ont montré une résolution ou une amélioration à un moment donné au cours des 12 semaines de BIAXIN à des doses de 500 mg à 2 000 mg deux fois par jour. De même, 77 % des patients ont signalé une résolution ou une amélioration de la fièvre à un moment donné. Les taux de réponse pour les signes cliniques de MAC sont donnés dans le tableau 15 ci-dessous.
La durée médiane de la réponse, définie comme l'amélioration ou la résolution des signes et symptômes cliniques, était de 2 semaines à 6 semaines.
Étant donné que l'essai n'a pas été conçu pour déterminer le bénéfice de la monothérapie au-delà de 12 semaines, la durée de la réponse peut être sous-estimée pour les 25 % à 33 % des patients qui ont continué à montrer une réponse clinique après 12 semaines.
Survie
La durée médiane de survie depuis l'entrée dans l'essai (essai 1) était de 249 jours à la dose de 500 mg deux fois par jour contre 215 jours avec la dose de 1000 mg deux fois par jour. Cependant, au cours des 12 premières semaines de traitement, il y a eu 2 décès chez 53 patients du groupe 500 mg deux fois par jour contre 13 décès chez 51 patients du groupe 1000 mg deux fois par jour. La raison de cette différence apparente de mortalité n'est pas connue. La survie dans les deux groupes était similaire au-delà de 12 semaines. Les temps de survie médians pour ces doses étaient similaires à ceux des témoins historiques récents avec MAC lorsqu'ils étaient traités avec des thérapies combinées.2
La durée médiane de survie depuis l'entrée dans l'essai 2 était de 199 jours pour la dose de 500 mg deux fois par jour et de 179 jours pour la dose de 1000 mg deux fois par jour. Au cours des quatre premières semaines de traitement, alors que les patients ont été maintenus à leur dose initialement assignée, il y a eu 11 décès chez 255 patients prenant 500 mg deux fois par jour et 18 décès chez 214 patients prenant 1000 mg deux fois par jour.
Essais de monothérapie à dosage variable chez des patients pédiatriques atteints du SIDA atteints de MAC
L'essai 4 était un essai pédiatrique de 3,75 mg/kg, 7,5 mg/kg et 15 mg/kg de BIAXIN deux fois par jour chez des patients atteints du SIDA défini par les CDC et dont le nombre de CD4 était inférieur à 100 cellules/mcL. L'essai a recruté 25 patients âgés de 1 à 20 ans. L'essai a évalué les mêmes critères d'évaluation que dans les essais pour adultes 1 et 2. Les résultats avec la dose de 7,5 mg/kg deux fois par jour dans l'essai pédiatrique étaient comparables à ceux de la dose de 500 mg. deux fois par jour dans les essais chez l'adulte.
Thérapie combinée chez les patients atteints du SIDA avec un MAC disséminé
L'essai 5 a comparé l'innocuité et l'efficacité de BIAXIN 250 mg en association avec l'éthambutol par rapport à BIAXIN 250 mg en association avec l'éthambutol et la clofazimine pour le traitement de l'infection disséminée à MAC (dMAC). Cet essai de 24 semaines a recruté 106 patients atteints du SIDA et dMAC, avec 55 patients randomisés pour recevoir BIAXIN 500 mg et éthambutol, et 51 patients randomisés pour recevoir de la clarithromycine, de l'éthambutol et du clofazime. Les caractéristiques de base entre les bras de traitement étaient similaires à l'exception du nombre médian d'UFC qui était au moins 1 log plus élevé dans le bras BIAXIN 500 mg, éthambutol et clofazime.
Par rapport à l'expérience antérieure avec la monothérapie à la clarithromycine, le régime à deux médicaments de la clarithromycine et de l'éthambutol a prolongé le délai de rechute microbiologique, en grande partie en supprimant l'émergence de souches résistantes à la clarithromycine. Cependant, l'ajout de clofazimine au régime n'a ajouté aucun avantage microbiologique ou clinique supplémentaire. La tolérance des deux polychimiothérapies était comparable, les événements indésirables les plus courants étant de nature gastro-intestinale. Les patients recevant le régime contenant de la clofazimine avaient des taux de survie réduits ; cependant, leur nombre initial de colonies de mycobactéries était plus élevé. Les résultats de cet essai appuient l'ajout d'éthambutol à la clarithromycine pour le traitement des infections initiales au dMAC, mais ne soutiennent pas l'ajout de clofazimine comme troisième agent.
Otite moyenne
Essai sur l'otite moyenne de BIAXIN par rapport à la céphalosporine orale
Dans un essai clinique contrôlé de patients pédiatriques atteints d'otite moyenne aiguë réalisé aux États-Unis, où des taux significatifs d'organismes producteurs de bêta-lactamase ont été trouvés, BIAXIN 500 mg a été comparé à une céphalosporine orale. Dans cet essai, des critères d'évaluabilité stricts ont été utilisés pour déterminer la réponse clinique. Pour les 223 patients dont l'efficacité clinique a été évaluée, le taux de réussite clinique (c.-à-d. guérison plus amélioration) à la visite post-thérapeutique était de 88 % pour BIAXIN 500 mg et de 91 % pour la céphalosporine.
Chez un plus petit nombre de patients, des déterminations microbiologiques ont été faites lors de la visite pré-thérapeutique. Les résultats présomptifs d'éradication bactérienne/de guérison clinique (c'est-à-dire le succès clinique) sont présentés dans le tableau 16.
Essais sur l'otite moyenne de BIAXIN par rapport à un antimicrobien/inhibiteur de bêta-lactamase
Dans deux autres essais cliniques contrôlés sur l'otite moyenne aiguë réalisés aux États-Unis, où des taux significatifs d'organismes producteurs de bêta-lactamase ont été trouvés, BIAXIN a été comparé à un agent antimicrobien oral contenant un inhibiteur spécifique de bêta-lactamase. Dans ces essais, des critères d'évaluabilité stricts ont été utilisés pour déterminer les réponses cliniques. Chez les 233 patients dont l'efficacité clinique a été évaluée, le taux de réussite clinique combiné (c.-à-d. guérison et amélioration) lors de la visite post-thérapeutique était de 91 % pour BIAXIN 500 mg et le contrôle.
Pour les patients qui ont eu des déterminations microbiologiques lors de la visite de pré-traitement, les résultats présomptifs d'éradication bactérienne/de guérison clinique (c'est-à-dire, le succès clinique) sont présentés dans le tableau 17.
Éradication de H. pylori pour réduire le risque de récidive de l'ulcère duodénal
BIAXIN + Lansoprazole Et Amoxicilline
Deux essais cliniques américains randomisés en double aveugle (essai 6 et essai 7) chez des patients atteints de H. pylori et d'ulcère duodénal (défini comme un ulcère actif ou des antécédents d'ulcère actif dans l'année) ont évalué l'efficacité de BIAXIN 500 mg deux fois tous les jours en association avec le lansoprazole 30 mg deux fois par jour et l'amoxicilline 1 g deux fois par jour en trithérapie de 14 jours pour l'éradication de H. pylori.
L'éradication de H. pylori a été définie par deux tests négatifs (culture et histologie) à 4 semaines à 6 semaines après la fin du traitement.
L'association de BIAXIN plus lansoprazole et amoxicilline en trithérapie a été efficace dans l'éradication de H. pylori (voir résultats dans le tableau 18). Il a été démontré que l'éradication de H. pylori réduit le risque de récidive de l'ulcère duodénal.
Un essai clinique randomisé en double aveugle (essai 8) réalisé aux États-Unis chez des patients atteints de H. pylori et d'un ulcère duodénal (défini comme un ulcère actif ou des antécédents d'ulcère dans l'année) a comparé l'efficacité de BIAXIN 250 mg en association avec lansoprazole et amoxicilline en trithérapie pendant 10 jours et 14 jours. Cet essai a établi que la trithérapie de 10 jours était équivalente à la trithérapie de 14 jours pour éradiquer H. pylori (voir résultats dans le tableau 18).
Thérapie BIAXIN + Oméprazole Et Amoxicilline
Trois essais cliniques américains randomisés en double aveugle chez des patients atteints d'une infection à H. pylori et d'un ulcère duodénal (n = 558) ont comparé BIAXIN plus oméprazole et amoxicilline à BIAXIN 250 mg plus amoxicilline. Deux essais (essais 9 et 10) ont été menés chez des patients atteints d'un ulcère duodénal actif, et le troisième essai (essai 11) a été mené chez des patients ayant un ulcère duodénal au cours des 5 dernières années, mais sans ulcère présent au moment de l'inscription . Le schéma posologique dans les essais était de BIAXIN 500 mg deux fois par jour plus oméprazole 20 mg deux fois par jour plus amoxicilline 1 gramme deux fois par jour pendant 10 jours. Dans les essais 9 et 10, les patients qui prenaient le régime d'oméprazole ont également reçu 18 jours supplémentaires d'oméprazole 20 mg une fois par jour. Les critères d'évaluation étudiés étaient l'éradication de H. pylori et la cicatrisation de l'ulcère duodénal (essais 9 et 10 uniquement). Le statut H. pylori a été déterminé par CLOtest®, histologie et culture dans les trois essais. Pour un patient donné, H. pylori était considéré comme éradiqué si au moins deux de ces tests étaient négatifs et qu'aucun n'était positif. L'association de BIAXIN plus oméprazole et amoxicilline a été efficace pour éradiquer H. pylori (voir résultats dans le tableau 19).
Thérapie BIAXIN + Oméprazole
Quatre essais randomisés, en double aveugle et multicentriques (essais 12, 13, 14 et 15) ont évalué BIAXIN 500 mg trois fois par jour plus oméprazole 40 mg une fois par jour pendant 14 jours, suivis de l'oméprazole 20 mg une fois par jour ( essais 12, 13 et 15) ou par l'oméprazole 40 mg une fois par jour (essai 14) pendant 14 jours supplémentaires chez les patients présentant un ulcère duodénal actif associé à H. pylori. Les essais 12 et 13 ont été menés aux États-Unis et au Canada et ont recruté 242 et 256 patients, respectivement. L'infection à H. pylori et l'ulcère duodénal ont été confirmés chez 219 patients dans l'essai 12 et 228 patients dans l'essai 13. Ces essais ont comparé l'association à l'oméprazole et aux monothérapies BIAXIN. Les essais 14 et 15 ont été menés en Europe et ont respectivement recruté 154 et 215 patients. L'infection à H. pylori et l'ulcère duodénal ont été confirmés chez 148 patients dans l'essai 14 et 208 patients dans l'essai 15. Ces essais ont comparé le régime combiné à la monothérapie par l'oméprazole. Les résultats des analyses d'efficacité pour ces essais sont décrits dans les tableaux 20, 21 et 22.
Guérison de l'ulcère duodénal
L'association de BIAXIN 250 mg et d'oméprazole a été aussi efficace que l'oméprazole seul pour la cicatrisation de l'ulcère duodénal (voir Tableau 20).
Éradication de H. pylori associée à l'ulcère duodénal
L'association de BIAXIN 500 mg et d'oméprazole a été efficace pour éradiquer H. pylori (voir Tableau 21). L'éradication de H. pylori était définie par l'absence de test positif (culture ou histologie) à 4 semaines après la fin du traitement, et deux tests négatifs étaient nécessaires pour être considéré comme éradiqué. Dans l'analyse per-protocole, les patients suivants ont été exclus : les abandons, les patients avec des violations majeures du protocole, les patients avec des tests H. pylori manquants après le traitement et les patients qui n'ont pas été évalués pour l'éradication de H. pylori à 4 semaines après la fin de traitement car on a découvert qu'ils avaient un ulcère non cicatrisé à la fin du traitement.
Récidive de l'ulcère duodénal
La récidive de l'ulcère à 6 mois et à 12 mois après la fin du traitement a été évaluée pour les patients chez qui les ulcères étaient cicatrisés après le traitement (voir les résultats dans le tableau 22). Ainsi, chez les patients présentant un ulcère duodénal associé à une infection à H. pylori, l'éradication de H. pylori a réduit la récidive de l'ulcère.
RÉFÉRENCES
2.Kemper CA, et al. Traitement de la bactériémie du complexe Mycobacterium avium dans le SIDA avec un régime oral à quatre médicaments. Ann Stagiaire Med. 1992;116:466-472.
INFORMATIONS PATIENTS
Fournissez les instructions ou informations suivantes sur BIAXIN 250mg aux patients :
- Conseillez aux patients que les médicaments antibactériens, y compris BIAXIN (clarithromycine), ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsque BIAXIN 250 mg est prescrit pour traiter une infection bactérienne, les patients doivent être informés que même s'il est courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut (1) diminuer l'efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne puissent plus être traitées par BIAXIN 250 mg ou d'autres médicaments antibactériens à l'avenir.
- Informez les patients que la diarrhée est un problème courant causé par les antibactériens, y compris BIAXIN (clarithromycine), qui se termine généralement lorsque l'antibactérien est arrêté. Parfois, après le début du traitement avec des antibactériens, les patients peuvent développer des selles liquides et sanglantes (avec ou sans crampes d'estomac et fièvre) même deux mois ou plus après avoir pris la dernière dose de l'antibactérien. Si cela se produit, demandez aux patients de contacter leur fournisseur de soins de santé dès que possible.
- Avisez les patients que BIAXIN (clarithromycine) peut interagir avec certains médicaments; par conséquent, conseillez aux patients de signaler à leur fournisseur de soins de santé l'utilisation de tout autre médicament.
- Aviser les patients que BIAXIN (clarithromycine) Filmtab et suspension buvable peut être pris avec ou sans nourriture et peut être pris avec du lait; cependant, BIAXIN 250 mg XL Filmtab (comprimés à libération prolongée de clarithromycine) doit être pris avec de la nourriture. Ne pas réfrigérer la suspension.
- Il n'existe aucune donnée sur l'effet de BIAXIN (clarithromycine) sur l'aptitude à conduire des véhicules ou à utiliser des machines. Cependant, conseillez les patients concernant le potentiel d'étourdissements, de vertiges, de confusion et de désorientation, qui peuvent survenir avec le médicament. Le potentiel de ces effets indésirables doit être pris en compte avant que les patients conduisent ou utilisent des machines.
- Informez les patients que si une grossesse survient pendant la prise de ce médicament, il existe un risque potentiel pour le fœtus [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
- Conseillez aux patients qui ont une maladie coronarienne de continuer à prendre des médicaments et à modifier leur mode de vie pour leur maladie coronarienne, car BIAXIN 500 mg peut être associé à un risque accru de mortalité des années après la fin du traitement par BIAXIN.
