Keflex 250mg, 500mg Cephalexin Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Keflex 250 mg et comment est-il utilisé ?
Keflex est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de diverses infections bactériennes en arrêtant la croissance des bactéries. Keflex 500 mg peut être utilisé seul ou avec d'autres médicaments.
Keflex est connu comme un antibiotique céphalosporine.
Quels sont les effets secondaires de Keflex ?
Keflex peut provoquer des effets secondaires graves, notamment :
- fortes douleurs à l'estomac,
- diarrhée aqueuse ou sanglante,
- fatigue inhabituelle,
- se sentir étourdi ou essoufflé,
- ecchymoses faciles,
- saignement inhabituel,
- des taches violettes ou rouges sous la peau,
- saisie,
- peau pâle,
- mains et pieds froids,
- peau jaunie, urine foncée,
- fièvre,
- la faiblesse ,
- douleur au côté ou au bas du dos,
- miction douloureuse,
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Keflex 500 mg incluent :
- diarrhée,
- nausée,
- vomissement,
- indigestion,
- Douleur d'estomac,
- démangeaisons ou pertes vaginales,
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Keflex. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
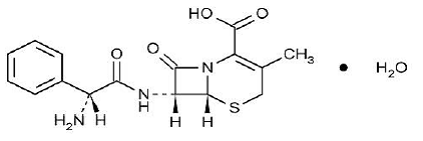
KEFLEX® (céphalexine) Capsules, USP est un médicament antibactérien de type céphalosporine semi-synthétique destiné à l'administration orale. Il s'agit de l'acide 7-(D-α-amino-α-phénylacétamido)-3-méthyl-3-céphème-4-carboxylique monohydraté. La céphalexine a la formule moléculaire C16H17N3O4S•H2O et le poids moléculaire est de 365,41.
La céphalexine a la formule structurelle suivante :
Chaque capsule contient du monohydrate de céphalexine équivalent à 250 mg, 500 mg ou 750 mg de céphalexine. Les gélules contiennent également de la carboxyméthylcellulose sodique, du D&C jaune n° 10, de la diméthicone, du FD&C bleu n° 1, du FD&C jaune n° 6, de la gélatine, du stéarate de magnésium, de la cellulose microcristalline et du dioxyde de titane.
LES INDICATIONS
Infections des voies respiratoires
KEFLEX est indiqué pour le traitement des infections des voies respiratoires causées par des isolats sensibles de Streptococcus pneumoniae et Streptococcus pyogenes.
Otite moyenne
KEFLEX est indiqué pour le traitement des otites moyennes causées par des isolats sensibles de Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Streptococcus pyogenes et Moraxella catarrhalis.
Infections de la peau et des structures cutanées
KEFLEX 250 mg est indiqué pour le traitement des infections de la peau et des tissus cutanés causées par des isolats sensibles des bactéries Gram-positives suivantes : Staphylococcus aureus et Streptococcus pyogenes.
Infections osseuses
KEFLEX 250 mg est indiqué pour le traitement des infections osseuses causées par des isolats sensibles de Staphylococcus aureus et Proteus mirabilis.
Infections des voies génito-urinaires
KEFLEX est indiqué pour le traitement des infections des voies génito-urinaires, y compris la prostatite aiguë, causées par des isolats sensibles d'Escherichia coli, de Proteus mirabilis et de Klebsiella pneumoniae.
Usage
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l'efficacité de KEFLEX 250 mg et d'autres médicaments antibactériens, KEFLEX 500 mg doit être utilisé uniquement pour traiter les infections dont il est prouvé ou fortement suspecté qu'elles sont causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, ces informations doivent être prises en compte lors de la sélection ou de la modification du traitement antibactérien. En l'absence de telles données, l'épidémiologie locale et les schémas de sensibilité peuvent contribuer à la sélection empirique du traitement.
DOSAGE ET ADMINISTRATION
Adultes et patients pédiatriques âgés d'au moins 15 ans
La dose habituelle de KEFLEX 250 mg par voie orale est de 250 mg toutes les 6 heures, mais une dose de 500 mg toutes les 12 heures peut être administrée. Le traitement est administré pendant 7 à 14 jours.
Pour les infections plus graves, des doses plus importantes de KEFLEX par voie orale peuvent être nécessaires, jusqu'à 4 grammes par jour en deux à quatre doses également divisées.
Patients pédiatriques (plus d'un an)
La dose quotidienne totale recommandée de KEFLEX 500 mg par voie orale pour les patients pédiatriques est de 25 à 50 mg/kg administrée en doses égales pendant 7 à 14 jours. Dans le traitement des infections à streptocoques β-hémolytiques, une durée d'au moins 10 jours est recommandée. Dans les infections sévères, une dose quotidienne totale de 50 à 100 mg/kg peut être administrée en doses égales.
Pour le traitement de l'otite moyenne, la dose quotidienne recommandée est de 75 à 100 mg/kg administrée en doses égales.
Ajustements posologiques chez les patients adultes et pédiatriques âgés d'au moins 15 ans atteints d'insuffisance rénale
Administrer les schémas posologiques suivants pour KEFLEX aux patients présentant une fonction rénale altérée [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
COMMENT FOURNIE
Formes posologiques et points forts
Gélules de 250 mg : une poudre blanche à jaune clair remplie dans une capsule blanche opaque et vert foncé opaque qui est imprimée avec KEFLEX 250 mg à l'encre noire comestible sur le corps blanc.
Gélules de 500 mg : une poudre blanche à jaune clair remplie dans une capsule vert clair opaque et vert foncé opaque qui est imprimée avec KEFLEX 500 mg à l'encre noire comestible sur le corps vert clair.
Gélules de 750 mg : une poudre blanche à jaune clair remplie dans une capsule allongée vert foncé opaque et vert foncé opaque qui porte l'inscription KEFLEX 750 mg à l'encre blanche comestible sur le corps vert foncé.
Stockage et manutention
Capsules de KEFLEX (céphalexine) , USP, est fourni comme suit :
Gélules à 250 mg, flacons de 100 – CDN 59630-112-10 Gélules de 500 mg, flacons de 100 – CDN 59630-113-10 Gélules à 750 mg, flacons de 50 – CDN 59630-115-05
KEFLEX doit être conservé à 25°C (77°F); excursions permises jusqu'à 15° à 30°C (59° à 86°F) [voir Température ambiante contrôlée USP ].
Distribuer dans un récipient étanche et résistant à la lumière.
Fabriqué pour : Shionogi Inc. Florham Park, NJ 07932. Fabriqué par : Sandoz GmbH Kundl, Autriche. Révisé : octobre 2015.
EFFETS SECONDAIRES
Les événements graves suivants sont décrits plus en détail dans la section Avertissements et précautions :
- Réactions d'hypersensibilité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Diarrhée associée à Clostridium difficile [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Séroconversion directe du test de Coombs [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Potentiel de saisie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Effet sur l'activité de la prothrombine [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Développement de bactéries résistantes aux médicaments [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique
Dans les essais cliniques, l'effet indésirable le plus fréquent était la diarrhée. Des nausées et des vomissements, une dyspepsie, une gastrite et des douleurs abdominales sont également survenus. Comme avec les pénicillines et les autres céphalosporines, des cas d'hépatite transitoire et d'ictère cholestatique ont été signalés.
D'autres réactions ont inclus des réactions d'hypersensibilité, un prurit génital et anal, une candidose génitale, une vaginite et des pertes vaginales, des étourdissements, de la fatigue, des maux de tête, de l'agitation, de la confusion, des hallucinations, de l'arthralgie, de l'arthrite et des troubles articulaires. Une néphrite interstitielle réversible a été rapportée. Une éosinophilie, une neutropénie, une thrombocytopénie, une anémie hémolytique et de légères élévations de l'aspartate transaminase (AST) et de l'alanine transaminase (ALT) ont été rapportées.
En plus des effets indésirables énumérés ci-dessus qui ont été observés chez les patients traités par KEFLEX 500 mg, les effets indésirables suivants et d'autres tests de laboratoire modifiés ont été signalés pour les médicaments antibactériens de la classe des céphalosporines :
Autres effets indésirables
Fièvre, colite, anémie aplasique, hémorragie, dysfonctionnement rénal et néphropathie toxique.
Tests de laboratoire modifiés
Temps de prothrombine prolongé, augmentation de l'urée sanguine (BUN), augmentation de la créatinine, élévation de la phosphatase alcaline, élévation de la bilirubine, élévation de la lactate déshydrogénase (LDH), pancytopénie, leucopénie et agranulocytose.
INTERACTIONS MÉDICAMENTEUSES
Metformine
L'administration de KEFLEX 250 mg avec de la metformine entraîne une augmentation des concentrations plasmatiques de metformine et une diminution de la clairance rénale de la metformine.
Une surveillance attentive du patient et un ajustement posologique de la metformine sont recommandés chez les patients prenant simultanément KEFLEX et la metformine [voir PHARMACOLOGIE CLINIQUE ].
Probénécide
L'excrétion rénale de KEFLEX est inhibée par le probénécide. La co-administration de probénécide avec KEFLEX 500 mg n'est pas recommandée.
Interaction avec les tests de laboratoire ou de diagnostic
Une réaction faussement positive peut se produire lors du test de la présence de glucose dans l'urine à l'aide de la solution de Benedict ou de la solution de Fehling.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.

PRÉCAUTIONS
Réactions d'hypersensibilité
Des réactions allergiques sous forme d'éruption cutanée, d'urticaire, d'œdème de Quincke, d'anaphylaxie, d'érythème polymorphe, de syndrome de Stevens-Johnson ou de nécrolyse épidermique toxique ont été signalées lors de l'utilisation de KEFLEX. Avant d'instaurer un traitement par KEFLEX 500 mg, demandez si le patient a des antécédents de réactions d'hypersensibilité à la céphalexine, aux céphalosporines, aux pénicillines ou à d'autres médicaments. Une hypersensibilité croisée entre les bêta-lactamines peut survenir chez jusqu'à 10 % des patients ayant des antécédents d'allergie à la pénicilline.
En cas de réaction allergique à KEFLEX 500 mg, arrêter le médicament et instituer un traitement approprié.
Diarrhée associée à Clostridium difficile
Des diarrhées associées à Clostridium difficile (DACD) ont été signalées avec l'utilisation de presque tous les agents antibactériens, y compris KEFLEX 500 mg, et leur gravité peut varier d'une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens altère la flore normale du côlon, entraînant une prolifération de C. difficile.
C. difficile produit les toxines A et B, qui contribuent au développement de la DACD. Les souches de C. difficile productrices d'hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée suite à l'utilisation d'antibiotiques. Des antécédents médicaux minutieux sont nécessaires car il a été rapporté que la DACD survient plus de deux mois après l'administration d'agents antibactériens.
Si la DACD est suspectée ou confirmée, l'utilisation continue d'antibiotiques non dirigés contre C. difficile peut devoir être interrompue. Une gestion appropriée des liquides et des électrolytes, une supplémentation en protéines, un traitement antibiotique de C. difficile et une évaluation chirurgicale doivent être institués selon les indications cliniques.
Séroconversion directe du test de Coombs
Des tests de Coombs directs positifs ont été rapportés pendant le traitement avec les médicaments antibactériens à base de céphalosporine, y compris la céphalexine. Une hémolyse intravasculaire aiguë induite par un traitement par céphalexine a été rapportée. Si une anémie se développe pendant ou après le traitement par la céphalexine, effectuer un bilan diagnostique pour l'anémie hémolytique d'origine médicamenteuse, arrêter la céphalexine et instituer un traitement approprié.
Potentiel de saisie
Plusieurs céphalosporines ont été impliquées dans le déclenchement des crises, en particulier chez les insuffisants rénaux lorsque la posologie n'a pas été réduite. En cas de convulsions, arrêtez KEFLEX. Un traitement anticonvulsivant peut être administré si cliniquement indiqué.
Temps de prothrombine prolongé
Les céphalosporines peuvent être associées à un temps de prothrombine prolongé. Les personnes à risque comprennent les patients présentant une insuffisance rénale ou hépatique, ou un mauvais état nutritionnel, ainsi que les patients recevant un traitement antibactérien prolongé et les patients recevant un traitement anticoagulant. Surveiller le temps de prothrombine chez les patients à risque et gérer comme indiqué.
Développement de bactéries résistantes aux médicaments
La prescription de KEFLEX en l'absence d'infection bactérienne avérée ou fortement suspectée est peu susceptible d'apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes aux médicaments.
L'utilisation prolongée de KEFLEX peut entraîner la prolifération d'organismes non sensibles. Une observation attentive du patient est essentielle. Si une surinfection survient pendant le traitement, des mesures appropriées doivent être prises.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune étude sur la durée de vie chez l'animal n'a été réalisée pour évaluer le potentiel carcinogène de la céphalexine. Les tests pour déterminer le potentiel mutagène de la céphalexine n'ont pas été effectués. Chez les rats mâles et femelles, la fertilité et la performance reproductive n'ont pas été affectées par des doses orales de céphalexine jusqu'à 1,5 fois la dose humaine recommandée la plus élevée en fonction de la surface corporelle.
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse B
Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Des études de reproduction ont été réalisées sur des souris et des rats utilisant des doses orales de monohydrate de céphalexine 0,6 et 1,5 fois la dose humaine quotidienne maximale (66 mg/kg/jour) en fonction de la surface corporelle, et n'ont révélé aucun signe d'altération de la fertilité ou d'atteinte à la santé. le fœtus.
Mères allaitantes
La céphalexine est excrétée dans le lait maternel. La prudence s'impose lorsque KEFLEX est administré à une femme qui allaite.
Utilisation pédiatrique
L'innocuité et l'efficacité de KEFLEX 500 mg chez les patients pédiatriques ont été établies dans des essais cliniques pour les dosages décrits dans la section Posologie et administration [voir DOSAGE ET ADMINISTRATION ].
Utilisation gériatrique
Sur les 701 sujets des 3 études cliniques publiées sur la céphalexine, 433 (62 %) avaient 65 ans et plus. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences de réponses entre les patients âgés et les patients plus jeunes.
Ce médicament est en grande partie excrété par les reins et le risque de réactions toxiques à ce médicament peut être plus élevé chez les patients présentant une insuffisance rénale. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises lors de la sélection de la dose [voir AVERTISSEMENTS ET PRECAUTIONS ].
Insuffisance rénale
KEFLEX doit être administré avec prudence en présence d'insuffisance rénale (clairance de la créatinine DOSAGE ET ADMINISTRATION ].
RÉFÉRENCES
1. Institut des normes cliniques et de laboratoire (CLSI). Méthodes de dilution des tests de sensibilité aux antimicrobiens pour les bactéries à croissance aérobie ; Norme approuvée - Dixième édition. Document CLSI M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvanie 19087, États-Unis, 2015.
2. Institut des normes cliniques et de laboratoire (CLSI). Normes de performance pour les tests de sensibilité aux antimicrobiens ; Vingt-cinquième supplément d'information. Document CLSI M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvanie 19087, États-Unis, 2015.
3. Institut des normes cliniques et de laboratoire (CLSI). Normes de performance pour les tests de sensibilité aux disques antimicrobiens ; Norme approuvée - Douzième édition. Document CLSI M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvanie 19087, États-Unis, 2015.
SURDOSAGE
Les symptômes d'un surdosage oral peuvent inclure des nausées, des vomissements, une détresse épigastrique, une diarrhée et une hématurie. En cas de surdosage, instaurer des mesures générales de soutien.
La diurèse forcée, la dialyse péritonéale, l'hémodialyse ou l'hémoperfusion au charbon n'ont pas été établies comme étant bénéfiques en cas de surdosage de céphalexine.
CONTRE-INDICATIONS
KEFLEX est contre-indiqué chez les patients présentant une hypersensibilité connue à la céphalexine ou à d'autres membres de la classe des céphalosporines de médicaments antibactériens.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
La céphalexine est un médicament antibactérien de type céphalosporine [voir Microbiologie ].
Pharmacocinétique
Absorption
La céphalexine est stable en milieu acide et peut être administrée sans tenir compte des repas. Après des doses de 250 mg, 500 mg et 1 g, des concentrations sériques maximales moyennes d'environ 9, 18 et 32 mcg/mL, respectivement, ont été obtenues à 1 heure. Les taux sériques étaient détectables 6 heures après l'administration (à un niveau de détection de 0,2 mcg/mL).
Distribution
La céphalexine est liée à environ 10 % à 15 % aux protéines plasmatiques.
Excrétion
La céphalexine est excrétée dans l'urine par filtration glomérulaire et sécrétion tubulaire. Des études ont montré que plus de 90 % du médicament était excrété sous forme inchangée dans l'urine en 8 heures. Au cours de cette période, les concentrations urinaires maximales après les doses de 250 mg, 500 mg et 1 g étaient respectivement d'environ 1 000, 2 200 et 5 000 mcg/mL.
Interactions médicamenteuses
Chez des sujets sains ayant reçu des doses uniques de 500 mg de céphalexine et de metformine, la Cmax et l'ASC moyennes plasmatiques de la metformine ont augmenté en moyenne de 34 % et 24 %, respectivement, et la clairance rénale moyenne de la metformine a diminué de 14 %. Aucune information n'est disponible sur l'interaction de la céphalexine et de la metformine après plusieurs doses de l'un ou l'autre médicament.
Microbiologie
Mécanisme d'action
La céphalexine est un agent bactéricide qui agit en inhibant la synthèse de la paroi cellulaire bactérienne.
La résistance
Les staphylocoques résistants à la méthicilline et la plupart des isolats d'entérocoques sont résistants à la céphalexine. La céphalexine n'est pas active contre la plupart des isolats d'Enterobacter spp., Morganella morganii et Proteus vulgaris. La céphalexine n'a aucune activité contre Pseudomonas spp. ou Acinetobacter calcoaceticus. Streptococcus pneumoniae résistant à la pénicilline présente généralement une résistance croisée aux médicaments antibactériens bêta-lactamines.
Activité anti-microbienne
La céphalexine s'est avérée active contre la plupart des isolats des bactéries suivantes à la fois in vitro et dans les infections cliniques [voir INDICATIONS ET USAGE ].
Bactéries à Gram positif
Staphylococcus aureus (isolats sensibles à la méthicilline uniquement) Streptococcus pneumoniae (isolats sensibles à la pénicilline) Streptococcus pyogenes
Bactéries Gram-négatives
Escherichia coli Haemophilus influenzae Klebsiella pneumoniae Moraxella catarrhalis Proteus mirabilis
Méthodes des tests de sensibilité
Lorsqu'ils sont disponibles, le laboratoire de microbiologie clinique doit fournir au médecin les résultats des tests de sensibilité in vitro pour les produits médicamenteux antimicrobiens utilisés dans les hôpitaux résidents sous forme de rapports périodiques décrivant le profil de sensibilité des agents pathogènes nosocomiaux et d'origine communautaire. Ces rapports devraient aider le médecin à choisir un médicament antibactérien pour le traitement.
En cas d'infection urinaire non compliquée uniquement, la sensibilité d'E. coli, K. pneumoniae et P. mirabilis à la céphalexine peut être déduite en testant la céfazoline2.
Techniques de dilution
Des méthodes quantitatives sont utilisées pour déterminer les concentrations inhibitrices minimales antimicrobiennes (CMI). Ces CMI fournissent des estimations de la sensibilité des bactéries aux composés antimicrobiens. Les CMI doivent être déterminées à l'aide d'une méthode de test standardisée (bouillon ou gélose)1,2.
Techniques de diffusion
Les méthodes quantitatives qui nécessitent la mesure des diamètres de zone fournissent également des estimations reproductibles de la sensibilité des bactéries aux composés antimicrobiens. La taille de la zone fournit une estimation de la sensibilité des bactéries aux composés antimicrobiens. La taille de la zone doit être déterminée à l'aide d'une méthode de test normalisée2,3.
Un rapport de Susceptible (S) indique que le médicament antimicrobien est susceptible d'inhiber la croissance de l'agent pathogène si le médicament antimicrobien atteint la concentration habituellement réalisable au site de l'infection. Un rapport de l'intermédiaire (I) indique que le résultat doit être considéré comme équivoque, et si le micro-organisme n'est pas entièrement sensible aux autres médicaments cliniquement réalisables, le test doit être répété. Cette catégorie implique une applicabilité clinique possible dans des sites corporels où le médicament est physiologiquement concentré ou dans des situations où une dose élevée du médicament peut être utilisée. Cette catégorie fournit également une zone tampon qui empêche les petits facteurs techniques incontrôlés de provoquer des divergences majeures dans l'interprétation. Un rapport de résistant (R) indique que le médicament antimicrobien n'est pas susceptible d'inhiber la croissance de l'agent pathogène si le médicament antimicrobien atteint les concentrations habituellement réalisables au site d'infection ; un autre traitement doit être choisi.
Contrôle de qualité
Les procédures de test de sensibilité standardisées nécessitent l'utilisation de contrôles de laboratoire pour surveiller et garantir l'exactitude et la précision des fournitures et des réactifs utilisés dans le test, ainsi que les techniques de la personne effectuant le test1,2,3.
INFORMATIONS PATIENTS
- Informez les patients que des réactions allergiques, y compris des réactions allergiques graves, peuvent survenir et que des réactions graves nécessitent un traitement immédiat. Interroger le patient sur toute réaction d'hypersensibilité antérieure à KEFLEX, à d'autres bêta-lactamines (y compris les céphalosporines) ou à d'autres allergènes
- Informez les patients que la diarrhée est un problème courant causé par les médicaments antibactériens et qu'elle se résout généralement lorsque le médicament est arrêté. Parfois, une diarrhée aqueuse ou sanglante fréquente peut survenir et peut être le signe d'une infection intestinale plus grave. Si une diarrhée aqueuse ou sanglante sévère se développe, conseillez aux patients de contacter leur fournisseur de soins de santé.
- Conseillez aux patients que les médicaments antibactériens, y compris KEFLEX, ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsque KEFLEX 500 mg est prescrit pour traiter une infection bactérienne, informez les patients que même s'il est courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut (1) diminuer l'efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne puissent plus être traitées par KEFLEX ou d'autres médicaments antibactériens à l'avenir.
