Levaquin 250mg, 500mg, 750mg Levofloxacin Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Levaquin 750 mg et comment est-il utilisé ?
Levaquin est un médicament d'ordonnance utilisé pour traiter les symptômes de diverses infections bactériennes. Levaquin peut être utilisé seul ou avec d'autres médicaments.
Levaquin 500 mg appartient à une classe de médicaments appelés Fluoroquinolones.
On ne sait pas si Levaquin est sûr et efficace chez les enfants pour une durée de traitement supérieure à 14 jours.
Quels sont les effets secondaires possibles de Levaquin 500mg ?
Levaquin 750 mg peut provoquer des effets secondaires graves, notamment :
- mal de tête,
- faim,
- transpiration,
- irritabilité,
- vertiges,
- nausée,
- rythme cardiaque rapide,
- se sentir anxieux ou tremblant,
- engourdissements ou picotements dans les mains, les bras, les jambes ou les pieds,
- faiblesse dans les bras, les mains, les jambes ou les pieds,
- sensation de brûlure dans les bras, les mains, les jambes ou les pieds,
- graves changements d'humeur ou de comportement,
- nervosité,
- confusion,
- agitation,
- paranoïa,
- hallucinations,
- problèmes de mémoire,
- difficulté à se concentrer,
- pensées suicidaires,
- rupture tendineuse,
- douleur soudaine,
- gonflement,
- ecchymoses,
- tendresse,
- raideur,
- problèmes de mouvement,
- un claquement ou un claquement dans l'une de vos articulations,
- fortes douleurs à l'estomac,
- diarrhée aqueuse ou sanglante,
- flottant dans ta poitrine,
- essoufflement,
- démangeaison de la peau,
- problèmes de respiration,
- convulsions (convulsions),
- maux de tête intenses,
- problèmes de vue,
- douleur derrière les yeux,
- douleur dans le haut du ventre,
- perte d'appétit,
- urine foncée,
- selles de couleur argile, et
- jaunissement de la peau ou des yeux (jaunisse)
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Levaquin 250 mg incluent :
- nausée,
- constipation,
- diarrhée,
- mal de tête,
- des étourdissements et
- troubles du sommeil
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Levaquin. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
RÉACTIONS INDÉSIRABLES GRAVES, Y COMPRIS TENDINITE, RUPTURE DES TENDON, NEUROPATHIE PÉRIPHÉRIQUE, EFFETS SUR LE SYSTÈME NERVEUX CENTRAL ET EXACERBATION DE LA MYASTHÉNIE GRAVIE
- Les fluoroquinolones, y compris LEVAQUIN®, ont été associées à des effets indésirables graves invalidants et potentiellement irréversibles qui se sont produits ensemble [voir MISES EN GARDE ET PRÉCAUTIONS], notamment :
- Tendinite et rupture de tendon [voir MISES EN GARDE ET PRÉCAUTIONS]
- Neuropathie périphérique [voir MISES EN GARDE ET PRÉCAUTIONS]
- Effets sur le système nerveux central [voir MISES EN GARDE ET PRÉCAUTIONS]
Cesser immédiatement LEVAQUIN® et éviter l'utilisation de fluoroquinolones, y compris LEVAQUIN®, chez les patients qui présentent l'un de ces effets indésirables graves [voir MISES EN GARDE ET PRÉCAUTIONS]
- Les fluoroquinolones, y compris LEVAQUIN®, peuvent exacerber la faiblesse musculaire chez les patients atteints de myasthénie grave. Éviter LEVAQUIN® chez les patients ayant des antécédents connus de myasthénie grave [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Étant donné que les fluoroquinolones, y compris LEVAQUIN®, ont été associées à des effets indésirables graves [voir AVERTISSEMENTS ET PRECAUTIONS ], réserver LEVAQUIN® aux patients qui n'ont pas d'alternative thérapeutique pour les indications suivantes :
- Infection urinaire non compliquée [voir LES INDICATIONS ]
- Exacerbation bactérienne aiguë de la bronchite chronique [voir LES INDICATIONS ]
- Sinusite bactérienne aiguë [voir LES INDICATIONS ].
LA DESCRIPTION
Les comprimés LEVAQUIN® sont des agents antibactériens synthétiques pour administration orale. Chimiquement, la lévofloxacine, une carboxyquinolone fluorée chirale, est l'énantiomère (-)-(S) pur de la substance médicamenteuse racémique ofloxacine. Le nom chimique est (-)-(S)-9-fluoro-2,3-dihydro-3-méthyl-10-(4-méthyl-1-pipérazinyl)-7-oxo-7H-pyrido[1,2, Hémihydrate d'acide 3-de]-1,4-benzoxazine-6-carboxylique.
Figure 1: La structure chimique de la lévofloxacine
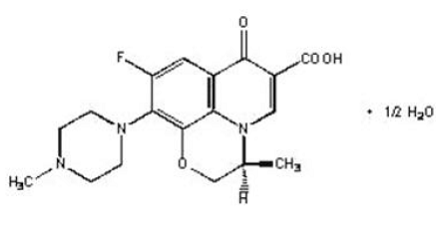
La formule empirique est C18H20FN3O4 · ½ H2O et le poids moléculaire est de 370,38. La lévofloxacine est un cristal ou une poudre cristalline blanc jaunâtre clair à blanc jaune. La molécule existe sous forme de zwitterion dans les conditions de pH de l'intestin grêle.
Les données démontrent qu'à partir d'un pH de 0,6 à 5,8, la solubilité de la lévofloxacine est essentiellement constante (environ 100 mg/mL). La lévofloxacine est considérée comme soluble à librement soluble dans cette plage de pH, telle que définie par la nomenclature USP. Au-dessus de pH 5,8, la solubilité augmente rapidement jusqu'à son maximum à pH 6,7 (272 mg/mL) et est considérée comme librement soluble dans cette plage. Au-dessus de pH 6,7, la solubilité diminue et atteint une valeur minimale (environ 50 mg/mL) à un pH d'environ 6,9.
La lévofloxacine a le potentiel de former des composés de coordination stables avec de nombreux ions métalliques. Ce potentiel de chélation in vitro a l'ordre de formation suivant : Al+3>Cu+2>Zn+2>Mg+2>Ca+2.
Les comprimés LEVAQUIN® sont disponibles sous forme de comprimés pelliculés et contiennent les ingrédients inactifs suivants :
- 250 mg (exprimé sous forme anhydre) : crospovidone, hypromellose, stéarate de magnésium, cellulose microcristalline, polyéthylèneglycol, polysorbate 80, oxyde de fer rouge synthétique et dioxyde de titane.
- 500 mg (exprimé sous forme anhydre) : crospovidone, hypromellose, stéarate de magnésium, cellulose microcristalline, polyéthylèneglycol, polysorbate 80, oxydes de fer rouge et jaune synthétiques et dioxyde de titane.
- 750 mg (exprimé sous forme anhydre) : crospovidone, hypromellose, stéarate de magnésium, cellulose microcristalline, polyéthylène glycol, polysorbate 80, dioxyde de titane.
LES INDICATIONS
Pneumonie nosocomiale
LEVAQUIN® est indiqué chez les patients adultes pour le traitement de la pneumonie nosocomiale due à Staphylococcus aureus sensible à la méthicilline, Pseudomonas aeruginosa, Serratia marcescens, Escherichia coli, Klebsiella pneumoniae, Haemophilus influenzae ou Streptococcus pneumoniae. Le traitement adjuvant doit être utilisé selon les indications cliniques. Lorsque Pseudomonas aeruginosa est un agent pathogène documenté ou présumé, un traitement combiné avec un β-lactamine anti-pseudomonas est recommandé [voir Etudes cliniques ].
Pneumonie communautaire
Régime de traitement de 7 à 14 jours
LEVAQUIN® est indiqué chez les patients adultes pour le traitement de la pneumonie communautaire due à Staphylococcus aureus sensible à la méthicilline, Streptococcus pneumoniae (y compris Streptococcus pneumoniae multirésistant [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae, Moraxella catarrhalis , Chlamydophila pneumoniae, Legionella pneumophila ou Mycoplasma pneumoniae [voir DOSAGE ET ADMINISTRATION et Etudes cliniques ].
Les isolats MDRSP sont des isolats résistants à au moins deux des antibactériens suivants : pénicilline (CMI ≥ 2 mcg/mL), céphalosporines de 2e génération, par exemple, céfuroxime, macrolides, tétracyclines et triméthoprime/sulfaméthoxazole.
Pneumonie communautaire
Régime de traitement de 5 jours
LEVAQUIN® est indiqué chez les patients adultes pour le traitement de la pneumonie communautaire due à Streptococcus pneumoniae (excluant les isolats multirésistants [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenzae, Mycoplasma pneumoniae ou Chlamydophila pneumoniae [voir DOSAGE ET ADMINISTRATION et Etudes cliniques ].
Infections compliquées de la peau et des structures cutanées
LEVAQUIN® est indiqué chez les patients adultes pour le traitement des infections compliquées de la peau et des annexes cutanées dues à Staphylococcus aureus sensible à la méthicilline, Enterococcus faecalis, Streptococcus pyogenes ou Proteus mirabilis [voir Etudes cliniques ].
Infections non compliquées de la peau et des structures cutanées
LEVAQUIN® est indiqué chez les patients adultes pour le traitement des infections non compliquées de la peau et des annexes cutanées (légères à modérées), y compris les abcès, la cellulite, les furoncles, l'impétigo, la pyodermite, les infections des plaies, dues à Staphylococcus aureus sensible à la méthicilline ou à Streptococcus pyogenes.
Prostatite bactérienne chronique
LEVAQUIN® est indiqué chez les patients adultes pour le traitement de la prostatite bactérienne chronique due à Escherichia coli, Enterococcus faecalis ou Staphylococcus epidermidis sensible à la méthicilline [voir Etudes cliniques ].
Anthrax par inhalation (post-exposition)
LEVAQUIN® est indiqué pour le traitement du charbon par inhalation (post-exposition) afin de réduire l'incidence ou la progression de la maladie suite à une exposition à Bacillus anthracis en aérosol chez les patients adultes et pédiatriques, âgés de 6 mois et plus [voir DOSAGE ET ADMINISTRATION ]. L'efficacité de LEVAQUIN® est basée sur les concentrations plasmatiques atteintes chez l'homme, critère de substitution raisonnablement susceptible de prédire le bénéfice clinique.
LEVAQUIN® n'a pas été testé chez l'homme pour la prévention post-exposition du charbon pulmonaire par inhalation. L'innocuité de LEVAQUIN® chez les adultes pour des durées de traitement supérieures à 28 jours ou chez les patients pédiatriques pour des durées de traitement supérieures à 14 jours n'a pas été étudiée. Le traitement prolongé par LEVAQUIN® ne doit être utilisé que lorsque les avantages l'emportent sur les risques [voir Etudes cliniques ].
Peste
LEVAQUIN® est indiqué pour le traitement de la peste, y compris la peste pulmonaire et septicémique, due à Yersinia pestis (Y. pestis) et la prophylaxie de la peste chez les adultes et les patients pédiatriques, âgés de 6 mois et plus [voir DOSAGE ET ADMINISTRATION ].
Les études d'efficacité de LEVAQUIN® n'ont pas pu être menées chez l'homme pesteux pour des raisons éthiques et de faisabilité. Par conséquent, l'approbation de cette indication a été basée sur une étude d'efficacité menée chez l'animal [voir Etudes cliniques ].
Infections urinaires compliquées
Régime de traitement de 5 jours
LEVAQUIN® est indiqué chez les patients adultes pour le traitement des infections compliquées des voies urinaires dues à Escherichia coli, Klebsiella pneumoniae ou Proteus mirabilis [voir Etudes cliniques ].
Infections urinaires compliquées
Régime de traitement de 10 jours
LEVAQUIN® est indiqué chez les patients adultes pour le traitement des infections compliquées des voies urinaires (légères à modérées) dues à Enterococcus faecalis, Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis ou Pseudomonas aeruginosa [voir Etudes cliniques ].
Pyélonéphrite aiguë
Régime de traitement de 5 ou 10 jours
LEVAQUIN® est indiqué chez les patients adultes pour le traitement de la pyélonéphrite aiguë causée par Escherichia coli, y compris les cas avec bactériémie concomitante [voir Etudes cliniques ].
Infections urinaires non compliquées
LEVAQUIN® est indiqué chez les patients adultes pour le traitement des infections urinaires non compliquées (légères à modérées) dues à Escherichia coli, Klebsiella pneumoniae ou Staphylococcus saprophyticus.
Étant donné que les fluoroquinolones, y compris LEVAQUIN®, ont été associées à des effets indésirables graves [voir AVERTISSEMENTS ET PRECAUTIONS et chez certains patients, les infections urinaires non compliquées sont spontanément résolutives, réserver LEVAQUIN® au traitement des infections urinaires non compliquées chez les patients qui n'ont pas d'autre option de traitement.
Exacerbation bactérienne aiguë de la bronchite chronique
LEVAQUIN® est indiqué chez les patients adultes pour le traitement de l'exacerbation bactérienne aiguë de la bronchite chronique (ABECB) due à Staphylococcus aureus sensible à la méthicilline, Streptococcus pneumoniae, Haemophilus influenzae, Haemophilus parainfluenzae ou Moraxella catarrhalis.
Étant donné que les fluoroquinolones, y compris LEVAQUIN®, ont été associées à des effets indésirables graves [voir AVERTISSEMENTS ET PRECAUTIONS ] et pour certains patients, l'ABECB est spontanément résolutif, réserver LEVAQUIN® pour le traitement de l'ABECB chez les patients qui n'ont pas d'autres options de traitement.
Sinusite bactérienne aiguë
Régimes de traitement de 5 jours et de 10 à 14 jours
LEVAQUIN® est indiqué chez les patients adultes pour le traitement de la sinusite bactérienne aiguë (SBA) due à Streptococcus pneumoniae, Haemophilus influenzae ou Moraxella catarrhalis [voir Etudes cliniques ].
Étant donné que les fluoroquinolones, y compris LEVAQUIN®, ont été associées à des effets indésirables graves [voir AVERTISSEMENTS ET PRECAUTIONS et pour certains patients, l'ABS est spontanément résolutif, réserver LEVAQUIN® pour le traitement de l'ABS chez les patients qui n'ont pas d'autres options de traitement.
Usage
Afin de réduire le développement de bactéries résistantes aux médicaments et de maintenir l'efficacité de LEVAQUIN® et d'autres médicaments antibactériens, LEVAQUIN® doit être utilisé uniquement pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu'elles sont causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte lors de la sélection ou de la modification du traitement antibactérien. En l'absence de telles données, l'épidémiologie locale et les schémas de sensibilité peuvent contribuer à la sélection empirique du traitement.
Tests de culture et de sensibilité
Des cultures et des tests de sensibilité appropriés doivent être effectués avant le traitement afin d'isoler et d'identifier les organismes à l'origine de l'infection et de déterminer leur sensibilité à la lévofloxacine [voir Microbiologie ]. Le traitement par LEVAQUIN® peut être initié avant que les résultats de ces tests ne soient connus ; une fois les résultats disponibles, un traitement approprié doit être sélectionné.
Comme avec d'autres médicaments de cette classe, certains isolats de Pseudomonas aeruginosa peuvent développer une résistance assez rapidement pendant le traitement par LEVAQUIN® . La culture et les tests de sensibilité effectués périodiquement pendant le traitement fourniront des informations sur la sensibilité continue des agents pathogènes à l'agent antimicrobien et également sur l'émergence possible d'une résistance bactérienne.
DOSAGE ET ADMINISTRATION
Posologie des comprimés LEVAQUIN® chez les patients adultes dont la clairance de la créatinine est ≥ 50 mL/minute
La dose habituelle de comprimés LEVAQUIN® est de 250 mg, 500 mg ou 750 mg administrée par voie orale toutes les 24 heures, comme indiqué par l'infection et décrit dans le tableau 1.
Ces recommandations s'appliquent aux patients dont la clairance de la créatinine est ≥ 50 ml/minute. Pour les patients dont la clairance de la créatinine est inférieure à 50 ml/min, des ajustements du schéma posologique sont nécessaires [voir Ajustement posologique chez les adultes atteints d'insuffisance rénale ].
Posologie des comprimés LEVAQUIN® chez les patients pédiatriques atteints d'anthrax par inhalation ou de peste
La posologie des comprimés LEVAQUIN® pour le charbon pulmonaire (post-exposition) et la peste chez les patients pédiatriques pesant 30 kg ou plus est décrite ci-dessous dans le tableau 2. Les comprimés LEVAQUIN® ne peuvent pas être administrés aux patients pesant moins de 30 kg en raison des limitations de la force disponible. Des formulations alternatives de lévofloxacine peuvent être envisagées pour les patients pédiatriques pesant moins de 30 kg.
Ajustement posologique chez les adultes atteints d'insuffisance rénale
Administrer LEVAQUIN® avec prudence chez les patients atteints d'insuffisance rénale. Une observation clinique attentive et des études de laboratoire appropriées doivent être réalisées avant et pendant le traitement car l'élimination de la lévofloxacine peut être réduite chez ces patients.
Chez les patients insuffisants rénaux (clairance de la créatinine inférieure à 50 ml/min), un ajustement de la posologie est nécessaire pour éviter l'accumulation de lévofloxacine due à une diminution de la clairance [voir Utilisation dans des populations spécifiques ]. Aucun ajustement n'est nécessaire pour les patients ayant une clairance de la créatinine supérieure ou égale à 50 ml/minute.
Le tableau 3 montre comment ajuster la dose en fonction de la clairance de la créatinine.
Interaction médicamenteuse avec les agents chélateurs
Antiacides, sucralfate, cations métalliques, multivitamines
Les comprimés LEVAQUIN® doivent être administrés au moins deux heures avant ou deux heures après les antiacides contenant du magnésium, de l'aluminium, ainsi que du sucralfate, des cations métalliques tels que le fer et des préparations multivitaminées avec des comprimés à croquer/tamponnés de zinc ou de didanosine ou la poudre pédiatrique pour solution buvable. [voir INTERACTIONS MÉDICAMENTEUSES et INFORMATIONS PATIENTS ].
Consignes administratives
Les comprimés LEVAQUIN® peuvent être administrés sans égard aux aliments.
Hydratation pour les patients recevant des comprimés LEVAQUIN®
Une hydratation adéquate des patients recevant LEVAQUIN® doit être maintenue pour prévenir la formation d'urine très concentrée. Une cristallurie et une cylindrurie ont été rapportées avec les quinolones [voir EFFETS INDÉSIRABLES et INFORMATIONS PATIENTS ].
COMMENT FOURNIE
Formes posologiques et points forts
COMPRIMÉS, pelliculés, en forme de capsule
- Comprimés roses en terre cuite de 250 mg, portant l'inscription « 250 » sur une face et « LEVAQUIN » sur l'autre face
- Comprimés de pêche à 500 mg, portant l'inscription « 500 » sur une face et « LEVAQUIN » sur l'autre face
- Comprimés blancs à 750 mg, portant l'inscription « 750 » sur une face et « LEVAQUIN » sur l'autre face
Stockage et manutention
Les comprimés LEVAQUIN® sont offerts sous forme de comprimés enrobés en forme de capsule dosés à 250, 500 et 750 mg.
Comprimés LEVAQUIN® sont conditionnés en flacons dans les configurations suivantes :
- Les comprimés de 250 mg sont de couleur rose terre cuite et portent les inscriptions : « LEVAQUIN® » sur une face et « 250 » sur l'autre face.
- bouteilles de 50 ( CDN 50458-920-50)
- Les comprimés de 500 mg sont de couleur pêche et portent l'inscription « LEVAQUIN® » d'un côté et « 500 » de l'autre.
- bouteilles de 50 ( CDN 50458-925-50)
- Les comprimés de 750 mg sont blancs et portent l'inscription « LEVAQUIN® » d'un côté et « 750 » de l'autre.
- bouteilles de 20 ( CDN 50458-930-20)
Les comprimés LEVAQUIN® doivent être conservés entre 15 et 30 °C (59 et 86 °F) dans des contenants bien fermés.
Fabriqué par : Ingrédient actif Fabriqué au Japon. Révisé : juillet 2018
EFFETS SECONDAIRES
Effets indésirables graves et autrement importants
Les effets indésirables graves et par ailleurs importants suivants sont traités plus en détail dans d'autres sections de l'étiquetage :
- Effets indésirables graves invalidants et potentiellement irréversibles [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Tendinite et rupture du tendon [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Neuropathie périphérique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Effets sur le système nerveux central [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Exacerbation de la myasthénie grave [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Autres réactions graves et parfois mortelles [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions d'hypersensibilité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hépatotoxicité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Diarrhée associée à Clostridium difficile [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Allongement de l'intervalle QT [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Troubles musculosquelettiques chez les patients pédiatriques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Troubles de la glycémie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Photosensibilité/Phototoxicité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Développement de bactéries résistantes aux médicaments [voir AVERTISSEMENTS ET PRECAUTIONS ]
Une cristallurie et une cylindrurie ont été rapportées avec les quinolones, y compris LEVAQUIN®. Par conséquent, une hydratation adéquate des patients recevant LEVAQUIN® doit être maintenue afin d'éviter la formation d'une urine très concentrée [voir DOSAGE ET ADMINISTRATION ].
Expérience d'essai clinique
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Les données décrites ci-dessous reflètent l'exposition à LEVAQUIN® chez 7537 patients dans 29 essais cliniques de phase 3 regroupés. La population étudiée avait un âge moyen de 50 ans (environ 74 % de la population avait LES INDICATIONS ]. Les patients ont reçu des doses de LEVAQUIN® de 750 mg une fois par jour, 250 mg une fois par jour ou 500 mg une ou deux fois par jour.
La durée du traitement était généralement de 3 à 14 jours et le nombre moyen de jours de traitement était de 10 jours.
L'incidence globale, le type et la distribution des effets indésirables étaient similaires chez les patients recevant des doses de LEVAQUIN® de 750 mg une fois par jour, 250 mg une fois par jour et 500 mg une ou deux fois par jour.
L'arrêt de LEVAQUIN® en raison d'effets indésirables est survenu chez 4,3 % des patients dans l'ensemble, 3,8 % des patients traités avec les doses de 250 mg et 500 mg et 5,4 % des patients traités avec la dose de 750 mg. Les effets indésirables les plus fréquents ayant conduit à l'arrêt des doses de 250 et 500 mg étaient gastro-intestinaux (1,4 %), principalement des nausées (0,6 %) ; vomissements (0,4%); étourdissements (0,3 %) ; et maux de tête (0,2 %). Les effets indésirables les plus fréquents ayant conduit à l'arrêt de la dose de 750 mg étaient gastro-intestinaux (1,2 %), principalement des nausées (0,6 %), des vomissements (0,5 %) ; étourdissements (0,3 %) ; et maux de tête (0,3 %).
Les effets indésirables survenant chez ≥ 1 % des patients traités par LEVAQUIN® et les effets indésirables moins fréquents, survenant chez 0,1 à
Lors d'essais cliniques utilisant un traitement à doses multiples, des anomalies ophtalmologiques, y compris des cataractes et des opacités lenticulaires ponctuées multiples, ont été observées chez des patients sous traitement par quinolones, y compris LEVAQUIN® . La relation entre les médicaments et ces événements n'est pas actuellement établie.
Expérience post-commercialisation
Le tableau 6 énumère les effets indésirables qui ont été identifiés lors de l'utilisation post-approbation de LEVAQUIN®. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
INTERACTIONS MÉDICAMENTEUSES
Agents de chélation
Antiacides, sucralfate, cations métalliques, multivitamines
Bien que la chélation par les cations divalents soit moins marquée qu'avec les autres fluoroquinolones, l'administration concomitante de comprimés LEVAQUIN® avec des antiacides contenant du magnésium ou de l'aluminium, ainsi que du sucralfate, des cations métalliques comme le fer et des préparations multivitaminées contenant du zinc peut interférer avec l'absorption gastro-intestinale. de lévofloxacine, entraînant des niveaux systémiques considérablement inférieurs à ceux souhaités. Les comprimés contenant des antiacides contenant du magnésium, de l'aluminium, ainsi que du sucralfate, des cations métalliques tels que le fer et des préparations multivitaminées contenant du zinc ou de la didanosine peuvent considérablement interférer avec l'absorption gastro-intestinale de la lévofloxacine, entraînant des taux systémiques considérablement inférieurs à ceux souhaités. Ces agents doivent être pris au moins deux heures avant ou deux heures après l'administration orale de LEVAQUIN®.
Warfarine
Aucun effet significatif de LEVAQUIN® sur les concentrations plasmatiques maximales, l'ASC et d'autres paramètres d'élimination de la warfarine R et S n'a été détecté dans une étude clinique impliquant des volontaires sains. De même, aucun effet apparent de la warfarine sur l'absorption et la disposition de la lévofloxacine n'a été observé. Cependant, il y a eu des rapports au cours de l'expérience post-commercialisation chez les patients que LEVAQUIN® augmente les effets de la warfarine. Des élévations du temps de prothrombine dans le cadre de l'utilisation concomitante de warfarine et de LEVAQUIN® ont été associées à des épisodes hémorragiques. Le temps de prothrombine, le rapport international normalisé (INR) ou d'autres tests d'anticoagulation appropriés doivent être étroitement surveillés si LEVAQUIN® est administré en concomitance avec la warfarine. Les patients doivent également être surveillés pour tout signe de saignement [voir EFFETS INDÉSIRABLES et INFORMATIONS PATIENTS ].
Agents antidiabétiques
Des perturbations de la glycémie, notamment une hyperglycémie et une hypoglycémie, ont été rapportées chez des patients traités simultanément par des fluoroquinolones et un antidiabétique. Par conséquent, une surveillance attentive de la glycémie est recommandée lorsque ces agents sont co-administrés [voir AVERTISSEMENTS ET PRECAUTIONS , EFFETS INDÉSIRABLES , et INFORMATIONS PATIENTS ].
Médicaments anti-inflammatoires non stéroïdiens
L'administration concomitante d'un anti-inflammatoire non stéroïdien avec une fluoroquinolone, y compris LEVAQUIN®, peut augmenter le risque de stimulation du SNC et de convulsions [voir AVERTISSEMENTS ET PRECAUTIONS ].
Théophylline
Aucun effet significatif de LEVAQUIN® sur les concentrations plasmatiques, l'ASC et d'autres paramètres de disposition de la théophylline n'a été détecté dans une étude clinique impliquant des volontaires sains. De même, aucun effet apparent de la théophylline sur l'absorption et la disposition de la lévofloxacine n'a été observé. Cependant, l'administration concomitante d'autres fluoroquinolones avec la théophylline a entraîné une demi-vie d'élimination prolongée, des taux sériques élevés de théophylline et une augmentation subséquente du risque d'effets indésirables liés à la théophylline dans la population de patients. Par conséquent, les taux de théophylline doivent être étroitement surveillés et les ajustements posologiques appropriés effectués lorsque LEVAQUIN® est co-administré. Des effets indésirables, y compris des convulsions, peuvent survenir avec ou sans élévation des taux sériques de théophylline [voir AVERTISSEMENTS ET PRECAUTIONS ].
Ciclosporine
Aucun effet significatif de LEVAQUIN® sur les concentrations plasmatiques maximales, l'ASC et d'autres paramètres d'élimination de la cyclosporine n'a été détecté dans une étude clinique impliquant des volontaires sains. Cependant, des taux sériques élevés de cyclosporine ont été rapportés dans la population de patients en cas d'administration concomitante avec d'autres fluoroquinolones. La Cmax et la ke de la lévofloxacine étaient légèrement inférieures tandis que la Tmax et la t1/2 étaient légèrement plus longues en présence de cyclosporine que celles observées dans d'autres études sans traitement concomitant. Cependant, les différences ne sont pas considérées comme cliniquement significatives. Par conséquent, aucun ajustement posologique n'est nécessaire pour LEVAQUIN® ou la cyclosporine lorsqu'ils sont administrés en concomitance.
Digoxine
Aucun effet significatif de LEVAQUIN® sur les concentrations plasmatiques maximales, l'ASC et d'autres paramètres d'élimination de la digoxine n'a été détecté dans une étude clinique impliquant des volontaires sains. La cinétique d'absorption et de disposition de la lévofloxacine était similaire en présence ou en l'absence de digoxine. Par conséquent, aucun ajustement posologique de LEVAQUIN® ou de la digoxine n'est nécessaire en cas d'administration concomitante.
Probénécide Et Cimétidine
Aucun effet significatif du probénécide ou de la cimétidine sur la Cmax de la lévofloxacine n'a été observé dans une étude clinique impliquant des volontaires sains. L'ASC et la t1/2 de la lévofloxacine étaient plus élevées tandis que la CL/F et la CLR étaient plus faibles pendant le traitement concomitant de LEVAQUIN® avec le probénécide ou la cimétidine par rapport à LEVAQUIN® seul. Cependant, ces changements ne justifient pas un ajustement posologique de LEVAQUIN® lorsque le probénécide ou la cimétidine sont co-administrés.
Interactions avec les tests de laboratoire ou de diagnostic
Certaines fluoroquinolones, y compris LEVAQUIN®, peuvent produire des résultats de dépistage urinaire faussement positifs pour les opiacés à l'aide de kits d'immunodosage disponibles dans le commerce. La confirmation des dépistages positifs aux opiacés par des méthodes plus spécifiques peut être nécessaire.
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Réactions indésirables graves invalidantes et potentiellement irréversibles, y compris tendinite et rupture de tendon, neuropathie périphérique et effets sur le système nerveux central
Les fluoroquinolones, y compris LEVAQUIN®, ont été associées à des effets indésirables graves invalidants et potentiellement irréversibles de différents systèmes corporels qui peuvent survenir ensemble chez le même patient. Les effets indésirables fréquemment observés comprennent la tendinite, la rupture du tendon, l'arthralgie, la myalgie, la neuropathie périphérique et les effets sur le système nerveux central (hallucinations, anxiété, dépression, insomnie, maux de tête sévères et confusion). Ces réactions peuvent survenir quelques heures à quelques semaines après le début de LEVAQUIN®. Des patients de tout âge ou sans facteurs de risque préexistants ont présenté ces effets indésirables [voir Tendinite et rupture de tendon, neuropathie périphérique, effets sur le système nerveux central ].
Arrêtez immédiatement LEVAQUIN® dès les premiers signes ou symptômes de tout effet indésirable grave. De plus, évitez l'utilisation de fluoroquinolones, y compris LEVAQUIN®, chez les patients qui ont présenté l'un de ces effets indésirables graves associés aux fluoroquinolones.
Tendinite et rupture de tendon
Les fluoroquinolones, y compris LEVAQUIN®, ont été associées à un risque accru de tendinite et de rupture de tendon à tous les âges [voir Réactions indésirables graves invalidantes et potentiellement irréversibles, y compris tendinite et rupture de tendon, neuropathie périphérique et effets sur le système nerveux central et EFFETS INDÉSIRABLES ]. Cet effet indésirable concerne le plus souvent le tendon d'Achille et a également été rapporté avec la coiffe des rotateurs (l'épaule), la main, le biceps, le pouce et d'autres sites tendineux. Une tendinite ou une rupture de tendon peut survenir quelques heures ou quelques jours après le début du traitement par LEVAQUIN® ou jusqu'à plusieurs mois après la fin du traitement par fluoroquinolone. La tendinite et la rupture du tendon peuvent survenir bilatéralement.
Le risque de développer une tendinite et une rupture de tendon associées aux fluoroquinolones est augmenté chez les patients de plus de 60 ans, chez ceux qui prennent des corticoïdes et chez les patients transplantés rénaux, cardiaques ou pulmonaires. D'autres facteurs qui peuvent indépendamment augmenter le risque de rupture du tendon comprennent une activité physique intense, une insuffisance rénale et des troubles tendineux antérieurs tels que la polyarthrite rhumatoïde. Des tendinites et des ruptures de tendons ont été rapportées chez des patients prenant des fluoroquinolones qui ne présentaient pas les facteurs de risque ci-dessus. Arrêtez LEVAQUIN® immédiatement si le patient ressent une douleur, un gonflement, une inflammation ou une rupture d'un tendon. Il faut conseiller aux patients de se reposer dès les premiers signes de tendinite ou de rupture de tendon et de contacter leur fournisseur de soins de santé concernant le passage à un médicament antimicrobien autre que la quinolone. Éviter LEVAQUIN® chez les patients ayant des antécédents de troubles tendineux ou de rupture de tendon [voir EFFETS INDÉSIRABLES et INFORMATIONS PATIENTS ].
Neuropathie périphérique
Les fluoroquinolones, y compris LEVAQUIN®, ont été associées à un risque accru de neuropathie périphérique. Des cas de polyneuropathie axonale sensorielle ou sensorimotrice affectant les petits et/ou gros axones entraînant des paresthésies, des hypoesthésies, des dysesthésies et une faiblesse ont été rapportés chez des patients recevant des fluoroquinolones, y compris LEVAQUIN®. Les symptômes peuvent survenir peu de temps après le début de LEVAQUIN® et peuvent être irréversibles chez certains patients [voir Réactions indésirables graves invalidantes et potentiellement irréversibles, y compris tendinite et rupture de tendon, neuropathie périphérique et effets sur le système nerveux central et EFFETS INDÉSIRABLES ].
Arrêtez LEVAQUIN® immédiatement si le patient présente des symptômes de neuropathie, notamment douleur, brûlure, picotements, engourdissement et/ou faiblesse ou autres altérations de la sensation, notamment toucher léger, douleur, température, sens de la position et sensation vibratoire. Éviter les fluoroquinolones, y compris LEVAQUIN®, chez les patients qui ont déjà présenté une neuropathie périphérique [voir EFFETS INDÉSIRABLES et INFORMATIONS PATIENTS ].
Effets sur le système nerveux central
Les fluoroquinolones, y compris LEVAQUIN®, ont été associées à un risque accru d'effets sur le système nerveux central (SNC), y compris des convulsions, des psychoses toxiques, une augmentation de la pression intracrânienne (y compris une pseudotumeur cérébrale). Les fluoroquinolones peuvent également provoquer une stimulation du système nerveux central pouvant entraîner des tremblements, de l'agitation, de l'anxiété, des étourdissements, de la confusion, des hallucinations, de la paranoïa, de la dépression, des cauchemars et de l'insomnie. Des pensées suicidaires et des tentatives ou des tentatives de suicide peuvent également survenir, en particulier chez les patients ayant des antécédents médicaux de dépression ou un facteur de risque sous-jacent de dépression. Ces réactions peuvent survenir après la première dose. Si ces réactions surviennent chez des patients recevant LEVAQUIN®, arrêtez LEVAQUIN® et mettez en place les mesures appropriées. Comme les autres fluoroquinolones, LEVAQUIN® doit être utilisé avec prudence chez les patients présentant un trouble du système nerveux central (SNC) connu ou soupçonné pouvant les prédisposer aux convulsions ou abaisser le seuil convulsif (p. ex., artériosclérose cérébrale grave, épilepsie) ou en présence d'autres facteurs de risque susceptibles de les prédisposer aux convulsions ou d'abaisser le seuil convulsif (p. ex., certains traitements médicamenteux, dysfonctionnement rénal). [voir EFFETS INDÉSIRABLES , INTERACTIONS MÉDICAMENTEUSES , et INFORMATIONS PATIENTS ].
Exacerbation de la myasthénie grave
Les fluoroquinolones, y compris LEVAQUIN®, ont une activité de blocage neuromusculaire et peuvent exacerber la faiblesse musculaire chez les patients atteints de myasthénie grave. Des effets indésirables graves post-commercialisation, y compris des décès et la nécessité d'une assistance ventilatoire, ont été associés à l'utilisation de fluoroquinolones chez des patients atteints de myasthénie grave. Éviter LEVAQUIN® chez les patients ayant des antécédents connus de myasthénie grave [voir EFFETS INDÉSIRABLES et INFORMATIONS PATIENTS ].
Autres effets indésirables graves et parfois mortels
D'autres effets indésirables graves et parfois mortels, certains dus à une hypersensibilité et d'autres à une étiologie incertaine, ont été rarement signalés chez des patients recevant un traitement par fluoroquinolones, y compris LEVAQUIN® . Ces événements peuvent être graves et surviennent généralement après l'administration de doses multiples. Les manifestations cliniques peuvent inclure un ou plusieurs des éléments suivants :
- fièvre, éruption cutanée ou réactions dermatologiques graves (p. ex. nécrolyse épidermique toxique, syndrome de Stevens-Johnson);
- vascularite; arthralgie; myalgie; maladie sérique;
- pneumonite allergique;
- néphrite interstitielle; insuffisance ou insuffisance rénale aiguë;
- hépatite; jaunisse; nécrose ou insuffisance hépatique aiguë;
- anémie, y compris hémolytique et aplasique; thrombocytopénie, y compris purpura thrombocytopénique thrombotique; leucopénie; agranulocytose; pancytopénie; et/ou d'autres anomalies hématologiques.
Arrêtez immédiatement LEVAQUIN® dès la première apparition d'une éruption cutanée, d'un ictère ou de tout autre signe d'hypersensibilité et mettez en place des mesures de soutien [voir EFFETS INDÉSIRABLES et INFORMATIONS PATIENTS ].
Réactions d'hypersensibilité
Des réactions d'hypersensibilité et/ou anaphylactiques graves et parfois mortelles ont été signalées chez des patients recevant un traitement par des fluoroquinolones, y compris LEVAQUIN® . Ces réactions surviennent souvent après la première dose. Certaines réactions ont été accompagnées d'un collapsus cardiovasculaire, d'une hypotension/choc, de convulsions, d'une perte de conscience, de picotements, d'un œdème de Quincke (y compris œdème/gonflement de la langue, du larynx, de la gorge ou du visage), d'une obstruction des voies respiratoires (y compris bronchospasme, essoufflement et troubles respiratoires aigus). détresse), dyspnée, urticaire, démangeaisons et autres réactions cutanées graves. LEVAQUIN® doit être arrêté immédiatement dès la première apparition d'une éruption cutanée ou de tout autre signe d'hypersensibilité. Les réactions d'hypersensibilité aiguës graves peuvent nécessiter un traitement par épinéphrine et d'autres mesures de réanimation, y compris l'oxygène, les liquides intraveineux, les antihistaminiques, les corticostéroïdes, les amines pressives et la prise en charge des voies respiratoires, selon les indications cliniques [voir EFFETS INDÉSIRABLES et INFORMATIONS PATIENTS ].
Hépatotoxicité
Des rapports post-commercialisation d'hépatotoxicité grave (y compris des hépatites aiguës et des événements mortels) ont été reçus chez des patients traités par LEVAQUIN® . Aucune preuve d'hépatotoxicité grave associée au médicament n'a été détectée dans les essais cliniques de plus de 7 000 patients. Une hépatotoxicité sévère est généralement survenue dans les 14 jours suivant le début du traitement et la plupart des cas sont survenus dans les 6 jours. La plupart des cas d'hépatotoxicité sévère n'étaient pas associés à une hypersensibilité [voir Autres effets indésirables graves et parfois mortels ].
La majorité des rapports d'hépatotoxicité mortelle sont survenus chez des patients de 65 ans ou plus et la plupart n'étaient pas associés à une hypersensibilité. LEVAQUIN® doit être arrêté immédiatement si le patient développe des signes et des symptômes d'hépatite [voir EFFETS INDÉSIRABLES et INFORMATIONS PATIENTS ].
Diarrhée associée à Clostridium difficile
Des diarrhées associées à Clostridium difficile (DACD) ont été signalées avec l'utilisation de presque tous les agents antibactériens, y compris LEVAQUIN®, et leur gravité peut varier d'une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens altère la flore normale du côlon, entraînant une prolifération de C. difficile.
C. difficile produit les toxines A et B qui contribuent au développement de CDAD. Les souches de C. difficile productrices d'hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée suite à l'utilisation d'antibiotiques. Des antécédents médicaux minutieux sont nécessaires car il a été rapporté que la DACD survient plus de deux mois après l'administration d'agents antibactériens.
Si la DACD est suspectée ou confirmée, l'utilisation continue d'antibiotiques non dirigés contre C. difficile peut devoir être interrompue. Une gestion appropriée des liquides et des électrolytes, une supplémentation en protéines, un traitement antibiotique de C. difficile et une évaluation chirurgicale doivent être instaurés selon les indications cliniques [voir EFFETS INDÉSIRABLES et INFORMATIONS PATIENTS ].
Allongement de l'intervalle QT
Certaines fluoroquinolones, dont LEVAQUIN®, ont été associées à un allongement de l'intervalle QT sur l'électrocardiogramme et à des cas peu fréquents d'arythmie. De rares cas de torsades de pointes ont été rapportés spontanément lors de la surveillance post-commercialisation chez des patients recevant des fluoroquinolones, dont LEVAQUIN®. LEVAQUIN® doit être évité chez les patients présentant un allongement connu de l'intervalle QT, les patients présentant une hypokaliémie non corrigée et les patients recevant des antiarythmiques de classe IA (quinidine, procaïnamide) ou de classe III (amiodarone, sotalol). Les patients âgés peuvent être plus sensibles aux effets associés aux médicaments sur l'intervalle QT [voir EFFETS INDÉSIRABLES , Utilisation dans des populations spécifiques , et INFORMATIONS PATIENTS ].
Troubles musculosquelettiques chez les patients pédiatriques et effets arthropathiques chez les animaux
LEVAQUIN® est indiqué chez les patients pédiatriques (âgés de 6 mois et plus) uniquement pour la prévention du charbon pulmonaire (post-exposition) et de la peste [voir LES INDICATIONS ]. Une incidence accrue de troubles musculo-squelettiques (arthralgie, arthrite, tendinopathie et anomalie de la marche) par rapport aux témoins a été observée chez les patients pédiatriques recevant LEVAQUIN® [voir Utilisation dans des populations spécifiques ].
Chez les rats et les chiens immatures, l'administration orale et intraveineuse de lévofloxacine a entraîné une augmentation de l'ostéochondrose. L'examen histopathologique des articulations portantes de chiens immatures ayant reçu une dose de lévofloxacine a révélé des lésions persistantes du cartilage. D'autres fluoroquinolones produisent également des érosions similaires dans les articulations portantes et d'autres signes d'arthropathie chez les animaux immatures de diverses espèces [voir Pharmacologie animale ].
Troubles de la glycémie
Comme avec les autres fluoroquinolones, des troubles de la glycémie, y compris une hyperglycémie et une hypoglycémie symptomatiques, ont été signalés avec LEVAQUIN®, habituellement chez des patients diabétiques recevant un traitement concomitant par un hypoglycémiant oral (p. ex., le glyburide) ou par de l'insuline. Chez ces patients, une surveillance attentive de la glycémie est recommandée. Si une réaction hypoglycémique survient chez un patient traité par LEVAQUIN®, LEVAQUIN® doit être interrompu et un traitement approprié doit être instauré immédiatement [voir EFFETS INDÉSIRABLES , INTERACTIONS MÉDICAMENTEUSES et INFORMATIONS PATIENTS ].
Photosensibilité/Phototoxicité
Réactions de photosensibilité/phototoxicité modérées à sévères, ces dernières pouvant se manifester par des réactions de coup de soleil exagérées (p. ex., brûlure, érythème, exsudation, vésicules, cloques, œdème) impliquant des zones exposées à la lumière (généralement le visage, la zone en « V » du cou , surfaces extenseurs des avant-bras, dos des mains), peuvent être associées à l'utilisation de fluoroquinolones après une exposition solaire ou aux UV. Par conséquent, une exposition excessive à ces sources de lumière doit être évitée. Le traitement médicamenteux doit être interrompu en cas de photosensibilité/phototoxicité [voir EFFETS INDÉSIRABLES et INFORMATIONS PATIENTS ].
Développement de bactéries résistantes aux médicaments
La prescription de LEVAQUIN® en l'absence d'infection bactérienne avérée ou fortement suspectée ou d'indication prophylactique est peu susceptible d'apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes aux médicaments [voir INFORMATIONS PATIENTS ].
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments ).
Réactions indésirables graves
Conseillez aux patients d'arrêter de prendre LEVAQUIN® s'ils ressentent un effet indésirable et d'appeler leur fournisseur de soins de santé pour obtenir des conseils sur la fin du traitement complet avec un autre médicament antibactérien.
Informez les patients des effets indésirables graves suivants qui ont été associés à l'utilisation de LEVAQUIN® ou d'autres fluoroquinolones :
- Réactions indésirables graves invalidantes et potentiellement irréversibles pouvant survenir ensemble : Informer les patients que des effets indésirables graves invalidants et potentiellement irréversibles, y compris des tendinites et des ruptures de tendons, des neuropathies périphériques et des effets sur le système nerveux central, ont été associés à l'utilisation de LEVAQUIN® et peuvent survenir ensemble chez le même patient. Informez les patients qu'ils doivent arrêter de prendre LEVAQUIN® immédiatement s'ils ressentent un effet indésirable et qu'ils doivent appeler leur fournisseur de soins de santé.
- Tendinite et rupture tendineuse : Demandez aux patients de contacter leur fournisseur de soins de santé s'ils ressentent une douleur, un gonflement ou une inflammation d'un tendon, ou une faiblesse ou une incapacité à utiliser l'une de leurs articulations ; se reposer et s'abstenir de faire de l'exercice; et arrêter le traitement par LEVAQUIN®. Les symptômes peuvent être irréversibles. Le risque de trouble tendineux sévère avec les fluoroquinolones est plus élevé chez les patients âgés généralement de plus de 60 ans, chez les patients prenant des corticostéroïdes et chez les patients ayant subi une transplantation rénale, cardiaque ou pulmonaire.
- Neuropathies périphériques : Informez les patients que des neuropathies périphériques ont été associées à l'utilisation de la lévofloxacine, les symptômes peuvent survenir peu après le début du traitement et peuvent être irréversibles. Si des symptômes de neuropathie périphérique tels que douleur, sensation de brûlure, picotements, engourdissement et/ou faiblesse se développent, arrêtez immédiatement LEVAQUIN® et dites-leur de contacter leur médecin.
- Effets sur le système nerveux central (par exemple, convulsions, étourdissements, étourdissements, augmentation de la pression intracrânienne) : informez les patients que des convulsions ont été signalées chez des patients recevant des fluoroquinolones, y compris la lévofloxacine. Demandez aux patients d'informer leur médecin avant de prendre ce médicament s'ils ont des antécédents de convulsions. Informez les patients qu'ils doivent savoir comment ils réagissent à LEVAQUIN® avant de conduire une automobile ou des machines ou de s'engager dans d'autres activités nécessitant de la vigilance mentale et de la coordination. Demandez aux patients d'informer leur médecin en cas de mal de tête persistant avec ou sans vision floue.
- Exacerbation de la myasthénie grave : Demandez aux patients d'informer leur médecin de tout antécédent de myasthénie grave. Demandez aux patients d'informer leur médecin s'ils ressentent des symptômes de faiblesse musculaire, y compris des difficultés respiratoires.
- Réactions d'hypersensibilité : Informez les patients que la lévofloxacine peut provoquer des réactions d'hypersensibilité, même après une dose unique, et d'arrêter le médicament au premier signe d'éruption cutanée, d'urticaire ou d'autres réactions cutanées, d'un rythme cardiaque rapide, de difficultés à avaler ou à respirer, tout gonflement suggérant un œdème de Quincke ( par exemple, gonflement des lèvres, de la langue, du visage, sensation d'oppression dans la gorge, enrouement) ou d'autres symptômes d'une réaction allergique.
- Hépatotoxicité : Informer les patients qu'une hépatotoxicité grave (y compris une hépatite aiguë et des événements mortels) a été signalée chez des patients prenant LEVAQUIN® . Demandez aux patients d'informer leur médecin s'ils présentent des signes ou des symptômes d'atteinte hépatique, notamment : perte d'appétit, nausées, vomissements, fièvre, faiblesse, fatigue, sensibilité du quadrant supérieur droit, démangeaisons, jaunissement de la peau et des yeux, selles de couleur claire. ou urine de couleur foncée.
- Diarrhée: La diarrhée est un problème courant causé par les antibiotiques qui se termine généralement lorsque l'antibiotique est arrêté. Parfois, après le début du traitement aux antibiotiques, les patients peuvent développer des selles liquides et sanglantes (avec ou sans crampes d'estomac et fièvre) même deux mois ou plus après avoir pris la dernière dose de l'antibiotique. Si cela se produit, demandez aux patients de contacter leur médecin dès que possible.
- Allongement de l'intervalle QT : Demandez aux patients d'informer leur médecin de tout antécédent personnel ou familial d'allongement de l'intervalle QT ou de conditions proarythmiques telles que l'hypokaliémie, la bradycardie ou une ischémie myocardique récente ; s'ils prennent des antiarythmiques de classe IA (quinidine, procaïnamide) ou de classe III (amiodarone, sotalol). Demandez aux patients d'informer leur médecin s'ils présentent des symptômes d'allongement de l'intervalle QT, y compris des palpitations cardiaques prolongées ou une perte de conscience.
- Troubles musculosquelettiques chez les patients pédiatriques : Demandez aux parents d'informer le médecin de leur enfant si l'enfant a des antécédents de problèmes articulaires avant de prendre ce médicament. Informez les parents des patients pédiatriques qu'ils doivent informer le médecin de leur enfant de tout problème articulaire survenant pendant ou après le traitement par la lévofloxacine [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
- Photosensibilité/Phototoxicité : Informer les patients qu'une photosensibilité/phototoxicité a été rapportée chez des patients recevant des fluoroquinolones. Informer les patients de minimiser ou d'éviter l'exposition à la lumière naturelle ou artificielle du soleil (lits de bronzage ou traitement UVA/B) pendant la prise de fluoroquinolones. Si les patients doivent être à l'extérieur pendant qu'ils utilisent des fluoroquinolones, demandez-leur de porter des vêtements amples qui protègent la peau de l'exposition au soleil et discutez d'autres mesures de protection solaire avec leur médecin. Si une réaction semblable à un coup de soleil ou une éruption cutanée se produit, demandez aux patients de contacter leur médecin.
Résistance antibactérienne
Les médicaments antibactériens, y compris LEVAQUIN®, ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsque LEVAQUIN® est prescrit pour traiter une infection bactérienne, les patients doivent être informés que même s'il est courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut (1) diminuer l'efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne puissent plus être traitées par LEVAQUIN® ou d'autres médicaments antibactériens à l'avenir.
Administration avec de la nourriture, des liquides et des médicaments concomitants
Les patients doivent être informés que les comprimés LEVAQUIN® peuvent être pris avec ou sans nourriture. Les comprimés doivent être pris à la même heure chaque jour.
Les patients doivent boire abondamment pendant qu'ils prennent LEVAQUIN® pour éviter la formation d'une urine très concentrée et la formation de cristaux dans l'urine.
Les antiacides contenant du magnésium ou de l'aluminium, ainsi que du sucralfate, des cations métalliques tels que le fer et les préparations multivitaminées contenant du zinc ou de la didanosine doivent être pris au moins deux heures avant ou deux heures après l'administration orale de LEVAQUIN®.
Interactions médicamenteuses avec l'insuline, les hypoglycémiants oraux et la warfarine
Les patients doivent être informés que s'ils sont diabétiques et qu'ils sont traités avec de l'insuline ou un hypoglycémiant oral et qu'une réaction hypoglycémique se produit, ils doivent arrêter LEVAQUIN® et consulter un médecin.
Les patients doivent être informés que l'administration concomitante de warfarine et de LEVAQUIN® a été associée à des augmentations du rapport international normalisé (INR) ou du temps de prothrombine et à des épisodes cliniques de saignement. Les patients doivent informer leur médecin s'ils prennent de la warfarine, être surveillés pour tout signe de saignement et faire surveiller de près leurs tests d'anticoagulation lorsqu'ils prennent de la warfarine en concomitance.
Études sur la peste et l'anthrax
Les patients recevant LEVAQUIN® pour ces affections doivent être informés que les études d'efficacité ne peuvent pas être menées chez l'homme pour des raisons d'éthique et de faisabilité. Par conséquent, l'approbation de ces affections était fondée sur des études d'efficacité menées sur des animaux.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Dans un essai biologique à vie chez le rat, la lévofloxacine n'a montré aucun potentiel carcinogène après une administration alimentaire quotidienne pendant 2 ans ; la dose la plus élevée (100 mg/kg/jour) était de 1,4 fois la dose humaine recommandée la plus élevée (750 mg) en fonction de la surface corporelle relative. La lévofloxacine n'a pas raccourci le temps de développement tumoral des tumeurs cutanées induites par les UV chez les souris albinos sans poils (Skh-1) à n'importe quel niveau de dose de lévofloxacine et n'était donc pas photo-cancérigène dans les conditions de cette étude. Les concentrations cutanées de lévofloxacine chez les souris sans poils variaient de 25 à 42 mcg/g à la dose de lévofloxacine la plus élevée (300 mg/kg/jour) utilisée dans l'étude de photocancérogénicité. En comparaison, les concentrations cutanées de lévofloxacine chez les sujets humains recevant 750 mg de LEVAQUIN® étaient en moyenne d'environ 11,8 mcg/g à la Cmax .
La lévofloxacine n'a pas été mutagène dans les tests suivants : test de mutation bactérienne d'Ames (S. typhimurium et E. coli), test de mutation directe CHO/HGPRT, test du micronoyau chez la souris, test de létalité dominante chez la souris, test de synthèse d'ADN non programmé chez le rat et chromatide sœur de la souris essai d'échange. Il était positif dans les tests in vitro d'aberration chromosomique (lignée cellulaire CHL) et d'échange de chromatides soeurs (lignée cellulaire CHL/IU).
La lévofloxacine n'a provoqué aucune altération de la fertilité ou des performances de reproduction chez le rat à des doses orales aussi élevées que 360 mg/kg/jour, correspondant à 4,2 fois la dose humaine recommandée la plus élevée en fonction de la surface corporelle relative et des doses intraveineuses aussi élevées que 100 mg/kg/jour. jour, correspondant à 1,2 fois la dose humaine recommandée la plus élevée en fonction de la surface corporelle relative.
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse C
La lévofloxacine n'a pas été tératogène chez le rat à des doses aussi élevées que 810 mg/kg/jour, ce qui correspond à 9,4 fois la dose humaine orale la plus élevée recommandée en fonction de la surface corporelle relative. La dose orale de 810 mg/kg/jour administrée à des rats a entraîné une diminution du poids corporel du fœtus et une augmentation de la mortalité fœtale. Aucune tératogénicité n'a été observée lorsque des lapins ont reçu par voie orale des doses aussi élevées que 50 mg/kg/jour, ce qui correspond à 1,1 fois la dose humaine orale la plus élevée recommandée en fonction de la surface corporelle relative.
Il n'y a cependant pas d'études adéquates et bien contrôlées chez les femmes enceintes. LEVAQUIN® ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Mères allaitantes
Sur la base de données sur d'autres fluoroquinolones et de données très limitées sur LEVAQUIN®, on peut supposer que la lévofloxacine sera excrétée dans le lait maternel. En raison du risque d'effets indésirables graves de LEVAQUIN® chez les nourrissons, une décision doit être prise soit d'interrompre l'allaitement soit d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère.
Utilisation pédiatrique
Les quinolones, y compris la lévofloxacine, provoquent une arthropathie et une ostéochondrose chez les animaux juvéniles de plusieurs espèces. [voir AVERTISSEMENTS ET PRECAUTIONS et Pharmacologie animale ].
Anthrax par inhalation (post-exposition)
La lévofloxacine est indiquée chez les patients pédiatriques âgés de 6 mois et plus, pour l'anthrax par inhalation (post-exposition). L'évaluation du rapport bénéfice/risque indique que l'administration de lévofloxacine aux patients pédiatriques est appropriée. La sécurité de la lévofloxacine chez les patients pédiatriques traités pendant plus de 14 jours n'a pas été étudiée [voir LES INDICATIONS , DOSAGE ET ADMINISTRATION et Etudes cliniques ].
Peste
La lévofloxacine est indiquée chez les patients pédiatriques, âgés de 6 mois et plus, pour le traitement de la peste, y compris la peste pulmonaire et septicémique due à Yersinia pestis (Y. pestis) et la prophylaxie de la peste. Les études d'efficacité de LEVAQUIN® n'ont pas pu être menées chez l'homme atteint de peste pulmonaire pour des raisons éthiques et de faisabilité. Par conséquent, l'approbation de cette indication a été basée sur une étude d'efficacité menée chez l'animal. L'évaluation du rapport bénéfice/risque indique que l'administration de lévofloxacine aux patients pédiatriques est appropriée [voir LES INDICATIONS , DOSAGE ET ADMINISTRATION et Etudes cliniques ].
L'innocuité et l'efficacité de LEVAQUIN® chez les patients pédiatriques âgés de moins de six mois n'ont pas été établies.
Pharmacocinétique après administration intraveineuse
La pharmacocinétique de la lévofloxacine après une dose intraveineuse unique a été étudiée chez des patients pédiatriques âgés de six mois à 16 ans. Les patients pédiatriques éliminent la lévofloxacine plus rapidement que les patients adultes, ce qui entraîne des expositions plasmatiques inférieures à celles des adultes pour une dose donnée en mg/kg [voir PHARMACOLOGIE CLINIQUE et Etudes cliniques ].
Posologie chez les patients pédiatriques atteints d'anthrax par inhalation ou de peste
Pour la posologie recommandée des comprimés LEVAQUIN® chez les patients pédiatriques atteints de charbon pulmonaire ou de peste, voir DOSAGE ET ADMINISTRATION . Les comprimés LEVAQUIN® ne peuvent pas être administrés aux patients pédiatriques pesant moins de 30 kg en raison des limites des dosages disponibles. Des formulations alternatives de lévofloxacine peuvent être envisagées pour les patients pédiatriques pesant moins de 30 kg.
Effets indésirables
Dans les essais cliniques, 1 534 patients pédiatriques (âgés de 6 mois à 16 ans) ont été traités par LEVAQUIN® par voie orale et intraveineuse. Les patients pédiatriques âgés de 6 mois à 5 ans ont reçu LEVAQUIN® 10 mg/kg deux fois par jour et les patients pédiatriques de plus de 5 ans ont reçu 10 mg/kg une fois par jour (maximum 500 mg par jour) pendant environ 10 jours. Les comprimés LEVAQUIN® ne peuvent être administrés qu'aux patients pédiatriques atteints d'anthrax par inhalation (post-exposition) ou de peste qui pèsent 30 kg ou plus en raison des limites des dosages disponibles [voir DOSAGE ET ADMINISTRATION ].
Un sous-ensemble de patients pédiatriques dans les essais cliniques (1340 traités par LEVAQUIN® et 893 traités par des non-fluoroquinolones) inclus dans une étude de surveillance prospective à long terme pour évaluer l'incidence des troubles musculo-squelettiques définis par le protocole (arthralgie, arthrite, tendinopathie, anomalie de la marche ) pendant 60 jours et 1 an après la première dose du médicament à l'étude. Les patients pédiatriques traités avec LEVAQUIN® présentaient une incidence significativement plus élevée de troubles musculo-squelettiques par rapport aux enfants non traités par fluoroquinolone, comme illustré dans le tableau 7. Les comprimés LEVAQUIN® ne peuvent être administrés qu'aux patients pédiatriques atteints de charbon pulmonaire (post-exposition) ou de peste. qui pèsent 30 kg ou plus en raison des limitations des dosages disponibles [voir DOSAGE ET ADMINISTRATION ].
L'arthralgie était le trouble musculo-squelettique le plus fréquent dans les deux groupes de traitement. La plupart des troubles musculo-squelettiques dans les deux groupes impliquaient plusieurs articulations portantes. Les troubles étaient modérés chez 8/46 (17 %) enfants et légers chez 35/46 (76 %) patients pédiatriques traités par LEVAQUIN® et la plupart étaient traités avec des analgésiques. Le délai médian de résolution était de 7 jours pour les patients pédiatriques traités par LEVAQUIN® et de 9 pour les enfants non traités par fluoroquinolone (environ 80 % de résolution dans les 2 mois dans les deux groupes). Aucun patient pédiatrique n'a présenté de trouble grave ou grave et tous les troubles musculo-squelettiques se sont résolus sans séquelles.
Les vomissements et la diarrhée ont été les effets indésirables les plus fréquemment rapportés, survenant à une fréquence similaire chez les patients pédiatriques traités par LEVAQUIN® et non traités par fluoroquinolone.
En plus des effets indésirables rapportés chez les patients pédiatriques dans les essais cliniques, les effets indésirables rapportés chez les adultes au cours des essais cliniques ou après commercialisation [voir EFFETS INDÉSIRABLES ] peut également se produire chez les patients pédiatriques.
Utilisation gériatrique
Les patients gériatriques courent un risque accru de développer des troubles tendineux graves, y compris une rupture de tendon, lorsqu'ils sont traités avec une fluoroquinolone telle que LEVAQUIN®. Ce risque est encore accru chez les patients recevant une corticothérapie concomitante. Une tendinite ou une rupture de tendon peut impliquer le tendon d'Achille, la main, l'épaule ou d'autres sites tendineux et peut survenir pendant ou après la fin du traitement ; des cas survenant jusqu'à plusieurs mois après un traitement aux fluoroquinolones ont été rapportés. La prudence s'impose lors de la prescription de LEVAQUIN® à des patients âgés, en particulier ceux qui prennent des corticostéroïdes. Les patients doivent être informés de cet effet secondaire potentiel et conseillés d'arrêter LEVAQUIN® et de contacter leur fournisseur de soins de santé si des symptômes de tendinite ou de rupture de tendon surviennent [voir AVERTISSEMENT DE BOÎTE ; AVERTISSEMENTS ET PRECAUTIONS ; et EFFETS INDÉSIRABLES ].

Dans les essais cliniques de phase 3, 1 945 patients traités par LEVAQUIN® (26 %) étaient âgés de ≥ 65 ans. Parmi ceux-ci, 1 081 patients (14 %) étaient âgés de 65 à 74 ans et 864 patients (12 %) avaient 75 ans ou plus. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue.
Des cas graves, et parfois mortels, d'hépatotoxicité ont été signalés après la commercialisation en association avec LEVAQUIN®. La majorité des rapports d'hépatotoxicité mortelle sont survenus chez des patients de 65 ans ou plus et la plupart n'étaient pas associés à une hypersensibilité. LEVAQUIN® doit être arrêté immédiatement si le patient développe des signes et des symptômes d'hépatite [voir AVERTISSEMENTS ET PRECAUTIONS ].
Les patients âgés peuvent être plus sensibles aux effets associés aux médicaments sur l'intervalle QT. Par conséquent, des précautions doivent être prises lors de l'utilisation de LEVAQUIN® avec des médicaments concomitants pouvant entraîner un allongement de l'intervalle QT (p. ex., antiarythmiques de classe IA ou de classe III) ou chez les patients présentant des facteurs de risque de torsade de pointes (p. hypokaliémie) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Les propriétés pharmacocinétiques de la lévofloxacine chez les jeunes adultes et les personnes âgées ne diffèrent pas significativement lorsque la clairance de la créatinine est prise en compte. Cependant, étant donné que le médicament est connu pour être en grande partie excrété par les reins, le risque de réactions toxiques à ce médicament peut être plus élevé chez les patients présentant une insuffisance rénale. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises lors du choix de la dose et il peut être utile de surveiller la fonction rénale [voir PHARMACOLOGIE CLINIQUE ].
Insuffisance rénale
La clairance de la lévofloxacine est considérablement réduite et la demi-vie d'élimination plasmatique est considérablement prolongée chez les patients insuffisants rénaux (clairance de la créatinine DOSAGE ET ADMINISTRATION ].
Insuffisance hépatique
Aucune étude pharmacocinétique n'a été menée chez des patients insuffisants hépatiques. En raison de l'étendue limitée du métabolisme de la lévofloxacine, la pharmacocinétique de la lévofloxacine ne devrait pas être affectée par une insuffisance hépatique.
SURDOSAGE
En cas de surdosage aigu, l'estomac doit être vidé. Le patient doit être surveillé et une hydratation appropriée doit être maintenue. La lévofloxacine n'est pas éliminée efficacement par hémodialyse ou dialyse péritonéale.
LEVAQUIN® présente un faible potentiel de toxicité aiguë. Des souris, des rats, des chiens et des singes ont présenté les signes cliniques suivants après avoir reçu une seule dose élevée de LEVAQUIN® : ataxie, ptose, diminution de l'activité locomotrice, dyspnée, prostration, tremblements et convulsions. Des doses dépassant 1500 mg/kg par voie orale et 250 mg/kg IV ont entraîné une mortalité significative chez les rongeurs.
CONTRE-INDICATIONS
LEVAQUIN® est contre-indiqué chez les personnes présentant une hypersensibilité connue à la lévofloxacine ou à d'autres antibactériens quinolones [voir AVERTISSEMENTS ET PRECAUTIONS ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
La lévofloxacine fait partie de la classe des fluoroquinolones d'agents antibactériens. voir Microbiologie ].
Pharmacocinétique
Les paramètres pharmacocinétiques moyens ± ET de la lévofloxacine déterminés dans des conditions uniques et à l'état d'équilibre après l'administration des comprimés oraux sont résumés dans le tableau 8.
La pharmacocinétique de la lévofloxacine est linéaire et prévisible après des schémas posologiques uniques et multiples par voie orale ou IV. L'état d'équilibre est atteint dans les 48 heures suivant un schéma posologique de 500 mg ou 750 mg une fois par jour. Les concentrations plasmatiques maximales et minimales moyennes ± SD atteintes après plusieurs schémas posologiques oraux une fois par jour étaient d'environ 5,7 ± 1,4 et 0,5 ± 0,2 mcg/mL après les doses de 500 mg, et de 8,6 ± 1,9 et 1,1 ± 0,4 mcg/mL après les 750 doses mg, respectivement. Les concentrations plasmatiques maximales et minimales moyennes ± SD atteintes après plusieurs schémas thérapeutiques IV une fois par jour étaient d'environ 6,4 ± 0,8 et 0,6 ± 0,2 mcg/mL après les doses de 500 mg, et de 12,1 ± 4,1 et 1,3 ± 0,71 mcg/mL après les doses de 750 mg. doses, respectivement.
Absorption
La lévofloxacine est rapidement et essentiellement complètement absorbée après administration orale. Les concentrations plasmatiques maximales sont généralement atteintes une à deux heures après l'administration orale. La biodisponibilité absolue de la lévofloxacine à partir d'un comprimé à 500 mg et d'un comprimé à 750 mg de LEVAQUIN® est d'environ 99 %, démontrant une absorption orale complète de la lévofloxacine. Après une dose intraveineuse unique de LEVAQUIN® chez des volontaires sains, la concentration plasmatique maximale moyenne ± ET atteinte était de 6,2 ± 1,0 mcg/mL après une dose de 500 mg perfusée en 60 minutes et de 11,5 ± 4,0 mcg/mL après une dose de 750 mg perfusée en 90 minutes. L'administration orale d'une dose de 500 mg de LEVAQUIN® avec de la nourriture prolonge le temps d'atteinte du pic de concentration d'environ 1 heure et diminue le pic de concentration d'environ 14 % après l'administration d'un comprimé et d'environ 25 % après l'administration d'une solution buvable. Par conséquent, les comprimés LEVAQUIN® peuvent être administrés sans égard aux aliments.
Le profil de concentration plasmatique de la lévofloxacine après administration IV est similaire et comparable en termes d'étendue de l'exposition (ASC) à celui observé pour les comprimés LEVAQUIN® lorsque des doses égales (mg/mg) sont administrées. Par conséquent, les voies d'administration orale et IV peuvent être considérées comme interchangeables.
Distribution
Le volume moyen de distribution de la lévofloxacine varie généralement de 74 à 112 L après des doses uniques et multiples de 500 mg ou 750 mg, indiquant une distribution étendue dans les tissus corporels. La lévofloxacine atteint ses concentrations maximales dans les tissus cutanés et dans le liquide des cloques de sujets sains environ 3 heures après l'administration. Le rapport biopsie du tissu cutané/ASC plasmatique est d'environ 2 et le rapport liquide vésiculaire/ASC plasmatique est d'environ 1 après l'administration orale quotidienne multiple de doses de 750 mg et 500 mg de LEVAQUIN®, respectivement, à des sujets sains. La lévofloxacine pénètre également bien dans les tissus pulmonaires. Les concentrations dans les tissus pulmonaires étaient généralement 2 à 5 fois plus élevées que les concentrations plasmatiques et variaient d'environ 2,4 à 11,3 mcg/g sur une période de 24 heures après une dose orale unique de 500 mg.
In vitro, sur une plage cliniquement pertinente (1 à 10 mcg/mL) de concentrations sériques/plasmatiques de lévofloxacine, la lévofloxacine est liée à environ 24 à 38 % aux protéines sériques chez toutes les espèces étudiées, comme déterminé par la méthode de dialyse à l'équilibre. La lévofloxacine est principalement liée à l'albumine sérique chez l'homme. La liaison de la lévofloxacine aux protéines sériques est indépendante de la concentration du médicament.
Élimination
Métabolisme
La lévofloxacine est stéréochimiquement stable dans le plasma et l'urine et ne s'inverse pas métaboliquement en son énantiomère, la D-ofloxacine. La lévofloxacine subit un métabolisme limité chez l'homme et est principalement excrétée sous forme inchangée dans l'urine. Après administration orale, environ 87 % d'une dose administrée ont été récupérés sous forme inchangée dans l'urine dans les 48 heures, tandis que moins de 4 % de la dose ont été récupérés dans les fèces en 72 heures. Moins de 5 % d'une dose administrée ont été récupérés dans l'urine sous forme de métabolites desméthyl et N-oxyde, les seuls métabolites identifiés chez l'homme. Ces métabolites ont peu d'activité pharmacologique pertinente.
Excrétion
La lévofloxacine est excrétée en grande partie sous forme inchangée dans l'urine. La demi-vie d'élimination plasmatique terminale moyenne de la lévofloxacine varie d'environ 6 à 8 heures après des doses uniques ou multiples de lévofloxacine administrées par voie orale ou intraveineuse. La clairance corporelle totale apparente moyenne et la clairance rénale varient d'environ 144 à 226 ml/min et de 96 à 142 ml/min, respectivement. Une clairance rénale supérieure au débit de filtration glomérulaire suggère que la sécrétion tubulaire de lévofloxacine se produit en plus de sa filtration glomérulaire. L'administration concomitante de cimétidine ou de probénécide entraîne une réduction d'environ 24 % et 35 % de la clairance rénale de la lévofloxacine, respectivement, ce qui indique que la sécrétion de lévofloxacine se produit dans le tubule rénal proximal. Aucun cristal de lévofloxacine n'a été trouvé dans les échantillons d'urine fraîchement prélevés chez les sujets recevant LEVAQUIN®.
Populations spécifiques
Patients gériatriques
Il n'y a pas de différences significatives dans la pharmacocinétique de la lévofloxacine entre les sujets jeunes et âgés lorsque les sujets " les différences de clairance de la créatinine sont prises en compte. Après une dose orale de 500 mg de LEVAQUIN® chez des sujets âgés en bonne santé (66 à 80 ans), la demi-vie d'élimination plasmatique terminale moyenne de la lévofloxacine était d'environ 7,6 heures, contre environ 6 heures chez les adultes plus jeunes. La différence était attribuable à la variation de l'état de la fonction rénale des sujets et n'était pas considérée comme cliniquement significative. L'absorption des médicaments ne semble pas affectée par l'âge. L'adaptation de la dose de LEVAQUIN® en fonction de l'âge seul n'est pas nécessaire [voir Utilisation dans des populations spécifiques ].
Patients pédiatriques
La pharmacocinétique de la lévofloxacine après une dose intraveineuse unique de 7 mg/kg a été étudiée chez des patients pédiatriques âgés de 6 mois à 16 ans. Les patients pédiatriques ont éliminé la lévofloxacine plus rapidement que les patients adultes, entraînant des expositions plasmatiques plus faibles que les adultes pour une dose donnée en mg/kg. Des analyses pharmacocinétiques ultérieures ont prédit qu'un schéma posologique de 8 mg/kg toutes les 12 heures (sans dépasser 250 mg par dose) pour les patients pédiatriques âgés de 6 mois à 17 ans permettrait d'obtenir des expositions plasmatiques à l'état d'équilibre comparables (ASC0-24 et Cmax) à ceux observés chez les patients adultes ayant reçu 500 mg de lévofloxacine une fois toutes les 24 heures. Les comprimés LEVAQUIN® ne peuvent être administrés qu'aux patients pédiatriques atteints d'anthrax par inhalation (post-exposition) ou de peste qui pèsent 30 kg ou plus en raison des limites des dosages disponibles [voir DOSAGE ET ADMINISTRATION ].
Sujets masculins et féminins
Il n'y a pas de différences significatives dans la pharmacocinétique de la lévofloxacine entre les sujets masculins et féminins lorsque les sujets & # 39; les différences de clairance de la créatinine sont prises en compte. Après l'administration d'une dose orale de 500 mg de LEVAQUIN® à des sujets sains de sexe masculin, la demi-vie d'élimination plasmatique terminale moyenne de la lévofloxacine était d'environ 7,5 heures, comparativement à environ 6,1 heures chez les sujets féminins. Cette différence était attribuable à la variation de l'état de la fonction rénale des sujets masculins et féminins et n'était pas considérée comme cliniquement significative. L'absorption des médicaments ne semble pas être affectée par le sexe des sujets. Un ajustement posologique basé uniquement sur le sexe n'est pas nécessaire.
Groupes raciaux ou ethniques
L'effet de la race sur la pharmacocinétique de la lévofloxacine a été examiné au moyen d'une analyse de covariables effectuée sur les données de 72 sujets : 48 blancs et 24 non blancs. La clairance corporelle totale apparente et le volume de distribution apparent n'ont pas été affectés par la race des sujets.
Patients atteints d'insuffisance rénale
La clairance de la lévofloxacine est considérablement réduite et la demi-vie d'élimination plasmatique est considérablement prolongée chez les patients adultes présentant une insuffisance rénale (clairance de la créatinine DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ].
Patients atteints d'insuffisance hépatique
Aucune étude pharmacocinétique n'a été menée chez des patients atteints d'insuffisance hépatique. En raison de l'étendue limitée du métabolisme de la lévofloxacine, la pharmacocinétique de la lévofloxacine ne devrait pas être affectée par une insuffisance hépatique [voir Utilisation dans des populations spécifiques ].
Patients atteints d'infection bactérienne
La pharmacocinétique de la lévofloxacine chez les patients atteints d'infections bactériennes communautaires graves est comparable à celle observée chez les sujets sains.
Études sur les interactions médicamenteuses
Le potentiel d'interactions médicamenteuses pharmacocinétiques entre LEVAQUIN® et les antiacides, la warfarine, la théophylline, la cyclosporine, la digoxine, le probénécide et la cimétidine a été évalué [voir INTERACTIONS MÉDICAMENTEUSES ].
Microbiologie
Mécanisme d'action
La lévofloxacine est l'isomère L du racémate, l'ofloxacine, un agent antimicrobien quinolone. L'activité antibactérienne de l'ofloxacine réside principalement dans l'isomère L. Le mécanisme d'action de la lévofloxacine et d'autres antimicrobiens fluoroquinolones implique l'inhibition de la topoisomérase bactérienne IV et de l'ADN gyrase (qui sont toutes deux des topoisomérases de type II), enzymes nécessaires à la réplication, la transcription, la réparation et la recombinaison de l'ADN.
La résistance
La résistance aux fluoroquinolones peut survenir par des mutations dans des régions définies de l'ADN gyrase ou de la topoisomérase IV, appelées régions déterminant la résistance aux quinolones (QRDR), ou par un efflux altéré.
Les fluoroquinolones, y compris la lévofloxacine, diffèrent par leur structure chimique et leur mode d'action des aminoglycosides, des macrolides et des antibiotiques β-lactamines, y compris les pénicillines. Les fluoroquinolones peuvent donc être actives contre les bactéries résistantes à ces antimicrobiens.
La résistance à la lévofloxacine due à une mutation spontanée in vitro est un événement rare (gamme : 10-9 à 10-10). Une résistance croisée a été observée entre la lévofloxacine et certaines autres fluoroquinolones, certains micro-organismes résistants à d'autres fluoroquinolones pouvant être sensibles à la lévofloxacine.
Activité anti-microbienne
La lévofloxacine a une activité in vitro contre les bactéries Gram-négatives et Gram-positives.
La lévofloxacine s'est avérée active contre la plupart des isolats des bactéries suivantes, à la fois in vitro et dans les infections cliniques, comme décrit dans voir LES INDICATIONS :
Bactéries aérobies
Bactéries Gram-positives
Enterococcus faecalisStaphylococcus aureus (isolats sensibles à la méthicilline)Staphylococcus epidermidis (isolats sensibles à la méthicilline)Staphylococcus saprophyticusStreptococcus pneumoniae (y compris les isolats multirésistants [MDRSP]1)Streptococcus pyogenes
Bactéries Gram-négatives
Enterobacter cloacaeEscherichia coliHaemophilus influenzaeHaemophilus parainfluenzaeKlebsiella pneumoniaeLegionella pneumophilaMoraxella catarrhalisProteus mirabilisPseudomonas aeruginosaSerratia marcescens
Autres micro-organismes
Chlamydophila pneumoniae Mycoplasma pneumoniae
Les données in vitro suivantes sont disponibles, mais leur signification clinique est inconnue : la lévofloxacine présente des concentrations minimales inhibitrices in vitro (valeurs CMI) de 2 mcg/mL ou moins contre la plupart (≥ 90 %) des isolats des micro-organismes suivants ; cependant, l'innocuité et l'efficacité de LEVAQUIN® dans le traitement des infections cliniques dues à ces bactéries n'ont pas été établies dans des essais cliniques adéquats et bien contrôlés.
Les isolats MDRSP (Multi-drug resistant Streptococcus pneumoniae) sont des isolats résistants à au moins deux des antibiotiques suivants : pénicilline (CMI ≥2 mcg/mL), céphalosporines de 2e génération, p. ex. céfuroxime; macrolides, tétracyclines et triméthoprime/sulfaméthoxazole.
Bactéries aérobies
Bactéries Gram-positives
Staphylococcus haemolyticusStreptocoque β-hémolytique (Groupe C/F)Streptocoque β-hémolytique (Groupe G)Streptococcus agalactiaeStreptococcus milleriStreptocoques du groupe ViridansBacillus anthracis
Bactéries Gram-négatives
Acinetobacter baumanniiAcinetobacter lwoffiiBordetella pertussisCitrobacter koseriCitrobacter freundiiEnterobacter aerogenesEnterobacter sakazakiiKlebsiella oxytocaMorganella morganiiPantoea agglomeransProteus vulgarisProvidencia rettgeriProvidencia stuartiiPseudomonas fluorescensYersinia pestis
Bactéries anaérobies
Bactéries Gram-positives
Clostridium perfringens
Tests de sensibilité
Pour des informations spécifiques concernant les critères d'interprétation des tests de sensibilité et les méthodes de test associées et les normes de contrôle qualité reconnues par la FDA pour ce médicament, veuillez consulter : https://www.fda.gov/STIC.
Toxicologie animale et/ou pharmacologie
Il a été démontré que la lévofloxacine et d'autres quinolones provoquent une arthropathie chez les animaux immatures de la plupart des espèces testées [voir AVERTISSEMENTS ET PRECAUTIONS ]. Chez les chiens immatures (âgés de 4 à 5 mois), des doses orales de 10 mg/kg/jour pendant 7 jours et des doses intraveineuses de 4 mg/kg/jour pendant 14 jours de lévofloxacine ont entraîné des lésions arthropathiques. L'administration à des doses orales de 300 mg/kg/jour pendant 7 jours et à des doses intraveineuses de 60 mg/kg/jour pendant 4 semaines a provoqué une arthropathie chez des rats juvéniles. Des chiens beagle âgés de trois mois ayant reçu par voie orale de la lévofloxacine à raison de 40 mg/kg/jour ont présenté une arthrotoxicité cliniquement grave entraînant l'arrêt du traitement au jour 8 d'une routine de dosage de 14 jours. De légers effets cliniques musculo-squelettiques, en l'absence d'effets pathologiques ou histopathologiques macroscopiques, ont résulté de la dose la plus faible de 2,5 mg/kg/jour (environ 0,2 fois la dose pédiatrique d'après les comparaisons de l'ASC). Une synovite et des lésions du cartilage articulaire ont été observées aux doses de 10 et 40 mg/kg (environ 0,7 fois et 2,4 fois la dose pédiatrique, respectivement, sur la base des comparaisons de l'ASC). La pathologie macroscopique du cartilage articulaire et l'histopathologie ont persisté jusqu'à la fin de la période de récupération de 18 semaines pour les chiens aux doses de 10 et 40 mg/kg/jour.
Lorsqu'elle a été testée dans un essai biologique de gonflement de l'oreille de souris, la lévofloxacine a présenté une phototoxicité similaire en ampleur à l'ofloxacine, mais moins de phototoxicité que les autres quinolones.
Bien que la cristallurie ait été observée dans certaines études intraveineuses chez le rat, les cristaux urinaires ne se forment pas dans la vessie, n'étant présents qu'après la miction et ne sont pas associés à une néphrotoxicité.
Chez la souris, l'effet stimulant des quinolones sur le SNC est renforcé par l'administration concomitante d'anti-inflammatoires non stéroïdiens.
Chez le chien, la lévofloxacine administrée à 6 mg/kg ou plus par injection intraveineuse rapide a produit des effets hypotenseurs. Ces effets ont été considérés comme étant liés à la libération d'histamine.
Des études in vitro et in vivo chez l'animal indiquent que la lévofloxacine n'est ni un inducteur ni un inhibiteur enzymatique dans la plage de concentration plasmatique thérapeutique humaine; par conséquent, aucune interaction liée aux enzymes métabolisant les médicaments avec d'autres médicaments ou agents n'est prévue.
Etudes cliniques
Pneumonie nosocomiale
Des patients adultes atteints de pneumonie nosocomiale cliniquement et radiologiquement documentée ont été inclus dans une étude multicentrique, randomisée et ouverte comparant LEVAQUIN® intraveineux (750 mg une fois par jour) suivi de LEVAQUIN® oral (750 mg une fois par jour) pendant un total de 7 à 15 jours à l'imipénème/cilastatine par voie intraveineuse (500-1000 mg toutes les 6 à 8 heures par jour) suivi de ciprofloxacine par voie orale (750 mg toutes les 12 heures par jour) pendant un total de 7 à 15 jours. Les patients traités par LEVAQUIN® ont reçu en moyenne 7 jours de thérapie intraveineuse (intervalle : 1 à 16 jours) ; les patients traités par comparateur ont reçu en moyenne 8 jours de thérapie intraveineuse (intervalle : 1 à 19 jours).
Globalement, dans la population cliniquement et microbiologiquement évaluable, un traitement adjuvant a été initié empiriquement à l'entrée dans l'étude chez 56 des 93 (60,2%) patients du bras LEVAQUIN® et 53 des 94 (56,4%) patients du bras comparateur. La durée moyenne du traitement adjuvant a été de 7 jours dans le bras LEVAQUIN® et de 7 jours dans le comparateur. Chez les patients cliniquement et microbiologiquement évaluables présentant une infection documentée à Pseudomonas aeruginosa, 15 sur 17 (88,2 %) ont reçu de la ceftazidime (N = 11) ou de la pipéracilline/tazobactam (N = 4) dans le bras LEVAQUIN® et 16 sur 17 (94,1 %) ont reçu un aminoglycoside dans le bras comparateur. Globalement, chez les patients cliniquement et microbiologiquement évaluables, la vancomycine a été ajoutée au schéma thérapeutique de 37 patients sur 93 (39,8 %) dans le bras LEVAQUIN® et de 28 patients sur 94 (29,8 %) dans le bras comparateur pour suspicion de S résistant à la méthicilline. infection aureus.
Les taux de réussite clinique chez les patients cliniquement et microbiologiquement évaluables lors de la visite post-thérapeutique (critère d'évaluation principal de l'étude évalué du jour 3 au jour 15 après la fin du traitement) étaient de 58,1 % pour LEVAQUIN® et de 60,6 % pour le comparateur. L'IC à 95 % de la différence des taux de réponse (LEVAQUIN® moins comparateur) était de [-17,2 ; 12,0]. Les taux d'éradication microbiologique à la visite post-thérapeutique étaient de 66,7 % pour LEVAQUIN® et de 60,6 % pour le comparateur. L'IC à 95 % de la différence des taux d'éradication (LEVAQUIN® moins comparateur) était de [-8,3 ; 20,3]. Le succès clinique et les taux d'éradication microbiologique par agent pathogène sont détaillés dans le tableau 9.
Pneumonie communautaire
Régime de traitement de 7 à 14 jours
Des patients adultes hospitalisés et ambulatoires ayant reçu un diagnostic de pneumonie bactérienne acquise dans la communauté ont été évalués dans 2 études cliniques pivots. Dans la première étude, 590 patients ont été inclus dans un essai prospectif, multicentrique, randomisé sans insu comparant LEVAQUIN® 500 mg une fois par jour par voie orale ou intraveineuse pendant 7 à 14 jours à la ceftriaxone 1 à 2 grammes par voie intraveineuse une fois ou en doses égales deux fois par jour. suivi de céfuroxime axétil 500 mg par voie orale deux fois par jour pendant un total de 7 à 14 jours. Les patients assignés au traitement avec le schéma témoin étaient autorisés à recevoir de l'érythromycine (ou de la doxycycline en cas d'intolérance à l'érythromycine) si une infection due à des agents pathogènes atypiques était suspectée ou avérée. Des évaluations cliniques et microbiologiques ont été effectuées pendant le traitement, 5 à 7 jours après le traitement et 3 à 4 semaines après le traitement. Le succès clinique (guérison plus amélioration) avec LEVAQUIN® 5 à 7 jours après le traitement, la principale variable d'efficacité dans cette étude, était supérieur (95 %) à celui du groupe témoin (83 %). L'IC à 95 % de la différence des taux de réponse (LEVAQUIN® moins comparateur) était de [-6, 19]. Dans la deuxième étude, 264 patients ont été inclus dans un essai prospectif, multicentrique et non comparatif de 500 mg de LEVAQUIN® administré par voie orale ou intraveineuse une fois par jour pendant 7 à 14 jours. Le succès clinique pour les patients cliniquement évaluables était de 93 %. Pour les deux études, le taux de réussite clinique chez les patients atteints de pneumonie atypique due à Chlamydophila pneumoniae, Mycoplasma pneumoniae et Legionella pneumophila était de 96 %, 96 % et 70 %, respectivement. Les taux d'éradication microbiologique dans les deux études sont présentés dans le tableau 10.
Pneumonie communautaire due à Streptococcus Pneumoniae multirésistant
LEVAQUIN® s'est avéré efficace pour le traitement de la pneumonie communautaire causée par le Streptococcus pneumoniae multirésistant (MDRSP). Les isolats MDRSP sont des isolats résistants à au moins deux des antibactériens suivants : pénicilline (CMI ≥ 2 mcg/mL), céphalosporines de 2e génération (p. ex., céfuroxime, macrolides, tétracyclines et triméthoprime/sulfaméthoxazole). Sur 40 patients microbiologiquement évaluables avec des isolats MDRSP, 38 patients (95,0 %) ont obtenu un succès clinique et bactériologique après le traitement. Les taux de succès clinique et bactérien sont présentés dans le tableau 11.
Tous les isolats n'étaient pas résistants à toutes les classes d'antimicrobiens testées. Les taux de réussite et d'éradication sont résumés dans le tableau 12.
Pneumonie communautaire
Régime de traitement de 5 jours
Pour évaluer l'innocuité et l'efficacité de la dose plus élevée et du traitement plus court de LEVAQUIN®, 528 adultes ambulatoires et hospitalisés atteints de pneumonie communautaire légère à grave cliniquement et radiologiquement déterminée ont été évalués dans une étude multicentrique prospective, randomisée, en double aveugle comparant LEVAQUIN ® 750 mg, IV ou voie orale, tous les jours pendant 5 jours ou LEVAQUIN® 500 mg IV ou voie orale, tous les jours pendant 10 jours.
Les taux de succès clinique (guérison plus amélioration) dans la population cliniquement évaluable ont été de 90,9 % dans le groupe LEVAQUIN® 750 mg et de 91,1 % dans le groupe LEVAQUIN® 500 mg. L'IC à 95 % pour la différence des taux de réponse (LEVAQUIN® 750 moins LEVAQUIN® 500) était de [-5,9, 5,4]. Dans la population cliniquement évaluable (31 à 38 jours après l'inclusion), une pneumonie a été observée chez 7 patients sur 151 du groupe LEVAQUIN® 750 mg et 2 patients sur 147 du groupe LEVAQUIN® 500 mg. Compte tenu des petits nombres observés, la signification de ce résultat ne peut être déterminée statistiquement. L'efficacité microbiologique du régime de 5 jours a été documentée pour les infections répertoriées dans le tableau 13.
Sinusite bactérienne aiguë
Régimes de traitement de 5 jours et de 10 à 14 jours
LEVAQUIN® est approuvé pour le traitement de la sinusite bactérienne aiguë (ABS) en utilisant soit 750 mg par voie orale × 5 jours, soit 500 mg par voie orale une fois par jour × 10 à 14 jours. Pour évaluer l'innocuité et l'efficacité d'un traitement de courte durée à forte dose de LEVAQUIN®, 780 adultes ambulatoires atteints de sinusite bactérienne aiguë cliniquement et radiologiquement déterminée ont été évalués dans une étude multicentrique prospective, randomisée, en double aveugle comparant LEVAQUIN® 750 mg par voie orale une fois par jour pendant cinq jours à LEVAQUIN® 500 mg par voie orale une fois par jour pendant 10 jours.
Les taux de réussite clinique (définis comme la résolution complète ou partielle des signes et symptômes pré-thérapeutiques de l'ABS à un point tel qu'aucun autre traitement antibiotique n'a été jugé nécessaire) dans la population microbiologiquement évaluable étaient de 91,4 % (139/152) dans l'étude LEVAQUIN® groupe 750 mg et 88,6% (132/149) dans le groupe LEVAQUIN® 500 mg lors de la visite de test de guérison (TOC) (IC 95% [-4,2, 10,0] pour LEVAQUIN® 750 mg moins LEVAQUIN® 500 mg) .
Les taux de succès clinique par agent pathogène dans la population microbiologiquement évaluable qui avait des échantillons obtenus par ponction antrale à l'entrée dans l'étude ont montré des résultats comparables pour les régimes de cinq et dix jours lors de la visite de test de guérison 22 jours après le traitement (voir tableau 14) .
Infections compliquées de la peau et des structures cutanées
Trois cent quatre-vingt-dix-neuf patients ont été inclus dans une étude comparative ouverte, randomisée, sur les infections compliquées de la peau et des structures cutanées. Les patients ont été randomisés pour recevoir soit LEVAQUIN® 750 mg une fois par jour (IV puis voie orale), soit un comparateur agréé pendant une durée médiane de 10 ± 4,7 jours. Comme attendu dans les infections compliquées de la peau et des annexes cutanées, des interventions chirurgicales ont été réalisées dans les groupes LEVAQUIN® et comparateur. La chirurgie (incision et drainage ou débridement) a été pratiquée chez 45 % des patients traités par LEVAQUIN® et 44 % des patients sous traitement comparateur, peu avant ou pendant l'antibiothérapie et faisait partie intégrante du traitement de cette indication.
Parmi ceux qui ont pu être évalués cliniquement 2 à 5 jours après la fin du médicament à l'étude, les taux de réussite globaux (améliorés ou guéris) étaient de 116/138 (84,1 %) pour les patients traités par LEVAQUIN® et de 106/132 (80,3 %) pour les patients traités avec le comparateur.
Les taux de réussite variaient selon le type de diagnostic, allant de 68 % chez les patients présentant des ulcères infectés à 90 % chez les patients présentant des plaies et des abcès infectés. Ces taux étaient équivalents à ceux observés avec les médicaments de comparaison.
Prostatite bactérienne chronique
Des patients adultes avec un diagnostic clinique de prostatite et des résultats de culture microbiologique d'un échantillon d'urine prélevé après un massage prostatique (VB3) ou des échantillons de sécrétion prostatique exprimée (EPS) obtenus via la procédure de Meares-Stamey ont été inclus dans une étude multicentrique, randomisée, en double aveugle comparant LEVAQUIN® 500 mg par voie orale, une fois par jour pendant 28 jours au total à la ciprofloxacine 500 mg par voie orale, deux fois par jour pendant 28 jours au total. Le critère principal d'évaluation de l'efficacité était l'efficacité microbiologique chez les patients microbiologiquement évaluables. Au total, 136 et 125 patients microbiologiquement évaluables ont été inscrits respectivement dans les groupes LEVAQUIN® et ciprofloxacine. Le taux d'éradication microbiologique par infection du patient 5 à 18 jours après la fin du traitement a été de 75,0 % dans le groupe LEVAQUIN® et de 76,8 % dans le groupe ciprofloxacine (IC à 95 % [-12,58, 8,98] pour LEVAQUIN® moins ciprofloxacine). Les taux d'éradication globaux des agents pathogènes d'intérêt sont présentés dans le tableau 15.
Les taux d'éradication de S. epidermidis lorsqu'il est trouvé avec d'autres co-pathogènes sont cohérents avec les taux observés dans les isolats purs.
Les taux de réussite clinique (guérison + amélioration sans nécessité d'antibiothérapie supplémentaire) dans la population microbiologiquement évaluable 5 à 18 jours après la fin du traitement étaient de 75,0 % pour les patients traités par LEVAQUIN® et de 72,8 % pour les patients traités par ciprofloxacine (IC à 95 % [- 8.87, 13.27] pour LEVAQUIN® moins ciprofloxacine). Les taux de réussite clinique à long terme (24 à 45 jours après la fin du traitement) étaient de 66,7 % pour les patients traités par LEVAQUIN® et de 76,9 % pour les patients traités par ciprofloxacine (IC à 95 % [-23,40, 2,89] pour LEVAQUIN® moins ciprofloxacine).
Infections urinaires compliquées et pyélonéphrite aiguë
Régime de traitement de 5 jours
Pour évaluer l'innocuité et l'efficacité de la dose plus élevée et du traitement plus court de LEVAQUIN®, 1 109 patients atteints d'IVUc et de PA ont été recrutés dans un essai clinique randomisé, en double aveugle et multicentrique mené aux États-Unis de novembre 2004 à avril 2006 comparant LEVAQUIN® 750 mg IV ou par voie orale une fois par jour pendant 5 jours (546 patients) avec ciprofloxacine 400 mg IV ou 500 mg par voie orale deux fois par jour pendant 10 jours (563 patients). Les patients atteints de PA compliquée par des maladies rénales sous-jacentes ou des affections telles qu'une obstruction complète, une intervention chirurgicale, une transplantation, une infection concomitante ou une malformation congénitale ont été exclus. L'efficacité a été mesurée par l'éradication bactériologique du ou des organismes de base lors de la visite post-thérapeutique chez les patients présentant un agent pathogène identifié au départ. La visite post-thérapeutique (test de guérison) a eu lieu 10 à 14 jours après la dernière dose active de LEVAQUIN® et 5 à 9 jours après la dernière dose de ciprofloxacine active.
Les taux de guérison bactériologique globaux pour LEVAQUIN® et contrôle lors de la visite de test de guérison (TOC) pour le groupe de tous les patients avec un agent pathogène documenté à l'inclusion (intention modifiée de traiter ou mITT) et le groupe de patients de la population mITT qui ont suivi de près le protocole (microbiologiquement évaluable) sont résumées dans le tableau 16.
Les taux d'éradication microbiologique dans la population microbiologiquement évaluable au TOC pour les agents pathogènes individuels récupérés chez les patients randomisés pour recevoir le traitement par LEVAQUIN® sont présentés dans le tableau 17.
Infections urinaires compliquées et pyélonéphrite aiguë
Régime de traitement de 10 jours
Pour évaluer l'innocuité et l'efficacité de la dose de 250 mg sur 10 jours de LEVAQUIN®, 567 patients atteints d'IU non compliquée, d'IUc légère à modérée et de PA légère à modérée ont été recrutés dans une étude randomisée, en double aveugle et multicentrique essai clinique mené aux États-Unis de juin 1993 à janvier 1995 comparant LEVAQUIN® 250 mg par voie orale 1 fois/jour pendant 10 jours (285 patients) à la ciprofloxacine 500 mg par voie orale 2 fois/jour pendant 10 jours (282 patients). Les patients avec un agent pathogène résistant, une infection urinaire récurrente, les femmes de plus de 55 ans et avec une sonde à demeure ont été initialement exclus, avant la modification du protocole qui a eu lieu après 30 % d'inscription. L'efficacité microbiologique a été mesurée par l'éradication bactériologique du ou des organismes de base 1 à 12 jours après le traitement chez les patients présentant un agent pathogène identifié au départ.
Les taux de guérison bactériologique globaux pour LEVAQUIN® et contrôle lors de la visite de test de guérison (TOC) pour le groupe de tous les patients avec un agent pathogène documenté à l'inclusion (intention modifiée de traiter ou mITT) et le groupe de patients de la population mITT qui ont suivi de près le protocole (microbiologiquement évaluable) sont résumées dans le tableau 18.
Anthrax par inhalation (post-exposition)
L'efficacité de LEVAQUIN® pour cette indication est basée sur les concentrations plasmatiques atteintes chez l'homme, critère de substitution raisonnablement susceptible de prédire le bénéfice clinique. LEVAQUIN® n'a pas été testé chez l'homme pour la prévention post-exposition du charbon pulmonaire par inhalation. Les concentrations plasmatiques moyennes de LEVAQUIN® associées à une amélioration statistiquement significative de la survie par rapport au placebo dans le modèle singe rhésus du charbon pulmonaire sont atteintes ou dépassées chez les patients adultes et pédiatriques recevant les schémas posologiques recommandés par voie orale et intraveineuse [voir LES INDICATIONS et DOSAGE ET ADMINISTRATION ].
La pharmacocinétique de la lévofloxacine a été évaluée chez des patients adultes et pédiatriques. La concentration plasmatique maximale moyenne (± ET) à l'état d'équilibre chez les adultes humains recevant 500 mg par voie orale ou intraveineuse une fois par jour est de 5,7 ± 1,4 et 6,4 ± 0,8 mcg/mL, respectivement ; et l'exposition plasmatique totale correspondante (AUC) est de 47,5 ± 6,7 et 54,6 ± 11,1 mcg.h/mL, respectivement. Les paramètres pharmacocinétiques prédits à l'état d'équilibre chez les patients pédiatriques âgés de 6 mois à 17 ans recevant 8 mg/kg par voie orale toutes les 12 heures (sans dépasser 250 mg par dose) ont été calculés pour être comparables à ceux observés chez les adultes recevant 500 mg par voie orale une fois par jour [voir PHARMACOLOGIE CLINIQUE ].
Les comprimés LEVAQUIN® ne peuvent être administrés qu'aux patients pédiatriques atteints d'anthrax par inhalation (post-exposition) ou de peste qui pèsent 30 kg ou plus en raison des limites des dosages disponibles [voir DOSAGE ET ADMINISTRATION ].
Chez l'adulte, la tolérance de LEVAQUIN® pour des durées de traitement allant jusqu'à 28 jours est bien caractérisée. Cependant, les informations relatives à une utilisation prolongée à 500 mg par jour jusqu'à 60 jours sont limitées. Le traitement prolongé par LEVAQUIN® chez l'adulte ne doit être utilisé que lorsque le bénéfice l'emporte sur le risque.
Chez les patients pédiatriques, la sécurité de la lévofloxacine pour des durées de traitement supérieures à 14 jours n'a pas été étudiée. Une incidence accrue d'événements indésirables musculo-squelettiques (arthralgie, arthrite, tendinopathie, anomalie de la marche) par rapport aux témoins a été observée dans les études cliniques avec une durée de traitement allant jusqu'à 14 jours. Les données de sécurité à long terme, y compris les effets sur le cartilage, suite à l'administration de lévofloxacine à des patients pédiatriques sont limitées [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Une étude animale contrôlée par placebo chez des singes rhésus exposés à une dose moyenne inhalée de 49 DL50 (~2,7 × 106) spores (gamme de 17 à 118 DL50) de B. anthracis (souche Ames) a été menée. La concentration minimale inhibitrice (CMI) de la lévofloxacine pour la souche d'anthrax utilisée dans cette étude était de 0,125 mcg/mL. Chez les animaux étudiés, les concentrations plasmatiques moyennes de lévofloxacine atteintes au Tmax attendu (1 heure après l'administration) après administration orale jusqu'à l'état d'équilibre variaient de 2,79 à 4,87 mcg/mL. Les concentrations minimales à l'état d'équilibre 24 heures après l'administration variaient de 0,107 à 0,164 mcg/mL. L'ASC0-24 moyenne (ET) à l'état d'équilibre était de 33,4 ± 3,2 mcg.h/mL (intervalle de 30,4 à 36,0 mcg.h/mL). La mortalité due au charbon chez les animaux ayant reçu un régime de 30 jours de LEVAQUIN® par voie orale commençant 24 heures après l'exposition était significativement plus faible (1/10), par rapport au groupe placebo (9/10) [P = 0,0011, Fisher 39;s Test exact]. Le seul animal traité à la lévofloxacine qui est mort de l'anthrax l'a fait après la période d'administration du médicament de 30 jours.
Peste
Les études d'efficacité de LEVAQUIN® n'ont pas pu être menées chez l'homme atteint de peste pulmonaire pour des raisons éthiques et de faisabilité. Par conséquent, l'approbation de cette indication a été basée sur une étude d'efficacité menée chez l'animal.
Les concentrations plasmatiques moyennes de LEVAQUIN® associées à une amélioration statistiquement significative de la survie par rapport au placebo chez un singe vert d'Afrique modèle de peste pulmonaire sont atteintes ou dépassées chez les patients adultes et pédiatriques recevant les schémas posologiques recommandés par voie orale et intraveineuse [voir LES INDICATIONS et DOSAGE ET ADMINISTRATION ].
La pharmacocinétique de la lévofloxacine a été évaluée chez des patients adultes et pédiatriques. La concentration plasmatique maximale moyenne (± ET) à l'état d'équilibre chez les adultes humains recevant 500 mg par voie orale ou intraveineuse une fois par jour est de 5,7 ± 1,4 et 6,4 ± 0,8 mcg/mL, respectivement ; et l'exposition plasmatique totale correspondante (ASC0-24) est de 47,5 ± 6,7 et 54,6 ± 11,1 mcg.h/mL, respectivement. Les paramètres pharmacocinétiques prédits à l'état d'équilibre chez les patients pédiatriques âgés de 6 mois à 17 ans recevant 8 mg/kg par voie orale toutes les 12 heures (sans dépasser 250 mg par dose) ont été calculés pour être comparables à ceux observés chez les adultes recevant 500 mg par voie orale une fois par jour [voir PHARMACOLOGIE CLINIQUE ]. Les comprimés LEVAQUIN® ne peuvent être administrés qu'aux patients pédiatriques atteints d'anthrax par inhalation (post-exposition) ou de peste qui pèsent 30 kg ou plus en raison des limites des dosages disponibles [voir DOSAGE ET ADMINISTRATION ].
Une étude animale contrôlée par placebo chez des singes verts africains exposés à une dose moyenne inhalée de 65 LD (gamme de 3 à 145 LD50) de Yersinia pestis (souche CO92) a été menée. La concentration minimale inhibitrice (CMI) de la lévofloxacine pour la souche Y. pestis utilisée dans cette étude était de 0,03 mcg/mL. Les concentrations plasmatiques moyennes de lévofloxacine obtenues à la fin d'une seule perfusion de 30 minutes variaient de 2,84 à 3,50 mcg/mL chez les singes verts d'Afrique. Les concentrations minimales 24 heures après l'administration variaient de
INFORMATIONS PATIENTS
LEVAQUIN® (Laissez ah kwin)(lévofloxacine) comprimés
Quelles sont les informations les plus importantes que je devrais connaître sur LEVAQUIN 500 mg ?
LEVAQUIN 500mg, un antibiotique fluoroquinolone, peut provoquer des effets indésirables graves. Certains de ces effets secondaires graves peuvent survenir en même temps et entraîner la mort.
Si vous présentez l'un des effets indésirables graves suivants pendant que vous prenez LEVAQUIN 500 mg, vous devez arrêter immédiatement de prendre LEVAQUIN et consulter immédiatement un médecin.
- Des problèmes de tendon peuvent survenir chez les personnes de tout âge qui prennent LEVAQUIN. Les tendons sont des cordons de tissus résistants qui relient les muscles aux os. Certains problèmes de tendon comprennent:
- la douleur
- gonflement
- déchirures et gonflement des tendons, y compris l'arrière de la cheville (Achille), l'épaule, la main ou d'autres sites tendineux.
- Le risque d'avoir des problèmes tendineux pendant que vous prenez LEVAQUIN est plus élevé si vous :
- ont plus de 60 ans
- avez subi une greffe de rein, de cœur ou de poumon.
- Des problèmes de tendon peuvent survenir chez les personnes qui ne présentent pas les facteurs de risque ci-dessus lorsqu'elles prennent LEVAQUIN.
- D'autres raisons qui peuvent augmenter votre risque de problèmes de tendon peuvent inclure :
- activité physique ou exercice
- insuffisance rénale
- problèmes de tendon dans le passé, comme chez les personnes atteintes de polyarthrite rhumatoïde (PR)
- Arrêtez immédiatement de prendre LEVAQUIN et consultez immédiatement un médecin dès les premiers signes de douleur, d'enflure ou d'inflammation des tendons. Évitez de faire de l'exercice et d'utiliser la zone touchée.
- La zone la plus courante de douleur et d'enflure est le tendon d'Achille à l'arrière de la cheville. Cela peut également arriver avec d'autres tendons. Vous pourriez avoir besoin d'un autre antibiotique qui n'est pas une fluoroquinolone pour traiter votre infection.
- Une rupture de tendon peut survenir pendant ou après avoir pris LEVAQUIN. Les ruptures de tendon peuvent survenir dans les heures ou les jours suivant la prise de LEVAQUIN et se sont produites jusqu'à plusieurs mois après la fin de la prise de fluoroquinolone.
- Arrêtez immédiatement de prendre LEVAQUIN 750 mg et consultez immédiatement un médecin si vous présentez l'un des signes ou symptômes suivants d'une rupture de tendon :
- entendre ou sentir un claquement ou un pop dans une zone tendineuse
- ecchymose juste après une blessure dans une zone tendineuse
- incapable de déplacer la zone touchée ou de supporter le poids
- la douleur
- brûlant
- picotements
- engourdissement
- la faiblesse
Les lésions nerveuses peuvent être permanentes.
- convulsions
- entendre des voix, voir des choses ou ressentir des choses qui n'existent pas (hallucinations)
- se sentir agité
- tremblements
- se sentir anxieux ou nerveux
- confusion
- la dépression
- troubles du sommeil
- cauchemars
- se sentir étourdi ou étourdi
- se sentir plus méfiant (paranoïa)
- pensées ou actes suicidaires
- maux de tête persistants, avec ou sans vision floue
Qu'est-ce que LEVAQUIN ?
LEVAQUIN 500 mg est un médicament antibiotique fluoroquinolone utilisé chez les adultes âgés de 18 ans ou plus pour traiter certaines infections causées par certains germes appelés bactéries. Ces infections bactériennes comprennent :
- pneumonie nosocomiale
- pneumonie communautaire
- infections cutanées, compliquées et non compliquées
- infection chronique de la prostate
- germes du charbon par inhalation
- la peste
- infections des voies urinaires, compliquées et non compliquées
- infection rénale aiguë (pyélonéphrite)
- infection aiguë des sinus
- aggravation aiguë ou bronchite chronique
Les études sur l'utilisation de LEVAQUIN dans le traitement de la peste et de la fièvre charbonneuse n'ont été menées que sur des animaux, car la peste et la fièvre charbonneuse n'ont pas pu être étudiées chez l'homme.
LEVAQUIN ne doit pas être utilisé chez les patients présentant des infections urinaires non compliquées, une exacerbation bactérienne aiguë d'une bronchite chronique ou une sinusite bactérienne aiguë s'il existe d'autres options thérapeutiques.
LEVAQUIN 750 mg comprimés est également utilisé pour traiter les enfants qui pèsent au moins 66 livres (ou au moins 30 kilogrammes) et qui peuvent avoir inhalé des germes de l'anthrax, avoir la peste ou avoir été exposés aux germes de la peste. On ne sait pas si LEVAQUIN est sûr et efficace chez les enfants de moins de 6 mois.
L'innocuité et l'efficacité chez les enfants traités par LEVAQUIN® pendant plus de 14 jours ne sont pas connues.
Qui ne doit pas prendre LEVAQUIN 750 mg ?
Ne prenez jamais LEVAQUIN : si vous avez déjà eu une réaction allergique grave à un antibiotique connu sous le nom de fluoroquinolone, ou si vous êtes allergique à la lévofloxacine ou à l'un des ingrédients de LEVAQUIN. Voir la fin de cette notice pour la liste complète des ingrédients de LEVAQUIN.
Avant de prendre LEVAQUIN, informez votre professionnel de la santé de toutes vos conditions médicales, y compris si vous :
- avez des problèmes de tendons; LEVAQUIN 250 mg ne doit pas être utilisé chez les personnes ayant des antécédents de problèmes tendineux.
- avez un problème qui provoque une faiblesse musculaire (myasthénie grave); LEVAQUIN ne doit pas être utilisé chez les personnes ayant des antécédents connus de myasthénie grave.
- avez des problèmes du système nerveux central tels que des convulsions (épilepsie).
- avez des problèmes nerveux; LEVAQUIN 250 mg ne doit pas être utilisé chez les patients ayant des antécédents d'un problème nerveux appelé neuropathie périphérique.
- avez ou quelqu'un de votre famille a un rythme cardiaque irrégulier, en particulier une condition appelée "allongement de l'intervalle QT".
- avez un faible taux de potassium dans le sang (hypokaliémie).
- ont des problèmes osseux.
- avez des problèmes articulaires, y compris la polyarthrite rhumatoïde (PR).
- avoir des problèmes rénaux. Vous pourriez avoir besoin d'une dose plus faible de LEVAQUIN si vos reins ne fonctionnent pas bien.
- avoir des problèmes de foie.
- souffrez de diabète ou de problèmes d'hypoglycémie (hypoglycémie).
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si LEVAQUIN 750 mg nuira à votre enfant à naître.
- allaitez ou envisagez d'allaiter. On ne sait pas si LEVAQUIN passe dans votre lait maternel. Vous et votre professionnel de la santé devez décider si vous allez prendre LEVAQUIN 250 mg ou allaiter. Vous ne devriez pas faire les deux.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
LEVAQUIN et d'autres médicaments peuvent s'influencer mutuellement et provoquer des effets indésirables.
Informez particulièrement votre fournisseur de soins de santé si vous prenez :
- un médicament stéroïdien.
- un médicament anti-psychotique.
- un antidépresseur tricyclique.
- une pilule d'eau (diurétique).
- certains médicaments peuvent empêcher LEVAQUIN 750 mg d'agir correctement. Prenez LEVAQUIN® 2 heures avant ou 2 heures après la prise de ces médicaments ou suppléments :
- un antiacide, une multivitamine ou d'autres médicaments ou suppléments contenant du magnésium, de l'aluminium, du fer ou du zinc
- sucralfate (Carafate® )
- didanosine (Videx®, Videx® EC)
- un anticoagulant (warfarine, Coumadin, Jantoven).
- un antidiabétique oral ou de l'insuline.
- un AINS (anti-inflammatoire non stéroïdien). De nombreux médicaments courants pour soulager la douleur sont des AINS. La prise d'un AINS pendant que vous prenez LEVAQUIN 250 mg ou d'autres fluoroquinolones peut augmenter votre risque d'effets sur le système nerveux central et de convulsions.
- théophylline (Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- un médicament pour contrôler votre fréquence cardiaque ou votre rythme (antiarythmiques).
Demandez à votre fournisseur de soins de santé si vous n'êtes pas sûr si l'un de vos médicaments est répertorié ci-dessus. Connaissez les médicaments que vous prenez. Gardez une liste de vos médicaments et montrez-la à votre fournisseur de soins de santé et à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je prendre LEVAQUIN 500 mg ?
- Prenez LEVAQUIN exactement comme votre professionnel de la santé vous l'a indiqué.
- Prenez LEVAQUIN 750 mg à peu près à la même heure chaque jour.
- Buvez beaucoup de liquides pendant que vous prenez LEVAQUIN.
- LEVAQUIN peut être pris avec ou sans nourriture.
- Si vous oubliez une dose de LEVAQUIN 500 mg, prenez-la dès que vous vous en rendez compte. Ne prenez pas plus de 1 dose en 1 jour.
- Ne sautez aucune dose de LEVAQUIN 750 mg ou n'arrêtez pas de le prendre, même si vous commencez à vous sentir mieux, jusqu'à ce que vous ayez terminé votre traitement prescrit sauf si :
- vous avez des problèmes de tendons. Voir "Quelle est l'information la plus importante que je devrais connaître sur LEVAQUIN 500mg ?".
- vous avez un problème nerveux. Voir "Quels sont les effets secondaires possibles de LEVAQUIN ?".
- vous avez un problème du système nerveux central. Voir "Quels sont les effets secondaires possibles de LEVAQUIN 750mg ?".
- vous avez une réaction allergique grave. Voir "Quels sont les effets secondaires possibles de LEVAQUIN 250mg ?".
- votre fournisseur de soins de santé vous dit d'arrêter de prendre LEVAQUIN.
La prise de toutes vos doses de LEVAQUIN 500 mg vous aidera à vous assurer que toutes les bactéries sont tuées. Prendre toutes vos doses de LEVAQUIN 250 mg vous aidera à réduire le risque que les bactéries deviennent résistantes à LEVAQUIN. Si votre infection ne s'améliore pas pendant que vous prenez LEVAQUIN 750 mg, cela peut signifier que la bactérie à l'origine de votre infection peut être résistante à LEVAQUIN. Si votre infection ne s'améliore pas, appelez votre fournisseur de soins de santé. Si votre infection ne s'améliore pas, LEVAQUIN et d'autres médicaments antibiotiques similaires peuvent ne plus fonctionner pour vous à l'avenir.
- Si vous avez pris trop de LEVAQUIN, appelez votre professionnel de la santé ou consultez immédiatement un médecin.
Que dois-je éviter lors de la prise de LEVAQUIN 500 mg ?
- LEVAQUIN peut provoquer des étourdissements et des étourdissements. Ne pas conduire, utiliser des machines ou faire d'autres activités qui nécessitent de la vigilance ou de la coordination jusqu'à ce que vous sachiez comment LEVAQUIN vous affecte.
- Évitez les lampes solaires, les lits de bronzage et essayez de limiter votre temps au soleil. LEVAQUIN 750 mg peut rendre votre peau sensible au soleil (photosensibilité) et à la lumière des lampes solaires et des cabines de bronzage. Vous pourriez avoir de graves coups de soleil, des cloques ou un gonflement de la peau. Si vous présentez l'un de ces symptômes pendant que vous prenez LEVAQUIN, appelez immédiatement votre fournisseur de soins de santé. Vous devez utiliser un écran solaire et porter un chapeau et des vêtements qui couvrent votre peau si vous devez vous exposer au soleil.
Quels sont les effets secondaires possibles de LEVAQUIN 750 mg ?
LEVAQUIN 750 mg peut provoquer des effets indésirables graves, notamment :
- Voir "Quelle est l'information la plus importante que je devrais connaître sur LEVAQUIN 250mg ?"
- Réactions allergiques graves.
Des réactions allergiques peuvent survenir chez les personnes prenant des fluoroquinolones, y compris LEVAQUIN 500 mg, même après seulement 1 dose. Arrêtez de prendre LEVAQUIN 500 mg et consultez immédiatement un médecin si vous présentez l'un des symptômes suivants d'une réaction allergique sévère :
- urticaire
- difficulté à respirer ou à avaler
- gonflement des lèvres, de la langue, du visage
- serrement de gorge, enrouement
- rythme cardiaque rapide
- perdre connaissance
- démangeaison de la peau
Une éruption cutanée peut survenir chez les personnes prenant LEVAQUIN 500 mg, même après seulement 1 dose. Arrêtez de prendre LEVAQUIN 250 mg au premier signe d'éruption cutanée et appelez immédiatement votre professionnel de la santé. Une éruption cutanée peut être le signe d'une réaction plus grave à LEVAQUIN.
- Dommages au foie (hépatotoxicité) : Une hépatotoxicité peut survenir chez les personnes qui prennent LEVAQUIN®. Appelez immédiatement votre fournisseur de soins de santé si vous présentez des symptômes inexpliqués tels que :
- nausées ou vomissements
- Douleur d'estomac
- fièvre
- la faiblesse
- douleur ou sensibilité abdominale
- démangeaison
- fatigue inhabituelle
- perte d'appétit
- selles de couleur claire
- urine de couleur foncée
- jaunissement de votre peau ou du blanc de vos yeux
Arrêtez de prendre LEVAQUIN 750 mg et informez immédiatement votre professionnel de la santé si vous présentez un jaunissement de la peau ou du blanc des yeux, ou si vous avez des urines foncées. Ceux-ci peuvent être les signes d'une réaction grave à LEVAQUIN (un problème de foie).
- Infection intestinale (colite pseudomembraneuse) La colite pseudomembraneuse peut survenir avec de nombreux antibiotiques, y compris LEVAQUIN. Appelez immédiatement votre fournisseur de soins de santé si vous avez une diarrhée aqueuse, une diarrhée qui ne disparaît pas ou des selles sanglantes. Vous pouvez avoir des crampes d'estomac et de la fièvre. La colite pseudomembraneuse peut survenir 2 mois ou plus après la fin de votre antibiotique.
- Modifications graves du rythme cardiaque (allongement de l'intervalle QT et torsades dépointées) Informez immédiatement votre fournisseur de soins de santé si vous avez un changement dans votre rythme cardiaque (un rythme cardiaque rapide ou irrégulier) ou si vous vous évanouissez. LEVAQUIN 250 mg peut provoquer un problème cardiaque rare appelé allongement de l'intervalle QT. Cette condition peut provoquer un rythme cardiaque anormal et peut être très dangereuse. Les chances que cela se produise sont plus élevées chez les personnes :
- qui sont âgés
- avec des antécédents familiaux d'intervalle QT prolongé
- avec un faible taux de potassium dans le sang (hypokaliémie)
- qui prennent certains médicaments pour contrôler le rythme cardiaque (antiarythmiques)
- Problèmes articulaires Un risque accru de problèmes d'articulations et de tissus autour des articulations chez les enfants peut survenir. Informez le professionnel de santé de votre enfant si votre enfant a des problèmes articulaires pendant ou après le traitement par LEVAQUIN.
- Modifications de la glycémie Les personnes qui prennent LEVAQUIN et d'autres médicaments à base de fluoroquinolone avec des médicaments antidiabétiques oraux ou avec de l'insuline peuvent présenter une hypoglycémie (hypoglycémie) et une glycémie élevée (hyperglycémie). Suivez les instructions de votre fournisseur de soins de santé pour savoir à quelle fréquence vérifier votre glycémie. Si vous souffrez de diabète et que votre taux de sucre dans le sang est bas pendant que vous prenez LEVAQUIN, arrêtez de prendre LEVAQUIN 500 mg et appelez immédiatement votre professionnel de la santé. Votre médicament antibiotique devra peut-être être changé.
- Sensibilité au soleil (photosensibilité) Voir « Que dois-je éviter pendant que je prends LEVAQUIN ? » Les effets indésirables les plus courants de LEVAQUIN 250 mg incluent :
- nausée
- mal de tête
- diarrhée
- insomnie
- constipation
- vertiges
Chez les enfants de 6 mois et plus qui prennent LEVAQUIN pour traiter la maladie du charbon ou la peste, les vomissements sont également fréquents.
LEVAQUIN peut provoquer des résultats de dépistage urinaire faussement positifs pour les opiacés lorsque le test est effectué avec certains kits disponibles dans le commerce. Un résultat positif doit être confirmé par un test plus spécifique. Ce ne sont pas tous les effets indésirables possibles de LEVAQUIN.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment conserver LEVAQUIN 250 mg ?
- Conservez LEVAQUIN 500 mg à température ambiante entre 59 °F et 86 °F (15 °C et 30 °C).
- Conservez LEVAQUIN 500 mg dans un récipient hermétiquement fermé.
Informations générales sur l'utilisation sûre et efficace de LEVAQUIN.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. N'utilisez pas LEVAQUIN pour une affection pour laquelle il n'est pas prescrit. Ne donnez pas LEVAQUIN 500 mg à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire. Ce Guide de Médication résume les informations les plus importantes sur LEVAQUIN. Si vous souhaitez plus d'informations sur LEVAQUIN 750 mg, parlez-en à votre professionnel de la santé. Vous pouvez demander à votre professionnel de la santé ou à votre pharmacien des informations sur LEVAQUIN 500 mg destinées aux professionnels de la santé.
Quels sont les ingrédients de LEVAQUIN 500 mg ?
Ingrédient actif: lévofloxacine
Ingrédients inactifs : crospovidone, hypromellose, stéarate de magnésium, cellulose microcristalline, polyéthylèneglycol, polysorbate 80, dioxyde de titane.
Les comprimés LEVAQUIN 250 mg contiennent également de l'oxyde de fer rouge synthétique.
Les comprimés LEVAQUIN 500 mg contiennent également de l'oxyde de fer rouge synthétique et de l'oxyde de fer jaune synthétique.
Ce guide des médicaments a été approuvé par la Food and Drug Administration des États-Unis
