Cipro 1000mg, 250mg, 500mg, 750mg Ciprofloxacin Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Cipro 750 mg et comment est-il utilisé ?
Cipro 500 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes des infections bactériennes. Cipro peut être utilisé seul ou avec d'autres médicaments.
Cipro appartient à une classe de médicaments appelés fluoroquinolones.
On ne sait pas si Cipro 750 mg est sûr et efficace chez les enfants de moins de 1 an.
Quels sont les effets secondaires possibles de Cipro ?
Cipro peut provoquer des effets secondaires graves, notamment :
- hypoglycémie,
- mal de tête,
- faim,
- transpiration,
- irritabilité,
- vertiges,
- nausée,
- rythme cardiaque rapide,
- se sentir anxieux ou tremblant,
- engourdissement des mains, des bras, des jambes ou des pieds,
- la faiblesse,
- sensation de picotements ou de brûlures,
- nervosité,
- confusion,
- agitation,
- paranoïa,
- hallucinations,
- problèmes de mémoire,
- difficulté à se concentrer,
- pensées suicidaires,
- douleur soudaine,
- gonflement,
- ecchymoses,
- tendresse,
- raideur,
- problèmes de mouvement,
- casser ou éclater dans n'importe quel joint,
- douleur intense ou constante à la poitrine, au ventre ou au dos,
- diarrhée aqueuse ou sanglante,
- flottant dans ta poitrine,
- essoufflement,
- étourdissement,
- éruption,
- problèmes de respiration,
- peu ou pas de miction,
- jaunissement de la peau ou des yeux,
- Maux de tête sévères,
- résonne dans tes oreilles,
- problèmes de vision, et
- douleur derrière les yeux
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Cipro 1000mg incluent :
- nausée,
- vomissement,
- diarrhée,
- Douleur d'estomac,
- démangeaisons ou pertes vaginales,
- maux de tête, et
- tests de la fonction hépatique anormaux
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Cipro. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
RÉACTIONS INDÉSIRABLES GRAVES, Y COMPRIS TENDINITE, RUPTURE DES TENDON, NEUROPATHIE PÉRIPHÉRIQUE, EFFETS SUR LE SYSTÈME NERVEUX CENTRAL ET EXACERBATION DE LA MYASTHÉNIE GRAVIE
- Les fluoroquinolones, y compris Cipro 250 mg, ont été associées à des effets indésirables graves invalidants et potentiellement irréversibles qui se sont produits ensemble [voir MISES EN GARDE ET PRÉCAUTIONS], notamment :
- Tendinite et rupture de tendon [voir MISES EN GARDE ET PRÉCAUTIONS]
- Neuropathie périphérique [voir MISES EN GARDE ET PRÉCAUTIONS]
- Effets sur le système nerveux central [voir MISES EN GARDE ET PRÉCAUTIONS]
Arrêtez immédiatement Cipro 750 mg et évitez l'utilisation de fluoroquinolones, y compris Cipro, chez les patients qui présentent l'un de ces effets indésirables graves [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Les fluoroquinolones, y compris Cipro 750 mg, peuvent exacerber la faiblesse musculaire chez les patients atteints de myasthénie grave. Évitez Cipro chez les patients ayant des antécédents connus de myasthénie grave. [voir MISES EN GARDE ET PRÉCAUTIONS]
- Étant donné que les fluoroquinolones, y compris CIPRO 500 mg, ont été associées à des effets indésirables graves [voir MISES EN GARDE ET PRÉCAUTIONS], réserver CIPRO pour les patients qui n'ont pas d'autres options de traitement pour les infections des voies urinaires non compliquées [voir INDICATIONS]
LA DESCRIPTION
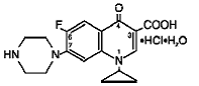
Les comprimés à libération prolongée Cipro (cipro 750mgfloxacin*) contiennent cipro 500mgfloxacin, un agent antimicrobien synthétique pour administration orale. Les comprimés Cipro 1000 mg sont des comprimés enrobés bicouches constitués d'une couche à libération immédiate et d'une couche à libération contrôlée de type matrice d'érosion. Les comprimés contiennent une combinaison de deux types de substance médicamenteuse à base de ciprofloxacine, le chlorhydrate de ciprofloxacine et la bétaïne de ciprofloxacine (base). Le chlorhydrate de Cipro 750mgfloxacine est le chlorhydrate de l'acide 1-cyclopropyl-6-fluoro-1,4dihydro-4-oxo-7-(1-pipérazinyl)-3-quinoléinecarboxylique. Il se présente sous la forme d'un mélange de monohydrate et de sesquihydrate. La formule empirique du monohydrate est C17H18FN3O3 . HCl . H2O et son poids moléculaire est de 385,8. La formule empirique du sesquihydrate est C17H18FN3O3 . HCl . 1,5 H2O et son poids moléculaire est de 394,8. La substance médicamenteuse est une substance cristalline légèrement jaunâtre à jaune pâle. La structure chimique du monohydrate est la suivante :
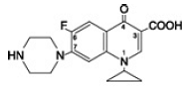
Cipro 1000mgfloxacin betaine est l'acide 1-cyclopropyl-6-fluoro-1,4-dihydro-4-oxo-7-(1-pipérazinyl)-3-quinolinecarboxylique. En tant qu'hydrate, sa formule empirique est C17H18FN3O3 . 3,5 H2O et son poids moléculaire est de 394,3. C'est une substance cristalline jaunâtre pâle à jaune clair et sa structure chimique est la suivante :
Cipro est disponible en comprimés de 500 mg et 1000 mg (équivalent cipro 500mgfloxacine). Les comprimés de Cipro sont des comprimés pelliculés de forme oblongue, presque blancs à légèrement jaunâtres. Chaque comprimé Cipro 500 mg contient 500 mg de ciprofloxacine sous forme de chlorhydrate de ciprofloxacine (287,5 mg, calculé en tant que ciprofloxacine sur la base sèche) et cipro 1000mgfloxacine† (212,6 mg, calculé sur la base sèche). Chaque comprimé de Cipro 1000 mg contient 1000 mg de ciprofloxacine sous forme de chlorhydrate de ciprofloxacine (574,9 mg, calculé en tant que ciprofloxacine sur la base sèche) et cipro 750mgfloxacine† (425,2 mg, calculé sur la base sèche). Les ingrédients inactifs sont la crospovidone, l'hypromellose, le stéarate de magnésium, le polyéthylèneglycol, la silice colloïdale anhydre, l'acide succinique et le dioxyde de titane.
* étant donné que cipro 500mgfloxacin† et cipro 250mgfloxacin hydrochloride † ne sont pas conformes au test de perte au séchage et au test de résidu au feu de la monographie USP.
LES INDICATIONS
Infections de la peau et des structures cutanées
CIPRO 1000 mg est indiqué chez les patients adultes pour le traitement des infections de la peau et des structures cutanées causées par Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Proteus vulgaris, Providencia stuartii, Morganella morganii, Citrobacter freundii, Pseudomonas aeruginosa, Staphylococcus aureus sensible à la méthicilline, Staphylococcus epidermidis sensible à la méthicilline ou Streptococcus pyogenes.
Infections osseuses et articulaires
CIPRO 750 mg est indiqué chez les patients adultes pour le traitement des infections osseuses et articulaires causées par Enterobacter cloacae, Serratia marcescens ou Pseudomonas aeruginosa.
Infections intra-abdominales compliquées
CIPRO 250 mg est indiqué chez les patients adultes pour le traitement des infections intra-abdominales compliquées (utilisées en association avec le métronidazole) causées par Escherichia coli, Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumoniae ou Bacteroides fragilis.
Diarrhée infectieuse
CIPRO 500 mg est indiqué chez les patients adultes pour le traitement de la diarrhée infectieuse causée par Escherichia coli (isolats entérotoxinogènes), Campylobacter jejuni, Shigella boydii†, Shigella dysenteriae, Shigella flexneri ou Shigella sonnei† lorsqu'un traitement antibactérien est indiqué.
†Bien que le traitement des infections dues à cet organisme dans ce système d'organes ait démontré un résultat cliniquement significatif, l'efficacité a été étudiée chez moins de 10 patients.
Fièvre typhoïde (fièvre entérique)
CIPRO 1000 mg est indiqué chez les patients adultes pour le traitement de la fièvre typhoïde (fièvre entérique) causée par Salmonella typhi. L'efficacité de la ciprofloxacine dans l'éradication de l'état de porteur chronique de la typhoïde n'a pas été démontrée.
Gonorrhée cervicale et urétrale non compliquée
CIPRO est indiqué chez les patients adultes pour le traitement de la gonorrhée cervicale et urétrale non compliquée due à Neisseria gonorrhoeae [voir AVERTISSEMENTS ET PRECAUTIONS ].
Anthrax par inhalation (post-exposition)
CIPRO 250 mg est indiqué chez les adultes et les patients pédiatriques de la naissance à 17 ans pour le charbon par inhalation (post-exposition) afin de réduire l'incidence ou la progression de la maladie suite à une exposition à Bacillus anthracis en aérosol.
Les concentrations sériques de Cipro 500mgfloxacine obtenues chez l'homme ont servi de critère d'évaluation de substitution raisonnablement susceptible de prédire un bénéfice clinique et ont fourni la base initiale pour l'approbation de cette indication. 2001 [voir Etudes cliniques ].
Peste
CIPRO 1000 mg est indiqué pour le traitement de la peste, y compris la peste pulmonaire et septicémique, due à Yersinia pestis (Y. pestis) et la prophylaxie de la peste chez les adultes et les enfants de la naissance à 17 ans. Les études d'efficacité de cipro 250 mgfloxacine n'ont pas pu être menées chez l'homme atteint de peste pour des raisons de faisabilité. Cette indication est donc basée sur une étude d'efficacité menée chez l'animal uniquement [voir Etudes cliniques ].
Prostatite bactérienne chronique
CIPRO est indiqué chez les patients adultes pour le traitement de la prostatite bactérienne chronique causée par Escherichia coli ou Proteus mirabilis.
Infections des voies respiratoires inférieures
CIPRO 750 mg est indiqué chez les patients adultes pour le traitement des infections des voies respiratoires inférieures causées par Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Pseudomonas aeruginosa, Haemophilus influenzae, Haemophilus parainfluenzae ou Streptococcus pneumoniae.
CIPRO n'est pas un médicament de premier choix dans le traitement des pneumonies présumées ou confirmées secondaires à Streptococcus pneumoniae.
CIPRO est indiqué pour le traitement des exacerbations aiguës de la bronchite chronique (EABC) causées par Moraxella catarrhalis.
Étant donné que les fluoroquinolones, y compris CIPRO, ont été associées à des effets indésirables graves [voir AVERTISSEMENTS ET PRECAUTIONS ] et pour certains patients, l'EABC est autolimitative, réservez CIPRO 750 mg pour le traitement de l'EABC chez les patients qui n'ont pas d'autres options de traitement.
Infections des voies urinaires
Infections des voies urinaires chez les adultes
CIPRO 500 mg est indiqué chez les patients adultes pour le traitement des infections des voies urinaires causées par Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Serratia marcescens, Proteus mirabilis, Providencia rettgeri, Morganella morganii, Citrobacter koseri, Citrobacter freundii, Pseudomonas aeruginosa, Staphylococcus epidermidis sensible à la méthicilline , Staphylococcus saprophyticus ou Enterococcus faecalis.
Cystite aiguë non compliquée
CIPRO 750 mg est indiqué chez les patientes adultes pour le traitement de la cystite aiguë non compliquée causée par Escherichia coli ou Staphylococcus saprophyticus.
Étant donné que les fluoroquinolones, y compris CIPRO, ont été associées à des effets indésirables graves [voir AVERTISSEMENTS ET PRECAUTIONS ] et pour certains patients, la cystite aiguë non compliquée est spontanément résolutive, réserver CIPRO pour le traitement de la cystite aiguë non compliquée chez les patients qui n'ont pas d'autres options de traitement.
Infection urinaire compliquée et pyélonéphrite chez les patients pédiatriques
CIPRO est indiqué chez les patients pédiatriques âgés de 1 à 17 ans pour le traitement des infections urinaires compliquées (cUTI) et de la pyélonéphrite due à Escherichia coli [voir Utilisation dans des populations spécifiques ].
Bien qu'efficace dans les essais cliniques, CIPRO n'est pas un médicament de premier choix dans la population pédiatrique en raison d'une incidence accrue d'effets indésirables par rapport aux témoins, y compris des réactions liées aux articulations et/ou aux tissus environnants. CIPRO 250 mg, comme les autres fluoroquinolones, est associé à une arthropathie et à des modifications histopathologiques des articulations portantes des animaux juvéniles [voir AVERTISSEMENTS ET PRECAUTIONS , EFFETS INDÉSIRABLES , Utilisation dans des populations spécifiques et Toxicologie non clinique ].
Sinusite aiguë
CIPRO est indiqué chez les patients adultes pour le traitement de la sinusite aiguë causée par Haemophilus influenzae, Streptococcus pneumoniae ou Moraxella catarrhalis.
Étant donné que les fluoroquinolones, y compris CIPRO, ont été associées à des effets indésirables graves [voir AVERTISSEMENTS ET PRECAUTIONS ] et pour certains patients, la sinusite aiguë est spontanément résolutive, réserver CIPRO pour le traitement de la sinusite aiguë chez les patients qui n'ont pas d'autres options de traitement.
Usage
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l'efficacité de CIPRO 1000 mg et d'autres médicaments antibactériens, CIPRO 500 mg doit être utilisé uniquement pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu'elles sont causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte lors de la sélection ou de la modification du traitement antibactérien. En l'absence de telles données, l'épidémiologie locale et les schémas de sensibilité peuvent contribuer à la sélection empirique du traitement.
Si des organismes anaérobies sont suspectés de contribuer à l'infection, un traitement approprié doit être administré. Des tests de culture et de sensibilité appropriés doivent être effectués avant le traitement afin d'isoler et d'identifier les organismes responsables de l'infection et de déterminer leur sensibilité à la ciprofloxacine. Le traitement par CIPRO peut être initié avant que les résultats de ces tests ne soient connus ; une fois les résultats disponibles, un traitement approprié doit être poursuivi.
Comme avec d'autres médicaments, certains isolats de Pseudomonas aeruginosa peuvent développer une résistance assez rapidement pendant le traitement par cipro 1000 mgfloxacine. La culture et les tests de sensibilité effectués périodiquement pendant le traitement fourniront des informations non seulement sur l'effet thérapeutique de l'agent antimicrobien mais également sur l'émergence possible d'une résistance bactérienne.
DOSAGE ET ADMINISTRATION
Les comprimés et la suspension orale de CIPRO à 1000 mg doivent être administrés par voie orale comme décrit dans les tableaux des directives posologiques appropriés.
Posologie chez les adultes
La détermination de la posologie et de la durée pour un patient particulier doit tenir compte de la gravité et de la nature de l'infection, de la sensibilité du microorganisme responsable, de l'intégrité des mécanismes de défense de l'hôte du patient et de l'état de la fonction rénale et hépatique. . Les comprimés CIPRO ou CIPRO pour suspension orale peuvent être administrés à des patients adultes lorsque cliniquement indiqué, à la discrétion du médecin. Administrer CIPRO pour suspension orale à l'aide de la cuillère graduée co-emballée [voir DOSAGE ET ADMINISTRATION ].
Conversion de l'administration intraveineuse en administration orale chez les adultes
Les patients dont le traitement est commencé avec CIPRO IV peuvent être remplacés par des comprimés ou une suspension orale CIPRO à 750 mg lorsque cela est cliniquement indiqué à la discrétion du médecin (tableau 2) [voir PHARMACOLOGIE CLINIQUE ].
Posologie chez les patients pédiatriques
La posologie et la voie initiale de traitement (c'est-à-dire IV ou orale) pour les cUTI ou la pyélonéphrite doivent être déterminées en fonction de la gravité de l'infection. CIPRO doit être administré comme décrit dans le tableau 3. Administrez CIPRO pour suspension orale à l'aide de la cuillère graduée co-emballée [voir DOSAGE ET ADMINISTRATION ].
Modifications posologiques chez les patients atteints d'insuffisance rénale
Cipro 250 mgfloxacine est éliminé principalement par excrétion rénale ; cependant, le médicament est également métabolisé et partiellement éliminé par le système biliaire du foie et par l'intestin. Ces voies alternatives d'élimination du médicament semblent compenser la réduction de l'excrétion rénale chez les patients insuffisants rénaux. Néanmoins, une modification de la posologie est recommandée, en particulier chez les patients présentant une insuffisance rénale sévère. Les recommandations posologiques à utiliser chez les patients insuffisants rénaux sont présentées dans le tableau 4.
Lorsque seule la concentration de créatinine sérique est connue, les formules suivantes peuvent être utilisées pour estimer la clairance de la créatinine :
La créatinine sérique doit représenter un état stable de la fonction rénale.
Chez les patients présentant des infections sévères et une insuffisance rénale sévère, une dose unitaire de 750 mg peut être administrée aux intervalles indiqués ci-dessus. Les patients doivent être étroitement surveillés.
Les patients pédiatriques présentant une insuffisance rénale modérée à sévère ont été exclus de l'essai clinique sur l'UTIc et la pyélonéphrite. Aucune information n'est disponible sur les ajustements posologiques nécessaires chez les patients pédiatriques présentant une insuffisance rénale modérée à sévère (c'est-à-dire une clairance de la créatinine
Instructions d'administration importantes
Avec des cations multivalents
Administrer CIPRO au moins 2 heures avant ou 6 heures après les antiacides magnésium/aluminium ; des liants de phosphate polymères (par exemple, sevelamer, carbonate de lanthane) ou du sucralfate ; Videx® (didanosine) comprimés à croquer/tamponnés ou poudre pédiatrique pour solution buvable ; d'autres médicaments hautement tamponnés ; ou d'autres produits contenant du calcium, du fer ou du zinc.
Avec des produits laitiers
L'administration concomitante de CIPRO 500 mg avec des produits laitiers (comme le lait ou le yaourt) ou des jus enrichis en calcium seuls doit être évitée car une diminution de l'absorption est possible ; cependant, CIPRO peut être pris avec un repas qui contient ces produits.
Hydratation des patients recevant CIPRO
Assurer une hydratation adéquate des patients recevant CIPRO 1000mg pour prévenir la formation d'urine très concentrée. Une cristallurie a été rapportée avec les quinolones.
Informez le patient de l'administration appropriée de CIPRO 1000 mg [voir Informations sur les conseils aux patients ].
Doses oubliées
Si une dose est oubliée, elle doit être prise à tout moment mais au plus tard 6 heures avant la prochaine dose prévue. S'il reste moins de 6 heures avant la dose suivante, la dose oubliée ne doit pas être prise et le traitement doit être poursuivi tel que prescrit avec la prochaine dose prévue. Il ne faut pas prendre de doubles doses pour compenser une dose oubliée.
Fractionnement des comprimés CIPRO 1000mg
Les comprimés CIPRO 750 mg, 250 mg et 500 mg sont des comprimés sécables fonctionnellement qui peuvent être divisés en deux au niveau de la ligne sécable pour fournir une concentration de 125 mg et 250 mg, respectivement.
Instructions pour la reconstitution des microcapsules CIPRO 500 mg pour suspension buvable
La suspension orale CIPRO 750 mg est fournie en concentrations de 5 % (5 g de ciprofloxacine dans 100 mL) et de 10 % (10 g de cipro 750 mg de floxacine dans 100 mL). La suspension buvable CIPRO 250 mg est composée de deux composants (microcapsules et diluant) qui doivent être associés avant la délivrance.
Préparation de la suspension
Étape 1
Le petit flacon contient les microcapsules, le grand flacon contient le diluant.

Étape 2
Ouvrez les deux bouteilles. Bouchon à l'épreuve des enfants : Appuyez selon les instructions sur le bouchon tout en tournant vers la gauche.

Étape 3
 Versez complètement les microcapsules dans le plus grand flacon de diluant. Ne pas ajouter d'eau à la suspension .
Étape 4
· Retirez la couche supérieure de l'étiquette du flacon de diluant (pour révéler l'étiquette de la suspension orale CIPRO 1000 mg). Fermez complètement la grande bouteille selon les instructions sur le bouchon et agitez vigoureusement pendant environ 15 secondes. La suspension est prête à l'emploi.
Étape 5
Inscrivez la date de péremption de la suspension buvable reconstituée sur l'étiquette du flacon.
Le produit reconstitué peut être conservé à une température inférieure à 30 °C (86 °F) pendant 14 jours. Protéger du gel.
Aucun ajout ne doit être fait à la suspension finale mixte de ciprofloxacine. La suspension orale CIPRO 1000 mg ne doit pas être administrée par des sondes d'alimentation ou NG (nasogastriques) en raison de ses caractéristiques physiques.
Instructions d'administration de CIPRO pour suspension orale après reconstitution
- Agitez vigoureusement CIPRO 750 mg suspension orale à chaque fois avant utilisation pendant environ 15 secondes.
- Administrer la suspension orale CIPRO à l'aide de la cuillère à thé graduée fournie dans le même emballage pour le patient (voir la figure 1)
Figure 1 : Cuillère à thé graduée de 5 mL co-emballée
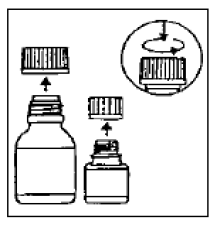
La cuillère à café graduée co-emballée (5 ml) est fournie, avec des marques pour ½ (2,5 ml) et 1/1 (5 ml)
- Après utilisation, nettoyez la cuillère à café graduée sous l'eau courante avec du liquide vaisselle et séchez-la soigneusement.
- Ne mâchez pas les microcapsules de la suspension orale CIPRO 250 mg, avalez-les plutôt entières.
- L'eau peut être prise par la suite.
- Bien refermer le flacon après chaque utilisation en suivant les instructions sur le bouchon.
- Une fois le traitement terminé, la suspension orale CIPRO 1000 mg ne doit pas être réutilisée.
Posologie de CIPRO pour suspension orale à l'aide de la cuillère co-emballée chez les adultes et les patients pédiatriques
COMMENT FOURNIE
Formes posologiques et points forts
Comprimés
- 250 mg, légèrement jaunâtre, pelliculé, rond, sécable fonctionnellement, portant l'inscription « BAYER » d'un côté et « CIP 250 » de l'autre.
- 500 mg, légèrement jaunâtre, pelliculé, en forme de capsule, sécable fonctionnellement, portant l'inscription « BAYER » d'un côté et « CIP 500 » de l'autre.
Suspension orale
- Suspension orale à 5 % : 250 mg cipro 750 mgfloxacine par 5 mL après reconstitution
- Suspension orale à 10 % : 500 mg cipro 250 mgfloxacine par 5 mL après reconstitution
Stockage et manutention
Les comprimés CIPRO (chlorhydrate de cipro 750mgfloxacine) sont disponibles sous forme de comprimés pelliculés ronds légèrement jaunâtres contenant 250 mg de cipro 500mgfloxacine. Le comprimé de 250 mg est codé avec le mot « BAYER » sur une face et fonctionnellement sécable et gravé « CIP 250 » sur l'autre face. CIPRO est également disponible sous forme de comprimés pelliculés légèrement jaunâtres en forme de capsule contenant 500 mg de ciprofloxacine. Le comprimé de 500 mg est codé avec le mot « BAYER » sur une face et fonctionnellement sécable et gravé « CIP 500 » sur l'autre face. CIPRO 250 mg et 500 mg sont disponibles en flacons de 100.
Conserver à 20° à 25°C (68° à 77°F); excursions permises jusqu'à 15° à 30°C (59° à 86°F) [voir Température ambiante contrôlée USP ].
La suspension orale CIPRO est fournie en concentrations de 5 % et 10 %. Le médicament est composé de deux composants (microcapsules contenant le principe actif et diluant) qui doivent être mélangés par le pharmacien [voir DOSAGE ET ADMINISTRATION ].
Conserver les microcapsules et le diluant à une température inférieure à 25 °C (77 °F) ; les excursions sont autorisées de 15°C à 30°C (59°F à 86°F) [voir Température ambiante contrôlée USP ]. Protéger du gel.
Le produit reconstitué peut être conservé à 25°C (77°F) pendant 14 jours ; les excursions sont autorisées de 15°C à 30°C (59°F à 86°F) [voir Température ambiante contrôlée USP ]. Protéger du gel.
Une cuillère à café graduée (5 ml) avec des graduations ½ (2,5 ml) et 1/1 (5 ml) est fournie au patient.
RÉFÉRENCES
1. 21 CFR 314.510 (Sous-partie H - Approbation accélérée de nouveaux médicaments pour les maladies potentiellement mortelles).
2. Friedman J, Polifka J. Effets tératogènes des médicaments : une ressource pour les cliniciens (TERIS). Baltimore, Maryland : Johns Hopkins University Press, 2000 : 149-195.
3. Loebstein R, Addis A, Ho E, et al. Résultat de la grossesse suite à une exposition gestationnelle aux fluoroquinolones : une étude contrôlée prospective multicentrique. Agents antimicrobiens Chemother. 1998;42(6):1336-1339.
Fabriqué pour : Bayer HealthCare Pharmaceuticals Inc. Whippany, NJ 07981. Révisé : novembre 2021
EFFETS SECONDAIRES
Les effets indésirables graves et par ailleurs importants suivants sont traités plus en détail dans d'autres sections de l'étiquetage :
- Effets indésirables graves invalidants et potentiellement irréversibles [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Tendinite et rupture du tendon [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Neuropathie périphérique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Effets sur le système nerveux central [voir AVERTISSEMENTS ET PRECAUTIONS ] Exacerbation de la myasthénie grave [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Autres effets indésirables graves et parfois mortels [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions d'hypersensibilité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hépatotoxicité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Risque d'anévrisme aortique et de dissection [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions indésirables graves avec la théophylline concomitante [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Diarrhée associée à Clostridioides difficile [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Allongement de l'intervalle QT [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Troubles musculosquelettiques chez les patients pédiatriques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Photosensibilité/Phototoxicité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Développement de bactéries résistantes aux médicaments [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Patients adultes
Au cours des investigations cliniques avec CIPRO 750 mg par voie orale et parentérale, 49 038 patients ont reçu des cures de ce médicament.
Les effets indésirables les plus fréquemment signalés, dans les essais cliniques portant sur toutes les formulations, toutes les posologies, toutes les durées de traitement médicamenteux et pour toutes les indications du traitement par la ciprofloxacine, étaient les nausées (2,5 %), la diarrhée (1,6 %), les tests de la fonction hépatique anormaux (1,3 % ), vomissements (1 %) et éruption cutanée (1 %).
Dans des essais cliniques contrôlés randomisés en double aveugle comparant les comprimés CIPRO [500 mg deux fois par jour (BID)] au céfuroxime axétil (250 mg à 500 mg BID) et à la clarithromycine (500 mg BID) chez des patients souffrant d'infections des voies respiratoires, CIPRO a démontré un profil d'effets indésirables sur le SNC comparable à celui des médicaments témoins.
Patients pédiatriques
L'innocuité musculo-squelettique et neurologique à court (6 semaines) et à long terme (1 an) de la ciprofloxacine orale/intraveineuse a été comparée à une céphalosporine pour le traitement de l'UTI c ou de la pyélonéphrite chez les patients pédiatriques âgés de 1 à 17 ans (âge moyen de 6 ± 4 ans). ) dans un essai multicentrique international. La durée du traitement était de 10 à 21 jours (la durée moyenne de traitement était de 11 jours avec un intervalle de 1 à 88 jours). Au total, 335 patients traités par cipro 250 mgfloxacine et 349 patients traités par un comparateur ont été inclus.
Un comité indépendant de sécurité pédiatrique (IPSC) a examiné tous les cas d'effets indésirables musculo-squelettiques, y compris une démarche anormale ou un examen articulaire anormal (au départ ou en cours de traitement). Dans les 6 semaines suivant le début du traitement, les taux d'effets indésirables musculo-squelettiques étaient de 9,3 % (31/335) dans le groupe traité par cipro 750 mgfloxacine contre 6 % (21/349) chez les patients traités par le comparateur. Tous les effets indésirables musculo-squelettiques survenus au bout de 6 semaines ont disparu (résolution clinique des signes et symptômes), généralement dans les 30 jours suivant la fin du traitement. Les évaluations radiologiques n'étaient pas systématiquement utilisées pour confirmer la résolution des effets indésirables. Les patients traités par Cipro 500mgfloxacine étaient plus susceptibles de signaler plus d'un effet indésirable et à plus d'une occasion par rapport aux patients témoins. Le taux d'effets indésirables musculo-squelettiques était systématiquement plus élevé dans le groupe ciprofloxacine par rapport au groupe témoin dans tous les sous-groupes d'âge. Au bout d'un an, le taux de ces effets indésirables rapportés à tout moment au cours de cette période était de 13,7 % (46/335) dans le groupe traité par cipro 250 mgfloxacine contre 9,5 % (33/349) chez les patients traités par comparateur ( Tableau 9).
Les taux d'incidence des effets indésirables neurologiques dans les 6 semaines suivant le début du traitement étaient de 3 % (9/335) dans le groupe CIPRO contre 2 % (7/349) dans le groupe comparateur et comprenaient des étourdissements, de la nervosité, de l'insomnie et de la somnolence.
Dans cet essai, les taux d'incidence globaux des effets indésirables dans les 6 semaines suivant le début du traitement étaient de 41 % (138/335) dans le groupe cipro 250 mgfloxacine contre 31 % (109/349) dans le groupe comparateur. Les effets indésirables les plus fréquents ont été digestifs : 15% (50/335) des patients ciprofloxacine versus 9% (31/349) des patients comparateurs. Des effets indésirables graves ont été observés chez 7,5 % (25/335) des patients traités par la ciprofloxacine contre 5,7 % (20/349) des patients témoins. L'arrêt du médicament en raison d'un effet indésirable a été observé chez 3 % (10/335) des patients traités par la ciprofloxacine contre 1,4 % (5/349) des patients comparateurs. Les autres effets indésirables survenus chez au moins 1 % des patients sous ciprofloxacine étaient la diarrhée 4,8 %, les vomissements 4,8 %, les douleurs abdominales 3,3 %, la dyspepsie 2,7 %, les nausées 2,7 %, la fièvre 2,1 %, l'asthme 1,8 % et les éruptions cutanées 1,8 %.
Des données sur l'innocuité à court terme de cipro 1000 mgfloxacine ont également été recueillies dans le cadre d'un essai clinique randomisé en double aveugle pour le traitement des exacerbations pulmonaires aiguës chez les patients atteints de mucoviscidose (âgés de 5 à 17 ans). Soixante-sept patients ont reçu CIPRO IV 10 mg/kg/dose toutes les 8 heures pendant une semaine suivi de CIPRO 250 mg comprimés 20 mg/kg/dose toutes les 12 heures pour compléter le traitement de 10 à 21 jours et 62 patients ont reçu l'association de ceftazidime intraveineuse 50 mg/kg/dose toutes les 8 heures et tobramycine intraveineuse 3 mg/kg/dose toutes les 8 heures pendant un total de 10 à 21 jours. Des évaluations musculo-squelettiques périodiques ont été effectuées par des examinateurs en aveugle au traitement. Les patients ont été suivis pendant une moyenne de 23 jours après la fin du traitement (intervalle de 0 à 93 jours). Des effets indésirables musculo-squelettiques ont été rapportés chez 22 % des patients du groupe ciprofloxacine et 21 % des patients du groupe de comparaison. Une diminution de l'amplitude des mouvements a été signalée chez 12 % des sujets du groupe ciprofloxacine et 16 % du groupe de comparaison. Des arthralgies ont été rapportées chez 10 % des patients du groupe cipro 500 mgfloxacine et 11 % du groupe de comparaison. Les autres effets indésirables étaient de nature et de fréquence similaires entre les bras de traitement. L'efficacité de CIPRO pour le traitement des exacerbations pulmonaires aiguës chez les patients pédiatriques atteints de fibrose kystique n'a pas été établie.
En plus des effets indésirables rapportés chez les patients pédiatriques lors des essais cliniques, il faut s'attendre à ce que des effets indésirables rapportés chez les adultes au cours des essais cliniques ou après la commercialisation puissent également survenir chez les patients pédiatriques.
Expérience post-commercialisation
Les effets indésirables suivants ont été signalés dans le cadre de l'expérience de commercialisation mondiale des fluoroquinolones, y compris CIPRO. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament (tableau 10).
Changements de laboratoire indésirables
Les modifications des paramètres de laboratoire pendant le traitement par CIPRO 250 mg sont répertoriées ci-dessous :
Hépatique –Élévations de l'ALT (SGPT), de l'AST (SGOT), de la phosphatase alcaline, de la LDH, de la bilirubine sérique.
Hématologique –Éosinophilie, leucopénie, diminution des plaquettes sanguines, augmentation des plaquettes sanguines, pancytopénie.
Rénal – Des élévations de la créatinine sérique, de l'urée, de la cristallurie, de la cylindrurie et de l'hématurie ont été rapportées.
Les autres changements survenus étaient les suivants : élévation de la gammaglutamyl transférase sérique, élévation de l'amylase sérique, réduction de la glycémie, élévation de l'acide urique, diminution de l'hémoglobine, anémie, diathèse hémorragique, augmentation des monocytes sanguins et hyperleucocytose.
INTERACTIONS MÉDICAMENTEUSES
La ciprofloxacine est un inhibiteur du métabolisme médié par le cytochrome humain P450 1A2 (CYP1A2). La co-administration de CIPRO avec d'autres médicaments principalement métabolisés par le CYP1A2 entraîne une augmentation des concentrations plasmatiques de ces médicaments et pourrait entraîner des effets indésirables cliniquement significatifs du médicament co-administré.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Réactions indésirables graves invalidantes et potentiellement irréversibles, y compris tendinite et rupture de tendon, neuropathie périphérique et effets sur le système nerveux central
Les fluoroquinolones, y compris CIPRO, ont été associées à des effets indésirables graves invalidants et potentiellement irréversibles de différents systèmes corporels qui peuvent survenir ensemble chez le même patient. Les effets indésirables fréquemment observés comprennent la tendinite, la rupture du tendon, l'arthralgie, la myalgie, la neuropathie périphérique et les effets sur le système nerveux central (hallucinations, anxiété, dépression, insomnie, maux de tête sévères et confusion). Ces réactions peuvent survenir quelques heures à quelques semaines après le début de CIPRO. Des patients de tout âge ou sans facteurs de risque préexistants ont présenté ces effets indésirables [voir AVERTISSEMENTS ET PRECAUTIONS ].
Arrêtez immédiatement CIPRO 250 mg dès les premiers signes ou symptômes de tout effet indésirable grave. De plus, évitez l'utilisation de fluoroquinolones, y compris CIPRO 500 mg, chez les patients qui ont présenté l'un de ces effets indésirables graves associés aux fluoroquinolones.
Tendinite et rupture de tendon
Les fluoroquinolones, y compris CIPRO, ont été associées à un risque accru de tendinite et de rupture de tendon à tous les âges [voir AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ]. Cet effet indésirable concerne le plus souvent le tendon d'Achille et a également été rapporté avec la coiffe des rotateurs (l'épaule), la main, le biceps, le pouce et d'autres tendons. Une tendinite ou une rupture de tendon peut survenir dans les heures ou les jours suivant le début de CIPRO 500 mg, ou jusqu'à plusieurs mois après la fin du traitement par fluoroquinolone. La tendinite et la rupture du tendon peuvent survenir bilatéralement.
Le risque de développer une tendinite et une rupture de tendon associées aux fluoroquinolones est augmenté chez les patients de plus de 60 ans, chez les patients prenant des corticoïdes et chez les patients ayant subi une transplantation rénale, cardiaque ou pulmonaire. D'autres facteurs qui peuvent indépendamment augmenter le risque de rupture du tendon comprennent une activité physique intense, une insuffisance rénale et des troubles tendineux antérieurs tels que la polyarthrite rhumatoïde. Des tendinites et des ruptures de tendons sont également survenues chez des patients prenant des fluoroquinolones qui ne présentaient pas les facteurs de risque ci-dessus. Arrêtez CIPRO 250 mg immédiatement si le patient ressent une douleur, un gonflement, une inflammation ou une rupture d'un tendon. Éviter les fluoroquinolones, y compris CIPRO 250 mg, chez les patients ayant des antécédents de troubles tendineux ou ayant subi une tendinite ou une rupture tendineuse [voir EFFETS INDÉSIRABLES ].
Neuropathie périphérique
Les fluoroquinolones, y compris CIPRO, ont été associées à un risque accru de neuropathie périphérique. Des cas de polyneuropathie axonale sensorielle ou sensorimotrice affectant les petits et/ou gros axones entraînant des paresthésies, des hypoesthésies, des dysesthésies et une faiblesse ont été rapportés chez des patients recevant des fluoroquinolones, y compris CIPRO. Les symptômes peuvent survenir peu de temps après le début de CIPRO et peuvent être irréversibles chez certains patients [voir AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ].
Arrêtez CIPRO immédiatement si le patient présente des symptômes de neuropathie périphérique, notamment douleur, brûlure, picotement, engourdissement et/ou faiblesse, ou d'autres altérations des sensations, notamment toucher léger, douleur, température, sens de la position et sensation vibratoire, et/ou force motrice dans afin de minimiser le développement d'une condition irréversible. Éviter les fluoroquinolones, y compris CIPRO 500 mg, chez les patients ayant déjà présenté une neuropathie périphérique [voir EFFETS INDÉSIRABLES ].
Effets sur le système nerveux central
Effets indésirables psychiatriques
Les fluoroquinolones, y compris CIPRO, ont été associées à un risque accru d'effets indésirables psychiatriques, notamment : psychose toxique, réactions psychotiques évoluant vers des idées/pensées suicidaires, des hallucinations ou de la paranoïa ; la dépression ou un comportement d'automutilation tel qu'une tentative ou un suicide réussi ; anxiété, agitation ou nervosité; confusion, délire, désorientation ou troubles de l'attention ; insomnie ou cauchemars; déficience de mémoire. Ces réactions peuvent survenir après la première dose. Conseillez aux patients recevant CIPRO d'informer immédiatement leur fournisseur de soins de santé si ces réactions se produisent, d'arrêter le médicament et d'instituer les soins appropriés.
Effets indésirables du système nerveux central
Les fluoroquinolones, y compris CIPRO 750 mg, ont été associées à un risque accru de convulsions (convulsions), d'augmentation de la pression intracrânienne (pscudotumor cerebri), d'étourdissements et de tremblements. CIPRO, comme les autres fluoroquinolones, est connu pour déclencher des crises ou abaisser le seuil épileptogène. Des cas d'état de mal épileptique ont été rapportés. Comme avec toutes les fluoroquinolones, utiliser CIPRO avec prudence chez les patients épileptiques et les patients présentant des troubles connus ou suspectés du SNC pouvant prédisposer aux convulsions ou abaisser le seuil convulsif (par exemple, artériosclérose cérébrale sévère, antécédents de convulsion, diminution du débit sanguin cérébral, altération du cerveau). ou d'accident vasculaire cérébral), ou en présence d'autres facteurs de risque susceptibles de prédisposer aux crises ou d'abaisser le seuil épileptogène (par exemple, certains traitements médicamenteux, un dysfonctionnement rénal). En cas de convulsions, arrêtez CIPRO 500 mg et instituez les soins appropriés [voir EFFETS INDÉSIRABLES et INTERACTIONS MÉDICAMENTEUSES ].
Exacerbation de la myasthénie grave
Les fluoroquinolones, y compris CIPRO, ont une activité de blocage neuromusculaire et peuvent exacerber la faiblesse musculaire chez les patients atteints de myasthénie grave. Des effets indésirables graves post-commercialisation, y compris des décès et la nécessité d'une assistance ventilatoire, ont été associés à l'utilisation de fluoroquinolones chez des patients atteints de myasthénie grave. Éviter CIPRO chez les patients ayant des antécédents connus de myasthénie grave [voir EFFETS INDÉSIRABLES ].
Autres effets indésirables graves et parfois mortels
D'autres effets indésirables graves et parfois mortels, certains dus à une hypersensibilité et d'autres à une étiologie incertaine, ont été signalés chez des patients recevant un traitement par quinolones, y compris CIPRO. Ces événements peuvent être graves et surviennent généralement après l'administration de doses multiples. Les manifestations cliniques peuvent inclure un ou plusieurs des éléments suivants :
- Fièvre, éruption cutanée ou réactions dermatologiques sévères (par exemple, nécrolyse épidermique toxique, syndrome de Stevens-Johnson) ;
- Vascularite; arthralgie; myalgie; maladie sérique;
- pneumopathie allergique ;
- néphrite interstitielle ; insuffisance ou insuffisance rénale aiguë;
- Hépatite; jaunisse; nécrose ou insuffisance hépatique aiguë;
- Anémie, y compris hémolytique et aplasique ; thrombocytopénie, y compris purpura thrombocytopénique thrombotique; leucopénie; agranulocytose; pancytopénie; et/ou d'autres anomalies hématologiques.
Arrêtez CIPRO 500 mg immédiatement à la première apparition d'une éruption cutanée, d'un ictère ou de tout autre signe d'hypersensibilité et de mesures de soutien instituées [voir EFFETS INDÉSIRABLES ].
Réactions d'hypersensibilité
Des réactions d'hypersensibilité (anaphylactiques) graves et parfois mortelles, certaines après la première dose, ont été signalées chez des patients recevant un traitement par fluoroquinolone, y compris CIPRO. Certaines réactions étaient accompagnées d'un collapsus cardiovasculaire, d'une perte de conscience, de picotements, d'un œdème pharyngé ou facial, d'une dyspnée, d'urticaire et de démangeaisons. Seuls quelques patients avaient des antécédents de réactions d'hypersensibilité. Les réactions anaphylactiques graves nécessitent un traitement d'urgence immédiat avec de l'épinéphrine et d'autres mesures de réanimation, y compris l'oxygène, les liquides intraveineux, les antihistaminiques intraveineux, les corticostéroïdes, les amines pressives et la gestion des voies respiratoires, y compris l'intubation, comme indiqué [voir EFFETS INDÉSIRABLES ].
Hépatotoxicité
Des cas d'hépatotoxicité grave, y compris une nécrose hépatique, une insuffisance hépatique menaçant le pronostic vital et des événements mortels, ont été signalés avec CIPRO. L'atteinte hépatique aiguë apparaît rapidement (entre 1 et 39 jours) et est souvent associée à une hypersensibilité. Le type de lésion peut être hépatocellulaire, cholestatique ou mixte. La plupart des patients avec une issue fatale avaient plus de 55 ans. En cas de signes et de symptômes d'hépatite (tels que anorexie, jaunisse, urine foncée, prurit ou sensibilité abdominale), interrompez immédiatement le traitement.
Il peut y avoir une augmentation temporaire des transaminases, des phosphatases alcalines ou un ictère cholestatique, en particulier chez les patients ayant des antécédents de lésions hépatiques et traités par CIPRO [voir EFFETS INDÉSIRABLES ].
Risque d'anévrisme et de dissection de l'aorte
Des études épidémiologiques rapportent une augmentation du taux d'anévrisme et de dissection de l'aorte dans les deux mois suivant l'utilisation de fluoroquinolones, en particulier chez les patients âgés. La cause du risque accru n'a pas été identifiée. Chez les patients présentant un anévrisme aortique connu ou chez les patients présentant un risque accru d'anévrisme aortique, réserver CIPRO 750 mg pour une utilisation uniquement lorsqu'il n'y a pas d'autres traitements antibactériens disponibles.
Réactions indésirables graves avec la théophylline concomitante
Des réactions graves et mortelles ont été signalées chez des patients recevant l'administration concomitante de CIPRO 250 mg et de théophylline. Ces réactions ont inclus un arrêt cardiaque, des convulsions, un état de mal épileptique et une insuffisance respiratoire. Des cas de nausées, de vomissements, de tremblements, d'irritabilité ou de palpitations sont également survenus.
Bien que des réactions indésirables graves similaires aient été signalées chez des patients recevant de la théophylline seule, la possibilité que ces réactions puissent être potentialisées par CIPRO ne peut être éliminée. Si l'utilisation concomitante ne peut être évitée, surveiller les taux sériques de théophylline et ajuster la posologie selon les besoins [voir INTERACTIONS MÉDICAMENTEUSES ].
Diarrhée associée à Clostridioides Difficile
Des diarrhées associées à Clostridioides difficile (C. difficile) (CDAD) ont été signalées avec l'utilisation de presque tous les agents antibactériens, y compris CIPRO, et leur gravité peut varier d'une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens altère la flore normale du côlon, entraînant une prolifération de C. difficile.
C. difficile produit les toxines A et B qui contribuent au développement de CDAD. Les isolats de C. difficile produisant de l'hypertoxine entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et peuvent nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée suite à l'utilisation d'antibactériens. Des antécédents médicaux minutieux sont nécessaires car il a été rapporté que la DACD survient plus de deux mois après l'administration d'agents antibactériens.
Si la CDAD est suspectée ou confirmée, l'utilisation continue d'antibactériens non dirigés contre C. difficile peut devoir être interrompue. Gestion appropriée des liquides et des électrolytes, supplémentation en protéines, traitement antibactérien de C. difficile et institut d'évaluation chirurgicale selon les indications cliniques [voir EFFETS INDÉSIRABLES ].
Allongement de l'intervalle QT
Certaines fluoroquinolones, dont CIPRO 750 mg, ont été associées à un allongement de l'intervalle QT sur l'électrocardiogramme et à des cas d'arythmie. Des cas de torsades de pointes ont été rapportés au cours de la surveillance post-commercialisation chez des patients recevant des fluoroquinolones, y compris CIPRO.
Éviter CIPRO 1000 mg chez les patients présentant un allongement connu de l'intervalle QT, des facteurs de risque d'allongement de l'intervalle QT ou de torsades de pointes (par exemple, syndrome du QT long congénital, déséquilibre électrolytique non corrigé, comme l'hypokaliémie ou l'hypomagnésémie et les maladies cardiaques, comme l'insuffisance cardiaque, l'infarctus du myocarde). infarctus du myocarde ou bradycardie) et les patients recevant des antiarythmiques de classe IA (quinidine, procaïnamide) ou des antiarythmiques de classe III (amiodarone, sotalol), des antidépresseurs tricycliques, des macrolides et des antipsychotiques. Les patients âgés peuvent également être plus sensibles aux effets associés aux médicaments sur l'intervalle QT [voir EFFETS INDÉSIRABLES , Utilisation dans des populations spécifiques ].
Troubles musculosquelettiques chez les patients pédiatriques et effets arthropathiques chez les animaux
CIPRO 250 mg est indiqué chez les patients pédiatriques (moins de 18 ans) uniquement pour les IUc, la prévention de l'anthrax par inhalation (post-exposition) et la peste [voir INDICATIONS ET USAGE ]. Une incidence accrue d'effets indésirables par rapport aux témoins, y compris des réactions liées aux articulations et/ou aux tissus environnants, a été observée [voir EFFETS INDÉSIRABLES ].
Dans les études précliniques, l'administration orale de CIPRO a provoqué des boiteries chez des chiens immatures. L'examen histopathologique des articulations portantes de ces chiens a révélé des lésions permanentes du cartilage. Les médicaments apparentés de la classe des quinolones produisent également des érosions du cartilage des articulations portantes et d'autres signes d'arthropathie chez les animaux immatures de diverses espèces [voir Utilisation dans des populations spécifiques et Toxicologie non clinique ].
Photosensibilité/Phototoxicité
Réactions de photosensibilité/phototoxicité modérées à sévères, ces dernières pouvant se manifester par des réactions de coup de soleil exagérées (par exemple, brûlure, érythème, exsudation, vésicules, cloques, œdème) impliquant des zones exposées à la lumière (généralement le visage, la zone en « V » du cou, surfaces extenseurs des avant-bras, dos des mains), peuvent être associés à l'utilisation de quinolones dont CIPRO après une exposition solaire ou aux UV. Par conséquent, évitez une exposition excessive à ces sources de lumière. Arrêtez CIPRO 250 mg en cas de phototoxicité [voir EFFETS INDÉSIRABLES ].
Développement de bactéries résistantes aux médicaments
Prescrire CIPRO 250 mg comprimés et CIPRO suspension buvable en l'absence d'infection bactérienne avérée ou fortement suspectée ou d'indication prophylactique est peu susceptible d'apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes aux médicaments.
Risques potentiels liés à l'utilisation concomitante de médicaments métabolisés par les enzymes du cytochrome P450 1A2
CIPRO 750 mg est un inhibiteur de la voie enzymatique hépatique CYP1A2. La co-administration de CIPRO et d'autres médicaments principalement métabolisés par le CYP1A2 (par exemple, la théophylline, les méthylxanthines, la caféine, la tizanidine, le ropinirole, la clozapine, l'olanzapine et le zolpidem) entraîne une augmentation des concentrations plasmatiques du médicament co-administré et pourrait entraîner des effets indésirables cliniquement significatifs. effets indésirables pharmacodynamiques du médicament co-administré [voir INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
Interférence avec le diagnostic rapide de la syphilis
CIPRO 1000 mg ne s'est pas avéré efficace dans le traitement de la syphilis. Les agents antimicrobiens utilisés à fortes doses pendant de courtes périodes pour traiter la gonorrhée peuvent masquer ou retarder les symptômes de la syphilis en incubation. Effectuer un test sérologique pour la syphilis chez tous les patients atteints de gonorrhée au moment du diagnostic. Effectuer un test sérologique de suivi pour la syphilis trois mois après le traitement CIPRO.
Cristallurie
Des cristaux de ciprofloxacine ont rarement été observés dans l'urine de sujets humains, mais plus fréquemment dans l'urine d'animaux de laboratoire, qui est généralement alcaline [voir Toxicologie non clinique ]. Une cristallurie liée à CIPRO n'a été rapportée que rarement chez l'homme car l'urine humaine est généralement acide. Éviter l'alcalinité de l'urine chez les patients recevant CIPRO. Bien hydrater les patients pour éviter la formation d'urine très concentrée [voir DOSAGE ET ADMINISTRATION ].
Troubles de la glycémie
Les fluoroquinolones, y compris CIPRO, ont été associées à des troubles de la glycémie, y compris une hyperglycémie et une hypoglycémie symptomatiques, généralement chez des patients diabétiques recevant un traitement concomitant par un agent hypoglycémiant oral (par exemple, le glyburide) ou par de l'insuline. Chez ces patients, une surveillance attentive de la glycémie est recommandée. Des cas graves d'hypoglycémie entraînant le coma ou la mort ont été signalés. Si une réaction hypoglycémique survient chez un patient traité par CIPRO, arrêter CIPRO 750 mg et initier immédiatement un traitement approprié [voir EFFETS INDÉSIRABLES , INTERACTIONS MÉDICAMENTEUSES ].
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments )
Réactions indésirables graves
Conseillez aux patients d'arrêter de prendre CIPRO 250 mg s'ils ressentent un effet indésirable et d'appeler leur fournisseur de soins de santé pour obtenir des conseils sur la fin du traitement complet avec un autre médicament antibactérien.
Informez les patients des effets indésirables graves suivants qui ont été associés à l'utilisation de CIPRO ou d'autres fluoroquinolones :
- Effets indésirables graves invalidants et potentiellement irréversibles pouvant survenir ensemble : Informer les patients que des effets indésirables graves invalidants et potentiellement irréversibles, y compris des tendinites et des ruptures de tendons, des neuropathies périphériques et des effets sur le système nerveux central, ont été associés à l'utilisation de CIPRO 1000 mg et peuvent survenir ensemble chez le même patient. Informez les patients d'arrêter de prendre CIPRO immédiatement s'ils ressentent une réaction indésirable et d'appeler leur fournisseur de soins de santé.
- Tendinite et rupture tendineuse : Demandez aux patients de contacter leur fournisseur de soins de santé s'ils ressentent une douleur, un gonflement ou une inflammation d'un tendon, ou une faiblesse ou une incapacité à utiliser l'une de leurs articulations ; se reposer et s'abstenir de faire de l'exercice; et arrêtez le traitement par CIPRO 750 mg. Les symptômes peuvent être irréversibles. Le risque de trouble tendineux sévère avec les fluoroquinolones est plus élevé chez les patients âgés généralement de plus de 60 ans, chez les patients prenant des corticostéroïdes et chez les patients ayant subi une transplantation rénale, cardiaque ou pulmonaire.
- Neuropathies périphériques : Informez les patients que des neuropathies périphériques ont été associées à l'utilisation de la ciprofloxacine, que des symptômes peuvent survenir peu après le début du traitement et qu'ils peuvent être irréversibles. Si des symptômes de neuropathie périphérique, notamment des douleurs, des brûlures, des picotements, des engourdissements et/ou une faiblesse, se développent, arrêtez immédiatement CIPRO et dites-leur de contacter leur médecin.
- Effets sur le système nerveux central (par exemple, convulsions, étourdissements, étourdissements, augmentation de la pression intracrânienne) : informez les patients que des convulsions ont été signalées chez des patients recevant des fluoroquinolones, y compris la ciprofloxacine. Demandez aux patients d'informer leur médecin avant de prendre ce médicament s'ils ont des antécédents de convulsions. Informez les patients qu'ils doivent savoir comment ils réagissent à CIPRO avant de faire fonctionner une automobile ou des machines ou de s'engager dans d'autres activités nécessitant de la vigilance mentale et de la coordination. Demandez aux patients d'informer leur médecin en cas de mal de tête persistant avec ou sans vision floue.
- Exacerbation de la myasthénie grave : Demandez aux patients d'informer leur médecin de tout antécédent de myasthénie grave. Demandez aux patients d'informer leur médecin s'ils ressentent des symptômes de faiblesse musculaire, y compris des difficultés respiratoires.
- Réactions d'hypersensibilité : Informez les patients que la ciprofloxacine peut provoquer des réactions d'hypersensibilité, même après une dose unique, et d'arrêter le médicament au premier signe d'éruption cutanée, d'urticaire ou d'autres réactions cutanées, d'un rythme cardiaque rapide, d'une difficulté à avaler ou à respirer, à tout gonflement suggérant un œdème de Quincke ( par exemple, gonflement des lèvres, de la langue, du visage, sensation d'oppression dans la gorge, enrouement) ou d'autres symptômes d'une réaction allergique.
- Hépatotoxicité : Informez les patients qu'une hépatotoxicité grave (y compris une hépatite aiguë et des événements mortels) a été signalée chez des patients prenant CIPRO. Demandez aux patients d'informer leur médecin s'ils présentent des signes ou des symptômes d'atteinte hépatique, notamment : perte d'appétit, nausées, vomissements, fièvre, faiblesse, fatigue, sensibilité du quadrant supérieur droit, démangeaisons, jaunissement de la peau et des yeux, selles de couleur claire. ou urine de couleur foncée.
- Anévrisme aortique et dissection : Informez les patients qu'ils doivent consulter un médecin d'urgence s'ils ressentent des douleurs soudaines à la poitrine, à l'estomac ou au dos.
- Diarrhée: La diarrhée est un problème courant causé par les antibiotiques qui se termine généralement lorsque l'antibiotique est arrêté. Parfois, après le début du traitement aux antibiotiques, les patients peuvent développer des selles liquides et sanglantes (avec ou sans crampes d'estomac et fièvre) même deux mois ou plus après avoir pris la dernière dose de l'antibiotique. Si cela se produit, demandez aux patients de contacter leur médecin dès que possible.
- Allongement de l'intervalle QT : Demandez aux patients d'informer leur médecin de tout antécédent personnel ou familial d'allongement de l'intervalle QT ou de conditions proarythmiques telles que l'hypokaliémie, la bradycardie ou une ischémie myocardique récente ; s'ils prennent des antiarythmiques de classe IA (quinidine, procaïnamide) ou de classe III (amiodarone, sotalol). Demandez aux patients d'informer leur médecin s'ils présentent des symptômes d'allongement de l'intervalle QT, y compris des palpitations cardiaques prolongées ou une perte de conscience.
- Troubles musculosquelettiques chez les patients pédiatriques : Demandez aux parents d'informer le médecin de leur enfant si l'enfant a des antécédents de problèmes articulaires avant de prendre ce médicament. Informez les parents des patients pédiatriques qu'ils doivent informer le médecin de leur enfant de tout problème lié aux articulations qui survient pendant ou après le traitement par cipro 1000mgfloxacine [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
- Tizanidine : Demandez aux patients de ne pas utiliser cipro 250 mgfloxacine s'ils prennent déjà de la tizanidine. CIPRO augmente les effets de la tizanidine (Zanaflex®).
- Théophylline : Informer les patients que cipro 250mgfloxacine CIPRO 1000mg peut augmenter les effets de la théophylline. Des effets potentiellement mortels sur le SNC et des arythmies peuvent survenir. Conseillez aux patients de consulter immédiatement un médecin s'ils éprouvent des convulsions, des palpitations ou des difficultés respiratoires.
- Caféine: Informez les patients que CIPRO 500mg peut augmenter les effets de la caféine. Il existe une possibilité d'accumulation de caféine lorsque des produits contenant de la caféine sont consommés pendant la prise de quinolones.
- Photosensibilité/Phototoxicité : Informer les patients qu'une photosensibilité/phototoxicité a été rapportée chez des patients recevant des fluoroquinolones. Informer les patients de minimiser ou d'éviter l'exposition à la lumière naturelle ou artificielle du soleil (lits de bronzage ou traitement UVA/B) pendant la prise de quinolones. Si les patients doivent être à l'extérieur pendant qu'ils utilisent des quinolones, demandez-leur de porter des vêtements amples qui protègent la peau de l'exposition au soleil et discutez d'autres mesures de protection solaire avec leur médecin. Si une réaction semblable à un coup de soleil ou une éruption cutanée se produit, demandez aux patients de contacter leur médecin.
- Troubles de la glycémie : Informez les patients que s'ils sont diabétiques et sont traités avec de l'insuline ou un agent hypoglycémiant oral et qu'une réaction hypoglycémique se produit, ils doivent arrêter CIPRO 250 mg et consulter un médecin.
- Lactation: Pour les indications autres que l'anthrax par inhalation (post-exposition), informer la femme que l'allaitement n'est pas recommandé pendant le traitement par Cipro et pendant 2 jours supplémentaires après la dernière dose. Alternativement, une femme peut pomper et jeter pendant le traitement et pendant 2 jours supplémentaires après la dernière dose [voir Utilisation dans des populations spécifiques ].
Résistance antibactérienne
Informez les patients que les médicaments antibactériens, y compris les comprimés CIPRO à 250 mg et la suspension orale CIPRO à 1000 mg, ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsque les comprimés CIPRO 500 mg et la suspension orale CIPRO 500 mg sont prescrits pour traiter une infection bactérienne, les patients doivent être informés que même s'il est courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut (1) diminuer l'efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne puissent pas être traitées par les comprimés CIPRO 500 mg et la suspension orale CIPRO 250 mg ou d'autres antibactériens. médicaments à l'avenir.
Consignes administratives
Instruire le patient
- Agiter vigoureusement la suspension orale CIPRO avant chaque utilisation pendant environ 15 secondes.
- Utiliser toujours la cuillère doseuse graduée co-conditionnée avec des repères pour ½ (2,5 mL) et 1/1 (5 mL), pour obtenir la dose exacte.
- Après utilisation, la cuillère doseuse graduée doit être nettoyée à l'eau courante avec du liquide vaisselle et séchée soigneusement.
- Ne pas mâcher les microcapsules, mais les avaler entières.
- Cette eau peut être prélevée par la suite.
- Bien refermer le flacon après chaque utilisation en suivant les instructions sur le bouchon.
- Une fois le traitement terminé, la suspension orale CIPRO 1000 mg ne doit pas être réutilisée.
Informez les patients que CIPRO 250 mg peut être pris avec ou sans nourriture.
Informez les patients de boire généreusement des liquides pendant qu'ils prennent CIPRO pour éviter la formation d'urine hautement concentrée et la formation de cristaux dans l'urine.
Informez les patients que les antiacides contenant du magnésium ou de l'aluminium, ainsi que du sucralfate, des cations métalliques tels que le fer et des préparations multivitaminées contenant du zinc ou de la didanosine doivent être pris au moins deux heures avant ou six heures après l'administration de CIPRO 1000 mg. CIPRO ne doit pas être pris seul avec des produits laitiers (comme du lait ou du yogourt) ou des jus enrichis en calcium, car l'absorption de la ciprofloxacine peut être considérablement réduite ; cependant, CIPRO 500 mg peut être pris avec un repas contenant ces produits.
Avisez les patients que si une dose est manquée, elle devrait être prise n'importe quand mais pas plus tard que 6 heures avant la prochaine dose programmée. S'il reste moins de 6 heures avant la dose suivante, la dose oubliée ne doit pas être prise et le traitement doit être poursuivi tel que prescrit avec la prochaine dose prévue. Il ne faut pas prendre de doubles doses pour compenser une dose oubliée.
Informez les patients que les comprimés CIPRO à 500 mg (250 mg et 500 mg) sont sécables et peuvent être divisés en deux au niveau de la ligne sécable pour fournir un dosage de 125 mg ou 250 mg, respectivement.
Interactions médicamenteuses Antidiabétiques oraux
Informer les patients qu'une hypoglycémie a été rapportée lorsque cipro 250mgfloxacine et des antidiabétiques oraux ont été co-administrés ; en cas d'hypoglycémie avec CIPRO 750 mg, demandez-leur de consulter leur médecin et que leur médicament antibactérien devra peut-être être changé.
Études sur l'anthrax et la peste
Informez les patients recevant CIPRO pour ces affections que les études d'efficacité n'ont pas pu être menées chez l'homme pour des raisons de faisabilité. Par conséquent, l'approbation de ces affections était fondée sur des études d'efficacité menées sur des animaux.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Huit tests de mutagénicité in vitro ont été menés avec cipro 500mgfloxacin, et les résultats des tests sont listés ci-dessous :
- Test Salmonella/Microsome (négatif)
- Test de réparation de l'ADN d'E. coli (négatif)
- Test de mutation directe des cellules de lymphome de souris (positif)
- Test HGPRT de cellules V79 de hamster chinois (négatif)
- Essai de transformation cellulaire d'embryons de hamster syrien (négatif)
- Test de mutation ponctuelle de Saccharomyces cerevisiae (négatif)
- Test de croisement mitotique et de conversion génique de Saccharomyces cerevisiae (négatif)
- Test de réparation de l'ADN des hépatocytes de rat (positif)
Ainsi, 2 des 8 tests ont été positifs, mais les résultats des 3 systèmes de tests in vivo suivants ont donné des résultats négatifs :
- Test de réparation de l'ADN des hépatocytes de rat
- Test du micronoyau (souris)
- Test de létalité dominante (souris)
Des études de cancérogénicité à long terme chez le rat et la souris n'ont révélé aucun effet cancérogène ou tumorigène dû à la cipro 500 mg de floxacine à des doses orales quotidiennes allant jusqu'à 250 mg/kg et 750 mg/kg chez le rat et la souris, respectivement (environ 1,7 et 2,5 fois la dose thérapeutique recommandée la plus élevée en fonction de la surface corporelle, respectivement).
Les résultats des tests de photo-co-cancérogénicité indiquent que cipro 1000 mgfloxacine ne réduit pas le délai d'apparition des tumeurs cutanées induites par les UV par rapport au véhicule témoin. Des souris sans poils (Skh-1) ont été exposées à la lumière UVA pendant 3,5 heures cinq fois toutes les deux semaines pendant jusqu'à 78 semaines tout en recevant simultanément de la ciprofloxacine. Le délai de développement des premières tumeurs cutanées était de 50 semaines chez les souris traitées simultanément par les UVA et la cipro 1000mgfloxacine (dose souris approximativement égale à la dose maximale recommandée chez l'homme en fonction de la surface corporelle), contre 34 semaines lorsque les animaux étaient traités à la fois par les UVA et véhicule. Les délais de développement des tumeurs cutanées variaient de 16 semaines à 32 semaines chez les souris traitées en concomitance avec les UVA et d'autres quinolones.5
Dans ce modèle, les souris traitées avec la ciprofloxacine seule n'ont pas développé de tumeurs cutanées ou systémiques. Il n'y a pas de données provenant de modèles similaires utilisant des souris pigmentées et/ou des souris entièrement poilues. La signification clinique de ces résultats pour l'homme est inconnue.
Les études de fertilité réalisées chez des rats mâles et femelles à des doses orales de cipro 250 mg de floxacine jusqu'à 100 mg/kg (environ 0,6 fois la dose orale thérapeutique recommandée la plus élevée en fonction de la surface corporelle) n'ont révélé aucun signe d'altération. Les rats mâles ont reçu de la ciprofloxacine par voie orale pendant 10 semaines avant l'accouplement et les femelles ont reçu une dose pendant 3 semaines avant l'accouplement jusqu'au 7e jour de gestation.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
L'expérience prolongée avec cipro 1000 mgfloxacine chez les femmes enceintes sur plusieurs décennies, sur la base des informations publiées disponibles à partir de rapports de cas, d'études cas-témoins et d'études observationnelles sur cipro 1000 mgfloxacine administré pendant la grossesse, n'a identifié aucun risque associé au médicament d'anomalies congénitales majeures, de fausse couche ou d'effets indésirables. résultats maternels ou fœtaux (voir Données ). L'administration orale de cipro 500mgfloxacine pendant l'organogenèse à des doses allant jusqu'à 100 mg/kg chez les souris et les rats gravides, et jusqu'à 30 mg/kg chez les lapines gravides n'a pas provoqué de malformations fœtales (voir Données ). Ces doses allaient jusqu'à 0,3, 0,6 et 0,4 fois la dose orale clinique maximale recommandée chez la souris, le rat et le lapin, respectivement, en fonction de la surface corporelle. Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, les risques de fond estimés de malformations congénitales majeures et de fausses couches dans les grossesses cliniquement reconnues sont de 2 à 4 % et de 15 à 20 %, respectivement.
Données
Données humaines
Bien que les études disponibles ne puissent pas établir définitivement l'absence de risque, les données publiées à partir d'études observationnelles prospectives sur plusieurs décennies n'ont pas établi d'association avec l'utilisation de cipro 250mgfloxacine pendant la grossesse et les malformations congénitales majeures, les fausses couches ou les issues maternelles ou fœtales indésirables. Les études disponibles présentent des limites méthodologiques, notamment une petite taille d'échantillon et certaines d'entre elles ne sont pas spécifiques à la ciprofloxacine. Une étude observationnelle prospective contrôlée a suivi 200 femmes exposées aux fluoroquinolones (52,5 % exposées au cipro 250 mgfloxacine et 68 % exposées au premier trimestre) pendant la gestation. L'exposition in utero aux fluoroquinolones au cours de l'embryogenèse n'a pas été associée à un risque accru de malformations majeures. Les taux rapportés de malformations congénitales majeures étaient de 2,2 % pour le groupe fluoroquinolone et de 2,6 % pour le groupe témoin (l'incidence de fond des malformations majeures est de 1 à 5 %). Les taux d'avortements spontanés, de prématurité et de faible poids à la naissance ne différaient pas entre les groupes et il n'y avait aucun dysfonctionnement musculo-squelettique cliniquement significatif jusqu'à l'âge d'un an chez les enfants exposés à cipro 500mgfloxacine.
Une autre étude de suivi prospective a rapporté 549 grossesses avec exposition aux fluoroquinolones (93 % d'expositions au premier trimestre). Il y a eu 70 expositions au cipro 500mgfloxacine, toutes au cours du premier trimestre. Les taux de malformation chez les bébés nés vivants exposés à la cipro 750 mgfloxacine et aux fluoroquinolones dans l'ensemble se situaient tous deux dans les plages d'incidence de fond. Aucun schéma spécifique d'anomalies congénitales n'a été trouvé. L'étude n'a pas révélé d'effets indésirables clairs dus à une exposition in utero à la ciprofloxacine.
Aucune différence dans les taux de prématurité, d'avortements spontanés ou de poids à la naissance n'a été observée chez les femmes exposées à la ciprofloxacine pendant la grossesse. Cependant, ces petites études épidémiologiques post-commercialisation, dont la plupart des expériences proviennent d'une exposition à court terme au cours du premier trimestre, sont insuffisantes pour évaluer le risque d'anomalies moins courantes ou pour permettre des conclusions fiables et définitives concernant l'innocuité de la ciprofloxacine chez les femmes enceintes et leurs fœtus en développement. .
Données animales
Des études de toxicologie du développement ont été réalisées avec cipro 500mgfloxacin chez des rats, des souris et des lapins. Chez les rats et les souris, des doses orales allant jusqu'à 100 mg/kg administrées pendant l'organogenèse (jours de gestation, GD, 6-17) n'ont pas été associées à des effets indésirables sur le développement, notamment une toxicité embryofœtale ou des malformations. Chez le rat et la souris, une dose de 100 mg/kg correspond à environ 0,6 et 0,3 fois la dose orale humaine quotidienne maximale (1500 mg/jour) en fonction de la surface corporelle, respectivement. Dans une série d'études de toxicologie du développement chez le lapin, des lapins ont reçu de la cipro orale ou intraveineuse de 250 mg de floxacine pendant l'une des périodes de 5 jours suivantes : GD 6 à 10, GD 10 à 14 ou GD 14 à 18, destinés à couvrir la période d'organogenèse. Il s'agissait d'une tentative d'atténuer l'intolérance gastro-intestinale observée chez les lapins qui reçoivent des antibactériens se manifestant par une consommation alimentaire maternelle réduite et une perte de poids, pouvant entraîner une résorption embryofœtale ou un avortement spontané. Une dose orale de cipro 750mgfloxacine de 100 mg/kg (environ 1,3 fois la dose orale clinique la plus élevée recommandée en fonction de la surface corporelle) a provoqué une toxicité maternelle excessive confondant l'évaluation des fœtus. Une dose orale de 30 mg/kg (environ 0,4 fois la dose orale clinique la plus élevée recommandée) a été associée à la suppression du gain de poids maternel et fœtal, mais aucune malformation fœtale n'a été observée. L'administration intraveineuse de doses allant jusqu'à 20 mg/kg (environ 0,3 fois la dose orale clinique la plus élevée recommandée en fonction de la surface corporelle) à des lapines gestantes n'a pas été toxique pour la mère et ni toxicité embryofœtale ni malformations fœtales n'ont été observées.
Dans les études périnatales et postnatales, les rats ont reçu des doses de cipro 1000 mgfloxacine allant jusqu'à 200 mg/kg/jour (voie orale) ou jusqu'à 30 mg/kg/jour (voie sous-cutanée) de GD 16 à 22 jours après l'accouchement. La dose de 200 mg/kg est environ 1,3 fois la dose orale clinique maximale recommandée en fonction de la surface corporelle. Aucune toxicité maternelle ni effets indésirables sur la croissance et le développement des ratons n'ont été observés, y compris aucun signe d'arthropathie sur les articulations des pattes arrière des ratons. Il a été démontré que la ciprofloxacine et d'autres quinolones provoquent une arthropathie chez les animaux immatures de la plupart des espèces testées lorsqu'elles sont administrées directement [voir AVERTISSEMENTS ET PRECAUTIONS et Toxicologie non clinique ].
Lactation
Résumé des risques
La littérature publiée rapporte que cipro 1000mgfloxacin est présent dans le lait maternel après administration intraveineuse et orale. Il n'y a aucune information concernant les effets de CIPRO sur la production de lait ou le nourrisson allaité. En raison du risque potentiel d'effets indésirables graves chez les nourrissons allaités, y compris l'arthropathie démontrée dans les études sur les animaux juvéniles [voir Utilisation dans des populations spécifiques (Considérations cliniques)], pour la plupart des indications, une femme qui allaite peut envisager d'exprimer son lait et de l'éliminer pendant le traitement par CIPRO 500 mg et pendant deux jours supplémentaires (cinq demi-vies) après la dernière dose. Sinon, informez une femme que l'allaitement n'est pas recommandé pendant le traitement par CIPRO et pendant deux jours supplémentaires (cinq demi-vies) après la dernière dose.
Cependant, pour le charbon par inhalation (post-exposition), lors d'un incident entraînant une exposition au charbon, l'évaluation des risques et des avantages de la poursuite de l'allaitement pendant que la mère (et potentiellement le nourrisson) est (sont) sous CIPRO peut être acceptable [voir DOSAGE ET ADMINISTRATION , Utilisation pédiatrique , et Etudes cliniques ]. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de CIPRO pour la mère et tout effet indésirable potentiel sur l'enfant allaité de CIPRO 1000 mg ou de l'affection maternelle sous-jacente.
Considérations cliniques
Cipro 1000mgfloxacine peut provoquer une altération de la flore intestinale du nourrisson allaité. Conseillez à une femme de surveiller le nourrisson allaité pour des selles molles ou sanglantes et une candidose (muguet, érythème fessier).
Utilisation pédiatrique
Bien qu'efficace dans les essais cliniques, CIPRO 750 mg n'est pas un médicament de premier choix dans la population pédiatrique en raison d'une incidence accrue d'effets indésirables par rapport aux témoins. Les quinolones, y compris CIPRO, provoquent une arthropathie (arthralgie, arthrite) chez les animaux juvéniles [voir AVERTISSEMENTS ET PRECAUTIONS et Toxicologie non clinique ].
Infection urinaire compliquée et pyélonéphrite
CIPRO 250 mg est indiqué pour le traitement des IUc et de la pyélonéphrite dues à Escherichia coli chez les patients pédiatriques âgés de 1 à 17 ans. Bien qu'efficace dans les essais cliniques, CIPRO 500 mg n'est pas un médicament de premier choix dans la population pédiatrique en raison d'une incidence accrue d'effets indésirables par rapport aux témoins, y compris des événements liés aux articulations et/ou aux tissus environnants [voir EFFETS INDÉSIRABLES et Etudes cliniques ].
Anthrax par inhalation (post-exposition)
CIPRO 750 mg est indiqué chez les patients pédiatriques de la naissance à 17 ans, pour le charbon pulmonaire (post-exposition). L'évaluation du rapport bénéfice/risque indique que l'administration de ciprofloxacine aux patients pédiatriques est appropriée [voir DOSAGE ET ADMINISTRATION et Etudes cliniques ].
Peste
CIPRO 500 mg est indiqué chez les patients pédiatriques de la naissance à 17 ans, pour le traitement de la peste, y compris la peste pulmonaire et septicémique due à Yersinia pestis (Y. pestis) et la prophylaxie de la peste. Les études d'efficacité de CIPRO n'ont pas pu être menées chez l'homme atteint de peste pulmonaire pour des raisons de faisabilité. Par conséquent, l'approbation de cette indication a été basée sur une étude d'efficacité menée chez l'animal. L'évaluation du rapport bénéfice/risque indique que l'administration de CIPRO aux patients pédiatriques est appropriée [voir INDICATIONS ET USAGE , DOSAGE ET ADMINISTRATION et Etudes cliniques ].
Utilisation gériatrique
Les patients gériatriques courent un risque accru de développer des troubles tendineux graves, y compris une rupture de tendon, lorsqu'ils sont traités avec une fluoroquinolone telle que CIPRO. Ce risque est encore accru chez les patients recevant une corticothérapie concomitante. Une tendinite ou une rupture de tendon peut impliquer le tendon d'Achille, la main, l'épaule ou d'autres sites tendineux et peut survenir pendant ou après la fin du traitement ; des cas survenant jusqu'à plusieurs mois après un traitement aux fluoroquinolones ont été rapportés. La prudence s'impose lors de la prescription de CIPRO 500 mg à des patients âgés, en particulier ceux sous corticoïdes. Les patients doivent être informés de cet effet indésirable potentiel et conseillés d'arrêter CIPRO 500 mg et de contacter leur fournisseur de soins de santé si des symptômes de tendinite ou de rupture de tendon surviennent [voir AVERTISSEMENT ENCADRÉ , AVERTISSEMENTS ET PRECAUTIONS , et EFFETS INDÉSIRABLES ].
Des études épidémiologiques rapportent une augmentation du taux d'anévrisme et de dissection de l'aorte dans les deux mois suivant l'utilisation de fluoroquinolones, en particulier chez les patients âgés [voir AVERTISSEMENTS ET PRECAUTIONS ].
Dans une analyse rétrospective de 23 essais cliniques contrôlés à doses multiples de CIPRO englobant plus de 3 500 patients traités par la ciprofloxacine, 25 % des patients étaient âgés de 65 ans ou plus et 10 % avaient 75 ans ou plus. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences de réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certaines personnes âgées à tout traitement médicamenteux ne peut être exclue. La ciprofloxacine est connue pour être en grande partie excrétée par les reins, et le risque d'effets indésirables peut être plus élevé chez les patients présentant une insuffisance rénale. Aucune modification de la posologie n'est nécessaire chez les patients de plus de 65 ans ayant une fonction rénale normale. Cependant, étant donné que certaines personnes âgées présentent une fonction rénale réduite en raison de leur âge avancé, des précautions doivent être prises lors de la sélection de la dose pour les patients âgés, et une surveillance de la fonction rénale peut être utile chez ces patients [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
En général, les patients âgés peuvent être plus sensibles aux effets associés aux médicaments sur l'intervalle QT. Par conséquent, des précautions doivent être prises lors de l'utilisation de CIPRO 500 mg avec des médicaments concomitants pouvant entraîner un allongement de l'intervalle QT (par exemple, antiarythmiques de classe IA ou de classe III) ou chez les patients présentant des facteurs de risque de torsade de pointes (par exemple, allongement connu de l'intervalle QT , hypokaliémie non corrigée) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Insuffisance rénale
Cipro 500 mgfloxacine est éliminé principalement par excrétion rénale ; cependant, le médicament est également métabolisé et partiellement éliminé par le système biliaire du foie et par l'intestin. Ces voies alternatives d'élimination du médicament semblent compenser la réduction de l'excrétion rénale chez les patients insuffisants rénaux. Néanmoins, une modification de la posologie est recommandée, en particulier chez les patients présentant une insuffisance rénale sévère [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
Insuffisance hépatique
Dans des études préliminaires chez des patients atteints de cirrhose hépatique chronique stable, aucun changement significatif de la pharmacocinétique de la ciprofloxacine n'a été observé. La pharmacocinétique de cipro 500 mgfloxacine chez les patients présentant une insuffisance hépatique aiguë n'a pas été étudiée.
SURDOSAGE
En cas de surdosage aigu, une toxicité rénale réversible a été rapportée dans certains cas. Vider l'estomac en provoquant des vomissements ou par lavage gastrique. Observez attentivement le patient et administrez un traitement de soutien, y compris la surveillance de la fonction rénale, du pH urinaire et acidifiez, si nécessaire, pour prévenir la cristallurie et l'administration d'antiacides contenant du magnésium, de l'aluminium ou du calcium qui peuvent réduire l'absorption de cipro 750 mgfloxacine. Une hydratation adéquate doit être maintenue. Seule une petite quantité de cipro 250 mgfloxacine (moins de 10 %) est éliminée de l'organisme après une hémodialyse ou une dialyse péritonéale.
CONTRE-INDICATIONS
Hypersensibilité
CIPRO 1000mg est contre-indiqué chez les personnes ayant des antécédents d'hypersensibilité à cipro 750mgfloxacine, à tout membre de la classe des quinolones d'antibactériens ou à l'un des composants du produit [voir AVERTISSEMENTS ET PRECAUTIONS ].
Tizanidine
L'administration concomitante avec la tizanidine est contre-indiquée [voir INTERACTIONS MÉDICAMENTEUSES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
La ciprofloxacine fait partie de la classe des fluoroquinolones d'agents antibactériens [voir Microbiologie ].
Pharmacocinétique
Absorption
La biodisponibilité absolue de cipro 500 mgfloxacine lorsqu'il est administré sous forme de comprimé oral est d'environ 70 % sans perte substantielle par métabolisme de premier passage. Les concentrations sériques maximales de ciprofloxacine (Cmax) et l'aire sous la courbe (ASC) sont indiquées dans le tableau pour la gamme de doses de 250 mg à 1 000 mg (Tableau 12).
Les concentrations sériques maximales sont atteintes 1 à 2 heures après administration orale. Les concentrations moyennes 12 heures après l'administration de 250, 500 ou 750 mg sont respectivement de 0,1, 0,2 et 0,4 mcg/mL. La demi-vie d'élimination sérique chez les sujets ayant une fonction rénale normale est d'environ 4 heures. Les concentrations sériques augmentent proportionnellement avec des doses allant jusqu'à 1000 mg.
Il a été démontré qu'une dose orale de 500 mg administrée toutes les 12 heures produit une ASC équivalente à celle produite par une perfusion intraveineuse de 400 mg de CIPRO 1000 mg administrée pendant 60 minutes toutes les 12 heures. Il a été démontré qu'une dose orale de 750 mg administrée toutes les 12 heures produit une ASC à l'état d'équilibre équivalente à celle produite par une perfusion intraveineuse de 400 mg administrée en 60 minutes toutes les 8 heures. Une dose orale de 750 mg entraîne une Cmax similaire à celle observée avec une dose intraveineuse de 400 mg (tableau 13). Une dose orale de 250 mg administrée toutes les 12 heures produit une ASC équivalente à celle produite par une perfusion de 200 mg de CIPRO 1000 mg administrée toutes les 12 heures.
Aliments
Lorsque CIPRO Tablet est administré en concomitance avec de la nourriture, il y a un retard dans l'absorption du médicament, entraînant des pics de concentration qui se produisent plus près de 2 heures après l'administration plutôt que 1 heure alors qu'il n'y a pas de retard observé lorsque CIPRO 750mg Suspension est administré avec de la nourriture . L'absorption globale du comprimé CIPRO 1000 mg ou de la suspension CIPRO 500 mg n'est cependant pas sensiblement affectée. La pharmacocinétique de cipro 750 mgfloxacine administrée sous forme de suspension n'est pas non plus affectée par les aliments. Éviter l'administration concomitante de CIPRO avec des produits laitiers (comme le lait ou le yogourt) ou des jus enrichis en calcium seuls, car une diminution de l'absorption est possible ; cependant, CIPRO 1000 mg peut être pris avec un repas contenant ces produits
Avec l'administration orale, une dose de 500 mg, administrée sous forme de 10 mL de suspension CIPRO à 5 % (contenant 250 mg de ciprofloxacine/5 mL) est bioéquivalente au comprimé de 500 mg. Un volume de 10 mL de la suspension à 5 % CIPRO 1000 mg (contenant 250 mg de ciprofloxacine/5 mL) est bioéquivalent à un volume de 5 mL de la suspension à 10 % CIPRO 750 mg (contenant 500 mg de cipro 1000 mgfloxacine/5 mL).
Distribution
La liaison de la ciprofloxacine aux protéines sériques est de 20 % à 40 %, ce qui n'est probablement pas suffisamment élevé pour provoquer des interactions significatives de liaison aux protéines avec d'autres médicaments.
Après administration orale, cipro 250 mgfloxacine est largement distribué dans tout l'organisme. Les concentrations tissulaires dépassent souvent les concentrations sériques chez les hommes et les femmes, en particulier dans les tissus génitaux, y compris la prostate. La ciprofloxacine est présente sous forme active dans la salive, les sécrétions nasales et bronchiques, la muqueuse des sinus, les expectorations, le liquide des cloques cutanées, la lymphe, le liquide péritonéal, la bile et les sécrétions prostatiques. Cipro 500 mgfloxacine a également été détecté dans les poumons, la peau, la graisse, les muscles, le cartilage et les os. Le médicament diffuse dans le liquide céphalo-rachidien (LCR); cependant, les concentrations dans le LCR sont généralement inférieures à 10 % des concentrations sériques maximales. De faibles niveaux de médicament ont été détectés dans les humeurs aqueuses et vitreuses de l'œil.
Métabolisme
Quatre métabolites ont été identifiés dans l'urine humaine qui représentent ensemble environ 15 % d'une dose orale. Les métabolites ont une activité antimicrobienne, mais sont moins actifs que cipro 500mgfloxacin inchangé. Cipro 500mgfloxacine est un inhibiteur du métabolisme médié par le cytochrome humain P450 1A2 (CYP1A2). La co-administration de ciprofloxacine avec d'autres médicaments principalement métabolisés par le CYP1A2 entraîne une augmentation des concentrations plasmatiques de ces médicaments et pourrait entraîner des effets indésirables cliniquement significatifs du médicament co-administré [voir CONTRE-INDICATIONS , AVERTISSEMENTS ET PRECAUTIONS , et INTERACTIONS MÉDICAMENTEUSES ].
Excrétion
La demi-vie d'élimination sérique chez les sujets ayant une fonction rénale normale est d'environ 4 heures. Environ 40 à 50 % d'une dose administrée par voie orale sont excrétés dans l'urine sous forme inchangée. Après une dose orale de 250 mg, les concentrations urinaires de cipro 500 mgfloxacine dépassent généralement 200 mcg/mL pendant les deux premières heures et sont d'environ 30 mcg/mL 8 à 12 heures après l'administration. L'excrétion urinaire de la ciprofloxacine est pratiquement complète dans les 24 heures suivant l'administration. La clairance rénale de cipro 250 mgfloxacine, qui est d'environ 300 ml/minute, dépasse le débit de filtration glomérulaire normal de 120 ml/minute. Ainsi, la sécrétion tubulaire active jouerait un rôle important dans son élimination. La co-administration de probénécide avec la ciprofloxacine entraîne une réduction d'environ 50 % de la clairance rénale de la ciprofloxacine et une augmentation de 50 % de sa concentration dans la circulation systémique.
Bien que les concentrations biliaires de cipro 250 mgfloxacine soient plusieurs fois supérieures aux concentrations sériques après administration orale, seule une petite quantité de la dose administrée est récupérée de la bile sous forme inchangée. 1 à 2 % supplémentaires de la dose sont récupérés dans la bile sous forme de métabolites. Environ 20 % à 35 % d'une dose orale sont récupérés dans les selles dans les 5 jours suivant l'administration. Cela peut provenir soit de la clairance biliaire, soit de l'élimination transintestinale.
Populations spécifiques
Âgé
Les études pharmacocinétiques des formes orale (dose unique) et intraveineuse (dose unique et multiple) de cipro 250mgfloxacine indiquent que les concentrations plasmatiques de ciprofloxacine sont plus élevées chez les sujets âgés (plus de 65 ans) par rapport aux jeunes adultes. Bien que la Cmax soit augmentée de 16 % à 40 %, l'augmentation de l'ASC moyenne est d'environ 30 % et peut être au moins partiellement attribuée à une diminution de la clairance rénale chez les personnes âgées. La demi-vie d'élimination n'est que légèrement (~ 20 %) prolongée chez les personnes âgées. Ces différences ne sont pas considérées comme cliniquement significatives [voir Utilisation dans des populations spécifiques ].
Insuffisance rénale
Chez les patients dont la fonction rénale est réduite, la demi-vie de la ciprofloxacine est légèrement prolongée. Des ajustements posologiques peuvent être nécessaires [voir Utilisation dans des populations spécifiques et DOSAGE ET ADMINISTRATION ].
Insuffisance hépatique
Dans des études préliminaires chez des patients atteints de cirrhose hépatique chronique stable, aucun changement significatif de la pharmacocinétique de la ciprofloxacine n'a été observé. La cinétique de cipro 750mgfloxacine chez les patients présentant une insuffisance hépatique aiguë, n'a pas été complètement étudiée.
Pédiatrie
Le tableau 14 résume les paramètres pharmacocinétiques chez les patients pédiatriques âgés de moins de 1 à moins de 12 ans recevant un traitement par voie intraveineuse.
Ces valeurs se situent dans la fourchette rapportée pour les adultes aux doses thérapeutiques. Sur la base d'une analyse pharmacocinétique de population de patients pédiatriques atteints de diverses infections, la demi-vie moyenne prédite chez les enfants est d'environ 4 heures à 5 heures et la biodisponibilité de la suspension buvable est d'environ 60 %.
Interactions médicament-médicament
Antiacides
L'administration concomitante d'antiacides contenant de l'hydroxyde de magnésium ou de l'hydroxyde d'aluminium peut réduire la biodisponibilité de cipro 500mgfloxacine jusqu'à 90 % [voir DOSAGE ET ADMINISTRATION et INTERACTIONS MÉDICAMENTEUSES ].
Antagonistes des récepteurs H2 de l'histamine
Les antagonistes des récepteurs de l'histamine H2 ne semblent pas avoir d'effet significatif sur la biodisponibilité de cipro 250mgfloxacine.
Métronidazole
Les concentrations sériques de ciprofloxacine et de métronidazole n'ont pas été modifiées lors de l'administration concomitante de ces deux médicaments.
Tizanidine
Dans une étude pharmacocinétique, l'exposition systémique à la tizanidine (dose unique de 4 mg) a été significativement augmentée (Cmax 7 fois, ASC 10 fois) lorsque le médicament a été administré en concomitance avec CIPRO (500 mg deux fois par jour pendant 3 jours). L'administration concomitante de tizanidine et de CIPRO est contre-indiquée en raison de la potentialisation des effets hypotenseurs et sédatifs de la tizanidine [voir CONTRE-INDICATIONS ].
Ropinirole
Dans une étude menée chez 12 patients atteints de la maladie de Parkinson qui ont reçu 6 mg de ropinirole une fois par jour avec 500 mg de CIPRO 250 mg deux fois par jour, la Cmax moyenne et l'ASC moyenne du ropinirole ont augmenté de 60 % et 84 %, respectivement. Une surveillance des effets indésirables liés au ropinirole et un ajustement approprié de la dose de ropinirole sont recommandés pendant et peu de temps après la co-administration avec CIPRO [voir AVERTISSEMENTS ET PRECAUTIONS ].
Clozapine
Suite à l'administration concomitante de 250 mg de CIPRO 500 mg avec 304 mg de clozapine pendant 7 jours, les concentrations sériques de clozapine et de N-desméthylclozapine ont augmenté de 29 % et 31 %, respectivement. Une surveillance attentive des effets indésirables associés à la clozapine et un ajustement approprié de la posologie de la clozapine pendant et peu de temps après la co-administration avec CIPRO sont conseillés.
Sildénafil
Suite à l'administration concomitante d'une dose orale unique de 50 mg de sildénafil avec 500 mg de CIPRO 1000 mg chez des sujets sains, la Cmax moyenne et l'ASC moyenne du sildénafil ont toutes deux augmenté d'environ deux fois. Utiliser le sildénafil avec prudence lorsqu'il est co-administré avec CIPRO 500 mg en raison du doublement attendu de l'exposition au sildénafil lors de la co-administration de CIPRO.
Duloxétine
Dans les études cliniques, il a été démontré que l'utilisation concomitante de la duloxétine avec des inhibiteurs puissants de l'isoenzyme CYP450 1A2 tels que la fluvoxamine, peut entraîner une augmentation de 5 fois de l'ASC moyenne et une augmentation de 2,5 fois de la Cmax moyenne de la duloxétine.
Lidocaïne
Dans une étude menée chez 9 volontaires sains, l'utilisation concomitante de 1,5 mg/kg de lidocaïne IV avec CIPRO 500 mg deux fois par jour a entraîné une augmentation de la Cmax et de l'ASC de la lidocaïne de 12 % et 26 %, respectivement. Bien que le traitement à la lidocaïne ait été bien toléré à cette exposition élevée, une interaction possible avec CIPRO et une augmentation des effets indésirables liés à la lidocaïne peuvent survenir lors d'une administration concomitante.
Métoclopramide
Le métoclopramide accélère considérablement l'absorption de cipro 750 mg de floxacine par voie orale, ce qui réduit le temps nécessaire pour atteindre les concentrations plasmatiques maximales. Aucun effet significatif n'a été observé sur la biodisponibilité de la ciprofloxacine.
Oméprazole
Lorsque CIPRO a été administré en une seule dose de 1000 mg en concomitance avec l'oméprazole (40 mg une fois par jour pendant trois jours) à 18 volontaires sains, l'ASC et la Cmax moyennes de la ciprofloxacine ont été réduites de 20 % et 23 %, respectivement. La signification clinique de cette interaction n'a pas été déterminée.
Microbiologie
Mécanisme d'action
L'action bactéricide de cipro 750 mgfloxacine résulte de l'inhibition des enzymes topoisomérase II (ADN gyrase) et topoisomérase IV (les deux topoisomérases de type II), qui sont nécessaires à la réplication, la transcription, la réparation et la recombinaison de l'ADN bactérien.
Mécanisme de résistance
Le mécanisme d'action des fluoroquinolones, dont la ciprofloxacine, est différent de celui des pénicillines, des céphalosporines, des aminoglycosides, des macrolides et des tétracyclines ; par conséquent, les micro-organismes résistants à ces classes de médicaments peuvent être sensibles à la ciprofloxacine. La résistance aux fluoroquinolones se produit principalement soit par des mutations dans les gyrases de l'ADN, soit par une diminution de la perméabilité de la membrane externe, soit par un efflux de médicament. La résistance in vitro à la ciprofloxacine se développe lentement par des mutations en plusieurs étapes. La résistance à la ciprofloxacine due à des mutations spontanées survient à une fréquence générale comprise entre
Résistance croisée
Il n'y a pas de résistance croisée connue entre cipro 1000mgfloxacin et d'autres classes d'antimicrobiens.
La ciprofloxacine s'est avérée active contre la plupart des isolats des bactéries suivantes, à la fois in vitro et dans les infections cliniques [voir INDICATIONS ET USAGE ].
Bactéries à Gram positif
Bacillus anthracis Enterococcus faecalis Staphylococcus aureus (isolats sensibles à la méthicilline uniquement) Staphylococcus epidermidis (isolats sensibles à la méthicilline uniquement) Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes
Bactéries Gram-négatives
Campylobacter jejuni Citrobacter koseri Citrobacter freundii Enterobacter cloacae Escherichia coli Haemophilus influenza Haemophilus parainfluenzae Klebsiella pneumonia Moraxella catarrhalis Morganella morganii Neisseria gonorrhoeae Proteus mirabilis Proteus vulgaris Providencia rettgeri Providencia stuartii Pseudomonas aeruginosa Salmonella typhi Serratia marcescens Shigella boydii Shigella dysenteriae Shigella flexneri Shigella sonnei Yersinia pestis
Les données in vitro suivantes sont disponibles, mais leur signification clinique est inconnue. Au moins 90 % des bactéries suivantes présentent une concentration minimale inhibitrice (CMI) in vitro inférieure ou égale au seuil de sensibilité pour cipro 750 mgfloxacine par rapport aux isolats d'un genre ou d'un groupe d'organismes similaires. Cependant, l'efficacité de cipro 500 mgfloxacine dans le traitement des infections cliniques causées par ces bactéries n'a pas été établie dans des essais cliniques adéquats et bien contrôlés.
Bactéries à Gram positif
Staphylococcus haemolyticus (isolats sensibles à la méthicilline uniquement) Staphylococcus hominis (isolats sensibles à la méthicilline uniquement)
Bactéries Gram-négatives
Acinetobacter lwoffi Aeromonas hydrophila Edwardsiella tarda Enterobacter aerogenes Klebsiella oxytoca Legionella pneumophila Pasteurella multocida Salmonella enteritidis Vibrio cholera Vibrio parahaemolyticus Vibrio vulnificus Yersinia enterocolitica
Test de sensibilité
Pour des informations spécifiques concernant les critères d'interprétation des tests de sensibilité et les méthodes de test associées et les normes de contrôle qualité reconnues par la FDA pour ce médicament, veuillez consulter : https://www.fda.gov/STIC.
Etudes cliniques
Infection urinaire compliquée et pyélonéphrite - Efficacité chez les patients pédiatriques
CIPRO administré par voie intraveineuse et/ou orale a été comparé à une céphalosporine pour le traitement des IUc et de la pyélonéphrite chez les patients pédiatriques âgés de 1 à 17 ans (âge moyen de 6 ± 4 ans). L'essai a été mené aux États-Unis, au Canada, en Argentine, au Pérou, au Costa Rica, au Mexique, en Afrique du Sud et en Allemagne. La durée du traitement était de 10 à 21 jours (la durée moyenne de traitement était de 11 jours avec un intervalle de 1 à 88 jours). L'objectif principal de l'étude était d'évaluer la sécurité musculo-squelettique et neurologique.
Les patients ont été évalués pour le succès clinique et l'éradication bactériologique du ou des organismes de base sans nouvelle infection ou surinfection 5 à 9 jours après le traitement (Test of Cure ou TOC). La population selon le protocole avait un ou plusieurs organismes responsables avec un ou des nombres de colonies spécifiés par le protocole au départ, aucune violation du protocole et aucune interruption prématurée ou perte de suivi (entre autres critères).
Les taux de réussite clinique et d'éradication bactériologique dans la population selon le protocole étaient similaires entre CIPRO 250 mg et le groupe de comparaison, comme indiqué ci-dessous.
Anthrax par inhalation chez les adultes et les enfants
Les concentrations sériques moyennes de ciprofloxacine associées à une amélioration statistiquement significative de la survie dans le modèle de singe rhésus de l'anthrax par inhalation sont atteintes ou dépassées chez les patients adultes et pédiatriques recevant des régimes oraux et intraveineux. La pharmacocinétique de Cipro 500 mgfloxacine a été évaluée dans diverses populations humaines. La concentration sérique maximale moyenne atteinte à l'état d'équilibre chez les adultes humains recevant 500 mg par voie orale toutes les 12 heures est de 2,97 mcg/mL et de 4,56 mcg/mL après 400 mg par voie intraveineuse toutes les 12 heures. La concentration sérique minimale moyenne à l'état d'équilibre pour ces deux régimes est de 0,2 mcg/mL. Dans une étude portant sur 10 patients pédiatriques âgés de 6 à 16 ans, la concentration plasmatique maximale moyenne atteinte est de 8,3 mcg/mL et les concentrations minimales varient de 0,09 mcg/mL à 0,26 mcg/mL, après deux perfusions intraveineuses de 30 minutes de 10 mg/kg administrés à 12 heures d'intervalle. Après la deuxième perfusion intraveineuse, les patients passés à 15 mg/kg par voie orale toutes les 12 heures atteignent une concentration maximale moyenne de 3,6 mcg/mL après la dose orale initiale. Les données sur l'innocuité à long terme, y compris les effets sur le cartilage, suite à l'administration de CIPRO à des patients pédiatriques sont limitées. Les concentrations sériques de Cipro 1000 mgfloxacine obtenues chez l'homme servent de paramètre de substitution raisonnablement susceptible de prédire le bénéfice clinique et de fournir la base de cette indication.1
Une étude animale contrôlée par placebo chez des singes rhésus exposés à une dose moyenne inhalée de 11 LD50 (~ 5,5 x 105 spores (gamme de 5 à 30 LD50) de B. anthracis a été menée. La concentration minimale inhibitrice (CMI) de cipro 250mgfloxacine pour la souche de charbon utilisée dans cette étude était de 0,08 mcg/mL. Chez les animaux étudiés, les concentrations sériques moyennes de cipro 1 000 mgfloxacine atteintes au Tmax attendu (1 heure après l'administration) après administration orale jusqu'à l'état d'équilibre variaient de 0,98 mcg/mL à 1,69 mcg/mL. Les concentrations minimales moyennes à l'état d'équilibre 12 heures après l'administration variaient de 0,12 mcg/mL à 0,19 mcg/mL.6 - l'exposition était significativement plus faible (1/9), par rapport au groupe placebo (9/10) [p = 0,001] Le seul animal traité par CIPRO qui est mort du charbon est mort après la période d'administration du médicament de 30 jours.7
Plus de 9300 personnes ont été recommandées pour compléter un minimum de 60 jours de prophylaxie antibactérienne contre une éventuelle exposition par inhalation à B. anthracis en 2001. CIPRO 250 mg a été recommandé à la plupart de ces personnes pour tout ou partie du schéma prophylactique. Certaines personnes ont également reçu le vaccin contre l'anthrax ou sont passées à d'autres médicaments antibactériens. Aucune des personnes ayant reçu CIPRO 1000 mg ou d'autres thérapies en tant que traitement prophylactique n'a développé par la suite de fièvre charbonneuse par inhalation. Le nombre de personnes ayant reçu CIPRO dans le cadre de tout ou partie de leur régime de prophylaxie post-exposition est inconnu.
Peste
Une étude animale contrôlée par placebo chez des singes verts africains exposés à une dose moyenne inhalée de 110 DL50 (gamme de 92 à 127 DL50) de Yersinia pestis (souche CO92) a été menée. La concentration minimale inhibitrice (CMI) de la ciprofloxacine pour la souche Y. pestis utilisée dans cette étude était de 0,015 mcg/mL. Les concentrations sériques maximales moyennes de ciprofloxacine atteintes à la fin d'une perfusion unique de 60 minutes étaient de 3,49 ± mcg/mL 0,55 mcg/mL, 3,91 mcg/mL ± 0,58 mcg/mL et 4,03 mcg/mL ± 1,22 mcg/mL le Jour 2, Jour 6 et Jour 10 de traitement chez des singes verts d'Afrique, respectivement Toutes les concentrations minimales (Jour 2, Jour 6 et Jour 10) étaient
Toxicologie animale et/ou pharmacologie
Il a été démontré que Cipro 250 mgfloxacine et d'autres quinolones provoquent une arthropathie chez les animaux immatures de la plupart des espèces testées [voir AVERTISSEMENTS ET PRECAUTIONS ]. Des dommages aux articulations portantes ont été observés chez les chiens et les rats juvéniles. Chez de jeunes beagles, 100 mg/kg de ciprofloxacine, administrés quotidiennement pendant 4 semaines, ont provoqué des modifications articulaires dégénératives de l'articulation du genou. À 30 mg/kg, l'effet sur l'articulation était minime. Dans une étude ultérieure menée chez de jeunes chiens beagles, des doses orales de cipro 750 mgfloxacine de 30 mg/kg et 90 mg/kg de cipro 750 mgfloxacine (environ 1,3 fois et 3,5 fois la dose pédiatrique sur la base des ASC plasmatiques comparatives) administrées quotidiennement pendant 2 semaines ont causé des troubles articulaires. changements qui étaient encore observés par histopathologie après une période sans traitement de 5 mois. À 10 mg/kg (environ 0,6 fois la dose pédiatrique basée sur les ASC plasmatiques comparatives), aucun effet sur les articulations n'a été observé. Cette dose n'a pas non plus été associée à une arthrotoxicité après une période supplémentaire sans traitement de 5 mois. Dans une autre étude, la suppression de la mise en charge de l'articulation a réduit les lésions mais ne les a pas totalement prévenues.
Une cristallurie, parfois associée à une néphropathie secondaire, survient chez des animaux de laboratoire recevant de la ciprofloxacine. Ceci est principalement lié à la solubilité réduite de la ciprofloxacine dans des conditions alcalines, qui prédominent dans l'urine des animaux de test ; chez l'homme, la cristallurie est rare car l'urine humaine est généralement acide. Chez les singes rhésus, une cristallurie sans néphropathie a été notée après des doses orales uniques aussi faibles que 5 mg/kg. (environ 0,07 fois la dose thérapeutique recommandée la plus élevée en fonction de la surface corporelle). Après 6 mois de dosage intraveineux à 10 mg/kg/jour, aucun changement néphropathologique n'a été noté ; cependant, une néphropathie a été observée après l'administration de 20 mg/kg/jour pendant la même durée (environ 0,2 fois la dose thérapeutique recommandée la plus élevée en fonction de la surface corporelle).
Chez le chien, la ciprofloxacine à 3 mg/kg et 10 mg/kg par injection intraveineuse rapide (15 sec.) produit des effets hypotenseurs prononcés. Ces effets sont considérés comme étant liés à la libération d'histamine, car ils sont partiellement antagonisés par la pyrilamine, un antihistaminique. Chez les singes rhésus, une injection intraveineuse rapide produit également une hypotension, mais l'effet chez cette espèce est incohérent et moins prononcé.
Chez la souris, il a été rapporté que l'administration concomitante d'anti-inflammatoires non stéroïdiens tels que la phénylbutazone et l'indométhacine avec des quinolones renforce l'effet stimulant des quinolones sur le SNC.
La toxicité oculaire observée avec certains médicaments apparentés n'a pas été observée chez les animaux traités à la ciprofloxacine
RÉFÉRENCES
1. 21 CFR 314.510 (Sous-partie H - Approbation accélérée de nouveaux médicaments pour les maladies potentiellement mortelles).
5. Rapport présenté lors de la réunion du comité consultatif sur les médicaments anti-infectieux et dermatologiques de la FDA, 31 mars 1993, Silver Spring, MD. Rapport disponible auprès de la FDA, CDER, Advisors and Consultants Staff, HFD-21, 1901 Chapman Avenue, Room 200, Rockville, MD 20852, USA.
6. Kelly DJ, et al. Concentrations sériques de pénicilline, de doxycycline et de ciprofloxacine pendant un traitement prolongé chez des singes rhésus. J Infect Dis 1992; 166:1184-7.
7. Friedlander AM, et al. Prophylaxie post-exposition contre le charbon expérimental par inhalation. J Infect Dis 1993; 167:1239-42.
8. Réunion du Comité consultatif sur les médicaments anti-infectieux, 3 avril 2012 - L'efficacité de la ciprofloxacine pour le traitement de la peste pulmonaire.
INFORMATIONS PATIENTS
CIPRO® (Sip-row) (chlorhydrate de ciprofloxacine) comprimés, à usage oral
CIPRO® (Sip-row) (cipro 1000mgfloxacine) pour suspension buvable
Lisez ce guide des médicaments avant de commencer à prendre CIPRO 500 mg et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre fournisseur de soins de santé au sujet de votre état de santé ou de votre traitement.
Quelle est l'information la plus importante que je devrais connaître sur CIPRO 500mg ?
CIPRO, un médicament antibactérien à base de fluoroquinolone, peut provoquer des effets secondaires graves. Certains de ces effets secondaires graves peuvent survenir en même temps et entraîner la mort.
Si vous ressentez l'un des effets indésirables graves suivants pendant que vous prenez CIPRO, vous devez arrêter immédiatement de prendre CIPRO 750 mg et consulter immédiatement un médecin.
1. Rupture du tendon ou gonflement du tendon (tendinite).
- Des problèmes de tendon peuvent survenir chez les personnes de tous âges qui prennent CIPRO. Les tendons sont des cordons de tissus résistants qui relient les muscles aux os. Les symptômes des problèmes de tendon peuvent inclure :
- la douleur
- gonflement
- déchirures et gonflement des tendons, y compris l'arrière de la cheville (Achille), l'épaule, la main, le pouce ou d'autres sites tendineux.
- Le risque d'avoir des problèmes de tendons pendant que vous prenez CIPRO est plus élevé si vous :
- ont plus de 60 ans
- prenez des stéroïdes (corticostéroïdes)
- avez subi une greffe de rein, de cœur ou de poumon.
- Des problèmes de tendon peuvent survenir chez les personnes qui ne présentent pas les facteurs de risque ci-dessus lorsqu'elles prennent CIPRO.
- D'autres raisons qui peuvent augmenter votre risque de problèmes de tendon peuvent inclure :
- activité physique ou exercice
- insuffisance rénale
- problèmes de tendon dans le passé, comme chez les personnes atteintes de polyarthrite rhumatoïde (PR).
- Arrêtez immédiatement de prendre CIPRO et consultez immédiatement un médecin dès les premiers signes de douleur, d'enflure ou d'inflammation du tendon. La zone la plus courante de douleur et d'enflure est le tendon d'Achille à l'arrière de la cheville. Cela peut également arriver avec d'autres tendons.
- Une rupture de tendon peut survenir pendant ou après avoir pris CIPRO. Les ruptures de tendon peuvent survenir dans les heures ou les jours suivant la prise de CIPRO et se sont produites jusqu'à plusieurs mois après que les personnes ont fini de prendre leur fluoroquinolone.
- Arrêtez immédiatement de prendre CIPRO 500 mg et consultez immédiatement un médecin si vous présentez l'un des signes ou symptômes suivants d'une rupture de tendon :
- entendre ou sentir un claquement ou un pop dans une zone tendineuse
- ecchymose juste après une blessure dans une zone tendineuse
- incapable de déplacer la zone touchée ou de supporter le poids
Les problèmes tendineux peuvent être permanents.
2. Modifications de la sensation et lésions nerveuses possibles (neuropathie périphérique). Des dommages aux nerfs des bras, des mains, des jambes ou des pieds peuvent survenir chez les personnes qui prennent des fluoroquinolones, y compris CIPRO. Arrêtez immédiatement de prendre CIPRO 750 mg et parlez-en immédiatement à votre fournisseur de soins de santé si vous présentez l'un des symptômes suivants de neuropathie périphérique dans les bras, les mains, les jambes ou les pieds :
- la douleur
- engourdissement
- brûlant
- la faiblesse
- picotements
Il peut être nécessaire d'arrêter CIPRO 500 mg pour éviter des lésions nerveuses permanentes.
3. Effets sur le système nerveux central (SNC). Des problèmes de santé mentale et des convulsions ont été signalés chez des personnes prenant des médicaments antibactériens à base de fluoroquinolone, y compris CIPRO. Informez votre fournisseur de soins de santé si vous avez des antécédents de convulsions avant de commencer à prendre CIPRO. Les effets secondaires sur le SNC peuvent survenir dès la prise de la première dose de CIPRO. Arrêtez immédiatement de prendre CIPRO et parlez-en immédiatement à votre fournisseur de soins de santé si vous ressentez l'un de ces effets secondaires ou d'autres changements d'humeur ou de comportement :
- convulsions
- troubles du sommeil
- entendre des voix, voir des choses ou ressentir des choses qui n'existent pas (hallucinations)
- cauchemars
- se sentir étourdi ou étourdi
- se sentir agité
- se sentir plus méfiant (paranoïa)
- tremblements
- pensées ou actes suicidaires
- se sentir anxieux ou nerveux
- maux de tête qui ne disparaissent pas, avec ou sans
- confusion vision floue
- la dépression
- problèmes de mémoire
- conscience réduite de l'environnement
- pensées ou croyances fausses ou étranges (délires)
Ces changements peuvent être permanents.
4. Aggravation de la myasthénie grave (un problème qui provoque une faiblesse musculaire). Les fluoroquinolones telles que CIPRO 500 mg peuvent aggraver les symptômes de la myasthénie grave, y compris la faiblesse musculaire et les problèmes respiratoires. Informez votre fournisseur de soins de santé si vous avez des antécédents de myasthénie grave avant de commencer à prendre CIPRO. Appelez immédiatement votre fournisseur de soins de santé si vous avez une aggravation de la faiblesse musculaire ou des problèmes respiratoires.
Qu'est-ce que CIPRO 750mg ?
CIPRO est un médicament antibactérien de type fluoroquinolone utilisé chez les adultes de 18 ans et plus pour traiter certaines infections causées par certains germes appelés bactéries. Ces infections bactériennes comprennent :
-
- infection urinaire
- infection des os et des articulations
- gonorrhée cervicale et urétrale, non compliquée
- infection chronique de la prostate
- pneumonie nosocomiale
- les personnes ayant un faible nombre de globules blancs et de la fièvre
- infection des voies respiratoires inférieures
- infection intra-abdominale compliquée
- anthrax par inhalation
- Infection des sinus
- diarrhée infectieuse
- la peste
- infection de la peau
- fièvre typhoïde (entérique)
- Les études sur l'utilisation de CIPRO 1000 mg dans le traitement de la peste et de la maladie du charbon n'ont été menées que sur des animaux, car la peste et la maladie du charbon ne pouvaient pas être étudiées chez l'homme.
- CIPRO 250 mg ne doit pas être utilisé chez les personnes présentant une exacerbation aiguë de la bronchite chronique, de la cystite aiguë non compliquée et des infections des sinus, s'il existe d'autres options de traitement disponibles.
- CIPRO 750 mg ne doit pas être utilisé comme médicament antibactérien de premier choix pour traiter les infections des voies respiratoires inférieures causées par un certain type de bactérie appelée Streptococcus pneumoniae.
- CIPRO 1000 mg est également utilisé chez les enfants de moins de 18 ans pour traiter les infections compliquées des voies urinaires et des reins ou qui peuvent avoir inhalé des germes de l'anthrax, avoir la peste ou avoir été exposés à des germes de la peste.
- Les enfants de moins de 18 ans courent un risque plus élevé d'avoir des problèmes osseux, articulaires ou tendineux (musculo-squelettiques) tels que douleur ou enflure pendant la prise de CIPRO. CIPRO 500 mg ne doit pas être utilisé comme médicament antibactérien de premier choix chez les enfants de moins de 18 ans.
Qui ne devrait pas prendre CIPRO 1000mg ?
Ne prenez pas CIPRO 500 mg si vous :
- avez déjà eu une réaction allergique grave à un médicament antibactérien connu sous le nom de fluoroquinolone, ou êtes allergique au chlorhydrate de cipro 500mgfloxacine ou à l'un des ingrédients de CIPRO. Voir la fin de ce Guide de Médication pour une liste complète d'ingrédients dans CIPRO.
- prenez également un médicament appelé tizanidine (Zanaflex®). Demandez à votre fournisseur de soins de santé si vous n'êtes pas sûr.
Que dois-je dire à mon fournisseur de soins de santé avant de prendre CIPRO ?
Avant de prendre CIPRO, informez votre fournisseur de soins de santé de toutes vos conditions médicales, y compris si vous :
- avoir des problèmes de tendons. CIPRO ne doit pas être utilisé chez les personnes ayant des antécédents de problèmes tendineux.
- avez une maladie qui provoque une faiblesse musculaire (myasthénie grave). CIPRO ne doit pas être utilisé chez les personnes ayant des antécédents connus de myasthénie grave.
- avoir des problèmes de foie.
- avez des problèmes du système nerveux central (comme l'épilepsie).
- avoir des problèmes nerveux. CIPRO 500 mg ne doit pas être utilisé chez les personnes qui ont des antécédents d'un problème nerveux appelé neuropathie périphérique ou si un membre de votre famille a un rythme cardiaque irrégulier ou une crise cardiaque, en particulier une affection appelée «allongement de l'intervalle QT».
- avez un faible taux sanguin de potassium (hypokaliémie) ou un faible taux de magnésium (hypomagnésémie).
- avez ou avez eu des convulsions.
- avoir des problèmes rénaux. Vous pourriez avoir besoin d'une dose plus faible de CIPRO 500 mg si vos reins ne fonctionnent pas bien.
- souffrez de diabète ou de problèmes d'hypoglycémie (hypoglycémie).
- avez des problèmes articulaires, y compris la polyarthrite rhumatoïde (PR).
- avoir du mal à avaler des pilules.
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si CIPRO 250 mg nuira à votre bébé à naître.
- allaitez ou envisagez d'allaiter. CIPRO 250mg passe dans votre lait maternel.
- Vous ne devez pas allaiter pendant le traitement par CIPRO 500 mg et pendant 2 jours après avoir pris votre dernière dose de CIPRO. Vous pouvez tirer votre lait maternel et le jeter pendant le traitement par CIPRO et pendant 2 jours après avoir pris votre dernière dose de CIPRO.
- Si vous prenez CIPRO pour le charbon par inhalation, vous et votre professionnel de la santé devez décider si vous pouvez continuer à allaiter pendant que vous prenez CIPRO.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
- CIPRO 1000 mg et d'autres médicaments peuvent s'influencer mutuellement et provoquer des effets secondaires.
- Informez particulièrement votre fournisseur de soins de santé si vous prenez :
- un médicament stéroïdien.
- un médicament anti-psychotique.
- un antidépresseur tricyclique.
- une pilule d'eau (diurétique).
- théophylline (comme Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- un médicament pour contrôler votre fréquence cardiaque ou votre rythme (antiarythmiques).
- un médicament antidiabétique oral.
- phénytoïne (Fosphenytoin Sodium®, Cerebyx®, Dilantin-125®, Dilantin®, Extended Phenytoin Sodium®, Prompt Phenytoin Sodium®, Phenytek®).
- cyclosporine (Gengraf®, Neoral®, Sandimmune®, Sangcya®).
- un anticoagulant (comme la warfarine, Coumadin®, Jantoven®).
- méthotrexate (Trexall®).
- ropinirole (Requip®).
- clozapine (Clozaril®, Fazaclo® ODT®).
- un anti-inflammatoire non stéroïdien (AINS). De nombreux médicaments courants pour soulager la douleur sont des AINS. La prise d'un AINS pendant que vous prenez CIPRO 500 mg ou d'autres fluoroquinolones peut augmenter votre risque d'effets sur le système nerveux central et de convulsions.
- sildénafil (Viagra®, Revatio®).
- duloxétine.
- produits contenant de la caféine.
- le probénécide (Probalan®, Col-probenecid®).
- Certains médicaments peuvent empêcher les comprimés CIPRO et la suspension orale CIPRO de fonctionner correctement. Prenez les comprimés et la suspension orale CIPRO 2 heures avant ou 6 heures après la prise de ces médicaments, vitamines ou suppléments :
- un antiacide, une multivitamine ou un autre médicament ou supplément contenant du magnésium, du calcium, de l'aluminium, du fer ou du zinc.
- sucralfate (Carafate®).
- didanosine (Videx®, Videx EC®).
Demandez à votre fournisseur de soins de santé une liste de ces médicaments si vous n'êtes pas sûr.
Connaissez les médicaments que vous prenez. Conservez-en une liste pour la montrer à votre fournisseur de soins de santé et à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je prendre CIPRO 500mg ?
- Prenez CIPRO exactement comme votre professionnel de la santé vous a dit de le prendre.
- Votre fournisseur de soins de santé vous dira combien de CIPRO prendre et quand le prendre.
- CIPRO peut être pris avec ou sans nourriture.
- CIPRO ne doit pas être pris seul avec des produits laitiers (comme du lait ou du yogourt) ou des jus enrichis en calcium, mais peut être pris avec un repas contenant ces produits.
- Buvez beaucoup de liquides pendant que vous prenez CIPRO.
- Ne sautez aucune dose de CIPRO ou n'arrêtez pas de le prendre, même si vous commencez à vous sentir mieux, jusqu'à ce que vous ayez terminé votre traitement prescrit, sauf si :
- vous avez des problèmes de tendons. Voir « Quelle est l'information la plus importante que je devrais connaître sur CIPRO ? »
- vous avez des problèmes nerveux. Voir « Quelle est l'information la plus importante que je devrais connaître sur CIPRO ? »
- vous avez des problèmes du système nerveux central. Voir "Quelle est l'information la plus importante que je devrais connaître sur CIPRO 1000mg?"
- vous avez une réaction allergique grave. Voir « Quels sont les effets secondaires possibles de CIPRO 750 mg ? »
- votre fournisseur de soins de santé vous dit d'arrêter de prendre CIPRO.
Prendre toutes vos doses de CIPRO vous aidera à vous assurer que toutes les bactéries sont tuées. Prendre toutes vos doses de CIPRO aidera à réduire le risque que les bactéries deviennent résistantes à CIPRO. Si vous devenez résistant à CIPRO, CIPRO 1000 mg et d'autres médicaments antibactériens peuvent ne plus fonctionner pour vous à l'avenir.
-
Si vous avez pris trop de CIPRO 750 mg, appelez votre fournisseur de soins de santé ou consultez immédiatement un médecin.
-
CIPRO est fourni sous forme de comprimé sécable (CIPRO 1000 mg comprimés), de suspension buvable (CIPRO 750 mg suspension orale), de comprimé à libération prolongée (CIPRO XR) et d'injection pour perfusion intraveineuse (CIPRO IV). Lisez et suivez les instructions ci-dessous pour le type de CIPRO 500 mg que votre professionnel de la santé vous a prescrit.
Comprimés CIPRO :
- Les comprimés CIPRO se présentent sous forme de comprimés sécables de 250 mg et 500 mg qui peuvent être pris entiers ou peuvent être divisés en deux au niveau de la ligne sécable. Votre fournisseur de soins de santé vous indiquera la quantité de comprimés CIPRO 500 mg à prendre et si vous devrez diviser les comprimés CIPRO 1000 mg en deux pour obtenir la dose prescrite.
- Prenez les comprimés CIPRO le matin et le soir à peu près à la même heure chaque jour. Ne pas écraser ou mâcher le comprimé. Dites à votre fournisseur de soins de santé si vous ne pouvez pas avaler le comprimé.
- Si vous oubliez une dose de comprimés CIPRO 500 mg et que c'est :
- 6 heures ou plus jusqu'à votre prochaine dose prévue, prenez immédiatement la dose oubliée. Prenez ensuite la dose suivante à l'heure habituelle.
- moins de 6 heures jusqu'à votre prochaine dose prévue, ne prenez pas la dose oubliée. Prenez la dose suivante à l'heure habituelle.
- Ne prenez pas 2 doses de comprimés CIPRO 750 mg à la fois pour compenser une dose oubliée. Si vous ne savez pas quand prendre les comprimés CIPRO 500 mg après une dose oubliée, demandez conseil à votre professionnel de la santé ou à votre pharmacien.
Suspension orale CIPRO :
- Prenez la suspension orale CIPRO 1000 mg le matin et le soir à peu près à la même heure chaque jour. Bien agiter le flacon de suspension orale CIPRO 750 mg à chaque fois avant utilisation pendant environ 15 secondes pour s'assurer que la suspension est bien mélangée. Bien refermer le flacon après utilisation.
- Si vous oubliez une dose de suspension orale CIPRO et que celle-ci est :
- 6 heures ou plus jusqu'à votre prochaine dose prévue, prenez immédiatement la dose oubliée. Prenez ensuite la dose suivante à l'heure habituelle.
- moins de 6 heures jusqu'à votre prochaine dose prévue, ne prenez pas la dose oubliée. Prenez la dose suivante à l'heure habituelle.
- Ne prenez pas 2 doses de suspension orale CIPRO 750 mg à la fois pour compenser une dose oubliée. Si vous ne savez pas quand prendre la suspension orale CIPRO après une dose oubliée, demandez à votre fournisseur de soins de santé ou à votre pharmacien.
Que dois-je éviter pendant que je prends CIPRO ?
- CIPRO 250 mg peut vous donner des vertiges et des étourdissements. Ne conduisez pas, n'utilisez pas de machines ou ne faites pas d'autres activités qui nécessitent de la vigilance mentale ou de la coordination jusqu'à ce que vous sachiez comment CIPRO 250 mg vous affecte.
- Évitez les lampes solaires, les lits de bronzage et essayez de limiter votre temps au soleil. CIPRO 500 mg peut rendre votre peau sensible au soleil (photosensibilité) et à la lumière des lampes solaires et des lits de bronzage. Vous pourriez avoir un coup de soleil grave, des cloques ou un gonflement de la peau. Si vous ressentez l'un de ces symptômes pendant que vous prenez CIPRO 250 mg, appelez immédiatement votre fournisseur de soins de santé. Vous devez utiliser un écran solaire et porter un chapeau et des vêtements qui couvrent votre peau si vous devez vous exposer au soleil.
Quels sont les effets secondaires possibles de CIPRO ?
CIPRO peut provoquer des effets secondaires graves, notamment :
- Voir « Quelle est l'information la plus importante que je devrais connaître sur CIPRO ? »
- Réactions allergiques graves. Des réactions allergiques graves, y compris la mort, peuvent survenir chez les personnes prenant des fluoroquinolones, y compris CIPRO, même après une seule dose. Arrêtez de prendre CIPRO et obtenez immédiatement une aide médicale d'urgence si vous présentez l'un des symptômes suivants d'une réaction allergique grave :
- urticaire
- rythme cardiaque rapide
- difficulté à respirer ou à avaler
- perdre connaissance
- gonflement des lèvres, de la langue, du visage
- démangeaison de la peau
- serrement de gorge, enrouement
Une éruption cutanée peut survenir chez les personnes prenant CIPRO 1000 mg même après seulement 1 dose. Arrêtez de prendre CIPRO 500 mg au premier signe d'éruption cutanée et appelez votre fournisseur de soins de santé. Une éruption cutanée peut être le signe d'une réaction plus grave à CIPRO.
- Dommages au foie (hépatotoxicité). L'hépatotoxicité peut survenir chez les personnes qui prennent CIPRO. Appelez immédiatement votre fournisseur de soins de santé si vous présentez des symptômes inexpliqués tels que :
- nausées ou vomissements
- fatigue inhabituelle
- Douleur d'estomac
- perte d'appétit
- fièvre
- selles de couleur claire
- la faiblesse
- urine de couleur foncée
- douleur ou sensibilité abdominale
- jaunissement de la peau et du blanc des yeux
- démangeaison
Arrêtez de prendre CIPRO 750 mg et informez immédiatement votre fournisseur de soins de santé si vous avez un jaunissement de la peau ou de la partie blanche de vos yeux, ou si vous avez des urines foncées. Ceux-ci peuvent être des signes d'une réaction grave à CIPRO (un problème de foie).
- Anévrisme aortique et dissection. Dites à votre fournisseur de soins de santé si on vous a déjà dit que vous aviez un anévrisme de l'aorte, un gonflement de la grosse artère qui transporte le sang du cœur vers le corps. Obtenez immédiatement une aide médicale d'urgence si vous ressentez une douleur soudaine à la poitrine, à l'estomac ou au dos.
- Infection intestinale (Clostridioides difficile - diarrhée associée). La diarrhée associée à Clostridioides difficile (DACD) peut survenir avec de nombreux médicaments antibactériens, y compris CIPRO. Appelez immédiatement votre fournisseur de soins de santé si vous avez une diarrhée aqueuse, une diarrhée qui ne disparaît pas ou des selles sanglantes. Vous pouvez avoir des crampes d'estomac et de la fièvre. La CDAD peut survenir 2 mois ou plus après la fin de votre traitement antibactérien.
- Modifications graves du rythme cardiaque (allongement de l'intervalle QT et torsade de pointes). Informez immédiatement votre fournisseur de soins de santé si vous avez un changement dans votre rythme cardiaque (un rythme cardiaque rapide ou irrégulier) ou si vous vous évanouissez. CIPRO peut causer un problème cardiaque rare appelé allongement de l'intervalle QT. Cette condition peut provoquer un rythme cardiaque anormal et peut être très dangereuse. Les chances de cet événement sont plus élevées chez les personnes :
- qui sont âgés.
- ayant des antécédents familiaux d'intervalle QT prolongé.
- avec un faible taux sanguin de potassium (hypokaliémie) ou un faible taux de magnésium (hypomagnésémie).
- qui prennent certains médicaments pour contrôler le rythme cardiaque (antiarythmiques).
- Problèmes articulaires. Un risque accru de problèmes d'articulations et de tissus autour des articulations chez les enfants de moins de 18 ans peut survenir. Informez le fournisseur de soins de santé de votre enfant si votre enfant a des problèmes articulaires pendant ou après le traitement par CIPRO.
- Sensibilité au soleil (photosensibilité). Voir « Que dois-je éviter en prenant CIPRO 250 mg ? »
- Modifications de la glycémie. Les personnes qui prennent CIPRO et d'autres médicaments à base de fluoroquinolone avec des médicaments antidiabétiques oraux ou avec de l'insuline peuvent présenter une hypoglycémie (hypoglycémie) et une glycémie élevée (hyperglycémie). Suivez les instructions de votre fournisseur de soins de santé pour savoir à quelle fréquence vérifier votre glycémie. Si vous souffrez de diabète et que votre taux de sucre dans le sang est bas pendant que vous prenez CIPRO, arrêtez de prendre CIPRO et appelez immédiatement votre fournisseur de soins de santé. Votre médicament antibiotique devra peut-être être changé.
Les effets secondaires les plus courants de CIPRO 750 mg incluent :
- nausée
- diarrhée
- changements dans les tests de la fonction hépatique
- vomissement
- éruption
Informez votre fournisseur de soins de santé de tout effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de CIPRO. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver CIPRO ?
CIPRO 500mg Comprimés
- Conserver à température ambiante entre 68 °F et 77 °F (20 °C à 25 °C).
CIPRO 750mg Suspension orale
- Conserver les microcapsules et le diluant à température ambiante jusqu'à 77 °F (25 °C).
- Ne pas congeler.
- Une fois votre traitement CIPRO terminé, jetez en toute sécurité toute suspension buvable inutilisée.
Gardez CIPRO 250 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de CIPRO.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. N'utilisez pas CIPRO pour une condition pour laquelle il n'est pas prescrit. Ne donnez pas CIPRO à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Ce Guide de Médication résume les informations les plus importantes sur CIPRO. Si vous souhaitez plus d'informations sur CIPRO, parlez-en à votre fournisseur de soins de santé. Vous pouvez demander à votre professionnel de la santé ou à votre pharmacien des informations sur CIPRO 250 mg destinées aux professionnels de la santé.
Quels sont les ingrédients de CIPRO 500mg ?
Comprimés CIPRO 1000 mg :
- Ingrédient actif: cipro 250 mg de chlorhydrate de floxacine
- Ingrédients inactifs: amidon de maïs, crospovidone, hypromellose, stéarate de magnésium, cellulose microcristalline, polyéthylèneglycol, dioxyde de silicium et dioxyde de titane.
Suspension orale CIPRO :
- Ingrédient actif: ciprofloxacine
- Ingrédients inactifs:
- Les microcapsules contiennent : hypromellose, stéarate de magnésium, copolymère d'acide méthacrylique, polysorbate 20 et povidone.
- Le diluant contient : triglycérides à chaîne moyenne, saccharose, lécithine de soja, eau et arôme de fraise.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
