Cleocin 150mg, 300mg Clindamycin Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Que sont les gélules de chlorhydrate de Cleocin 300 mg ?
Les gélules de chlorhydrate de Cleocin contiennent un antibiotique indiqué dans le traitement des infections graves causées par des bactéries anaérobies sensibles. Cleocin 150mg Hydrochloride est également indiqué dans le traitement des infections graves dues à des souches sensibles de streptocoques, pneumocoques et staphylocoques. Son utilisation doit être réservée aux patients allergiques à la pénicilline ou à d'autres patients pour lesquels, de l'avis du médecin, une pénicilline est inappropriée. Cleocin Hydrochloride est disponible sous forme générique.
Quels sont les effets secondaires des gélules de chlorhydrate de Cleocin 300mg ?
Les effets secondaires courants de Cleocin Hydrochloride comprennent:
- Colite à Clostridium difficile,
- douleur abdominale,
- colite pseudomembraneuse,
- oesophagite,
- nausée,
- vomissement,
- diarrhée,
- démangeaison de la peau,
- urticaire,
- réactions allergiques sévères (anaphylaxie),
- réactions d'hypersensibilité,
- démangeaison,
- pertes vaginales et inconfort,
- gonflement de la peau,
- jaunissement de la peau et des yeux (jaunisse),
- tests anormaux de la fonction hépatique, et
- douleur articulaire.
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l'efficacité de CLEOCIN 300 mg HCl et d'autres médicaments antibactériens, CLEOCIN 300 mg HCl doit être utilisé uniquement pour traiter ou prévenir les infections dont l'origine bactérienne est avérée ou fortement suspectée.
ATTENTION
Des diarrhées associées à Clostridium difficile (DACD) ont été signalées avec l'utilisation de presque tous les agents antibactériens, y compris CLEOCIN HCl, et leur gravité peut varier d'une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens modifie la flore normale du côlon, entraînant une prolifération de C. difficile.
Étant donné que le traitement par CLEOCIN 150 mg HCl a été associé à des colites sévères pouvant entraîner la mort, il doit être réservé aux infections graves où des agents antimicrobiens moins toxiques sont inappropriés, comme décrit dans le INDICATIONS ET USAGE section. Il ne doit pas être utilisé chez les patients atteints d'infections non bactériennes telles que la plupart des infections des voies respiratoires supérieures.
C. difficile produit les toxines A et B, qui contribuent au développement de CDAD. Les souches de C. difficile productrices d'hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et peuvent nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée suite à l'utilisation d'antibiotiques. Des antécédents médicaux minutieux sont nécessaires car il a été rapporté que la DACD survient plus de deux mois après l'administration d'agents antibactériens.
Si la DACD est suspectée ou confirmée, l'utilisation continue d'antibiotiques non dirigés contre C. difficile peut devoir être interrompue. Une gestion appropriée des fluides et des électrolytes, une supplémentation en protéines, un traitement antibiotique de C. difficile et une évaluation chirurgicale doivent être institués selon les indications cliniques.
LA DESCRIPTION
Le chlorhydrate de clindamycine est le sel chlorhydrate hydraté de la clindamycine. La clindamycine est un antibiotique semi-synthétique produit par une substitution 7(S)-chloro du groupe 7(R)-hydroxyle du composé parent lincomycine.
Les capsules CLEOCIN HCl contiennent du chlorhydrate de clindamycine équivalent à 75 mg, 150 mg ou 300 mg de clindamycine.
Ingrédients inactifs : 75 mg - amidon de maïs, FD&C bleu no. 1, FD&C jaune no. 5, gélatine, lactose, stéarate de magnésium et talc ; 150 mg - amidon de maïs, FD&C bleu no. 1, FD&C jaune no. 5, gélatine, lactose, stéarate de magnésium, talc et dioxyde de titane ; 300 mg - amidon de maïs, FD&C bleu no. 1, gélatine, lactose, stéarate de magnésium, talc et dioxyde de titane.
La formule structurale est représentée ci-dessous :
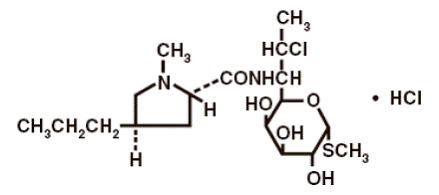
Le nom chimique du chlorhydrate de clindamycine est Methyl 7-chloro-6,7,8-trideoxy-6-(1-methyl-trans-4-propyl-L-2-pyrrolidinecarboxamido)-1-thio-L-threo-α- Monochlorhydrate de D-galacto-octopyranoside.
LES INDICATIONS
La clindamycine est indiquée dans le traitement des infections graves causées par des bactéries anaérobies sensibles.
La clindamycine est également indiquée dans le traitement des infections graves dues à des souches sensibles de streptocoques, de pneumocoques et de staphylocoques. Son utilisation doit être réservée aux patients allergiques à la pénicilline ou à d'autres patients pour lesquels, de l'avis du médecin, une pénicilline est inappropriée. En raison du risque de colite, tel que décrit dans l'AVERTISSEMENT ENCADRÉ, avant de choisir la clindamycine, le médecin doit tenir compte de la nature de l'infection et de la pertinence d'alternatives moins toxiques (par exemple, l'érythromycine).
Anaérobies : Infections graves des voies respiratoires telles que l'empyème, la pneumonie anaérobie et l'abcès pulmonaire ; infections graves de la peau et des tissus mous; septicémie; des infections intra-abdominales telles qu'une péritonite et un abcès intra-abdominal (résultant typiquement d'organismes anaérobies résidant dans le tractus gastro-intestinal normal); infections du bassin et des voies génitales féminines telles que l'endométrite, l'abcès tubo-ovarien non gonococcique, la cellulite pelvienne et l'infection de la coiffe vaginale post-chirurgicale.
Streptocoques : Infections graves des voies respiratoires ; infections graves de la peau et des tissus mous.
Staphylocoques : Infections graves des voies respiratoires ; infections graves de la peau et des tissus mous.
Pneumocoques : Infections graves des voies respiratoires.
Des études bactériologiques doivent être réalisées pour déterminer les organismes responsables et leur sensibilité à la clindamycine.
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l'efficacité de CLEOCIN HCl et d'autres médicaments antibactériens, CLEOCIN HCl doit être utilisé uniquement pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu'elles sont causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte lors de la sélection ou de la modification du traitement antibactérien. En l'absence de telles données, l'épidémiologie locale et les schémas de sensibilité peuvent contribuer à la sélection empirique du traitement.
DOSAGE ET ADMINISTRATION
Si une diarrhée importante survient pendant le traitement, cet antibiotique doit être arrêté (voir AVERTISSEMENT ENCADRÉ ).
Adultes
Infections graves - 150 à 300 mg toutes les 6 heures. Infections plus graves - 300 à 450 mg toutes les 6 heures.
Patients pédiatriques (pour les enfants capables d'avaler des gélules) :
Infections graves 8 à 16 mg/kg/jour (4 à 8 mg/lb/jour) répartis en trois ou quatre prises égales. Infections plus graves - 16 à 20 mg/kg/jour (8 à 10 mg/lb/jour) divisés en trois ou quatre doses égales.
Pour éviter la possibilité d'irritation de l'œsophage, les gélules CLEOCIN 300mg HCl doivent être prises avec un grand verre d'eau.
Les gélules CLEOCIN HCl ne conviennent pas aux enfants qui ne peuvent pas les avaler en entier. Les gélules ne fournissent pas de doses exactes en mg/kg, il peut donc être nécessaire d'utiliser la solution buvable de palmitate de clindamycine dans certains cas.
Les infections graves dues aux bactéries anaérobies sont généralement traitées avec la Solution Stérile CLEOCIN PHOSPHATE®. Cependant, dans des circonstances cliniquement appropriées, le médecin peut choisir d'initier ou de poursuivre le traitement avec CLEOCIN 150mg HCl Capsules.
En cas d'infections à streptocoques β-hémolytiques, le traitement doit être poursuivi pendant au moins 10 jours.
COMMENT FOURNIE
CLÉOCIN HCl Capsules sont disponibles dans les forces, couleurs et tailles suivantes :
75mg Bouteilles vertes de 100 CDN 0009-0331-02
150mg Flacons bleu clair et vert de 100 CDN 0009-0225-02
300mg Bleu clair Flacons de 100 CDN 0009-0395-14
Conserver à température ambiante contrôlée 20° à 25° C (68° à 77° F) [voir USP ].
Distribué par : Pharmacia & Upjohn Co, Division of Pfizer Inc, NY, NY 10017. Révisé en 2017
EFFETS SECONDAIRES
Les réactions suivantes ont été rapportées avec l'utilisation de la clindamycine.
Infections et infestations : Colite à Clostridium difficile
Gastro-intestinal : Douleurs abdominales, colite pseudomembraneuse, œsophagite, nausées, vomissements et diarrhée (voir AVERTISSEMENT ENCADRÉ ). L'apparition de symptômes de colite pseudomembraneuse peut survenir pendant ou après un traitement antibactérien (voir AVERTISSEMENTS ). Un ulcère de l'œsophage a été rapporté. Un goût désagréable ou métallique a été rapporté après administration orale.
Réactions d'hypersensibilité : Les éruptions cutanées généralisées légères à modérées de type morbilliforme (maculopapuleuses) sont les effets indésirables les plus fréquemment rapportés. Des éruptions vésiculobulleuses, ainsi que de l'urticaire, ont été observées au cours d'un traitement médicamenteux. Des réactions cutanées graves telles que la nécrolyse épidermique toxique, dont certaines avec une issue fatale, ont été signalées (voir AVERTISSEMENTS ). Des cas de pustulose exanthématique aiguë généralisée (PEAG), d'érythème polymorphe, certains ressemblant au syndrome de Stevens-Johnson, de choc anaphylactique, de réaction anaphylactique et d'hypersensibilité ont également été signalés.
Peau et Muqueuses : Prurit, vaginite, œdème de Quincke et de rares cas de dermatite exfoliative ont été rapportés. (Voir Réactions d'hypersensibilité .)
Foie: Un ictère et des anomalies des tests de la fonction hépatique ont été observés au cours du traitement par la clindamycine.
Rénal: Bien qu'aucune relation directe entre la clindamycine et les lésions rénales n'ait été établie, un dysfonctionnement rénal tel qu'il est mis en évidence par une azotémie, une oligurie et/ou une protéinurie a été observé.
Hématopoïétique : Une neutropénie transitoire (leucopénie) et une éosinophilie ont été rapportées. Des cas d'agranulocytose et de thrombocytopénie ont été signalés. Aucune relation étiologique directe avec un traitement concomitant à la clindamycine n'a pu être établie dans aucun des cas précédents.
Système immunitaire: Des cas de réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) ont été rapportés.
Musculo-squelettique : Des cas de polyarthrite ont été rapportés.
INTERACTIONS MÉDICAMENTEUSES
Il a été démontré que la clindamycine possède des propriétés de blocage neuromusculaire qui peuvent renforcer l'action d'autres agents de blocage neuromusculaire. Par conséquent, il doit être utilisé avec prudence chez les patients recevant de tels agents.
La clindamycine est métabolisée principalement par le CYP3A4 et, dans une moindre mesure, par le CYP3A5, en métabolite principal, le sulfoxyde de clindamycine et en métabolite mineur, la N-desméthylclindamycine. Par conséquent, les inhibiteurs du CYP3A4 et du CYP3A5 peuvent augmenter les concentrations plasmatiques de clindamycine et les inducteurs de ces isoenzymes peuvent réduire les concentrations plasmatiques de clindamycine. En présence d'inhibiteurs puissants du CYP3A4, surveiller les effets indésirables. En présence d'inducteurs puissants du CYP3A4 tels que la rifampicine, surveiller la perte d'efficacité.
Des études in vitro indiquent que la clindamycine n'inhibe pas le CYP1A2, le CYP2C9, le CYP2C19, le CYP2E1 ou le CYP2D6 et n'inhibe que modérément le CYP3A4.
Un antagonisme a été démontré entre la clindamycine et l'érythromycine in vitro. En raison d'une signification clinique possible, ces deux médicaments ne doivent pas être administrés simultanément.
AVERTISSEMENTS
Voir AVERTISSEMENT ENCADRÉ
Diarrhée associée à Clostridium difficile
Des diarrhées associées à Clostridium difficile (DACD) ont été signalées avec l'utilisation de presque tous les agents antibactériens, y compris CLEOCIN 300 mg HCl, et leur gravité peut varier d'une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens modifie la flore normale du côlon, entraînant une prolifération de C. difficile.
C. difficile produit les toxines A et B, qui contribuent au développement de CDAD. Les souches de C. difficile productrices d'hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et peuvent nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée suite à l'utilisation d'antibiotiques. Des antécédents médicaux minutieux sont nécessaires car il a été rapporté que la DACD survient plus de deux mois après l'administration d'agents antibactériens.
Si la DACD est suspectée ou confirmée, l'utilisation continue d'antibiotiques non dirigés contre C. difficile peut devoir être interrompue. Une gestion appropriée des fluides et des électrolytes, une supplémentation en protéines, un traitement antibiotique de C. difficile et une évaluation chirurgicale doivent être institués selon les indications cliniques.
Réactions anaphylactiques et d'hypersensibilité sévère
Des chocs anaphylactiques et des réactions anaphylactiques ont été rapportés (voir EFFETS INDÉSIRABLES ).
Des réactions d'hypersensibilité sévères, y compris des réactions cutanées sévères telles qu'une nécrolyse épidermique toxique (NET), une réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) et le syndrome de Stevens-Johnson (SJS), dont certaines avec une issue fatale, ont été rapportées (voir EFFETS INDÉSIRABLES ).
En cas de réaction anaphylactique ou d'hypersensibilité sévère, interrompre définitivement le traitement et instaurer un traitement approprié.
Une enquête approfondie doit être faite concernant les sensibilités antérieures aux médicaments et autres allergènes.
Utilisation dans la méningite
Étant donné que la clindamycine ne diffuse pas adéquatement dans le liquide céphalo-rachidien, le médicament ne doit pas être utilisé dans le traitement de la méningite.
PRÉCAUTIONS
Général
L'examen de l'expérience à ce jour suggère qu'un sous-groupe de patients âgés atteints d'une maladie grave associée peut moins bien tolérer la diarrhée. Lorsque la clindamycine est indiquée chez ces patients, ils doivent faire l'objet d'une surveillance attentive afin de détecter toute modification de la fréquence intestinale.
CLEOCIN 300 mg HCl doit être prescrit avec prudence chez les personnes ayant des antécédents de maladie gastro-intestinale, en particulier de colite.
CLEOCIN 300mg HCl doit être prescrit avec prudence chez les personnes atopiques.
Les interventions chirurgicales indiquées doivent être réalisées en association avec une antibiothérapie.
L'utilisation de CLEOCIN 150mg HCl entraîne parfois une prolifération d'organismes non sensibles, en particulier des levures. En cas de surinfections, des mesures appropriées doivent être prises en fonction de la situation clinique.
Une modification de la posologie de la clindamycine peut ne pas être nécessaire chez les patients atteints de maladie rénale. Chez les patients atteints d'une maladie hépatique modérée à sévère, une prolongation de la demi-vie de la clindamycine a été observée. Cependant, il a été postulé à partir d'études que lorsqu'il est administré toutes les huit heures, une accumulation devrait rarement se produire. Par conséquent, une modification de la posologie chez les patients atteints d'une maladie du foie peut ne pas être nécessaire. Cependant, des déterminations périodiques des enzymes hépatiques doivent être effectuées lors du traitement de patients atteints d'une maladie hépatique grave.
Les gélules de 75 mg et 150 mg contiennent du jaune FD&C no. 5 (tartrazine), qui peut provoquer des réactions de type allergique (dont asthme bronchique) chez certaines personnes sensibles. Bien que l'incidence globale de FD&C jaune non. 5 (tartrazine) dans la population générale est faible, elle est fréquemment observée chez les patients présentant également une hypersensibilité à l'aspirine.
La prescription de CLEOCIN 150mg HCl en l'absence d'infection bactérienne avérée ou fortement suspectée ou d'indication prophylactique est peu susceptible d'apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes aux médicaments.
Tests de laboratoire
Pendant un traitement prolongé, des tests périodiques de la fonction hépatique et rénale et des numérations globulaires doivent être effectués.
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune étude à long terme chez l'animal n'a été réalisée avec la clindamycine pour évaluer le potentiel carcinogène. Les tests de génotoxicité réalisés comprenaient un test du micronoyau chez le rat et un test de réversion Ames Salmonella. Les deux tests étaient négatifs.
Des études de fertilité chez des rats traités par voie orale avec jusqu'à 300 mg/kg/jour (environ 1,6 fois la dose humaine adulte recommandée la plus élevée en mg/m²) n'ont révélé aucun effet sur la fertilité ou la capacité d'accouplement.
Grossesse
Effets tératogènes
Lors d'essais cliniques menés auprès de femmes enceintes, l'administration systémique de clindamycine au cours des deuxième et troisième trimestres n'a pas été associée à une fréquence accrue d'anomalies congénitales.
La clindamycine ne doit être utilisée au cours du premier trimestre de la grossesse qu'en cas de nécessité absolue. Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes au cours du premier trimestre de la grossesse. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Études de reproduction réalisées chez des rats et des souris utilisant des doses orales de clindamycine jusqu'à 600 mg/kg/jour (3,2 et 1,6 fois la dose humaine adulte recommandée la plus élevée en mg/m², respectivement) ou des doses sous-cutanées de clindamycine jusqu'à 250 mg/kg /jour (1,3 et 0,7 fois la dose la plus élevée recommandée chez l'homme adulte en mg/m², respectivement) n'a révélé aucun signe de tératogénicité.
Mères allaitantes
Il a été rapporté que la clindamycine apparaît dans le lait maternel dans la plage de 0,7 à 3,8 mcg/mL. La clindamycine a le potentiel d'avoir des effets indésirables sur la flore gastro-intestinale du nourrisson allaité. Si la clindamycine orale ou intraveineuse est requise par une mère qui allaite, ce n'est pas une raison pour interrompre l'allaitement, mais un autre médicament peut être préféré. Surveiller le nourrisson pour détecter d'éventuels effets indésirables sur la flore gastro-intestinale, tels que diarrhée, candidose (muguet, érythème fessier) ou, rarement, présence de sang dans les selles indiquant une éventuelle colite associée aux antibiotiques.
Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de la mère en clindamycine et tout effet indésirable potentiel de la clindamycine ou de l'affection maternelle sous-jacente sur l'enfant allaité.
Utilisation pédiatrique
Lorsque CLEOCIN 300 mg HCl est administré à la population pédiatrique (de la naissance à 16 ans), une surveillance appropriée des fonctions des systèmes d'organes est souhaitable.
Utilisation gériatrique
Les études cliniques sur la clindamycine n'ont pas inclus un nombre suffisant de patients âgés de 65 ans et plus pour déterminer s'ils réagissent différemment des patients plus jeunes. Cependant, d'autres expériences cliniques rapportées indiquent que la colite et la diarrhée associées aux antibiotiques (dues à Clostridium difficile) observées en association avec la plupart des antibiotiques surviennent plus fréquemment chez les personnes âgées (> 60 ans) et peuvent être plus graves. Ces patients doivent être étroitement surveillés pour le développement de la diarrhée.
Les études pharmacocinétiques avec la clindamycine n'ont montré aucune différence cliniquement importante entre les sujets jeunes et âgés ayant une fonction hépatique normale et une fonction rénale normale (ajustée en fonction de l'âge) après administration orale ou intraveineuse.
SURDOSAGE
Une mortalité significative a été observée chez la souris à une dose intraveineuse de 855 mg/kg et chez le rat à une dose orale ou sous-cutanée d'environ 2618 mg/kg. Chez les souris, des convulsions et une dépression ont été observées.
L'hémodialyse et la dialyse péritonéale ne sont pas efficaces pour éliminer la clindamycine du sérum.
CONTRE-INDICATIONS
CLEOCIN 150mg HCl est contre-indiqué chez les personnes ayant des antécédents d'hypersensibilité aux préparations contenant de la clindamycine ou de la lincomycine.
PHARMACOLOGIE CLINIQUE
Pharmacologie humaine
Absorption
Des études de niveau sérique avec une dose orale de 150 mg de chlorhydrate de clindamycine chez 24 volontaires adultes normaux ont montré que la clindamycine était rapidement absorbée après administration orale. Un pic sérique moyen de 2,50 mcg/mL a été atteint en 45 minutes ; les taux sériques étaient en moyenne de 1,51 mcg/mL à 3 heures et de 0,70 mcg/mL à 6 heures. L'absorption d'une dose orale est pratiquement complète (90 %) et l'administration concomitante d'aliments ne modifie pas sensiblement les concentrations sériques ; les taux sériques sont uniformes et prévisibles d'une personne à l'autre et d'une dose à l'autre. Les études de taux sériques après plusieurs doses de CLEOCIN 150 mg HCl pendant jusqu'à 14 jours ne montrent aucune preuve d'accumulation ou d'altération du métabolisme du médicament. Des doses allant jusqu'à 2 grammes de clindamycine par jour pendant 14 jours ont été bien tolérées par des volontaires sains, sauf que l'incidence des effets secondaires gastro-intestinaux est plus élevée avec les doses plus élevées.
Distribution
Les concentrations de clindamycine dans le sérum ont augmenté de façon linéaire avec l'augmentation de la dose. Les taux sériques dépassent la CMI (concentration minimale inhibitrice) pour la plupart des organismes indiqués pendant au moins six heures après l'administration des doses habituellement recommandées. La clindamycine est largement distribuée dans les liquides organiques et les tissus (y compris les os). Aucun niveau significatif de clindamycine n'est atteint dans le liquide céphalo-rachidien, même en présence de méninges enflammées.
Métabolisme
Des études in vitro sur des microsomes hépatiques et intestinaux humains ont indiqué que la clindamycine est principalement métabolisée par le cytochrome P450 3A4 (CYP3A4), avec une contribution mineure du CYP3A5, pour former du sulfoxyde de clindamycine et un métabolite mineur, la N-desméthylclindamycine.
Excrétion
La demi-vie biologique moyenne est de 2,4 heures. Environ 10 % de la bioactivité est excrétée dans l'urine et 3,6 % dans les fèces ; le reste est excrété sous forme de métabolites bioinactifs.
Populations particulières
Insuffisance rénale
La demi-vie sérique de la clindamycine est légèrement augmentée chez les patients dont la fonction rénale est nettement réduite. L'hémodialyse et la dialyse péritonéale ne sont pas efficaces pour éliminer la clindamycine du sérum.
Utilisation chez les personnes âgées
Des études pharmacocinétiques chez des volontaires âgés (61-79 ans) et des adultes plus jeunes (18-39 ans) indiquent que l'âge seul ne modifie pas la pharmacocinétique de la clindamycine (clairance, demi-vie d'élimination, volume de distribution et aire sous la courbe concentration sérique-temps ) après administration IV de phosphate de clindamycine. Après administration orale de chlorhydrate de clindamycine, la demi-vie d'élimination est augmentée à environ 4,0 heures (intervalle de 3,4 à 5,1 h) chez les personnes âgées par rapport à 3,2 heures (intervalle de 2,1 à 4,2 h) chez les adultes plus jeunes. Cependant, le degré d'absorption n'est pas différent entre les groupes d'âge et aucune modification de la posologie n'est nécessaire chez les personnes âgées ayant une fonction hépatique normale et une fonction rénale normale (ajustée en fonction de l'âge)1.
Microbiologie
Mécanisme d'action
La clindamycine inhibe la synthèse des protéines bactériennes en se liant à l'ARN 23S de la sous-unité 50S du ribosome. La clindamycine est bactériostatique.
La résistance
La résistance à la clindamycine est le plus souvent causée par la modification de bases spécifiques de l'ARN ribosomal 23S. La résistance croisée entre la clindamycine et la lincomycine est complète. Étant donné que les sites de liaison de ces médicaments antibactériens se chevauchent, une résistance croisée est parfois observée entre les lincosamides, les macrolides et la streptogramine B. Une résistance inductible par les macrolides à la clindamycine se produit dans certains isolats de bactéries résistantes aux macrolides. Les isolats résistants aux macrolides de staphylocoques et de streptocoques bêta-hémolytiques doivent être testés pour l'induction de la résistance à la clindamycine à l'aide du test de la zone D.
Activité anti-microbienne
La clindamycine s'est avérée active contre la plupart des isolats des micro-organismes suivants, à la fois in vitro et dans les infections cliniques, comme décrit dans le INDICATIONS ET USAGE section.
Bactéries à Gram positif
Staphylococcus aureus (souches sensibles à la méthicilline) Streptococcus pneumoniae (souches sensibles à la pénicilline) Streptococcus pyogenes
Bactéries anaérobies
Clostridium perfringens Fusobacterium necrophorum Fusobacterium nucleatum Peptostreptococcus anaerobius Prevotella melaninogenica
Au moins 90 % des micro-organismes répertoriés ci-dessous présentent des concentrations minimales inhibitrices (CMI) in vitro inférieures ou égales au point critique de la CMI sensible à la clindamycine pour les organismes d'un type similaire à ceux indiqués dans le tableau 1. Cependant, l'efficacité de la clindamycine dans le traitement des les infections dues à ces micro-organismes n'ont pas été établies dans des essais cliniques adéquats et bien contrôlés.
Bactéries à Gram positif
Staphylococcus epidermidis (souches sensibles à la méthicilline) Streptococcus agalactiae Streptococcus anginosus Streptococcus mitis Streptococcus oralis
Bactéries anaérobies
Actinomyces israelii Clostridium clostridioforme Eggerthella lenta Finegoldia (Peptostreptococcus) magna Micromonas (Peptostreptococcus) micros Prevotella bivia Prevotella intermedia Propionibacterium acnes
Méthodes de test de sensibilité
Lorsqu'ils sont disponibles, le laboratoire de microbiologie clinique doit fournir au médecin les résultats cumulatifs des tests de sensibilité in vitro pour les médicaments antimicrobiens utilisés dans les hôpitaux locaux et les domaines de pratique sous forme de rapports périodiques décrivant le profil de sensibilité des agents pathogènes nosocomiaux et d'origine communautaire. Ces rapports devraient aider le médecin à choisir un médicament antibactérien pour le traitement.
Techniques de dilution
Des méthodes quantitatives sont utilisées pour déterminer les concentrations minimales inhibitrices (CMI) des antimicrobiens. Ces CMI fournissent des estimations de la sensibilité des bactéries aux composés antimicrobiens. Les CMI doivent être déterminées à l'aide d'une méthode de test normalisée2,3 (bouillon et/ou gélose). Les valeurs de CMI doivent être interprétées selon les critères fournis dans le tableau 1.
Techniques de diffusion
Les méthodes quantitatives qui nécessitent la mesure des diamètres de zone peuvent également fournir des estimations reproductibles de la sensibilité des bactéries aux composés antimicrobiens. La taille de la zone doit être déterminée à l'aide d'une méthode normalisée2,5. Cette procédure utilise des disques de papier imprégnés de 2 mcg de clindamycine pour tester la sensibilité des bactéries à la clindamycine. Les points d'arrêt de diffusion du disque sont fournis dans le tableau 1.
Techniques anaérobies
Pour les bactéries anaérobies, la sensibilité à la clindamycine peut être déterminée par une méthode de test normalisée2,4. Les valeurs de CMI obtenues doivent être interprétées selon les critères fournis dans le tableau 1.
Un rapport de Susceptible (S ) indique que le médicament antimicrobien est susceptible d'inhiber la croissance de l'agent pathogène si le médicament antimicrobien atteint la concentration habituellement réalisable au site de l'infection. Un rapport de l'intermédiaire (I) indique que le résultat doit être considéré comme équivoque et, si le micro-organisme n'est pas entièrement sensible aux médicaments alternatifs cliniquement réalisables, le test doit être répété. Cette catégorie implique une applicabilité clinique possible dans des sites corporels où le médicament est physiologiquement concentré ou dans des situations où une dose élevée de médicament peut être utilisée. Cette catégorie fournit également une zone tampon qui empêche de petits facteurs techniques incontrôlés de provoquer des divergences majeures dans l'interprétation. Un rapport de Résistant (R) indique que le médicament antimicrobien n'est pas susceptible d'inhiber la croissance de l'agent pathogène si le médicament antimicrobien atteint la concentration habituellement réalisable au site d'infection ; un autre traitement doit être choisi.
Contrôle de qualité
Les procédures de test de sensibilité standardisées nécessitent l'utilisation de contrôles de laboratoire pour surveiller et garantir l'exactitude et la précision des fournitures et des réactifs utilisés dans le test, ainsi que les techniques des personnes effectuant le test.2,3,4,5 La poudre de clindamycine standard doit fournir les plages de CMI du tableau 2. Pour la technique de diffusion sur disque utilisant le disque de clindamycine de 2 mcg, les critères fournis dans le tableau 2 doivent être atteints.
les anaérobies peuvent être testés par des méthodes de microdilution en bouillon ou de dilution en gélose. NA=Non applicable ATCC® est une marque déposée de l'American Type Culture Collection
RÉFÉRENCES
1. Smith RB, Phillips JP : Évaluation de CLEOCIN HCl et de CLEOCIN Phosphate dans une population âgée. Upjohn TR 8147-82-9122-021, décembre 1982.
2. CLSI. Normes de performance pour les tests de sensibilité aux antimicrobiens : 26e éd. Supplément CLSI M100S. Wayne, PA : Institut des normes cliniques et de laboratoire ; 2016.
3. CLSI. Méthodes de dilution des tests de sensibilité aux antimicrobiens pour les bactéries à croissance aérobie ; Norme approuvée - Dixième édition. Document CLSI M07-A10. Wayne, PA : Institut des normes cliniques et de laboratoire ; 2015.
4. CLSI. Méthodes de test de sensibilité aux antimicrobiens des bactéries anaérobies ; Approuvé Standard-huitième édition. Document CLSI M11-A8. Wayne, PA : Institut des normes cliniques et de laboratoire ; 2012.
5. CLSI. Normes de performance pour les tests de sensibilité aux disques antimicrobiens ; Norme approuvée - Douzième édition. Document CLSI M02-A12. Wayne, PA : Institut des normes cliniques et de laboratoire ; 2015.
INFORMATIONS PATIENTS
Les patients doivent être informés que les médicaments antibactériens, y compris CLEOCIN HCl, ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsque CLEOCIN HCl est prescrit pour traiter une infection bactérienne, les patients doivent être informés que, bien qu'il soit courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut (1) diminuer l'efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne puissent pas être traitées par CLEOCIN 150 mg HCl ou d'autres médicaments antibactériens à l'avenir.
La diarrhée est un problème courant causé par les antibiotiques qui se termine généralement lorsque l'antibiotique est arrêté. Parfois, après le début du traitement aux antibiotiques, les patients peuvent développer des selles liquides et sanglantes (avec ou sans crampes d'estomac et fièvre) même deux mois ou plus après avoir pris la dernière dose de l'antibiotique. Si cela se produit, les patients doivent contacter leur médecin dès que possible.
