Minocin 50mg, 100mg Minocycline Hydrochloride Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que la suspension orale Minocin et comment est-elle utilisée ?
Minocin (chlorhydrate de minocycline) est un antibiotique tétracycline utilisé pour traiter de nombreuses infections bactériennes différentes, telles que les infections des voies urinaires, les infections respiratoires, les infections cutanées, l'acné sévère, la gonorrhée, la fièvre des tiques, la chlamydia et autres.
Quels sont les effets secondaires de la suspension orale Minocin?
Les effets secondaires courants de Minocin incluent :
- vertiges,
- sensation de fatigue,
- sensation de rotation,
- douleurs articulaires ou musculaires,
- décoloration de la peau, des ongles ou des gencives,
- nausée,
- diarrhée,
- maux d'estomac,
- éruption cutanée ou démangeaisons,
- langue enflée, ou
- démangeaisons ou pertes vaginales.
Dites à votre médecin si vous avez des effets secondaires graves de Minocin 50 mg, notamment :
- des crampes d'estomac,
- diarrhée aqueuse ou sanglante,
- symptômes de la grippe,
- plaies dans la bouche et la gorge,
- la faiblesse,
- urine de couleur foncée,
- saignement inhabituel,
- des taches violettes ou rouges sous la peau,
- fièvre,
- démangeaison de la peau,
- ecchymoses,
- picotements ou engourdissements sévères,
- faiblesse musculaire,
- perte d'appétit,
- jaunissement de la peau ou des yeux,
- douleur thoracique,
- rythme cardiaque irrégulier,
- toux,
- respiration sifflante,
- essoufflement,
- confusion,
- vomissement,
- gonflement,
- gain de poids,
- uriner moins que d'habitude ou pas du tout,
- mal de tête ou douleur derrière les yeux,
- résonne dans tes oreilles,
- problèmes de vue,
- douleurs articulaires ou gonflement accompagné de fièvre,
- glandes enflées,
- douleurs musculaires,
- malaise général,
- pensées ou comportements inhabituels,
- crises d'épilepsie (convulsions), ou
- une réaction cutanée sévère.
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l'efficacité de la suspension orale MINOCIN® et d'autres médicaments antibactériens, la suspension orale MINOCIN doit être utilisée uniquement pour traiter ou prévenir les infections qui sont prouvées ou fortement suspectées d'être causées par des bactéries.
LA DESCRIPTION
MINOCIN 100 mg de chlorhydrate de minocycline, est un dérivé semi-synthétique de la tétracycline, 4,7Bis (diméthylamino)-1,4,4a,5,5a,6,11,12a-octahydro-3,10,12,12a-tétrahydroxy-1,11 -dioxo-2naphtacènecarboxamide monochlorhydrate.
Sa formule structurale est :
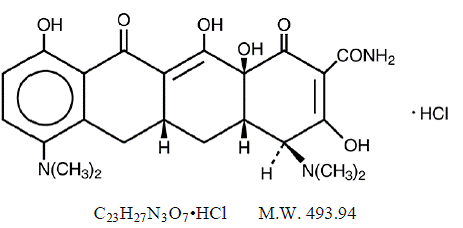 C23H27N3O7•HCl MW 493,94
C23H27N3O7•HCl MW 493,94 MINOCIN 50mg Suspension Orale contient du chlorhydrate de minocycline équivalent à 50 mg de minocycline par 5 mL (10 mg/mL) et les ingrédients inactifs suivants : Alcool, Butylparaben, Hydroxyde de Calcium, Cellulose, Décaglycéryl Tétraoléate, Edétate de Calcium Disodique, Gomme de Guar, Polysorbate 80 , propylparabène, propylène glycol, saccharine sodique, sulfite de sodium (voir AVERTISSEMENTS ) et Sorbitol.
LES INDICATIONS
MINOCIN 100mg Suspension Orale est indiqué dans le traitement des infections suivantes dues à des souches sensibles des micro-organismes désignés :
Fièvre pourprée des montagnes Rocheuses, fièvre typhus et le groupe typhus, fièvre Q, rickettsialpox et fièvres à tiques causées par les rickettsies.
Infections des voies respiratoires causées par Mycoplasma pneumoniae.
Lymphogranulome vénérien causé par Chlamydia trachomatis.
Psittacose (ornithose) due à Chlamydophila psittaci.
Trachome causé par Chlamydia trachomatis, bien que l'agent infectieux ne soit pas toujours éliminé, à en juger par l'immunofluorescence.
Conjonctivite à inclusions causée par Chlamydia trachomatis.
Urétrite non gonococcique, infections endocervicales ou rectales chez l'adulte causées par Ureaplasma urealyticum ou Chlamydia trachomatis.
Fièvre récurrente due à Borrelia recurrentis.
Chancre mou causé par Haemophilus ducreyi.
Peste due à Yersinia pestis.
Tularémie due à Francisella tularensis.
Choléra causé par Vibrio cholerae.
Infections à Campylobacter fetus causées par Campylobacter fetus.
Brucellose due aux espèces de Brucella (en association avec la streptomycine).
Bartonellose à Bartonella bacilliformis.
Granulome inguinal causé par Klebsiella granulomatis.
La minocycline est indiquée pour le traitement des infections causées par les micro-organismes gram-négatifs suivants lorsque les tests bactériologiques indiquent une sensibilité appropriée au médicament :
Escherichia coli.
Enterobacter aerogenes.
Espèce Shigella.
Espèce Acinetobacter.
Infections des voies respiratoires causées par Haemophilus influenzae.
Infections des voies respiratoires et des voies urinaires causées par les espèces de Klebsiella.
La suspension orale MINOCIN est indiquée pour le traitement des infections causées par les micro-organismes gram-positifs suivants lorsque les tests bactériologiques indiquent une sensibilité appropriée au médicament :
Infections des voies respiratoires supérieures causées par Streptococcus pneumoniae. Infections de la peau et des structures cutanées causées par Staphylococcus aureus (remarque : la minocycline n'est pas le médicament de choix dans le traitement de tout type d'infection staphylococcique).
Lorsque la pénicilline est contre-indiquée, la minocycline est un médicament alternatif dans le traitement des infections suivantes :
Urétrite non compliquée chez l'homme due à Neisseria gonorrhoeae et pour le traitement d'autres infections gonococciques.
Infections féminines causées par Neisseria gonorrhoeae.
Syphilis causée par Treponema pallidum sous-espèce pallidum.
Pian causé par la sous-espèce Treponema pallidum pertenue.
Listériose due à Listeria monocytogenes.
Charbon dû à Bacillus anthracis.
Infection de Vincent causée par Fusobacterium fusiforme.
Actinomycose causée par Actinomyces israelii.
Infections causées par les espèces de Clostridium.
Dans l'amibiase intestinale aiguë, la minocycline peut être un complément utile aux amibicides.
Dans l'acné sévère, la minocycline peut être un traitement d'appoint utile.
La minocycline orale est indiquée dans le traitement des porteurs asymptomatiques de Neisseria meningitidis pour éliminer les méningocoques du nasopharynx. Afin de préserver l'utilité de la minocycline dans le traitement des porteurs asymptomatiques de méningocoque, des procédures de diagnostic en laboratoire, y compris le sérotypage et les tests de sensibilité, doivent être effectuées pour établir l'état de porteur et le traitement approprié. Il est recommandé de réserver l'utilisation prophylactique de la minocycline aux situations où le risque de méningite à méningocoque est élevé.
La minocycline orale n'est pas indiquée pour le traitement de l'infection à méningocoque.
Bien qu'aucune étude d'efficacité clinique contrôlée n'ait été menée, des données cliniques limitées montrent que le chlorhydrate de minocycline par voie orale a été utilisé avec succès dans le traitement des infections causées par Mycobacterium marinum.
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l'efficacité de la suspension orale MINOCIN 100 mg et d'autres médicaments antibactériens, la suspension orale MINOCIN doit être utilisée uniquement pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu'elles sont causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte lors de la sélection ou de la modification du traitement antibactérien. En l'absence de telles données, l'épidémiologie locale et les schémas de sensibilité peuvent contribuer à la sélection empirique du traitement.
DOSAGE ET ADMINISTRATION
LA POSOLOGIE ET LA FRÉQUENCE D'ADMINISTRATION HABITUELLES DE LA MINOCYCLINE DIFFÉRENT DE CELLES DES AUTRES TÉTRACYCLINES. LE DÉPASSEMENT DE LA POSOLOGIE RECOMMANDÉE PEUT ENTRAÎNER UNE INCIDENCE AUGMENTÉE DES EFFETS SECONDAIRES.
Le traitement doit être poursuivi pendant au moins 24 à 48 heures après la disparition des symptômes et de la fièvre.
Les études à ce jour ont indiqué que l'absorption de la suspension orale de MINOCIN n'est pas notablement influencée par les aliments et les produits laitiers.
La pharmacocinétique de la minocycline chez les patients insuffisants rénaux (CLCR AVERTISSEMENTS ).
Dans le traitement des infections streptococciques, une dose thérapeutique de tétracycline doit être administrée pendant au moins dix jours.
Pour les patients pédiatriques de plus de 8 ans
La posologie pédiatrique habituelle de MINOCIN est de 4 mg/kg initialement suivie de 2 mg/kg toutes les 12 heures, sans dépasser la dose adulte habituelle.
Adultes
La posologie habituelle de MINOCIN est de 200 mg initialement suivis de 100 mg toutes les 12 heures.
Pour le traitement de la syphilis, la posologie habituelle de MINOCIN doit être administrée sur une période de 10 à 15 jours. Un suivi étroit, y compris des tests de laboratoire, est recommandé.
Les patients atteints de gonorrhée sensibles à la pénicilline peuvent être traités avec MINOCIN 50 mg, administré à raison de 200 mg initialement, suivi de 100 mg toutes les 12 heures pendant au moins 4 jours, avec des cultures post-thérapeutiques dans les 2 à 3 jours.
Dans le traitement de l'état de porteur du méningocoque, la posologie recommandée est de 100 mg toutes les 12 heures pendant 5 jours.
Infections à Mycobacterium marinum : Bien que les doses optimales n'aient pas été établies, 100 mg toutes les 12 heures pendant 6 à 8 semaines ont été utilisés avec succès dans un nombre limité de cas.
Infection urétrale, endocervicale ou rectale non compliquée chez l'adulte causée par Chlamydia trachomatis ou Ureaplasma urealyticum : 100 mg par voie orale, toutes les 12 heures pendant au moins 7 jours.
Dans le traitement de l'urétrite gonococcique non compliquée chez l'homme, 100 mg deux fois par jour par voie orale pendant 5 jours sont recommandés.
COMMENT FOURNIE
MINOCIN (chlorhydrate de minocycline) suspension orale contient du chlorhydrate de minocycline équivalent à 50 mg de minocycline par cuillère à thé (5 ml). Conservé avec du propylparabène 0,10 % et du butylparabène 0,06 % avec de l'alcool USP 5 % v/v. Saveur de crème pâtissière.
CDN 16781-473-60 - Bouteille 2 fl. Oz. (60 ml)
Conserver à température ambiante contrôlée de 20 ° à 25 °C (68 ° à 77 °F).
NE PAS CONGELER.
Fabriqué pour : Onset Dermatologics, LLC Cumberland, RI 02864. Révisé : novembre 2018
EFFETS SECONDAIRES
En raison de l'absorption pratiquement complète de la minocycline orale, les effets secondaires au niveau de l'intestin inférieur, en particulier la diarrhée, ont été peu fréquents. Les effets indésirables suivants ont été observés chez des patients recevant des tétracyclines.
Corps dans son ensemble : Fièvre et décoloration des sécrétions.
Gastro-intestinal : Anorexie, nausées, vomissements, diarrhée, dyspepsie, stomatite, glossite, dysphagie, hypoplasie de l'émail, entérocolite, colite pseudomembraneuse, pancréatite, lésions inflammatoires (avec prolifération moniliale) dans les régions buccale et anogénitale.
Génito-urinaire : Vulvovaginite.
Toxicité hépatique : Hyperbilirubinémie, cholestase hépatique, augmentation des enzymes hépatiques, insuffisance hépatique mortelle et ictère. Des hépatites, y compris des hépatites auto-immunes, et des insuffisances hépatiques ont été rapportées (voir PRÉCAUTIONS ).

Peau: Alopécie, érythème noueux, hyperpigmentation des ongles, prurit, nécrolyse épidermique toxique, vascularite, éruption maculopapuleuse et éruption érythémateuse. Des dermatites exfoliatives ont été rapportées. Des éruptions médicamenteuses fixes, y compris une balanite, ont été signalées. L'érythème polymorphe et le syndrome de Stevens-Johnson ont été rapportés. La photosensibilité est discutée ci-dessus (voir AVERTISSEMENTS ). Une pigmentation de la peau et des muqueuses a été rapportée.
Respiratoire: Toux, dyspnée, bronchospasme, exacerbation de l'asthme et pneumonite.
Toxicité rénale : Néphrite interstitielle. Des élévations du BUN ont été rapportées et sont apparemment liées à la dose (voir AVERTISSEMENTS ). Une insuffisance rénale aiguë réversible a été rapportée.
Musculo-squelettique : Arthralgie, arthrite, décoloration osseuse, myalgie, raideur articulaire et gonflement articulaire.
Réactions d'hypersensibilité : Urticaire, œdème de Quincke, polyarthralgie, anaphylaxie/réaction anaphylactoïde (y compris choc et décès), purpura anaphylactoïde, myocardite, péricardite, exacerbation du lupus érythémateux disséminé et infiltrats pulmonaires avec éosinophilie ont été rapportés. Un syndrome pseudo-lupique transitoire et des réactions de type maladie sérique ont également été rapportés.
Sang: Des cas d'agranulocytose, d'anémie hémolytique, de thrombocytopénie, de leucopénie, de neutropénie, de pancytopénie et d'éosinophilie ont été rapportés.
Système nerveux central: Convulsions, étourdissements, hypoesthésie, paresthésie, sédation et vertiges. Pseudotumor cerebri (hypertension intracrânienne bénigne) chez les adultes et fontanelles bombées chez les nourrissons (voir PRÉCAUTIONS - Général ). Des maux de tête ont également été signalés.
Autre: Des cas de cancer de la thyroïde ont été signalés après la commercialisation en association avec des produits à base de minocycline. Lorsque le traitement par la minocycline est administré sur des périodes prolongées, une surveillance des signes de cancer de la thyroïde doit être envisagée. Lorsqu'elles sont administrées sur des périodes prolongées, il a été rapporté que les tétracyclines produisaient une décoloration microscopique brun-noir de la glande thyroïde. Des cas de fonction thyroïdienne anormale ont été rapportés.
Coloration des dents chez les enfants de moins de 8 ans (voir AVERTISSEMENTS ) et aussi, chez les adultes a été signalé.
Une décoloration de la cavité buccale (y compris la langue, les lèvres et les gencives) a été signalée.
Des acouphènes et une diminution de l'audition ont été rapportés chez des patients sous MINOCIN (chlorhydrate de minocycline).
Les syndromes suivants ont été rapportés. Dans certains cas impliquant ces syndromes, la mort a été rapportée. Comme pour les autres effets indésirables graves, si l'un de ces syndromes est reconnu, le médicament doit être arrêté immédiatement :
Syndrome d'hypersensibilité consistant en une réaction cutanée (telle qu'une éruption cutanée ou une dermatite exfoliative), une éosinophilie et un ou plusieurs des éléments suivants : hépatite, pneumonite, néphrite, myocardite et péricardite. De la fièvre et des adénopathies peuvent être présentes.
Syndrome de type lupique consistant en un anticorps antinucléaire positif ; arthralgie, arthrite, raideur articulaire ou gonflement articulaire ; et un ou plusieurs des éléments suivants : fièvre, myalgie, hépatite, éruption cutanée et vascularite.
Syndrome de type maladie sérique consistant en fièvre ; urticaire ou éruption cutanée; et arthralgie, arthrite, raideur articulaire ou gonflement articulaire et lymphadénopathie. Une éosinophilie peut être présente.
Pour signaler des RÉACTIONS INDÉSIRABLES SUSPECTÉES, contactez Valeant Pharmaceuticals North America LLC au 1-800-321-4576 ou la FDA au 1-800-FDA-1088 ou www.fda.gov/medwatch.
INTERACTIONS MÉDICAMENTEUSES
Étant donné qu'il a été démontré que les tétracyclines diminuent l'activité de la prothrombine plasmatique, les patients sous traitement anticoagulant peuvent nécessiter un ajustement à la baisse de leur dose d'anticoagulant.
Étant donné que les médicaments bactériostatiques peuvent interférer avec l'action bactéricide de la pénicilline, il est conseillé d'éviter de donner des médicaments de la classe des tétracyclines en association avec la pénicilline.
L'absorption des tétracyclines est altérée par les antiacides contenant de l'aluminium, du calcium ou du magnésium et les préparations contenant du fer.
L'utilisation concomitante de tétracycline et de méthoxyflurane a entraîné une toxicité rénale mortelle.
L'utilisation concomitante de tétracyclines avec des contraceptifs oraux peut rendre les contraceptifs oraux moins efficaces.
L'administration d'isotrétinoïne doit être évitée peu de temps avant, pendant et peu de temps après le traitement par la minocycline. Chaque médicament seul a été associé à une pseudo-tumeur cérébrale (voir PRÉCAUTIONS ).
Risque accru d'ergotisme lorsque des alcaloïdes de l'ergot de seigle ou leurs dérivés sont administrés avec des tétracyclines.
AVERTISSEMENTS
Développement des dents
La suspension orale MINOCIN, comme d'autres antibiotiques de la classe des tétracyclines, peut nuire au fœtus lorsqu'elle est administrée à une femme enceinte. Si une tétracycline est utilisée pendant la grossesse ou si la patiente tombe enceinte pendant qu'elle prend ces médicaments, la patiente doit être informée du danger potentiel pour le fœtus. L'utilisation de médicaments de la classe des tétracyclines pendant le développement des dents (dernière moitié de la grossesse, petite enfance et enfance jusqu'à l'âge de 8 ans) peut provoquer une décoloration permanente des dents (jaune-gris-brun).
Cet effet indésirable est plus fréquent lors de l'utilisation à long terme du médicament, mais a été observé après des traitements répétés à court terme. Une hypoplasie de l'émail a également été rapportée. Par conséquent, les médicaments à base de tétracycline ne doivent pas être utilisés pendant le développement des dents, à moins que d'autres médicaments ne soient probablement pas efficaces ou soient contre-indiqués.
Développement du squelette
Toutes les tétracyclines forment un complexe de calcium stable dans tout tissu osseux. Une diminution du taux de croissance du péroné a été observée chez des nourrissons humains prématurés ayant reçu de la tétracycline par voie orale à des doses de 25 mg/kg toutes les six heures. Cette réaction s'est avérée réversible lorsque le médicament a été arrêté.
Utilisation pendant la grossesse
Les résultats d'études animales indiquent que les tétracyclines traversent le placenta, se trouvent dans les tissus fœtaux et peuvent avoir des effets toxiques sur le fœtus en développement (souvent liés à un retard du développement du squelette). Des signes d'embryotoxicité ont été observés chez des animaux traités en début de gestation. La sécurité d'utilisation de MINOCIN pendant la grossesse n'a pas été établie.
Réaction dermatologique
Une éruption médicamenteuse avec éosinophilie et symptômes systémiques (DRESS), y compris des cas mortels, a été signalée avec l'utilisation de la minocycline. Si ce syndrome est reconnu, le médicament doit être arrêté immédiatement.
Action antianabolique
L'action antianabolique des tétracyclines peut entraîner une augmentation de l'azote uréique. Bien que cela ne soit pas un problème chez les personnes dont la fonction rénale est normale, chez les patients dont la fonction rénale est considérablement altérée, des taux sériques plus élevés de tétracycline peuvent entraîner une azotémie, une hyperphosphatémie et une acidose. Dans ces conditions, une surveillance de la créatinine et de l'urée est recommandée et la posologie quotidienne totale ne doit pas dépasser 200 mg en 24 heures (voir DOSAGE ET ADMINISTRATION ). En cas d'insuffisance rénale, même les doses orales ou parentérales habituelles peuvent entraîner une accumulation systémique du médicament et une éventuelle toxicité hépatique.
Photosensibilité
Une photosensibilité se manifestant par une réaction exagérée de coup de soleil a été observée chez certains individus prenant des tétracyclines. Cela a été rapporté avec la minocycline.
Effets sur le système nerveux central
Des effets secondaires sur le système nerveux central, notamment des étourdissements, des étourdissements ou des vertiges, ont été signalés avec le traitement par la minocycline. Les patients qui présentent ces symptômes doivent être mis en garde contre la conduite de véhicules ou l'utilisation de machines dangereuses pendant le traitement par la minocycline. Ces symptômes peuvent disparaître pendant le traitement et disparaissent généralement rapidement à l'arrêt du médicament.
Diarrhée associée à Clostridium difficile
Des diarrhées associées à Clostridium difficile (CDAD) ont été signalées avec l'utilisation de presque tous les agents antibactériens, y compris MINOCIN 50 mg, et leur gravité peut varier d'une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens altère la flore normale du côlon, entraînant une prolifération de C. difficile.
C. difficile produit les toxines A et B qui contribuent au développement de CDAD. Les souches de C. difficile productrices d'hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée suite à l'utilisation d'antibiotiques. Des antécédents médicaux minutieux sont nécessaires car il a été rapporté que la DACD survient plus de deux mois après l'administration d'agents antibactériens.
Si la DACD est suspectée ou confirmée, l'utilisation continue d'antibiotiques non dirigés contre C. difficile peut devoir être interrompue. Une gestion appropriée des liquides et des électrolytes, une supplémentation en protéines, un traitement antibiotique de C. difficile et une évaluation chirurgicale doivent être institués selon les indications cliniques.
Hypersensibilité au sulfite de sodium
La suspension orale MINOCIN contient du sulfite de sodium, un sulfite qui peut provoquer des réactions de type allergique, notamment des symptômes anaphylactiques et des épisodes asthmatiques potentiellement mortels ou moins graves chez certaines personnes sensibles. La prévalence globale de la sensibilité aux sulfites dans la population générale est inconnue et probablement faible. La sensibilité aux sulfites est plus fréquente chez les asthmatiques que chez les non-asthmatiques.
Hypertension intracrânienne
L'hypertension intracrânienne (IH, pseudotumor cerebri) a été associée à l'utilisation de tétracyclines, y compris MINOCIN. Les manifestations cliniques de l'IH comprennent des maux de tête, une vision floue, une diplopie et une perte de vision ; l'œdème papillaire peut être trouvé sur le fond d'œil. Les femmes en âge de procréer qui sont en surpoids ou qui ont des antécédents d'IH sont plus à risque de développer une IH associée à la tétracycline. L'utilisation concomitante d'isotrétinoïne et de MINOCIN doit être évitée car l'isotrétinoïne est également connue pour provoquer une pseudotumeur cérébrale.
Bien que l'IH disparaisse généralement après l'arrêt du traitement, la possibilité d'une perte visuelle permanente existe. Si des symptômes visuels se développent pendant le traitement, une évaluation ophtalmologique rapide est justifiée. Étant donné que la pression intracrânienne peut rester élevée pendant des semaines après l'arrêt du traitement, les patients doivent être surveillés jusqu'à ce qu'ils se stabilisent.
PRÉCAUTIONS
Général
Comme avec d'autres préparations antibiotiques, l'utilisation de ce médicament peut entraîner une prolifération d'organismes non sensibles, y compris des champignons. En cas de surinfection, l'antibiotique doit être arrêté et un traitement approprié institué.
Une hépatotoxicité a été signalée avec la minocycline; par conséquent, la minocycline doit être utilisée avec prudence chez les patients présentant un dysfonctionnement hépatique et en association avec d'autres médicaments hépatotoxiques.
L'incision et le drainage ou d'autres procédures chirurgicales doivent être effectuées en conjonction avec une antibiothérapie, le cas échéant.
Prescrire MINOCIN suspension buvable en l'absence d'infection bactérienne avérée ou fortement suspectée ou d'indication prophylactique est peu susceptible d'apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes aux médicaments.
Tests de laboratoire
Des évaluations périodiques en laboratoire des systèmes d'organes, y compris hématopoïétiques, rénaux et hépatiques, doivent être effectuées.
Tous les patients atteints de gonorrhée doivent subir un test sérologique pour la syphilis au moment du diagnostic. Les patients traités par la minocycline doivent subir un test sérologique de suivi pour la syphilis après 3 mois.
Interactions médicament/test de laboratoire
De fausses élévations des taux de catécholamines urinaires peuvent survenir en raison d'interférences avec le test de fluorescence.
Carcinogenèse, mutagenèse, altération de la fertilité
L'administration alimentaire de minocycline dans des études de tumorigénicité à long terme chez le rat a mis en évidence la production de tumeurs thyroïdiennes. On a également constaté que la minocycline produisait une hyperplasie thyroïdienne chez le rat et le chien. De plus, il y a eu des preuves d'activité oncogène chez les rats dans des études avec un antibiotique apparenté, l'oxytétracycline (c.-à-d. tumeurs surrénaliennes et hypophysaires). De même, bien qu'aucune étude de mutagénicité de la minocycline n'ait été menée, des résultats positifs dans des tests in vitro sur des cellules de mammifères (c.-à-d. lymphome de souris et cellules pulmonaires de hamster chinois) ont été signalés pour des antibiotiques apparentés (chlorhydrate de tétracycline et oxytétracycline). Les études de segment I (fertilité et reproduction générale) ont fourni des preuves que la minocycline altère la fertilité chez les rats mâles.
Grossesse
Résumé des risques
Toutes les grossesses présentent un risque de fond de malformations congénitales, de perte ou d'autres résultats indésirables, quelle que soit l'exposition aux médicaments. Il n'y a pas d'études adéquates et bien contrôlées sur l'utilisation de la minocycline chez la femme enceinte. La minocycline, comme les autres antibiotiques de la classe des tétracyclines, traverse le placenta et peut nuire au fœtus lorsqu'elle est administrée à une femme enceinte. De rares cas spontanés d'anomalies congénitales, y compris de réduction de membre, ont été rapportés depuis la commercialisation. Seules des informations limitées sont disponibles concernant ces rapports ; par conséquent, aucune conclusion sur l'association causale ne peut être établie. Si la minocycline est utilisée pendant la grossesse ou si la patiente tombe enceinte pendant qu'elle prend ce médicament, la patiente doit être informée du risque potentiel pour le fœtus.
Effets non tératogènes : (voir AVERTISSEMENTS ).
Travail et accouchement
L'effet des tétracyclines sur le travail et l'accouchement est inconnu.
Mères allaitantes
Les tétracyclines sont excrétées dans le lait maternel. En raison du risque d'effets indésirables graves chez les nourrissons allaités par les tétracyclines, une décision doit être prise soit d'interrompre l'allaitement soit d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère (voir AVERTISSEMENTS ).
Utilisation pédiatrique
L'utilisation de la minocycline n'est pas recommandée chez les enfants de moins de 8 ans, sauf si les bénéfices attendus du traitement l'emportent sur les risques (voir AVERTISSEMENTS ).
Utilisation gériatrique
Les études cliniques sur la minocycline orale n'incluaient pas un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondaient différemment des sujets plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement par le bas de la plage posologique, reflétant la fréquence plus élevée de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux (voir AVERTISSEMENTS , DOSAGE ET ADMINISTRATION ).
MINOCIN 50mg Suspension Orale contient 4,3 mg (0,18 mEq) de sodium par 5 mL.
SURDOSAGE
Les événements indésirables les plus fréquemment observés en cas de surdosage sont les étourdissements, les nausées et les vomissements.
Aucun antidote spécifique de la minocycline n'est connu.
En cas de surdosage, arrêtez le traitement, traitez de manière symptomatique et mettez en place des mesures de soutien. La minocycline n'est pas éliminée en quantité significative par hémodialyse ou dialyse péritonéale.
CONTRE-INDICATIONS
Ce médicament est contre-indiqué chez les personnes qui ont montré une hypersensibilité à l'une des tétracyclines ou à l'un des composants de la formulation du produit.
PHARMACOLOGIE CLINIQUE
Après une dose unique de deux gélules remplies de poudre de 100 mg de minocycline HCl administrées à dix volontaires adultes normaux, les taux sériques variaient de 0,74 à 4,45 mcg/mL en 1 heure (moyenne de 2,24); après 12 heures, elles variaient de 0,34 à 2,36 mcg/mL (moyenne 1,25). La demi-vie sérique après une dose unique de 200 mg chez 12 volontaires essentiellement normaux variait de 11 à 17 heures. Chez sept patients atteints d'insuffisance hépatique, elle variait de 11 à 16 heures, et chez 5 patients atteints d'insuffisance rénale, elle variait de 18 à 69 heures. La récupération urinaire et fécale de la minocycline administrée à 12 volontaires normaux était de la moitié à un tiers de celle des autres tétracyclines.
Microbiologie
Mécanisme d'action
Les tétracyclines sont principalement bactériostatiques et on pense qu'elles exercent leur effet antimicrobien en inhibant la synthèse des protéines. Les tétracyclines, y compris la minocycline, ont un spectre d'activité antimicrobien similaire contre un large éventail d'organismes gram-positifs et gram-négatifs. La résistance croisée de ces organismes à la tétracycline est courante.
Activité anti-microbienne
La minocycline s'est avérée active contre la plupart des souches des micro-organismes suivants, à la fois in vitro et dans les infections cliniques, comme décrit dans le LES INDICATIONS section:
Bactéries Gram-positives
Bacillus anthracis Listeria monocytogenes Staphylococcus aureus Streptococcus pneumoniae
Bactéries Gram-négatives
Bartonella bacilliformis Espèce Brucella Klebsiella granulomatis Campylobacter fetus Francisella tularensis Haemophilus ducreyi Vibrio cholerae Yersinia pestis Espèce Acinetobacter Enterobacter aerogenes Escherichia coli Haemophilus influenzae Espèce Klebsiella Neisseria gonorrhoeae Neisseria meningitidis Espèce Shigella
Autres micro-organismes
Espèce Actinomyces Borrelia recurrentis Chlamydophila psittaci Chlamydia trachomatis Espèce Clostridium Espèce Entamoeba Fusobacterium nucleatum sous-espèce fusiforme Mycobacterium marinum Mycoplasma pneumoniae Propionibacterium acnes Rickettsiae Treponema pallidum sous-espèce pallidum Treponema pallidum sous-espèce pertenue Ureaplasma urealyticum
Test de sensibilité
Pour des informations spécifiques concernant les critères d'interprétation des tests de sensibilité et les méthodes de test associées et les normes de contrôle qualité reconnues par la FDA pour ce médicament, veuillez consulter : https://www.fda.gov/STIC.
Pharmacologie et toxicologie animales
Il a été observé que le chlorhydrate de minocycline provoque une décoloration foncée de la thyroïde chez les animaux de laboratoire (rats, cochons nains, chiens et singes). Chez le rat, un traitement chronique au chlorhydrate de minocycline a entraîné un goitre accompagné d'une absorption élevée d'iode radioactif et de signes de production de tumeurs thyroïdiennes. On a également découvert que le chlorhydrate de minocycline produisait une hyperplasie thyroïdienne chez le rat et le chien.
INFORMATIONS PATIENTS
La diarrhée est un problème courant causé par les antibiotiques qui se termine généralement lorsque l'antibiotique est arrêté. Parfois, après le début du traitement aux antibiotiques, les patients peuvent développer des selles liquides et sanglantes (avec ou sans crampes d'estomac et fièvre) même deux mois ou plus après avoir pris la dernière dose de l'antibiotique. Si cela se produit, les patients doivent contacter leur médecin dès que possible.
Une photosensibilité se manifestant par une réaction exagérée de coup de soleil a été observée chez certains individus prenant des tétracyclines. Les patients susceptibles d'être exposés à la lumière directe du soleil ou à la lumière ultraviolette doivent être informés que cette réaction peut survenir avec les médicaments à base de tétracycline et le traitement doit être interrompu dès les premiers signes d'érythème cutané. Cette réaction a été rapportée avec l'utilisation de la minocycline.
Les patients qui présentent des symptômes du système nerveux central doivent être avertis de la conduite de véhicules ou de l'utilisation de machines dangereuses pendant le traitement par la minocycline (voir AVERTISSEMENTS ).
L'utilisation concomitante de tétracycline avec des contraceptifs oraux peut rendre les contraceptifs oraux moins efficaces (voir INTERACTIONS MÉDICAMENTEUSES ).
Les patients doivent être informés que les médicaments antibactériens, y compris la suspension orale MINOCIN 50 mg, ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsque la suspension orale MINOCIN est prescrite pour traiter une infection bactérienne, les patients doivent être informés que, bien qu'il soit courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut (1) diminuer l'efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne soient pas traitables par MINOCIN 50mg Suspension Orale ou d'autres médicaments antibactériens à l'avenir .
Les fournitures non utilisées d'antibiotiques tétracyclines doivent être jetées avant la date de péremption.
