Augmentin 250/125mg, 500/125mg, 750/250mg, 875/125mg Clavulanate Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Augmentin 875 mg et comment est-il utilisé ?
Augmentin 250 mg est un médicament sur ordonnance utilisé pour traiter les symptômes de nombreuses infections différentes causées par des bactéries telles que les infections des voies respiratoires inférieures, la bronchopneumopathie chronique obstructive, la sinusite bactérienne, les morsures animales/humaines et les infections cutanées. Augmentin 125 mg peut être utilisé seul ou avec d'autres médicaments.
- Augmentin est une Pénicilline, Amino.
Quels sont les effets secondaires possibles d'Augmentin ?
Augmentin 750 mg peut provoquer des effets secondaires graves, notamment :
- fortes douleurs à l'estomac,
- diarrhée aqueuse ou sanglante,
- peau pâle ou jaunie,
- urine de couleur foncée,
- fièvre,
- confusion,
- la faiblesse,
- perte d'appétit,
- douleur dans le haut du ventre,
- jaunissement de la peau ou des yeux (jaunisse),
- ecchymoses ou saignements faciles,
- peu ou pas de miction,
- mal de gorge,
- gonflement du visage ou de la langue,
- brûlant dans tes yeux,
- douleur cutanée suivie d'une éruption cutanée rouge ou violette qui s'étend (sur le visage ou le haut du corps) avec des cloques et une desquamation
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Augmentin incluent :
- nausée,
- diarrhée,
- démangeaisons ou pertes vaginales,
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Augmentin. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
AUGMENTIN 500 mg est une association antibactérienne orale composée d'amoxicilline et d'un inhibiteur de bêta-lactamase, le clavulanate de potassium (le sel de potassium de l'acide clavulanique).
L'amoxicilline est un analogue de l'ampicilline, dérivé du noyau basique de la pénicilline, l'acide 6-aminopénicillanique. La formule moléculaire de l'amoxicilline est C16H19N3O5S•3H2O et le poids moléculaire est de 419,46. Chimiquement, l'amoxicilline est (2S,5R,6R)-6-[(R)-(-)-2-Amino-2-(p-hydroxyphényl)acétamido]-3,3- diméthyl-7-oxo-4-thia -1-azabicyclo[3.2.0]heptane-2-acide carboxylique trihydraté et peut être représenté structurellement comme :
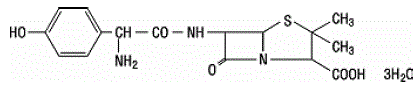
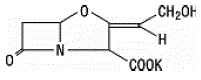
L'acide clavulanique est produit par la fermentation de Streptomyces clavuligerus. C'est une bêta-lactamine structurellement apparentée aux pénicillines et possède la capacité d'inactiver certaines bêta-lactamases en bloquant les sites actifs de ces enzymes. La formule moléculaire du clavulanate de potassium est C8H8KNO5 et le poids moléculaire est de 237,25. Chimiquement, le clavulanate de potassium est du potassium (Z)(2R,5R)-3-(2-hydroxyéthylidène)-7-oxo-4-oxa-1-azabicyclo[3.2.0]-heptane-2-carboxylate et peut être représenté structurellement comme:
ingrédients inactifs
- Comprimés - Dioxyde de silicium colloïdal, hypromellose, stéarate de magnésium, cellulose microcristalline, polyéthylèneglycol, glycolate d'amidon sodique et dioxyde de titane. Chaque comprimé d'AUGMENTIN contient 0,63 mEq de potassium.
- Poudre pour suspension orale - Dioxyde de silicium colloïdal, arômes, gomme de xanthane et un ou plusieurs des éléments suivants : hypromellose, mannitol, gel de silice, dioxyde de silicium, acide succinique, saccharine sodique et aspartame. [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Comprimés à croquer - Dioxyde de silicium colloïdal, arômes, stéarate de magnésium, mannitol et un ou plusieurs des éléments suivants : D&C jaune n° 10, FD&C rouge n° 40, glycine, saccharine sodique et aspartame. [voir AVERTISSEMENTS ET PRECAUTIONS]
- Chaque comprimé à croquer de 125 mg et chaque 5 mL de suspension buvable reconstituée de 125/5 mL d'AUGMENTIN 750 mg contient 0,16 mEq de potassium
- Chaque comprimé à croquer de 250 mg et chaque 5 mL de suspension buvable reconstituée de 250/5 mL d'AUGMENTIN contient 0,32 mEq de potassium
- Chaque comprimé à croquer de 200 mg et chaque 5 mL de suspension buvable reconstituée de 200/5 mL d'AUGMENTIN contient 0,14 mEq de potassium
- Chaque comprimé à croquer de 400 mg et chaque 5 mL de suspension buvable reconstituée de 400/5 mL d'AUGMENTIN 500 mg contient 0,29 mEq de potassium
LES INDICATIONS
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l'efficacité d'AUGMENTIN (amoxicilline/acide clavulanique potassique) et d'autres médicaments antibactériens, AUGMENTIN 500 mg doit être utilisé uniquement pour traiter des infections avérées ou fortement suspectées d'être causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte lors de la sélection ou de la modification du traitement antibactérien. En l'absence de telles données, l'épidémiologie locale et les schémas de sensibilité peuvent contribuer à la sélection empirique du traitement.
AUGMENTIN® est une combinaison d'antibactérien de la classe des pénicillines et d'inhibiteur de bêta-lactamase indiquée dans le traitement des infections dues à des isolats sensibles des bactéries désignées dans les conditions énumérées ci-dessous* :
Infections des voies respiratoires inférieures
Causée par des isolats producteurs de bêta-lactamase d'Haemophilus influenzae et de Moraxella catarrhalis.
Otite moyenne bactérienne aiguë
Causée par des isolats producteurs de bêta-lactamase de H. influenzae et M. catarrhalis.
Sinusite
Causée par des isolats producteurs de bêta-lactamase de H. influenzae et M. catarrhalis.
Infections de la peau et des structures cutanées
Causée par des isolats producteurs de bêta-lactamase de Staphylococcus aureus, Escherichia coli et Klebsiella.
Infections des voies urinaires
Causée par des isolats producteurs de bêta-lactamase d'E. coli, des espèces de Klebsiella et des espèces d'Enterobacter.
Limites d'utilisation
Lorsque les résultats des tests de sensibilité montrent une sensibilité à l'amoxicilline, indiquant l'absence de production de bêta-lactamase, AUGMENTIN ne doit pas être utilisé.
DOSAGE ET ADMINISTRATION
AUGMENTIN 875 mg peut être pris indépendamment des repas ; cependant, l'absorption du clavulanate potassique est améliorée lorsqu'AUGMENTIN 250 mg est administré en début de repas. Afin de minimiser le risque d'intolérance gastro-intestinale, AUGMENTIN 125 mg doit être pris en début de repas.
Adultes
La posologie usuelle chez l'adulte est d'un comprimé d'AUGMENTIN à 500 mg toutes les 12 heures ou d'un comprimé d'AUGMENTIN 125 mg à 250 mg toutes les 8 heures. Pour les infections plus sévères et les infections des voies respiratoires, la dose doit être d'un comprimé d'AUGMENTIN à 875 mg toutes les 12 heures ou d'un comprimé d'AUGMENTIN à 500 mg toutes les 8 heures. Les adultes qui ont des difficultés à avaler peuvent recevoir la suspension à 125 mg/5 ml ou 250 mg/5 ml à la place du comprimé à 500 mg. La suspension à 200 mg/5 mL ou la suspension à 400 mg/5 mL peuvent être utilisées à la place du comprimé à 875 mg.
Deux comprimés d'AUGMENTIN à 250 mg ne doivent pas remplacer un comprimé d'AUGMENTIN à 500 mg. Étant donné que les comprimés d'AUGMENTIN à 250 mg et à 500 mg contiennent la même quantité d'acide clavulanique (125 mg, sous forme de sel de potassium), deux comprimés à 250 mg ne sont pas équivalents à un comprimé à 500 mg d'AUGMENTIN.
Le comprimé à 250 mg d'AUGMENTIN et le comprimé à croquer à 250 mg ne doivent pas être substitués l'un à l'autre, car ils ne sont pas interchangeables. Le comprimé à 250 mg d'AUGMENTIN 250 mg et le comprimé à croquer à 250 mg ne contiennent pas la même quantité d'acide clavulanique (que le sel de potassium). Le comprimé à 250 mg d'AUGMENTIN contient 125 mg d'acide clavulanique alors que le comprimé à croquer à 250 mg contient 62,5 mg d'acide clavulanique.
Patients pédiatriques
Sur la base du composant amoxicilline, AUGMENTIN doit être dosé comme suit :
Nouveau-nés et nourrissons âgés de
La dose recommandée d'AUGMENTIN est de 30 mg/kg/jour à répartir toutes les 12 heures, en fonction du composant amoxicilline. L'expérience avec la formulation de 200 mg/5 ml dans ce groupe d'âge est limitée, et par conséquent, l'utilisation de la suspension buvable de 125 mg/5 ml est recommandée.
Patients âgés de 12 semaines (3 mois) et plus
Voir les schémas posologiques fournis dans le tableau 1. Le schéma posologique toutes les 12 heures est recommandé car il est associé à une diminution significative de la diarrhée [voir Etudes cliniques ]. Cependant, la suspension toutes les 12 heures (200 mg/5 ml et 400 mg/5 ml) et les comprimés à croquer (200 mg et 400 mg) contiennent de l'aspartame et ne doivent pas être utilisés par les phénylcétonuriques. [voir AVERTISSEMENTS ET PRECAUTIONS ]
Patients pesant 40 kg ou plus
Les patients pédiatriques pesant 40 kg ou plus doivent être dosés selon les recommandations des adultes.
Le comprimé à 250 mg d'AUGMENTIN ne doit pas être utilisé tant que l'enfant ne pèse pas au moins 40 kg, en raison des ratios amoxicilline/acide clavulanique différents dans le comprimé à 250 mg d'AUGMENTIN (250/125) versus le comprimé à croquer à 250 mg d'AUGMENTIN. AUGMENTIN (250/62,5).
Patients atteints d'insuffisance rénale
Les patients dont la fonction rénale est altérée ne nécessitent généralement pas de réduction de dose, sauf si l'insuffisance est sévère. Les patients insuffisants rénaux avec un débit de filtration glomérulaire
Les patients sous hémodialyse doivent recevoir 500 mg ou 250 mg toutes les 24 heures, selon la gravité de l'infection. Ils doivent recevoir une dose supplémentaire pendant et à la fin de la dialyse.
Instructions pour mélanger la suspension orale
Préparer une suspension au moment de la distribution comme suit : Tapoter le flacon jusqu'à ce que toute la poudre s'écoule librement. Ajouter environ 2/3 de la quantité totale d'eau pour la reconstitution (voir tableau 2 ci-dessous) et agiter vigoureusement pour suspendre la poudre. Ajouter le reste de l'eau et agiter à nouveau vigoureusement.
Noter: Bien agiter la suspension buvable avant utilisation. La suspension reconstituée doit être conservée au réfrigérateur et jetée après 10 jours.
COMMENT FOURNIE
Formes posologiques et points forts
Comprimés
- Comprimés à 250 mg/125 mg : Chaque comprimé pelliculé blanc ovale, portant les inscriptions en creux AUGMENTIN 750 mg sur une face et 250/125 sur l'autre, contient 250 mg d'amoxicilline et 125 mg d'acide clavulanique sous forme de sel de potassium.
- Comprimés à 500 mg/125 mg : Chaque comprimé pelliculé ovale blanc, portant les inscriptions en creux AUGMENTIN 125 mg sur une face et 500/125 sur l'autre, contient 500 mg d'amoxicilline et 125 mg d'acide clavulanique sous forme de sel de potassium.
- Comprimés à 875 mg/125 mg : Chaque comprimé blanc sécable en forme de capsule, portant l'inscription AUGMENTIN 875 gravée sur une face et sécable sur l'autre, contient 875 mg d'amoxicilline et 125 mg d'acide clavulanique sous forme de sel de potassium.
Poudre pour suspension orale
- 125 mg/31,25 mg par 5 ml : Poudre pour suspension buvable à saveur de banane (chaque 5 ml de suspension reconstituée contient 125 mg d'amoxicilline et 31,25 mg d'acide clavulanique sous forme de sel de potassium).
- 200 mg/28,5 mg par 5 ml : Poudre pour suspension buvable à l'orange (chaque 5 ml de suspension reconstituée contient 200 mg d'amoxicilline et 28,5 mg d'acide clavulanique sous forme de sel de potassium).
- 250 mg/62,5 mg par 5 ml : Poudre aromatisée à l'orange pour suspension buvable (chaque 5 ml de suspension reconstituée contient 250 mg d'amoxicilline et 62,5 mg d'acide clavulanique sous forme de sel de potassium).
- 400 mg/57 mg par 5 mL Poudre aromatisée à l'orange pour suspension buvable (chaque 5 ml de suspension reconstituée contient 400 mg d'amoxicilline et 57,0 mg d'acide clavulanique sous forme de sel de potassium).
Tablette mastiquables
- Comprimés à croquer de 125 mg/31,25 mg : Chaque comprimé jaune marbré, rond, à saveur de citron et de lime, portant l'inscription BMP 189 en creux, contient 125 mg d'amoxicilline et 31,25 mg d'acide clavulanique sous forme de sel de potassium.
- Comprimés à croquer de 200 mg/28,5 mg : Chaque comprimé rose marbré, rond, biconvexe à saveur de cerise et de banane, portant l'inscription AUGMENTIN 200 en creux, contient 200 mg d'amoxicilline et 28,5 mg d'acide clavulanique sous forme de sel de potassium.
- Comprimés à croquer de 250 mg/62,5 mg : Chaque comprimé jaune marbré, rond, à saveur de citron et de lime, portant l'inscription BMP 190 en creux, contient 250 mg d'amoxicilline et 62,5 mg d'acide clavulanique sous forme de sel de potassium.
- Comprimés à croquer de 400 mg/57 mg : Chaque comprimé rose marbré, rond, biconvexe à saveur de cerise et de banane, portant l'inscription AUGMENTIN 400 en creux, contient 400 mg d'amoxicilline et 57,0 mg d'acide clavulanique sous forme de sel de potassium.
Le comprimé à 250 mg d'AUGMENTIN 750 mg et le comprimé à croquer à 250 mg ne doivent PAS être substitués l'un à l'autre car ils ne sont pas interchangeables et le comprimé à 250 mg ne doit pas être utilisé chez l'enfant de moins de 40 kg. Le comprimé à 250 mg d'AUGMENTIN et le comprimé à croquer à 250 mg ne contiennent pas la même quantité d'acide clavulanique. Le comprimé à 250 mg d'AUGMENTIN contient 125 mg d'acide clavulanique alors que le comprimé à croquer à 250 mg contient 62,5 mg d'acide clavulanique.
Deux comprimés de 250 mg d'AUGMENTIN 750 mg ne doivent PAS remplacer un comprimé de 500 mg d'AUGMENTIN. Les comprimés d'AUGMENTIN à 250 mg et à 500 mg contenant la même quantité d'acide clavulanique (125 mg, sous forme de sel de potassium), deux comprimés à 250 mg d'AUGMENTIN 750 mg ne sont pas équivalents à un comprimé à 500 mg d'AUGMENTIN.
Stockage et manutention
Comprimés
Comprimés à 250 mg/125 mg : Chaque comprimé pelliculé ovale blanc, gravé AUGMENTIN 750 mg sur une face et 250/125 sur l'autre, contient 250 mg d'amoxicilline sous forme de trihydrate et 125 mg d'acide clavulanique sous forme de sel de potassium.
CDN 43598-018-30 bouteilles de 30 CDN 43598-018-78 Dose Unitaire (10x10) 100 comprimés
Comprimés à 500 mg/125 mg : Chaque comprimé pelliculé ovale blanc, portant les inscriptions en creux AUGMENTIN sur une face et 500/125 sur l'autre, contient 500 mg d'amoxicilline sous forme de trihydrate et 125 mg d'acide clavulanique sous forme de sel de potassium.
CDN 43598-006-14 bouteilles de 20 CDN 43598-006-78 Dose Unitaire (10x10) 100 comprimés
Comprimés à 875 mg/125 mg : Chaque comprimé blanc sécable en forme de capsule, portant l'inscription AUGMENTIN 875 gravée sur une face et sécable sur l'autre, contient 875 mg d'amoxicilline sous forme de trihydrate et 125 mg d'acide clavulanique sous forme de sel de potassium.
CDN 43598-021-14 bouteilles de 20 CDN 43598-021-78 Dose unitaire (10x10) 100 comprimés
Poudre pour suspension orale : 125 mg/31,25 mg pour 5 mL : Poudre pour suspension buvable à saveur de banane (chaque 5 ml de suspension reconstituée contient 125 mg d'amoxicilline et 31,25 mg d'acide clavulanique sous forme de sel de potassium).
CDN 43598-012-51 Flacon de 75 ml CDN 43598-012-52 Flacon de 100 ml CDN 43598-012-53 Flacon de 150 ml
200 mg/28,5 mg par 5 ml : Poudre pour suspension buvable à l'orange (chaque 5 ml de suspension reconstituée contient 200 mg d'amoxicilline et 28,5 mg d'acide clavulanique sous forme de sel de potassium).
CDN 43598-013-50 Flacon de 50 ml CDN 43598-013-51 Flacon de 75 ml CDN 43598-013-52 Flacon de 100 ml
250 mg/62,5 mg par 5 ml : Poudre aromatisée à l'orange pour suspension buvable (chaque 5 ml de suspension reconstituée contient 250 mg d'amoxicilline et 62,5 mg d'acide clavulanique sous forme de sel de potassium).
CDN 43598-004-51 Flacon de 75 ml CDN 43598-004-52 Flacon de 100 ml CDN 43598-004-53 Flacon de 150 ml
400 mg/57 mg par 5 mL Poudre aromatisée à l'orange pour suspension buvable (chaque 5 ml de suspension reconstituée contient 400 mg d'amoxicilline et 57,0 mg d'acide clavulanique sous forme de sel de potassium).
CDN 43598-008-50 Flacon de 50 ml CDN 43598-008-51 Flacon de 75 ml CDN 43598-008-52 Flacon de 100 ml
Comprimés à croquer : 125 mg/31,25 mg Comprimés à croquer : Chaque comprimé jaune marbré, rond, à saveur de citron et de lime, portant l'inscription BMP 189 en creux, contient 125 mg d'amoxicilline et 31,25 mg d'acide clavulanique sous forme de sel de potassium.
CDN 43598-014-31 carton de 30 (5x6) comprimés
Comprimés à croquer de 200 mg/28,5 mg : Chaque comprimé rose marbré, rond, biconvexe, à saveur de cerise-banane, portant l'inscription AUGMENTIN 200 en creux, contient 200 mg d'amoxicilline et 28,5 mg d'acide clavulanique sous forme de sel de potassium.
CDN 43598-015-14 carton de 20 comprimés
Comprimés à croquer de 250 mg/62,5 mg : Chaque comprimé jaune marbré, rond, à saveur de citron-lime, portant l'inscription BMP 190 en creux, contient 250 mg d'amoxicilline et 62,5 mg d'acide clavulanique sous forme de sel de potassium.
CDN 43598-016-31 carton de 30 (5x6) comprimés
Comprimés à croquer de 400 mg/57 mg : Chaque comprimé rose marbré, rond, biconvexe, à saveur de cerise-banane, portant l'inscription AUGMENTIN 400 en creux, contient 400 mg d'amoxicilline et 57,0 mg d'acide clavulanique sous forme de sel de potassium.
CDN 43598-017-14 boîte de 20 comprimés
Distribuer dans le récipient d'origine.
Conservez les comprimés et la poudre sèche à ou en dessous de 25°C (77°F).
Conserver la suspension reconstituée au réfrigérateur. Jeter la suspension inutilisée après 10 jours. Garder hors de la portée des enfants.
RÉFÉRENCES
1. Swanson-Biearman B, Dean BS, Lopez G, Krenzelok EP. Les effets de l'ingestion de pénicilline et de céphalosporine chez les enfants de moins de six ans.Vet Hum Toxicol. 1988; 30 : 66 67.
2. Institut des normes cliniques et de laboratoire (CLSI). Méthodes de dilution des tests de sensibilité aux antimicrobiens pour les bactéries à croissance aérobie ; Norme approuvée - 8ème. Document CLSI M7-A9. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
3. Institut des normes cliniques et de laboratoire (CLSI). Norme de performance pour les tests de sensibilité aux disques antimicrobiens ; Norme approuvée - 11e. Document CLSI M2-A11. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
4. CLSI. Normes de performance pour les tests de sensibilité aux antimicrobiens : 22e supplément d'information. Document CLSI M100-S22. CLSI, Wayne, Pennsylvanie, 2012.
Distribué par : Dr. Reddy's Laboratories Inc. Bridgewater, NJ 08807. Révisé : mars 2013
EFFETS SECONDAIRES
Les éléments suivants sont abordés plus en détail dans d'autres sections de l'étiquetage :
- Réactions anaphylactiques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Dysfonction hépatique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- CDAD [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience d'essai clinique
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Les effets indésirables les plus fréquemment rapportés étaient la diarrhée/selles molles (9 %), les nausées (3 %), les éruptions cutanées et l'urticaire (3 %), les vomissements (1 %) et la vaginite (1 %). Moins de 3 % des patients ont interrompu le traitement en raison d'effets indésirables liés au médicament. L'incidence globale des effets indésirables, et en particulier de la diarrhée, a augmenté avec la dose recommandée plus élevée. D'autres effets indésirables moins fréquemment rapportés (
Chez des patients pédiatriques (âgés de 2 mois à 12 ans), 1 essai clinique américain/canadien a été mené qui a comparé 45/6,4 mg/kg/jour (à répartir toutes les 12 heures) d'AUGMENTIN pendant 10 jours versus 40/10 mg/kg/jour (à répartir toutes les 8 heures) d'AUGMENTIN 125mg pendant 10 jours dans le traitement des otites moyennes aiguës. Au total, 575 patients ont été recrutés et seules les formulations en suspension ont été utilisées dans cet essai. Dans l'ensemble, les effets indésirables observés étaient comparables à ceux notés ci-dessus ; cependant, il y avait des différences dans les taux de diarrhée, d'éruptions cutanées/urticaire et d'éruptions cutanées. [Voir Etudes cliniques ]
Expérience post-commercialisation
En plus des effets indésirables rapportés lors des essais cliniques, les effets indésirables suivants ont été identifiés au cours de l'utilisation post-commercialisation d'AUGMENTIN. Parce qu'ils sont signalés volontairement à partir d'une population de taille inconnue, les estimations de fréquence ne peuvent pas être faites. Ces événements ont été choisis pour inclusion en raison d'une combinaison de leur gravité, de leur fréquence de déclaration ou de leur lien de causalité potentiel avec AUGMENTIN.
Gastro-intestinal
Indigestion, gastrite, stomatite, glossite, langue noire « poilue », candidose cutanéo-muqueuse, entérocolite et colite hémorragique/pseudomembraneuse. L'apparition de symptômes de colite pseudomembraneuse peut survenir pendant ou après un traitement antibiotique. [voir AVERTISSEMENTS ET PRECAUTIONS ]
Réactions d'hypersensibilité
Prurit, œdème de Quincke, réactions de type maladie sérique (urticaire ou éruption cutanée accompagnée d'arthrite, d'arthralgie, de myalgie et fréquemment de fièvre), érythème polymorphe, syndrome de Stevens Johnson, pustulose exanthématique aiguë généralisée, vascularite d'hypersensibilité et cas de dermatite exfoliative (y compris nécrolyse) ont été rapportés. [voir AVERTISSEMENTS ET PRECAUTIONS ]
Foie
Un dysfonctionnement hépatique, y compris une hépatite et un ictère cholestatique, des augmentations des transaminases sériques (AST et/ou ALT), de la bilirubine sérique et/ou de la phosphatase alcaline, ont été rapportés avec AUGMENTIN. Il a été rapporté plus fréquemment chez les personnes âgées, chez les hommes ou chez les patients sous traitement prolongé. Les résultats histologiques de la biopsie hépatique ont consisté en un traitement principalement cholestatique. Les résultats histologiques de la biopsie hépatique ont consisté en des modifications hépatocellulaires principalement cholestatiques, hépatocellulaires ou mixtes cholestatiques. L'apparition de signes/symptômes de dysfonctionnement hépatique peut survenir pendant ou plusieurs semaines après l'arrêt du traitement. Le dysfonctionnement hépatique, qui peut être sévère, est généralement réversible. Des décès ont été signalés. [voir CONTRE-INDICATIONS , AVERTISSEMENTS ET PRECAUTIONS ]
Rénal
Une néphrite interstitielle, une hématurie et une cristallurie ont été rapportées. [voir SURDOSAGE ]

Systèmes sanguin et lymphatique
L'anémie, y compris l'anémie hémolytique, la thrombocytopénie, le purpura thrombocytopénique, l'éosinophilie, la leucopénie et l'agranulocytose ont été rapportées. Ces réactions sont généralement réversibles à l'arrêt du traitement et sont considérées comme des phénomènes d'hypersensibilité. Une thrombocytose a été notée chez moins de 1% des patients traités par AUGMENTIN. Des cas d'augmentation du temps de prothrombine ont été rapportés chez des patients recevant simultanément AUGMENTIN 125 mg et un traitement anticoagulant. [voir INTERACTIONS MÉDICAMENTEUSES ]
Système nerveux central
Des cas d'agitation, d'anxiété, de changements de comportement, de confusion, de convulsions, d'étourdissements, d'insomnie et d'hyperactivité réversible ont été signalés.
Divers
Une décoloration des dents (taches brunes, jaunes ou grises) a été signalée. La plupart des rapports sont survenus chez des patients pédiatriques. La décoloration a été réduite ou éliminée avec le brossage ou le nettoyage dentaire dans la plupart des cas.
INTERACTIONS MÉDICAMENTEUSES
Probénécide
Le probénécide diminue la sécrétion tubulaire rénale de l'amoxicilline mais ne retarde pas l'excrétion rénale de l'acide clavulanique. L'utilisation concomitante d'AUGMENTIN 875 mg peut entraîner une augmentation et une prolongation des concentrations sanguines d'amoxicilline. L'administration concomitante de probénécide n'est pas recommandée.
Anticoagulants oraux
Un allongement anormal du temps de prothrombine (augmentation du rapport international normalisé [INR]) a été rapporté chez des patients recevant de l'amoxicilline et des anticoagulants oraux. Une surveillance appropriée doit être entreprise lorsque des anticoagulants sont prescrits en même temps qu'AUGMENTIN. Des ajustements de la dose d'anticoagulants oraux peuvent être nécessaires pour maintenir le niveau d'anticoagulation souhaité.
Allopurinol
L'administration concomitante d'allopurinol et d'amoxicilline augmente l'incidence des éruptions cutanées chez les patients recevant les deux médicaments par rapport aux patients recevant de l'amoxicilline seule. On ne sait pas si cette potentialisation des éruptions d'amoxicilline est due à l'allopurinol ou à l'hyperuricémie présente chez ces patients.
Contraceptifs oraux
AUGMENTIN 750 mg peut affecter la flore intestinale, entraînant une diminution de la réabsorption des œstrogènes et une diminution de l'efficacité des contraceptifs oraux combinés œstrogène/progestérone.
Effets sur les tests de laboratoire
Des concentrations élevées d'amoxicilline dans l'urine peuvent entraîner des réactions faussement positives lors du test de la présence de glucose dans l'urine à l'aide de CLINITEST®, de la solution de Benedict ou de la solution de Fehling. Cet effet pouvant également survenir avec AUGMENTIN, il est recommandé d'utiliser des tests de glycémie basés sur des réactions enzymatiques de glucose oxydase.
Suite à l'administration d'amoxicilline à des femmes enceintes, une diminution transitoire de la concentration plasmatique d'estriol conjugué total, d'estriol-glucuronide, d'estrone conjuguée et d'estradiol a été notée.
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Réactions d'hypersensibilité
Des réactions d'hypersensibilité (anaphylactiques) graves et parfois mortelles ont été signalées chez des patients recevant des bêta-lactamines, y compris AUGMENTIN. Ces réactions sont plus susceptibles de se produire chez les personnes ayant des antécédents d'hypersensibilité à la pénicilline et/ou des antécédents de sensibilité à de multiples allergènes. Avant d'initier un traitement par AUGMENTIN 250 mg, une enquête approfondie doit être effectuée concernant les réactions d'hypersensibilité antérieures aux pénicillines, aux céphalosporines ou à d'autres allergènes. En cas de réaction allergique, AUGMENTIN doit être arrêté et un traitement approprié instauré.
Dysfonctionnement hépatique
Un dysfonctionnement hépatique, y compris une hépatite et un ictère cholestatique, a été associé à l'utilisation d'AUGMENTIN. La toxicité hépatique est généralement réversible; cependant, des décès ont été signalés. La fonction hépatique doit être surveillée à intervalles réguliers chez les patients insuffisants hépatiques.
Diarrhée associée à Clostridium difficile (DACD)
Des diarrhées associées à Clostridium difficile (DACD) ont été signalées avec l'utilisation de presque tous les agents antibactériens, y compris AUGMENTIN 250 mg, et leur gravité peut varier d'une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens altère la flore normale du côlon, entraînant une prolifération de C. difficile.
C. difficile produit les toxines A et B qui contribuent au développement de CDAD. Les souches de C. difficile productrices d'hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée suite à l'utilisation d'antibactériens. Des antécédents médicaux minutieux sont nécessaires car il a été rapporté que la DACD survient plus de 2 mois après l'administration d'agents antibactériens.
Si la CDAD est suspectée ou confirmée, l'utilisation continue d'antibactériens non dirigés contre C. difficile peut devoir être interrompue. Une gestion appropriée des liquides et des électrolytes, une supplémentation en protéines, un traitement antibactérien de C. difficile et une évaluation chirurgicale doivent être institués selon les indications cliniques.
Éruption cutanée chez les patients atteints de mononucléose
Un pourcentage élevé de patients atteints de mononucléose qui reçoivent de l'amoxicilline développent une éruption cutanée érythémateuse. Ainsi, AUGMENTIN ne doit pas être administré aux patients atteints de mononucléose.
Potentiel de prolifération microbienne
La possibilité de surinfections par des agents pathogènes fongiques ou bactériens doit être envisagée pendant le traitement. En cas de surinfection, l'association amoxicilline/clavulanate de potassium doit être interrompue et un traitement approprié instauré.
Phénylcétonuriques
AUGMENTIN 500 mg comprimés à croquer et AUGMENTIN poudre pour solution buvable contiennent de l'aspartam qui contient de la phénylalanine. Chaque comprimé à croquer de 200 mg d'AUGMENTIN 750 mg contient 2,1 mg de phénylalanine ; chaque comprimé à croquer de 400 mg contient 4,2 mg de phénylalanine ; chaque 5 mL de suspension buvable à 200 mg/5 mL ou à 400 mg/5 mL contient 7 mg de phénylalanine. Les autres formulations d'AUGMENTIN 875mg ne contiennent pas de phénylalanine.
Développement de bactéries résistantes aux médicaments
La prescription d'AUGMENTIN 250 mg en l'absence d'infection bactérienne avérée ou fortement suspectée est peu susceptible d'apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes aux médicaments.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune étude à long terme chez l'animal n'a été réalisée pour évaluer le potentiel carcinogène.
AUGMENTIN (formulation amoxicilline/acide clavulanique dans un rapport de 4:1) s'est avéré non mutagène dans le test de mutation bactérienne d'Ames et le test de conversion génique de levure. AUGMENTIN était faiblement positif dans le test du lymphome de souris, mais la tendance à l'augmentation des fréquences de mutation dans ce test s'est produite à des doses qui étaient également associées à une diminution de la survie des cellules. AUGMENTIN s'est révélé négatif au test du micronoyau chez la souris et au test de létalité dominante chez la souris. Le clavulanate de potassium seul a été testé dans le test de mutation bactérienne d'Ames et dans le test du micronoyau chez la souris, et s'est révélé négatif dans chacun de ces tests.
AUGMENTIN (formulation amoxicilline/acide clavulanique dans un rapport de 2:1) à des doses orales allant jusqu'à 1 200 mg/kg/jour n'a eu aucun effet sur la fertilité et les performances de reproduction chez le rat. Basée sur la surface corporelle, cette dose d'amoxicilline est environ 4 fois la dose orale maximale recommandée chez l'homme adulte (875 mg toutes les 12 heures). Pour le clavulanate, le multiple de dose est environ 9 fois supérieur à la dose orale maximale recommandée chez l'homme adulte (125 mg toutes les 8 heures), également basée sur la surface corporelle.
Utilisation dans des populations spécifiques
Grossesse
Effets tératogènes
Catégorie de grossesse B. Les études de reproduction réalisées chez des rats et des souris gravides ayant reçu AUGMENTIN (formulation amoxicilline/acide clavulanique dans un rapport 2:1) à des doses orales allant jusqu'à 1 200 mg/kg/jour n'ont révélé aucun effet nocif sur le fœtus dû à AUGMENTIN. Les doses d'amoxicilline chez les rats et les souris (basées sur la surface corporelle) étaient environ 4 et 2 fois la dose orale maximale recommandée chez l'homme adulte (875 mg toutes les 12 heures). Pour clavulanate, ces multiples de dose étaient environ 9 et 4 fois la dose orale humaine adulte recommandée maximum (125 mgs toutes les 8 heures). Il n'y a cependant pas d'études adéquates et bien contrôlées chez les femmes enceintes. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Travail et accouchement
Les antibiotiques oraux de la classe de l'ampicilline sont mal absorbés pendant le travail. On ne sait pas si l'utilisation d'amoxicilline/clavulanate de potassium chez l'homme pendant le travail ou l'accouchement a des effets indésirables immédiats ou différés sur le fœtus, prolonge la durée du travail ou augmente la probabilité de la nécessité d'une intervention obstétricale.
Mères allaitantes
Il a été démontré que l'amoxicilline est excrétée dans le lait maternel. L'utilisation d'amoxicilline/clavulanate de potassium par les mères qui allaitent peut entraîner une sensibilisation des nourrissons. La prudence s'impose lors de l'administration d'amoxicilline/clavulanate de potassium à une femme qui allaite.
Utilisation pédiatrique
La sécurité et l'efficacité d'AUGMENTIN poudre pour suspension buvable et comprimés à croquer ont été établies chez les patients pédiatriques. L'utilisation d'AUGMENTIN 125 mg chez les patients pédiatriques est étayée par des preuves issues d'études sur les comprimés AUGMENTIN chez l'adulte et des données supplémentaires provenant d'une étude sur la poudre pour suspension buvable AUGMENTIN chez des patients pédiatriques âgés de 2 mois à 12 ans atteints d'otite moyenne aiguë. [voir Etudes cliniques ]
En raison d'une fonction rénale incomplètement développée chez les nouveau-nés et les jeunes nourrissons, l'élimination de l'amoxicilline peut être retardée ; l'élimination du clavulanate est inchangée dans ce groupe d'âge. La posologie d'AUGMENTIN 500 mg doit être modifiée chez les patients pédiatriques âgés de DOSAGE ET ADMINISTRATION ]
Utilisation gériatrique
Sur les 3 119 patients inclus dans une analyse des études cliniques d'AUGMENTIN, 32 % avaient ≥ 65 ans et 14 % avaient ≥ 75 ans. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue.
Ce médicament est connu pour être en grande partie excrété par les reins, et le risque de réactions indésirables à ce médicament peut être plus élevé chez les patients présentant une insuffisance rénale. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises lors du choix de la dose et il peut être utile de surveiller la fonction rénale.
Posologie en cas d'insuffisance rénale
L'amoxicilline est principalement éliminée par les reins et un ajustement posologique est généralement nécessaire chez les patients présentant une insuffisance rénale sévère (DFG Patients atteints d'insuffisance rénale pour des recommandations spécifiques chez les patients insuffisants rénaux.
SURDOSAGE
En cas de surdosage, interrompez le traitement, traitez de manière symptomatique et mettez en place des mesures de soutien au besoin. Une étude prospective de 51 patients pédiatriques dans un centre antipoison a suggéré que des surdosages inférieurs à 250 mg/kg d'amoxicilline ne sont pas associés à des symptômes cliniques significatifs1.
Une néphrite interstitielle entraînant une insuffisance rénale oligurique a été rapportée chez des patients après un surdosage avec l'amoxicilline/acide clavulanique potassique.
Une cristallurie, entraînant dans certains cas une insuffisance rénale, a également été rapportée après un surdosage d'amoxicilline/acide clavulanique potassique chez des patients adultes et pédiatriques. En cas de surdosage, un apport hydrique adéquat et une diurèse doivent être maintenus pour réduire le risque de cristallurie amoxicilline/clavulanate de potassium. L'insuffisance rénale semble être réversible avec l'arrêt de l'administration du médicament. Des taux sanguins élevés peuvent survenir plus facilement chez les patients présentant une insuffisance rénale en raison d'une diminution de la clairance rénale de l'amoxicilline/clavulanate de potassium. L'amoxicilline/clavulanate de potassium peut être retirée de la circulation par hémodialyse. [voir DOSAGE ET ADMINISTRATION ]
CONTRE-INDICATIONS
Réactions d'hypersensibilité graves
AUGMENTIN est contre-indiqué chez les patients ayant des antécédents de réactions d'hypersensibilité graves (p. ex., anaphylaxie ou syndrome de Stevens-Johnson) à l'amoxicilline, au clavulanate ou à d'autres médicaments antibactériens bêta-lactamines (p. ex., pénicillines et céphalosporines).
Ictère cholestatique/dysfonctionnement hépatique
AUGMENTIN 250 mg est contre-indiqué chez les patients ayant des antécédents d'ictère cholestatique/dysfonctionnement hépatique associés à AUGMENTIN.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
AUGMENTIN est un médicament antibactérien. [voir Microbiologie ]
Pharmacocinétique
Les paramètres pharmacocinétiques moyens de l'amoxicilline et du clavulanate de potassium chez l'adulte normal après administration d'AUGMENTIN 250 mg comprimés sont présentés dans le tableau 3 et après l'administration d'AUGMENTIN 250 mg poudre pour suspension buvable et comprimés à croquer sont présentés dans le tableau 4.
L'administration orale de 5 mL de suspension à 250 mg/5 mL d'AUGMENTIN ou de la dose équivalente de 10 mL de suspension à 125 mg/5 mL d'AUGMENTIN fournit des concentrations sériques maximales moyennes environ 1 heure après l'administration de 6,9 mcg/mL pour l'amoxicilline et 1,6 mcg /mL pour l'acide clavulanique. Les aires sous les courbes de concentration sérique obtenues au cours des 4 premières heures suivant l'administration étaient de 12,6 mcg*h/mL pour l'amoxicilline et de 2,9 mcg*h/mL pour l'acide clavulanique lorsque 5 mL de suspension à 250 mg/5 mL d'AUGMENTIN ou d'une dose équivalente de 10 mL de suspension à 125 mg/5 mL d'AUGMENTIN ont été administrés à des adultes sains. Un comprimé à croquer de 250 mg d'AUGMENTIN ou deux comprimés à croquer de 125 mg d'AUGMENTIN équivalent à 5 ml de suspension d'AUGMENTIN à 250 mg/5 ml et fournissent des concentrations sériques similaires d'amoxicilline et d'acide clavulanique.
Les concentrations sériques d'amoxicilline atteintes avec AUGMENTIN 250 mg sont similaires à celles obtenues par l'administration orale de doses équivalentes d'amoxicilline seule. Il a été démontré que le temps au-dessus de la concentration minimale inhibitrice de 1 mcg/mL pour l'amoxicilline était similaire après des schémas posologiques correspondants toutes les 12 heures et toutes les 8 heures d'AUGMENTIN 250 mg chez les adultes et les enfants.
Absorption
L'administration à jeun ou à jeun a un effet minime sur la pharmacocinétique de l'amoxicilline. Bien qu'AUGMENTIN puisse être administré sans tenir compte des repas, l'absorption du clavulanate de potassium lorsqu'il est pris avec de la nourriture est plus importante par rapport à l'état à jeun. Dans une étude, la biodisponibilité relative du clavulanate était réduite lorsqu'AUGMENTIN était administré 30 et 150 minutes après le début d'un petit-déjeuner riche en graisses.
Distribution
Aucun des composants d'AUGMENTIN n'est fortement lié aux protéines ; l'acide clavulanique est lié à environ 25 % au sérum humain et l'amoxicilline à environ 18 %. L'amoxicilline se diffuse facilement dans la plupart des tissus et fluides corporels à l'exception du cerveau et du liquide céphalo-rachidien.
Deux heures après l'administration orale d'une dose unique de 35 mg/kg de suspension d'AUGMENTIN 500 mg à des enfants à jeun, des concentrations moyennes de 3 mcg/mL d'amoxicilline et de 0,5 mcg/mL d'acide clavulanique ont été détectées dans les épanchements de l'oreille moyenne.
Métabolisme et excrétion
La demi-vie de l'amoxicilline après administration orale d'AUGMENTIN 125 mg est de 1,3 heure et celle de l'acide clavulanique est de 1 heure.
Environ 50 % à 70 % de l'amoxicilline et environ 25 % à 40 % de l'acide clavulanique sont excrétés sous forme inchangée dans les urines au cours des 6 premières heures suivant l'administration d'un seul comprimé de 250 mg ou 500 mg d'AUGMENTIN.
Microbiologie
L'amoxicilline est un antibiotique semi-synthétique ayant une activité bactéricide in vitro contre les bactéries Gram-positives et Gram-négatives. L'amoxicilline est cependant sensible à la dégradation par les bêta-lactamases et, par conséquent, le spectre d'activité n'inclut pas les organismes qui produisent ces enzymes. L'acide clavulanique est un bêta-lactamine, structurellement apparenté aux pénicillines, qui possède la capacité d'inactiver certaines enzymes bêta-lactamases couramment présentes dans les micro-organismes résistants aux pénicillines et aux céphalosporines. En particulier, il a une bonne activité contre les bêtalactamases à médiation plasmidique cliniquement importantes fréquemment responsables de la résistance aux médicaments transférée.
La formulation d'amoxicilline et d'acide clavulanique dans AUGMENTIN protège l'amoxicilline de la dégradation par certaines enzymes bêta-lactamases et étend le spectre antibiotique de l'amoxicilline pour inclure de nombreuses bactéries normalement résistantes à l'amoxicilline.
L'amoxicilline/acide clavulanique s'est avérée active contre la plupart des isolats des bactéries suivantes, à la fois in vitro et dans les infections cliniques, comme décrit dans la section INDICATIONS ET UTILISATION.
Bactéries Gram-positives
Staphylococcus aureus
Bactéries Gram-négatives
Espèce Enterobacter Escherichia coli Haemophilus influenzae Espèce Klebsiella Moraxella catarrhalis
Les données in vitro suivantes sont disponibles, mais leur importance clinique est inconnue . Au moins 90 % des bactéries suivantes présentent une concentration minimale inhibitrice (CMI) in vitro inférieure ou égale au seuil de sensibilité pour l'amoxicilline/acide clavulanique. Cependant, l'efficacité de l'amoxicilline/acide clavulanique dans le traitement des infections cliniques dues à ces bactéries n'a pas été établie dans des essais cliniques adéquats et bien contrôlés.
Bactéries Gram-positives
Enterococcus faecalis Staphylococcus epidermidis Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes Groupe Viridans Streptococcus
Bactéries Gram-négatives
Eikenellacorrodens Proteus mirabilis
Bactéries anaérobies
Espèces Bacteroides dont Bacteroides fragilis Espèces Fusobacterium Espèces Peptostreptococcus
Méthodes de test de sensibilité
Lorsqu'ils sont disponibles, le laboratoire de microbiologie clinique doit fournir au médecin les résultats des tests de sensibilité in vitro pour les produits médicamenteux antimicrobiens utilisés dans les hôpitaux résidents sous forme de rapports périodiques décrivant le profil de sensibilité des agents pathogènes nosocomiaux et d'origine communautaire. Ces rapports devraient aider le médecin à choisir un médicament antibactérien pour le traitement.
Techniques de dilution
Des méthodes quantitatives sont utilisées pour déterminer les concentrations minimales inhibitrices (CMI) des antimicrobiens. Ces CMI fournissent des estimations de la sensibilité des bactéries aux composés antimicrobiens. Les CMI doivent être déterminées à l'aide d'une méthode de test normalisée2,3 (bouillon et/ou gélose). Les valeurs de CMI doivent être interprétées selon les critères fournis dans le tableau 5.
Techniques de diffusion
Les méthodes quantitatives qui nécessitent la mesure des diamètres de zone peuvent également fournir des estimations reproductibles de la sensibilité des bactéries aux composés antimicrobiens. La taille de la zone fournit une estimation de la sensibilité des bactéries aux composés antimicrobiens. La taille de la zone doit être déterminée à l'aide d'une méthode de test normalisée3,4. Cette procédure utilise des disques de papier imprégnés de 30 mcg d'amoxicilline/acide clavulanique (20 mcg d'amoxicilline plus 10 mcg d'acide clavulanique) pour tester la sensibilité des bactéries à l'amoxicilline/acide clavulanique. Les critères d'interprétation de la diffusion du disque sont fournis dans le tableau 5.
Contrôle de qualité
Les procédures de test de sensibilité standardisées nécessitent l'utilisation de contrôles de laboratoire pour surveiller et garantir l'exactitude et la précision des fournitures et des réactifs utilisés dans le test, ainsi que les techniques des personnes réalisant le test2,3,4. La poudre d'amoxicilline/acide clavulanique standard doit fournir la plage suivante de valeurs de CMI indiquées dans le tableau 6 pour la technique de diffusion utilisant le disque de 30 mcg d'amoxicilline/acide clavulanique (20 mcg d'amoxicilline plus 10 mcg d'acide clavulanique), les critères du tableau 6 doivent être atteints .
Etudes cliniques
Infections des voies respiratoires inférieures et des voies urinaires compliquées
Les données de 2 essais pivots portant sur 1 191 patients traités pour des infections des voies respiratoires inférieures ou des infections urinaires compliquées ont comparé un schéma posologique d'AUGMENTIN comprimés à 875 mg toutes les 12 heures à des comprimés à 500 mg d'AUGMENTIN 125 mg administrés toutes les 8 heures (respectivement 584 et 607 patients ). Une efficacité comparable a été démontrée entre les schémas posologiques toutes les 12 heures et toutes les 8 heures. Il n'y avait pas de différence significative dans le pourcentage d'événements indésirables dans chaque groupe. L'événement indésirable le plus fréquemment signalé était la diarrhée; les taux d'incidence étaient similaires pour les schémas posologiques de 875 mg toutes les 12 heures et de 500 mg toutes les 8 heures (15 % et 14 %, respectivement) ; cependant, il y avait une différence statistiquement significative (p
Dans l'un de ces essais pivots, les patients atteints soit de pyélonéphrite (n = 361) soit d'une infection compliquée des voies urinaires (c'est-à-dire des patients présentant des anomalies des voies urinaires qui prédisposent à la rechute de la bactériurie après l'éradication, n = 268) ont été randomisés (1 : 1) recevoir soit des comprimés à 875 mg d'AUGMENTIN 125 mg toutes les 12 heures (n = 308) soit des comprimés à 500 mg d'AUGMENTIN toutes les 8 heures (n = 321).
Le nombre de patients bactériologiquement évaluables était comparable entre les deux schémas posologiques. AUGMENTIN 250 mg a produit des taux de succès bactériologiques comparables chez les patients évalués 2 à 4 jours immédiatement après la fin du traitement. Les taux d'efficacité bactériologique étaient comparables lors de l'une des visites de suivi (5 à 9 jours après le traitement) et lors d'une visite tardive après le traitement (dans la majorité des cas, il s'agissait de 2 à 4 semaines après le traitement), comme le montre le tableau sept.
Comme indiqué précédemment, bien qu'il n'y ait pas eu de différence significative dans le pourcentage d'événements indésirables dans chaque groupe, il y avait une différence statistiquement significative dans les taux de diarrhée sévère ou d'arrêts avec diarrhée entre les régimes.
Otite moyenne bactérienne aiguë et diarrhée chez les patients pédiatriques
Un essai clinique américain/canadien a été mené comparant 45/6,4 mg/kg/jour (à répartir toutes les 12 heures) d'AUGMENTIN pendant 10 jours à 40/10 mg/kg/jour (à répartir toutes les 8 heures) d'AUGMENTIN pendant 10 jours chez le traitement des otites moyennes aiguës. Seules les formulations en suspension ont été utilisées dans cet essai. Un total de 575 patients pédiatriques (âgés de 2 mois à 12 ans) ont été recrutés, avec une répartition égale entre les 2 groupes de traitement et un nombre comparable de patients évaluables (c'est-à-dire ³ 84 %) par groupe de traitement. Des critères spécifiques à l'otite moyenne étaient requis pour l'éligibilité et une forte corrélation a été trouvée à la fin du traitement et du suivi entre ces critères et l'évaluation par le médecin de la réponse clinique. Les taux d'efficacité clinique à la fin de la visite de traitement (définie comme 2 à 4 jours après la fin du traitement) et lors de la visite de suivi (définie comme 22 à 28 jours après la fin du traitement) étaient comparables pour les 2 groupes de traitement, les suivants taux de guérison obtenus pour les patients évaluables : à la fin du traitement, 87 % (n = 265) et 82 % (n = 260) pour 45 mg/kg/jour toutes les 12 heures et 40 mg/kg/jour toutes les 8 heures, respectivement . Au suivi, 67 % (n = 249) et 69 % (n = 243) pour 45 mg/kg/jour toutes les 12 heures et 40 mg/kg/jour toutes les 8 heures, respectivement.
La diarrhée a été définie comme suit : (a) 3 selles liquides ou plus ou 4 selles molles ou plus liquides en 1 jour ; OU (b) 2 selles liquides par jour ou 3 selles molles/liquides par jour pendant 2 jours consécutifs. L'incidence de la diarrhée était significativement plus faible chez les patients ayant reçu le régime toutes les 12 heures par rapport aux patients ayant reçu le régime toutes les 8 heures (14 % et 34 %, respectivement). De plus, le nombre de patients atteints de diarrhée sévère ou qui ont été retirés du traitement pour diarrhée était significativement plus faible dans le groupe de traitement toutes les 12 heures (3 % et 8 % pour le groupe de traitement toutes les 12 heures/10 jours et toutes les 8 heures/10 jours, respectivement ). Dans le groupe de traitement toutes les 12 heures, 3 patients (1 %) ont été retirés du traitement en raison d'une réaction allergique, tandis qu'un patient du groupe toutes les 8 heures a été retiré pour cette raison. Le nombre de patients présentant une infection candidosique de la zone fessière était de 4 % et 6 % pour les groupes toutes les 12 heures et toutes les 8 heures, respectivement.
On ne sait pas si la constatation d'une réduction statistiquement significative de la diarrhée avec les suspensions buvables dosées toutes les 12 heures, par rapport aux suspensions dosées toutes les 8 heures, peut être extrapolée aux comprimés à croquer. La présence de mannitol dans les comprimés à croquer peut contribuer à un profil de diarrhée différent. Les suspensions buvables toutes les 12 heures (200 mg/5 mL et 400 mg/5 mL) sont édulcorées à l'aspartame.
INFORMATIONS PATIENTS
Les patients doivent être informés qu'AUGMENTIN peut être pris toutes les 8 heures ou toutes les 12 heures, selon la dose prescrite. Chaque dose doit être prise avec un repas ou une collation pour réduire le risque de troubles gastro-intestinaux.
Les patients doivent être informés que les médicaments antibactériens, y compris AUGMENTIN 125 mg, ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsqu'AUGMENTIN est prescrit pour traiter une infection bactérienne, les patients doivent être informés que même s'il est courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut : (1) diminuer l'efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne puissent pas être traitées par AUGMENTIN 250 mg ou d'autres médicaments antibactériens à l'avenir. .
Informez les patients que la diarrhée est un problème courant causé par les antibactériens et qu'elle se termine généralement lorsque l'antibactérien est arrêté. Parfois, après le début du traitement avec des antibactériens, les patients peuvent développer des selles liquides et sanglantes (avec ou sans crampes d'estomac et fièvre) même jusqu'à 2 mois ou plus après avoir pris leur dernière dose d'antibactérien. Si la diarrhée est sévère ou dure plus de 2 ou 3 jours, les patients doivent contacter leur médecin.
Il faut conseiller aux patients de conserver la suspension au réfrigérateur. Bien agiter avant utilisation. Lors de l'administration à un enfant de la suspension (liquide) d'AUGMENTIN 125 mg, utilisez une cuillère doseuse ou un compte-gouttes. Assurez-vous de rincer la cuillère ou le compte-gouttes après chaque utilisation. Les flacons de suspension d'AUGMENTIN peuvent contenir plus de liquide que nécessaire. Suivez les instructions de votre médecin concernant la quantité à utiliser et les jours de traitement dont votre enfant a besoin. Jeter tout médicament non utilisé.
Les patients doivent savoir qu'AUGMENTIN 125 mg contient un médicament de la classe des pénicillines qui peut provoquer des réactions allergiques chez certaines personnes.
