Zyprexa 2.5mg, 5mg, 7.5mg, 10mg, 15mg, 20mg Olanzapine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Zyprexa 10 mg et comment est-il utilisé ?
Zyprexa est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de la schizophrénie et du trouble bipolaire (maniaco-dépression). Zyprexa peut être utilisé seul ou avec d'autres médicaments.
- Zyprexa appartient à une classe de médicaments appelés antipsychotiques, 2e génération, agents antimaniaques.
- On ne sait pas si Zyprexa est sûr et efficace chez les enfants de moins de 13 ans.
Quels sont les effets secondaires possibles du Zyprexa 15 mg ?
Zyprexa peut provoquer des effets secondaires graves, notamment :
- mouvements musculaires incontrôlés de votre visage (mastication, claquement de lèvres, froncement des sourcils, mouvement de la langue, clignement des yeux ou mouvement des yeux),
- difficulté à parler ou à avaler,
- gonflement des mains ou des pieds,
- confusion,
- pensées ou comportements inhabituels,
- hallucinations,
- pensées de se faire du mal,
- faiblesse soudaine ou malaise,
- fièvre,
- des frissons,
- mal de gorge,
- gencives enflées,
- plaies buccales douloureuses,
- douleur à la déglutition,
- plaies cutanées,
- symptômes de rhume ou de grippe,
- toux,
- avoir très soif ou chaud,
- incapacité à uriner,
- transpiration abondante,
- peau chaude ou sèche,
- douleur dans le haut du ventre,
- démangeaison,
- perte d'appétit,
- urine foncée,
- selles de couleur argile,
- jaunissement de la peau ou des yeux (jaunisse),
- augmentation de la soif,
- augmentation de la miction,
- faim,
- bouche sèche,
- odeur d'haleine fruitée,
- somnolence,
- Vision floue,
- perte de poids,
- muscles très raides,
- forte fièvre,
- confusion,
- battements cardiaques rapides ou irréguliers,
- tremblements et
- étourdissement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants du Zyprexa incluent :
- prise de poids (plus fréquente chez les adolescents),
- Augmentation de l'appétit,
- maux de tête,
- vertiges,
- somnolence,
- se sentir fatigué ou agité,
- problèmes d'élocution ou de mémoire,
- tremblements ou secousses,
- engourdissement ou sensation de picotement,
- changements de personnalité,
- bouche sèche,
- augmentation de la salivation,
- Douleur d'estomac,
- la constipation et
- douleur dans les bras ou les jambes
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles du Zyprexa. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
AUGMENTATION DE LA MORTALITÉ CHEZ LES PATIENTS ÂGÉS ATTEINTS DE PSYCHOSE LIÉE À LA DÉMENCE
Les patients âgés atteints de psychose liée à la démence traités avec des médicaments antipsychotiques courent un risque accru de décès. Les analyses de dix-sept essais contrôlés par placebo (durée modale de 10 semaines), en grande partie chez des patients prenant des antipsychotiques atypiques, ont révélé un risque de décès chez les patients traités par médicament compris entre 1,6 et 1,7 fois le risque de décès chez les patients traités par placebo. Au cours d'un essai contrôlé typique de 10 semaines, le taux de décès chez les patients traités par médicament était d'environ 4,5 %, contre un taux d'environ 2,6 % dans le groupe placebo. Bien que les causes de décès aient été variées, la plupart des décès semblaient être de nature cardiovasculaire (p. ex., insuffisance cardiaque, mort subite) ou infectieuse (p. ex., pneumonie). Des études observationnelles suggèrent que, comme pour les médicaments antipsychotiques atypiques, le traitement avec des médicaments antipsychotiques conventionnels peut augmenter la mortalité. La mesure dans laquelle les résultats d'une mortalité accrue dans les études observationnelles peuvent être attribuées au médicament antipsychotique par opposition à certaines caractéristiques des patients n'est pas claire. ZYPREXA (olanzapine) n'est pas approuvé pour le traitement des patients atteints de psychose liée à la démence [voir AVERTISSEMENTS ET PRECAUTIONS et INFORMATIONS PATIENTS ].
Lors de l'utilisation de ZYPREXA 15 mg et de fluoxétine en association, reportez-vous également à la section Avertissement encadré de la notice de Symbyax.
LA DESCRIPTION
ZYPREXA (olanzapine) est un antipsychotique atypique qui appartient à la classe des thiénobenzodiazépines. La désignation chimique est 2-méthyl-4-(4-méthyl-1-pipérazinyl)-10H-thiéno[2,3-b] [1,5]benzodiazépine. La formule moléculaire est C17H20N4S, ce qui correspond à un poids moléculaire de 312,44. La structure chimique est :
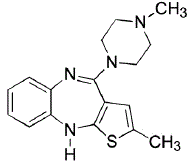
L'olanzapine est un solide cristallin jaune, pratiquement insoluble dans l'eau.
Les comprimés ZYPREXA 7,5 mg sont destinés à une administration orale uniquement.
Chaque comprimé contient de l'olanzapine équivalant à 2,5 mg (8 μmol), 5 mg (16 μmol), 7,5 mg (24 μmol), 10 mg (32 μmol), 15 mg (48 μmol) ou 20 mg (64 μmol). Les ingrédients inactifs sont la cire de carnauba, la crospovidone, l'hydroxypropylcellulose, l'hypromellose, le lactose, le stéarate de magnésium, la cellulose microcristalline et d'autres ingrédients inactifs. Le revêtement de couleur contient du dioxyde de titane (toutes les concentrations), de la laque d'aluminium FD&C bleu n° 2 (15 mg) ou de l'oxyde de fer rouge synthétique (20 mg). Les comprimés de 2,5, 5, 7,5 et 10 mg sont imprimés avec de l'encre comestible qui contient la laque d'aluminium FD&C Blue No. 2.
ZYPREXA 2,5 mg ZYDIS (comprimés d'olanzapine à dissolution orale) est destiné à une administration orale uniquement.
Chaque comprimé à dissolution orale contient de l'olanzapine équivalant à 5 mg (16 μmol), 10 mg (32 μmol), 15 mg (48 μmol) ou 20 mg (64 μmol). Il commence à se désintégrer dans la bouche en quelques secondes, permettant à son contenu d'être ensuite avalé avec ou sans liquide. ZYPREXA 15 mg ZYDIS (comprimés d'olanzapine à dissolution orale) contient également les ingrédients inactifs suivants : gélatine, mannitol, aspartame, méthylparabène sodique et propylparabène sodique.
ZYPREXA 2,5 mg intramusculaire (olanzapine pour injection) est destiné à un usage intramusculaire uniquement.
Chaque flacon permet l'administration de 10 mg (32 μmol) d'olanzapine avec des ingrédients inactifs 50 mg de lactose monohydraté et 3,5 mg d'acide tartrique. De l'acide chlorhydrique et/ou de l'hydroxyde de sodium peuvent avoir été ajoutés lors de la fabrication pour ajuster le pH.
LES INDICATIONS
La schizophrénie
ZYPREXA oral est indiqué pour le traitement de la schizophrénie. L'efficacité a été établie dans trois essais cliniques chez des patients adultes atteints de schizophrénie : deux essais de 6 semaines et un essai d'entretien. Chez les patients adolescents atteints de schizophrénie (âgés de 13 à 17 ans), l'efficacité a été établie dans un essai de 6 semaines [voir Etudes cliniques ].
Au moment de décider parmi les traitements alternatifs disponibles pour les adolescents, les cliniciens doivent tenir compte du potentiel accru (chez les adolescents par rapport aux adultes) de prise de poids et de dyslipidémie. Les cliniciens doivent tenir compte des risques potentiels à long terme lorsqu'ils prescrivent aux adolescents, et dans de nombreux cas, cela peut les amener à envisager de prescrire d'abord d'autres médicaments aux adolescents [voir AVERTISSEMENTS ET PRECAUTIONS ].
Trouble bipolaire I (épisodes maniaques ou mixtes)
Monothérapie
ZYPREXA oral est indiqué pour le traitement aigu des épisodes maniaques ou mixtes associés au trouble bipolaire I et le traitement d'entretien du trouble bipolaire I. L'efficacité a été établie dans trois essais cliniques chez des patients adultes présentant des épisodes maniaques ou mixtes de trouble bipolaire I : deux essais de 3 à 4 semaines et un essai d'entretien en monothérapie. Chez les adolescents présentant des épisodes maniaques ou mixtes associés au trouble bipolaire I (âgés de 13 à 17 ans), l'efficacité a été établie dans un essai de 3 semaines [voir Etudes cliniques ].
Au moment de décider parmi les traitements alternatifs disponibles pour les adolescents, les cliniciens doivent tenir compte du potentiel accru (chez les adolescents par rapport aux adultes) de prise de poids et de dyslipidémie. Les cliniciens doivent tenir compte des risques potentiels à long terme lorsqu'ils prescrivent aux adolescents, et dans de nombreux cas, cela peut les amener à envisager de prescrire d'abord d'autres médicaments aux adolescents [voir AVERTISSEMENTS ET PRECAUTIONS ].
Thérapie d'appoint au lithium ou au valproate
ZYPREXA oral 5 mg est indiqué dans le traitement des épisodes maniaques ou mixtes associés au trouble bipolaire I en complément du lithium ou du valproate. L'efficacité a été établie dans deux essais cliniques de 6 semaines chez l'adulte. L'efficacité du traitement adjuvant pour une utilisation à long terme n'a pas été systématiquement évaluée dans des essais contrôlés [voir Etudes cliniques ].
Considérations particulières dans le traitement de la schizophrénie pédiatrique et du trouble bipolaire I
La schizophrénie pédiatrique et le trouble bipolaire I sont des troubles mentaux graves; cependant, le diagnostic peut être difficile. Pour la schizophrénie pédiatrique, les profils de symptômes peuvent être variables, et pour le trouble bipolaire I, les patients pédiatriques peuvent avoir des schémas variables de périodicité des symptômes maniaques ou mixtes. Il est recommandé de ne commencer le traitement médicamenteux de la schizophrénie pédiatrique et du trouble bipolaire I qu'après avoir effectué une évaluation diagnostique approfondie et accordé une attention particulière aux risques associés au traitement médicamenteux. Le traitement médicamenteux de la schizophrénie pédiatrique et du trouble bipolaire I devrait faire partie d'un programme de traitement global qui comprend souvent des interventions psychologiques, éducatives et sociales.
ZYPREXA 15mg Intra Musculaire : Agitation Associée À La Schizophrénie Et La Manie Bipolaire I
ZYPREXA 15mg IntraMusculaire est indiqué pour le traitement de l'agitation aiguë associée à la schizophrénie et à la manie bipolaire I.
L'efficacité a été démontrée dans 3 essais à court terme (24 heures de traitement IM) contrôlés par placebo chez des patients adultes agités hospitalisés atteints de : schizophrénie ou trouble bipolaire I (épisodes maniaques ou mixtes) [voir Etudes cliniques ].
« L'agitation psychomotrice » est définie dans le DSM-IV comme « une activité motrice excessive associée à une sensation de tension intérieure ». Les patients agités manifestent souvent des comportements qui interfèrent avec leur diagnostic et leurs soins, p.
ZYPREXA et fluoxétine en association : épisodes dépressifs associés au trouble bipolaire I
ZYPREXA oral et la fluoxétine en association sont indiqués pour le traitement des épisodes dépressifs associés au trouble bipolaire I, selon des études cliniques. Lors de l'utilisation de ZYPREXA 10 mg et de fluoxétine en association, reportez-vous à la section Études cliniques de la notice de Symbyax.
ZYPREXA en monothérapie n'est pas indiqué dans le traitement des épisodes dépressifs associés au trouble bipolaire I.
ZYPREXA et fluoxétine en association : dépression résistante au traitement
ZYPREXA oral et la fluoxétine en association sont indiqués pour le traitement de la dépression résistante au traitement (trouble dépressif majeur chez les patients qui ne répondent pas à 2 essais distincts de différents antidépresseurs de dose et de durée adéquates dans l'épisode en cours), sur la base d'études cliniques chez des patients adultes . Lors de l'utilisation de ZYPREXA et de fluoxétine en association, reportez-vous à la section Études cliniques de la notice de Symbyax.
ZYPREXA 5 mg en monothérapie n'est pas indiqué dans le traitement de la dépression résistante au traitement.
DOSAGE ET ADMINISTRATION
La schizophrénie
Adultes
Sélection des doses
L'olanzapine orale doit être administrée en une prise par jour sans tenir compte des repas, en commençant généralement par 5 à 10 mg initialement, avec une dose cible de 10 mg/jour en quelques jours. D'autres ajustements posologiques, s'ils sont indiqués, doivent généralement être effectués à des intervalles d'au moins 1 semaine, car l'état d'équilibre de l'olanzapine ne serait pas atteint avant environ 1 semaine chez le patient type. Lorsque des ajustements posologiques sont nécessaires, des augmentations/diminutions de dose de 5 mg par jour sont recommandées.
L'efficacité dans la schizophrénie a été démontrée dans une gamme de doses de 10 à 15 mg/jour dans des essais cliniques. Cependant, les doses supérieures à 10 mg/jour ne se sont pas avérées plus efficaces que la dose de 10 mg/jour. Une augmentation à une dose supérieure à la dose cible de 10 mg/jour (c'est-à-dire à une dose de 15 mg/jour ou plus) n'est recommandée qu'après une évaluation clinique. L'olanzapine n'est pas indiquée pour une utilisation à des doses supérieures à 20 mg/jour.
Dosage dans les populations particulières
La dose initiale recommandée est de 5 mg chez les patients qui sont affaiblis, qui ont une prédisposition aux réactions hypotensives, qui présentent par ailleurs une combinaison de facteurs pouvant entraîner un ralentissement du métabolisme de l'olanzapine (par exemple, les patientes non fumeuses âgées de ≥ 65 ans), ou qui peuvent être plus pharmacodynamiquement sensibles à l'olanzapine [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES , et PHARMACOLOGIE CLINIQUE ]. Lorsqu'elles sont indiquées, les augmentations de dose doivent être effectuées avec prudence chez ces patients.
Traitement d'entretien
L'efficacité de l'olanzapine orale, 10 mg/jour à 20 mg/jour, dans le maintien de la réponse au traitement chez les patients schizophrènes qui étaient stables sous ZYPREXA depuis environ 8 semaines et qui ont ensuite été suivis en cas de rechute a été démontrée dans un essai contrôlé contre placebo [voir Etudes cliniques ]. Le fournisseur de soins de santé qui choisit d'utiliser ZYPREXA pendant de longues périodes doit réévaluer périodiquement l'utilité à long terme du médicament pour le patient individuel.
Adolescents
Sélection des doses
L'olanzapine orale doit être administrée en une prise par jour sans tenir compte des repas avec une dose initiale recommandée de 2,5 ou 5 mg, avec une dose cible de 10 mg/jour. L'efficacité chez les adolescents atteints de schizophrénie a été démontrée sur la base d'une gamme de doses flexibles de 2,5 à 20 mg/jour dans les essais cliniques, avec une dose modale moyenne de 12,5 mg/jour (dose moyenne de 11,1 mg/jour). Lorsque des ajustements posologiques sont nécessaires, des augmentations/diminutions de dose de 2,5 ou 5 mg sont recommandées.
La sécurité et l'efficacité des doses supérieures à 20 mg/jour n'ont pas été évaluées dans les essais cliniques [voir Etudes cliniques ].
Traitement d'entretien
L'efficacité de ZYPREXA pour le traitement d'entretien de la schizophrénie dans la population adolescente n'a pas été systématiquement évaluée ; cependant, l'efficacité de la maintenance peut être extrapolée à partir des données sur les adultes ainsi que des comparaisons des paramètres pharmacocinétiques de l'olanzapine chez les patients adultes et adolescents. Ainsi, il est généralement recommandé que les patients répondeurs soient poursuivis au-delà de la réponse aiguë, mais à la dose la plus faible nécessaire pour maintenir la rémission. Les patients doivent être réévalués périodiquement pour déterminer la nécessité d'un traitement d'entretien.
Trouble bipolaire I (épisodes maniaques ou mixtes)
Adultes
Sélection de la dose pour la monothérapie
L'olanzapine orale doit être administrée une fois par jour sans tenir compte des repas, en commençant généralement par 10 ou 15 mg. Les ajustements posologiques, s'ils sont indiqués, doivent généralement se produire à des intervalles d'au moins 24 heures, reflétant les procédures des essais contrôlés par placebo. Lorsque des ajustements posologiques sont nécessaires, des augmentations/diminutions de dose de 5 mg par jour sont recommandées.
L'efficacité antimaniaque à court terme (3-4 semaines) a été démontrée dans une gamme de doses de 5 mg à 20 mg/jour dans des essais cliniques. La sécurité des doses supérieures à 20 mg/jour n'a pas été évaluée dans les essais cliniques [voir Etudes cliniques ].
Monothérapie d'entretien
Le bénéfice du maintien des patients bipolaires I en monothérapie par ZYPREXA 10 mg par voie orale à la dose de 5 à 20 mg/jour, après avoir atteint un statut répondeur pendant une durée moyenne de 2 semaines, a été démontré dans un essai contrôlé [voir Etudes cliniques ]. Le fournisseur de soins de santé qui choisit d'utiliser ZYPREXA pendant de longues périodes doit réévaluer périodiquement l'utilité à long terme du médicament pour le patient individuel.
Sélection de la dose pour le traitement d'appoint
Lorsqu'elle est administrée en tant que traitement d'appoint au lithium ou au valproate, l'administration orale d'olanzapine doit généralement commencer par 10 mg une fois par jour, sans tenir compte des repas.
L'efficacité antimaniaque a été démontrée dans une gamme de doses de 5 mg à 20 mg/jour dans des essais cliniques [voir Etudes cliniques ]. La sécurité des doses supérieures à 20 mg/jour n'a pas été évaluée dans les essais cliniques.
Adolescents
Sélection des doses
L'olanzapine orale doit être administrée en une prise par jour sans tenir compte des repas avec une dose initiale recommandée de 2,5 ou 5 mg, avec une dose cible de 10 mg/jour. L'efficacité chez les adolescents atteints de trouble bipolaire I (épisodes maniaques ou mixtes) a été démontrée sur la base d'une gamme de doses flexibles de 2,5 à 20 mg/jour dans les essais cliniques, avec une dose modale moyenne de 10,7 mg/jour (dose moyenne de 8,9 mg/jour ). Lorsque des ajustements posologiques sont nécessaires, des augmentations/diminutions de dose de 2,5 ou 5 mg sont recommandées.
La sécurité et l'efficacité des doses supérieures à 20 mg/jour n'ont pas été évaluées dans les essais cliniques [voir Etudes cliniques ].
Traitement d'entretien
L'efficacité de ZYPREXA 7,5 mg pour le traitement d'entretien du trouble bipolaire I dans la population adolescente n'a pas été évaluée ; cependant, l'efficacité de la maintenance peut être extrapolée à partir des données sur les adultes ainsi que des comparaisons des paramètres pharmacocinétiques de l'olanzapine chez les patients adultes et adolescents. Ainsi, il est généralement recommandé que les patients répondeurs soient poursuivis au-delà de la réponse aiguë, mais à la dose la plus faible nécessaire pour maintenir la rémission. Les patients doivent être réévalués périodiquement pour déterminer la nécessité d'un traitement d'entretien.
Administration de ZYPREXA ZYDIS (comprimés d'olanzapine à dissolution orale)
Après ouverture du sachet, décoller la feuille d'aluminium du blister. Ne poussez pas le comprimé à travers le papier d'aluminium. Immédiatement après l'ouverture de la plaquette, en utilisant les mains sèches, retirez le comprimé et placez ZYPREXA 15mg ZYDIS entier dans la bouche. La désintégration des comprimés se produit rapidement dans la salive, de sorte qu'ils peuvent être facilement avalés avec ou sans liquide.
ZYPREXA Intra Musculaire : Agitation Associée À La Schizophrénie Et La Manie Bipolaire I
Sélection de la dose pour les patients adultes agités atteints de schizophrénie et de manie bipolaire I
L'efficacité de l'olanzapine intramusculaire pour injection dans le contrôle de l'agitation dans ces troubles a été démontrée à une dose comprise entre 2,5 mg et 10 mg. La dose recommandée chez ces patients est de 10 mg. Une dose plus faible de 5 ou 7,5 mg peut être envisagée lorsque des facteurs cliniques le justifient [voir Etudes cliniques ]. Si l'agitation justifiant des doses intramusculaires supplémentaires persiste après la dose initiale, des doses ultérieures allant jusqu'à 10 mg peuvent être administrées. Cependant, l'efficacité de doses répétées d'olanzapine intramusculaire pour injection chez les patients agités n'a pas été systématiquement évaluée dans des essais cliniques contrôlés. De plus, la sécurité des doses quotidiennes totales supérieures à 30 mg ou des injections de 10 mg administrées plus fréquemment que 2 heures après la dose initiale et 4 heures après la deuxième dose n'a pas été évaluée dans les essais cliniques. La posologie maximale d'olanzapine intramusculaire (p. ex., 3 doses de 10 mg administrées à 2 à 4 heures d'intervalle) peut être associée à une survenue importante d'hypotension orthostatique importante [voir AVERTISSEMENTS ET PRECAUTIONS ]. Ainsi, il est recommandé que les patients nécessitant des injections intramusculaires ultérieures soient évalués pour l'hypotension orthostatique avant l'administration de toute dose ultérieure d'olanzapine intramusculaire pour injection. L'administration d'une dose supplémentaire à un patient présentant un changement postural cliniquement significatif de la pression artérielle systolique n'est pas recommandée.
Si un traitement continu par l'olanzapine est cliniquement indiqué, l'olanzapine par voie orale peut être initiée dans une fourchette de 5 à 20 mg/jour dès que cela est cliniquement approprié [voir La schizophrénie et Trouble bipolaire I (épisodes maniaques ou mixtes) ].
Dosage intramusculaire dans des populations particulières
Une dose de 5 mg/injection doit être envisagée chez les patients gériatriques ou lorsque d'autres facteurs cliniques le justifient. Une dose plus faible de 2,5 mg/injection doit être envisagée chez les patients qui pourraient autrement être affaiblis, être prédisposés à des réactions hypotensives ou être plus pharmacodynamiquement sensibles à l'olanzapine [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES , et PHARMACOLOGIE CLINIQUE ].
Administration de ZYPREXA Intra Musculaire
ZYPREXA Intra Musculaire est destiné à un usage intramusculaire uniquement. Ne pas administrer par voie intraveineuse ou sous-cutanée. Injectez lentement, profondément dans la masse musculaire. Les produits médicamenteux parentéraux doivent être inspectés visuellement pour déceler les particules et la décoloration avant l'administration, chaque fois que la solution et le contenant le permettent.
Mode d'emploi pour la préparation de ZYPREXA 2,5 mg intramusculaire avec de l'eau stérile pour injection
Dissoudre le contenu du flacon en utilisant 2,1 mL d'eau stérile pour injection pour obtenir une solution contenant environ 5 mg/mL d'olanzapine. La solution résultante doit apparaître claire et jaune. ZYPREXA 7,5 mg intramusculaire reconstitué avec de l'eau stérile pour injection doit être utilisé immédiatement (dans l'heure qui suit) après la reconstitution. Jeter toute portion inutilisée.
Le tableau suivant indique les volumes d'injection pour l'administration de diverses doses d'olanzapine intramusculaire pour injection reconstituée avec de l'eau stérile pour injection.
Informations sur l'incompatibilité physique
ZYPREXA 15 mg intramusculaire doit être reconstitué uniquement avec de l'eau stérile pour injection. ZYPREXA 20 mg intramusculaire ne doit pas être combiné dans une seringue avec du diazépam injectable car une précipitation se produit lorsque ces produits sont mélangés. L'injection de lorazépam ne doit pas être utilisée pour reconstituer ZYPREXA intramusculaire car cette association retarde le temps de reconstitution. ZYPREXA IntraMuscular ne doit pas être combiné dans une seringue avec l'injection d'halopéridol car il a été démontré que le faible pH qui en résulte dégrade l'olanzapine au fil du temps.
ZYPREXA 20mg Et Fluoxétine En Association : Épisodes Dépressifs Associés Au Trouble Bipolaire I
Lors de l'utilisation de ZYPREXA 7,5 mg et de fluoxétine en association, reportez-vous également à la section Études cliniques de la notice de Symbyax.
Adultes
L'olanzapine orale doit être administrée en association avec la fluoxétine une fois par jour le soir, sans égard aux repas, en commençant généralement par 5 mg d'olanzapine orale et 20 mg de fluoxétine. Des ajustements posologiques, si indiqués, peuvent être effectués en fonction de l'efficacité et de la tolérance dans les fourchettes posologiques d'olanzapine orale 5 à 12,5 mg et de fluoxétine 20 à 50 mg. L'efficacité antidépressive a été démontrée avec ZYPREXA 10 mg et la fluoxétine en association chez des patients adultes avec une gamme de doses d'olanzapine de 6 à 12 mg et de fluoxétine de 25 à 50 mg. La sécurité de la co-administration de doses supérieures à 18 mg d'olanzapine avec 75 mg de fluoxétine n'a pas été évaluée dans les études cliniques.
Enfants et adolescents (10-17 ans)
L'olanzapine orale doit être administrée en association avec la fluoxétine une fois par jour le soir, sans égard aux repas, en commençant généralement par 2,5 mg d'olanzapine orale et 20 mg de fluoxétine. Des ajustements posologiques, si indiqués, peuvent être effectués en fonction de l'efficacité et de la tolérance. La sécurité de la co-administration de doses supérieures à 12 mg d'olanzapine avec 50 mg de fluoxétine n'a pas été évaluée dans les études cliniques pédiatriques.
L'innocuité et l'efficacité de ZYPREXA et de la fluoxétine en association ont été déterminées dans des essais cliniques soutenant l'approbation de Symbyax (association à dose fixe de ZYPREXA et de fluoxétine). Symbyax est dosé entre 3 mg/25 mg (olanzapine/fluoxétine) par jour et 12 mg/50 mg (olanzapine/fluoxétine) par jour. Le tableau suivant montre les doses individuelles appropriées des composants de ZYPREXA 10 mg et de fluoxétine par rapport à Symbyax. Les ajustements posologiques, si indiqués, doivent être effectués avec les composants individuels en fonction de l'efficacité et de la tolérance.
Bien qu'il n'y ait aucun élément de preuve pour répondre à la question de savoir combien de temps un patient traité par ZYPREXA et la fluoxétine en association devrait y rester, il est généralement admis que le trouble bipolaire I, y compris les épisodes dépressifs associés au trouble bipolaire I, est une maladie chronique. maladie nécessitant un traitement chronique. Le fournisseur de soins de santé doit réexaminer périodiquement la nécessité d'une pharmacothérapie continue.
ZYPREXA 5 mg en monothérapie n'est pas indiqué dans le traitement des épisodes dépressifs associés au trouble bipolaire I.
ZYPREXA 7,5 mg et fluoxétine en association : Dépression résistante au traitement
Lors de l'utilisation de ZYPREXA et de fluoxétine en association, reportez-vous également à la section Études cliniques de la notice de Symbyax.
L'olanzapine orale doit être administrée en association avec la fluoxétine une fois par jour le soir, sans égard aux repas, en commençant généralement par 5 mg d'olanzapine orale et 20 mg de fluoxétine. Des ajustements posologiques, si indiqués, peuvent être effectués en fonction de l'efficacité et de la tolérance dans les fourchettes posologiques d'olanzapine orale 5 à 20 mg et de fluoxétine 20 à 50 mg. L'efficacité antidépressive a été démontrée avec l'olanzapine et la fluoxétine en association chez des patients adultes avec une gamme de doses d'olanzapine de 6 à 18 mg et de fluoxétine de 25 à 50 mg.
L'innocuité et l'efficacité de l'olanzapine en association avec la fluoxétine ont été déterminées dans des essais cliniques soutenant l'approbation de Symbyax (association à dose fixe d'olanzapine et de fluoxétine). Symbyax est dosé entre 3 mg/25 mg (olanzapine/fluoxétine) par jour et 12 mg/50 mg (olanzapine/fluoxétine) par jour. Le tableau 1 ci-dessus montre les doses de composants individuels appropriées de ZYPREXA et de fluoxétine par rapport à Symbyax. Les ajustements posologiques, si indiqués, doivent être effectués avec les composants individuels en fonction de l'efficacité et de la tolérance.
Bien qu'il n'existe aucun élément de preuve permettant de répondre à la question de savoir pendant combien de temps un patient traité par ZYPREXA et la fluoxétine en association doit rester sous traitement, il est généralement admis que la dépression résistante au traitement (trouble dépressif majeur chez les patients adultes qui ne répondent pas à 2 essais de différents antidépresseurs à dose et durée adéquates dans l'épisode en cours) est une maladie chronique nécessitant un traitement chronique. Le fournisseur de soins de santé doit réexaminer périodiquement la nécessité d'une pharmacothérapie continue.
La sécurité de la co-administration de doses supérieures à 18 mg d'olanzapine avec 75 mg de fluoxétine n'a pas été évaluée dans les études cliniques.
ZYPREXA 7,5 mg en monothérapie n'est pas indiqué dans le traitement de la dépression résistante au traitement (trouble dépressif majeur chez les patients qui ne répondent pas à 2 antidépresseurs de dose et de durée adéquates dans l'épisode en cours).
ZYPREXA 10mg Et Fluoxetine En Association: Posologie Dans Des Populations Particulières
La dose initiale d'olanzapine orale 2,5-5 mg avec fluoxétine 20 mg doit être utilisée chez les patients prédisposés aux réactions hypotensives, les patients atteints d'insuffisance hépatique ou les patients qui présentent une combinaison de facteurs susceptibles de ralentir le métabolisme de l'olanzapine ou de la fluoxétine en association. (sexe féminin, âge gériatrique, statut non-fumeur), ou les patients qui peuvent être pharmacodynamiquement sensibles à l'olanzapine. Une modification de la posologie peut être nécessaire chez les patients qui présentent une combinaison de facteurs susceptibles de ralentir le métabolisme. Lorsqu'elles sont indiquées, les augmentations de dose doivent être effectuées avec prudence chez ces patients. ZYPREXA et la fluoxétine en association n'ont pas été systématiquement étudiés chez les patients de plus de 65 ans ou chez les patients de moins de 10 ans [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES , et PHARMACOLOGIE CLINIQUE ].
COMMENT FOURNIE
Formes posologiques et points forts
Les comprimés de ZYPREXA 2,5 mg, 5 mg, 7,5 mg et 10 mg sont blancs, ronds et imprimés à l'encre bleue avec LILLY et le numéro du comprimé. Les comprimés de 15 mg sont elliptiques, bleus et gravés avec LILLY et le numéro du comprimé. Les comprimés de 20 mg sont elliptiques, roses et gravés LILLY et le numéro du comprimé. Les comprimés ne sont pas sécables. Les tablettes sont disponibles comme suit :
ZYPREXA 10mg ZYDIS (comprimés d'olanzapine à dissolution orale) sont jaunes, ronds et gravés avec la force du comprimé. Les comprimés ne sont pas sécables. Les tablettes sont disponibles comme suit :
ZYPREXA 15 mg intramusculaire est disponible en flacon de 10 mg (1s).
Les comprimés de ZYPREXA 2,5 mg, 5 mg, 7,5 mg et 10 mg sont blancs, ronds et imprimés à l'encre bleue avec LILLY et le numéro du comprimé. Les comprimés de 15 mg sont elliptiques, bleus et gravés avec LILLY et le numéro du comprimé. Les comprimés de 20 mg sont elliptiques, roses et gravés LILLY et le numéro du comprimé. Les tablettes sont disponibles comme suit :
ZYPREXA 2,5 mg ZYDIS (comprimés d'olanzapine à dissolution orale) sont jaunes, ronds et gravés avec la force du comprimé. Les tablettes sont disponibles comme suit :
ZYPREXA intramusculaire est disponible en :
CDN 0002-7597-01 (n° VL7597) – flacon de 10 mg (1 s)
Stockage et manutention
Conservez les comprimés ZYPREXA, ZYPREXA ZYDIS et les flacons intramusculaires ZYPREXA (avant reconstitution) à température ambiante contrôlée, entre 20 et 25 °C (68 et 77 °F) [voir USP ]. ZYPREXA 20 mg intramusculaire reconstitué peut être conservé à température ambiante contrôlée, entre 20 et 25 °C (68 et 77 °F) [voir USP jusqu'à 1 heure si nécessaire. Jeter toute portion inutilisée de ZYPREXA intramusculaire reconstitué. L'USP définit la température ambiante contrôlée comme une température maintenue thermostatiquement qui englobe l'environnement de travail habituel et habituel de 20° à 25°C (68° à 77°F); qui se traduit par une température cinétique moyenne calculée comme n'étant pas supérieure à 25°C ; et qui permet des excursions entre 15° et 30°C (59° et 86°F) qui sont expérimentées dans les pharmacies, les hôpitaux et les entrepôts.
Protégez les comprimés ZYPREXA et ZYPREXA ZYDIS de la lumière et de l'humidité. Protéger ZYPREXA IntraMuscular de la lumière, ne pas congeler.
Commercialisé par : Lilly USA, LLC, Indianapolis, IN 46285, États-Unis. Révisé : octobre 2019
EFFETS SECONDAIRES
Lors de l'utilisation de ZYPREXA 2,5 mg et de fluoxétine en association, reportez-vous également à la section Effets indésirables de la notice de Symbyax.
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter ou prédire les taux observés dans la pratique.
Essais cliniques chez l'adulte
Les informations ci-dessous pour l'olanzapine sont tirées d'une base de données d'essais cliniques pour l'olanzapine composée de 10 504 patients adultes avec environ 4 765 années-patients d'exposition à l'olanzapine plus 722 patients ayant été exposés à l'olanzapine intramusculaire pour injection. Cette base de données comprend : (1) 2 500 patients ayant participé à des essais de précommercialisation d'olanzapine orale à doses multiples dans la schizophrénie et la maladie d'Alzheimer, représentant environ 1 122 patients-années d'exposition au 14 février 1995 ; (2) 182 patients ayant participé à des essais sur le trouble bipolaire I (épisodes maniaques ou mixtes) portant sur l'olanzapine par voie orale, représentant environ 66 patients-années d'exposition ; (3) 191 patients ayant participé à un essai d'olanzapine orale chez des patients présentant divers symptômes psychiatriques en association avec la maladie d'Alzheimer, représentant environ 29 années-patients d'exposition ; (4) 5 788 patients supplémentaires issus de 88 essais cliniques sur l'olanzapine orale au 31 décembre 2001 ; (5) 1843 patients supplémentaires issus de 41 essais cliniques sur l'olanzapine au 31 octobre 2011 ; et (6) 722 patients ayant participé à des essais de précommercialisation d'olanzapine pour injection intramusculaire chez des patients agités atteints de schizophrénie, de trouble bipolaire I (épisodes maniaques ou mixtes) ou de démence. Vous trouverez également ci-dessous des informations provenant de la base de données d'études cliniques de précommercialisation de 6 semaines pour l'olanzapine en association avec du lithium ou du valproate, composée de 224 patients ayant participé à des essais sur le trouble bipolaire I (épisodes maniaques ou mixtes) avec environ 22 années-patients d'exposition.
Les conditions et la durée du traitement par l'olanzapine variaient considérablement et comprenaient (dans des catégories qui se chevauchent) des phases d'études en ouvert et en double aveugle, des patients hospitalisés et ambulatoires, des études à dose fixe et à dose fixe et une exposition à court terme ou à plus long terme. . Les effets indésirables ont été évalués en recueillant les effets indésirables, les résultats des examens physiques, les signes vitaux, les poids, les analytes de laboratoire, les ECG, les radiographies pulmonaires et les résultats des examens ophtalmologiques.
Certaines parties de la discussion ci-dessous concernant les paramètres de sécurité objectifs ou numériques, à savoir les effets indésirables dose-dépendants, les modifications des signes vitaux, la prise de poids, les modifications de laboratoire et les modifications de l'ECG sont dérivées d'études chez des patients atteints de schizophrénie et n'ont pas été dupliquées pour le trouble bipolaire I. (épisodes maniaques ou mixtes) ou agitation. Cependant, cette information s'applique aussi généralement au trouble bipolaire I (épisodes maniaques ou mixtes) et à l'agitation.
Les effets indésirables pendant l'exposition ont été obtenus par notification spontanée et enregistrés par les investigateurs cliniques en utilisant la terminologie de leur choix. Par conséquent, il n'est pas possible de fournir une estimation significative de la proportion d'individus présentant des effets indésirables sans d'abord regrouper des types de réactions similaires dans un plus petit nombre de catégories de réactions standardisées. Dans les tableaux et tableaux qui suivent, la terminologie du dictionnaire MedDRA et COSTART a été utilisée pour classer les effets indésirables rapportés.
Les fréquences indiquées des effets indésirables représentent la proportion d'individus qui ont présenté, au moins une fois, un effet indésirable lié au traitement du type indiqué. Une réaction était considérée comme émergeant du traitement si elle se produisait pour la première fois ou s'aggravait pendant le traitement après l'évaluation initiale. Les réactions rapportées n'incluent pas les termes de réaction qui étaient si généraux qu'ils n'étaient pas informatifs. Les réactions énumérées ailleurs dans l'étiquetage peuvent ne pas être répétées ci-dessous. Il est important de souligner que, bien que les réactions se soient produites pendant le traitement par l'olanzapine, elles n'ont pas nécessairement été causées par celui-ci. L'intégralité de l'étiquette doit être lue pour bien comprendre le profil d'innocuité de l'olanzapine.
Le prescripteur doit être conscient que les chiffres des tableaux et tabulations ne peuvent pas être utilisés pour prédire l'incidence des effets indésirables au cours de la pratique médicale habituelle lorsque les caractéristiques du patient et d'autres facteurs diffèrent de ceux qui ont prévalu dans les essais cliniques. De même, les fréquences citées ne peuvent être comparées aux chiffres obtenus à partir d'autres investigations cliniques impliquant différents traitements, utilisations et investigateurs. Les chiffres cités, cependant, fournissent au fournisseur de soins de santé prescripteur une base pour estimer la contribution relative des facteurs médicamenteux et non médicamenteux à l'incidence des effets indésirables dans la population étudiée.
Incidence des effets indésirables dans les essais à court terme, contrôlés par placebo et combinés
Les résultats suivants sont basés sur des essais de précommercialisation portant sur (1) l'olanzapine orale pour la schizophrénie, le trouble bipolaire I (épisodes maniaques ou mixtes), un essai ultérieur de patients présentant divers symptômes psychiatriques associés à la maladie d'Alzheimer, et des essais d'association précommercialisation, et (2 ) olanzapine intramusculaire pour injection chez les patients agités atteints de schizophrénie ou de manie bipolaire I.
Effets indésirables associés à l'arrêt du traitement dans les essais à court terme contrôlés par placebo
La schizophrénie
Dans l'ensemble, il n'y a pas eu de différence dans l'incidence des arrêts pour cause d'effets indésirables (5 % pour l'olanzapine orale contre 6 % pour le placebo). Cependant, les arrêts dus à des augmentations des ALAT ont été considérés comme liés au médicament (2 % pour l'olanzapine orale contre 0 % pour le placebo).
Trouble bipolaire I (épisodes maniaques ou mixtes) Monothérapie
Dans l'ensemble, il n'y a pas eu de différence dans l'incidence des arrêts pour cause d'effets indésirables (2 % pour l'olanzapine orale contre 2 % pour le placebo).
Agitation
Dans l'ensemble, il n'y a pas eu de différence dans l'incidence des abandons en raison d'effets indésirables (0,4 % pour l'olanzapine intramusculaire pour injection vs 0 % pour le placebo).
Effets indésirables associés à l'arrêt du traitement dans les essais d'association à court terme
Trouble bipolaire I (épisodes maniaques ou mixtes), olanzapine en complément du lithium ou du valproate
Dans une étude portant sur des patients qui toléraient déjà soit le lithium soit le valproate en monothérapie, les taux d'arrêts dus à des effets indésirables étaient de 11 % pour l'association d'olanzapine orale avec du lithium ou du valproate contre 2 % pour les patients qui restaient sous lithium ou valproate en monothérapie. Les arrêts de l'association d'olanzapine orale et de lithium ou de valproate survenus chez plus d'un patient ont été : somnolence (3 %), prise de poids (1 %) et œdème périphérique (1 %).
Effets indésirables couramment observés dans les essais à court terme contrôlés par placebo
Les effets indésirables les plus fréquemment observés associés à l'utilisation d'olanzapine orale (incidence de 5 % ou plus) et non observés à une incidence équivalente chez les patients traités par placebo (incidence de l'olanzapine au moins deux fois supérieure à celle du placebo) étaient :
Olanzapine intramusculaire
Il y a eu 1 effet indésirable (somnolence) observé à une incidence de 5 % ou plus chez les patients traités par l'olanzapine intramusculaire pour injection et non observé à une incidence équivalente chez les patients traités par placebo (incidence de l'olanzapine au moins deux fois supérieure à celle du placebo) pendant le traitement par placebo. -études contrôlées de précommercialisation. L'incidence de la somnolence pendant la période de traitement IM de 24 heures dans les essais cliniques menés chez des patients agités atteints de schizophrénie ou de manie bipolaire I était de 6 % pour l'olanzapine intramusculaire pour injection et de 3 % pour le placebo.
Effets indésirables survenant à une incidence de 2 % ou plus chez les patients traités par l'olanzapine par voie orale lors d'essais à court terme contrôlés par placebo
Le tableau 11 énumère l'incidence, arrondie au pourcentage le plus proche, des effets indésirables liés au traitement qui sont survenus chez 2 % ou plus des patients traités par olanzapine orale (doses ≥ 2,5 mg/jour) et avec une incidence supérieure au placebo qui ont participé à la phase aiguë phase d'essais contrôlés par placebo.
Dépendance à la dose des effets indésirables
Une différence entre les groupes de doses a été observée pour la fatigue, les étourdissements, la prise de poids et l'élévation de la prolactine. Dans une seule étude randomisée, en double aveugle et à dose fixe de 8 semaines comparant 10 (N = 199), 20 (N = 200) et 40 (N = 200) mg/jour d'olanzapine orale chez des patients adultes atteints de schizophrénie ou de troubles schizo-affectifs l'incidence de la fatigue (10 mg/jour : 1,5 % ; 20 mg/jour : 2,1 % ; 40 mg/jour : 6,6 %) a été observée avec des différences significatives entre 10 vs 40 et 20 vs 40 mg/jour. L'incidence des étourdissements (10 mg/jour : 2,6 % ; 20 mg/jour : 1,6 % ; 40 mg/jour : 6,6 %) a été observée avec des différences significatives entre 20 et 40 mg. Des différences entre les groupes de dose ont également été notées pour le gain de poids et l'élévation de la prolactine [voir AVERTISSEMENTS ET PRECAUTIONS ].
Le tableau suivant traite de la relation dose-effet pour les autres effets indésirables en utilisant les données d'un essai sur la schizophrénie impliquant des gammes de dosage fixes d'olanzapine orale. Il énumère le pourcentage de patients présentant des effets indésirables liés au traitement pour les 3 groupes à dose fixe et le placebo. Les données ont été analysées à l'aide du test de Cochran-Armitage, à l'exclusion du groupe placebo, et le tableau ne comprend que les effets indésirables pour lesquels il y avait une tendance.
Effets indésirables fréquemment observés lors d'essais à court terme sur l'olanzapine par voie orale en complément du lithium ou du valproate
Dans les essais contrôlés par placebo sur le trouble bipolaire I (épisodes maniaques ou mixtes), les effets indésirables les plus fréquemment observés associés à l'association d'olanzapine et de lithium ou de valproate (incidence ≥ 5 % et au moins deux fois le placebo) étaient :
Effets indésirables survenant à une incidence de 2 % ou plus chez les patients traités par olanzapine par voie orale lors d'essais à court terme sur l'olanzapine en complément du lithium ou du valproate
Le tableau 14 énumère l'incidence, arrondie au pourcentage le plus proche, des effets indésirables liés au traitement qui sont survenus chez 2 % ou plus des patients traités par l'association d'olanzapine (doses ≥ 5 mg/jour) et de lithium ou de valproate et dont l'incidence est supérieure à de lithium ou de valproate seuls qui ont participé à la phase aiguë d'essais d'association contrôlés par placebo.
Pour des informations spécifiques sur les effets indésirables observés avec le lithium ou le valproate, reportez-vous à la section Effets indésirables des notices de ces autres produits.
Effets indésirables survenant à une incidence de 1 % ou plus chez les patients traités par injection d'olanzapine intramusculaire dans des essais à court terme contrôlés par placebo
Le tableau 15 énumère l'incidence, arrondie au pourcentage le plus proche, des effets indésirables liés au traitement survenus chez 1 % ou plus des patients traités par l'olanzapine intramusculaire pour injection (intervalle de doses de 2,5 à 10 mg/injection) et avec une incidence supérieure à celle du placebo. qui ont participé aux essais à court terme contrôlés par placebo chez des patients agités atteints de schizophrénie ou de manie bipolaire I.
Symptômes extrapyramidaux
Le tableau suivant énumère le pourcentage de patients présentant des symptômes extrapyramidaux apparus sous traitement, évalués par des analyses catégorielles d'échelles d'évaluation formelles au cours d'un traitement aigu dans un essai clinique contrôlé comparant l'olanzapine orale à 3 doses fixes à un placebo dans le traitement de la schizophrénie au cours d'une période de 6 semaines. essai.
Le tableau suivant énumère le pourcentage de patients présentant des symptômes extrapyramidaux apparus sous traitement, évalués par les effets indésirables rapportés spontanément pendant le traitement aigu dans le même essai clinique contrôlé comparant l'olanzapine à 3 doses fixes à un placebo dans le traitement de la schizophrénie dans un essai de 6 semaines.
Le tableau suivant énumère le pourcentage de patients adolescents présentant des symptômes extrapyramidaux apparus sous traitement, évalués par les effets indésirables signalés spontanément au cours du traitement aigu (intervalle de doses : 2,5 à 20 mg/jour).
Le tableau suivant énumère le pourcentage de patients présentant des symptômes extrapyramidaux apparus sous traitement, évalués par des analyses catégorielles d'échelles d'évaluation formelles au cours d'essais cliniques contrôlés comparant des doses fixes d'olanzapine intramusculaire pour injection à un placebo sous agitation. Les patients de chaque groupe de dose pouvaient recevoir jusqu'à 3 injections pendant les essais [voir Etudes cliniques ]. Les évaluations des patients ont été menées au cours des 24 heures suivant la dose initiale d'olanzapine intramusculaire pour injection.
Le tableau suivant énumère le pourcentage de patients présentant des symptômes extrapyramidaux apparus sous traitement, évalués par les effets indésirables signalés spontanément dans le même essai clinique contrôlé comparant des doses fixes d'olanzapine intramusculaire pour injection à un placebo chez des patients agités atteints de schizophrénie.
Dystonie, effet de classe
Des symptômes de dystonie, des contractions anormales prolongées de groupes musculaires, peuvent survenir chez les personnes sensibles au cours des premiers jours de traitement. Les symptômes dystoniques comprennent : un spasme des muscles du cou, évoluant parfois vers une oppression de la gorge, une difficulté à avaler, une difficulté à respirer et/ou une protrusion de la langue. Bien que ces symptômes puissent survenir à de faibles doses, la fréquence et la gravité sont plus élevées avec une puissance élevée et à des doses plus élevées de médicaments antipsychotiques de première génération. En général, un risque élevé de dystonie aiguë peut être observé chez les hommes et les groupes d'âge plus jeunes recevant des antipsychotiques ; cependant, des événements de dystonie ont été signalés peu fréquemment (
Autres effets indésirables
Autres effets indésirables observés au cours de l'évaluation de l'essai clinique de l'olanzapine orale
Vous trouverez ci-dessous une liste des effets indésirables liés au traitement rapportés par des patients traités par olanzapine orale (à doses multiples ≥ 1 mg/jour) dans des essais cliniques. Cette liste n'est pas destinée à inclure les réactions (1) déjà répertoriées dans les tableaux précédents ou ailleurs dans l'étiquetage, (2) pour lesquelles une cause médicamenteuse était éloignée, (3) qui étaient si générales qu'elles n'étaient pas informatives, (4) qui n'étaient pas considérés comme ayant des implications cliniques significatives, ou (5) qui se sont produits à un taux égal ou inférieur au placebo. Les réactions sont classées par système corporel en utilisant les définitions suivantes : les réactions indésirables fréquentes sont celles qui surviennent chez au moins 1 patient sur 100 ; les effets indésirables peu fréquents sont ceux qui surviennent chez 1/100 à 1/1000 patients ; les réactions rares sont celles qui surviennent chez moins de 1/1000 patients.
Corps dans son ensemble - Peu fréquents : frissons, œdème facial, réaction de photosensibilité, tentative de suicide1 ; Rare : frissons et fièvre, effet de gueule de bois, mort subite1.
Système cardiovasculaire - Peu fréquents : accident vasculaire cérébral, vasodilatation.
Système digestif - Peu fréquents : distension abdominale, nausées et vomissements, œdème de la langue ; Rare : iléus, occlusion intestinale, dépôt de graisse hépatique.
Système sanguin et lymphatique - Peu fréquent : thrombocytopénie.
Troubles métaboliques et nutritionnels - Fréquent : phosphatase alcaline augmentée ; Peu fréquents : bilirubinémie, hypoprotéinémie.
Système musculo-squelettique - Rare : ostéoporose.
Système nerveux - Peu fréquents : ataxie, dysarthrie, diminution de la libido, stupeur ; Rare : coma.
Système respiratoire - Peu fréquent : épistaxis ; Rare : œdème pulmonaire.
Peau et Appendices - Peu fréquent : alopécie.
Sens spéciaux - Peu fréquents : anomalie de l'accommodation, yeux secs ; Rare : mydriase.
Système urogénital - Peu fréquents : aménorrhée2, douleur mammaire, diminution des menstruations, impuissance2, augmentation des menstruations2, ménorragie2, métrorragie2, polyurie2, pollakiurie, rétention urinaire, urgence urinaire, miction altérée.
1 Ces termes représentent des événements indésirables graves mais ne répondent pas à la définition des effets indésirables des médicaments. Ils sont inclus ici en raison de leur gravité. 2 Ajusté selon le sexe.
Autres effets indésirables observés au cours de l'évaluation de l'essai clinique d'olanzapine intramusculaire pour injection
Voici une liste des effets indésirables survenus pendant le traitement signalés par des patients traités par olanzapine intramusculaire pour injection (à 1 dose ou plus ≥ 2,5 mg/injection) au cours d'essais cliniques. Cette liste n'est pas destinée à inclure les réactions (1) déjà répertoriées dans les tableaux précédents ou ailleurs dans l'étiquetage, (2) pour lesquelles une cause médicamenteuse était éloignée, (3) qui étaient si générales qu'elles n'étaient pas informatives, (4) qui n'étaient pas considérés comme ayant des implications cliniques significatives, ou (5) pour lesquels s'est produit à un taux égal ou inférieur au placebo. Les réactions sont classées par système corporel en utilisant les définitions suivantes : les réactions indésirables fréquentes sont celles qui surviennent chez au moins 1 patient sur 100 ; les effets indésirables peu fréquents sont ceux qui surviennent chez 1/100 à 1/1000 patients.
Corps dans son ensemble - Fréquents : douleur au site d'injection.
Système cardiovasculaire - Peu fréquent : syncope.
Système digestif - Peu fréquent : nausées.
Troubles métaboliques et nutritionnels - Peu fréquent : augmentation de la créatine phosphokinase.
Essais cliniques chez des patients adolescents (âgés de 13 à 17 ans)
Effets indésirables couramment observés dans les essais à court terme contrôlés par placebo sur l'olanzapine orale
Les effets indésirables chez les patients adolescents traités par olanzapine orale (doses ≥ 2,5 mg) signalés avec une incidence de 5 % ou plus et signalés au moins deux fois plus fréquemment que les patients traités par placebo sont énumérés dans le tableau 21.
Effets indésirables survenant à une incidence de 2 % ou plus chez les patients traités par l'olanzapine par voie orale lors d'essais à court terme (3 à 6 semaines) contrôlés par placebo
Les effets indésirables chez les patients adolescents traités par olanzapine orale (doses ≥ 2,5 mg) signalés avec une incidence de 2 % ou plus et supérieure au placebo sont énumérés dans le tableau 22.
Signes vitaux et études de laboratoire
Modifications des signes vitaux
L'olanzapine orale a été associée à une hypotension orthostatique et à une tachycardie dans les essais cliniques. L'olanzapine intramusculaire pour injection a été associée à de la bradycardie, de l'hypotension et de la tachycardie dans les essais cliniques [voir AVERTISSEMENTS ET PRECAUTIONS ].
Changements de laboratoire
Olanzapine en monothérapie chez l'adulte
Une évaluation de l'expérience de précommercialisation de l'olanzapine a révélé une association avec des augmentations asymptomatiques des taux d'ALT, d'AST et de GGT. Dans la base de données originale de précommercialisation d'environ 2 400 patients adultes avec un taux initial d'ALT ≤ 90 UI/L, l'incidence des élévations d'ALT à > 200 UI/L était de 2 % (50/2 381). Aucun de ces patients n'a présenté d'ictère ou d'autres symptômes attribuables à une insuffisance hépatique et la plupart ont présenté des modifications transitoires qui ont eu tendance à se normaliser pendant la poursuite du traitement par l'olanzapine.
Dans les études contrôlées par placebo portant sur l'olanzapine en monothérapie chez l'adulte, des élévations cliniquement significatives des ALAT (passage de
D'après une analyse des données de laboratoire dans une base de données intégrée de 41 études cliniques terminées chez des patients adultes traités par olanzapine orale, des taux élevés de GGT ont été enregistrés chez ≥ 1 % (88/5245) des patients.
La prudence s'impose chez les patients présentant des signes et symptômes d'insuffisance hépatique, chez les patients présentant des affections préexistantes associées à une réserve fonctionnelle hépatique limitée et chez les patients traités par des médicaments potentiellement hépatotoxiques.
L'administration d'olanzapine a également été associée à des augmentations de la prolactine sérique [voir AVERTISSEMENTS ET PRECAUTIONS ], avec une élévation asymptomatique du nombre d'éosinophiles chez 0,3 % des patients et une augmentation des CPK.
D'après une analyse des données de laboratoire dans une base de données intégrée de 41 études cliniques terminées chez des patients adultes traités par olanzapine orale, une élévation de l'acide urique a été enregistrée chez ≥ 3 % (171/4641) des patients.
Olanzapine en monothérapie chez les adolescents
Dans des essais cliniques contrôlés par placebo portant sur des patients adolescents atteints de schizophrénie ou de trouble bipolaire de type I (épisodes maniaques ou mixtes), des fréquences plus élevées pour les résultats suivants liés au traitement, à tout moment, ont été observées dans les analytes de laboratoire par rapport au placebo : ALT élevée (≥ 3 X LSN chez les patients avec ALT au départ
Dans les études contrôlées par placebo portant sur l'olanzapine en monothérapie chez les adolescents, des élévations cliniquement significatives des ALAT (passage de
Modifications de l'ECG
Dans les études groupées d'adultes ainsi que dans les études groupées d'adolescents, il n'y avait pas de différences significatives entre l'olanzapine et le placebo dans les proportions de patients présentant des modifications potentiellement importantes des paramètres ECG, y compris les intervalles QT, QTc (corrigé de Fridericia) et PR. L'utilisation d'olanzapine a été associée à une augmentation moyenne de la fréquence cardiaque par rapport au placebo (adultes : +2,4 battements par minute contre aucun changement avec le placebo ; adolescents : +6,3 battements par minute contre -5,1 battements par minute avec le placebo). Cette augmentation de la fréquence cardiaque peut être liée au potentiel de l'olanzapine à induire des modifications orthostatiques [voir AVERTISSEMENTS ET PRECAUTIONS ].
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de ZYPREXA. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il est difficile d'estimer de manière fiable leur fréquence ou d'évaluer une relation causale avec l'exposition au médicament.
Les effets indésirables rapportés depuis la mise sur le marché qui étaient temporairement (mais pas nécessairement causalement) liés au traitement par ZYPREXA comprennent les suivants : réaction allergique (par exemple, réaction anaphylactoïde, œdème de Quincke, prurit ou urticaire), lésion hépatique cholestatique ou mixte, coma diabétique, acidocétose diabétique, réaction de sevrage (diaphorèse, nausées ou vomissements), réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS), hépatite, ictère, neutropénie, pancréatite, priapisme, éruption cutanée, syndrome des jambes sans repos, rhabdomyolyse, bégaiement1 et événements thromboemboliques veineux (y compris embolie pulmonaire et thrombose veineuse profonde). Des taux de cholestérol aléatoires ≥ 240 mg/dL et des taux de triglycérides aléatoires ≥ 1 000 mg/dL ont été rapportés.
1 Le bégaiement n'a été étudié que dans les formulations orales et injectables à action prolongée (LAI).
INTERACTIONS MÉDICAMENTEUSES
Les risques liés à l'utilisation de l'olanzapine en association avec d'autres médicaments n'ont pas été largement évalués dans des études systématiques.
Possibilité que d'autres médicaments affectent l'olanzapine
Diazépam
La co-administration de diazépam avec l'olanzapine a potentialisé l'hypotension orthostatique observée avec l'olanzapine.
Cimétidine et antiacides
Des doses uniques de cimétidine (800 mg) ou d'antiacides contenant de l'aluminium et du magnésium n'ont pas affecté la biodisponibilité orale de l'olanzapine.
Inducteurs du CYP1A2
Le traitement par la carbamazépine (200 mg bid) entraîne une augmentation d'environ 50 % de la clairance de l'olanzapine. Cette augmentation est probablement due au fait que la carbamazépine est un puissant inducteur de l'activité du CYP1A2. Des doses quotidiennes plus élevées de carbamazépine peuvent entraîner une augmentation encore plus importante de la clairance de l'olanzapine.
De l'alcool
L'éthanol (dose unique de 45 mg/70 kg) n'a pas eu d'effet sur la pharmacocinétique de l'olanzapine. L'administration concomitante d'alcool (c'est-à-dire d'éthanol) et d'olanzapine a potentialisé l'hypotension orthostatique observée avec l'olanzapine [voir INTERACTIONS MÉDICAMENTEUSES ].
Inhibiteurs du CYP1A2
Fluvoxamine
La fluvoxamine, un inhibiteur du CYP1A2, diminue la clairance de l'olanzapine. Cela se traduit par une augmentation moyenne de la Cmax de l'olanzapine après fluvoxamine de 54 % chez les femmes non-fumeuses et de 77 % chez les hommes fumeurs. L'augmentation moyenne de l'ASC de l'olanzapine est de 52 % et 108 %, respectivement. Des doses plus faibles d'olanzapine doivent être envisagées chez les patients recevant un traitement concomitant par la fluvoxamine.
Inhibiteurs du CYP2D6
Fluoxétine
La fluoxétine (dose unique de 60 mg ou dose quotidienne de 60 mg pendant 8 jours) provoque une légère augmentation (moyenne de 16 %) de la concentration maximale d'olanzapine et une faible diminution (moyenne de 16 %) de la clairance de l'olanzapine. L'ampleur de l'impact de ce facteur est faible par rapport à la variabilité globale entre les individus et, par conséquent, la modification de la dose n'est pas systématiquement recommandée. Lors de l'utilisation de ZYPREXA et de fluoxétine en association, reportez-vous également à la section Interactions médicamenteuses de la notice de Symbyax.
Warfarine
La warfarine (dose unique de 20 mg) n'a pas affecté la pharmacocinétique de l'olanzapine.
Inducteurs du CYP1A2 ou de la glucuronyl transférase
L'oméprazole et la rifampicine peuvent entraîner une augmentation de la clairance de l'olanzapine.
charbon
L'administration de charbon actif (1 g) a réduit la Cmax et l'ASC de l'olanzapine orale d'environ 60 %. Comme les niveaux maximaux d'olanzapine ne sont généralement pas atteints avant environ 6 heures après l'administration, le charbon de bois peut être un traitement utile en cas de surdosage d'olanzapine.
Potentiel pour l'olanzapine d'affecter d'autres médicaments
Médicaments agissant sur le SNC
Compte tenu des principaux effets de l'olanzapine sur le SNC, la prudence s'impose lorsque l'olanzapine est prise en association avec d'autres médicaments à action centrale et de l'alcool.
Agents antihypertenseurs
L'olanzapine, en raison de son potentiel hypotenseur, peut augmenter les effets de certains agents antihypertenseurs.
Agonistes de la lévodopa et de la dopamine
L'olanzapine peut antagoniser les effets de la lévodopa et des agonistes dopaminergiques.
Lorazépam (IM)
L'administration de lorazépam intramusculaire (2 mg) 1 heure après l'olanzapine intramusculaire pour injection (5 mg) n'a pas affecté de manière significative la pharmacocinétique de l'olanzapine, du lorazépam non conjugué ou du lorazépam total. Cependant, cette co-administration de lorazépam intramusculaire et d'olanzapine intramusculaire pour injection a ajouté à la somnolence observée avec l'un ou l'autre médicament seul [voir AVERTISSEMENTS ET PRECAUTIONS ].
Lithium
Des doses multiples d'olanzapine (10 mg pendant 8 jours) n'ont pas influencé la cinétique du lithium. Par conséquent, l'administration concomitante d'olanzapine ne nécessite pas d'ajustement posologique du lithium [voir AVERTISSEMENTS ET PRECAUTIONS ].
Valproate
L'olanzapine (10 mg par jour pendant 2 semaines) n'a pas modifié les concentrations plasmatiques à l'état d'équilibre du valproate. Par conséquent, l'administration concomitante d'olanzapine ne nécessite pas d'ajustement posologique du valproate [voir AVERTISSEMENTS ET PRECAUTIONS ].
Effet de l'olanzapine sur les enzymes métabolisant les médicaments
Des études in vitro utilisant des microsomes hépatiques humains suggèrent que l'olanzapine a peu de potentiel pour inhiber le CYP1A2, le CYP2C9, le CYP2C19, le CYP2D6 et le CYP3A. Ainsi, il est peu probable que l'olanzapine provoque des interactions médicamenteuses cliniquement importantes médiées par ces enzymes.
Imipramine
Des doses uniques d'olanzapine n'ont pas affecté la pharmacocinétique de l'imipramine ou de son métabolite actif, la désipramine.
Warfarine
Des doses uniques d'olanzapine n'ont pas affecté la pharmacocinétique de la warfarine.
Diazépam
L'olanzapine n'a pas influencé la pharmacocinétique du diazépam ou de son métabolite actif, le Ndesméthyldiazépam. Cependant, le diazépam co-administré avec l'olanzapine a augmenté l'hypotension orthostatique observée avec l'un ou l'autre médicament administré seul.
De l'alcool
Des doses multiples d'olanzapine n'ont pas influencé la cinétique de l'éthanol.
Bipériden
Des doses multiples d'olanzapine n'ont pas influencé la cinétique du bipéridène.
Théophylline
Des doses multiples d'olanzapine n'ont pas affecté la pharmacocinétique de la théophylline ou de ses métabolites.
Toxicomanie et dépendance
Dépendance
Dans des études conçues de manière prospective pour évaluer le potentiel d'abus et de dépendance, il a été démontré que l'olanzapine avait des effets dépressifs aigus sur le SNC, mais peu ou pas de potentiel d'abus ou de dépendance physique chez les rats ayant reçu des doses orales allant jusqu'à 15 fois la MRHD orale quotidienne (20 mg) et les singes rhésus. doses orales administrées jusqu'à 8 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m².
L'olanzapine n'a pas été systématiquement étudiée chez l'homme pour son potentiel d'abus, de tolérance ou de dépendance physique. Bien que les essais cliniques n'aient révélé aucune tendance à un comportement de recherche de drogue, ces observations n'étaient pas systématiques et il n'est pas possible de prédire, sur la base de cette expérience limitée, dans quelle mesure un médicament agissant sur le SNC sera mal utilisé, détourné , et/ou abusé une fois commercialisé. Par conséquent, les patients doivent être soigneusement évalués pour rechercher des antécédents de toxicomanie, et ces patients doivent être étroitement surveillés afin de détecter tout signe de mésusage ou d'abus d'olanzapine (par exemple, développement d'une tolérance, augmentation de la dose, comportement de recherche de drogue).
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Lors de l'utilisation de ZYPREXA 7,5 mg et de fluoxétine en association, reportez-vous également à la section Avertissements et précautions de la notice de Symbyax.
Patients âgés atteints de psychose liée à la démence
Augmentation de la mortalité
Les patients âgés atteints de psychose liée à la démence traités avec des médicaments antipsychotiques courent un risque accru de décès. ZYPREXA 20 mg n'est pas approuvé pour le traitement des patients atteints de psychose liée à la démence [voir l'AVERTISSEMENT ENCADRÉ, Utilisation chez les patients présentant une maladie concomitante et RENSEIGNEMENTS POUR LES PATIENTS].
Dans les essais cliniques contrôlés par placebo menés chez des patients âgés atteints de psychose liée à la démence, l'incidence des décès chez les patients traités par l'olanzapine était significativement supérieure à celle des patients traités par placebo (3,5 % contre 1,5 %, respectivement).
Événements indésirables cérébrovasculaires (CVAE), y compris les accidents vasculaires cérébraux
Des événements indésirables cérébrovasculaires (p. ex., accident vasculaire cérébral, accident ischémique transitoire), y compris des décès, ont été signalés chez des patients participant à des essais sur l'olanzapine chez des patients âgés atteints de psychose liée à la démence. Dans les essais contrôlés par placebo, il y avait une incidence significativement plus élevée d'événements indésirables vasculaires cérébraux chez les patients traités par olanzapine par rapport aux patients traités par placebo. L'olanzapine n'est pas approuvée pour le traitement des patients atteints de psychose liée à la démence [voir AVERTISSEMENT ENCADRÉ et INFORMATIONS PATIENTS ].
Suicide
La possibilité d'une tentative de suicide est inhérente à la schizophrénie et au trouble bipolaire I, et une surveillance étroite des patients à haut risque doit accompagner le traitement médicamenteux. Les prescriptions d'olanzapine doivent être rédigées pour la plus petite quantité de comprimés compatible avec une bonne prise en charge du patient, afin de réduire le risque de surdosage.
Syndrome malin des neuroleptiques (SMN)
Un complexe de symptômes potentiellement mortel parfois appelé syndrome malin des neuroleptiques (SMN) a été rapporté en association avec l'administration de médicaments antipsychotiques, y compris l'olanzapine. Les manifestations cliniques du SMN sont l'hyperpyrexie, la rigidité musculaire, l'altération de l'état mental et des signes d'instabilité autonome (pouls ou tension artérielle irréguliers, tachycardie, diaphorèse et dysrythmie cardiaque). Des signes supplémentaires peuvent inclure une élévation de la créatinine phosphokinase, une myoglobinurie (rhabdomyolyse) et une insuffisance rénale aiguë.
L'évaluation diagnostique des patients atteints de ce syndrome est compliquée. Pour arriver à un diagnostic, il est important d'exclure les cas où la présentation clinique comprend à la fois une maladie médicale grave (p. ex., pneumonie, infection systémique, etc.) et des signes et symptômes extrapyramidaux non traités ou insuffisamment traités. D'autres considérations importantes dans le diagnostic différentiel comprennent la toxicité anticholinergique centrale, le coup de chaleur, la fièvre médicamenteuse et la pathologie primaire du système nerveux central.
La prise en charge du SMN doit inclure : 1) l'arrêt immédiat des médicaments antipsychotiques et d'autres médicaments non essentiels au traitement concomitant ; 2) un traitement symptomatique intensif et un suivi médical ; et 3) le traitement de tout problème médical grave concomitant pour lequel des traitements spécifiques sont disponibles. Il n'y a pas d'accord général sur les schémas thérapeutiques pharmacologiques spécifiques du SMN.
Si un patient nécessite un traitement médicamenteux antipsychotique après avoir récupéré d'un SMN, la réintroduction potentielle d'un traitement médicamenteux doit être soigneusement envisagée. Le patient doit être étroitement surveillé, car des récidives de SMN ont été rapportées [voir INFORMATIONS PATIENTS ].
Réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS)
Une réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) a été signalée lors d'une exposition à l'olanzapine. Le DRESS peut présenter une réaction cutanée (telle qu'une éruption cutanée ou une dermatite exfoliative), une éosinophilie, de la fièvre et/ou une lymphadénopathie avec des complications systémiques telles qu'une hépatite, une néphrite, une pneumonite, une myocardite et/ou une péricardite. DRESS est parfois fatal. Arrêtez l'olanzapine si DRESS est suspecté [voir INFORMATIONS PATIENTS ].
Changements métaboliques
Les médicaments antipsychotiques atypiques ont été associés à des changements métaboliques, notamment l'hyperglycémie, la dyslipidémie et la prise de poids. Les changements métaboliques peuvent être associés à un risque cardiovasculaire/cérébrovasculaire accru. Le profil métabolique spécifique de l'olanzapine est présenté ci-dessous.
Hyperglycémie et diabète sucré
Les prestataires de soins de santé doivent tenir compte des risques et des bénéfices lorsqu'ils prescrivent de l'olanzapine à des patients ayant un diagnostic établi de diabète sucré ou présentant une glycémie à la limite de l'augmentation (à jeun 100-126 mg/dL, non à jeun 140-200 mg/dL). Les patients prenant de l'olanzapine doivent être surveillés régulièrement pour déceler une détérioration du contrôle glycémique. Les patients débutant un traitement par olanzapine doivent subir un test de glycémie à jeun au début du traitement et périodiquement pendant le traitement. Tout patient traité avec des antipsychotiques atypiques doit être surveillé pour des symptômes d'hyperglycémie, y compris la polydipsie, la polyurie, la polyphagie et la faiblesse. Les patients qui développent des symptômes d'hyperglycémie pendant le traitement avec des antipsychotiques atypiques doivent subir un test de glycémie à jeun. Dans certains cas, l'hyperglycémie a disparu après l'arrêt de l'antipsychotique atypique ; cependant, certains patients ont nécessité la poursuite du traitement antidiabétique malgré l'arrêt du médicament suspect [voir INFORMATIONS PATIENTS ].
Une hyperglycémie, parfois extrême et associée à une acidocétose ou à un coma hyperosmolaire ou au décès, a été rapportée chez des patients traités par des antipsychotiques atypiques, y compris l'olanzapine. L'évaluation de la relation entre l'utilisation d'antipsychotiques atypiques et les anomalies glycémiques est compliquée par la possibilité d'un risque de fond accru de diabète sucré chez les patients atteints de schizophrénie et l'incidence croissante du diabète sucré dans la population générale. Des études épidémiologiques suggèrent un risque accru d'effets indésirables liés à l'hyperglycémie liés au traitement chez les patients traités par les antipsychotiques atypiques. Alors que les estimations du risque relatif sont incohérentes, l'association entre les antipsychotiques atypiques et les augmentations de la glycémie semble tomber sur un continuum et l'olanzapine semble avoir une association plus importante que certains autres antipsychotiques atypiques.
Des augmentations moyennes de la glycémie ont été observées chez des patients traités (exposition médiane de 9,2 mois) par l'olanzapine lors de la phase 1 des essais cliniques sur l'efficacité des interventions antipsychotiques (CATIE). L'augmentation moyenne de la glycémie (échantillons à jeun et non à jeun) entre le départ et la moyenne des 2 concentrations sériques les plus élevées était de 15,0 mg/dL.
Dans une étude menée sur des volontaires sains, les sujets ayant reçu de l'olanzapine (N = 22) pendant 3 semaines ont présenté une augmentation moyenne par rapport à la valeur initiale de la glycémie à jeun de 2,3 mg/dL. Les sujets traités par placebo (N = 19) ont présenté une augmentation moyenne de la glycémie à jeun par rapport à la ligne de base de 0,34 mg/dL.
Olanzapine en monothérapie chez l'adulte
Dans une analyse de 5 études contrôlées par placebo sur la monothérapie par l'olanzapine chez l'adulte avec une durée médiane de traitement d'environ 3 semaines, l'olanzapine a été associée à une variation moyenne plus importante de la glycémie à jeun par rapport au placebo (2,76 mg/dL contre 0,17 mg/dL). La différence de variation moyenne entre l'olanzapine et le placebo était plus importante chez les patients présentant des signes de dérégulation glycémique à l'inclusion (patients diagnostiqués avec un diabète sucré ou des effets indésirables associés, patients traités avec des agents antidiabétiques, patients avec une glycémie initiale aléatoire ≥ 200 mg/ dL et/ou une glycémie à jeun initiale ≥ 126 mg/dL). Les patients traités par l'olanzapine ont présenté une augmentation moyenne supérieure de l'HbA1c par rapport à l'inclusion de 0,04 % (exposition médiane de 21 jours), par rapport à une diminution moyenne de l'HbA1c de 0,06 % chez les sujets traités par placebo (exposition médiane de 17 jours).
Dans une analyse de 8 études contrôlées par placebo (exposition médiane au traitement de 4 à 5 semaines), 6,1 % des sujets traités par l'olanzapine (N = 855) ont présenté une glycosurie apparue sous traitement, contre 2,8 % des sujets traités par placebo (N = 599). . Le tableau 2 montre les changements à court et à long terme des niveaux de glucose à jeun dans les études de monothérapie à l'olanzapine chez l'adulte.
La variation moyenne de la glycémie à jeun chez les patients exposés au moins 48 semaines était de 4,2 mg/dL (N = 487). Dans les analyses de patients ayant terminé 9 à 12 mois de traitement par l'olanzapine, la variation moyenne des glycémies à jeun et non à jeun a continué d'augmenter avec le temps.
Olanzapine en monothérapie chez les adolescents
La sécurité et l'efficacité de l'olanzapine n'ont pas été établies chez les patients de moins de 13 ans. Dans une analyse de 3 études contrôlées par placebo portant sur l'olanzapine en monothérapie chez des patients adolescents, y compris ceux atteints de schizophrénie (6 semaines) ou de trouble bipolaire de type I (épisodes maniaques ou mixtes) (3 semaines), l'olanzapine a été associée à un changement moyen plus important par rapport à l'inclusion dans le jeûne taux de glucose par rapport au placebo (2,68 mg/dL contre -2,59 mg/dL). La variation moyenne de la glycémie à jeun chez les adolescents exposés au moins 24 semaines était de 3,1 mg/dL (N = 121). Le tableau 3 montre les changements à court et à long terme de la glycémie à jeun dans les études sur la monothérapie à l'olanzapine chez les adolescents.
Dyslipidémie
Des altérations indésirables des lipides ont été observées avec l'utilisation d'olanzapine. Une surveillance clinique, y compris des évaluations lipidiques de base et de suivi périodique chez les patients utilisant l'olanzapine, est recommandée [voir INFORMATIONS PATIENTS ].
Des élévations cliniquement significatives et parfois très élevées (> 500 mg/dL) des taux de triglycérides ont été observées avec l'utilisation d'olanzapine. Des augmentations moyennes modestes du cholestérol total ont également été observées avec l'utilisation d'olanzapine.
Olanzapine en monothérapie chez l'adulte
Dans une analyse de 5 études contrôlées par placebo sur l'olanzapine en monothérapie avec une durée de traitement allant jusqu'à 12 semaines, les patients traités par l'olanzapine ont présenté des augmentations par rapport aux valeurs initiales du cholestérol total moyen à jeun, du cholestérol LDL et des triglycérides de 5,3 mg/dL, 3,0 mg/dL et 20,8 mg/dL respectivement par rapport à des diminutions par rapport au départ du cholestérol total moyen à jeun, du cholestérol LDL et des triglycérides de 6,1 mg/dL, 4,3 mg/dL et 10,7 mg/dL pour les patients traités par placebo. Pour le cholestérol HDL à jeun, aucune différence cliniquement significative n'a été observée entre les patients traités par l'olanzapine et les patients traités par placebo. Les augmentations moyennes des valeurs lipidiques à jeun (cholestérol total, cholestérol LDL et triglycérides) étaient plus importantes chez les patients sans preuve de dérèglement lipidique au départ, où le dérèglement lipidique était défini comme les patients diagnostiqués avec une dyslipidémie ou des effets indésirables associés, les patients traités avec des agents hypolipidémiants, ou les patients avec des niveaux de lipides de base élevés.
Dans les études à long terme (au moins 48 semaines), les patients ont présenté des augmentations par rapport au départ du cholestérol total moyen à jeun, du cholestérol LDL et des triglycérides de 5,6 mg/dL, 2,5 mg/dL et 18,7 mg/dL, respectivement, et une moyenne diminution du cholestérol HDL à jeun de 0,16 mg/dL. Dans une analyse de patients ayant terminé 12 mois de traitement, le cholestérol total moyen non à jeun n'a pas augmenté davantage après environ 4 à 6 mois.
La proportion de patients ayant présenté des modifications (au moins une fois) du cholestérol total, du cholestérol LDL ou des triglycérides de normal ou limite à élevé, ou des modifications du taux de cholestérol HDL de normal ou limite à faible, était plus élevée dans les études à long terme (au moins 48 semaines) par rapport aux études à court terme. Le tableau 4 montre les changements catégoriques dans les valeurs de lipides à jeun.
Dans la phase 1 des essais cliniques sur l'efficacité des interventions antipsychotiques (CATIE), sur une exposition médiane de 9,2 mois, l'augmentation moyenne des triglycérides chez les patients prenant de l'olanzapine était de 40,5 mg/dL. Dans la phase 1 de CATIE, l'augmentation moyenne du cholestérol total était de 9,4 mg/dL.
Olanzapine en monothérapie chez les adolescents
La sécurité et l'efficacité de l'olanzapine n'ont pas été établies chez les patients de moins de 13 ans. Dans une analyse de 3 études contrôlées par placebo portant sur l'olanzapine en monothérapie chez des adolescents, y compris ceux atteints de schizophrénie (6 semaines) ou de trouble bipolaire de type I (épisodes maniaques ou mixtes) (3 semaines), les adolescents traités par l'olanzapine ont présenté des augmentations par rapport aux valeurs initiales du taux moyen de cholestérol total à jeun, LDL taux de cholestérol et de triglycérides de 12,9 mg/dL, 6,5 mg/dL et 28,4 mg/dL, respectivement, par rapport à des augmentations par rapport au départ du cholestérol total moyen à jeun et du cholestérol LDL de 1,3 mg/dL et 1,0 mg/dL, et une diminution en triglycérides de 1,1 mg/dL pour les adolescents traités par placebo. Pour le cholestérol HDL à jeun, aucune différence cliniquement significative n'a été observée entre les adolescents traités par l'olanzapine et les adolescents traités par placebo.
Dans les études à long terme (au moins 24 semaines), les adolescents ont présenté des augmentations par rapport au départ du cholestérol total moyen à jeun, du cholestérol LDL et des triglycérides de 5,5 mg/dL, 5,4 mg/dL et 20,5 mg/dL, respectivement, et une moyenne diminution du cholestérol HDL à jeun de 4,5 mg/dL. Le tableau 5 montre les changements catégoriques des valeurs de lipides à jeun chez les adolescents.
Gain de poids
Les conséquences potentielles d'une prise de poids doivent être envisagées avant de commencer l'olanzapine. Les patients recevant de l'olanzapine doivent faire l'objet d'une surveillance régulière de leur poids [voir Informations sur les conseils aux patients ].
Olanzapine en monothérapie chez l'adulte
Dans une analyse de 13 études contrôlées par placebo sur la monothérapie à l'olanzapine, les patients traités par l'olanzapine ont pris en moyenne 2,6 kg (5,7 lb) par rapport à une perte de poids moyenne de 0,3 kg (0,6 lb) chez les patients traités par placebo avec une exposition médiane de 6 semaines ; 22,2 % des patients traités par l'olanzapine ont gagné au moins 7 % de leur poids initial, contre 3 % des patients traités par placebo, avec une exposition médiane à l'événement de 8 semaines ; 4,2 % des patients traités par l'olanzapine ont gagné au moins 15 % de leur poids initial, contre 0,3 % des patients traités par placebo, avec une exposition médiane à l'événement de 12 semaines. Un gain de poids cliniquement significatif a été observé dans toutes les catégories d'indice de masse corporelle (IMC) de base. L'arrêt du traitement en raison d'une prise de poids est survenu chez 0,2 % des patients traités par l'olanzapine et chez 0 % des patients sous placebo.
Dans les études à long terme (au moins 48 semaines), le gain de poids moyen était de 5,6 kg (12,3 lb) (exposition médiane de 573 jours, N = 2021). Les pourcentages de patients ayant gagné au moins 7 %, 15 % ou 25 % de leur poids corporel initial avec une exposition à long terme étaient de 64 %, 32 % et 12 %, respectivement. L'arrêt du traitement en raison d'une prise de poids est survenu chez 0,4 % des patients traités par l'olanzapine après au moins 48 semaines d'exposition.
Le tableau 6 comprend des données sur la prise de poids chez l'adulte avec l'olanzapine regroupées à partir de 86 essais cliniques. Les données de chaque colonne représentent les données des patients qui ont terminé les périodes de traitement des durées spécifiées.
Des différences entre les groupes de dose en ce qui concerne le gain de poids ont été observées. Dans une seule étude randomisée, en double aveugle, à dose fixe de 8 semaines comparant 10 (N = 199), 20 (N = 200) et 40 (N = 200) mg/jour d'olanzapine orale chez des patients adultes atteints de schizophrénie ou de troubles schizo-affectifs, une augmentation moyenne de la ligne de base au point final du poids (10 mg/jour : 1,9 kg ; 20 mg/jour : 2,3 kg ; 40 mg/jour : 3 kg) a été observée avec des différences significatives entre 10 et 40 mg/jour.
Olanzapine en monothérapie chez les adolescents
La sécurité et l'efficacité de l'olanzapine n'ont pas été établies chez les patients de moins de 13 ans. L'augmentation moyenne de poids chez les adolescents était plus importante que chez les adultes. Dans 4 essais contrôlés par placebo, l'arrêt du traitement en raison d'une prise de poids est survenu chez 1 % des patients traités par l'olanzapine, contre 0 % des patients sous placebo.
Dans les études à long terme (au moins 24 semaines), le gain de poids moyen était de 11,2 kg (24,6 lb); (exposition médiane de 201 jours, N=179). Les pourcentages d'adolescents qui ont gagné au moins 7 %, 15 % ou 25 % de leur poids corporel initial avec une exposition à long terme étaient de 89 %, 55 % et 29 %, respectivement. Chez les patients adolescents, le gain de poids moyen par catégorie d'IMC de base était de 11,5 kg (25,3 lb), 12,1 kg (26,6 lb) et 12,7 kg (27,9 lb), respectivement, pour un poids normal (N = 106) et un surpoids (N = 26). et obèses (N=17). L'arrêt du traitement en raison d'une prise de poids est survenu chez 2,2 % des patients traités par l'olanzapine après au moins 24 semaines d'exposition.
Le tableau 8 montre les données sur la prise de poids chez les adolescents avec l'olanzapine regroupées à partir de 6 essais cliniques. Les données de chaque colonne représentent les données des patients qui ont terminé les périodes de traitement des durées spécifiées. Peu de données d'essais cliniques sont disponibles sur la prise de poids chez les adolescents traités par l'olanzapine au-delà de 6 mois de traitement.
Dyskinésie tardive
Un syndrome de mouvements dyskinétiques involontaires potentiellement irréversibles peut se développer chez les patients traités par des antipsychotiques. Bien que la prévalence du syndrome semble être la plus élevée chez les personnes âgées, en particulier les femmes âgées, il est impossible de se fier aux estimations de prévalence pour prédire, au début du traitement antipsychotique, quels patients sont susceptibles de développer le syndrome. On ne sait pas si les médicaments antipsychotiques diffèrent dans leur potentiel de provoquer une dyskinésie tardive.
On pense que le risque de développer une dyskinésie tardive et la probabilité qu'elle devienne irréversible augmentent à mesure que la durée du traitement et la dose cumulée totale de médicaments antipsychotiques administrés au patient augmentent. Cependant, le syndrome peut se développer, bien que beaucoup moins fréquemment, après des périodes de traitement relativement brèves à faibles doses ou peut même survenir après l'arrêt du traitement.
La dyskinésie tardive peut disparaître, partiellement ou complètement, si le traitement antipsychotique est arrêté. Cependant, le traitement antipsychotique lui-même peut supprimer (ou supprimer partiellement) les signes et symptômes du syndrome et peut ainsi masquer le processus sous-jacent. L'effet de la suppression symptomatique sur l'évolution à long terme du syndrome est inconnu.
Compte tenu de ces considérations, l'olanzapine doit être prescrite de la manière la plus susceptible de minimiser la survenue d'une dyskinésie tardive. Le traitement antipsychotique chronique doit généralement être réservé aux patients (1) qui souffrent d'une maladie chronique connue pour répondre aux médicaments antipsychotiques, et (2) pour lesquels des traitements alternatifs, tout aussi efficaces, mais potentiellement moins nocifs ne sont pas disponibles ou appropriés. Chez les patients nécessitant un traitement chronique, la dose la plus faible et la durée de traitement la plus courte produisant une réponse clinique satisfaisante doivent être recherchées. La nécessité de poursuivre le traitement doit être réévaluée périodiquement.
Si des signes et des symptômes de dyskinésie tardive apparaissent chez un patient sous olanzapine, l'arrêt du médicament doit être envisagé. Cependant, certains patients peuvent nécessiter un traitement par olanzapine malgré la présence du syndrome.
Pour des informations spécifiques sur les avertissements de lithium ou de valproate, reportez-vous à la section Avertissements des notices d'emballage de ces autres produits.
Hypotension orthostatique
L'olanzapine peut induire une hypotension orthostatique associée à des vertiges, une tachycardie, une bradycardie et, chez certains patients, une syncope, en particulier pendant la période initiale de titration de la dose, reflétant probablement ses propriétés antagonistes α1-adrénergiques [voir Informations sur les conseils aux patients ].
D'après une analyse des données des signes vitaux dans une base de données intégrée de 41 études cliniques terminées chez des patients adultes traités par olanzapine orale, une hypotension orthostatique a été enregistrée chez ≥ 20 % (1277/6030) des patients.
Pour le traitement par olanzapine par voie orale, le risque d'hypotension orthostatique et de syncope peut être minimisé en initiant le traitement avec 5 mg QD [voir DOSAGE ET ADMINISTRATION ]. Une titration plus progressive jusqu'à la dose cible doit être envisagée en cas d'hypotension.
L'hypotension, la bradycardie avec ou sans hypotension, la tachycardie et la syncope ont également été signalées au cours des essais cliniques avec l'olanzapine pour injection intramusculaire. Dans une étude de pharmacologie clinique en ouvert chez des patients schizophrènes non agités dans laquelle l'innocuité et la tolérabilité de l'olanzapine intramusculaire ont été évaluées selon un schéma posologique maximal (trois doses de 10 mg administrées à 4 heures d'intervalle), environ un tiers de ces patients ont présenté une diminution orthostatique de la pression artérielle systolique (c.-à-d. diminution ≥ 30 mmHg) [voir DOSAGE ET ADMINISTRATION ]. Une syncope a été rapportée chez 0,6 % (15/2500) des patients traités par l'olanzapine dans les études de phase 2-3 sur l'olanzapine par voie orale et chez 0,3 % (2/722) des patients traités par l'olanzapine présentant une agitation dans les études sur l'olanzapine pour injection par voie intramusculaire. Trois volontaires sains dans les études de phase 1 avec l'olanzapine intramusculaire ont présenté une hypotension, une bradycardie et des pauses sinusales allant jusqu'à 6 secondes qui se sont résolues spontanément (dans 2 cas, les réactions sont survenues sous olanzapine intramusculaire et dans 1 cas sous olanzapine orale). Le risque de cette séquence d'hypotension, de bradycardie et de pause sinusale peut être plus élevé chez les patients non psychiatriques que chez les patients psychiatriques qui sont peut-être plus adaptés à certains effets des médicaments psychotropes. Pour le traitement par olanzapine pour injection intramusculaire, les patients doivent rester couchés s'ils sont somnolents ou étourdis après l'injection jusqu'à ce qu'un examen ait indiqué qu'ils ne présentent pas d'hypotension orthostatique, de bradycardie et/ou d'hypoventilation.
L'olanzapine doit être utilisée avec une prudence particulière chez les patients présentant une maladie cardiovasculaire connue (antécédents d'infarctus du myocarde ou d'ischémie, insuffisance cardiaque ou anomalies de la conduction), une maladie cérébrovasculaire et des conditions qui prédisposeraient les patients à l'hypotension (déshydratation, hypovolémie et traitement par des médicaments antihypertenseurs). ) où la survenue d'une syncope, d'une hypotension et/ou d'une bradycardie pourrait exposer le patient à un risque médical accru.
La prudence s'impose chez les patients recevant un traitement par d'autres médicaments ayant des effets pouvant induire une hypotension, une bradycardie, une dépression respiratoire ou du système nerveux central [voir INTERACTIONS MÉDICAMENTEUSES ]. L'administration concomitante d'olanzapine intramusculaire et de benzodiazépine parentérale n'est pas recommandée en raison du risque de sédation excessive et de dépression cardiorespiratoire.
Des chutes
ZYPREXA peut provoquer une somnolence, une hypotension orthostatique, une instabilité motrice et sensorielle pouvant entraîner des chutes et, par conséquent, des fractures ou d'autres blessures. Pour les patients atteints de maladies, d'affections ou de médicaments susceptibles d'exacerber ces effets, effectuer des évaluations du risque de chute lors de l'initiation d'un traitement antipsychotique et de manière récurrente pour les patients sous traitement antipsychotique à long terme.
Leucopénie, neutropénie et agranulocytose
Effet de classe
Dans les essais cliniques et/ou après commercialisation, des événements de leucopénie/neutropénie ont été rapportés temporairement liés aux agents antipsychotiques, y compris ZYPREXA. Une agranulocytose a également été rapportée.
Les facteurs de risque possibles de leucopénie/neutropénie comprennent une faible numération leucocytaire préexistante et des antécédents de leucopénie/neutropénie d'origine médicamenteuse. Les patients ayant des antécédents de faible nombre de leucocytes cliniquement significatifs ou de leucopénie/neutropénie d'origine médicamenteuse doivent faire surveiller fréquemment leur numération globulaire complète (FSC) au cours des premiers mois de traitement et l'arrêt de ZYPREXA doit être envisagé dès les premiers signes d'un déclin cliniquement significatif. dans WBC en l'absence d'autres facteurs causaux.
Les patients présentant une neutropénie cliniquement significative doivent faire l'objet d'une surveillance attentive afin de déceler une fièvre ou d'autres symptômes ou signes d'infection et être traités rapidement si de tels symptômes ou signes apparaissent. Les patients atteints de neutropénie sévère (nombre absolu de neutrophiles
Dysphagie
La dysmotilité œsophagienne et l'aspiration ont été associées à l'utilisation d'antipsychotiques. La pneumonie par aspiration est une cause fréquente de morbidité et de mortalité chez les patients atteints de la maladie d'Alzheimer à un stade avancé. L'olanzapine n'est pas approuvée pour le traitement des patients atteints de la maladie d'Alzheimer.
Saisies
Au cours des tests de précommercialisation, des convulsions sont survenues chez 0,9 % (22/2 500) des patients traités par l'olanzapine. Il y avait des facteurs de confusion qui peuvent avoir contribué à la survenue de crises dans bon nombre de ces cas. L'olanzapine doit être utilisée avec prudence chez les patients ayant des antécédents de convulsions ou des affections susceptibles d'abaisser le seuil convulsif, par exemple la démence d'Alzheimer. L'olanzapine n'est pas approuvée pour le traitement des patients atteints de la maladie d'Alzheimer. Les conditions qui abaissent le seuil épileptogène peuvent être plus fréquentes dans une population de 65 ans ou plus.
Potentiel de déficience cognitive et motrice
La somnolence était un effet indésirable fréquemment rapporté associé au traitement par l'olanzapine, survenant à une incidence de 26 % chez les patients sous olanzapine contre 15 % chez les patients sous placebo. Cet effet indésirable était également lié à la dose. La somnolence a conduit à l'arrêt du traitement chez 0,4 % (9/2500) des patients de la base de données avant commercialisation.
Étant donné que l'olanzapine a le potentiel d'altérer le jugement, la réflexion ou la motricité, les patients doivent être avertis de l'utilisation de machines dangereuses, y compris les automobiles, jusqu'à ce qu'ils soient raisonnablement certains que le traitement par olanzapine ne les affecte pas négativement [voir Informations sur les conseils aux patients ].
Régulation de la température corporelle
La perturbation de la capacité du corps à réduire la température corporelle centrale a été attribuée aux agents antipsychotiques. Des précautions appropriées sont recommandées lors de la prescription d'olanzapine chez les patients qui connaîtront des conditions pouvant contribuer à une élévation de la température corporelle centrale, par exemple, un exercice intense, une exposition à une chaleur extrême, la prise concomitante de médicaments à activité anticholinergique ou une déshydratation [voir INFORMATIONS PATIENTS ].
Utilisation chez les patients atteints d'une maladie concomitante
L'expérience clinique avec l'olanzapine chez les patients atteints de certaines maladies systémiques concomitantes est limitée [voir PHARMACOLOGIE CLINIQUE ].
L'olanzapine présente une affinité pour les récepteurs muscariniques in vitro. Dans les essais cliniques de précommercialisation avec l'olanzapine, l'olanzapine a été associée à la constipation, à la bouche sèche et à la tachycardie, tous des effets indésirables pouvant être liés à un antagonisme cholinergique. De tels effets indésirables n'étaient pas souvent à l'origine des arrêts d'olanzapine, mais l'olanzapine doit être utilisée avec prudence chez les patients présentant une hypertrophie prostatique cliniquement significative, un glaucome à angle fermé ou des antécédents d'iléus paralytique ou d'affections apparentées.
Dans 5 études contrôlées par placebo sur l'olanzapine chez des patients âgés atteints de psychose liée à la démence (n = 1 184), les effets indésirables suivants liés au traitement ont été signalés chez les patients traités par l'olanzapine à une incidence d'au moins 2 % et significativement supérieure à celle observée avec le placebo. patients traités : chutes, somnolence, œdème périphérique, démarche anormale, incontinence urinaire, léthargie, prise de poids, asthénie, pyrexie, pneumonie, bouche sèche et hallucinations visuelles. Le taux d'arrêt en raison d'effets indésirables a été plus élevé avec l'olanzapine qu'avec le placebo (13 % contre 7 %). Les patients âgés atteints de psychose liée à la démence traités par l'olanzapine présentent un risque accru de décès par rapport au placebo. L'olanzapine n'est pas approuvée pour le traitement des patients atteints de psychose liée à la démence [voir AVERTISSEMENT ENCADRÉ , Patients âgés atteints de psychose liée à la démence , et INFORMATIONS PATIENTS ].
L'olanzapine n'a pas été évaluée ni utilisée de façon appréciable chez les patients ayant des antécédents récents d'infarctus du myocarde ou de maladie cardiaque instable. Les patients avec ces diagnostics ont été exclus des études cliniques de précommercialisation. En raison du risque d'hypotension orthostatique associé à l'olanzapine, la prudence s'impose chez les patients cardiaques [voir Hypotension orthostatique ].
Hyperprolactinémie
Comme avec d'autres médicaments qui antagonisent les récepteurs dopaminergiques D2, l'olanzapine élève les taux de prolactine et cette élévation persiste pendant l'administration chronique. L'hyperprolactinémie peut supprimer la GnRH hypothalamique, entraînant une réduction de la sécrétion hypophysaire de gonadotrophines. Ceci, à son tour, peut inhiber la fonction de reproduction en altérant la stéroïdogenèse gonadique chez les patients féminins et masculins. Galactorrhée, aménorrhée, gynécomastie et impuissance ont été signalées chez des patients recevant des composés élevant la prolactine. Une hyperprolactinémie de longue date, lorsqu'elle est associée à un hypogonadisme, peut entraîner une diminution de la densité osseuse chez les sujets féminins et masculins.
Des expériences de culture de tissus indiquent qu'environ un tiers des cancers du sein humains sont dépendants de la prolactine in vitro, un facteur d'importance potentielle si la prescription de ces médicaments est envisagée chez une patiente atteinte d'un cancer du sein déjà détecté. Comme c'est souvent le cas avec les composés qui augmentent la libération de prolactine, une augmentation de la néoplasie de la glande mammaire a été observée dans les études de cancérogénicité de l'olanzapine menées chez la souris et le rat [voir Toxicologie non clinique ]. Ni les études cliniques ni les études épidémiologiques menées à ce jour n'ont montré d'association entre l'administration chronique de cette classe de médicaments et la tumorigenèse chez l'homme ; les preuves disponibles sont considérées comme trop limitées pour être concluantes à l'heure actuelle.
Dans les études cliniques contrôlées par placebo sur l'olanzapine (jusqu'à 12 semaines), des variations de la concentration de prolactine normale à élevée ont été observées chez 30 % des adultes traités par l'olanzapine contre 10,5 % des adultes traités par le placebo. Dans une analyse groupée d'études cliniques portant sur 8136 adultes traités par l'olanzapine, les manifestations cliniques potentiellement associées comprenaient des événements liés aux menstruations1 (2 % [49/3240] des femmes), des événements liés à la fonction sexuelle2 (2 % [150/8136] des femmes et hommes) et événements liés au sein3 (0,7 % [23/3240] des femmes, 0,2 % [9/4896] des hommes).
Dans des études contrôlées par placebo sur l'olanzapine en monothérapie chez des patients adolescents (jusqu'à 6 semaines) atteints de schizophrénie ou de trouble bipolaire de type I (épisodes maniaques ou mixtes), des changements de la normale à des concentrations élevées de prolactine ont été observés chez 47 % des patients traités par l'olanzapine contre 7 % de patients traités par placebo. Dans une analyse groupée d'essais cliniques portant sur 454 adolescents traités par l'olanzapine, les manifestations cliniques potentiellement associées comprenaient des événements liés aux menstruations1 (1 % [2/168] des femmes), des événements liés à la fonction sexuelle2 (0,7 % [3/454] des femmes et des hommes ) et événements liés au sein3 (2 % [3/168] des femmes, 2 % [7/286] des hommes) [voir Utilisation dans des populations spécifiques ].
1 Basé sur une recherche des termes suivants : aménorrhée, hypoménorrhée, menstruation retardée et oligoménorrhée.
2 Basé sur une recherche des termes suivants : anorgasmie, éjaculation retardée, dysfonction érectile, diminution de la libido, perte de libido, orgasme anormal et dysfonctionnement sexuel.
Basé sur une recherche des termes suivants : écoulement mammaire, hypertrophie ou gonflement, galactorrhée, gynécomastie et trouble de la lactation.
Des différences entre les groupes de dose en ce qui concerne l'élévation de la prolactine ont été observées. Dans une seule étude randomisée, en double aveugle et à dose fixe de 8 semaines comparant 10 (N = 199), 20 (N = 200) et 40 (N = 200) mg/jour d'olanzapine orale chez des patients adultes atteints de schizophrénie ou de troubles schizo-affectifs trouble, incidence d'élévation de la prolactine > 24,2 ng/mL (femme) ou > 18,77 ng/mL (homme) à tout moment de l'essai (10 mg/jour : 31,2 % ; 20 mg/jour : 42,7 % ; 40 mg/jour : 61,1 %) ont indiqué des différences significatives entre 10 vs 40 mg/jour et 20 vs 40 mg/jour.
Utilisation en association avec la fluoxétine, le lithium ou le valproate
Lors de l'utilisation de ZYPREXA et de fluoxétine en association, le prescripteur doit également se reporter à la section Avertissements et précautions de la notice de Symbyax. Lors de l'utilisation de ZYPREXA en association avec du lithium ou du valproate, le prescripteur doit se référer aux sections Avertissements et Précautions des notices d'emballage pour le lithium ou le valproate [voir INTERACTIONS MÉDICAMENTEUSES ].
Tests de laboratoire
Des tests de glycémie à jeun et un bilan lipidique au début et périodiquement pendant le traitement sont recommandés [voir Changements métaboliques et INFORMATIONS PATIENTS ].
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments ) pour les formulations orales.
Les patients doivent être informés des problèmes suivants et invités à alerter leur médecin prescripteur si ceux-ci surviennent lors de la prise de ZYPREXA 15 mg en monothérapie ou en association avec la fluoxétine. Si vous pensez que votre état ne s'améliore pas ou si vous avez des inquiétudes concernant votre état pendant que vous prenez ZYPREXA 2,5 mg, appelez votre médecin. Lors de l'utilisation de ZYPREXA et de fluoxétine en association, reportez-vous également à la section Informations sur les conseils aux patients de la notice de Symbyax.
Patients âgés atteints de psychose liée à la démence : augmentation de la mortalité et des événements indésirables cérébrovasculaires (CVAE), y compris les accidents vasculaires cérébraux
Les patients et les soignants doivent être informés que les patients âgés atteints de psychose liée à la démence traités avec des médicaments antipsychotiques présentent un risque accru de décès. Les patients et les soignants doivent être informés que les patients âgés atteints de psychose liée à la démence traités par ZYPREXA ont eu une incidence significativement plus élevée d'événements indésirables cérébrovasculaires (par exemple, accident vasculaire cérébral, accident ischémique transitoire) par rapport au placebo.
ZYPREXA n'est pas approuvé pour les patients âgés atteints de psychose liée à la démence [voir AVERTISSEMENT ENCADRÉ et AVERTISSEMENTS ET PRECAUTIONS ].
Syndrome malin des neuroleptiques (SMN)
Les patients et les soignants doivent être informés qu'un complexe de symptômes potentiellement mortel, parfois appelé SMN, a été signalé en association avec l'administration de médicaments antipsychotiques, y compris ZYPREXA. Les signes et symptômes du SMN comprennent l'hyperpyrexie, la rigidité musculaire, l'altération de l'état mental et des signes d'instabilité autonome (pouls ou tension artérielle irréguliers, tachycardie, diaphorèse et dysrythmie cardiaque) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS)
Les patients doivent être avisés de signaler à leur fournisseur de soins de santé dès l'apparition de tout signe et symptôme pouvant être associé à une réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Hyperglycémie et diabète sucré
Les patients doivent être informés du risque potentiel d'effets indésirables liés à l'hyperglycémie. Les patients doivent être surveillés régulièrement pour détecter une aggravation du contrôle glycémique. Les patients diabétiques doivent suivre les instructions de leur médecin concernant la fréquence de contrôle de leur glycémie pendant la prise de ZYPREXA [voir AVERTISSEMENTS ET PRECAUTIONS ].
Dyslipidémie
Les patients doivent être informés qu'une dyslipidémie s'est produite pendant le traitement par ZYPREXA. Les patients doivent faire surveiller régulièrement leur profil lipidique [voir AVERTISSEMENTS ET PRECAUTIONS ].
Gain de poids
Les patients doivent être informés qu'une prise de poids est survenue pendant le traitement par ZYPREXA. Les patients doivent faire surveiller leur poids régulièrement [voir AVERTISSEMENTS ET PRECAUTIONS ].
Hypotension orthostatique
Les patients doivent être informés du risque d'hypotension orthostatique, en particulier pendant la période de titration de la dose initiale et en association avec l'utilisation concomitante de médicaments susceptibles de potentialiser l'effet orthostatique de ZYPREXA, par exemple le diazépam ou l'alcool [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ]. Il faut conseiller aux patients de changer de position avec précaution pour aider à prévenir l'hypotension orthostatique et de s'allonger s'ils se sentent étourdis ou s'évanouissent jusqu'à ce qu'ils se sentent mieux. Les patients doivent être avisés d'appeler leur médecin s'ils présentent l'un des signes et symptômes suivants associés à une hypotension orthostatique : étourdissements, rythme cardiaque rapide ou lent ou évanouissement.
Potentiel de déficience cognitive et motrice
Étant donné que ZYPREXA a le potentiel d'altérer le jugement, la réflexion ou les capacités motrices, les patients doivent être avertis de l'utilisation de machines dangereuses, y compris les automobiles, jusqu'à ce qu'ils soient raisonnablement certains que le traitement par ZYPREXA ne les affecte pas négativement [voir AVERTISSEMENTS ET PRECAUTIONS ].
Régulation de la température corporelle
Les patients doivent être informés des soins appropriés pour éviter la surchauffe et la déshydratation. Il faut conseiller aux patients d'appeler immédiatement leur médecin s'ils tombent gravement malades et présentent certains ou tous ces symptômes de déshydratation : transpiration excessive ou pas du tout, bouche sèche, sensation de chaleur intense, sensation de soif, incapacité à produire de l'urine [ voir AVERTISSEMENTS ET PRECAUTIONS ].
Médicament concomitant
Les patients doivent être informés qu'ils doivent informer leur professionnel de la santé s'ils prennent ou envisagent de prendre Symbyax. Les patients doivent également être avisés d'informer leur professionnel de la santé s'ils prennent, prévoient de prendre ou ont cessé de prendre des médicaments sur ordonnance ou en vente libre, y compris des suppléments à base de plantes, car il existe un risque d'interactions [voir INTERACTIONS MÉDICAMENTEUSES ].
De l'alcool
Il faut conseiller aux patients d'éviter l'alcool pendant la prise de ZYPREXA [voir INTERACTIONS MÉDICAMENTEUSES ].
Phénylcétonuriques
ZYPREXA 10 mg ZYDIS (comprimés d'olanzapine à dissolution orale) contient de la phénylalanine (0,34, 0,45, 0,67 ou 0,90 mg par comprimé de 5, 10, 15 ou 20 mg, respectivement) [voir LA DESCRIPTION ].
Utilisation dans des populations spécifiques
Grossesse
Conseillez aux femmes d'informer leur fournisseur de soins de santé si elles tombent enceintes ou ont l'intention de tomber enceintes pendant le traitement par ZYPREXA. Informez les patients que ZYPREXA peut provoquer des symptômes extrapyramidaux et/ou de sevrage (agitation, hypertonie, hypotonie, tremblements, somnolence, détresse respiratoire et trouble de l'alimentation) chez un nouveau-né. Informez les patientes qu'il existe un registre d'exposition pendant la grossesse qui surveille l'issue de la grossesse chez les femmes exposées à ZYPREXA 7,5 mg pendant la grossesse [voir Utilisation dans des populations spécifiques ].
Lactation
Conseillez aux femmes allaitantes utilisant ZYPREXA 20 mg de surveiller les nourrissons pour une sédation excessive, une irritabilité, une mauvaise alimentation et des symptômes extrapyramidaux (tremblements et mouvements musculaires anormaux) et de consulter un médecin si elles remarquent ces signes. [voir Utilisation dans des populations spécifiques ].
Infertilité
Informez les femmes en âge de procréer que ZYPREXA peut altérer la fertilité en raison d'une augmentation des taux de prolactine sérique. Les effets sur la fertilité sont réversibles [voir Utilisation dans des populations spécifiques ].
Utilisation pédiatrique
ZYPREXA 15 mg est indiqué dans le traitement de la schizophrénie et des épisodes maniaques ou mixtes associés au trouble bipolaire I chez les adolescents de 13 à 17 ans. Comparativement aux patients des essais cliniques pour adultes, les adolescents étaient susceptibles de prendre plus de poids, de subir une sédation accrue et d'avoir des augmentations plus importantes des taux de cholestérol total, de triglycérides, de cholestérol LDL, de prolactine et d'aminotransférase hépatique. Les patients doivent être informés des risques potentiels à long terme associés à ZYPREXA et informés que ces risques peuvent les amener à envisager d'abord d'autres médicaments [voir INDICATIONS ET USAGE ]. La sécurité et l'efficacité de ZYPREXA 5 mg chez les patients de moins de 13 ans n'ont pas été établies. La sécurité et l'efficacité de ZYPREXA 15 mg et de la fluoxétine en association chez les patients âgés de 10 à 17 ans ont été établies pour le traitement aigu des épisodes dépressifs associés au trouble bipolaire I. La sécurité et l'efficacité de ZYPREXA et de la fluoxétine en association chez les patients de moins de 10 ans n'ont pas été établies [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Besoin d'un programme de traitement complet chez les patients pédiatriques
ZYPREXA 20 mg est indiqué dans le cadre d'un programme de traitement total pour les patients pédiatriques atteints de schizophrénie et de trouble bipolaire pouvant inclure d'autres mesures (psychologiques, éducatives, sociales) pour les patients atteints de ce trouble. L'efficacité et l'innocuité de ZYPREXA 7,5 mg n'ont pas été établies chez les patients pédiatriques de moins de 13 ans. Les antipsychotiques atypiques ne sont pas destinés à être utilisés chez les patients pédiatriques qui présentent des symptômes secondaires à des facteurs environnementaux et/ou à d'autres troubles psychiatriques primaires. Un placement éducatif approprié est essentiel et une intervention psychosociale est souvent utile. La décision de prescrire un antipsychotique atypique dépendra de l'évaluation par le professionnel de la santé de la chronicité et de la gravité des symptômes du patient [voir INDICATIONS ET USAGE ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Des études de cancérogénicité par voie orale ont été menées chez la souris et le rat. L'olanzapine a été administrée à des souris dans deux études de 78 semaines à des doses de 3, 10, 30/20 mg/kg/jour (équivalant à 0,8 à 5 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m²) et 0,25, 2 , 8 mg/kg/jour (équivalent à 0,06 à 2 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m²). Des rats ont reçu pendant 2 ans des doses de 0,25, 1, 2,5, 4 mg/kg/jour (mâles) et 0,25, 1, 4, 8 mg/kg/jour (femelles) (équivalant à 0,13-2 et 0,13-4 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m², respectivement). L'incidence des hémangiomes hépatiques et des hémangiosarcomes a été significativement augmentée dans 1 étude chez la souris chez des souris femelles à 2 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m². Ces tumeurs n'ont pas été augmentées dans une autre étude de souris dans les femelles dosées jusqu'à 2-5 fois le MRHD oral quotidien basé sur la superficie de corps de ² de mg/m ; dans cette étude, il y avait une incidence élevée de mortalités précoces chez les mâles du groupe 30/20 mg/kg/jour. L'incidence des adénomes et des adénocarcinomes de la glande mammaire a été significativement augmentée chez les souris femelles ayant reçu une dose ≥ 2 mg/kg/jour et chez les rats femelles ayant reçu une dose ≥ 4 mg/kg/jour (0,5 et 2 fois la MRHD orale quotidienne basée sur mg/m² surface corporelle, respectivement). Il a été démontré que les médicaments antipsychotiques élèvent de manière chronique les taux de prolactine chez les rongeurs. Les taux sériques de prolactine n'ont pas été mesurés au cours des études de cancérogénicité de l'olanzapine ; cependant, les mesures au cours des études de toxicité subchronique ont montré que l'olanzapine augmentait les taux de prolactine sérique jusqu'à 4 fois chez les rats aux mêmes doses utilisées dans l'étude de cancérogénicité. Une augmentation des néoplasmes des glandes mammaires a été observée chez les rongeurs après l'administration chronique d'autres médicaments antipsychotiques et est considérée comme étant médiée par la prolactine. La pertinence pour le risque humain de la découverte de tumeurs endocrines médiées par la prolactine chez les rongeurs est inconnue [voir AVERTISSEMENTS ET PRECAUTIONS ].
Mutagenèse
Aucune preuve de potentiel génotoxique de l'olanzapine n'a été trouvée dans le test de mutation inverse d'Ames, le test du micronoyau in vivo chez la souris, le test d'aberration chromosomique dans les cellules ovariennes de hamster chinois, le test de synthèse d'ADN non programmé dans les hépatocytes de rat, le test d'induction de mutation directe dans les cellules de lymphome de souris , ou test in vivo d'échange de chromatides sœurs dans la moelle osseuse de hamsters chinois.
Altération de la fertilité
Dans une étude sur la fertilité orale et les performances de reproduction chez le rat, les performances d'accouplement des mâles, mais pas la fertilité, ont été altérées à une dose de 22,4 mg/kg/jour et la fertilité des femelles a diminué à une dose de 3 mg/kg/jour (11 et 1,5 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m², respectivement). L'arrêt du traitement à l'olanzapine a inversé les effets sur les performances d'accouplement des mâles. Chez les rats femelles, la période précoïtale a été augmentée et l'indice d'accouplement réduit à 5 mg/kg/jour (2,5 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m²). Diestrous a été prolongé et œstrus retardé à 1,1 mg/kg/jour (0,6 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m²); par conséquent, l'olanzapine peut retarder l'ovulation.
Utilisation dans des populations spécifiques
Lors de l'utilisation de ZYPREXA et de fluoxétine en association, reportez-vous également à la section Utilisation dans des populations spécifiques de la notice de Symbyax.
Grossesse
Registre d'exposition pendant la grossesse
Il existe un registre d'exposition pendant la grossesse qui surveille les résultats de la grossesse chez les femmes exposées à des antipsychotiques atypiques, y compris ZYPREXA, pendant la grossesse. Les prestataires de soins de santé sont encouragés à enregistrer les patientes en contactant le Registre national des grossesses pour les antipsychotiques atypiques au 1-866-961-2388 ou en visitant http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Résumé des risques
Les nouveau-nés exposés à des médicaments antipsychotiques, y compris ZYPREXA, au cours du troisième trimestre sont à risque de symptômes extrapyramidaux et/ou de sevrage après l'accouchement (voir Considérations cliniques ). Dans l'ensemble, les données disponibles provenant d'études épidémiologiques publiées portant sur des femmes enceintes exposées à l'olanzapine n'ont pas établi de risque associé au médicament de malformations congénitales majeures, de fausses couches ou d'issues maternelles ou fœtales indésirables (voir Données ). Il existe des risques pour la mère associés à la schizophrénie ou au trouble bipolaire I non traités et à l'exposition aux antipsychotiques, y compris ZYPREXA 7,5 mg, pendant la grossesse (voir Considérations cliniques ).
L'olanzapine n'a pas été tératogène lorsqu'elle a été administrée par voie orale à des rats et des lapins gravides à des doses 9 et 30 fois supérieures à la dose orale quotidienne maximale recommandée chez l'homme (MRHD), basée sur la surface corporelle en mg/m² ; certaines toxicités fœtales ont été observées à ces doses (voir Données ).
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour les populations indiquées est inconnu. Toutes les grossesses présentent un risque de fond de malformations congénitales, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Considérations cliniques
Risque maternel et embryonnaire/fœtal associé à la maladie
Il existe un risque pour la mère de schizophrénie non traitée ou de trouble bipolaire I, y compris un risque accru de rechute, d'hospitalisation et de suicide. La schizophrénie et le trouble bipolaire I sont associés à une augmentation des issues périnatales indésirables, y compris l'accouchement prématuré. On ne sait pas s'il s'agit d'un résultat direct de la maladie ou d'autres facteurs comorbides.
Effets indésirables fœtaux/néonatals
Des symptômes extrapyramidaux et/ou de sevrage, notamment agitation, hypertonie, hypotonie, tremblements, somnolence, détresse respiratoire et troubles de l'alimentation, ont été rapportés chez des nouveau-nés exposés à des médicaments antipsychotiques, dont ZYPREXA 2,5 mg, au cours du troisième trimestre de la grossesse. Ces symptômes ont varié en gravité. Surveiller les nouveau-nés pour des symptômes extrapyramidaux et/ou de sevrage et gérer les symptômes de manière appropriée. Certains nouveau-nés se sont rétablis en quelques heures ou jours sans traitement spécifique ; d'autres ont nécessité une hospitalisation prolongée.
Données
Données humaines
Le passage placentaire a été rapporté dans des rapports d'études publiés ; cependant, le taux de passage placentaire était très variable, allant de 7 % à 167 % à la naissance suite à une exposition pendant la grossesse. La pertinence clinique de cette découverte est inconnue.
Les données publiées provenant d'études observationnelles, de registres des naissances et de rapports de cas qui ont évalué l'utilisation d'antipsychotiques atypiques pendant la grossesse n'établissent pas de risque accru d'anomalies congénitales majeures. Une étude de cohorte rétrospective à partir d'une base de données Medicaid de 9258 femmes exposées aux antipsychotiques pendant la grossesse n'a pas indiqué un risque global accru de malformations congénitales majeures.
Données animales
Dans les études de reproduction orale chez le rat à des doses allant jusqu'à 18 mg/kg/jour et chez le lapin à des doses allant jusqu'à 30 mg/kg/jour (respectivement 9 et 30 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m²), aucun signe de tératogénicité n'a été observé. Dans une étude de tératologie orale chez le rat, des résorptions précoces et une augmentation du nombre de fœtus non viables ont été observées à une dose de 18 mg/kg/jour (9 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m²), et la gestation a été prolongée à 10 mg/kg/jour (5 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m²). Dans une étude de tératologie orale chez le lapin, la toxicité fœtale, manifestée par une augmentation des résorptions et une diminution du poids fœtal, s'est produite à une dose maternellement toxique de 30 mg/kg/jour (30 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m²).
Lactation
Résumé des risques
L'olanzapine est présente dans le lait maternel. Des cas de sédation excessive, d'irritabilité, de mauvaise alimentation et de symptômes extrapyramidaux (tremblements et mouvements musculaires anormaux) ont été rapportés chez des nourrissons exposés à l'olanzapine par le lait maternel (voir Considérations cliniques ). Il n'existe aucune information sur les effets de l'olanzapine sur la production de lait.
Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de ZYPREXA pour la mère et tout effet indésirable potentiel sur l'enfant allaité de ZYPREXA ou de l'affection sous-jacente de la mère.
Considérations cliniques
Les nourrissons exposés à ZYPREXA 7,5 mg doivent être surveillés pour une sédation excessive, une irritabilité, une mauvaise alimentation et des symptômes extrapyramidaux (tremblements et mouvements musculaires anormaux).
Femelles et mâles de potentiel reproducteur
Infertilité
Femelles
Compte tenu de l'action pharmacologique de l'olanzapine (antagonisme des récepteurs D2), le traitement par ZYPREXA peut entraîner une augmentation des taux sériques de prolactine, ce qui peut entraîner une réduction réversible de la fertilité chez les femmes en âge de procréer [voir AVERTISSEMENTS ET PRECAUTIONS ].
Utilisation pédiatrique
La sécurité et l'efficacité de ZYPREXA oral dans le traitement de la schizophrénie et des épisodes maniaques ou mixtes associés au trouble bipolaire I ont été établies dans des études à court terme chez des adolescents (âgés de 13 à 17 ans). L'utilisation de ZYPREXA chez les adolescents est étayée par des preuves issues d'études adéquates et bien contrôlées de ZYPREXA 5 mg dans lesquelles 268 adolescents ont reçu ZYPREXA 20 mg dans une fourchette de 2,5 à 20 mg/jour [voir Etudes cliniques ]. La dose initiale recommandée pour les adolescents est inférieure à celle pour les adultes [voir DOSAGE ET ADMINISTRATION ]. Comparativement aux patients des essais cliniques pour adultes, les adolescents étaient susceptibles de prendre plus de poids, de ressentir une sédation accrue et d'augmenter plus fortement les taux de cholestérol total, de triglycérides, de cholestérol LDL, de prolactine et d'aminotransférase hépatique [voir AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ]. Au moment de décider parmi les traitements alternatifs disponibles pour les adolescents, les cliniciens doivent tenir compte du potentiel accru (chez les adolescents par rapport aux adultes) de prise de poids et de dyslipidémie. Les cliniciens doivent tenir compte des risques potentiels à long terme lorsqu'ils prescrivent aux adolescents, et dans de nombreux cas, cela peut les amener à envisager de prescrire d'abord d'autres médicaments aux adolescents [voir INDICATIONS ET USAGE ].
L'innocuité et l'efficacité de l'olanzapine chez les enfants de moins de 13 ans n'ont pas été établies [voir INFORMATIONS PATIENTS ].
La sécurité et l'efficacité de ZYPREXA 7,5 mg et de la fluoxétine en association chez les enfants et les adolescents (âgés de 10 à 17 ans) ont été établies pour le traitement aigu des épisodes dépressifs associés au trouble bipolaire I.
La sécurité et l'efficacité de ZYPREXA et de la fluoxétine en association chez les enfants de moins de 10 ans n'ont pas été établies.
Utilisation gériatrique
Sur les 2 500 patients ayant participé aux études cliniques de précommercialisation avec l'olanzapine orale, 11 % (263) étaient âgés de 65 ans ou plus. Chez les patients atteints de schizophrénie, il n'y avait aucune indication d'une tolérance différente de l'olanzapine chez les personnes âgées par rapport aux patients plus jeunes. Des études chez des patients âgés atteints de psychose liée à la démence ont suggéré qu'il pourrait y avoir un profil de tolérance différent dans cette population par rapport aux patients plus jeunes atteints de schizophrénie. Les patients âgés atteints de psychose liée à la démence traités par l'olanzapine présentent un risque accru de décès par rapport au placebo. Dans des études contrôlées versus placebo sur l'olanzapine chez des patients âgés atteints de psychose liée à la démence, l'incidence d'événements indésirables vasculaires cérébraux (par exemple, accident vasculaire cérébral, accident ischémique transitoire) a été plus élevée chez les patients traités par olanzapine que chez les patients traités par placebo. L'olanzapine n'est pas approuvée pour le traitement des patients atteints de psychose liée à la démence. De plus, la présence de facteurs susceptibles de diminuer la clairance pharmacocinétique ou d'augmenter la réponse pharmacodynamique à l'olanzapine doit conduire à envisager une dose initiale plus faible pour tout patient gériatrique [voir AVERTISSEMENT ENCADRÉ , DOSAGE ET ADMINISTRATION , et AVERTISSEMENTS ET PRECAUTIONS ].
Les études cliniques sur ZYPREXA et la fluoxétine en association n'ont pas inclus un nombre suffisant de patients âgés de ≥ 65 ans pour déterminer s'ils répondent différemment des patients plus jeunes.
SURDOSAGE
Expérience humaine
Dans les essais de précommercialisation impliquant plus de 3100 patients et/ou sujets sains, un surdosage aigu accidentel ou intentionnel d'olanzapine a été identifié chez 67 patients. Chez le patient prenant la plus grande quantité identifiée, 300 mg, les seuls symptômes signalés étaient la somnolence et les troubles de l'élocution. Dans le nombre limité de patients qui ont été évalués dans les hôpitaux, y compris le patient prenant 300 mg, il n'y a eu aucune observation indiquant un changement indésirable des analytes de laboratoire ou de l'ECG. Les signes vitaux étaient généralement dans les limites normales après un surdosage.
Dans les rapports post-commercialisation de surdosage avec l'olanzapine seule, des symptômes ont été rapportés dans la majorité des cas. Chez les patients symptomatiques, les symptômes avec une incidence ≥ 10 % comprenaient l'agitation/l'agressivité, la dysarthrie, la tachycardie, divers symptômes extrapyramidaux et un niveau de conscience réduit allant de la sédation au coma. Parmi les symptômes les moins fréquemment rapportés figuraient les réactions potentiellement graves sur le plan médical suivantes : aspiration, arrêt cardiorespiratoire, arythmies cardiaques (telles que tachycardie supraventriculaire et 1 patient présentant une pause sinusale avec reprise spontanée d'un rythme normal), délire, possible syndrome malin des neuroleptiques, dépression/arrêt respiratoire. , convulsions, hypertension et hypotension. Eli Lilly and Company a reçu des rapports de décès en association avec une surdose d'olanzapine seule. Dans 1 cas de décès, la quantité d'olanzapine ingérée de manière aiguë a été signalée comme étant peut-être aussi faible que 450 mg d'olanzapine par voie orale; cependant, dans un autre cas, un patient a survécu à une ingestion aiguë d'olanzapine d'environ 2 g d'olanzapine par voie orale.
Gestion du surdosage
Pour obtenir des informations à jour sur la prise en charge d'un surdosage de ZYPREXA (olanzapine), contactez un centre antipoison certifié (1-800-222-1222 ou www.poison.org). La possibilité d'une implication de plusieurs médicaments doit être envisagée. En cas de surdosage aigu, établissez et maintenez une voie aérienne et assurez une oxygénation et une ventilation adéquates, ce qui peut inclure une intubation. Un lavage gastrique (après intubation, si le patient est inconscient) et l'administration de charbon actif avec un laxatif doivent être envisagés. L'administration de charbon actif (1 g) a réduit la Cmax et l'ASC de l'olanzapine orale d'environ 60 %. Comme les niveaux maximaux d'olanzapine ne sont généralement pas atteints avant environ 6 heures après l'administration, le charbon de bois peut être un traitement utile en cas de surdosage d'olanzapine.
La possibilité d'une obnubilation, de convulsions ou d'une réaction dystonique de la tête et du cou suite à un surdosage peut créer un risque d'aspiration avec vomissements induits. La surveillance cardiovasculaire doit commencer immédiatement et doit inclure une surveillance électrocardiographique continue pour détecter d'éventuelles arythmies.
Il n'existe pas d'antidote spécifique à l'olanzapine. Par conséquent, des mesures de soutien appropriées doivent être mises en place. L'hypotension et le collapsus circulatoire doivent être traités par des mesures appropriées telles que des liquides intraveineux et/ou des agents sympathomimétiques. (Ne pas utiliser d'épinéphrine, de dopamine ou d'autres sympathomimétiques à activité bêta-agoniste, car la stimulation bêta peut aggraver l'hypotension dans le cadre d'un blocage alpha induit par l'olanzapine.) Une surveillance et une surveillance médicales étroites doivent se poursuivre jusqu'à ce que le patient se rétablisse.
Pour des informations spécifiques sur le surdosage de lithium ou de valproate, reportez-vous à la section Surdosage des notices de ces produits. Pour des informations spécifiques sur le surdosage avec l'olanzapine et la fluoxétine en association, reportez-vous à la section Surdosage de la notice de Symbyax.
CONTRE-INDICATIONS
- Aucun avec ZYPREXA en monothérapie.
- Lors de l'utilisation de ZYPREXA et de fluoxétine en association, reportez-vous également à la section Contre-indications de la notice de Symbyax.
- Pour des informations spécifiques sur les contre-indications du lithium ou du valproate, reportez-vous à la section Contre-indications des notices de ces autres produits.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le mécanisme d'action de l'olanzapine, dans les indications énumérées, n'est pas clair. Cependant, l'efficacité de l'olanzapine dans la schizophrénie pourrait être médiée par une combinaison d'antagonisme de la dopamine et de la sérotonine de type 2 (5HT2).
Pharmacodynamie
L'olanzapine se lie avec une haute affinité aux récepteurs suivants : sérotonine 5HT2A/2C, 5HT6 (Ki=4, 11 et 5 nM, respectivement), dopamine D1-4 (Ki=11-31 nM), histamine H1 (Ki=7 nM ), et les récepteurs α1 adrénergiques (Ki = 19 nM). L'olanzapine est un antagoniste avec une affinité modérée pour la sérotonine 5HT3 (Ki = 57 nM) et la muscarinique M1-5 (Ki = 73, 96, 132, 32 et 48 nM, respectivement). L'olanzapine se lie avec une faible affinité aux récepteurs GABAA, BZD et β-adrénergiques (Ki> 10 μM).
Pharmacocinétique
Administration orale, monothérapie
L'olanzapine est bien absorbée et atteint des concentrations maximales environ 6 heures après une prise orale. Il est éliminé en grande partie par métabolisme de premier passage, environ 40 % de la dose étant métabolisée avant d'atteindre la circulation systémique. La nourriture n'affecte pas le taux ou l'étendue de l'absorption de l'olanzapine. Des études pharmacocinétiques ont montré que les comprimés ZYPREXA 5 mg et les formes posologiques ZYPREXA ZYDIS (comprimés d'olanzapine à dissolution orale) d'olanzapine sont bioéquivalents.
L'olanzapine présente une cinétique linéaire sur toute la plage de dosage clinique. Sa demi-vie varie de 21 à 54 heures (5e au 95e centile ; moyenne de 30 heures) et sa clairance plasmatique apparente varie de 12 à 47 L/h (5e au 95e centile ; moyenne de 25 L/h).
L'administration d'olanzapine une fois par jour conduit à des concentrations à l'état d'équilibre en environ 1 semaine qui sont environ le double des concentrations après des doses uniques. Les concentrations plasmatiques, la demi-vie et la clairance de l'olanzapine peuvent varier d'un individu à l'autre en fonction du statut tabagique, du sexe et de l'âge.
L'olanzapine est largement distribuée dans tout l'organisme, avec un volume de distribution d'environ 1 000 L. Elle est liée à 93 % aux protéines plasmatiques sur la plage de concentration de 7 à 1 100 ng/mL, se liant principalement à l'albumine et à la glycoprotéine α1-acide.
Métabolisme et élimination
Après une dose orale unique d'olanzapine marquée au 14C, 7 % de la dose d'olanzapine ont été récupérés dans l'urine sous forme inchangée, ce qui indique que l'olanzapine est hautement métabolisée. Environ 57 % et 30 % de la dose ont été récupérés dans l'urine et les fèces, respectivement. Dans le plasma, l'olanzapine ne représentait que 12 % de l'ASC de la radioactivité totale, ce qui indique une exposition significative aux métabolites. Après administration multiple, les principaux métabolites circulants étaient le 10-N-glucuronide, présent à l'état d'équilibre à 44 % de la concentration d'olanzapine, et le 4´-N-desméthyl olanzapine, présent à l'état d'équilibre à 31 % de la concentration d'olanzapine. . Les deux métabolites manquent d'activité pharmacologique aux concentrations observées.
La glucuronidation directe et l'oxydation médiée par le cytochrome P450 (CYP) sont les principales voies métaboliques de l'olanzapine. Des études in vitro suggèrent que les CYP 1A2 et 2D6 et le système monooxygénase contenant de la flavine sont impliqués dans l'oxydation de l'olanzapine. L'oxydation médiée par le CYP2D6 semble être une voie métabolique mineure in vivo, car la clairance de l'olanzapine n'est pas réduite chez les sujets déficients en cette enzyme.
Administration intramusculaire
ZYPREXA intramusculaire entraîne une absorption rapide avec des concentrations plasmatiques maximales survenant en 15 à 45 minutes. D'après une étude pharmacocinétique chez des volontaires sains, une dose de 5 mg d'olanzapine intramusculaire pour injection produit, en moyenne, une concentration plasmatique maximale environ 5 fois supérieure à la concentration plasmatique maximale produite par une dose de 5 mg d'olanzapine orale. L'aire sous la courbe obtenue après une dose intramusculaire est similaire à celle obtenue après administration orale de la même dose. La demi-vie observée après administration intramusculaire est similaire à celle observée après administration orale. La pharmacocinétique est linéaire sur toute la plage de dosage clinique. Les profils métaboliques après administration intramusculaire sont qualitativement similaires aux profils métaboliques après administration orale.
Populations spécifiques
Insuffisance rénale
Étant donné que l'olanzapine est hautement métabolisée avant l'excrétion et que seulement 7 % du médicament est excrété sous forme inchangée, il est peu probable que l'insuffisance rénale seule ait un impact majeur sur la pharmacocinétique de l'olanzapine. Les caractéristiques pharmacocinétiques de l'olanzapine étaient similaires chez les patients atteints d'insuffisance rénale sévère et chez les sujets normaux, ce qui indique qu'un ajustement posologique en fonction du degré d'insuffisance rénale n'est pas nécessaire. De plus, l'olanzapine n'est pas éliminée par dialyse. L'effet de l'insuffisance rénale sur l'élimination des métabolites n'a pas été étudié.
Insuffisance hépatique
Bien que l'on puisse s'attendre à ce que la présence d'une insuffisance hépatique réduise la clairance de l'olanzapine, une étude de l'effet de l'insuffisance hépatique chez des sujets (n = 6) atteints de cirrhose cliniquement significative (Childs Pugh Classification A et B) a révélé peu d'effet sur la pharmacocinétique. d'olanzapine.
Gériatrique
Dans une étude portant sur 24 sujets sains, la demi-vie d'élimination moyenne de l'olanzapine était environ 1,5 fois plus élevée chez les personnes âgées (≥ 65 ans) que chez les sujets non âgés ( DOSAGE ET ADMINISTRATION ].
Le genre
La clairance de l'olanzapine est environ 30 % plus faible chez les femmes que chez les hommes. Il n'y avait cependant aucune différence apparente entre les hommes et les femmes en termes d'efficacité ou d'effets indésirables. Des modifications posologiques basées sur le sexe ne devraient pas être nécessaires.
Statut de fumeur
La clairance de l'olanzapine est d'environ 40 % plus élevée chez les fumeurs que chez les non-fumeurs, bien que des modifications posologiques ne soient pas systématiquement recommandées.
Course
Des études in vivo ont montré que les expositions sont similaires chez les Japonais, les Chinois et les Caucasiens, en particulier après normalisation des différences de poids corporel. Les modifications de dosage pour la race ne sont donc pas recommandées.
Effets combinés
Les effets combinés de l'âge, du tabagisme et du sexe pourraient entraîner des différences pharmacocinétiques substantielles dans les populations. La clairance chez les jeunes hommes fumeurs, par exemple, peut être 3 fois plus élevée que chez les femmes âgées non-fumeuses. Une modification de la posologie peut être nécessaire chez les patients qui présentent une combinaison de facteurs pouvant entraîner un ralentissement du métabolisme de l'olanzapine [voir DOSAGE ET ADMINISTRATION ].
Adolescents (13 à 17 ans)
Dans les études cliniques, la plupart des adolescents étaient non-fumeurs et cette population avait un poids corporel moyen inférieur, ce qui a entraîné une exposition moyenne à l'olanzapine plus élevée que celle des adultes.
Toxicologie animale et/ou pharmacologie
Dans les études animales avec l'olanzapine, les principaux résultats hématologiques étaient des cytopénies périphériques réversibles chez des chiens individuels dosés à 10 mg/kg (17 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m²), des diminutions liées à la dose des lymphocytes et des neutrophiles chez la souris. , et la lymphopénie chez le rat. Quelques chiens traités avec 10 mg/kg ont développé une neutropénie réversible et/ou une anémie hémolytique réversible entre 1 et 10 mois de traitement. Des diminutions liées à la dose des lymphocytes et des neutrophiles ont été observées chez des souris ayant reçu des doses de 10 mg/kg (égales à 2 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m²) dans des études d'une durée de 3 mois. Une lymphopénie non spécifique, compatible avec une diminution du gain de poids corporel, est survenue chez des rats recevant 22,5 mg/kg (11 fois la MRHD orale quotidienne basée sur la surface corporelle en mg/m²) pendant 3 mois ou 16 mg/kg (8 fois la MRHD orale quotidienne basée sur sur mg/m² de surface corporelle) pendant 6 ou 12 mois. Aucune preuve de cytotoxicité de la moelle osseuse n'a été trouvée chez aucune des espèces examinées. Les moelles osseuses étaient normocellulaires ou hypercellulaires, ce qui indique que les réductions des cellules sanguines circulantes étaient probablement dues à des facteurs périphériques (non médullaires).
Etudes cliniques
Lors de l'utilisation de ZYPREXA 7,5 mg et de fluoxétine en association, reportez-vous également à la section Études cliniques de la notice de Symbyax.
La schizophrénie
Adultes
L'efficacité de l'olanzapine orale dans le traitement de la schizophrénie a été établie dans 2 essais contrôlés à court terme (6 semaines) chez des patients adultes hospitalisés qui répondaient aux critères du DSM III-R pour la schizophrénie. Un seul bras halopéridol a été inclus en tant que traitement comparatif dans 1 des 2 essais, mais cet essai n'a pas comparé ces 2 médicaments sur la gamme complète de doses cliniquement pertinentes pour les deux.
Plusieurs instruments ont été utilisés pour évaluer les signes et symptômes psychiatriques dans ces études, parmi lesquels la Brief Psychiatric Rating Scale (BPRS), un inventaire multi-items de la psychopathologie générale traditionnellement utilisé pour évaluer les effets du traitement médicamenteux dans la schizophrénie. Le groupe de psychose BPRS (désorganisation conceptuelle, comportement hallucinatoire, méfiance et contenu de pensée inhabituel) est considéré comme un sous-ensemble particulièrement utile pour évaluer les patients schizophrènes psychotiques actifs. Une deuxième évaluation traditionnelle, l'impression clinique globale (CGI), reflète l'impression d'un observateur qualifié, parfaitement familiarisé avec les manifestations de la schizophrénie, sur l'état clinique global du patient. En outre, 2 échelles plus récemment développées ont été utilisées ; ceux-ci comprenaient l'échelle des symptômes positifs et négatifs à 30 éléments (PANSS), dans laquelle sont intégrés les 18 éléments du BPRS, et l'échelle d'évaluation des symptômes négatifs (SANS). Les résumés des essais ci-dessous se concentrent sur les critères de jugement suivants : total PANSS et/ou total BPRS ; cluster psychose BPRS ; sous-échelle négative du PANSS ou SANS ; et Gravité CGI. Les résultats des essais suivent :
(1) Dans un essai contrôlé par placebo de 6 semaines (n = 149) impliquant 2 doses fixes d'olanzapine de 1 et 10 mg/jour (schéma une fois par jour), l'olanzapine, à 10 mg/jour (mais pas à 1 mg/ jour), était supérieur au placebo sur le score total PANSS (également sur le total BPRS extrait), sur le groupe de psychose BPRS, sur la sous-échelle négative PANSS et sur la gravité CGI.
(2) Dans un essai contrôlé par placebo de 6 semaines (n = 253) portant sur 3 gammes de doses fixes d'olanzapine (5 ± 2,5 mg/jour, 10 ± 2,5 mg/jour et 15 ± 2,5 mg/jour) sur un une fois par jour, les 2 groupes recevant la dose la plus élevée d'olanzapine (doses moyennes réelles de 12 et 16 mg/jour, respectivement) étaient supérieurs au placebo sur le score total BPRS, le groupe de psychose BPRS et le score de gravité CGI ; le groupe recevant la dose la plus élevée d'olanzapine était supérieur au placebo sur le SANS. Il n'y avait pas d'avantage clair pour le groupe à dose élevée par rapport au groupe à dose moyenne.
(3) Dans un essai à plus long terme, des patients adultes ambulatoires (n = 326) qui répondaient principalement aux critères du DSM-IV pour la schizophrénie et qui sont restés stables sous olanzapine pendant un traitement en ouvert pendant au moins 8 semaines ont été randomisés pour continuer leur olanzapine actuelle doses (allant de 10 à 20 mg/jour) ou à un placebo. La période de suivi pour observer les rechutes des patients, définie en termes d'augmentation des symptômes positifs au BPRS ou d'hospitalisation, était prévue sur 12 mois, cependant, les critères ont été remplis pour arrêter l'essai prématurément en raison d'un excès de rechutes sous placebo par rapport aux rechutes sous olanzapine , et l'olanzapine était supérieure au placebo sur le délai de rechute, le critère de jugement principal de cette étude. Ainsi, l'olanzapine a été plus efficace que le placebo pour maintenir l'efficacité chez les patients stabilisés depuis environ 8 semaines et suivis pendant une période d'observation allant jusqu'à 8 mois.
L'examen des sous-ensembles de la population (race et sexe) n'a révélé aucune réactivité différentielle sur la base de ces sous-groupes.
Adolescents
L'efficacité de l'olanzapine orale dans le traitement aigu de la schizophrénie chez les adolescents (âgés de 13 à 17 ans) a été établie au cours d'un essai randomisé en double aveugle, contrôlé par placebo, d'une durée de 6 semaines mené auprès de patients hospitalisés et ambulatoires atteints de schizophrénie (n = 107) qui critères de diagnostic selon le DSM-IV-TR et confirmés par le Kiddie Schedule for Affective Disorders and Schizophrenia for School Aged Children-Present and Lifetime Version (K-SADS-PL).
Le principal instrument d'évaluation utilisé pour évaluer les signes et symptômes psychiatriques dans cet essai était le score total de la version ancrée de l'échelle d'évaluation psychiatrique brève pour les enfants (BPRS-C).
Dans cet essai à doses flexibles, l'olanzapine 2,5 à 20 mg/jour (dose modale moyenne de 12,5 mg/jour, dose moyenne de 11,1 mg/jour) s'est avérée plus efficace que le placebo dans le traitement d'adolescents diagnostiqués schizophrènes, comme en témoignent les statistiques réduction moyenne significativement plus importante du score total BPRS-C pour les patients du groupe de traitement par olanzapine que pour ceux du groupe placebo.
Bien qu'il n'existe aucun ensemble de preuves disponibles pour répondre à la question de savoir combien de temps le patient adolescent traité par ZYPREXA doit être maintenu, l'efficacité de la maintenance peut être extrapolée à partir des données sur l'adulte ainsi que des comparaisons des paramètres pharmacocinétiques de l'olanzapine chez les patients adultes et adolescents. Il est généralement recommandé que les patients répondeurs soient poursuivis au-delà de la réponse aiguë, mais à la dose la plus faible nécessaire pour maintenir la rémission. Les patients doivent être réévalués périodiquement pour déterminer la nécessité d'un traitement d'entretien.
Trouble bipolaire I (épisodes maniaques ou mixtes)
Adultes
Monothérapie
L'efficacité de l'olanzapine orale dans le traitement des épisodes maniaques ou mixtes a été établie dans 2 essais à court terme (un de 3 semaines et un de 4 semaines) contrôlés par placebo chez des patients adultes qui répondaient aux critères du DSM-IV pour le trouble bipolaire I avec épisodes maniaques ou mixtes. Ces essais incluaient des patients avec ou sans caractéristiques psychotiques et avec ou sans cycle rapide.
Le principal instrument d'évaluation utilisé pour évaluer les symptômes maniaques dans ces essais était l'échelle d'évaluation de la manie de Young (Y-MRS), une échelle de 11 éléments cotée par un clinicien traditionnellement utilisée pour évaluer le degré de symptomatologie maniaque (irritabilité, comportement perturbateur/agressif, sommeil , humeur élevée, parole, activité accrue, intérêt sexuel, trouble du langage/de la pensée, contenu de la pensée, apparence et perspicacité) dans une plage de 0 (pas de caractéristiques maniaques) à 60 Â (score maximum). Le critère de jugement principal de ces essais était le changement par rapport au départ du score total Y-MRS. Les résultats des essais suivent :
(1) Dans un essai contrôlé par placebo de 3 semaines (n = 67) qui impliquait une gamme de doses d'olanzapine (5-20 mg/jour, une fois par jour, à partir de 10 mg/jour), l'olanzapine était supérieure au placebo dans le réduction du score total Y-MRS. Dans un essai de conception identique mené simultanément avec le premier essai, l'olanzapine a démontré une différence de traitement similaire, mais peut-être en raison de la taille de l'échantillon et de la variabilité du site, ne s'est pas avérée supérieure au placebo sur ce critère de jugement.
(2) Dans un essai contrôlé par placebo de 4 semaines (n = 115) qui impliquait une gamme de doses d'olanzapine (5-20 mg/jour, une fois par jour, commençant à 15 mg/jour), l'olanzapine était supérieure au placebo dans le réduction du score total Y-MRS.
(3) Dans un autre essai, 361 patients répondant aux critères du DSM-IV pour un épisode maniaque ou mixte de trouble bipolaire I ayant répondu lors d'une phase initiale de traitement en ouvert d'environ 2 semaines en moyenne à l'olanzapine 5 à 20 mg/ jour ont été randomisés soit pour la poursuite de l'olanzapine à leur même dose (n=225) soit pour le placebo (n=136), pour l'observation de la rechute. Environ 50 % des patients avaient arrêté le groupe olanzapine au jour 59 et 50 % du groupe placebo avaient arrêté au jour 23 du traitement en double aveugle. La réponse pendant la phase en ouvert a été définie par une diminution du score total Y-MRS à ≤ 12 et HAM-D 21 à ≤ 8. La rechute au cours de la phase en double aveugle était définie comme une augmentation du score total Y-MRS ou HAM-D 21 à ≥ 15, ou une hospitalisation pour manie ou dépression. Dans la phase randomisée, les patients recevant de l'olanzapine en continu ont présenté un délai de rechute significativement plus long.
Adjuvant au lithium ou au valproate
L'efficacité de l'olanzapine orale associée au lithium ou au valproate dans le traitement des épisodes maniaques ou mixtes a été établie dans 2 essais contrôlés chez des patients répondant aux critères du DSM-IV pour le trouble bipolaire I avec épisodes maniaques ou mixtes. Ces essais incluaient des patients avec ou sans caractéristiques psychotiques et avec ou sans cycle rapide. Les résultats des essais suivent :
(1) Dans un essai combiné contrôlé par placebo de 6 semaines, 175 patients ambulatoires sous traitement au lithium ou au valproate présentant des symptômes maniaques ou mixtes insuffisamment contrôlés (Y-MRS ≥ 16) ont été randomisés pour recevoir soit de l'olanzapine, soit un placebo, en association avec leur traitement initial . L'olanzapine (dans un intervalle posologique de 5 à 20 mg/jour, une fois par jour, à partir de 10 mg/jour) associée au lithium ou au valproate (dans un intervalle thérapeutique de 0,6 mEq/L à 1,2 mEq/L ou 50 μg/mL à 125 μg/mL, respectivement) était supérieur au lithium ou au valproate seul dans la réduction du score total Y-MRS.
(2) Dans un deuxième essai d'association contrôlé par placebo de 6 semaines, 169 patients ambulatoires sous traitement au lithium ou au valproate présentant des symptômes maniaques ou mixtes insuffisamment contrôlés (Y-MRS ≥ 16) ont été randomisés pour recevoir soit de l'olanzapine, soit un placebo, en association avec leur traitement d'origine. thérapie. L'olanzapine (dans un intervalle posologique de 5 à 20 mg/jour, une fois par jour, à partir de 10 mg/jour) associée au lithium ou au valproate (dans un intervalle thérapeutique de 0,6 mEq/L à 1,2 mEq/L ou 50 μg/mL à 125 μg/mL, respectivement) était supérieur au lithium ou au valproate seul dans la réduction du score total Y-MRS.
Adolescents
Monothérapie aiguë
L'efficacité de l'olanzapine orale dans le traitement des épisodes maniaques aigus ou mixtes chez les adolescents (âgés de 13 à 17 ans) a été établie au cours d'un essai randomisé, en double aveugle, contrôlé par placebo, d'une durée de 3 semaines mené auprès d'adolescents hospitalisés et ambulatoires répondant au diagnostic critères des épisodes maniaques ou mixtes associés au trouble bipolaire I (avec ou sans caractéristiques psychotiques) selon le DSM-IV-TR (n=161). Le diagnostic a été confirmé par le K-SADS-PL.
Le principal instrument d'évaluation utilisé pour évaluer les symptômes maniaques dans cet essai était le score total de l'échelle d'évaluation structurée de Young-Mania pour adolescents (Y-MRS).
Dans cet essai à doses flexibles, l'olanzapine 2,5 à 20 mg/jour (dose modale moyenne de 10,7 mg/jour, dose moyenne de 8,9 mg/jour) a été plus efficace que le placebo dans le traitement d'adolescents présentant des épisodes maniaques ou mixtes associés à des troubles bipolaires de type I. trouble, comme le confirme la réduction moyenne statistiquement significativement plus importante du score total Y-MRS chez les patients du groupe de traitement par l'olanzapine que dans le groupe placebo.
Bien qu'il n'existe aucun ensemble de preuves disponibles pour répondre à la question de savoir combien de temps le patient adolescent traité par ZYPREXA doit être maintenu, l'efficacité de la maintenance peut être extrapolée à partir des données sur l'adulte ainsi que des comparaisons des paramètres pharmacocinétiques de l'olanzapine chez les patients adultes et adolescents. Il est généralement recommandé que les patients répondeurs soient poursuivis au-delà de la réponse aiguë, mais à la dose la plus faible nécessaire pour maintenir la rémission. Les patients doivent être réévalués périodiquement pour déterminer la nécessité d'un traitement d'entretien.
Agitation associée à la schizophrénie et à la manie bipolaire I
L'efficacité de l'olanzapine intramusculaire pour injection pour le traitement de l'agitation a été établie dans 3 essais contrôlés par placebo à court terme (24 heures de traitement IM) chez des patients adultes agités hospitalisés de 2 groupes de diagnostic : schizophrénie et trouble bipolaire I (épisodes maniaques ou mixtes) . Chacun des essais comprenait un seul bras de traitement comparateur actif d'injection d'halopéridol (études sur la schizophrénie) ou d'injection de lorazépam (étude sur la manie bipolaire). Les patients inscrits aux essais devaient être : (1) jugés par les investigateurs cliniques comme des candidats cliniquement agités et cliniquement appropriés pour un traitement par voie intramusculaire, et (2) présentant un niveau d'agitation qui atteignait ou dépassait un score seuil ≥ 14 sur les 5 éléments composant la composante excitée de l'échelle du syndrome positif et négatif (PANSS) (c'est-à-dire, mauvais contrôle des impulsions, tension, hostilité, manque de coopération et excitation) avec au moins 1 point individuel score ≥ 4 en utilisant un système de notation de 1 à 7 (1 = absent, 4=modéré, 7=extrême). Dans les études, le score moyen initial de la composante excitée du PANSS était de 18,4, avec des scores allant de 13 à 32 (sur un score maximum de 35), suggérant ainsi des niveaux d'agitation principalement modérés, certains patients présentant des niveaux d'agitation légers ou sévères. La principale mesure d'efficacité utilisée pour évaluer les signes et symptômes d'agitation dans ces essais était le changement par rapport à la ligne de base de la composante excitée du PANSS 2 heures après l'injection. Les patients pouvaient recevoir jusqu'à 3 injections pendant les périodes de traitement IM de 24 heures ; cependant, les patients ne pouvaient pas recevoir la deuxième injection avant la fin de la période initiale de 2 heures au cours de laquelle la principale mesure d'efficacité a été évaluée. Les résultats des essais suivent :
(1) Dans un essai contrôlé contre placebo chez des patients hospitalisés agités répondant aux critères du DSM-IV pour la schizophrénie (n = 270), 4 doses intramusculaires fixes d'olanzapine pour injection de 2,5 mg, 5 mg, 7,5 mg et 10 mg ont été évaluées. Toutes les doses étaient statistiquement supérieures au placebo sur la composante excitée du PANSS à 2 heures après l'injection. Cependant, l'effet était plus important et plus constant pour les 3 doses les plus élevées. Il n'y avait pas de différences significatives par paires pour les doses de 7,5 et 10 mg par rapport à la dose de 5 mg.
(2) Dans un deuxième essai contrôlé par placebo chez des patients hospitalisés agités répondant aux critères du DSM-IV pour la schizophrénie (n = 311), 1 dose intramusculaire fixe d'olanzapine pour injection de 10 mg a été évaluée. L'olanzapine pour injection était statistiquement supérieure au placebo sur la composante excitée du PANSS 2 heures après l'injection.
(3) Dans un essai contrôlé par placebo chez des patients hospitalisés agités répondant aux critères du DSM-IV pour le trouble bipolaire I (et présentant actuellement un épisode maniaque aigu ou mixte avec ou sans caractéristiques psychotiques) (n = 201), 1 dose intramusculaire fixe d'olanzapine pour injection de 10 mg a été évalué. L'olanzapine pour injection était statistiquement supérieure au placebo sur la composante excitée du PANSS 2 heures après l'injection.
L'examen des sous-ensembles de la population (âge, race et sexe) n'a révélé aucune réactivité différentielle sur la base de ces sous-groupes.
INFORMATIONS PATIENTS
ZYPREXA® (zy-PREX-a) (olanzapine) Comprimé
ZYPREXA® ZYDIS® (zy-PREX-a ZY-dis) (olanzapine) Comprimé à désintégration orale
Lisez le Guide des médicaments fourni avec ZYPREXA avant de commencer à le prendre et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ce Guide de Médication ne prend pas l'endroit de parler à votre docteur de votre état médical ou traitement. Discutez avec votre médecin ou votre pharmacien s'il y a quelque chose que vous ne comprenez pas ou si vous voulez en savoir plus sur ZYPREXA.
Quelle est l'information la plus importante que je devrais connaître sur ZYPREXA ?
ZYPREXA 20 mg peut provoquer des effets indésirables graves, notamment :
Ces effets secondaires graves sont décrits ci-dessous.
1. Risque accru de décès chez les personnes âgées qui sont confuses, ont des pertes de mémoire et ont perdu le contact avec la réalité (psychose liée à la démence). ZYPREXA n'est pas approuvé pour le traitement de la psychose chez les personnes âgées atteintes de démence.
2. Glycémie élevée (hyperglycémie). Une glycémie élevée peut survenir si vous souffrez déjà de diabète ou si vous n'avez jamais eu de diabète. Une glycémie élevée peut entraîner :
- une accumulation d'acide dans le sang due aux corps cétoniques (acidocétose)
- coma
- décès
Votre médecin doit faire des tests pour vérifier votre glycémie avant que vous ne commenciez à prendre ZYPREXA 7,5 mg et pendant le traitement. Chez les personnes non diabétiques, il arrive parfois que l'hyperglycémie disparaisse à l'arrêt de ZYPREXA 7,5 mg. Les personnes atteintes de diabète et certaines personnes qui n'étaient pas atteintes de diabète avant de prendre ZYPREXA doivent prendre des médicaments contre l'hyperglycémie même après avoir arrêté de prendre ZYPREXA.
Si vous êtes diabétique, suivez les instructions de votre médecin concernant la fréquence de contrôle de votre glycémie pendant que vous prenez ZYPREXA.
Appelez votre médecin si vous présentez l'un de ces symptômes d'hyperglycémie (hyperglycémie) pendant que vous prenez ZYPREXA :
- avoir très soif
- besoin d'uriner plus que d'habitude
- avoir très faim
- se sentir faible ou fatigué
- avoir mal au ventre
- vous vous sentez confus ou votre haleine sent le fruit
3. Niveaux élevés de graisses dans le sang (cholestérol et triglycérides). Des taux élevés de graisses peuvent survenir chez les personnes traitées par ZYPREXA 10 mg, en particulier chez les adolescents (13 à 17 ans), ou lorsqu'il est utilisé en association avec la fluoxétine chez les enfants (10 à 17 ans). Il se peut que vous ne présentiez aucun symptôme. Votre médecin doit donc effectuer des analyses de sang pour vérifier vos taux de cholestérol et de triglycérides avant que vous ne commenciez à prendre ZYPREXA et pendant le traitement.
4. Gain de poids. La prise de poids est très fréquente chez les personnes qui prennent ZYPREXA. Les adolescents (13 à 17 ans) sont plus susceptibles de prendre du poids et d'en prendre plus que les adultes. Les enfants (âgés de 10 à 17 ans) sont également plus susceptibles de prendre du poids et de prendre plus de poids que les adultes lorsque ZYPREXA 7,5 mg est utilisé en association avec la fluoxétine. Certaines personnes peuvent prendre beaucoup de poids pendant la prise de ZYPREXA, vous et votre médecin devez donc vérifier votre poids régulièrement. Discutez avec votre médecin des moyens de contrôler la prise de poids, par exemple en adoptant une alimentation saine et équilibrée et en faisant de l'exercice.
Qu'est-ce que ZYPREXA ?
ZYPREXA est un médicament délivré sur ordonnance utilisé pour traiter :
- schizophrénie chez les personnes de 13 ans ou plus.
- trouble bipolaire, y compris :
- épisodes maniaques ou mixtes qui surviennent avec le trouble bipolaire I chez les personnes âgées de 13 ans ou plus.
- épisodes maniaques ou mixtes qui surviennent avec le trouble bipolaire I, lorsqu'il est utilisé avec le médicament lithium ou valproate, chez l'adulte.
- traitement à long terme du trouble bipolaire I chez l'adulte.
- les épisodes de dépression qui surviennent avec le trouble bipolaire I, lorsqu'il est utilisé avec le médicament fluoxétine (Prozac®) chez les personnes âgées de 10 ans ou plus.
- épisodes de dépression qui ne s'améliorent pas après 2 autres médicaments, également appelés dépression résistante au traitement, lorsqu'ils sont utilisés avec le médicament fluoxétine (Prozac), chez l'adulte.
ZYPREXA 7,5 mg n'a pas été approuvé pour une utilisation chez les enfants de moins de 13 ans. ZYPREXA 10 mg en association avec la fluoxétine n'a pas été approuvé pour une utilisation chez les enfants de moins de 10 ans.
Les symptômes de la schizophrénie comprennent le fait d'entendre des voix, de voir des choses qui n'existent pas, d'avoir des croyances qui ne sont pas vraies et d'être méfiant ou renfermé.
Les symptômes du trouble bipolaire I comprennent des périodes alternées de dépression et d'humeur élevée ou irritable, une activité et une agitation accrues, des pensées qui défilent, une conversation rapide, un comportement impulsif et une diminution du besoin de sommeil.
Les symptômes de la dépression résistante au traitement comprennent une baisse de l'humeur, une diminution de l'intérêt, une augmentation des sentiments de culpabilité, une diminution de l'énergie, une diminution de la concentration, des changements d'appétit et des pensées ou comportements suicidaires.
Certains de vos symptômes peuvent s'améliorer avec le traitement. Si vous pensez que votre état ne s'améliore pas, appelez votre médecin.
Que dois-je dire à mon médecin avant de prendre ZYPREXA ?
ZYPREXA peut ne pas vous convenir. Avant de commencer ZYPREXA, informez votre médecin si vous avez ou avez eu :
- problèmes cardiaques
- convulsions
- diabète ou glycémie élevée (hyperglycémie)
- taux élevé de cholestérol ou de triglycérides dans votre sang
- problèmes de foie
- pression artérielle basse ou élevée
- AVC ou « mini-AVC » également appelés accidents ischémiques transitoires (AIT)
- La maladie d'Alzheimer
- glaucome à angle fermé
- hypertrophie de la prostate chez les hommes
- une occlusion intestinale
- phénylcétonurie, car ZYPREXA 5mg ZYDIS contient de la phénylalanine
- cancer du sein
- pensées suicidaires ou se faire du mal
- toute autre condition médicale
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si ZYPREXA 2,5 mg nuira à votre bébé à naître.
- Si vous tombez enceinte pendant que vous recevez ZYPREXA 20 mg, parlez à votre fournisseur de soins de santé de l'enregistrement auprès du Registre national des grossesses pour les antipsychotiques atypiques. Vous pouvez vous inscrire en appelant le 1-866-961-2388 ou en vous rendant sur http://womensmentalhealth.org/clinical-andresearch-programs/pregnancyregistry/.
- allaitez ou envisagez d'allaiter. ZYPREXA passe dans votre lait maternel. Discutez avec votre médecin de la meilleure façon de nourrir votre bébé si vous prenez ZYPREXA.
Dites à votre médecin si vous faites beaucoup d'exercice ou si vous vous trouvez souvent dans des endroits chauds.
Les symptômes du trouble bipolaire I, de la dépression résistante au traitement ou de la schizophrénie peuvent inclure pensées suicidaires ou de vous blesser ou de blesser les autres. Si vous avez ces pensées à tout moment, parlez-en à votre médecin ou rendez-vous immédiatement aux urgences.
Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. ZYPREXA 20 mg et certains médicaments peuvent interagir entre eux et ne pas fonctionner aussi bien, ou provoquer d'éventuels effets indésirables graves. Votre médecin peut vous dire s'il est sécuritaire de prendre ZYPREXA avec vos autres médicaments. Ne commencez ni n'arrêtez aucun médicament pendant que vous prenez ZYPREXA sans en parler d'abord à votre médecin.
Comment dois-je prendre ZYPREXA 7,5 mg ?
- Prenez ZYPREXA exactement comme prescrit. Votre médecin devra peut-être modifier (ajuster) la dose de ZYPREXA 15 mg jusqu'à ce qu'elle vous convienne.
- Si vous oubliez une dose de ZYPREXA 20 mg, prenez la dose oubliée dès que vous vous en souvenez. S'il est presque l'heure de la prochaine dose, sautez simplement la dose oubliée et prenez votre prochaine dose à l'heure habituelle. Ne prenez pas deux doses de ZYPREXA 10 mg en même temps.
- Pour éviter des effets secondaires graves, n'arrêtez pas de prendre ZYPREXA soudainement. Si vous devez arrêter de prendre ZYPREXA, votre médecin peut vous dire comment arrêter de le prendre en toute sécurité.
- Si vous avez pris trop de ZYPREXA, appelez immédiatement votre médecin ou votre centre antipoison au 1-800-222-1222 ou obtenez un traitement d'urgence.
- ZYPREXA 10 mg peut être pris avec ou sans nourriture.
- ZYPREXA est généralement pris une fois par jour.
- Prenez ZYPREXA 20mg ZYDIS comme suit :
- Assurez-vous que vos mains sont sèches.
- Ouvrez le sachet et retirez la feuille d'aluminium du blister. Ne poussez pas le comprimé à travers la feuille.
- Dès que vous ouvrez la plaquette thermoformée, retirez le comprimé et mettez-le dans votre bouche.
- Le comprimé se désintégrera rapidement dans votre salive afin que vous puissiez facilement l'avaler avec ou sans boire de liquide.
- Appelez votre médecin si vous pensez que votre état ne s'améliore pas ou si vous avez des inquiétudes concernant votre état pendant que vous prenez ZYPREXA.
Que dois-je éviter pendant que je prends ZYPREXA ?
- ZYPREXA peut causer de la somnolence et affecter votre capacité à prendre des décisions, à penser clairement ou à réagir rapidement. Vous ne devez pas conduire, utiliser de machinerie lourde ou faire d'autres activités dangereuses jusqu'à ce que vous sachiez comment ZYPREXA 7,5 mg vous affecte.
- Évitez de boire de l'alcool pendant que vous prenez ZYPREXA. Boire de l'alcool pendant que vous prenez ZYPREXA peut vous rendre plus somnolent que si vous preniez ZYPREXA 15 mg seul.
Quels sont les effets secondaires possibles de ZYPREXA 5 mg ?
Des effets secondaires graves peuvent survenir lorsque vous prenez ZYPREXA 5 mg, notamment :
- Voir "Quelles sont les informations les plus importantes que je devrais connaître sur ZYPREXA ?", qui décrit le risque accru de décès chez les personnes âgées atteintes de psychose liée à la démence et les risques d'hyperglycémie, de taux élevés de cholestérol et de triglycérides et de prise de poids.
- Incidence accrue d'AVC ou de « mini-AVC » appelés accidents ischémiques transitoires (AIT) chez les personnes âgées atteintes de psychose liée à la démence (personnes âgées qui ont perdu le contact avec la réalité en raison de la confusion et de la perte de mémoire). ZYPREXA n'est pas approuvé pour ces patients.
- Syndrome malin des neuroleptiques (SMN) : Le SMN est une affection rare mais très grave qui peut survenir chez les personnes qui prennent des médicaments antipsychotiques, y compris ZYPREXA. Le SMN peut entraîner la mort et doit être traité à l'hôpital. Appelez immédiatement votre médecin si vous tombez gravement malade et présentez l'un de ces symptômes :
- forte fièvre
- transpiration excessive
- muscles rigides
- confusion
- des changements dans votre respiration, votre rythme cardiaque et votre tension artérielle.
- Réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) : DRESS peut survenir avec ZYPREXA. Les caractéristiques du DRESS peuvent inclure une éruption cutanée, de la fièvre, des ganglions enflés et d'autres atteintes d'organes internes tels que le foie, les reins, les poumons et le cœur. La tenue vestimentaire est parfois mortelle ; par conséquent, prévenez immédiatement votre médecin si vous présentez l'un de ces signes.
- Dyskinésie tardive: Cette condition provoque des mouvements corporels qui se produisent sans cesse et que vous ne pouvez pas contrôler. Ces mouvements affectent généralement le visage et la langue. La dyskinésie tardive peut ne pas disparaître, même si vous arrêtez de prendre ZYPREXA. Il peut également commencer après l'arrêt de ZYPREXA. Dites à votre médecin si vous ressentez des mouvements corporels que vous ne pouvez pas contrôler.
- Diminution de la pression artérielle lorsque vous changez de position, avec des symptômes d'étourdissements, de battements cardiaques rapides ou lents ou d'évanouissements.
- Difficulté à avaler, qui peut faire pénétrer des aliments ou des liquides dans vos poumons.
- Convulsions : informez votre médecin si vous avez une crise pendant le traitement par ZYPREXA.
- Problèmes de contrôle de la température corporelle : Vous pourriez avoir très chaud, par exemple lorsque vous faites beaucoup d'exercice ou que vous restez dans une zone très chaude. Il est important que vous buviez de l'eau pour éviter la déshydratation. Appelez immédiatement votre médecin si vous tombez gravement malade et présentez l'un de ces symptômes de déshydratation :
- transpirer trop ou pas du tout
- bouche sèche
- se sentir très chaud
- avoir soif
- incapable de produire de l'urine.
Les effets secondaires courants de ZYPREXA incluent : manque d'énergie, sécheresse de la bouche, augmentation de l'appétit, somnolence, tremblements (tremblements), selles dures ou peu fréquentes, étourdissements, changements de comportement ou agitation.
Les autres effets secondaires courants chez les adolescents (13 à 17 ans) comprennent : maux de tête, douleurs dans la région de l'estomac (abdominales), douleurs dans les bras ou les jambes ou fatigue. Les adolescents ont connu des augmentations plus importantes de la prolactine, des enzymes hépatiques et de la somnolence que les adultes.
Informez votre médecin de tout effet indésirable qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles avec ZYPREXA. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver ZYPREXA ?
- Conservez ZYPREXA à température ambiante, entre 68°F et 77°F (20°C et 25°C).
- Conservez ZYPREXA à l'abri de la lumière.
- Gardez ZYPREXA 15 mg au sec et à l'abri de l'humidité.
Gardez ZYPREXA 5 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur ZYPREXA
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. N'utilisez pas ZYPREXA pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas ZYPREXA 5mg à d'autres personnes, même si elles ont la même condition. Cela peut leur nuire.
Ce Guide de Médication résume les informations les plus importantes sur ZYPREXA. Si vous souhaitez plus d'informations, parlez-en à votre médecin. Vous pouvez demander à votre médecin ou à votre pharmacien des informations sur ZYPREXA 20 mg destinées aux professionnels de la santé. Pour plus d'informations sur ZYPREXA, appelez le 1-800-Lilly-Rx (1-800-545-5979).
Quels sont les ingrédients de ZYPREXA ?
Ingrédient actif: olanzapine
Ingrédients inactifs:
cire de carnauba, crospovidone, hydroxypropylcellulose, hypromellose, lactose, stéarate de magnésium, cellulose microcristalline et autres ingrédients inactifs. Le revêtement de couleur contient : dioxyde de titane, laque d'aluminium FD&C bleu n° 2 ou oxyde de fer rouge synthétique.
ZYDIS - gélatine, mannitol, aspartame, sodium methyl paraben et sodium propyl paraben.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
