Effexor 37.5mg, 75mg Venlafaxine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
INFORMATIONS PATIENTS
Effexor (venlafaxine) (ven-la-fax-een) Comprimés, USP
Lisez le Guide des médicaments fourni avec les comprimés de venlafaxine, USP avant de commencer à le prendre et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ce Guide de Médication ne prend pas l'endroit de parler à votre pourvoyeur de soins de santé de votre condition médicale ou traitement. Discutez avec votre fournisseur de soins de santé s'il y a quelque chose que vous ne comprenez pas ou si vous voulez en savoir plus.
Quelles sont les informations les plus importantes que je devrais connaître sur les comprimés de venlafaxine, USP ?
Les comprimés de venlafaxine, USP et d'autres médicaments antidépresseurs peuvent provoquer des effets secondaires graves, notamment :
1. Pensées ou actions suicidaires :
- Les comprimés de venlafaxine, USP et d'autres médicaments antidépresseurs peuvent augmenter les pensées ou actions suicidaires chez certains enfants, adolescents ou jeunes adultes au cours des premiers mois de traitement ou lorsque la dose est modifiée.
- La dépression ou d'autres maladies mentales graves sont les causes les plus importantes de pensées ou d'actions suicidaires.
- Surveillez ces changements et appelez immédiatement votre fournisseur de soins de santé si vous remarquez :
- Changements nouveaux ou soudains d'humeur, de comportement, d'actions, de pensées ou de sentiments, surtout s'ils sont graves.
- Portez une attention particulière à ces changements lorsque les comprimés de venlafaxine, USP sont commencés ou lorsque la dose est modifiée.
Gardez toutes les visites de suivi avec votre fournisseur de soins de santé et appelez entre les visites si vous vous inquiétez des symptômes.
Appelez immédiatement votre fournisseur de soins de santé si vous présentez l'un des symptômes suivants, ou appelez le 911 en cas d'urgence, surtout s'ils sont nouveaux, s'aggravent ou vous inquiètent :
- tentatives de suicide
- agir sur des impulsions dangereuses
- comportement agressif ou violent
- pensées sur le suicide ou la mort
- dépression nouvelle ou pire
- crises d'anxiété ou de panique nouvelles ou pires
- se sentir agité, agité, en colère ou irritable
- troubles du sommeil
- une augmentation de l'activité ou parler plus que ce qui est normal pour vous
- autres changements inhabituels de comportement ou d'humeur
Appelez immédiatement votre fournisseur de soins de santé si vous présentez l'un des symptômes suivants ou appelez le 911 en cas d'urgence. Les comprimés de venlafaxine, USP peuvent être associés à ces effets secondaires graves :
2. Syndrome sérotoninergique
Cette condition peut mettre la vie en danger et peut inclure :
- agitation, hallucinations, coma ou autres changements de l'état mental
- problèmes de coordination ou contractions musculaires (réflexes hyperactifs)
- rythme cardiaque accéléré, pression artérielle élevée ou basse
- transpiration ou fièvre
- nausées, vomissements ou diarrhée
- rigidité musculaire
3. Modifications de la tension artérielle. Les comprimés de venlafaxine, USP peuvent :
- augmenter votre tension artérielle. Contrôler l'hypertension artérielle avant de commencer le traitement et surveiller régulièrement la tension artérielle
4. Pupilles élargies (mydriase).
5. Anxiété et insomnie.
6. Changements d'appétit ou de poids.
- les enfants et les adolescents doivent faire surveiller leur taille et leur poids pendant le traitement
7. Épisodes maniaques/hypomaniaques :
- énergie considérablement augmentée
- gros troubles du sommeil
- pensées de course
- comportement imprudent
- des idées exceptionnellement grandioses
- bonheur excessif ou irritabilité
- parler plus ou plus vite que d'habitude
8. Faible taux de sel (sodium) dans le sang.
Les personnes âgées peuvent être plus à risque pour cela. Les symptômes peuvent inclure :
- mal de tête
- faiblesse ou sensation d'instabilité
- confusion, problèmes de concentration ou de réflexion ou problèmes de mémoire
9. Crises ou convulsions.
10. Saignements anormaux : les comprimés de venlafaxine, USP et d'autres médicaments antidépresseurs peuvent augmenter votre risque de saignement ou d'ecchymoses, en particulier si vous prenez de la warfarine, un anticoagulant (Coumadin®, Jantoven®), un anti-inflammatoire non stéroïdien (AINS, comme ibuprofène ou naproxène), ou de l'aspirine.
11. Cholestérol élevé.
12. Maladie pulmonaire et pneumonie : les comprimés de venlafaxine, USP, peuvent causer des problèmes pulmonaires rares. Les symptômes comprennent :
- aggravation de l'essoufflement
- toux
- gêne thoracique
13. Réactions allergiques sévères :
- difficulté à respirer
- gonflement du visage, de la langue, des yeux ou de la bouche
- éruption cutanée, démangeaisons (urticaire) ou cloques, seules ou accompagnées de fièvre ou de douleurs articulaires
14. Problèmes visuels :
- douleur oculaire
- changements de vision
- gonflement ou rougeur dans ou autour de l'œil
Seules certaines personnes sont à risque pour ces problèmes. Vous voudrez peut-être subir un examen de la vue pour voir si vous êtes à risque et recevoir un traitement préventif si vous l'êtes.
N'arrêtez pas les Comprimés de Venlafaxine, USP sans parler d'abord à votre pourvoyeur de soins médicaux. L'arrêt trop rapide des comprimés de venlafaxine, USP ou le changement trop rapide d'un autre antidépresseur peut provoquer des symptômes graves, notamment :
- anxiété, irritabilité
- se sentir fatigué, agité ou avoir des problèmes de sommeil
- maux de tête, transpiration, étourdissements
- sensations de choc électrique, tremblements, confusion, cauchemars
- vomissements, nausées, diarrhée
Qu'est-ce que les comprimés de venlafaxine, USP ?
Les comprimés de venlafaxine, USP sont un médicament d'ordonnance utilisé pour traiter la dépression. Il est important de discuter avec votre fournisseur de soins de santé des risques de traiter la dépression et aussi des risques de ne pas la traiter. Vous devriez discuter de tous les choix de traitement avec votre fournisseur de soins de santé.
Parlez à votre fournisseur de soins de santé si vous ne pensez pas que votre état s'améliore avec les comprimés de venlafaxine, traitement USP.
Qui ne devrait pas prendre les comprimés de venlafaxine, USP ?
- Ne prenez pas de comprimés de venlafaxine, USP si vous :
- êtes allergique aux comprimés de venlafaxine, USP ou à l'un des ingrédients des comprimés de venlafaxine, USP. Voir la fin de ce Guide de Médication pour une liste complète d'ingrédients dans les comprimés venlafaxine, USP.
- avoir un glaucome à angle fermé non contrôlé
- prenez un inhibiteur de la monoamine oxydase (IMAO). Demandez à votre fournisseur de soins de santé ou à votre pharmacien si vous n'êtes pas sûr de prendre un IMAO, y compris l'antibiotique linézolide.
- Ne prenez pas d'IMAO dans les 7 jours suivant l'arrêt des comprimés de venlafaxine, USP, sauf indication contraire de votre médecin.
- Ne commencez pas à prendre des comprimés de venlafaxine, USP si vous avez arrêté de prendre un IMAO au cours des 2 dernières semaines, sauf indication contraire de votre médecin.
Les personnes qui prennent des comprimés de venlafaxine, USP à proximité d'un IMAO peuvent avoir des effets secondaires graves, voire mortels. Consultez immédiatement un médecin si vous présentez l'un de ces symptômes :
- forte fièvre
- spasmes musculaires incontrôlés
- muscles raides
- changements rapides de la fréquence cardiaque ou de la pression artérielle
- confusion
- perte de connaissance (évanouissement)
Que dois-je dire à mon fournisseur de soins de santé avant de prendre des comprimés de venlafaxine, USP ? Demandez si vous n'êtes pas sûr.
Avant de commencer les comprimés de venlafaxine, USP, informez votre fournisseur de soins de santé si vous :
- Prenez certains médicaments tels que :
- Médicaments utilisés pour traiter les migraines tels que :
- triptans
- Médicaments utilisés pour traiter l'humeur, l'anxiété, les troubles psychotiques ou de la pensée, tels que :
- antidépresseurs tricycliques
- lithium
- ISRS
- SNRI
- médicaments antipsychotiques
- Médicaments utilisés pour traiter la douleur tels que :
- tramadol
- Médicaments utilisés pour fluidifier votre sang tels que :
- warfarine
- Médicaments utilisés pour traiter les brûlures d'estomac tels que :
- Cimétidine
- Médicaments en vente libre ou suppléments tels que :
- Aspirine ou autres AINS
- Tryptophane
- Millepertuis
- avoir des problèmes cardiaques
- avoir le diabète
- avoir des problèmes de foie
- avoir des problèmes rénaux
- avoir des problèmes de thyroïde
- avoir un glaucome
- avez ou avez eu des convulsions ou des convulsions
- souffrez de trouble bipolaire ou de manie
- avez un faible taux de sodium dans le sang
- avoir une pression artérielle élevée
- avoir un taux de cholestérol élevé
- avez ou avez eu des problèmes de saignement
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si les comprimés de venlafaxine, USP nuiront à votre bébé à naître. Parlez à votre fournisseur de soins de santé des avantages et des risques du traitement de la dépression pendant la grossesse
- allaitez ou envisagez d'allaiter. Certains comprimés de venlafaxine, USP peuvent passer dans votre lait maternel. Discutez avec votre fournisseur de soins de santé de la meilleure façon de nourrir votre bébé tout en prenant des comprimés de venlafaxine, USP.
Informez votre fournisseur de soins de santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Les comprimés de venlafaxine, USP et certains médicaments peuvent interagir les uns avec les autres, peuvent ne pas fonctionner aussi bien ou peuvent provoquer des effets secondaires graves.
Votre fournisseur de soins de santé ou votre pharmacien peut vous dire s'il est sécuritaire de prendre des comprimés de venlafaxine, USP avec vos autres médicaments. Ne commencez ni n'arrêtez aucun médicament pendant que vous prenez des comprimés de venlafaxine, USP sans en parler d'abord à votre fournisseur de soins de santé.
Si vous prenez des comprimés de venlafaxine, USP, vous ne devez prendre aucun autre médicament contenant de la (venlafaxine), y compris : chlorhydrate de venlafaxine.
Comment dois-je prendre les comprimés de venlafaxine, USP ?
- Prenez les comprimés de venlafaxine, USP exactement comme prescrit. Votre fournisseur de soins de santé devra peut-être modifier la dose de comprimés de venlafaxine, USP jusqu'à ce que ce soit la bonne dose pour vous.
- Les comprimés de venlafaxine, USP doivent être pris avec de la nourriture.
- Si vous manquez une dose de comprimés de venlafaxine, USP, prenez la dose manquée aussitôt que vous vous souvenez. S'il est presque l'heure de la prochaine dose, sautez la dose oubliée et prenez votre prochaine dose à l'heure habituelle. Ne prenez pas deux doses de comprimés de venlafaxine, USP en même temps.
- Si vous prenez trop de comprimés de venlafaxine, USP, appelez immédiatement votre fournisseur de soins de santé ou un centre antipoison, ou obtenez un traitement d'urgence.
- Lors du passage d'un autre antidépresseur aux comprimés de venlafaxine, USP, votre médecin peut vouloir réduire d'abord la dose de l'antidépresseur initial pour éviter les effets secondaires.
Que dois-je éviter pendant que je prends des comprimés de venlafaxine, USP ?
Les comprimés de venlafaxine, USP peuvent causer de la somnolence ou affecter votre capacité à prendre des décisions, à penser clairement ou à réagir rapidement.
Vous ne devez pas conduire, utiliser de machinerie lourde ou faire d'autres activités dangereuses jusqu'à ce que vous sachiez comment les comprimés de venlafaxine, USP vous affectent. Ne buvez pas d'alcool en utilisant des comprimés de venlafaxine, USP.
Quels sont les effets secondaires possibles des comprimés de venlafaxine, USP ?
Les comprimés de venlafaxine, USP peuvent provoquer des effets secondaires graves, notamment :
- Voir "Quelles sont les informations les plus importantes que je devrais connaître sur les comprimés de venlafaxine, USP ?"
- Augmentation du cholestérol - faites vérifier votre cholestérol régulièrement
- Les nouveau-nés dont les mères prennent des comprimés de venlafaxine, USP au cours du troisième trimestre peuvent avoir des problèmes juste après la naissance, notamment :
- problèmes d'alimentation et de respiration
- convulsions
- tremblements, nervosité ou pleurs constants
- Glaucome à angle fermé / pupilles agrandies.
Vérifiez régulièrement la pression oculaire si vous :
- avez des antécédents d'augmentation de la pression oculaire
- sont à risque pour certains types de glaucome
Les effets secondaires possibles courants chez les personnes qui prennent des comprimés de venlafaxine, USP comprennent :
rêves inhabituels
- problèmes sexuels
- perte d'appétit, constipation, diarrhée, nausées ou vomissements, ou bouche sèche
- se sentir fatigué, fatigué ou trop somnolent
- changement des habitudes de sommeil, problèmes de sommeil
- bâillement
- tremblement ou tremblement
- étourdissements, vision floue
- transpiration
- se sentir anxieux, nerveux ou nerveux
- mal de tête
- augmentation du rythme cardiaque
Dites à votre fournisseur de soins de santé si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles des comprimés de venlafaxine, USP.
Pour plus d'informations, demandez à votre fournisseur de soins de santé ou votre pharmacien.
APPELER VOTRE MEDECIN POUR OBTENIR DES CONSEILS MEDICAUX SUR LES EFFETS SECONDAIRES. VOUS POUVEZ SIGNALER LES EFFETS SECONDAIRES À LA FDA AU 1-800-FDA-1088.
Comment dois-je conserver les comprimés de venlafaxine, USP ?
- Conserver à 20° à 25°C (68° à 77°F) excursions permises 15° à 30°C (59° à 86°F) [Voir Température ambiante contrôlée USP ].
- Conservez les comprimés de vélafaxine, USP dans un endroit sec.
Gardez les comprimés de venlafaxine, USP et tous les médicaments hors de la portée des enfants.
Informations générales sur les comprimés de venlafaxine, USP Les médicaments sont parfois prescrits à des fins autres que celles répertoriées dans un Guide des médicaments. N'utilisez pas de comprimés de venlafaxine, USP pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas de comprimés de venlafaxine, USP à d'autres personnes, même si elles ont la même condition. Cela peut leur nuire.
Ce Guide de Médication résume les renseignements les plus importants sur les comprimés venlafaxine, USP. Si vous souhaitez plus d'informations, parlez-en à votre fournisseur de soins de santé. Vous pouvez demander à votre fournisseur de soins de santé ou à votre pharmacien des informations sur les comprimés de venlafaxine, USP, destinés aux professionnels de la santé.
Pour signaler des RÉACTIONS INDÉSIRABLES SUSPECTÉES, contactez Sun Pharmaceutical Industries, Inc. au 1-800-818-4555.
Quels sont les ingrédients des comprimés de venlafaxine, USP ?
Ingrédient actif : (venlafaxine)
Ingrédients inactifs:
- Comprimés : cellulose microcristalline, lactose monohydraté, amidon prégélatinisé, glycolate d'amidon sodique, oxyde de fer rouge, oxyde de fer jaune, dioxyde de silice colloïdale et stéarate de magnésium
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis pour tous les antidépresseurs.
LES INDICATIONS
Trouble dépressif majeur
Les gélules à libération prolongée Effexor XR (chlorhydrate de venlafaxine) sont indiquées pour le traitement du trouble dépressif majeur (TDM). L'efficacité a été établie dans trois essais d'entretien à court terme (4, 8 et 12 semaines) et deux à long terme.
Désordre anxieux généralisé
Effexor XR est indiqué pour le traitement du trouble anxieux généralisé (TAG). L'efficacité a été établie dans deux essais contrôlés par placebo de 8 semaines et deux de 26 semaines.
Trouble d'anxiété sociale
Effexor XR est indiqué pour le traitement du trouble d'anxiété sociale (TAS), également connu sous le nom de phobie sociale. L'efficacité a été établie dans quatre essais contrôlés par placebo de 12 semaines et un de 26 semaines.
Trouble panique
Effexor XR est indiqué pour le traitement du trouble panique (TP), avec ou sans agoraphobie. L'efficacité a été établie dans deux essais contrôlés par placebo de 12 semaines.
DOSAGE ET ADMINISTRATION
Effexor 37,5 mg XR doit être administré en une seule dose avec de la nourriture, soit le matin, soit le soir, à peu près à la même heure chaque jour [voir PHARMACOLOGIE CLINIQUE ]. Chaque gélule doit être avalée entière avec du liquide et non divisée, écrasée, mâchée ou placée dans de l'eau ou elle peut être administrée en ouvrant soigneusement la gélule et en saupoudrant tout le contenu sur une cuillerée de compote de pommes. Ce mélange médicament/aliment doit être avalé immédiatement sans mâcher et suivi d'un verre d'eau pour assurer une ingestion complète des granules (sphéroïdes).
Trouble dépressif majeur
Pour la plupart des patients, la dose initiale recommandée d'Effexor 37,5 mg XR est de 75 mg par jour, administrée en une seule dose. Pour certains patients, il peut être souhaitable de commencer à 37,5 mg par jour pendant 4 à 7 jours pour permettre aux nouveaux patients de s'adapter au médicament avant d'augmenter à 75 mg par jour. Les patients ne répondant pas à la dose initiale de 75 mg par jour peuvent bénéficier d'augmentations de dose jusqu'à un maximum de 225 mg par jour. Les augmentations de dose doivent être effectuées par paliers allant jusqu'à 75 mg par jour, selon les besoins, et doivent être effectuées à des intervalles d'au moins 4 jours, car les taux plasmatiques à l'état d'équilibre de la venlafaxine et de ses principaux métabolites sont atteints chez la plupart des patients au jour 4. [voir PHARMACOLOGIE CLINIQUE ]. Dans les études cliniques établissant l'efficacité, une augmentation de la dose était autorisée à des intervalles de 2 semaines ou plus.
Il convient de noter que, alors que la dose maximale recommandée pour les patients ambulatoires modérément déprimés est également de 225 mg par jour pour Effexor (à libération immédiate), les patients hospitalisés plus sévèrement déprimés dans une étude du programme de développement de ce produit ont répondu à une dose moyenne de 350 mg par jour (fourchette de 150 à 375 mg par jour). On ne sait pas si des doses plus élevées d'Effexor 37,5 mg XR sont nécessaires ou non pour les patients plus gravement déprimés ; cependant, l'expérience avec des doses d'Effexor 75 mg XR supérieures à 225 mg par jour est très limitée.
Désordre anxieux généralisé
Pour la plupart des patients, la dose initiale recommandée d'Effexor XR est de 75 mg par jour, administrée en une seule dose. Pour certains patients, il peut être souhaitable de commencer à 37,5 mg par jour pendant 4 à 7 jours pour permettre aux nouveaux patients de s'adapter au médicament avant d'augmenter à 75 mg par jour. Les patients ne répondant pas à la dose initiale de 75 mg par jour peuvent bénéficier d'augmentations de dose jusqu'à un maximum de 225 mg par jour. Les augmentations de dose doivent être effectuées par paliers allant jusqu'à 75 mg par jour, selon les besoins, et doivent être effectuées à des intervalles d'au moins 4 jours, car les taux plasmatiques à l'état d'équilibre de la venlafaxine et de ses principaux métabolites sont atteints chez la plupart des patients au jour 4. [voir PHARMACOLOGIE CLINIQUE ].
Trouble d'anxiété sociale (phobie sociale)
La dose recommandée est de 75 mg par jour, administrée en une seule prise. Il n'y avait aucune preuve que des doses plus élevées confèrent un avantage supplémentaire.
Trouble panique
La dose initiale recommandée est de 37,5 mg par jour d'Effexor 75 mg XR pendant 7 jours. Les patients ne répondant pas à 75 mg par jour peuvent bénéficier d'augmentations de dose jusqu'à un maximum d'environ 225 mg par jour. Les augmentations de dose doivent se faire par paliers allant jusqu'à 75 mg par jour, selon les besoins, et doivent être effectuées à des intervalles d'au moins 7 jours.
Changement de patients des comprimés Effexor 37,5 mg
Les patients déprimés qui sont actuellement traités à une dose thérapeutique avec Effexor (libération immédiate) peuvent passer à Effexor 37,5 mg XR à la dose équivalente la plus proche (mg par jour), par exemple, 37,5 mg de venlafaxine deux fois par jour à 75 mg Effexor 75 mg XR une fois par jour. Cependant, des ajustements posologiques individuels peuvent être nécessaires.
Populations spécifiques
Patients atteints d'insuffisance hépatique
La dose quotidienne totale doit être réduite de 50 % chez les patients présentant une insuffisance hépatique légère (Child-Pugh = 5-6) à modérée (Child-Pugh = 7-9). Chez les patients présentant une insuffisance hépatique sévère (Child-Pugh = 10-15) ou une cirrhose hépatique, il peut être nécessaire de réduire la dose de 50 % ou plus [voir Utilisation dans des populations spécifiques ].
Patients atteints d'insuffisance rénale
La dose quotidienne totale doit être réduite de 25 % à 50 % chez les patients présentant une insuffisance rénale légère (CLcr= 60-89 mL/min) ou modérée (CLcr= 30-59 mL/min). Chez les patients sous hémodialyse ou présentant une insuffisance rénale sévère (CLcr Utilisation dans des populations spécifiques ].
Traitement d'entretien
Il n'existe aucun ensemble de preuves provenant d'études contrôlées pour indiquer combien de temps les patients atteints de TDM, GAD, SAD ou PD doivent être traités avec Effexor 75 mg XR.
Il est généralement admis que les épisodes aigus de TDM nécessitent plusieurs mois ou plus de traitement pharmacologique soutenu au-delà de la réponse à l'épisode aigu. Effexor XR/Effexor ont démontré une poursuite de la réponse dans les études cliniques jusqu'à 52 semaines, à la même dose à laquelle les patients ont répondu au cours du traitement initial [voir Etudes cliniques ]. On ne sait pas si la dose d'Effexor XR nécessaire pour le traitement d'entretien est identique à la dose nécessaire pour obtenir une réponse initiale. Les patients doivent être réévalués périodiquement pour déterminer la nécessité d'un traitement d'entretien et la dose appropriée pour un tel traitement.
Chez les patients atteints de TAG et de TAS, Effexor 37,5 mg XR s'est avéré efficace dans des études cliniques de 6 mois. La nécessité de poursuivre la médication chez les patients atteints de TAG et de TAS qui s'améliorent avec le traitement par Effexor XR doit être réévaluée périodiquement.
Dans une étude clinique sur la maladie de Parkinson, les patients poursuivant Effexor 75 mg XR à la même dose à laquelle ils ont répondu au cours des 12 semaines initiales de traitement ont connu un temps de rechute statistiquement significativement plus long que les patients randomisés pour recevoir un placebo [voir Etudes cliniques ]. La nécessité de poursuivre la médication chez les patients atteints de MP qui s'améliorent avec le traitement Effexor XR doit être réévaluée périodiquement.
Arrêt d'Effexor XR
Une réduction progressive de la dose, plutôt qu'un arrêt brutal, est recommandée lors de l'arrêt du traitement par Effexor 37,5 mg XR. Dans les études cliniques avec Effexor 37,5 mg XR, la diminution a été obtenue en réduisant la dose quotidienne de 75 mg à des intervalles d'une semaine. L'individualisation du tapering peut être nécessaire [voir AVERTISSEMENTS ET PRECAUTIONS ]. Chez certains patients, l'arrêt peut devoir se produire sur une période de plusieurs mois.
Changement de patients vers ou depuis un inhibiteur de la monoamine oxydase (IMAO) destiné à traiter les troubles psychiatriques
Au moins 14 jours doivent s'écouler entre l'arrêt d'un IMAO (destiné à traiter les troubles psychiatriques) et le début du traitement par Effexor XR. De plus, au moins 7 jours doivent être autorisés après l'arrêt d'Effexor XR avant de commencer un IMAO destiné à traiter les troubles psychiatriques [voir CONTRE-INDICATIONS , AVERTISSEMENTS ET PRECAUTIONS , et INTERACTIONS MÉDICAMENTEUSES ].
Utilisation d'Effexor XR avec d'autres IMAO tels que le linézolide ou le bleu de méthylène intraveineux
Ne pas commencer Effexor 75 mg XR chez un patient traité par linézolide ou bleu de méthylène par voie intraveineuse, car il existe un risque accru de syndrome sérotoninergique. Chez un patient qui nécessite un traitement plus urgent d'une affection psychiatrique, d'autres interventions, y compris l'hospitalisation, doivent être envisagées [voir CONTRE-INDICATIONS ].
Dans certains cas, un patient recevant déjà un traitement Effexor 37,5 mg XR peut nécessiter un traitement urgent avec du linézolide ou du bleu de méthylène par voie intraveineuse. Si des alternatives acceptables au linézolide ou au bleu de méthylène par voie intraveineuse ne sont pas disponibles et que les avantages potentiels du traitement par le linézolide ou le bleu de méthylène par voie intraveineuse sont jugés supérieurs aux risques de syndrome sérotoninergique chez un patient particulier, Effexor XR doit être arrêté rapidement et le linézolide ou le bleu de méthylène par voie intraveineuse peut être administré. Surveillez le patient pour des symptômes de syndrome sérotoninergique pendant 7 jours ou jusqu'à 24 heures après la dernière dose de linézolide ou de bleu de méthylène par voie intraveineuse, selon la première éventualité. Le traitement par Effexor 75 mg XR peut être repris 24 heures après la dernière dose de linézolide ou de bleu de méthylène par voie intraveineuse [voir AVERTISSEMENTS ET PRECAUTIONS ].
Le risque d'administration de bleu de méthylène par des voies non intraveineuses (telles que des comprimés oraux ou par injection locale) ou à des doses intraveineuses bien inférieures à 1 mg/kg en concomitance avec Effexor XR n'est pas clair. Le clinicien doit néanmoins être conscient de la possibilité d'apparition de symptômes de syndrome sérotoninergique lors d'une telle utilisation [voir AVERTISSEMENTS ET PRECAUTIONS ].
COMMENT FOURNIE
Formes posologiques et points forts
Les gélules à libération prolongée Effexor 37,5 mg XR® (chlorhydrate de venlafaxine) sont disponibles dans les dosages suivants :
- Gélules de 37,5 mg (capuchon gris/corps pêche avec « W » et « Effexor 75mg XR » sur le capuchon et « 37,5 » sur le corps)
- Gélules de 75 mg (capuchon et corps pêche avec « W » et « Effexor 37,5 mg XR » sur le capuchon et « 75 » sur le corps)
- Gélules de 150 mg (capuchon et corps orange foncé avec « W » et « Effexor 75mg XR » sur le capuchon et « 150 » sur le corps)
Stockage et manutention
Capsules à libération prolongée Effexor XR® (chlorhydrate de venlafaxine) sont disponibles comme suit :
CDN 0008-0837-20, flacon de 15 gélules en conditionnement unitaire. CDN 0008-0837-21, flacon de 30 gélules en conditionnement unitaire. CDN 0008-0837-22, flacon de 90 gélules en conditionnement unitaire. CDN 0008-0837-03, boîte de 10 plaquettes thermoformées Redipak® de 10 gélules chacune.
CDN 0008-0833-20, flacon de 15 gélules en conditionnement unitaire. CDN 0008-0833-21, flacon de 30 gélules en conditionnement unitaire. CDN 0008-0833-22, flacon de 90 gélules en conditionnement unitaire. CDN 0008-0833-03, boîte de 10 plaquettes thermoformées Redipak® de 10 gélules chacune.
CDN 0008-0836-20, flacon de 15 gélules en conditionnement unitaire. CDN 0008-0836-21, flacon de 30 gélules en conditionnement unitaire. CDN 0008-0836-22, flacon de 90 gélules en conditionnement unitaire. CDN 0008-0836-03, boîte de 10 plaquettes thermoformées Redipak® de 10 gélules chacune.
- 37,5 mg , capuchon gris/corps pêche avec « W » et « Effexor XR » sur le capuchon et « 37,5 » sur le corps.
- 75mg , capuchon et corps pêche avec "W" et "Effexor 37.5mg XR" sur le capuchon et "75" sur le corps.
- 150mg capuchon et corps orange foncé avec « W » et « Effexor XR » sur le capuchon et « 150 » sur le corps.
Conserver à température ambiante contrôlée, 20° à 25°C (68° à 77°F).
L'emballage d'unité d'utilisation est destiné à être distribué comme une unité.
Distribué par : Wyeth Pharmaceuticals LLC, une filiale de Pfizer Inc, Philadelpia, PA 19101. Révisé : novembre 2021
EFFETS SECONDAIRES
Les effets indésirables suivants sont discutés plus en détail dans d'autres sections de l'étiquette :
- Hypersensibilité [voir CONTRE-INDICATIONS ]
- Pensées et comportements suicidaires chez les enfants, les adolescents et les adultes [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Syndrome sérotoninergique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Élévations de la tension artérielle [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Saignement anormal [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Glaucome à angle fermé [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Activation de la manie/hypomanie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Syndrome d'arrêt [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Saisie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hyponatrémie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Changements de poids et de taille chez les patients pédiatriques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Modifications de l'appétit chez les patients pédiatriques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Pneumopathie interstitielle et pneumonie à éosinophiles [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Dysfonction sexuelle [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des études cliniques
Étant donné que les études cliniques sont menées dans des conditions très variables, les taux d'effets indésirables observés dans les études cliniques d'un médicament ne peuvent pas être directement comparés aux taux des études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Effets indésirables les plus courants
Les effets indésirables les plus fréquemment observés dans la base de données des études cliniques chez les patients traités par Effexor XR dans le TDM, le TAG, le TAS et la MP (incidence ≥ 5 % et au moins deux fois le taux du placebo) étaient : nausées (30,0 %), somnolence (15,3 %), bouche sèche (14,8 %), transpiration (11,4 %), éjaculation anormale (9,9 %), anorexie (9,8 %), constipation (9,3 %), impuissance (5,3 %) et diminution de la libido (5,1 %).
Effets indésirables signalés comme motifs d'arrêt du traitement
Dans l'ensemble des études de précommercialisation à court terme contrôlées par placebo pour toutes les indications, 12 % des 3 558 patients ayant reçu Effexor XR (37,5-225 mg) ont arrêté le traitement en raison d'un effet indésirable, contre 4 % des 2 197 patients traités par placebo. dans ces études.Les effets indésirables les plus courants entraînant l'arrêt du traitement chez ≥ 1 % des patients traités par Effexor XR dans les études à court terme (jusqu'à 12 semaines) dans toutes les indications sont présentés dans le tableau 7.
Effets indésirables courants dans les études contrôlées par placebo
Le nombre de patients recevant des doses multiples d'Effexor XR au cours de l'évaluation préalable à la commercialisation pour chaque indication approuvée est indiqué dans le tableau 8. Les conditions et la durée d'exposition à la venlafaxine dans tous les programmes de développement variaient considérablement et incluaient (dans des catégories qui se chevauchent) des traitements ouverts et doubles. études en aveugle, études non contrôlées et contrôlées, études en milieu hospitalier (Effexor uniquement) et en ambulatoire, études à dose fixe et de titration.
Les incidences des effets indésirables courants (ceux qui se sont produits chez ≥ 2 % des patients traités par Effexor XR [357 patients atteints de TDM, 1 381 patients atteints de TAG, 819 patients atteints de TAS et 1 001 patients atteints de MP] et plus fréquemment que le placebo) chez les patients traités par Effexor XR en bref Les études cliniques à durée déterminée, contrôlées par placebo, à doses fixes et variables (doses de 37,5 à 225 mg par jour) sont présentées dans le tableau 9.
Le profil des effets indésirables ne différait pas sensiblement entre les différentes populations de patients.
Autres effets indésirables observés dans les études cliniques
Corps dans son ensemble : Réaction de photosensibilité, frissons
Système cardiovasculaire: Hypotension orthostatique, syncope, hypotension, tachycardie
Système digestif: Hémorragie gastro-intestinale [voir AVERTISSEMENTS ET PRECAUTIONS ],
bruxisme Système sanguin/lymphatique : Ecchymose [voir AVERTISSEMENTS ET PRECAUTIONS ]
Métabolique/Nutritionnel : Hypercholestérolémie, prise de poids [voir AVERTISSEMENTS ET PRECAUTIONS ], perte de poids [voir AVERTISSEMENTS ET PRECAUTIONS ]
Système nerveux: Saisies [voir AVERTISSEMENTS ET PRECAUTIONS ], réaction maniaque [voir AVERTISSEMENTS ET PRECAUTIONS ], agitation, confusion, akathisie, hallucinations, hypertonie, myoclonie, dépersonnalisation, apathie
Peau et phanères : Urticaire, prurit, rash, alopécie
Sens particuliers : Mydriase, anomalie de l'accommodation, acouphènes, altération du goût
Système urogénital : Rétention urinaire, troubles de la miction, incontinence urinaire, augmentation de la fréquence urinaire, troubles menstruels associés à une augmentation des saignements ou à une augmentation des saignements irréguliers (p. ex., ménorragie, métrorragie)
Modifications des signes vitaux
Dans les études de précommercialisation contrôlées par placebo, des augmentations de la tension artérielle moyenne ont été observées (voir tableau 10). Dans la plupart des indications, une augmentation liée à la dose de la pression artérielle systolique et diastolique moyenne en décubitus dorsal était évidente chez les patients traités avec Effexor 37,5 mg XR. Dans toutes les études cliniques portant sur le TDM, le TAG, le TAS et la MP, 1,4 % des patients des groupes Effexor XR ont présenté une augmentation de la SDBP ≥ 15 mm Hg ainsi qu'une tension artérielle ≥ 105 mm Hg, contre 0,9 % des patients du groupe groupes placebo. De même, 1 % des patients des groupes Effexor 37,5 mg XR ont présenté une augmentation de la SSBP ≥ 20 mm Hg avec une pression artérielle ≥ 180 mm Hg, contre 0,3 % des patients des groupes placebo.
Le traitement par Effexor 37,5 mg XR a été associé à une hypertension soutenue (définie comme une tension artérielle diastolique en décubitus [SDBP] ≥ 90 mm Hg et ≥ 10 mm Hg au-dessus de la ligne de base pendant trois visites consécutives sous traitement (voir Tableau 11). des patients ont reçu des doses moyennes d'Effexor XR supérieures à 300 mg par jour dans les études cliniques afin d'évaluer pleinement l'incidence des augmentations soutenues de la pression artérielle à ces doses plus élevées.
Effexor 37,5 mg XR a été associé à des augmentations moyennes du pouls par rapport au placebo dans les études contrôlées par placebo de précommercialisation (voir tableau 12) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Changements de laboratoire
Cholestérol sérique
Effexor XR a été associé à des augmentations finales moyennes des concentrations sériques de cholestérol par rapport aux diminutions finales moyennes pour le placebo dans les études cliniques de précommercialisation sur le TDM, le TAG, le TAS et la MP (Tableau 13).
Le traitement par Effexor 75 mg XR (chlorhydrate de venlafaxine) en gélules à libération prolongée jusqu'à 12 semaines dans les essais contrôlés par placebo de précommercialisation pour le trouble dépressif majeur a été associé à une augmentation finale moyenne sous traitement de la concentration sérique de cholestérol d'environ 1,5 mg/dL par rapport à un diminution finale moyenne de 7,4 mg/dL pour le placebo. Le traitement par Effexor XR pendant jusqu'à 8 semaines et jusqu'à 6 mois dans les essais GAD contrôlés par placebo de précommercialisation a été associé à des augmentations moyennes finales sous traitement de la concentration sérique de cholestérol d'environ 1,0 mg/dL et 2,3 mg/dL, respectivement, tandis que les sujets placebo ont connu diminutions finales moyennes de 4,9 mg/dL et 7,7 mg/dL, respectivement. Le traitement par Effexor XR pendant jusqu'à 12 semaines et jusqu'à 6 mois dans les essais de précommercialisation sur le trouble d'anxiété sociale contrôlés par placebo a été associé à des augmentations moyennes finales sous traitement de la concentration sérique de cholestérol d'environ 7,9 mg/dL et 5,6 mg/dL, respectivement, par rapport avec des diminutions finales moyennes de 2,9 et 4,2 mg/dL, respectivement, pour le placebo. Le traitement par Effexor XR jusqu'à 12 semaines dans les essais de précommercialisation sur le trouble panique contrôlés par placebo a été associé à des augmentations finales moyennes sous traitement de la concentration sérique de cholestérol d'environ 5,8 mg/dL par rapport à une diminution finale moyenne de 3,7 mg/dL pour le placebo.
Les patients traités par Effexor (libération immédiate) pendant au moins 3 mois dans le cadre d'essais de prolongation de 12 mois contrôlés par placebo ont présenté une augmentation finale moyenne sous traitement du cholestérol total de 9,1 mg/dL par rapport à une diminution de 7,1 mg/dL chez les patients sous placebo. malades traités. Cette augmentation était dépendante de la durée au cours de la période d'étude et avait tendance à être plus importante avec des doses plus élevées. Augmentations cliniquement pertinentes du cholestérol sérique, définies comme 1) une augmentation finale sous traitement du cholestérol sérique ≥ 50 mg/dL par rapport au départ et jusqu'à une valeur ≥ 261 mg/dL, ou 2) une augmentation moyenne sous traitement du cholestérol sérique ≥ 50 mg/dL par rapport au départ et à une valeur ≥ 261 mg/dL, ont été enregistrés chez 5,3 % des patients traités par la venlafaxine et 0,0 % des patients sous placebo.
Sérum triglycérides
Effexor 75 mg XR a été associé à des augmentations finales moyennes sous traitement des triglycérides sériques à jeun par rapport au placebo dans les études cliniques de précommercialisation sur le TAS et la MP jusqu'à 12 semaines (données regroupées) et une durée de 6 mois (Tableau 14).
Patients pédiatriques
En général, le profil des effets indésirables de la venlafaxine (dans les études cliniques contrôlées contre placebo) chez les enfants et les adolescents (âgés de 6 à 17 ans) était similaire à celui observé chez les adultes. Comme chez les adultes, une diminution de l'appétit, une perte de poids, une augmentation de la pression artérielle et une augmentation du cholestérol sérique ont été observées [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Dans les études cliniques pédiatriques, l'effet indésirable, des idées suicidaires, a été observé.
En particulier, les effets indésirables suivants ont été observés chez les patients pédiatriques : douleur abdominale, agitation, dyspepsie, ecchymose, épistaxis et myalgie.
Effets indésirables identifiés lors de l'utilisation post-approbation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation d'Effexor XR. Étant donné que ces réactions sont signalées volontairement à partir d'une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament :
Corps dans son ensemble : Anaphylaxie, œdème de Quincke
Système cardiovasculaire: Allongement de l'intervalle QT, fibrillation ventriculaire, tachycardie ventriculaire (y compris torsades de pointes), cardiomyopathie takotsubo
Système digestif: Pancréatite
Système sanguin/lymphatique : Saignement des muqueuses [voir AVERTISSEMENTS ET PRECAUTIONS ], dyscrasies sanguines (y compris agranulocytose, anémie aplasique, neutropénie et pancytopénie), allongement du temps de saignement, thrombocytopénie
Métabolique/Nutritionnel : Hyponatrémie [voir AVERTISSEMENTS ET PRECAUTIONS ], syndrome de sécrétion inappropriée d'hormone antidiurétique (SIADH) [voir AVERTISSEMENTS ET PRECAUTIONS ], anomalies des tests de la fonction hépatique, hépatite, augmentation de la prolactine
Musculo-squelettique : Rhabdomyolyse
Système nerveux: Syndrome malin des neuroleptiques (SMN) [voir AVERTISSEMENTS ET PRECAUTIONS ], syndrome sérotoninergique [voir AVERTISSEMENTS ET PRECAUTIONS ], délire, réactions extrapyramidales (dont dystonie et dyskinésie), trouble de la coordination et de l'équilibre, dyskinésie tardive
Système respiratoire: Dyspnée, pneumopathie interstitielle, éosinophilie pulmonaire [voir AVERTISSEMENTS ET PRECAUTIONS ]
Peau et phanères : Syndrome de Stevens-Johnson, nécrolyse épidermique toxique, érythème polymorphe
Sens particuliers : Glaucome à angle fermé [voir AVERTISSEMENTS ET PRECAUTIONS ]
INTERACTIONS MÉDICAMENTEUSES
Système nerveux central (SNC) - Médicaments actifs
Le risque d'utiliser la venlafaxine en association avec d'autres médicaments agissant sur le SNC n'a pas été systématiquement évalué. Par conséquent, la prudence est recommandée lorsque Effexor XR est pris en association avec d'autres médicaments agissant sur le SNC.
Inhibiteurs de la monoamine oxydase
Des effets indésirables, dont certains étaient graves, ont été signalés chez des patients qui ont récemment cessé de prendre un IMAO et ont commencé à prendre des antidépresseurs ayant des propriétés pharmacologiques similaires à Effexor XR (SNRI ou ISRS), ou chez qui un traitement par SNRI ou ISRS a récemment été interrompu avant à l'initiation d'un IMAO [voir DOSAGE ET ADMINISTRATION , CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Médicaments sérotoninergiques
Sur la base du mécanisme d'action d'Effexor XR et du potentiel de syndrome sérotoninergique, la prudence est recommandée lorsqu'Effexor XR est co-administré avec d'autres médicaments susceptibles d'affecter les systèmes de neurotransmetteurs sérotoninergiques, tels que les triptans, les ISRS, d'autres IRSN, le linézolide (un antibiotique qui est un IMAO réversible non sélectif), du lithium, du tramadol ou du millepertuis. Si un traitement concomitant par Effexor XR et ces médicaments est cliniquement justifié, une surveillance attentive du patient est conseillée, en particulier lors de l'initiation du traitement et des augmentations de dose. L'utilisation concomitante d'Effexor 75 mg XR avec des suppléments de tryptophane n'est pas recommandée [voir DOSAGE ET ADMINISTRATION , CONTRE-INDICATIONS , et AVERTISSEMENTS ET PRECAUTIONS ].
Médicaments qui interfèrent avec l'hémostase (par exemple, les AINS, l'aspirine et la warfarine)
La libération de sérotonine par les plaquettes joue un rôle important dans l'hémostase. L'utilisation de médicaments psychotropes qui interfèrent avec la recapture de la sérotonine est associée à la survenue d'hémorragies digestives hautes et l'utilisation concomitante d'un AINS ou d'aspirine peut potentialiser ce risque d'hémorragie [voir AVERTISSEMENTS ET PRECAUTIONS ]. Des effets anticoagulants modifiés, y compris une augmentation des saignements, ont été rapportés lorsque les ISRS et les IRSN sont co-administrés avec la warfarine. Les patients recevant un traitement par warfarine doivent être étroitement surveillés lors de l'initiation ou de l'arrêt d'Effexor 37,5 mg XR.
Agents de perte de poids
L'innocuité et l'efficacité du traitement par la venlafaxine en association avec des agents amaigrissants, y compris la phentermine, n'ont pas été établies. L'administration concomitante d'Effexor XR et d'agents amaigrissants n'est pas recommandée. Effexor XR n'est pas indiqué pour la perte de poids seul ou en combinaison avec d'autres produits.
Effets d'autres médicaments sur Effexor XR
Figure 1 : Effet des médicaments en interaction sur la pharmacocinétique de la venlafaxine et du métabolite actif O-desmethylvenlafaxine (ODV).
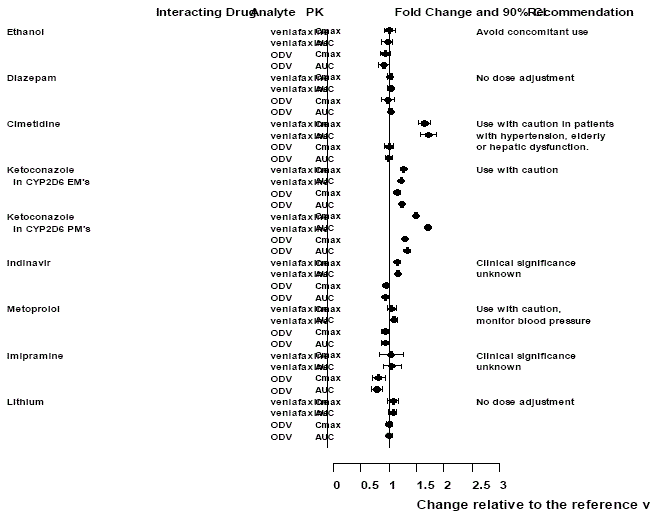
Effets d'Effexor XR sur d'autres médicaments
Figure 2 : Effet de la venlafaxine sur la pharmacocinétique des médicaments en interaction et leurs métabolites actifs.
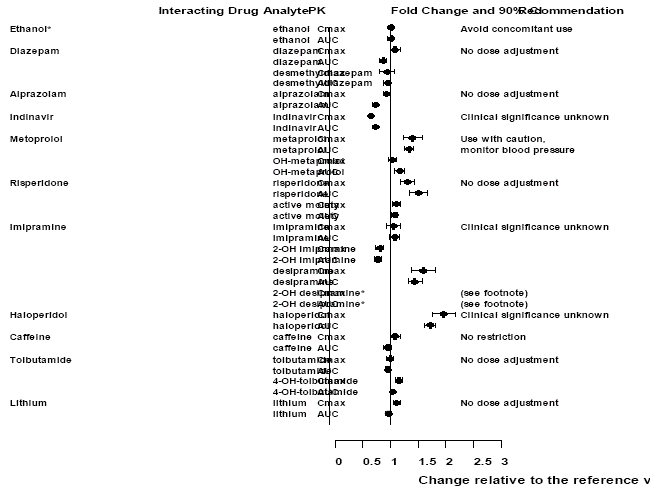
Noter
L'administration de venlafaxine en régime stable n'a pas exagéré les effets psychomoteurs et psychométriques induits par l'éthanol chez ces mêmes sujets lorsqu'ils ne recevaient pas de venlafaxine.
Interactions médicament-test de laboratoire
Des tests de dépistage immunologique urinaire faussement positifs pour la phencyclidine (PCP) et l'amphétamine ont été rapportés chez des patients prenant de la venlafaxine. Cela est dû au manque de spécificité des tests de dépistage. Des résultats de test faussement positifs peuvent être attendus pendant plusieurs jours après l'arrêt du traitement par la venlafaxine. Des tests de confirmation, tels que la chromatographie en phase gazeuse/spectrométrie de masse, permettront de distinguer la venlafaxine du PCP et de l'amphétamine.
Toxicomanie et dépendance
Substance contrôlée
Effexor 75 mg XR n'est pas une substance contrôlée.
Abuser de
Bien que la venlafaxine n'ait pas été systématiquement étudiée dans les études cliniques pour son potentiel d'abus, il n'y avait aucune indication de comportement de recherche de drogue dans les études cliniques. Cependant, il n'est pas possible de prédire sur la base de l'expérience de précommercialisation dans quelle mesure un médicament agissant sur le SNC sera mal utilisé, détourné et/ou abusé une fois commercialisé. Par conséquent, les médecins doivent soigneusement évaluer les patients pour des antécédents de toxicomanie et suivre ces patients de près, en les observant pour des signes de mésusage ou d'abus de venlafaxine (par exemple, développement d'une tolérance, augmentation de la dose, comportement de recherche de drogue).
Dépendance
Des études in vitro ont révélé que la venlafaxine n'a pratiquement aucune affinité pour les récepteurs des opiacés, des benzodiazépines, de la phencyclidine (PCP) ou de l'acide N-méthyl-D-aspartique (NMDA).
La venlafaxine n'a pas montré d'activité stimulante significative sur le SNC chez les rongeurs. Dans les études sur la discrimination des drogues chez les primates, la venlafaxine n'a montré aucun risque significatif d'abus de stimulants ou de dépresseurs.
Des effets d'arrêt ont été rapportés chez des patients recevant de la venlafaxine [voir DOSAGE ET ADMINISTRATION ].
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Pensées et comportements suicidaires chez les enfants, les adolescents et les jeunes adultes
Les patients atteints de trouble dépressif majeur (TDM), à la fois adultes et pédiatriques, peuvent présenter une aggravation de leur dépression et/ou l'émergence d'idées et de comportements suicidaires (suicidalité) ou des changements de comportement inhabituels, qu'ils prennent ou non des antidépresseurs, et cela le risque peut persister jusqu'à ce qu'une rémission significative se produise. Le suicide est un risque connu de dépression et de certains autres troubles psychiatriques, et ces troubles eux-mêmes sont les meilleurs prédicteurs du suicide. Cependant, on craint depuis longtemps que les antidépresseurs puissent jouer un rôle dans l'aggravation de la dépression et l'émergence de comportements suicidaires chez certains patients au cours des premières phases du traitement. Des analyses groupées d'études contrôlées par placebo à court terme sur les antidépresseurs (ISRS et autres) ont montré que ces médicaments augmentent le risque de pensées et de comportements suicidaires (suicidalité) chez les enfants, les adolescents et les jeunes adultes (âgés de 18 à 24 ans) atteints de TDM et d'autres troubles psychiatriques. Les études à court terme n'ont pas montré d'augmentation du risque de suicide avec les antidépresseurs par rapport au placebo chez les adultes au-delà de 24 ans ; il y avait une réduction avec les antidépresseurs par rapport au placebo chez les adultes âgés de 65 ans et plus.
Les analyses groupées d'études contrôlées par placebo chez des enfants et des adolescents atteints de TDM, de trouble obsessionnel-compulsif (TOC) ou d'autres troubles psychiatriques ont inclus un total de 24 études à court terme de 9 antidépresseurs chez plus de 4 400 patients. Les analyses groupées d'études contrôlées par placebo chez des adultes atteints de TDM ou d'autres troubles psychiatriques ont inclus un total de 295 études à court terme (durée médiane de 2 mois) de 11 médicaments antidépresseurs chez plus de 77 000 patients. Il y avait une variation considérable du risque de suicidalité entre les médicaments, mais une tendance à une augmentation chez les patients plus jeunes pour presque tous les médicaments étudiés. Il y avait des différences dans le risque absolu de suicidalité entre les différentes indications, avec l'incidence la plus élevée dans le TDM. Les différences de risque (médicament versus placebo) étaient toutefois relativement stables au sein des tranches d'âge et entre les indications. Ces différences de risque (différence médicament-placebo dans le nombre de cas de suicide pour 1 000 patients traités) sont présentées dans le tableau 1.
Aucun suicide n'est survenu dans aucune des études pédiatriques. Il y avait des suicides dans les études sur les adultes, mais le nombre n'était pas suffisant pour tirer une conclusion sur l'effet des médicaments sur le suicide.
On ne sait pas si le risque de suicidalité s'étend à une utilisation à plus long terme, c'est-à-dire au-delà de plusieurs mois. Cependant, il existe des preuves substantielles provenant d'études d'entretien contrôlées par placebo chez des adultes souffrant de dépression que l'utilisation d'antidépresseurs peut retarder la récurrence de la dépression.
Tous les patients traités avec des antidépresseurs pour toute indication doivent être surveillés de manière appropriée et observés de près pour déceler une aggravation clinique, des tendances suicidaires et des changements inhabituels de comportement, en particulier au cours des premiers mois d'un traitement médicamenteux, ou lors de changements de dose, soit des augmentations ou diminue.
Les symptômes suivants, anxiété, agitation, attaques de panique, insomnie, irritabilité, hostilité, agressivité, impulsivité, akathisie (agitation psychomotrice), hypomanie et manie, ont été rapportés chez des patients adultes et pédiatriques traités avec des antidépresseurs pour un TDM, ainsi que des pour d'autres indications, tant psychiatriques que non psychiatriques. Bien qu'un lien de causalité entre l'apparition de tels symptômes et soit l'aggravation de la dépression et/ou l'émergence d'impulsions suicidaires n'ait pas été établi, on craint que ces symptômes puissent représenter des précurseurs d'une suicidalité émergente.
Il convient d'envisager de modifier le schéma thérapeutique, y compris éventuellement d'arrêter le médicament, chez les patients dont la dépression s'aggrave de manière persistante, ou qui présentent des tendances suicidaires émergentes ou des symptômes qui pourraient être des précurseurs d'une aggravation de la dépression ou des tendances suicidaires, en particulier si ces symptômes sont graves, brusques. au début ou ne faisaient pas partie des symptômes présentés par le patient.
Si la décision a été prise d'arrêter le traitement, la médication doit être réduite, aussi rapidement que possible, mais en reconnaissant qu'un arrêt brutal peut être associé à certains symptômes [voir Syndrome d'arrêt et DOSAGE ET ADMINISTRATION ].
Les familles et les soignants des patients traités avec des antidépresseurs pour un TDM ou d'autres indications, à la fois psychiatriques et non psychiatriques, doivent être alertés de la nécessité de surveiller les patients pour l'apparition d'agitation, d'irritabilité, de changements inhabituels de comportement et des autres symptômes décrits ci-dessus, comme ainsi que l'émergence de tendances suicidaires, et de signaler immédiatement ces symptômes aux prestataires de soins de santé. Une telle surveillance devrait inclure une observation quotidienne par les familles et les soignants. Les prescriptions d'Effexor XR doivent être rédigées pour la plus petite quantité de gélules compatible avec une bonne prise en charge du patient, afin de réduire le risque de surdosage.
Dépistage des patients pour le trouble bipolaire
Un épisode dépressif majeur peut être la présentation initiale d'un trouble bipolaire. Il est généralement admis (bien que non établi dans des études contrôlées) que le traitement d'un tel épisode avec un antidépresseur seul peut augmenter la probabilité de précipitation d'un épisode mixte/maniaque chez les patients à risque de trouble bipolaire. On ne sait pas si l'un des symptômes décrits ci-dessus représente une telle conversion. Cependant, avant d'initier un traitement avec un antidépresseur, les patients présentant des symptômes dépressifs doivent faire l'objet d'un dépistage adéquat pour déterminer s'ils présentent un risque de trouble bipolaire ; un tel dépistage devrait inclure des antécédents psychiatriques détaillés, y compris des antécédents familiaux de suicide, de trouble bipolaire et de dépression. Il convient de noter qu'Effexor XR n'est pas approuvé pour une utilisation dans le traitement de la dépression bipolaire.
Syndrome sérotoninergique
Le développement d'un syndrome sérotoninergique potentiellement mortel a été rapporté avec les inhibiteurs de la recapture de la sérotonine-norépinéphrine (IRSN) et les ISRS, y compris Effexor XR seul, mais en particulier avec l'utilisation concomitante d'autres médicaments sérotoninergiques (y compris les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, tramadol, tryptophane, buspirone, amphétamines et millepertuis) et avec des médicaments qui altèrent le métabolisme de la sérotonine en particulier, les IMAO, tant ceux destinés à traiter les troubles psychiatriques que d'autres, comme le linézolide ou le bleu de méthylène par voie intraveineuse).
Les symptômes du syndrome sérotoninergique peuvent inclure des modifications de l'état mental (p. ex., agitation, hallucinations, délire, coma), une instabilité autonome (p. ex., tachycardie, tension artérielle labile, hyperthermie, diaphorèse, bouffées vasomotrices et étourdissements), des symptômes neuromusculaires (p. ex., tremblements, rigidité, myoclonie). , hyperréflexie, incoordination) ; convulsions et symptômes gastro-intestinaux (p. ex., nausées, vomissements, diarrhée). Les patients doivent être surveillés pour détecter l'apparition d'un syndrome sérotoninergique.
L'utilisation concomitante d'Effexor XR avec des IMAO (destinés à traiter les troubles psychiatriques) est contre-indiquée. Effexor XR ne doit pas non plus être démarré chez un patient qui est traité avec des IMAO tels que le linézolide ou le bleu de méthylène par voie intraveineuse. Tous les rapports avec le bleu de méthylène qui ont fourni des informations sur la voie d'administration impliquaient une administration intraveineuse dans la gamme de doses de 1 mg/kg à 8 mg/kg. Aucun rapport n'impliquait l'administration de bleu de méthylène par d'autres voies (telles que des comprimés oraux ou une injection tissulaire locale) ou à des doses plus faibles. Il peut y avoir des circonstances où il est nécessaire d'initier un traitement avec un IMAO tel que le linézolide ou le bleu de méthylène par voie intraveineuse chez un patient prenant Effexor 37,5 mg XR. Effexor XR doit être arrêté avant de commencer le traitement par IMAO [voir CONTRE-INDICATIONS , DOSAGE ET ADMINISTRATION , et INTERACTIONS MÉDICAMENTEUSES ].
Si l'utilisation concomitante d'Effexor 37,5 mg XR avec d'autres médicaments sérotoninergiques (par exemple, les triptans, les antidépresseurs tricycliques, la mirtazapine, le fentanyl, le lithium, le tramadol, la buspirone, les amphétamines, le tryptophane ou le millepertuis) est cliniquement justifiée, une observation attentive du patient est conseillé, en particulier lors de l'initiation du traitement et des augmentations de dose [voir INTERACTIONS MÉDICAMENTEUSES ]. Les patients doivent être informés du risque potentiel de syndrome sérotoninergique. Le traitement par Effexor XR et tout agent sérotoninergique concomitant doit être interrompu immédiatement si les événements ci-dessus se produisent, et un traitement symptomatique de soutien doit être instauré.
Élévations de la pression artérielle
Dans les essais contrôlés, il y a eu des augmentations liées à la dose de la pression artérielle systolique et diastolique, ainsi que des cas d'hypertension soutenue [voir EFFETS INDÉSIRABLES ].
Surveillez la tension artérielle avant de commencer le traitement avec Effexor 37,5 mg XR et régulièrement pendant le traitement. Contrôlez l'hypertension préexistante avant de commencer le traitement avec Effexor 75 mg XR. Faites preuve de prudence lors du traitement de patients souffrant d'hypertension préexistante ou d'affections cardiovasculaires ou cérébrovasculaires susceptibles d'être aggravées par une augmentation de la pression artérielle. Une élévation soutenue de la pression artérielle peut entraîner des résultats indésirables. Des cas d'hypertension artérielle nécessitant un traitement immédiat ont été rapportés avec Effexor XR. Envisager une réduction de la dose ou l'arrêt du traitement chez les patients qui présentent une augmentation soutenue de la pression artérielle.
Dans toutes les études cliniques avec Effexor 37,5 mg, 1,4 % des patients des groupes traités par Effexor XR ont présenté une augmentation ≥ 15 mm Hg de la pression artérielle diastolique en décubitus dorsal (SDBP) ≥ 105 mm Hg, contre 0,9 % des patients des groupes placebo. De même, 1 % des patients des groupes traités par Effexor 75 mg XR ont présenté une augmentation ≥ 20 mm Hg de la pression artérielle systolique (SSBP) en décubitus dorsal avec une pression artérielle ≥ 180 mm Hg, contre 0,3 % des patients des groupes placebo [voir Tableau 10 dans EFFETS INDÉSIRABLES ]. Le traitement par Effexor 75 mg XR a été associé à une hypertension soutenue (définie comme une SDBP apparue sous traitement ≥ 90 mm Hg et ≥ 10 mm Hg au-dessus de la ligne de base pendant trois visites consécutives sous traitement [voir le tableau 11 dans EFFETS INDÉSIRABLES ]. Un nombre insuffisant de patients ont reçu des doses moyennes d'Effexor 37,5 mg XR supérieures à 300 mg par jour dans les études cliniques pour évaluer pleinement l'incidence des augmentations soutenues de la pression artérielle à ces doses plus élevées.
Saignement anormal
Les ISRS et les IRSN, y compris Effexor 37,5 mg XR, peuvent augmenter le risque d'événements hémorragiques, allant des ecchymoses, des hématomes, des épistaxis, des pétéchies et des hémorragies gastro-intestinales aux hémorragies potentiellement mortelles. L'utilisation concomitante d'aspirine, d'anti-inflammatoires non stéroïdiens (AINS), de warfarine et d'autres anticoagulants ou d'autres médicaments connus pour affecter la fonction plaquettaire peut augmenter ce risque. Des rapports de cas et des études épidémiologiques (cas-témoins et conception de cohorte) ont démontré une association entre l'utilisation de médicaments qui interfèrent avec la recapture de la sérotonine et la survenue d'hémorragies gastro-intestinales. Avertir les patients du risque de saignement associé à l'utilisation concomitante d'Effexor 75 mg XR et d'AINS, d'aspirine ou d'autres médicaments qui affectent la coagulation.
Glaucome à angle fermé
La dilatation pupillaire qui survient après l'utilisation de nombreux antidépresseurs, y compris Effexor XR, peut déclencher une attaque à angle fermé chez un patient présentant des angles anatomiquement étroits qui n'a pas subi d'iridectomie perméable.
Activation de la manie/hypomanie
Une manie ou une hypomanie a été signalée chez des patients traités par Effexor 37,5 mg XR dans les études de précommercialisation portant sur le TDM, le TAS et la MP (voir tableau 2). La manie/hypomanie a également été rapportée chez une petite proportion de patients souffrant de troubles de l'humeur qui ont été traités avec d'autres médicaments commercialisés pour traiter le TDM. Effexor 37,5 mg XR doit être utilisé avec prudence chez les patients ayant des antécédents de manie ou d'hypomanie.
Syndrome d'arrêt
Les symptômes de sevrage ont été systématiquement évalués chez les patients prenant de la venlafaxine, y compris des analyses prospectives d'études cliniques sur le TAG et des enquêtes rétrospectives d'études sur le TDM et le TAS. L'arrêt brutal ou la réduction de la dose de venlafaxine à différentes doses s'est avéré être associé à l'apparition de nouveaux symptômes, dont la fréquence augmentait avec l'augmentation de la dose et avec une durée de traitement plus longue. Les symptômes rapportés incluent agitation, anorexie, anxiété, confusion, troubles de la coordination et de l'équilibre, diarrhée, étourdissements, bouche sèche, humeur dysphorique, fasciculation, fatigue, symptômes pseudo-grippaux, maux de tête, hypomanie, insomnie, nausées, nervosité, cauchemars, troubles sensoriels ( y compris des sensations électriques de type choc), somnolence, transpiration, tremblements, vertiges et vomissements.
Il y a eu des rapports post-commercialisation de symptômes de sevrage graves qui peuvent être prolongés et sévères. Suicide complet, pensées suicidaires, agression et comportement violent ont été observés chez des patients pendant la réduction de la posologie d'Effexor 75 mg XR, y compris pendant l'arrêt. D'autres rapports post-commercialisation décrivent des changements visuels (tels qu'une vision floue ou des problèmes de concentration) et une augmentation de la pression artérielle après l'arrêt ou la réduction de la dose d'Effexor XR.
Au cours de la commercialisation d'Effexor XR, d'autres SNRI et d'ISRS, d'autres événements indésirables survenant à l'arrêt de ces médicaments, en particulier lorsqu'ils sont brusques, ont été signalés spontanément, notamment les suivants : irritabilité, léthargie, labilité émotionnelle, acouphènes et convulsions.
Les patients doivent être surveillés pour ces symptômes lors de l'arrêt du traitement par Effexor XR. Une réduction progressive de la dose, plutôt qu'un arrêt brutal, est recommandée. Si des symptômes intolérables surviennent suite à une diminution de la dose ou à l'arrêt du traitement, la reprise de la dose précédemment prescrite peut être envisagée. Par la suite, le fournisseur de soins de santé peut continuer à diminuer la dose, mais à un rythme plus graduel. Chez certains patients, l'arrêt peut devoir se faire sur une période de plusieurs mois [voir DOSAGE ET ADMINISTRATION ].
Saisies
Des convulsions se sont produites avec le traitement par la venlafaxine. Effexor 75 mg XR, comme de nombreux antidépresseurs, doit être utilisé avec prudence chez les patients ayant des antécédents de convulsions et doit être interrompu chez tout patient qui développe des convulsions. [Doit atténuer le risque : facteurs de risque, médicaments concomitants qui abaissent le seuil épileptogène.]
Hyponatrémie
Une hyponatrémie peut survenir à la suite d'un traitement par ISRS et IRSN, y compris Effexor 37,5 mg XR. Dans de nombreux cas, l'hyponatrémie semble être le résultat du syndrome de sécrétion inappropriée d'hormone antidiurétique (SIADH). Des cas de sodium sérique inférieur à 110 mmol/L ont été rapportés. Les patients âgés peuvent être plus à risque de développer une hyponatrémie avec les ISRS et les IRSN [voir Utilisation dans des populations spécifiques ]. De plus, les patients prenant des diurétiques, ou ceux qui sont autrement appauvris en volume, peuvent être plus à risque. Envisager l'arrêt d'Effexor 37,5 mg XR chez les patients présentant une hyponatrémie symptomatique et instituer une intervention médicale appropriée.
Les signes et symptômes de l'hyponatrémie comprennent des maux de tête, des difficultés de concentration, des troubles de la mémoire, de la confusion, de la faiblesse et une instabilité pouvant entraîner des chutes. Les signes et symptômes associés à des cas plus graves et/ou aigus comprennent des hallucinations, des syncopes, des convulsions, le coma, un arrêt respiratoire et la mort.
Changements de poids et de taille chez les patients pédiatriques
Changements de poids
La variation moyenne du poids corporel et l'incidence de la perte de poids (pourcentage de patients ayant perdu 3,5 % ou plus) dans les études pédiatriques contrôlées par placebo sur le TDM, le TAG et le TAS sont présentées dans les tableaux 3 et 4.
La perte de poids n'était pas limitée aux patients atteints d'anorexie apparue sous traitement [voir Changements d'appétit chez les patients pédiatriques ].
Les risques associés à l'utilisation à plus long terme d'Effexor 75 mg XR ont été évalués dans une étude ouverte sur le MDD menée auprès d'enfants et d'adolescents ayant reçu Effexor XR pendant une période allant jusqu'à six mois. Les enfants et les adolescents de l'étude avaient des augmentations de poids inférieures aux attentes, d'après les données de pairs appariés selon l'âge et le sexe. La différence entre le gain de poids observé et le gain de poids attendu était plus importante chez les enfants (
Changements de hauteur
Le tableau 5 montre l'augmentation moyenne de la taille chez les patients pédiatriques dans les études MDD, GAD et SAD à court terme contrôlées par placebo. Les différences dans les augmentations de taille dans les études GAD et MDD étaient les plus notables chez les patients de moins de douze ans.
Dans l'étude MDD ouverte de six mois, les enfants et les adolescents avaient des augmentations de taille inférieures aux attentes, d'après les données de pairs appariés selon l'âge et le sexe. La différence entre les taux de croissance observés et attendus était plus importante pour les enfants (
Changements d'appétit chez les patients pédiatriques
Une diminution de l'appétit (signalée comme une anorexie apparue sous traitement) a été plus fréquemment observée chez les patients traités par Effexor XR par rapport aux patients traités par placebo dans l'évaluation précommercialisation d'Effexor XR pour le TDM, le TAG et le TAS (voir tableau 6).
Maladie pulmonaire interstitielle et pneumonie à éosinophiles
Une pneumopathie interstitielle et une pneumonie à éosinophiles associées au traitement par la venlafaxine ont été rarement rapportées. La possibilité de ces événements indésirables doit être envisagée chez les patients traités par la venlafaxine qui présentent une dyspnée progressive, une toux ou une gêne thoracique. Ces patients doivent subir une évaluation médicale rapide et l'arrêt du traitement par la venlafaxine doit être envisagé.
Dysfonction sexuelle
L'utilisation d'IRSN, y compris Effexor XR, peut provoquer des symptômes de dysfonctionnement sexuel [voir EFFETS INDÉSIRABLES ]. Chez les hommes, l'utilisation d'IRSN peut entraîner un retard ou un échec de l'éjaculation, une diminution de la libido et une dysfonction érectile. Chez les patientes, l'utilisation d'IRSN peut entraîner une diminution de la libido et un orgasme retardé ou absent.
Il est important que les prescripteurs se renseignent sur la fonction sexuelle avant le début d'Effexor 37,5 mg XR et se renseignent spécifiquement sur les modifications de la fonction sexuelle pendant le traitement, car la fonction sexuelle peut ne pas être signalée spontanément. Lors de l'évaluation des modifications de la fonction sexuelle, il est important d'obtenir un historique détaillé (y compris le moment de l'apparition des symptômes) car les symptômes sexuels peuvent avoir d'autres causes, y compris le trouble psychiatrique sous-jacent. Discuter des stratégies de prise en charge potentielles pour aider les patients à prendre des décisions éclairées sur le traitement.
Informations sur les conseils aux patients
Voir approuvé par la FDA INFORMATIONS PATIENTS ( Guide des médicaments ).
Les prescripteurs ou autres professionnels de la santé doivent informer les patients, leurs familles et leurs soignants des avantages et des risques associés au traitement par Effexor 37,5 mg XR et les conseiller sur son utilisation appropriée. Un guide de médication pour le patient sur «les médicaments antidépresseurs, la dépression et d'autres maladies mentales graves et les pensées ou actions suicidaires» est disponible pour Effexor 75 mg XR. Le prescripteur ou le professionnel de la santé doit demander aux patients, à leurs familles et à leurs soignants de lire le Guide des médicaments et doit les aider à comprendre son contenu. Les patients doivent avoir la possibilité de discuter du contenu du Guide de Médication et d'obtenir des réponses à toutes les questions qu'ils pourraient avoir. Le texte complet du Guide de Médication est réimprimé à la fin de ce document. Les patients doivent être informés des problèmes suivants et doivent être invités à alerter leur médecin traitant si ceux-ci surviennent lors de la prise d'Effexor XR.
Pensées et comportements suicidaires
Conseiller aux patients, à leur famille et aux soignants de rechercher l'apparition de tendances suicidaires, l'aggravation de la dépression et d'autres symptômes psychiatriques (anxiété, agitation, attaques de panique, insomnie, irritabilité, hostilité, agressivité, impulsivité, akathisie, agitation psychomotrice, hypomanie, manie, autres changements inhabituels de comportement), en particulier au début du traitement et lorsque la dose est augmentée ou diminuée. De tels symptômes doivent être signalés au médecin prescripteur ou au professionnel de la santé du patient, en particulier s'ils sont graves, d'apparition brutale ou ne faisaient pas partie des symptômes présentés par le patient. De tels symptômes peuvent être associés à un risque accru de pensées et de comportements suicidaires et indiquent la nécessité d'une surveillance très étroite [voir AVERTISSEMENT DE BOÎTE et AVERTISSEMENTS ET PRECAUTIONS ].
Médicament concomitant
Conseillez aux patients prenant Effexor XR de ne pas utiliser simultanément d'autres produits contenant de la venlafaxine ou de la desvenlafaxine. Les professionnels de la santé doivent informer les patients de ne pas prendre Effexor XR avec un IMAO ou dans les 14 jours suivant l'arrêt d'un IMAO et d'attendre 7 jours après l'arrêt d'Effexor XR avant de commencer un IMAO [voir CONTRE-INDICATIONS ].
Syndrome sérotoninergique
Les patients doivent être avertis du risque de syndrome sérotoninergique en cas d'utilisation concomitante d'Effexor 75 mg XR et de triptans, de tramadol, d'amphétamines, de suppléments de tryptophane, d'antipsychotiques ou d'autres antagonistes de la dopamine ou d'autres agents sérotoninergiques [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ].
Tension artérielle élevée
Informez les patients qu'ils doivent surveiller régulièrement leur tension artérielle lors de la prise d'Effexor XR [voir AVERTISSEMENTS ET PRECAUTIONS ].
Saignement anormal
Les patients doivent être avertis de l'utilisation concomitante d'Effexor 75 mg XR et d'AINS, d'aspirine, de warfarine ou d'autres médicaments qui affectent la coagulation, car l'utilisation combinée de médicaments psychotropes qui interfèrent avec la recapture de la sérotonine et de ces agents a été associée à un risque accru de saignement [voir AVERTISSEMENTS ET PRECAUTIONS ].
Glaucome à angle fermé
Les patients doivent être informés que la prise d'Effexor XR peut provoquer une légère dilatation pupillaire qui, chez les personnes sensibles, peut entraîner un épisode de glaucome à angle fermé. Le glaucome préexistant est presque toujours un glaucome à angle ouvert car le glaucome à angle fermé, lorsqu'il est diagnostiqué, peut être traité définitivement par iridectomie. Le glaucome à angle ouvert n'est pas un facteur de risque de glaucome à angle fermé. Les patients peuvent souhaiter être examinés pour déterminer s'ils sont sensibles à la fermeture de l'angle et subir une procédure prophylactique (p. ex., iridectomie), s'ils sont sensibles [voir AVERTISSEMENTS ET PRECAUTIONS ].
Activation de la manie/hypomanie
Conseillez aux patients, à leurs familles et aux soignants d'observer les signes d'activation de la manie/hypomanie [voir AVERTISSEMENTS ET PRECAUTIONS ].
Maladie cardiovasculaire/cérébrovasculaire
La prudence est recommandée lors de l'administration d'Effexor XR aux patients présentant des troubles cardiovasculaires, cérébrovasculaires ou du métabolisme des lipides [voir EFFETS INDÉSIRABLES ].
Élévation du cholestérol et des triglycérides sériques
Informez les patients que des élévations du cholestérol total, des LDL et des triglycérides peuvent survenir et que la mesure des lipides sériques peut être envisagée [voir AVERTISSEMENTS ET PRECAUTIONS ].
Syndrome d'arrêt
Conseillez aux patients de ne pas arrêter de prendre Effexor 75 mg XR sans en parler au préalable avec leur professionnel de la santé. Les patients doivent être conscients que des effets de sevrage peuvent survenir lors de l'arrêt d'Effexor XR [voir AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ].
Dysfonction sexuelle
Informez les patients que l'utilisation d'Effexor XR peut provoquer des symptômes de dysfonctionnement sexuel chez les hommes et les femmes. Informez les patients qu'ils doivent discuter de tout changement de la fonction sexuelle et des stratégies de gestion potentielles avec leur fournisseur de soins de santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Interférence avec les performances cognitives et motrices
Avertissez les patients de l'utilisation de machines dangereuses, y compris les automobiles, jusqu'à ce qu'ils soient raisonnablement certains que le traitement par Effexor 37,5 mg XR n'affecte pas leur capacité à se livrer à de telles activités.
De l'alcool
Conseillez aux patients d'éviter l'alcool pendant la prise d'Effexor 37,5 mg XR [voir INTERACTIONS MÉDICAMENTEUSES ].
Réactions allergiques
Conseillez aux patients d'informer leur médecin s'ils développent des phénomènes allergiques tels que des éruptions cutanées, de l'urticaire, un gonflement ou des difficultés respiratoires.
Grossesse
Conseillez aux patientes d'informer leur médecin si elles tombent enceintes ou ont l'intention de tomber enceintes pendant le traitement [voir Utilisation dans des populations spécifiques ].
Allaitement
Conseillez aux patientes d'informer leur médecin si elles allaitent un nourrisson [voir Utilisation dans des populations spécifiques ].
Sphéroïdes résiduels
Effexor XR contient des sphéroïdes, qui libèrent lentement le médicament dans le tube digestif. La partie insoluble de ces sphéroïdes est éliminée et les patients peuvent remarquer que des sphéroïdes passent dans les selles ou via une colostomie. Les patients doivent être informés que le médicament actif a déjà été absorbé au moment où le patient voit les sphéroïdes.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Les tumeurs n'ont pas été augmentées par le traitement à la venlafaxine chez les souris ou les rats. La venlafaxine a été administrée par gavage oral à des souris pendant 18 mois à des doses allant jusqu'à 120 mg/kg par jour, soit 1,7 fois la dose humaine maximale recommandée en mg/m2. La venlafaxine a également été administrée à des rats par gavage oral pendant 24 mois à des doses allant jusqu'à 120 mg/kg par jour. Chez les rats recevant la dose de 120 mg/kg, les concentrations plasmatiques de venlafaxine à l'autopsie étaient 1 fois (rats mâles) et 6 fois (rats femelles) les concentrations plasmatiques des patients recevant la dose humaine maximale recommandée. Les concentrations plasmatiques du métabolite O-desméthyl (ODV) étaient plus faibles chez les rats que chez les patients recevant la dose maximale recommandée. La O-desméthylvenlafaxine (ODV), le principal métabolite humain de la venlafaxine, administrée par gavage oral à des souris et des rats pendant 2 ans n'a pas augmenté l'incidence des tumeurs dans les deux études. Les souris ont reçu de l'ODV à des doses allant jusqu'à 500/300 mg/kg/jour (dose réduite après 45 semaines d'administration). L'exposition à la dose de 300 mg/kg/jour est 9 fois celle d'une dose humaine de 225 mg/jour. Les rats ont reçu de l'ODV à des doses allant jusqu'à 300 mg/kg/jour (mâles) ou 500 mg/kg/jour (femelles). L'exposition à la dose la plus élevée est d'environ 8 (hommes) ou 11 (femmes) fois celle d'une dose humaine de 225 mg/jour.
Mutagenèse
La venlafaxine et le principal métabolite humain, l'ODV, n'étaient pas mutagènes dans le test de mutation inverse d'Ames sur la bactérie Salmonella ou dans le test de mutation génique directe sur les ovaires de hamster chinois/HGPRT sur des cellules de mammifères. La venlafaxine n'était pas non plus mutagène ou clastogène dans le test in vitro de transformation de cellules de souris BALB/c-3T3, le test d'échange de chromatides sœurs dans des cellules ovariennes de hamster chinois en culture ou dans le test d'aberration chromosomique in vivo dans la moelle osseuse de rat. L'ODV n'était pas clastogène dans le test d'aberration chromosomique in vitro sur les cellules ovariennes du hamster chinois ou dans le test d'aberration chromosomique in vivo chez le rat.
Altération de la fertilité
Les études de reproduction et de fertilité de la venlafaxine chez le rat n'ont montré aucun effet indésirable de la venlafaxine sur la fertilité masculine ou féminine à des doses orales allant jusqu'à 2 fois la dose humaine maximale recommandée de 225 mg/jour sur une base mg/m2. Cependant, une diminution de la fertilité a été observée dans une étude dans laquelle des rats mâles et femelles ont été traités avec de l'O-desméthylvenlafaxine (ODV), le principal métabolite humain de la venlafaxine, avant et pendant l'accouplement et la gestation. Cela s'est produit à une exposition à l'ODV (AUC) d'environ 2 à 3 fois celle associée à une dose de venlafaxine humaine de 225 mg/jour.
Utilisation dans des populations spécifiques
Grossesse
Effets tératogènes
Catégorie de grossesse C
La venlafaxine n'a pas provoqué de malformations chez la progéniture de rats ou de lapins ayant reçu des doses allant jusqu'à 2,5 fois (rat) ou 4 fois (lapin) la dose quotidienne maximale recommandée chez l'homme sur une base en mg/m2. Cependant, chez les rats, il y a eu une diminution du poids des ratons, une augmentation des ratons mort-nés et une augmentation de la mortalité des ratons au cours des 5 premiers jours de lactation, lorsque l'administration a commencé pendant la gestation et s'est poursuivie jusqu'au sevrage. La cause de ces décès n'est pas connue. Ces effets se sont produits à 2,5 fois (mg/m2) la dose quotidienne humaine maximale. La dose sans effet sur la mortalité des ratons était de 0,25 fois la dose humaine sur une base en mg/m2. Dans les études sur le développement de la reproduction chez le rat et le lapin avec l'O-desméthylvenlafaxine (ODV), le principal métabolite humain de la venlafaxine, aucune preuve de tératogénicité n'a été observée à des marges d'exposition de 13 chez le rat et de 0,3 chez le lapin. Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Effexor XR ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Effets non tératogènes
Les nouveau-nés exposés à Effexor 37,5 mg XR, à d'autres SNRI ou ISRS, à la fin du troisième trimestre ont développé des complications nécessitant une hospitalisation prolongée, une assistance respiratoire et une alimentation par sonde. De telles complications peuvent survenir immédiatement après l'accouchement. Les signes cliniques signalés comprennent la détresse respiratoire, la cyanose, l'apnée, les convulsions, l'instabilité de la température, les difficultés d'alimentation, les vomissements, l'hypoglycémie, l'hypotonie, l'hypertonie, l'hyperréflexie, les tremblements, la nervosité, l'irritabilité et les pleurs constants. Ces caractéristiques correspondent soit à un effet toxique direct des ISRS et des IRSN, soit éventuellement à un syndrome de sevrage médicamenteux. Il convient de noter que, dans certains cas, le tableau clinique est compatible avec le syndrome sérotoninergique [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ]. Lors du traitement d'une femme enceinte avec Effexor XR au cours du troisième trimestre, le médecin doit examiner attentivement les risques et les avantages potentiels du traitement.
Travail et accouchement
L'effet de la venlafaxine sur le travail et l'accouchement chez l'homme est inconnu.
Mères allaitantes
Il a été rapporté que la venlafaxine et l'ODV sont excrétées dans le lait maternel. En raison du risque d'effets indésirables graves chez les nourrissons allaités par Effexor XR, une décision doit être prise d'interrompre l'allaitement ou d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère.
Utilisation pédiatrique
Deux essais contrôlés par placebo portant sur 766 patients pédiatriques atteints de TDM et deux essais contrôlés par placebo portant sur 793 patients pédiatriques atteints de TAG ont été menés avec Effexor XR, et les données n'étaient pas suffisantes pour étayer une allégation d'utilisation chez les patients pédiatriques.
Toute personne envisageant l'utilisation d'Effexor XR chez un enfant ou un adolescent doit équilibrer les risques potentiels avec le besoin clinique [voir AVERTISSEMENT DE BOÎTE , AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ].
Bien qu'aucune étude n'ait été conçue pour évaluer principalement l'impact d'Effexor 37,5 mg XR sur la croissance, le développement et la maturation des enfants et des adolescents, les études qui ont été réalisées suggèrent qu'Effexor XR peut affecter négativement le poids et la taille [voir AVERTISSEMENTS ET PRECAUTIONS ]. Si la décision est prise de traiter un patient pédiatrique avec Effexor XR, une surveillance régulière du poids et de la taille est recommandée pendant le traitement, en particulier si le traitement doit être poursuivi à long terme [voir AVERTISSEMENTS ET PRECAUTIONS ]. La sécurité du traitement par Effexor 75 mg XR pour les patients pédiatriques n'a pas été systématiquement évaluée pour un traitement chronique d'une durée supérieure à six mois. Dans les études menées chez des patients pédiatriques (âgés de 6 à 17 ans), la survenue d'augmentations de la pression artérielle et du cholestérol considérées comme cliniquement pertinentes chez les patients pédiatriques était similaire à celle observée chez les patients adultes. Par conséquent, les précautions pour les adultes s'appliquent aux patients pédiatriques [voir AVERTISSEMENTS ET PRECAUTIONS ].
Utilisation gériatrique
Le pourcentage de patients âgés de 65 ans ou plus dans les études cliniques sur Effexor 37,5 mg XR pour le TDM, le TAG, le TAS et la MP est indiqué dans le tableau 15.
Aucune différence globale d'efficacité ou de sécurité n'a été observée entre les patients gériatriques et les patients plus jeunes, et d'autres expériences cliniques rapportées n'ont généralement pas identifié de différences de réponse entre les patients âgés et les patients plus jeunes. Cependant, une plus grande sensibilité de certaines personnes âgées ne peut être exclue. Les ISRS et les IRSN, y compris Effexor XR, ont été associés à des cas d'hyponatrémie cliniquement significative chez les patients âgés, qui peuvent être plus à risque de cet effet indésirable [voir AVERTISSEMENTS ET PRECAUTIONS ].
La pharmacocinétique de la venlafaxine et de l'ODV n'est pas sensiblement modifiée chez les personnes âgées [voir PHARMACOLOGIE CLINIQUE ] (voir Figure 3). Aucun ajustement posologique n'est recommandé chez les personnes âgées sur la seule base de l'âge, bien que d'autres circonstances cliniques, dont certaines peuvent être plus fréquentes chez les personnes âgées, telles que l'insuffisance rénale ou hépatique, puissent justifier une réduction de la dose [voir DOSAGE ET ADMINISTRATION ].
Âge et sexe
Une analyse pharmacocinétique de population de 404 patients traités par Effexor issus de deux études portant à la fois sur des régimes deux fois par jour et trois fois par jour a montré que les concentrations plasmatiques minimales normalisées en fonction de la dose de venlafaxine ou d'ODV n'étaient pas modifiées par les différences d'âge ou de sexe. Un ajustement posologique en fonction de l'âge ou du sexe d'un patient n'est généralement pas nécessaire [voir DOSAGE ET ADMINISTRATION ] (voir tableau 15).
Utilisation dans les sous-groupes de patients
Figure 3 : Pharmacocinétique de la venlafaxine et de son métabolite O-desmethylvenlafaxine (ODV) dans des populations particulières.
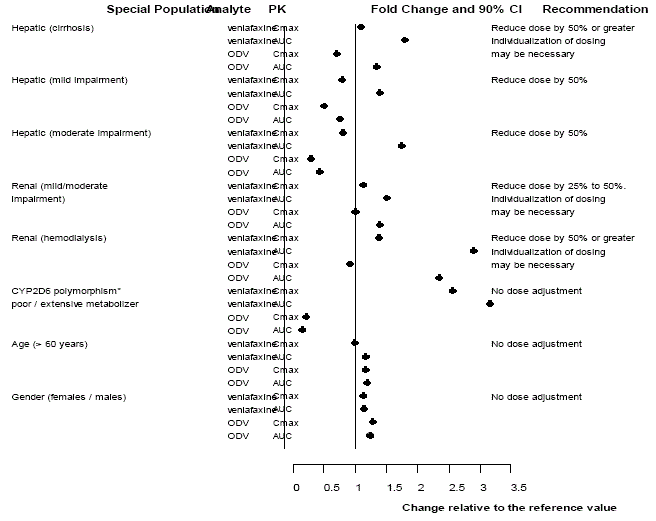
SURDOSAGE
Expérience humaine
Au cours des évaluations de précommercialisation d'Effexor 75 mg XR (pour le TDM, le GAD, le TAS et la MP) et d'Effexor (pour le TDM), il y a eu vingt rapports de surdosage aigu avec Effexor (6 et 14 rapports chez les patients Effexor XR et Effexor 75 mg, respectivement) , seul ou en association avec d'autres drogues et/ou alcool.
La somnolence était le symptôme le plus fréquemment rapporté. Parmi les autres symptômes signalés figuraient une paresthésie des quatre membres, des étourdissements modérés, des nausées, des mains et des pieds engourdis et des épisodes de chaud-froid 5 jours après le surdosage. Dans la plupart des cas, aucun signe ou symptôme n'a été associé à un surdosage. La majorité des rapports impliquaient une ingestion dans laquelle la dose totale de venlafaxine prise a été estimée comme n'étant pas plus de plusieurs fois supérieure à la dose thérapeutique habituelle. Un patient ayant ingéré 2,75 g de venlafaxine a présenté deux convulsions généralisées et un allongement de l'intervalle QTc à 500 msec, contre 405 msec au départ. Une légère tachycardie sinusale a été signalée chez deux des autres patients.
Les mesures prises pour traiter le surdosage comprenaient l'absence de traitement, l'hospitalisation et le traitement symptomatique, et l'hospitalisation plus un traitement au charbon actif. Tous les patients ont récupéré.
Dans l'expérience post-commercialisation, un surdosage avec la venlafaxine s'est produit principalement en association avec de l'alcool et/ou d'autres médicaments. Les événements les plus fréquemment signalés en cas de surdosage comprennent la tachycardie, les modifications du niveau de conscience (allant de la somnolence au coma), la mydriase, les convulsions et les vomissements.
Des modifications de l'électrocardiogramme (p. ex., allongement de l'intervalle QT, bloc de branche, allongement du QRS), tachycardie ventriculaire, bradycardie, hypotension, rhabdomyolyse, vertiges, nécrose hépatique, syndrome sérotoninergique et décès ont été signalés.
Des études rétrospectives publiées rapportent que le surdosage de venlafaxine peut être associé à un risque accru d'issue fatale par rapport à celui observé avec les produits antidépresseurs ISRS, mais inférieur à celui des antidépresseurs tricycliques. Des études épidémiologiques ont montré que les patients traités par la venlafaxine ont un fardeau préexistant de facteurs de risque de suicide plus élevé que les patients traités par un ISRS. La mesure dans laquelle la découverte d'un risque accru d'issues fatales peut être attribuée à la toxicité de la venlafaxine en cas de surdosage, par opposition à certaines caractéristiques des patients traités par la venlafaxine, n'est pas claire. Les prescriptions d'Effexor 75 mg XR doivent être rédigées pour la plus petite quantité de gélules compatible avec une bonne prise en charge du patient, afin de réduire le risque de surdosage.
Gestion du surdosage
Consultez un centre antipoison certifié pour obtenir des conseils et des conseils à jour (1-800-222-1222 ou www.poison.org). En cas de surdosage, fournir des soins de soutien, y compris une surveillance et une surveillance médicales étroites. Le traitement doit comprendre les mesures générales employées dans la prise en charge d'un surdosage avec n'importe quel médicament. Envisagez la possibilité d'une surdose de médicaments multiples. Assurer une ventilation adéquate, l'oxygénation et la ventilation. Surveiller le rythme cardiaque et les signes vitaux. Fournir des mesures de soutien et symptomatiques.
CONTRE-INDICATIONS
Hypersensibilité
Hypersensibilité au chlorhydrate de venlafaxine, au succinate de desvenlafaxine ou à l'un des excipients de la formulation
Utilisation concomitante avec des inhibiteurs de la monoamine oxydase (IMAO)
L'utilisation d'IMAO (destinés à traiter les troubles psychiatriques) en concomitance avec Effexor 75 mg XR ou dans les 7 jours suivant l'arrêt du traitement avec Effexor XR est contre-indiquée en raison d'un risque accru de syndrome sérotoninergique. L'utilisation d'Effexor 37,5 mg XR dans les 14 jours suivant l'arrêt du traitement par un IMAO (destiné à traiter les troubles psychiatriques) est également contre-indiquée [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS , et INTERACTIONS MÉDICAMENTEUSES ].
Commencer Effexor XR chez un patient qui est traité avec un IMAO tel que le linézolide ou le bleu de méthylène par voie intraveineuse est également contre-indiqué, en raison d'un risque accru de syndrome sérotoninergique [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS , et INTERACTIONS MÉDICAMENTEUSES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le mécanisme exact de l'action antidépressive de la venlafaxine chez l'homme est inconnu, mais on pense qu'il est lié à la potentialisation de la sérotonine et de la noradrénaline dans le système nerveux central, par inhibition de leur recapture. Des études non cliniques ont démontré que la venlafaxine et son métabolite actif, l'ODV, sont des inhibiteurs puissants et sélectifs de la recapture neuronale de la sérotonine et de la noradrénaline et de faibles inhibiteurs de la recapture de la dopamine.
Pharmacodynamie
La venlafaxine et l'ODV n'ont pas d'affinité significative pour les récepteurs muscariniques-cholinergiques, H1-histaminergiques ou α1 adrénergiques in vitro. On suppose que l'activité pharmacologique au niveau de ces récepteurs est associée aux divers effets anticholinergiques, sédatifs et cardiovasculaires observés avec d'autres médicaments psychotropes. La venlafaxine et l'ODV ne possèdent pas d'activité inhibitrice de la monoamine oxydase (MAO).
Électrophysiologie cardiaque
L'effet de la venlafaxine sur l'intervalle QT a été évalué dans le cadre d'une étude approfondie de l'intervalle QT, randomisée, en double aveugle, contrôlée par placebo et contrôlée positivement sur l'intervalle QT chez 54 sujets adultes en bonne santé. Aucun effet significatif d'allongement de l'intervalle QT de la venlafaxine 450 mg n'a été détecté.
Pharmacocinétique
Les concentrations à l'état d'équilibre de la venlafaxine et de l'ODV dans le plasma sont atteintes dans les 3 jours suivant le traitement oral à doses multiples. La venlafaxine et l'ODV ont présenté une cinétique linéaire sur la plage de doses de 75 à 450 mg par jour. La clairance plasmatique moyenne ± SD à l'état d'équilibre de la venlafaxine et de l'ODV est de 1,3 ± 0,6 et 0,4 ± 0,2 L/h/kg, respectivement ; la demi-vie d'élimination apparente est de 5 ± 2 et 11 ± 2 heures, respectivement; et le volume de distribution apparent (à l'état d'équilibre) est de 7,5 ± 3,7 et 5,7 ± 1,8 L/kg, respectivement. La venlafaxine et l'ODV sont très peu liées aux concentrations thérapeutiques aux protéines plasmatiques (27 % et 30 %, respectivement).
Absorption et distribution
La venlafaxine est bien absorbée et largement métabolisée dans le foie. L'ODV est le principal métabolite actif. Sur la base d'études de bilan massique, au moins 92 % d'une dose orale unique de venlafaxine sont absorbés. La biodisponibilité absolue de la venlafaxine est d'environ 45 %.
L'administration d'Effexor 37,5 mg XR (150 mg une fois par jour) a généralement entraîné une Cmax plus faible et des valeurs de Tmax plus tardives que pour Effexor (à libération immédiate) administré deux fois par jour (Tableau 16). Lorsque des doses quotidiennes égales de venlafaxine étaient administrées sous forme de comprimé à libération immédiate ou de capsule à libération prolongée, l'exposition à la venlafaxine et à l'ODV était similaire pour les deux traitements, et la fluctuation des concentrations plasmatiques était légèrement inférieure avec l'Effexor 37,5 mg. Capsule XR. Par conséquent, Effexor XR fournit un taux d'absorption plus lent, mais le même degré d'absorption par rapport au comprimé à libération immédiate.
La nourriture n'a pas affecté la biodisponibilité de la venlafaxine ou de son métabolite actif, l'ODV. Le moment de l'administration (AM versus PM) n'a pas affecté la pharmacocinétique de la venlafaxine et de l'ODV de la capsule 75 mg Effexor 75 mg XR.
La venlafaxine n'est pas fortement liée aux protéines plasmatiques; par conséquent, l'administration d'Effexor 37,5 mg XR à un patient prenant un autre médicament fortement lié aux protéines ne devrait pas entraîner d'augmentation des concentrations libres de l'autre médicament.
Métabolisme et élimination
Après absorption, la venlafaxine subit un important métabolisme présystémique dans le foie, principalement en ODV, mais aussi en N-desméthylvenlafaxine, N,O-didesméthylvenlafaxine et d'autres métabolites mineurs. Des études in vitro indiquent que la formation d'ODV est catalysée par le CYP2D6 ; cela a été confirmé dans une étude clinique montrant que les patients avec de faibles niveaux de CYP2D6 (métaboliseurs lents) avaient des niveaux accrus de venlafaxine et des niveaux réduits d'ODV par rapport aux personnes avec des niveaux normaux de CYP2D6 (métaboliseurs rapides) [voir Utilisation dans des populations spécifiques ].
Environ 87 % d'une dose de venlafaxine sont récupérés dans l'urine dans les 48 heures sous forme de venlafaxine inchangée (5 %), d'ODV non conjuguée (29 %), d'ODV conjuguée (26 %) ou d'autres métabolites inactifs mineurs (27 %). L'élimination rénale de la venlafaxine et de ses métabolites est donc la principale voie d'excrétion.
Etudes cliniques
Trouble dépressif majeur
L'efficacité des gélules à libération prolongée Effexor 75 mg XR (chlorhydrate de venlafaxine) dans le traitement du trouble dépressif majeur (TDM) a été établie dans deux études contrôlées par placebo à court terme (8 semaines pour l'étude 1 ; 12 semaines pour l'étude 2), flexibles -études de dose, avec des doses commençant à 75 mg par jour et allant jusqu'à 225 mg par jour chez des patients adultes ambulatoires répondant aux critères DSM-III-R ou DSM-IV pour le TDM. Chez les patients ambulatoires modérément déprimés, la dose initiale de venlafaxine était de 75 mg par jour. Dans les deux études, Effexor XR a démontré une supériorité par rapport au placebo sur la principale mesure d'efficacité définie comme le changement entre le score total HAM-D-21 et la visite au point final, Effexor XR a également démontré une supériorité par rapport au placebo sur le critère d'efficacité secondaire clé, la Impressions globales (CGI) Échelle de gravité de la maladie. L'examen des sous-ensembles de sexe de la population étudiée n'a révélé aucune réactivité différentielle sur la base du sexe.
Une étude de 4 semaines sur des patients hospitalisés répondant aux critères du DSM-III-R pour le TDM avec mélancolie utilisant Effexor 37,5 mg dans une plage de 150 à 375 mg par jour (répartis en trois prises par jour) a démontré la supériorité d'Effexor sur placebo sur la base du score total HAM-D-21. La dose moyenne chez les finissants était de 350 mg par jour (étude 3).
Dans une étude à plus long terme, des patients adultes ambulatoires atteints de TDM qui avaient répondu au cours d'une étude ouverte de 8 semaines sur Effexor 37,5 mg XR (75, 150 ou 225 mg, une fois par jour tous les matins) ont été randomisés pour continuer leur même Effexor dose XR ou au placebo, jusqu'à 26 semaines d'observation en cas de rechute. La réponse au cours de la phase en ouvert a été définie comme un score de l'élément de gravité de la maladie CGI ≤ 3 et un score total HAM-D-21 ≤ 10 au jour 56 de l'évaluation. La rechute au cours de la phase en double aveugle a été définie comme suit : (1) une réapparition d'un trouble dépressif majeur tel que défini par les critères du DSM-IV et un score d'item de gravité de la maladie CGI ≥ 4 (modérément malade), (2) 2 récidives CGI consécutives Scores de l'élément de gravité de la maladie ≥ 4, ou (3) un score final de l'élément de gravité de la maladie CGI ≥ 4 pour tout patient qui s'est retiré de l'étude pour une raison quelconque. Les patients recevant un traitement continu par Effexor 37,5 mg XR ont présenté des taux de rechute statistiquement significativement plus faibles au cours des 26 semaines suivantes par rapport à ceux recevant un placebo (étude 4).
Dans un deuxième essai à plus long terme, des patients adultes ambulatoires atteints de TDM, de type récurrent, qui avaient répondu (score total HAM-D21 ≤ 12 lors de l'évaluation au jour 56) et continuaient à s'améliorer [définis comme les critères suivants remplis pendant les jours 56 à 180 : (1) pas de score total HAM-D-21 ≥ 20 ; (2) pas plus de 2 scores totaux HAM39 D-21 > 10, et (3) aucun score d'élément de sévérité de la maladie CGI ≥ 4 (modérément malade)] pendant les 26 semaines initiales de traitement par Effexor [100 à 200 mg par jour, selon un schéma biquotidien] ont été randomisés pour continuer leur même dose d'Effexor ou pour recevoir un placebo. La période de suivi pour observer les patients en cas de rechute, définie comme un score d'item de gravité de la maladie CGI ≥ 4, a duré jusqu'à 52 semaines. Les patients recevant un traitement continu par Effexor ont présenté des taux de rechute statistiquement significativement plus faibles au cours des 52 semaines suivantes par rapport à ceux recevant un placebo (étude 5).
Désordre anxieux généralisé
L'efficacité d'Effexor XR en tant que traitement du trouble d'anxiété généralisée (TAG) a été établie dans deux études à dose fixe contrôlées par placebo de 8 semaines (75 à 225 mg par jour), une étude flexible de 6 mois contrôlée par placebo à dose fixe (75 à 225 mg par jour) et une étude à dose fixe contrôlée par placebo de 6 mois (37,5, 75 et 150 mg par jour) chez des patients adultes ambulatoires répondant aux critères du DSM-IV pour le TAG.
Dans une étude de 8 semaines, Effexor XR a démontré une supériorité sur le placebo pour les doses de 75, 150 et 225 mg par jour, mesurées par le score total de l'échelle d'évaluation de Hamilton pour l'anxiété (HAM-A), à la fois l'anxiété et la tension HAM-A. items et l'échelle d'impressions cliniques globales (CGI). Cependant, les doses de 75 et 150 mg par jour n'étaient pas aussi efficaces que la dose la plus élevée (étude 1). Une deuxième étude de 8 semaines évaluant des doses de 75 et 150 mg par jour et un placebo a montré que les deux doses étaient plus efficaces que le placebo sur certains de ces mêmes critères de jugement ; cependant, la dose de 75 mg par jour était plus efficace que la dose de 150 mg par jour (étude 2). Une relation dose-réponse pour l'efficacité dans le TAG n'a pas été clairement établie dans la gamme de doses de 75 à 225 mg par jour étudiée.
Deux études de 6 mois, l'une évaluant Effexor 75 mg XR à des doses de 37,5, 75 et 150 mg par jour (étude 3) et l'autre évaluant Effexor XR à des doses de 75 à 225 mg par jour (étude 4), ont montré que des doses quotidiennes de 75 mg ou plus ont été plus efficaces que le placebo sur le total HAM-A, à la fois sur les items anxiété et tension HAM-A et sur l'échelle CGI pendant 6 mois de traitement. Bien qu'il y ait également des preuves de supériorité sur le placebo pour la dose de 37,5 mg par jour, cette dose n'était pas aussi efficace que les doses plus élevées.
L'examen des sous-ensembles de sexe de la population étudiée n'a révélé aucune réactivité différentielle sur la base du sexe.
Trouble d'anxiété sociale (également connu sous le nom de phobie sociale)
L'efficacité d'Effexor 37,5 mg XR en tant que traitement du trouble d'anxiété sociale (TAS) a été établie dans quatre études en double aveugle, en groupes parallèles, de 12 semaines, multicentriques, contrôlées par placebo et à doses flexibles (études 1-4) et une étude en double aveugle, en groupes parallèles, de 6 mois, contrôlée par placebo, à dose fixe/flexible, qui comprenait des doses comprises entre 75 et 225 mg par jour chez des patients adultes ambulatoires répondant aux critères du DSM-IV pour le TAS (étude 5 ).
Dans ces cinq études, Effexor 75 mg XR était statistiquement significativement plus efficace que le placebo sur le changement entre le début et le point final sur le score total de l'échelle d'anxiété sociale de Liebowitz (LSAS). Il n'y avait aucune preuve d'une plus grande efficacité du groupe de 150 à 225 mg par jour par rapport au groupe de 75 mg par jour dans l'étude de 6 mois.
L'examen de sous-ensembles de la population étudiée n'a révélé aucune réactivité différentielle en fonction du sexe. Il n'y avait pas suffisamment d'informations pour déterminer l'effet de l'âge ou de la race sur les résultats dans ces études.
Trouble panique
L'efficacité d'Effexor XR en tant que traitement du trouble panique (TP) a été établie dans deux études multicentriques, en double aveugle, contrôlées par placebo, d'une durée de 12 semaines, chez des patients adultes ambulatoires répondant aux critères du DSM-IV pour le MP, avec ou sans agoraphobie. Les patients ont reçu des doses fixes de 75 ou 150 mg par jour dans une étude (étude 1) et de 75 ou 225 mg par jour dans l'autre étude (étude 2).
L'efficacité a été évaluée sur la base des résultats de trois variables : (1) pourcentage de patients sans attaques de panique à symptômes complets sur l'échelle de panique et d'anxiété d'anticipation (PAAS) ; (2) changement moyen entre le début et le point final sur le score total de l'échelle de gravité du trouble panique (PDSS) ; et (3) pourcentage de patients classés comme répondeurs (très améliorés ou très améliorés) sur l'échelle d'amélioration des impressions cliniques globales (CGI). Dans ces deux études, Effexor XR était statistiquement significativement plus efficace que le placebo (pour chaque dose fixe) sur les trois critères d'évaluation, mais une relation dose-réponse n'a pas été clairement établie.
L'examen de sous-ensembles de la population étudiée n'a révélé aucune réactivité différentielle en fonction du sexe. Il n'y avait pas suffisamment d'informations pour déterminer l'effet de l'âge ou de la race sur les résultats dans ces études.
Dans une étude à plus long terme (étude 3), des patients externes adultes répondant aux critères du DSM-IV pour la MP qui avaient répondu au cours d'une phase ouverte de 12 semaines avec Effexor 75 mg XR (75 à 225 mg par jour) ont été randomisés pour continuer le même Effexor 75 mg Dose XR (75, 150 ou 225 mg) ou passer au placebo pour l'observation d'une rechute dans des conditions en double aveugle. La réponse pendant la phase ouverte a été définie comme ≤ 1 crise de panique complète par semaine au cours des 2 dernières semaines de la phase ouverte et un score d'amélioration CGI de 1 (très amélioré) ou 2 (très amélioré). La rechute au cours de la phase en double aveugle a été définie comme ayant 2 crises de panique complètes ou plus par semaine pendant 2 semaines consécutives ou comme ayant interrompu en raison d'une perte d'efficacité déterminée par les investigateurs au cours de l'étude. Les patients randomisés étaient en état de réponse pendant une durée moyenne de 34 jours avant d'être randomisés. Dans la phase randomisée suivant la période en ouvert de 12 semaines, les patients recevant Effexor 75 mg XR continu ont connu un temps de rechute statistiquement significativement plus long.
Patients pédiatriques
Deux études contrôlées par placebo portant sur 766 patients pédiatriques atteints de TDM et deux études contrôlées par placebo portant sur 793 patients pédiatriques atteints de TAG ont été menées avec Effexor XR, et les données n'étaient pas suffisantes pour étayer une allégation d'utilisation chez les patients pédiatriques.
Qu'est-ce qu'Effexor et comment est-il utilisé ?
Effexor est un médicament d'ordonnance utilisé pour traiter les symptômes de la dépression, de l'anxiété généralisée, de l'anxiété sociale et du trouble panique. Effexor peut être utilisé seul ou avec d'autres médicaments.
Effexor appartient à une classe de médicaments appelés antidépresseurs, inhibiteurs sélectifs de la recapture de la sérotonine et de la noradrénaline (IRSN).
Quels sont les effets secondaires possibles d'Effexor 37,5 mg ?
Effexor peut provoquer des effets secondaires graves, notamment :
- Vision floue,
- vision tunnel,
- douleur ou gonflement des yeux,
- voir des halos de lumières rondes,
- ecchymoses ou saignements faciles (saignements de nez, saignements des gencives),
- sang dans vos urines ou vos selles,
- tousser du sang,
- toux,
- oppression thoracique,
- difficulté à respirer,
- convulsions (convulsions),
- mal de tête,
- confusion,
- troubles de l'élocution,
- grande faiblesse,
- vomissement,
- perte de coordination,
- se sentir instable,
- muscle très raide (rigide),
- forte fièvre,
- transpiration,
- confusion,
- battements cardiaques rapides ou irréguliers,
- tremblements et
- étourdissement
- Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
- Les effets secondaires les plus courants d'Effexor comprennent:
- vertiges,
- somnolence,
- anxiété,
- se sentir nerveux,
- troubles du sommeil (insomnie),
- changements de vision,
- nausée,
- vomissement,
- diarrhée,
- changements de poids ou d'appétit,
- bouche sèche,
- bâillement,
- augmentation de la transpiration,
- diminution de la libido,
- impuissance,
- éjaculation anormale, et
- difficulté à avoir un orgasme
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Effexor. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
Suicidalité et antidépresseurs
Les antidépresseurs ont augmenté le risque par rapport au placebo de pensées et de comportements suicidaires (suicidalité) chez les enfants, les adolescents et les jeunes adultes dans les études à court terme sur le trouble dépressif majeur (TDM) et d'autres troubles psychiatriques. Quiconque envisage l'utilisation de comprimés de venlafaxine, USP ou de tout autre antidépresseur chez un enfant, un adolescent ou un jeune adulte doit équilibrer ce risque avec le besoin clinique. Les études à court terme n'ont pas montré d'augmentation du risque de suicide avec les antidépresseurs par rapport au placebo chez les adultes au-delà de 24 ans ; il y avait une réduction du risque avec les antidépresseurs par rapport au placebo chez les adultes âgés de 65 ans et plus. La dépression et certains autres troubles psychiatriques sont eux-mêmes associés à une augmentation du risque de suicide. Les patients de tous âges qui commencent un traitement antidépresseur doivent être surveillés de manière appropriée et observés de près pour déceler une aggravation clinique, des tendances suicidaires ou des changements inhabituels de comportement. Les familles et les soignants doivent être informés de la nécessité d'une surveillance étroite et d'une communication avec le prescripteur. Les comprimés de venlafaxine, USP ne sont pas approuvés pour une utilisation chez les patients pédiatriques. (Voir AVERTISSEMENTS : Aggravation clinique et risque de suicide , INFORMATIONS PATIENTS , et PRÉCAUTIONS : Utilisation pédiatrique ).
LA DESCRIPTION
Les comprimés de venlafaxine, USP sont un antidépresseur structurellement nouveau pour l'administration orale. Il est désigné chlorhydrate de (R/S)-1-[2-(diméthylamino)-1-(4-méthoxyphényl)éthyl] cyclohexanol ou (±)-1-[α- [(diméthyl-amino)méthyl]-p- le chlorhydrate de méthoxybenzyl]cyclohexanol et a la formule brute de C17H27NO2 HCl. Son poids moléculaire est de 313,87. La formule structurale est illustrée ci-dessous.
Le chlorhydrate de venlafaxine est un solide cristallin blanc à blanc cassé avec une solubilité de 572 mg/mL dans l'eau (ajusté à une force ionique de 0,2 M avec du chlorure de sodium). Son coefficient de partage octanol:eau (chlorure de sodium 0,2 M) est de 0,43.
Les comprimés compressés contiennent du chlorhydrate de venlafaxine, USP équivalent à 25 mg, 37,5 mg, 50 mg, 75 mg ou 100 mg de base de venlafaxine et les ingrédients inactifs suivants : cellulose microcristalline, lactose monohydraté, amidon prégélatinisé, glycolate d'amidon sodique, oxyde de fer rouge, oxyde de fer jaune, dioxyde de silicium colloïdal et stéarate de magnésium.
