Pamelor 25mg Nortriptyline Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Pamelor 25 mg et comment est-il utilisé ?
Pamelor 25 mg est un médicament d'ordonnance utilisé pour traiter les symptômes de la dépression. Pamelor 25 mg peut être utilisé seul ou avec d'autres médicaments.
Pamelor appartient à une classe de médicaments appelés antidépresseurs, TCA.
On ne sait pas si Pamelor est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Pamelor 25mg ?
Pamelor peut provoquer des effets secondaires graves, notamment :
- des changements d'humeur,
- anxiété,
- crises de panique,
- troubles du sommeil,
- comportement impulsif,
- irritabilité,
- agitation,
- hostilité,
- agression,
- agitation,
- hyperactivité (mentale ou physique),
- augmentation de la dépression,
- pensées de se faire du mal,
- Vision floue,
- vision tunnel,
- douleur ou gonflement des yeux,
- voir des halos autour des lumières,
- mouvements musculaires agités dans les yeux, la langue, la mâchoire ou le cou,
- étourdissement,
- saisie,
- douleur thoracique nouvelle ou aggravée,
- des battements de cœur battants,
- flottant dans ta poitrine,
- engourdissement ou faiblesse soudaine,
- problèmes de vue,
- difficulté d'élocution ou d'équilibre,
- fièvre,
- mal de gorge,
- ecchymoses faciles,
- saignement inhabituel,
- jaunissement de la peau ou des yeux (jaunisse),
- miction douloureuse ou difficile,
- rythme cardiaque rapide,
- réflexes hyperactifs,
- nausée,
- vomissement,
- diarrhée,
- perte de coordination et
- évanouissement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Pamelor incluent :
- nausée,
- vomissement,
- perte d'appétit,
- anxiété,
- troubles du sommeil (insomnie),
- bouche sèche,
- goût inhabituel,
- peu ou pas d'urine,
- constipation,
- changements de vision,
- gonflement des seins (chez l'homme ou la femme),
- diminution de la libido,
- l'impuissance, et
- difficulté à avoir un orgasme
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Pamelor. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
Suicidalité et antidépresseurs
Les antidépresseurs ont augmenté le risque par rapport au placebo de pensées et de comportements suicidaires (suicidalité) chez les enfants, les adolescents et les jeunes adultes dans des études à court terme sur le trouble dépressif majeur (TDM) et d'autres troubles psychiatriques. Quiconque envisage l'utilisation de chlorhydrate de nortriptyline ou de tout autre antidépresseur chez un enfant, un adolescent ou un jeune adulte doit équilibrer ce risque avec le besoin clinique. Les études à court terme n'ont pas montré d'augmentation du risque de suicide avec les antidépresseurs par rapport au placebo chez les adultes au-delà de 24 ans ; il y avait une réduction du risque avec les antidépresseurs par rapport au placebo chez les adultes âgés de 65 ans et plus. La dépression et certains autres troubles psychiatriques sont eux-mêmes associés à une augmentation du risque de suicide. Les patients de tous âges qui commencent un traitement antidépresseur doivent être surveillés de manière appropriée et observés de près pour déceler une aggravation clinique, des tendances suicidaires ou des changements inhabituels de comportement. Les familles et les soignants doivent être informés de la nécessité d'une surveillance étroite et d'une communication avec le prescripteur. Le chlorhydrate de nortriptyline n'est pas approuvé pour une utilisation chez les patients pédiatriques (voir AVERTISSEMENTS aggravation clinique et risque suicidaire ; INFORMATIONS PATIENTS ; et PRÉCAUTIONS , Usage pédiatrique).
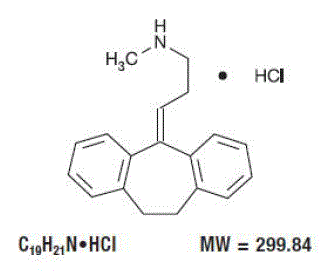
LA DESCRIPTION
Pamelor™ (nortriptyline HCl) est la 1-propanamine, 3-(10,11-dihydro-5H-dibenzo[a,d]cycloheptène-5-ylidène)-N-méthyl-, chlorhydrate.
La formule structurale est la suivante :
Gélules de 10 mg, 25 mg, 50 mg et 75 mg
Ingrédient actif
chlorhydrate de nortriptyline USP.
Gélules de 10 mg, 25 mg et 75 mg
ingrédients inactifs
D&C Yellow #10, FD&C Yellow #6, gélatine, liquide de silicone, amidon et dioxyde de titane.
Gélules de 50 mg
ingrédients inactifs
gélatine, liquide de silicone, amidon et dioxyde de titane.
LES INDICATIONS
Pamelor™ (chlorhydrate de nortriptyline) est indiqué pour le soulagement des symptômes de la dépression. Les dépressions endogènes sont plus susceptibles d'être atténuées que les autres états dépressifs.
DOSAGE ET ADMINISTRATION
Pamelor 25 mg est déconseillé aux enfants.
Pamelor est administré par voie orale sous forme de gélules. Des doses plus faibles que d'habitude sont recommandées pour les patients âgés et les adolescents. Des posologies plus faibles sont également recommandées pour les patients ambulatoires que pour les patients hospitalisés qui seront sous surveillance étroite. Le médecin doit initier la posologie à un niveau bas et l'augmenter progressivement, en notant attentivement la réponse clinique et tout signe d'intolérance. Après la rémission, un médicament d'entretien peut être nécessaire pendant une période plus longue à la dose la plus faible qui maintiendra la rémission.
Si un patient développe des effets secondaires mineurs, la posologie doit être réduite. Le médicament doit être arrêté rapidement en cas d'effets indésirables graves ou de manifestations allergiques.
Dose habituelle pour adultes
25 mg trois ou quatre fois par jour ; la posologie doit commencer à un faible niveau et être augmentée au besoin. En tant que régime alternatif, la dose quotidienne totale peut être administrée une fois par jour. Lorsque des doses supérieures à 100 mg par jour sont administrées, les taux plasmatiques de nortriptyline doivent être surveillés et maintenus dans la plage optimale de 50 à 150 ng/mL. Les doses supérieures à 150 mg/jour ne sont pas recommandées.
Patients âgés et adolescents
30 à 50 mg/jour, en doses fractionnées, ou la dose quotidienne totale peut être administrée une fois par jour.
Passage d'un patient à ou à partir d'un inhibiteur de la monoamine oxydase (IMAO) destiné à traiter les troubles psychiatriques
Au moins 14 jours doivent s'écouler entre l'arrêt d'un IMAO destiné à traiter des troubles psychiatriques et l'instauration d'un traitement par Pamelor. A l'inverse, il faut compter au moins 14 jours après l'arrêt de Pamelor avant de débuter un IMAO destiné à traiter les troubles psychiatriques ( CONTRE-INDICATIONS ).
Utilisation de Pamelor 25 mg avec d'autres IMAO, tels que le linézolide ou le bleu de méthylène
Ne pas commencer Pamelor chez un patient traité par linézolide ou bleu de méthylène par voie intraveineuse car il existe un risque accru de syndrome sérotoninergique. Chez un patient qui nécessite un traitement plus urgent d'une affection psychiatrique, d'autres interventions, y compris l'hospitalisation, doivent être envisagées (voir CONTRE-INDICATIONS ).
Dans certains cas, un patient recevant déjà un traitement par Pamelor peut nécessiter un traitement urgent avec du linézolide ou du bleu de méthylène par voie intraveineuse. Si des alternatives acceptables au traitement par le linézolide ou le bleu de méthylène par voie intraveineuse ne sont pas disponibles et que les avantages potentiels du traitement par le linézolide ou le bleu de méthylène par voie intraveineuse sont jugés supérieurs aux risques de syndrome sérotoninergique chez un patient particulier, Pamelor 25 mg doit être arrêté rapidement et le linézolide ou le méthylène par voie intraveineuse bleu peut être administré. Le patient doit être surveillé pour des symptômes de syndrome sérotoninergique pendant deux semaines ou jusqu'à 24 heures après la dernière dose de linézolide ou de bleu de méthylène par voie intraveineuse, selon la première éventualité. Le traitement par Pamelor peut être repris 24 heures après la dernière dose de linézolide ou de bleu de méthylène par voie intraveineuse (voir AVERTISSEMENTS ).
Le risque d'administration de bleu de méthylène par des voies non intraveineuses (telles que des comprimés oraux ou par injection locale) ou à des doses intraveineuses bien inférieures à 1 mg/kg avec Pamelor 25 mg n'est pas clair. Le clinicien doit néanmoins être conscient de la possibilité d'apparition de symptômes de syndrome sérotoninergique avec une telle utilisation (voir AVERTISSEMENTS ).
COMMENT FOURNIE
Pamelor™ (chlorhydrate de nortriptyline) Capsules USP
Les capsules Pamelor™ (nortriptyline HCl) USP, équivalentes à 10 mg, 25 mg, 50 mg et 75 mg de base, sont disponibles comme suit :
10 mg : Capuchon opaque orange clair imprimé « PAMELOR 10 mg » en noir et corps opaque blanc imprimé « M » en noir.
Bouteilles de 30 : CDN 0406-9910-03
25mg : Capuchon opaque orange clair imprimé « PAMELOR 25 mg » en noir et corps opaque blanc imprimé « M » en noir.
Bouteilles de 30 : CDN 0406-9911-03
50mg : Capuchon blanc opaque imprimé « PAMELOR 50 mg » en noir et corps blanc opaque imprimé « M » en noir.
Bouteilles de 30 : CDN 0406-9912-03
75mg Capuchon opaque orange clair imprimé « PAMELOR 75 mg » en noir et corps opaque orange clair imprimé « M » en noir.
Bouteilles de 30 : CDN 0406-9913-03
Stocker et distribuer
Le magasin à 20 ° à 25°C (68 ° à 77°F) [voit USP la Température de Pièce Contrôlée].
Distribuer dans un récipient étanche (USP) avec une fermeture à l'épreuve des enfants.
Mallinckrodt, la marque "M", le logo Mallinckrodt Pharmaceuticals et d'autres marques sont des marques déposées d'une société Mallinckrodt.
Fabriqué par : Patheon Inc. Whitby, Ontario, Canada. L1N 5Z5. Révisé : octobre 2016
EFFETS SECONDAIRES
Noter
La liste suivante contient quelques effets indésirables qui n'ont pas été signalés avec ce médicament spécifique. Cependant, les similitudes pharmacologiques entre les médicaments antidépresseurs tricycliques exigent que chacune des réactions soit prise en compte lors de l'administration de nortriptyline.
Cardiovasculaire
Hypotension, hypertension, tachycardie, palpitations, infarctus du myocarde, arythmies, bloc cardiaque, accident vasculaire cérébral.
Psychiatrique
États confusionnels (en particulier chez les personnes âgées) avec hallucinations, désorientation, délires ; anxiété, agitation, agitation; insomnie, panique, cauchemars ; hypomanie; exacerbation de la psychose.
Neurologique
Engourdissement, picotements, paresthésies des extrémités ; incoordination, ataxie, tremblements; neuropathie périphérique; symptômes extrapyramidaux; convulsions, altération des schémas EEG ; acouphène.
Anticholinergique
Bouche sèche et, rarement, adénite sublinguale associée ; vision floue, troubles de l'accommodation, mydriase ; constipation, iléus paralytique; rétention urinaire, miction retardée, dilatation des voies urinaires.
Allergique
Eruption cutanée, pétéchies, urticaire, démangeaisons, photosensibilisation (éviter une exposition excessive au soleil) ; œdème (général ou du visage et de la langue), fièvre médicamenteuse, sensibilité croisée avec d'autres médicaments tricycliques.
Hématologique
Dépression de la moelle osseuse, y compris agranulocytose ; éosinophilie; purpura; thrombocytopénie.
Gastro-intestinal
Nausées et vomissements, anorexie, détresse épigastrique, diarrhée, goût particulier, stomatite, crampes abdominales, langue noire.
Endocrine
Gynécomastie chez l'homme, hypertrophie mammaire et galactorrhée chez la femme ; augmentation ou diminution de la libido, impuissance; gonflement testiculaire; élévation ou dépression du taux de sucre dans le sang ; syndrome de sécrétion inappropriée d'ADH (hormone antidiurétique).
Autre
Jaunisse (simulant une obstruction), fonction hépatique altérée ; gain ou perte de poids; transpiration; rinçage; fréquence urinaire, nycturie; somnolence, vertiges, faiblesse, fatigue; mal de tête; gonflement parotide; alopécie.
Les symptômes de sevrage
Bien que ceux-ci ne soient pas indicatifs d'une dépendance, l'arrêt brutal du traitement après un traitement prolongé peut entraîner des nausées, des maux de tête et des malaises.
Expérience post-commercialisation
L'effet indésirable suivant a été signalé lors de l'utilisation post-approbation de Pamelor. Étant donné que cette réaction est signalée volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer la fréquence de manière fiable.
Troubles cardiaques -Syndrome de Brugada
Troubles oculaires - glaucome à angle fermé
INTERACTIONS MÉDICAMENTEUSES
Il a été démontré que l'administration de réserpine au cours d'un traitement par un antidépresseur tricyclique produisait un effet «stimulant» chez certains patients déprimés.
Une surveillance étroite et un ajustement soigneux de la posologie sont nécessaires lorsque Pamelor 25 mg est utilisé avec d'autres médicaments anticholinergiques et sympathomimétiques.
L'administration concomitante de cimétidine et d'antidépresseurs tricycliques peut produire des augmentations cliniquement significatives des concentrations plasmatiques de l'antidépresseur tricyclique. Le patient doit être informé que la réponse à l'alcool peut être exagérée.
Un cas d'hypoglycémie importante a été rapporté chez un patient diabétique de type II maintenu sous chlorpropamide (250 mg/j), après adjonction de nortriptyline (125 mg/j).
Médicaments métabolisés par le P450 2D6
L'activité biochimique du médicament métabolisant l'isozyme cytochrome P450 2D6 (débrisoquine hydroxylase) est réduite dans un sous-ensemble de la population caucasienne (environ 7 % à 10 % des Caucasiens sont appelés "métaboliseurs lents") ; des estimations fiables de la prévalence de l'activité réduite de l'isoenzyme P450 2D6 parmi les populations asiatiques, africaines et autres ne sont pas encore disponibles. Les métaboliseurs lents ont des concentrations plasmatiques d'antidépresseurs tricycliques (ATC) plus élevées que prévu lorsqu'ils reçoivent des doses habituelles. Selon la fraction de médicament métabolisée par le P450 2D6, l'augmentation de la concentration plasmatique peut être faible ou assez importante (augmentation de 8 fois de l'ASC plasmatique du TCA).
De plus, certains médicaments inhibent l'activité de cette isozyme et font ressembler les métaboliseurs normaux aux métaboliseurs lents. Un individu qui est stable avec une dose donnée de TCA peut devenir brusquement toxique lorsqu'il reçoit l'un de ces médicaments inhibiteurs en traitement concomitant. Les médicaments qui inhibent le cytochrome P450 2D6 comprennent certains qui ne sont pas métabolisés par l'enzyme (quinidine, cimétidine) et beaucoup qui sont des substrats pour P450 2D6 (de nombreux autres antidépresseurs, phénothiazines et les antiarythmiques de type 1C propafénone et flécaïnide). Bien que tous les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), par exemple la fluoxétine, la sertraline et la paroxétine, inhibent P450 2D6, leur degré d'inhibition peut varier. La mesure dans laquelle les interactions ISRS-TCA peuvent poser des problèmes cliniques dépendra du degré d'inhibition et de la pharmacocinétique des ISRS impliqués. Néanmoins, la prudence est de mise lors de la co-administration des ATC avec l'un des ISRS et également lors du passage d'une classe à l'autre. Il est particulièrement important de veiller à ce qu'un délai suffisant s'écoule avant d'initier un traitement par TCA chez un patient sevré de la fluoxétine, compte tenu de la longue demi-vie du parent et du métabolite actif (au moins 5 semaines peuvent être nécessaires).
L'utilisation concomitante d'antidépresseurs tricycliques avec des médicaments qui peuvent inhiber le cytochrome P450 2D6 peut nécessiter des doses plus faibles que celles habituellement prescrites pour l'antidépresseur tricyclique ou l'autre médicament. De plus, chaque fois que l'un de ces autres médicaments est retiré de la co-thérapie, une dose accrue d'antidépresseur tricyclique peut être nécessaire. Il est souhaitable de surveiller les taux plasmatiques de TCA chaque fois qu'un TCA va être co-administré avec un autre médicament connu pour être un inhibiteur de P450 2D6.
AVERTISSEMENTS
Aggravation clinique et risque de suicide
Les patients atteints de trouble dépressif majeur (TDM), à la fois adultes et pédiatriques, peuvent présenter une aggravation de leur dépression et/ou l'émergence d'idées et de comportements suicidaires (suicidalité) ou des changements de comportement inhabituels, qu'ils prennent ou non des antidépresseurs, et cela le risque peut persister jusqu'à ce qu'une rémission significative se produise. Le suicide est un risque connu de dépression et de certains autres troubles psychiatriques, et ces troubles eux-mêmes sont les meilleurs prédicteurs du suicide. Cependant, on craint depuis longtemps que les antidépresseurs puissent jouer un rôle dans l'aggravation de la dépression et l'émergence de comportements suicidaires chez certains patients au cours des premières phases du traitement. Des analyses groupées d'essais contrôlés par placebo à court terme portant sur des antidépresseurs (ISRS et autres) ont montré que ces médicaments augmentent le risque de pensées et de comportements suicidaires (suicidalité) chez les enfants, les adolescents et les jeunes adultes (âgés de 18 à 24 ans) atteints de dépression majeure. (MDD) et d'autres troubles psychiatriques. Les études à court terme n'ont pas montré d'augmentation du risque de suicide avec les antidépresseurs par rapport au placebo chez les adultes au-delà de 24 ans ; il y avait une réduction avec les antidépresseurs par rapport au placebo chez les adultes âgés de 65 ans et plus.
Les analyses groupées d'essais contrôlés par placebo chez des enfants et des adolescents atteints de TDM, de trouble obsessionnel-compulsif (TOC) ou d'autres troubles psychiatriques comprenaient un total de 24 essais à court terme de 9 antidépresseurs chez plus de 4 400 patients. Les analyses groupées d'essais contrôlés par placebo chez des adultes atteints de TDM ou d'autres troubles psychiatriques comprenaient un total de 295 essais à court terme (durée médiane de 2 mois) de 11 antidépresseurs chez plus de 77 000 patients. Il y avait une variation considérable du risque de suicidalité entre les médicaments, mais une tendance à une augmentation chez les patients plus jeunes pour presque tous les médicaments étudiés. Il y avait des différences dans le risque absolu de suicidalité entre les différentes indications, avec l'incidence la plus élevée dans le TDM. Les différences de risque (médicament contre placebo) étaient toutefois relativement stables au sein des tranches d'âge et entre les indications. Ces différences de risque (différence médicament-placebo dans le nombre de cas de suicide pour 1000 patients traités) sont fournies dans .
Aucun suicide n'est survenu dans aucun des essais pédiatriques. Il y a eu des suicides dans les essais sur les adultes, mais le nombre n'était pas suffisant pour tirer une conclusion sur l'effet du médicament sur le suicide.
On ne sait pas si le risque de suicide s'étend à une utilisation à plus long terme, c'est-à-dire au-delà de plusieurs mois. Cependant, il existe des preuves substantielles provenant d'essais d'entretien contrôlés par placebo chez des adultes souffrant de dépression que l'utilisation d'antidépresseurs peut retarder la récurrence de la dépression.
Tous les patients traités avec des antidépresseurs pour toute indication doivent être surveillés de manière appropriée et observés de près pour déceler une aggravation clinique, des tendances suicidaires et des changements inhabituels de comportement, en particulier au cours des premiers mois d'un traitement médicamenteux, ou lors de changements de dose, soit des augmentations ou diminue.
Les symptômes suivants, anxiété, agitation, attaques de panique, insomnie, irritabilité, hostilité, agressivité, impulsivité, akathisie (agitation psychomotrice), hypomanie et manie, ont été rapportés chez des patients adultes et pédiatriques traités avec des antidépresseurs pour un trouble dépressif majeur ainsi comme pour les autres indications, tant psychiatriques que non psychiatriques. Bien qu'un lien de causalité entre l'apparition de tels symptômes et soit l'aggravation de la dépression et/ou l'émergence d'impulsions suicidaires n'ait pas été établi, on craint que ces symptômes puissent représenter des précurseurs d'une suicidalité émergente.
Il convient d'envisager de modifier le schéma thérapeutique, y compris éventuellement d'arrêter le médicament, chez les patients dont la dépression s'aggrave de manière persistante, ou qui présentent des tendances suicidaires émergentes ou des symptômes qui pourraient être des précurseurs d'une aggravation de la dépression ou des tendances suicidaires, en particulier si ces symptômes sont graves, brusques. au début ou ne faisaient pas partie des symptômes présentés par le patient.
Les familles et les soignants des patients traités avec des antidépresseurs pour un trouble dépressif majeur ou d'autres indications, à la fois psychiatriques et non psychiatriques, doivent être alertés de la nécessité de surveiller les patients pour l'apparition d'agitation, d'irritabilité, de changements inhabituels de comportement et des autres symptômes décrits ci-dessus. , ainsi que l'émergence de tendances suicidaires, et de signaler immédiatement ces symptômes aux fournisseurs de soins de santé. Une telle surveillance devrait inclure une observation quotidienne par les familles et les soignants. Les prescriptions pour l'hydrochlorure nortriptyline devraient être écrites pour la plus petite quantité de capsules en harmonie avec la bonne direction patiente, pour réduire le risque d'overdose.
Dépistage des patients pour le trouble bipolaire
Un épisode dépressif majeur peut être la présentation initiale d'un trouble bipolaire. Il est généralement admis (bien que non établi dans des essais contrôlés) que le traitement d'un tel épisode avec un antidépresseur seul peut augmenter la probabilité de précipitation d'un épisode mixte/maniaque chez les patients à risque de trouble bipolaire. On ne sait pas si l'un des symptômes décrits ci-dessus représente une telle conversion. Cependant, avant d'initier un traitement avec un antidépresseur, les patients présentant des symptômes dépressifs doivent faire l'objet d'un dépistage adéquat pour déterminer s'ils présentent un risque de trouble bipolaire ; un tel dépistage devrait inclure des antécédents psychiatriques détaillés, y compris des antécédents familiaux de suicide, de trouble bipolaire et de dépression. Il convient de noter que le chlorhydrate de nortriptyline n'est pas approuvé pour une utilisation dans le traitement de la dépression bipolaire.
Les patients atteints de maladies cardiovasculaires ne doivent recevoir Pamelor 25 mg que sous étroite surveillance en raison de la tendance du médicament à produire une tachycardie sinusale et à prolonger le temps de conduction. Des infarctus du myocarde, des arythmies et des accidents vasculaires cérébraux se sont produits. L'action antihypertensive de la guanéthidine et des agents similaires peut être bloquée. En raison de son activité anticholinergique, Pamelor doit être utilisé avec une grande prudence chez les patients ayant des antécédents de rétention urinaire. Les patients ayant des antécédents de convulsions doivent être suivis de près lors de l'administration de Pamelor 25 mg, dans la mesure où ce médicament est connu pour abaisser le seuil convulsif. Une grande prudence est requise si Pamelor est administré à des patients hyperthyroïdiens ou à des personnes recevant des médicaments pour la thyroïde, car des arythmies cardiaques peuvent se développer.
Pamelor peut altérer les capacités mentales et/ou physiques requises pour l'exécution de tâches dangereuses, telles que l'utilisation de machines ou la conduite d'une voiture ; par conséquent, le patient doit être averti en conséquence.
Une consommation excessive d'alcool en association avec un traitement par la nortriptyline peut avoir un effet potentialisateur, ce qui peut entraîner un risque accru de tentatives de suicide ou de surdosage, en particulier chez les patients ayant des antécédents de troubles émotionnels ou d'idées suicidaires.
L'administration concomitante de quinidine et de nortriptyline peut entraîner une demi-vie plasmatique significativement plus longue, une ASC plus élevée et une clairance plus faible de la nortriptyline.
Syndrome sérotoninergique
Le développement d'un syndrome sérotoninergique potentiellement mortel a été rapporté avec les IRSN et les ISRS, y compris Pamelor 25 mg, seuls mais surtout avec l'utilisation concomitante d'autres médicaments sérotoninergiques (y compris les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, le tryptophane, la buspirone et millepertuis) et avec des médicaments qui altèrent le métabolisme de la sérotonine (en particulier les IMAO, tant ceux destinés à traiter les troubles psychiatriques que d'autres, comme le linézolide et le bleu de méthylène par voie intraveineuse).
Les symptômes du syndrome sérotoninergique peuvent inclure des modifications de l'état mental (p. ex., agitation, hallucinations, délire et coma), une instabilité autonome (p. ex., tachycardie, tension artérielle labile, étourdissements, diaphorèse, bouffées vasomotrices, hyperthermie), des modifications neuromusculaires (p. ex., tremblements, rigidité, myoclonies, hyperréflexie, incoordination), convulsions et/ou symptômes gastro-intestinaux (p. ex., nausées, vomissements, diarrhée). Les patients doivent être surveillés pour détecter l'apparition d'un syndrome sérotoninergique.
L'utilisation concomitante de Pamelor 25mg avec des IMAO destinés à traiter les troubles psychiatriques est contre-indiquée. Pamelor ne doit pas non plus être instauré chez un patient traité par des IMAO tels que le linézolide ou le bleu de méthylène par voie intraveineuse. Tous les rapports avec le bleu de méthylène qui ont fourni des informations sur la voie d'administration impliquaient une administration intraveineuse dans la gamme de doses de 1 mg/kg à 8 mg/kg. Aucun rapport n'impliquait l'administration de bleu de méthylène par d'autres voies (telles que des comprimés oraux ou une injection tissulaire locale) ou à des doses plus faibles. Il peut y avoir des circonstances où il est nécessaire d'initier un traitement avec un IMAO tel que le linézolide ou le bleu de méthylène par voie intraveineuse chez un patient prenant Pamelor. Pamelor 25 mg doit être arrêté avant de commencer le traitement par IMAO (voir CONTRE-INDICATIONS et DOSAGE ET ADMINISTRATION ).
Si l'utilisation concomitante de Pamelor 25 mg avec d'autres médicaments sérotoninergiques, y compris les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, la buspirone, le tryptophane et le millepertuis est cliniquement justifiée, les patients doivent être informés d'un risque accru potentiel de syndrome sérotoninergique, en particulier lors de l'initiation du traitement et des augmentations de dose.
Le traitement par Pamelor 25 mg et tout agent sérotoninergique concomitant doit être interrompu immédiatement si les événements ci-dessus se produisent et un traitement symptomatique de soutien doit être instauré.
Démasquer le syndrome de Brugada
Il y a eu des rapports post-commercialisation d'une association possible entre le traitement par Pamelor et le démasquage du syndrome de Brugada. Le syndrome de Brugada est un trouble caractérisé par une syncope, des résultats électrocardiographiques (ECG) anormaux et un risque de mort subite. Pamelor doit généralement être évité chez les patients atteints du syndrome de Brugada ou chez ceux suspectés d'avoir le syndrome de Brugada.
Glaucome à angle fermé
La dilatation pupillaire qui survient suite à l'utilisation de nombreux antidépresseurs, dont Pamelor 25 mg, peut déclencher une attaque à angle fermé chez un patient aux angles anatomiquement étroits qui n'a pas subi d'iridectomie perméable.
Utilisation pendant la grossesse
L'utilisation sûre de Pamelor pendant la grossesse et l'allaitement n'a pas été établie ; par conséquent, lorsque le médicament est administré à des patientes enceintes, à des mères allaitantes ou à des femmes en âge de procréer, les avantages potentiels doivent être mis en balance avec les risques possibles. Les études sur la reproduction animale ont donné des résultats non concluants.
PRÉCAUTIONS
Informations pour les patients
Les prescripteurs ou autres professionnels de la santé doivent informer les patients, leurs familles et leurs soignants des avantages et des risques associés au traitement par le chlorhydrate de nortriptyline et doivent les conseiller sur son utilisation appropriée. Un patient Guide des médicaments à propos de « Médicaments antidépresseurs, dépression et autres maladies mentales graves, et pensées ou actions suicidaires » est disponible pour le chlorhydrate de nortriptyline. Le prescripteur ou le professionnel de la santé doit demander aux patients, à leurs familles et à leurs soignants de lire le Guide des médicaments et doit les aider à comprendre son contenu. Les patients doivent avoir la possibilité de discuter du contenu du Guide des médicaments et d'obtenir des réponses à leurs éventuelles questions. Le texte complet du Guide de Médication est réimprimé à la fin de ce document.
Les patients doivent être informés des problèmes suivants et invités à alerter leur médecin traitant si ceux-ci surviennent lors de la prise de chlorhydrate de nortriptyline.
Aggravation clinique et risque de suicide
Les patients, leurs familles et leurs soignants doivent être encouragés à être attentifs à l'émergence d'anxiété, d'agitation, d'attaques de panique, d'insomnie, d'irritabilité, d'hostilité, d'agressivité, d'impulsivité, d'akathisie (agitation psychomotrice), d'hypomanie, de manie, d'autres changements inhabituels de comportement , aggravation de la dépression et idées suicidaires, en particulier au début du traitement antidépresseur et lorsque la dose est ajustée à la hausse ou à la baisse. Il faut conseiller aux familles et aux soignants des patients de rechercher l'apparition de tels symptômes au jour le jour, car les changements peuvent être brusques. De tels symptômes doivent être signalés au médecin prescripteur ou au professionnel de la santé du patient, en particulier s'ils sont graves, d'apparition brutale ou ne font pas partie des symptômes présentés par le patient. De tels symptômes peuvent être associés à un risque accru de pensées et de comportements suicidaires et indiquent la nécessité d'une surveillance très étroite et éventuellement de modifications de la médication.
L'utilisation de Pamelor chez les patients schizophrènes peut entraîner une exacerbation de la psychose ou activer des symptômes schizophréniques latents. Si le médicament est administré à des patients hyperactifs ou agités, une anxiété et une agitation accrues peuvent survenir. Chez les patients maniaco-dépressifs, Pamelor peut provoquer l'apparition de symptômes de la phase maniaque.
L'hostilité gênante du patient peut être suscitée par l'utilisation de Pamelor. Des crises épileptiformes peuvent accompagner son administration, comme c'est le cas pour d'autres médicaments de sa classe.
Lorsqu'il est essentiel, le médicament peut être administré avec une thérapie électroconvulsive, bien que les risques puissent être accrus. Arrêtez le médicament pendant plusieurs jours, si possible, avant une intervention chirurgicale élective.
La possibilité d'une tentative de suicide par un patient déprimé demeure après le début du traitement; à cet égard, il est important que la plus petite quantité possible de médicament soit délivrée à un moment donné.
Des élévations et des baisses de la glycémie ont été rapportées.
Les patients doivent être informés que la prise de Pamelor 25 mg peut provoquer une légère dilatation pupillaire qui, chez les personnes sensibles, peut entraîner un épisode de glaucome à angle fermé. Le glaucome préexistant est presque toujours un glaucome à angle ouvert car le glaucome à angle fermé, lorsqu'il est diagnostiqué, peut être traité définitivement par iridectomie. Le glaucome à angle ouvert n'est pas un facteur de risque de glaucome à angle fermé. Les patients peuvent souhaiter être examinés pour déterminer s'ils sont sensibles à la fermeture de l'angle et subir une intervention prophylactique (p. ex., iridectomie), s'ils y sont sensibles.
Inhibiteurs de la monoamine oxydase (IMAO)
(Voir CONTRE-INDICATIONS , AVERTISSEMENTS , et DOSAGE ET ADMINISTRATION .)
Médicaments sérotoninergiques
(Voir CONTRE-INDICATIONS , AVERTISSEMENTS , et DOSAGE ET ADMINISTRATION .)
Utilisation pédiatrique
La sécurité et l'efficacité dans la population pédiatrique n'ont pas été établies (voir AVERTISSEMENT DE BOÎTE et AVERTISSEMENTS , aggravation clinique et risque suicidaire). Quiconque envisage l'utilisation du chlorhydrate de nortriptyline chez un enfant ou un adolescent doit équilibrer les risques potentiels avec le besoin clinique.
Utilisation gériatrique
Les études cliniques de Pamelor n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment des sujets plus jeunes. D'autres expériences cliniques rapportées indiquent que, comme avec d'autres antidépresseurs tricycliques, des événements indésirables hépatiques (caractérisés principalement par un ictère et une élévation des enzymes hépatiques) sont observés très rarement chez les patients gériatriques et des décès associés à des lésions hépatiques cholestatiques ont été rapportés dans des cas isolés. La fonction cardiovasculaire, en particulier les arythmies et les fluctuations de la pression artérielle, doit être surveillée. Des états confusionnels ont également été rapportés après l'administration d'antidépresseurs tricycliques chez les personnes âgées. Des concentrations plasmatiques plus élevées du métabolite actif de la nortriptyline, la 10-hydroxynortriptyline, ont également été rapportées chez des patients âgés. Comme pour les autres antidépresseurs tricycliques, le choix de la dose chez un patient âgé doit généralement être limité à la dose quotidienne totale efficace la plus faible (voir DOSAGE ET ADMINISTRATION ).
SURDOSAGE
Des décès peuvent survenir à la suite d'un surdosage avec cette classe de médicaments. L'ingestion de plusieurs médicaments (dont l'alcool) est fréquente en cas de surdosage délibéré d'antidépresseurs tricycliques. Comme la prise en charge est complexe et changeante, il est recommandé au médecin de contacter un centre antipoison pour obtenir des informations à jour sur le traitement. Les signes et symptômes de toxicité se développent rapidement après un surdosage d'antidépresseurs tricycliques, par conséquent, une surveillance hospitalière est requise dès que possible.
manifestations
Les manifestations critiques d'un surdosage incluent : troubles du rythme cardiaque, hypotension sévère, état de choc, insuffisance cardiaque congestive, œdème pulmonaire, convulsions et dépression du SNC, y compris le coma. Les modifications de l'électrocardiogramme, en particulier de l'axe ou de la largeur du QRS, sont des indicateurs cliniquement significatifs de la toxicité des antidépresseurs tricycliques.
D'autres signes de surdosage peuvent inclure : confusion, agitation, concentration perturbée, hallucinations visuelles transitoires, pupilles dilatées, agitation, réflexes hyperactifs, stupeur, somnolence, rigidité musculaire, vomissements, hypothermie, hyperpyrexie ou l'un des symptômes aigus énumérés sous EFFETS INDÉSIRABLES . Il y a eu des rapports de patients se remettant d'un surdosage de nortriptyline allant jusqu'à 525 mg.
La gestion
Général
Obtenir un ECG et commencer immédiatement la surveillance cardiaque. Protégez les voies respiratoires du patient, établissez une ligne intraveineuse et lancez la décontamination gastrique. Un minimum de six heures d'observation avec surveillance cardiaque et observation des signes de dépression du SNC ou respiratoire, d'hypotension, de troubles du rythme cardiaque et/ou de blocs de conduction et de convulsions est nécessaire. Si des signes de toxicité apparaissent à tout moment au cours de cette période, une surveillance prolongée est requise. Il existe des rapports de cas de patients succombant à des troubles du rythme mortels tard après un surdosage; ces patients présentaient des signes cliniques d'empoisonnement important avant le décès et la plupart ont reçu une décontamination gastro-intestinale inadéquate. La surveillance des concentrations plasmatiques du médicament ne doit pas guider la prise en charge du patient.
Décontamination gastro-intestinale
Tous les patients suspectés de surdosage d'antidépresseurs tricycliques doivent bénéficier d'une décontamination gastro-intestinale. Cela devrait inclure un lavage gastrique à grand volume suivi de charbon actif. Si la conscience est altérée, les voies respiratoires doivent être sécurisées avant le lavage. EMESIS EST CONTRE-INDIQUÉ.
Cardiovasculaire
Une durée maximale du QRS des dérivations des membres de ≥ 0,10 seconde peut être la meilleure indication de la gravité du surdosage. Le bicarbonate de sodium intraveineux doit être utilisé pour maintenir le pH sérique entre 7,45 et 7,55. Si la réponse du pH est inadéquate, l'hyperventilation peut également être utilisée. L'utilisation concomitante d'hyperventilation et de bicarbonate de sodium doit être effectuée avec une extrême prudence, avec une surveillance fréquente du pH. Un pH > 7,60 ou un pCO
SNC
Chez les patients souffrant de dépression du SNC, une intubation précoce est conseillée en raison du risque de détérioration brutale. Les convulsions doivent être contrôlées avec des benzodiazépines ou, si celles-ci sont inefficaces, avec d'autres anticonvulsivants (p. ex., phénobarbital, phénytoïne). La physostigmine n'est pas recommandée, sauf pour traiter les symptômes potentiellement mortels qui n'ont pas répondu aux autres traitements, et uniquement en consultation avec un centre antipoison.
Suivi psychiatrique
Étant donné que le surdosage est souvent délibéré, les patients peuvent tenter de se suicider par d'autres moyens pendant la phase de récupération. Une référence psychiatrique peut être appropriée.
Gestion pédiatrique
Les principes de prise en charge des surdosages chez l'enfant et chez l'adulte sont similaires. Il est fortement recommandé que le médecin contacte le centre antipoison local pour un traitement pédiatrique spécifique.
CONTRE-INDICATIONS
Inhibiteurs de la monoamine oxydase (IMAO)
L'utilisation des IMAO destinés au traitement des troubles psychiatriques avec Pamelor 25 mg ou dans les 14 jours suivant l'arrêt du traitement par Pamelor 25 mg est contre-indiquée en raison d'un risque accru de syndrome sérotoninergique. L'utilisation de Pamelor 25mg dans les 14 jours suivant l'arrêt d'un IMAO destiné à traiter les troubles psychiatriques est également contre-indiquée (voir AVERTISSEMENTS et DOSAGE ET ADMINISTRATION ).
Commencer Pamelor 25 mg chez un patient traité par des IMAO tels que le linézolide ou le bleu de méthylène par voie intraveineuse est également contre-indiqué en raison d'un risque accru de syndrome sérotoninergique (voir AVERTISSEMENTS et DOSAGE ET ADMINISTRATION ).
Hypersensibilité aux antidépresseurs tricycliques
Une sensibilité croisée entre Pamelor et d'autres dibenzazépines est une possibilité.
Infarctus du myocarde
Pamelor 25 mg est contre-indiqué pendant la période de récupération aiguë après un infarctus du myocarde.
PHARMACOLOGIE CLINIQUE
Le mécanisme d'élévation de l'humeur par les antidépresseurs tricycliques est actuellement inconnu. Pamelor 25 mg n'est pas un inhibiteur de la monoamine oxydase. Il inhibe l'activité d'agents aussi divers que l'histamine, la 5-hydroxytryptamine et l'acétylcholine. Il augmente l'effet presseur de la noradrénaline mais bloque la réponse pressive de la phénéthylamine. Des études suggèrent que Pamelor 25 mg interfère avec le transport, la libération et le stockage des catécholamines. Les techniques de conditionnement opérant chez les rats et les pigeons suggèrent que Pamelor a une combinaison de propriétés stimulantes et dépressives.
INFORMATIONS PATIENTS
Pamelor™ (chlorhydrate de nortriptyline) Capsules USP
Médicaments antidépresseurs, dépression et autres maladies mentales graves, et pensées ou actions suicidaires
Lisez le Guide des médicaments qui accompagne votre médicament antidépresseur ou celui d'un membre de votre famille. Ce guide de médication concerne uniquement le risque de pensées et d'actions suicidaires avec les médicaments antidépresseurs.
Parlez à votre fournisseur de soins de santé ou à celui d'un membre de votre famille de :
- tous les risques et avantages du traitement avec des antidépresseurs
- tous les choix de traitement pour la dépression ou d'autres maladies mentales graves
Quelles sont les informations les plus importantes que je devrais connaître sur les médicaments antidépresseurs, la dépression et autres maladies mentales graves, et les pensées ou actions suicidaires ?
- Portez une attention particulière à tout changement, en particulier les changements soudains, d'humeur, de comportement, de pensées ou de sentiments. Ceci est très important lorsqu'un médicament antidépresseur est commencé ou lorsque la dose est modifiée.
- Appelez immédiatement le fournisseur de soins de santé pour signaler des changements nouveaux ou soudains d'humeur, de comportement, de pensées ou de sentiments.
- Gardez toutes les visites de suivi avec le fournisseur de soins de santé comme prévu. Appelez le fournisseur de soins de santé entre les visites au besoin, surtout si vous avez des inquiétudes au sujet des symptômes.
Appelez immédiatement un fournisseur de soins de santé si vous ou un membre de votre famille présentez l'un des symptômes suivants, surtout s'ils sont nouveaux, s'aggravent ou vous inquiètent :
- pensées sur le suicide ou la mort
- tentatives de suicide
- dépression nouvelle ou pire
- anxiété nouvelle ou pire
- se sentir très agité ou agité
- crises de panique
- troubles du sommeil (insomnie)
- irritabilité nouvelle ou pire
- agir de manière agressive, être en colère ou violent
- agir sur des impulsions dangereuses
- une augmentation extrême de l'activité et de la conversation (manie)
- autres changements inhabituels de comportement ou d'humeur
Problèmes visuels
- douleur oculaire
- changements de vision
- gonflement ou rougeur dans ou autour de l'œil
Seules certaines personnes sont à risque pour ces problèmes. Vous voudrez peut-être subir un examen de la vue pour voir si vous êtes à risque et recevoir un traitement préventif si vous l'êtes.
Qui ne devrait pas prendre Pamelor ?
Ne prenez jamais Pamelor si vous :
- prendre un inhibiteur de la monoamine oxydase (IMAO). Demandez à votre fournisseur de soins de santé ou à votre pharmacien si vous n'êtes pas sûr de prendre un IMAO, y compris l'antibiotique linézolide.
- Ne prenez pas d'IMAO dans les 2 semaines suivant l'arrêt de Pamelor 25 mg, sauf indication contraire de votre médecin.
- Ne commencez pas Pamelor 25 mg si vous avez arrêté de prendre un IMAO au cours des 2 dernières semaines, sauf indication contraire de votre médecin.
Que dois-je savoir d'autre sur les médicaments antidépresseurs ?
- N'arrêtez jamais un médicament antidépresseur sans en parler d'abord à un fournisseur de soins de santé. L'arrêt soudain d'un médicament antidépresseur peut provoquer d'autres symptômes.
- Les antidépresseurs sont des médicaments utilisés pour traiter la dépression et d'autres maladies. Il est important de discuter de tous les risques de traiter la dépression et aussi des risques de ne pas la traiter. Les patients et leurs familles ou autres soignants doivent discuter de tous les choix de traitement avec le fournisseur de soins de santé, et pas seulement de l'utilisation d'antidépresseurs.
- Les antidépresseurs ont d'autres effets secondaires. Parlez au fournisseur de soins de santé des effets secondaires du médicament prescrit pour vous ou un membre de votre famille.
- Les médicaments antidépresseurs peuvent interagir avec d'autres médicaments. Connaissez tous les médicaments que vous ou un membre de votre famille prenez. Gardez une liste de tous les médicaments à montrer au professionnel de la santé. Ne commencez pas de nouveaux médicaments sans d'abord consulter votre fournisseur de soins de santé.
- Tous les médicaments antidépresseurs prescrits aux enfants ne sont pas approuvés par la FDA pour une utilisation chez les enfants. Parlez au fournisseur de soins de santé de votre enfant pour plus d'informations.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
