Cymbalta 20mg, 30mg, 40mg, 60mg Duloxetine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Cymbalta et comment est-il utilisé ?
Cymbalta est un médicament sur ordonnance utilisé pour traiter les symptômes du trouble dépressif majeur, de la douleur neuropathique périphérique diabétique, du trouble anxieux généralisé, de la fibromyalgie et des douleurs musculaires chroniques. Cymbalta peut être utilisé seul ou avec d'autres médicaments.
- Cymbalta appartient à une classe de médicaments appelés antidépresseurs, IRSN, agents de la fibromyalgie.
- On ne sait pas si Cymbalta est sûr et efficace chez les enfants de moins de 7 ans.
Quels sont les effets secondaires possibles de Cymbalta 20mg ?
Cymbalta peut provoquer des effets secondaires graves, notamment :
- battre des battements de cœur ou flotter dans votre poitrine,
- étourdissement,
- ecchymoses faciles,
- saignement inhabituel,
- changements de vision,
- miction douloureuse ou difficile,
- impuissance,
- problèmes sexuels,
- douleur dans le haut du ventre droit,
- démangeaison,
- urine foncée,
- jaunissement de la peau ou des yeux (jaunisse),
- mal de tête,
- confusion,
- troubles de l'élocution,
- grande faiblesse,
- vomissement,
- perte de coordination,
- se sentir instable,
- pensées de course,
- augmentation de l'énergie,
- comportement imprudent,
- se sentir extrêmement heureux ou irritable,
- parler plus que d'habitude, et
- graves problèmes de sommeil
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Cymbalta comprennent :
- somnolence,
- nausée,
- constipation,
- perte d'appétit,
- bouche sèche et
- augmentation de la transpiration
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Cymbalta. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
PENSÉES ET COMPORTEMENTS SUICIDAIRES
Les antidépresseurs ont augmenté le risque de pensées et de comportements suicidaires chez les enfants, les adolescents et les jeunes adultes dans les études à court terme. Ces études n'ont pas montré d'augmentation du risque de pensées et de comportements suicidaires avec l'utilisation d'antidépresseurs chez les patients de plus de 24 ans ; il y avait une réduction du risque avec l'utilisation d'antidépresseurs chez les patients âgés de 65 ans et plus [voir AVERTISSEMENTS ET PRECAUTIONS ].
Chez les patients de tous âges qui ont commencé un traitement antidépresseur, surveiller de près l'aggravation et l'apparition de pensées et de comportements suicidaires. Informez les familles et les soignants de la nécessité d'une observation étroite et d'une communication avec le prescripteur [voir AVERTISSEMENTS ET PRECAUTIONS ].
LA DESCRIPTION
CYMBALTA® (capsules à libération retardée de duloxétine) est un inhibiteur sélectif du recaptage de la sérotonine et de la noradrénaline (SSNRI) pour administration orale. Sa désignation chimique est le chlorhydrate de (+)-(S)-N-méthyl-γ-(1-naphtyloxy)-2-thiophènepropylamine. La formule empirique est C18H19NOS•HCl, ce qui correspond à un poids moléculaire de 333,88. La formule structurale est :
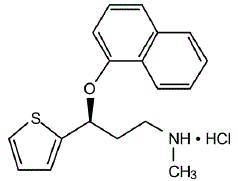
Le chlorhydrate de duloxétine est un solide blanc à blanc légèrement brunâtre, légèrement soluble dans l'eau.
Chaque gélule contient des granules entérosolubles de 22,4, 33,7 ou 67,3 mg de chlorhydrate de duloxétine équivalant à 20, 30 ou 60 mg de duloxétine, respectivement. Ces pastilles à enrobage entérique sont conçues pour empêcher la dégradation du médicament dans l'environnement acide de l'estomac. Les ingrédients inactifs comprennent FD&C Blue No. 2, la gélatine, l'hypromellose, le succinate d'acétate d'hydroxypropylméthylcellulose, le laurylsulfate de sodium, le saccharose, les sphères de sucre, le talc, le dioxyde de titane et le citrate de triéthyle. Les gélules de 20 et 60 mg contiennent également de l'oxyde de fer jaune.
LES INDICATIONS
CYMBALTA® est indiqué pour le traitement de :
- Trouble dépressif majeur chez l'adulte
- Trouble anxieux généralisé chez les adultes et les patients pédiatriques de 7 ans et plus
- Douleur neuropathique périphérique diabétique chez l'adulte
- Fibromyalgie chez les adultes et les patients pédiatriques de 13 ans et plus
- douleurs musculo-squelettiques chroniques chez l'adulte
DOSAGE ET ADMINISTRATION
Instructions d'administration importantes
Administrez CYMBALTA par voie orale (avec ou sans repas) et avalez-le entier. Ne mâchez pas ou n'écrasez pas et n'ouvrez pas la gélule à libération retardée et ne saupoudrez pas son contenu sur des aliments ou ne mélangez pas avec des liquides car ces actions pourraient affecter l'enrobage entérique. Si une dose de CYMBALTA 20 mg est oubliée, prenez la dose oubliée dès que vous vous en souvenez. S'il est presque l'heure de la dose suivante, sautez la dose oubliée et prenez la dose suivante à l'heure habituelle. Ne prenez pas deux doses de CYMBALTA 60 mg en même temps.
Posologie pour le traitement du trouble dépressif majeur chez les adultes
La posologie initiale recommandée chez les adultes atteints de TDM est de 40 mg/jour (administré à raison de 20 mg deux fois par jour) à 60 mg/jour (administré soit une fois par jour, soit à raison de 30 mg deux fois par jour). Pour certains patients, il peut être souhaitable de commencer à 30 mg une fois par jour pendant 1 semaine, pour permettre aux patients de s'adapter à CYMBALTA 30 mg avant d'augmenter à 60 mg une fois par jour. Alors qu'une dose de 120 mg/jour s'est avérée efficace, rien ne prouve que des doses supérieures à 60 mg/jour confèrent des avantages supplémentaires. Réévaluer périodiquement pour déterminer la nécessité d'un traitement d'entretien et la posologie appropriée pour un tel traitement.
Posologie pour le traitement du trouble d'anxiété généralisée
Posologie recommandée chez les adultes de moins de 65 ans
Pour la plupart des adultes de moins de 65 ans atteints de TAG, initiez CYMBALTA à 60 mg une fois par jour. Pour certains patients, il peut être souhaitable de commencer à 30 mg une fois par jour pendant 1 semaine, pour permettre aux patients de s'adapter à CYMBALTA 40 mg avant d'augmenter à 60 mg une fois par jour. Alors qu'une dose de 120 mg une fois par jour s'est avérée efficace, il n'y a aucune preuve que des doses supérieures à 60 mg/jour confèrent un bénéfice supplémentaire. Néanmoins, s'il est décidé d'augmenter la posologie au-delà de 60 mg une fois par jour, augmenter la posologie par paliers de 30 mg une fois par jour. Réévaluer périodiquement pour déterminer le besoin continu d'un traitement d'entretien et la posologie appropriée pour un tel traitement.
Posologie recommandée chez les patients gériatriques
Chez les patients gériatriques atteints de TAG, initier CYMBALTA à la dose de 30 mg une fois par jour pendant 2 semaines avant d'envisager une augmentation à la dose cible de 60 mg/jour. Par la suite, les patients peuvent bénéficier de doses supérieures à 60 mg une fois par jour. Si une décision est prise d'augmenter la dose au-delà de 60 mg une fois par jour, augmenter la dose par paliers de 30 mg une fois par jour. La dose maximale étudiée était de 120 mg par jour.
Posologie recommandée chez les patients pédiatriques de 7 à 17 ans
Initier CYMBALTA 30 mg chez les patients pédiatriques de 7 à 17 ans atteints de TAG à une posologie de 30 mg une fois par jour pendant 2 semaines avant d'envisager une augmentation à 60 mg une fois par jour. La gamme posologique recommandée est de 30 à 60 mg une fois par jour. Certains patients peuvent bénéficier de doses supérieures à 60 mg une fois par jour. Si une décision est prise d'augmenter la dose au-delà de 60 mg une fois par jour, augmenter la dose par paliers de 30 mg une fois par jour. La dose maximale étudiée était de 120 mg par jour.
Posologie pour le traitement de la douleur neuropathique périphérique diabétique chez les adultes
Administrer 60 mg une fois par jour chez les adultes souffrant de douleurs neuropathiques périphériques diabétiques. Il n'y a aucune preuve que des doses supérieures à 60 mg une fois par jour confèrent un bénéfice significatif supplémentaire et la dose plus élevée est clairement moins bien tolérée. Pour les patients pour lesquels la tolérance est une préoccupation, une dose initiale plus faible peut être envisagée.
Étant donné que le diabète est souvent compliqué par une maladie rénale, envisager une posologie initiale plus faible et une augmentation progressive de la posologie chez les patients insuffisants rénaux [voir Posologie chez les patients insuffisants hépatiques ou insuffisants rénaux sévères et Utilisation dans des populations spécifiques ].
Posologie pour le traitement de la fibromyalgie
Posologie recommandée chez les adultes
La posologie recommandée de CYMBALTA est de 60 mg une fois par jour chez les adultes atteints de fibromyalgie. Commencer le traitement à 30 mg une fois par jour pendant 1 semaine, pour permettre aux patients de s'adapter à CYMBALTA 20 mg avant d'augmenter à 60 mg une fois par jour. Certains patients peuvent répondre à la dose initiale. Il n'y a aucune preuve que des doses supérieures à 60 mg/jour confèrent un bénéfice supplémentaire, même chez les patients qui ne répondent pas à une dose de 60 mg/jour, et des doses plus élevées ont été associées à un taux plus élevé d'effets indésirables.
Posologie recommandée chez les patients pédiatriques de 13 à 17 ans
La posologie initiale recommandée de CYMBALTA à 60 mg chez les patients pédiatriques âgés de 13 à 17 ans atteints de fibromyalgie est de 30 mg une fois par jour. La posologie peut être augmentée à 60 mg une fois par jour en fonction de la réponse et de la tolérance.
Posologie pour le traitement de la douleur musculo-squelettique chronique chez l'adulte
La posologie recommandée de CYMBALTA est de 60 mg une fois par jour chez les adultes souffrant de douleurs musculo-squelettiques chroniques. Commencer le traitement à 30 mg une fois par jour pendant une semaine, pour permettre aux patients de s'adapter à CYMBALTA avant d'augmenter à 60 mg une fois par jour. Il n'y a aucune preuve que des doses plus élevées confèrent un bénéfice supplémentaire, même chez les patients qui ne répondent pas à une dose de 60 mg une fois par jour, et des doses plus élevées sont associées à un taux plus élevé d'effets indésirables [voir Etudes cliniques ].
Posologie chez les patients insuffisants hépatiques ou insuffisants rénaux sévères
Éviter l'utilisation chez les patients atteints d'une maladie hépatique chronique ou d'une cirrhose [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Éviter l'utilisation chez les patients présentant une insuffisance rénale sévère, DFG AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Arrêt de CYMBALTA
Les effets indésirables après l'arrêt de CYMBALTA, après un arrêt brutal ou progressif, comprennent : étourdissements, maux de tête, nausées, diarrhée, paresthésie, irritabilité, vomissements, insomnie, anxiété, hyperhidrose et fatigue. Une réduction progressive de la posologie plutôt qu'un arrêt brutal est recommandée dans la mesure du possible [voir AVERTISSEMENTS ET PRECAUTIONS ].
Passage d'un patient à ou à partir d'un inhibiteur de la monoamine oxydase (IMAO) destiné à traiter les troubles psychiatriques
Au moins 14 jours doivent s'écouler entre l'arrêt d'un IMAO destiné à traiter les troubles psychiatriques et le début du traitement par CYMBALTA. A l'inverse, il faut attendre au moins 5 jours après l'arrêt de CYMBALTA 60mg avant de débuter un IMAO destiné à traiter les troubles psychiatriques [voir CONTRE-INDICATIONS ].
Utilisation de CYMBALTA avec d'autres IMAO tels que le linézolide ou le bleu de méthylène
Ne pas commencer CYMBALTA chez un patient qui est traité avec du linézolide ou du bleu de méthylène par voie intraveineuse car il existe un risque accru de syndrome sérotoninergique. Chez un patient qui nécessite un traitement plus urgent d'une affection psychiatrique, d'autres interventions, y compris l'hospitalisation, doivent être envisagées [voir CONTRE-INDICATIONS ].
Dans certains cas, un patient recevant déjà un traitement par CYMBALTA peut nécessiter un traitement urgent avec du linézolide ou du bleu de méthylène par voie intraveineuse. Si des alternatives acceptables au traitement par le linézolide ou le bleu de méthylène par voie intraveineuse ne sont pas disponibles et que les avantages potentiels du traitement par le linézolide ou le bleu de méthylène par voie intraveineuse sont jugés supérieurs aux risques de syndrome sérotoninergique chez un patient particulier, CYMBALTA doit être arrêté rapidement et le linézolide ou le bleu de méthylène par voie intraveineuse peut être administré. Le patient doit être surveillé pour des symptômes de syndrome sérotoninergique pendant 5 jours ou jusqu'à 24 heures après la dernière dose de linézolide ou de bleu de méthylène par voie intraveineuse, selon la première éventualité. Le traitement par CYMBALTA peut être repris 24 heures après la dernière dose de linézolide ou de bleu de méthylène par voie intraveineuse [voir AVERTISSEMENTS ET PRECAUTIONS ].
Le risque d'administration de bleu de méthylène par des voies non intraveineuses (telles que des comprimés oraux ou par injection locale) ou à des doses intraveineuses bien inférieures à 1 mg/kg avec CYMBALTA n'est pas clair. Le clinicien doit néanmoins être conscient de la possibilité d'apparition de symptômes de syndrome sérotoninergique lors d'une telle utilisation [voir AVERTISSEMENTS ET PRECAUTIONS ].
COMMENT FOURNIE
Formes posologiques et points forts
CYMBALTA est disponible sous forme de gélules à libération retardée :
- Gélules vertes opaques de 20 mg portant l'inscription « Lilly 3235 20 mg »
- Gélules opaques blanches et bleues de 30 mg portant l'inscription « Lilly 3240 30 mg »
- Gélules vertes et bleues opaques de 60 mg portant l'inscription « Lilly 3270 60 mg »
CYMBALTA (capsules à libération retardée de duloxétine) est disponible dans les forces, couleurs, impressions et présentations suivantes :
Stockage et manutention
Conserver à 25 °C (77 °F); les excursions permises à 15-30°C (59-86°F) [voient USP la Température de Pièce Contrôlée].
Commercialisé par : Lilly USA, LLC Indianapolis, IN 46285, États-Unis. Révisé : juillet 2021
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont décrits ci-dessous et ailleurs dans l'étiquetage :
- Pensées et comportements suicidaires chez les enfants, les adolescents et les jeunes adultes [voir AVERTISSEMENT DE BOÎTE et AVERTISSEMENTS ET PRECAUTIONS ]
- Hépatotoxicité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypotension orthostatique, chutes et syncope [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Syndrome sérotoninergique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Risque accru de saignement [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions cutanées sévères [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Syndrome d'arrêt [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Activation de la manie/hypomanie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Glaucome à angle fermé [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Saisies [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Augmentation de la tension artérielle [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Interactions médicamenteuses cliniquement importantes [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hyponatrémie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hésitation et rétention urinaires [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Dysfonction sexuelle [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Les fréquences indiquées des effets indésirables représentent la proportion de patients qui ont présenté, au moins une fois, un effet indésirable lié au traitement du type indiqué. Une réaction était considérée comme émergeant du traitement si elle survenait pour la première fois ou s'aggravait pendant le traitement après l'évaluation initiale.
Effets indésirables chez les adultes
Base de données des essais cliniques pour adultes
Les données décrites ci-dessous reflètent l'exposition à CYMBALTA dans des essais contrôlés par placebo chez l'adulte pour le TDM (N = 3779), le TAG (N = 1018), l'OA (N = 503), le CLBP (N = 600), le DPNP (N = 906), et FM (N=1294). La tranche d'âge de cette population regroupée était de 17 à 89 ans. Dans cette population regroupée, 66 %, 61 %, 61 %, 43 % et 94 % des patients adultes étaient des femmes ; et 82 %, 73 %, 85 %, 74 % et 86 % des patients adultes étaient de race blanche dans les populations MDD, GAD, OA et CLBP, DPNP et FM, respectivement. La plupart des patients ont reçu des doses de CYMBALTA d'un total de 60 à 120 mg par jour [voir Etudes cliniques ]. Les données ci-dessous n'incluent pas les résultats de l'essai ayant évalué l'efficacité de CYMBALTA 30 mg pour le traitement du TAG chez les patients ≥ 65 ans (Étude GAD-5) [voir Etudes cliniques ] ; cependant, les effets indésirables observés dans cette population gériatrique étaient généralement similaires aux effets indésirables observés dans l'ensemble de la population adulte.
Effets indésirables entraînant l'arrêt du traitement dans les essais contrôlés par placebo chez l'adulte
Trouble dépressif majeur
Environ 8,4 % (319/3 779) des patients traités par CYMBALTA dans les essais contrôlés par placebo chez l'adulte pour le TDM ont interrompu le traitement en raison d'un effet indésirable, comparativement à 4,6 % (117/2 536) des patients traités par placebo. Les nausées (CYMBALTA 1,1 %, placebo 0,4 %) étaient le seul effet indésirable signalé comme motif d'arrêt et considéré comme lié au médicament (c'est-à-dire, arrêt survenu chez au moins 1 % des patients traités par CYMBALTA et à un moins deux fois celle des patients traités par placebo).
Désordre anxieux généralisé
Environ 13,7 % (139/1018) des patients traités par CYMBALTA dans les essais contrôlés par placebo chez l'adulte pour le TAG ont interrompu le traitement en raison d'un effet indésirable, comparativement à 5 % (38/767) des patients traités par placebo. Les effets indésirables courants rapportés comme motif d'arrêt et considérés comme liés au médicament (tel que défini ci-dessus) comprenaient les nausées (CYMBALTA 3,3 %, placebo 0,4 %) et les étourdissements (CYMBALTA 1,3 %, placebo 0,4 %).
Douleur neuropathique périphérique diabétique
Environ 12,9 % (117/906) des patients traités par CYMBALTA dans les essais contrôlés par placebo chez l'adulte pour le DPNP ont interrompu le traitement en raison d'un effet indésirable, contre 5,1 % (23/448) des patients traités par placebo. Les effets indésirables courants signalés comme motif d'arrêt du traitement et considérés comme liés au médicament (tel que défini ci-dessus) comprenaient les nausées (CYMBALTA 3,5 %, placebo 0,7 %), les étourdissements (CYMBALTA 1,2 %, placebo 0,4 %) et la somnolence (CYMBALTA 1,1 % , placebo 0 %).
Fibromyalgie
Environ 17,5 % (227/1294) des patients traités par CYMBALTA dans des essais contrôlés par placebo de 3 à 6 mois chez l'adulte pour la fibromyalgie ont interrompu le traitement en raison d'un effet indésirable, contre 10,1 % (96/955) pour les patients traités par placebo . Les effets indésirables rapportés comme motif d'arrêt et considérés comme liés au médicament (tel que défini ci-dessus) comprenaient les nausées (CYMBALTA 2,0 %, placebo 0,5 %), les maux de tête (CYMBALTA 1,2 %, placebo 0,3 %), la somnolence (CYMBALTA 1,1 %, placebo 0 %) et fatigue (CYMBALTA 1,1 %, placebo 0,1 %).
Douleur chronique due à l'arthrose
Environ 15,7 % (79/503) des patients traités par CYMBALTA dans les essais contrôlés par placebo de 13 semaines chez l'adulte pour la douleur chronique due à l'arthrose ont interrompu le traitement en raison d'un effet indésirable, contre 7,3 % (37/508) pour les patients sous placebo. malades traités. Les effets indésirables rapportés comme motif d'arrêt et considérés comme liés au médicament (tel que défini ci-dessus) comprenaient des nausées (CYMBALTA 2,2 %, placebo 1 %).
Lombalgie chronique
Environ 16,5 % (99/600) des patients traités par CYMBALTA au cours d'essais adultes de 13 semaines contrôlés par placebo sur la CLBP ont interrompu le traitement en raison d'un effet indésirable, contre 6,3 % (28/441) des patients traités par placebo. Les effets indésirables rapportés comme motif d'arrêt et considérés comme liés au médicament (tel que défini ci-dessus) comprenaient les nausées (CYMBALTA 3 %, placebo 0,7 %) et la somnolence (CYMBALTA 1 %, placebo 0 %).
Effets indésirables les plus fréquents dans les essais chez l'adulte
Les effets indésirables les plus fréquemment observés chez les patients traités par CYMBALTA (tels que définis ci-dessus) étaient :
- Douleur neuropathique périphérique diabétique : nausées, somnolence, diminution de l'appétit, constipation, hyperhidrose et bouche sèche.
- Fibromyalgie : nausées, bouche sèche, constipation, somnolence, diminution de l'appétit, hyperhidrose et agitation.
- Douleur chronique due à l'arthrose : nausées, fatigue, constipation, bouche sèche, insomnie, somnolence et étourdissements.
- Lombalgie chronique : nausées, bouche sèche, insomnie, somnolence, constipation, étourdissements et fatigue.
Les effets indésirables les plus fréquemment observés chez les patients traités par CYMBALTA dans toutes les populations adultes regroupées (c.-à-d. TDM, TAG, DPNP, FM, OA et CLBP) (incidence d'au moins 5 % et au moins deux fois l'incidence chez les patients traités par placebo patients) étaient les nausées, la bouche sèche, la somnolence, la constipation, la diminution de l'appétit et l'hyperhidrose.
Le tableau 2 présente l'incidence des effets indésirables dans les essais contrôlés par placebo pour les populations adultes approuvées (c'est-à-dire TDM, TAG, DPNP, FM, OA et CLBP) qui se sont produits chez 5 % ou plus des patients traités par CYMBALTA et avec une incidence supérieure que les patients traités par placebo.
Effets indésirables dans les essais MDD et GAD regroupés chez les adultes
Le tableau 3 présente l'incidence des effets indésirables dans les essais contrôlés par placebo sur les adultes atteints de TDM et de TAG qui sont survenus chez 2 % ou plus des patients traités par CYMBALTA et avec une incidence supérieure à celle des patients traités par placebo.
Effets indésirables dans les essais DPNP, FM, OA et CLBP pour adultes
Le tableau 4 présente l'incidence des effets indésirables survenus chez 2 % ou plus des patients traités par CYMBALTA (déterminé avant l'arrondissement) au cours de la phase aiguë de précommercialisation des essais contrôlés par placebo sur le DPNP, la fibromyalgie, l'arthrose et la CLBP et avec une incidence supérieure que les patients traités par placebo.
Effets sur la fonction sexuelle masculine et féminine chez les adultes atteints de TDM
Les modifications du désir sexuel, des performances sexuelles et de la satisfaction sexuelle surviennent souvent comme des manifestations de troubles psychiatriques ou de diabète, mais elles peuvent également être la conséquence d'un traitement pharmacologique. Étant donné que les réactions sexuelles indésirables sont présumées être volontairement sous-déclarées, l'échelle d'expérience sexuelle de l'Arizona (ASEX), une mesure validée conçue pour identifier les réactions sexuelles indésirables, a été utilisée de manière prospective dans 4 essais contrôlés par placebo sur le MDD chez l'adulte (études MDD-1, MDD-2 , MDD-3 et MDD-4) [voir Etudes cliniques ]. L'échelle ASEX comprend cinq questions qui se rapportent aux aspects suivants de la fonction sexuelle : 1) libido, 2) facilité d'excitation, 3) capacité à obtenir une érection (hommes) ou une lubrification (femmes), 4) facilité à atteindre l'orgasme, et 5) satisfaction de l'orgasme. Les nombres positifs signifient une aggravation de la fonction sexuelle par rapport au départ. Les nombres négatifs signifient une amélioration par rapport à un niveau de dysfonctionnement de base, ce qui est couramment observé chez les patients déprimés.
Dans ces essais, les patients masculins traités par CYMBALTA ont présenté significativement plus de dysfonction sexuelle, telle que mesurée par le score total à l'ASEX et la capacité à atteindre l'orgasme, que les patients masculins traités par placebo (voir ). Les patientes traitées par CYMBALTA n'ont pas présenté plus de dysfonctionnement sexuel que les patientes traitées par placebo, tel que mesuré par le score total ASEX. Les prestataires de soins de santé doivent régulièrement se renseigner sur les effets indésirables sexuels possibles chez les patients traités par CYMBALTA.
Modifications des signes vitaux chez les adultes
Dans des essais cliniques contrôlés par placebo menés auprès de populations adultes approuvées pour le changement entre le début et le point final, les patients traités par CYMBALTA ont présenté des augmentations moyennes de 0,23 mm Hg de la pression artérielle systolique (PAS) et de 0,73 mm Hg de la pression artérielle diastolique (PAD) par rapport aux diminutions moyennes de 1,09 mm Hg dans la PAS et de 0,55 mm Hg dans la PAD chez les patients traités par placebo. Il n'y avait pas de différence significative dans la fréquence de l'hypertension artérielle soutenue (3 visites consécutives) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Le traitement par CYMBALTA à 20 mg, pendant jusqu'à 26 semaines dans le cadre d'essais contrôlés par placebo dans des populations adultes approuvées, a généralement entraîné une légère augmentation de la fréquence cardiaque pour le changement entre le début et le point final par rapport au placebo jusqu'à 1,37 battements par minute (augmentation de 1,20 battements par minute chez les patients traités par CYMBALTA, diminution de 0,17 battements par minute chez les patients traités par placebo).
Changements de laboratoire chez les adultes
Le traitement par CYMBALTA dans des essais cliniques contrôlés par placebo menés auprès de populations adultes approuvées a été associé à de faibles augmentations moyennes entre le début de l'étude et le critère d'évaluation des taux d'ALT, d'AST, de CPK et de phosphatase alcaline ; des valeurs peu fréquentes, modestes, transitoires et anormales ont été observées pour ces analytes chez les patients traités par CYMBALTA par rapport aux patients traités par placebo [voir AVERTISSEMENTS ET PRECAUTIONS ]. Des taux élevés de bicarbonate, de cholestérol et un taux de potassium anormal (élevé ou faible) ont été observés plus fréquemment chez les patients traités par CYMBALTA que chez les patients traités par placebo.
Autres effets indésirables observés au cours de l'évaluation de l'essai clinique de CYMBALTA chez l'adulte
Voici une liste des effets indésirables signalés par des patients traités par CYMBALTA à 40 mg lors d'essais cliniques chez l'adulte. Dans les essais cliniques de toutes les populations adultes approuvées, 34 756 patients ont été traités par CYMBALTA. Parmi ceux-ci, 27 % (9 337) ont pris CYMBALTA 60 mg pendant au moins 6 mois et 12 % (4 317) ont pris CYMBALTA pendant au moins un an. La liste suivante ne vise pas à inclure les réactions (1) déjà répertoriées dans les tableaux précédents ou ailleurs dans l'étiquetage, (2) pour lesquelles une cause médicamenteuse était éloignée, (3) qui étaient si générales qu'elles n'étaient pas informatives, (4) qui étaient n'est pas considéré comme ayant des implications cliniques significatives, ou (5) qui s'est produit à un taux égal ou inférieur au placebo.
Les réactions sont classées par système corporel selon les définitions suivantes : les réactions indésirables fréquentes sont celles qui surviennent chez au moins 1 patient sur 100 ; les effets indésirables peu fréquents sont ceux qui surviennent chez 1/100 à 1/1000 patients ; les réactions rares sont celles qui surviennent chez moins de 1/1000 patients.
- Troubles cardiaques - Fréquents : palpitations ; Peu fréquents : infarctus du myocarde, tachycardie et cardiomyopathie de Takotsubo.
- Troubles de l'oreille et du labyrinthe - Fréquent : vertiges ; Peu fréquents : douleurs aux oreilles et acouphènes.
- Troubles endocriniens - Peu fréquent : hypothyroïdie.
- Troubles oculaires - Fréquent : vision floue ; Peu fréquents : diplopie, sécheresse oculaire et déficience visuelle.
- Problèmes gastro-intestinaux - Fréquents : flatulences ; Peu fréquents : dysphagie, éructation, gastrite, hémorragie gastro-intestinale, mauvaise haleine et stomatite ; Rare : ulcère gastrique.
- Troubles généraux et conditions au site d'administration - Fréquent : frissons/frissons ; Peu fréquents : chutes, sensation anormale, sensation de chaud et/ou de froid, malaise et soif ; Rare : troubles de la marche.
- Infections et infestations - Peu fréquents : gastro-entérite et laryngite.
- Enquêtes Fréquent : prise de poids, perte de poids ; Peu fréquent : augmentation du cholestérol sanguin.
- Troubles du métabolisme et de la nutrition - Peu fréquents : déshydratation et hyperlipidémie ; Rare : dyslipidémie.
- Troubles musculosquelettiques et du tissu conjonctif - Fréquents : douleurs musculo-squelettiques ; Peu fréquents : raideur musculaire et contractions musculaires.
- Troubles du système nerveux - Fréquent : dysgueusie, léthargie et paresthésie/hypoesthésie ; Peu fréquents : troubles de l'attention, dyskinésie, myoclonie et sommeil de mauvaise qualité ; Rare : dysarthrie.
- Troubles psychiatriques - Fréquents : rêves anormaux et troubles du sommeil ; Peu fréquents : apathie, bruxisme, désorientation/état confusionnel, irritabilité, sautes d'humeur et tentative de suicide ; Rare : suicide réussi.
- Troubles rénaux et urinaires - Fréquent : fréquence urinaire ; Peu fréquents : dysurie, urgence mictionnelle, nycturie, polyurie et odeur d'urine anormale.
- Système reproducteur et troubles mammaires - Fréquent : anorgasmie/orgasme anormal ; Peu fréquents : symptômes de la ménopause, dysfonctionnement sexuel et douleur testiculaire ; Rare : troubles menstruels.
- Troubles respiratoires, thoraciques et médiastinaux Fréquents : bâillements, douleurs oropharyngées ; Peu fréquent : serrement de gorge.
- Troubles de la peau et du tissu sous-cutané - Fréquent : prurit ; Peu fréquents : sueurs froides, dermatite de contact, érythème, tendance accrue aux ecchymoses, sueurs nocturnes et réaction de photosensibilité ; Rare : ecchymoses.
- Troubles vasculaires - Fréquent : bouffées de chaleur ; Peu fréquents : bouffées vasomotrices, hypotension orthostatique et froideur périphérique.
Effets indésirables observés lors d'essais cliniques contrôlés par placebo chez des patients pédiatriques
Base de données des essais cliniques pédiatriques
Les données décrites ci-dessous reflètent l'exposition à CYMBALTA (N = 567) chez des patients pédiatriques âgés de 7 à 18 ans issus de deux essais contrôlés par placebo de 10 semaines chez des patients atteints de TDM (N = 341) (études MDD-6 et MDD- 7), un essai contrôlé par placebo de 10 semaines sur le TAG (N = 135) (étude GAD-6) et un essai de 13 semaines sur la fibromyalgie (N = 91). CYMBALTA 60 mg n'est pas approuvé pour le traitement du TDM chez les patients pédiatriques [voir Utilisation dans des populations spécifiques ]. Parmi les patients traités par CYMBALTA dans ces études, 36 % étaient âgés de 7 à 11 ans (64 % étaient âgés de 12 à 18 ans), 55 % étaient des femmes et 69 % étaient de race blanche. Les patients ont reçu 30 à 120 mg de CYMBALTA par jour au cours des études de traitement aigu contrôlées par placebo. Dans les essais pédiatriques sur le TDM, le TAG et la fibromyalgie d'une durée allant jusqu'à 40 semaines, il y avait 988 patients pédiatriques traités par CYMBALTA âgés de 7 à 17 ans (la plupart des patients recevaient 30 à 120 mg par jour) - 35 % étaient âgés de 7 à 11 ans d'âge (65 % avaient entre 12 et 17 ans) et 56 % étaient des femmes.
Effets indésirables les plus fréquents dans les essais pédiatriques
Les effets indésirables les plus fréquents (≥ 5 % chez les patients traités par CYMBALTA et au moins le double de l'incidence des patients traités par placebo) dans toutes les populations pédiatriques regroupées (TDM, TAG et fibromyalgie) étaient une perte de poids, une diminution de l'appétit, des nausées, des vomissements, fatigue et diarrhée.
Effets indésirables chez les patients pédiatriques âgés de 7 à 17 ans atteints de TDM et de TAG
Le profil des effets indésirables observé dans les essais cliniques chez les patients pédiatriques âgés de 7 à 18 ans atteints de TDM et de TAG était cohérent avec le profil des effets indésirables observé dans les essais cliniques chez l'adulte. Les effets indésirables les plus courants (≥ 5 % et deux fois le placebo) observés dans ces essais cliniques pédiatriques comprenaient : nausées, diarrhée, perte de poids et étourdissements.
Le tableau 6 présente l'incidence des effets indésirables dans les essais pédiatriques contrôlés par placebo sur le TDM et le TAG qui se sont produits chez plus de 2 % des patients traités par CYMBALTA et avec une incidence supérieure à celle des patients traités par placebo. CYMBALTA n'est pas approuvé dans le traitement du TDM chez les patients pédiatriques [voir Utilisation dans des populations spécifiques ].
D'autres effets indésirables survenus à une incidence inférieure à 2 % et signalés par plus de patients traités par CYMBALTA que de patients traités par placebo dans les essais cliniques pédiatriques sur le TDM et le TAG comprenaient : des rêves anormaux (y compris des cauchemars), de l'anxiété, des bouffées vasomotrices (y compris des bouffées de chaleur ), hyperhidrose, palpitations, augmentation du pouls et tremblements (CYMBALTA 20 mg n'est pas approuvé pour le traitement des patients pédiatriques atteints de TDM).
Les symptômes les plus fréquemment signalés après l'arrêt de CYMBALTA à 30 mg dans les essais cliniques pédiatriques sur le TDM et le TAG comprenaient des maux de tête, des étourdissements, de l'insomnie et des douleurs abdominales [voir AVERTISSEMENTS ET PRECAUTIONS ].
Croissance (taille et poids) chez les patients pédiatriques de 7 à 17 ans atteints de TAG et de TDM
Une diminution de l'appétit et une perte de poids ont été observées en association avec l'utilisation d'ISRS et d'IRSN. Les patients pédiatriques traités par CYMBALTA dans les essais cliniques ont présenté une perte de poids moyenne de 0,1 kg à 10 semaines, comparativement à un gain de poids moyen d'environ 0,9 kg chez les patients pédiatriques traités par placebo. La proportion de patients ayant subi une perte de poids cliniquement significative (≥ 3,5 %) était plus élevée dans le groupe CYMBALTA que dans le groupe placebo (16 % et 6 %, respectivement). Par la suite, au cours des périodes d'extension non contrôlées de 4 à 6 mois, les patients traités par CYMBALTA ont eu tendance en moyenne à récupérer leur centile de poids de base attendu sur la base des données de population de pairs appariés selon l'âge et le sexe.
Dans les études jusqu'à 9 mois, les patients pédiatriques traités par CYMBALTA ont présenté une augmentation de taille de 1,7 cm en moyenne (augmentation de 2,2 cm chez les patients âgés de 7 à 11 ans et augmentation de 1,3 cm chez les patients âgés de 12 à 17 ans). Bien qu'une augmentation de la taille ait été observée au cours de ces études, une diminution moyenne de 1 % du percentile de la taille a été observée (diminution de 2 % chez les patients âgés de 7 à 11 ans et augmentation de 0,3 % chez les patients âgés de 12 à 17 ans). Le poids et la taille doivent être surveillés régulièrement chez les patients pédiatriques traités par CYMBALTA [voir Utilisation dans des populations spécifiques ].
Effets indésirables chez les patients pédiatriques âgés de 13 à 17 ans atteints de fibromyalgie
Le tableau 7 présente l'incidence des effets indésirables dans un essai pédiatrique contrôlé par placebo sur la fibromyalgie (étude FM-4) survenus chez plus de 5 % des patients traités par CYMBALTA à 30 mg et avec une incidence supérieure à celle des patients traités par placebo [voir Etudes cliniques ].
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de CYMBALTA. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Les effets indésirables signalés depuis la mise sur le marché qui étaient temporairement liés au traitement par CYMBALTA à 40 mg et non mentionnés ailleurs dans l'étiquetage comprennent : pancréatite aiguë, réaction anaphylactique, agressivité et colère (en particulier au début du traitement ou après l'arrêt du traitement), œdème de Quincke, glaucome à angle fermé, colite (microscopique ou sans précision), vascularite cutanée (parfois associée à une atteinte systémique), trouble extrapyramidal, galactorrhée, saignement gynécologique, hallucinations, hyperglycémie, hyperprolactinémie, hypersensibilité, crise hypertensive, spasme musculaire, rash, syndrome des jambes sans repos, convulsions à l'arrêt du traitement, arythmie supraventriculaire, acouphènes (à l'arrêt du traitement), trismus et urticaire.
INTERACTIONS MÉDICAMENTEUSES
Le CYP1A2 et le CYP2D6 sont responsables du métabolisme de la duloxétine.
Inhibiteurs du CYP1A2
Lorsque CYMBALTA 60 mg a été co-administré avec de la fluvoxamine 100 mg, un puissant inhibiteur du CYP1A2, à des sujets masculins (n = 14), l'ASC de la duloxétine a été augmentée d'environ 6 fois, la Cmax a été augmentée d'environ 2,5 fois et la t1/2 de la duloxétine a été augmenté d'environ 3 fois. D'autres médicaments qui inhibent le métabolisme du CYP1A2 comprennent la cimétidine et les antimicrobiens quinolones tels que la ciprofloxacine et l'énoxacine [voir AVERTISSEMENTS ET PRECAUTIONS ].
Inhibiteurs du CYP2D6
L'utilisation concomitante de CYMBALTA (40 mg une fois par jour) et de paroxétine (20 mg une fois par jour) a augmenté la concentration de l'ASC de la duloxétine d'environ 60 %, et des degrés d'inhibition plus importants sont attendus avec des doses plus élevées de paroxétine. Des effets similaires seraient attendus avec d'autres inhibiteurs puissants du CYP2D6 (par exemple, la fluoxétine, la quinidine) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Double inhibition du CYP1A2 et du CYP2D6
L'administration concomitante de CYMBALTA 40 mg deux fois par jour avec de la fluvoxamine 100 mg, un puissant inhibiteur du CYP1A2, à des sujets métaboliseurs lents du CYP2D6 (n = 14) a entraîné une multiplication par 6 de l'ASC et de la Cmax de la duloxétine.
Médicaments qui interfèrent avec l'hémostase (par exemple, les AINS, l'aspirine et la warfarine)
La libération de sérotonine par les plaquettes joue un rôle important dans l'hémostase. Des études épidémiologiques de conception cas-témoins et de cohorte qui ont démontré une association entre l'utilisation de médicaments psychotropes qui interfèrent avec la recapture de la sérotonine et la survenue d'hémorragies gastro-intestinales hautes ont également montré que l'utilisation concomitante d'un AINS ou d'aspirine peut potentialiser ce risque d'hémorragie. Des effets anticoagulants altérés, y compris une augmentation des saignements, ont été rapportés lorsque des ISRS ou des IRSN sont co-administrés avec la warfarine. L'administration concomitante de warfarine (2 à 9 mg une fois par jour) à l'état d'équilibre avec CYMBALTA 60 ou 120 mg une fois par jour pendant jusqu'à 14 jours chez des sujets sains (n = 15) n'a pas modifié significativement l'INR par rapport au départ (les variations moyennes de l'INR variaient de 0,05 à +0,07). La pharmacocinétique de la warfarine totale (protéine liée plus médicament libre) (ASCτ,ss, Cmax,ss ou tmax,ss) pour la warfarine R et la S-warfarine n'a pas été modifiée par la duloxétine. En raison de l'effet potentiel de la duloxétine sur les plaquettes, les patients recevant un traitement par la warfarine doivent être étroitement surveillés lors de l'instauration ou de l'arrêt de CYMBALTA [voir AVERTISSEMENTS ET PRECAUTIONS ].
Lorazépam
À l'état d'équilibre pour CYMBALTA (60 mg toutes les 12 heures) et le lorazépam (2 mg toutes les 12 heures), la pharmacocinétique de la duloxétine n'a pas été affectée par la co-administration.
Témazépam
À l'état d'équilibre pour CYMBALTA (20 mg qhs) et le témazépam (30 mg qhs), la pharmacocinétique de la duloxétine n'a pas été affectée par la co-administration.
Médicaments qui affectent l'acidité gastrique
CYMBALTA a un enrobage entérique qui résiste à la dissolution jusqu'à atteindre un segment du tractus gastro-intestinal où le pH dépasse 5,5. Dans des conditions extrêmement acides, CYMBALTA 20 mg, non protégé par l'enrobage entérique, peut subir une hydrolyse pour former du naphtol. La prudence est recommandée lors de l'utilisation de CYMBALTA 30 mg chez les patients souffrant d'affections susceptibles de ralentir la vidange gastrique (par exemple, certains diabétiques). Les médicaments qui augmentent le pH gastro-intestinal peuvent entraîner une libération plus précoce de duloxétine. Cependant, la co-administration de CYMBALTA 60 mg avec des antiacides contenant de l'aluminium et du magnésium (51 mEq) ou de CYMBALTA avec de la famotidine n'a eu aucun effet significatif sur le taux ou l'étendue de l'absorption de la duloxétine après l'administration d'une dose orale de 40 mg.
Médicaments métabolisés par le CYP1A2
Des études d'interactions médicamenteuses in vitro démontrent que la duloxétine n'induit pas l'activité du CYP1A2. Par conséquent, une augmentation du métabolisme des substrats du CYP1A2 (par exemple, la théophylline, la caféine) résultant de l'induction n'est pas anticipée, bien qu'aucune étude clinique d'induction n'ait été réalisée. La duloxétine est un inhibiteur de l'isoforme CYP1A2 dans les études in vitro, et dans deux études cliniques, l'augmentation moyenne (intervalle de confiance à 90 %) de l'ASC de la théophylline était de 7 % (1 %-15 %) et de 20 % (13 %-27 %) lorsqu'il est co-administré avec CYMBALTA (60 mg deux fois par jour).
Médicaments métabolisés par le CYP2D6
La duloxétine est un inhibiteur modéré du CYP2D6. Lorsque CYMBALTA a été administré (à une dose de 60 mg deux fois par jour) en association avec une dose unique de 50 mg de désipramine, un substrat du CYP2D6, l'ASC de la désipramine a été multipliée par 3 [voir AVERTISSEMENTS ET PRECAUTIONS ].
Médicaments métabolisés par le CYP2C9
Les résultats d'études in vitro démontrent que la duloxétine n'inhibe pas l'activité. Dans une étude clinique, la pharmacocinétique de la S-warfarine, un substrat du CYP2C9, n'a pas été significativement affectée par la duloxétine [voir Médicaments qui interfèrent avec l'hémostase (par exemple, les AINS, l'aspirine et la warfarine) ].
Médicaments métabolisés par le CYP3A
Les résultats d'études in vitro démontrent que la duloxétine n'inhibe ni n'induit l'activité du CYP3A. Par conséquent, une augmentation ou une diminution du métabolisme des substrats du CYP3A (par exemple, les contraceptifs oraux et autres agents stéroïdiens) résultant de l'induction ou de l'inhibition n'est pas anticipée, bien qu'aucune étude clinique n'ait été réalisée.
Médicaments métabolisés par le CYP2C19
Les résultats des études in vitro démontrent que la duloxétine n'inhibe pas l'activité du CYP2C19 aux concentrations thérapeutiques. L'inhibition du métabolisme des substrats du CYP2C19 n'est donc pas anticipée, bien qu'aucune étude clinique n'ait été réalisée.
Inhibiteurs de la monoamine oxydase (IMAO)
[Voir DOSAGE ET ADMINISTRATION , CONTRE-INDICATIONS , et AVERTISSEMENTS ET PRECAUTIONS ].
Médicaments sérotoninergiques
[Voir DOSAGE ET ADMINISTRATION , CONTRE-INDICATIONS , et AVERTISSEMENTS ET PRECAUTIONS ].
De l'alcool
Lorsque CYMBALTA 40 mg et l'éthanol ont été administrés à plusieurs heures d'intervalle afin que les concentrations maximales de chacun coïncident, CYMBALTA n'a pas augmenté l'altération des capacités mentales et motrices causée par l'alcool.
Dans la base de données des essais cliniques CYMBALTA, trois patients traités par CYMBALTA présentaient des lésions hépatiques se manifestant par des élévations de l'ALT et de la bilirubine totale, avec des signes d'obstruction. Une consommation intercurrente importante d'éthanol était présente dans chacun de ces cas, ce qui peut avoir contribué aux anomalies observées [voir AVERTISSEMENTS ET PRECAUTIONS ].
Médicaments du SNC
[Voir AVERTISSEMENTS ET PRECAUTIONS ].
Médicaments fortement liés aux protéines plasmatiques
Étant donné que la duloxétine est fortement liée aux protéines plasmatiques, l'administration de CYMBALTA 30 mg à un patient prenant un autre médicament fortement lié aux protéines peut entraîner une augmentation des concentrations libres de l'autre médicament, pouvant entraîner des effets indésirables. Cependant, la co-administration de CYMBALTA (60 ou 120 mg) avec de la warfarine (2 à 9 mg), un médicament fortement lié aux protéines, n'a pas entraîné de modifications significatives de l'INR et de la pharmacocinétique du S total ou du R total. warfarine (protéine liée plus médicament libre) [voir Médicaments qui interfèrent avec l'hémostase (par exemple, les AINS, l'aspirine et la warfarine) ].
Toxicomanie et dépendance
Abuser de
Dans les études animales, la duloxétine n'a pas démontré de potentiel d'abus de type barbiturique (dépresseur).
Bien que CYMBALTA n'ait pas été systématiquement étudié chez l'homme pour son potentiel d'abus, il n'y avait aucune indication de comportement de recherche de drogue dans les essais cliniques. Cependant, il n'est pas possible de prédire sur la base de l'expérience de précommercialisation dans quelle mesure un médicament actif sur le SNC sera mal utilisé, détourné et/ou abusé une fois commercialisé. Par conséquent, les médecins doivent évaluer attentivement les patients pour des antécédents de toxicomanie et suivre ces patients de près, en les observant pour des signes de mésusage ou d'abus de CYMBALTA (p. ex., développement d'une tolérance, augmentation de la dose, comportement de recherche de drogue).
Dépendance
Dans les études de pharmacodépendance, la duloxétine n'a pas démontré de potentiel de dépendance chez le rat.
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Pensées et comportements suicidaires chez les enfants, les adolescents et les jeunes adultes
Les patients atteints de trouble dépressif majeur (TDM), à la fois adultes et pédiatriques, peuvent présenter une aggravation de leur dépression et/ou l'émergence d'idées et de comportements suicidaires (suicidalité) ou des changements de comportement inhabituels, qu'ils prennent ou non des antidépresseurs, et cela le risque peut persister jusqu'à ce qu'une rémission significative se produise. Le suicide est un risque connu de dépression et de certains autres troubles psychiatriques, et ces troubles eux-mêmes sont les meilleurs prédicteurs du suicide. Cependant, on craint depuis longtemps que les antidépresseurs puissent jouer un rôle dans l'aggravation de la dépression et l'émergence de comportements suicidaires chez certains patients au cours des premières phases du traitement.
Des analyses groupées d'essais contrôlés par placebo à court terme portant sur des antidépresseurs (ISRS et autres) ont montré que ces médicaments augmentent le risque de pensées et de comportements suicidaires (suicidalité) chez les enfants, les adolescents et les jeunes adultes (âgés de 1 824 ans) atteints d'un trouble dépressif majeur ( MDD) et d'autres troubles psychiatriques. Les études à court terme n'ont pas montré d'augmentation du risque de suicide avec les antidépresseurs par rapport au placebo chez les adultes au-delà de 24 ans ; il y avait une réduction avec les antidépresseurs par rapport au placebo chez les adultes âgés de 65 ans et plus.
Les analyses groupées d'essais contrôlés par placebo chez des enfants et des adolescents atteints de TDM, de trouble obsessionnel-compulsif (TOC) ou d'autres troubles psychiatriques comprenaient un total de 24 essais à court terme de 9 antidépresseurs chez plus de 4 400 patients. Les analyses groupées d'essais contrôlés par placebo chez des adultes atteints de TDM ou d'autres troubles psychiatriques comprenaient un total de 295 essais à court terme (durée médiane de 2 mois) de 11 antidépresseurs chez plus de 77 000 patients. Il y avait une variation considérable du risque de suicidalité entre les médicaments, mais une tendance à une augmentation chez les patients plus jeunes pour presque tous les médicaments étudiés. Il y avait des différences dans le risque absolu de suicidalité entre les différentes indications, avec l'incidence la plus élevée dans le TDM. Le risque de différences (médicament vs placebo) était cependant relativement stable au sein des tranches d'âge et entre les indications. Ces différences de risque (différence médicament-placebo dans le nombre de cas de suicide pour 1000 patients traités) sont présentées dans le tableau 1.
Aucun suicide n'est survenu dans aucun des essais pédiatriques CYMBALTA. Il y a eu des suicides dans les essais CYMBALTA 20 mg pour adultes, mais le nombre n'était pas suffisant pour tirer une conclusion sur l'effet de CYMBALTA sur le suicide.
On ne sait pas si le risque de suicide s'étend à une utilisation à plus long terme, c'est-à-dire au-delà de plusieurs mois. Cependant, il existe des preuves substantielles provenant d'essais d'entretien contrôlés par placebo chez des adultes souffrant de dépression que l'utilisation d'antidépresseurs peut retarder la récurrence de la dépression.
Tous les patients traités avec des antidépresseurs pour toute indication doivent être surveillés de manière appropriée et observés de près pour déceler une aggravation clinique, des tendances suicidaires et des changements inhabituels de comportement, en particulier au cours des premiers mois d'un traitement médicamenteux, ou lors de changements de dose, soit des augmentations ou diminue.
Les symptômes suivants, anxiété, agitation, attaques de panique, insomnie, irritabilité, hostilité, agressivité, impulsivité, akathisie (agitation psychomotrice), hypomanie et manie, ont été rapportés chez des patients adultes et pédiatriques traités avec des antidépresseurs pour un trouble dépressif majeur ainsi comme pour les autres indications, tant psychiatriques que non psychiatriques. Bien qu'un lien de causalité entre l'apparition de tels symptômes et soit l'aggravation de la dépression et/ou l'émergence d'impulsions suicidaires n'ait pas été établi, on craint que ces symptômes puissent représenter des précurseurs d'une suicidalité émergente.
Il convient d'envisager de modifier le schéma thérapeutique, y compris éventuellement d'arrêter le médicament, chez les patients dont la dépression s'aggrave de manière persistante, ou qui présentent des tendances suicidaires émergentes ou des symptômes qui pourraient être des précurseurs d'une aggravation de la dépression ou des tendances suicidaires, en particulier si ces symptômes sont graves, brusques. au début ou ne faisaient pas partie des symptômes présentés par le patient.
Si la décision a été prise d'arrêter le traitement, la médication doit être réduite, aussi rapidement que possible, mais en reconnaissant que l'arrêt peut être associé à certains symptômes [voir DOSAGE ET ADMINISTRATION et Syndrome d'arrêt ] pour les descriptions des risques de l'arrêt de CYMBALTA.
Les familles et les soignants des patients traités avec des antidépresseurs pour un trouble dépressif majeur ou d'autres indications, à la fois psychiatriques et non psychiatriques, doivent être alertés de la nécessité de surveiller les patients pour l'apparition d'agitation, d'irritabilité, de changements inhabituels de comportement et des autres symptômes décrits ci-dessus. , ainsi que l'émergence de tendances suicidaires, et de signaler immédiatement ces symptômes aux fournisseurs de soins de santé. Une telle surveillance devrait inclure une observation quotidienne par les familles et les soignants. Les ordonnances de CYMBALTA doivent être rédigées pour la plus petite quantité de gélules compatible avec une bonne prise en charge du patient, afin de réduire le risque de surdosage.
Dépistage des patients pour le trouble bipolaire
Un épisode dépressif majeur peut être la présentation initiale d'un trouble bipolaire. Il est généralement admis (bien que non établi dans des essais contrôlés) que le traitement d'un tel épisode avec un antidépresseur seul peut augmenter la probabilité de précipitation d'un épisode mixte/maniaque chez les patients à risque de trouble bipolaire. On ne sait pas si l'un des symptômes décrits ci-dessus représente une telle conversion. Cependant, avant d'initier un traitement avec un antidépresseur, les patients présentant des symptômes dépressifs doivent faire l'objet d'un dépistage adéquat pour déterminer s'ils présentent un risque de trouble bipolaire ; un tel dépistage devrait inclure des antécédents psychiatriques détaillés, y compris des antécédents familiaux de suicide, de trouble bipolaire et de dépression. Il convient de noter que CYMBALTA n'est pas approuvé pour une utilisation dans le traitement de la dépression bipolaire.
Hépatotoxicité
Des cas d'insuffisance hépatique, parfois mortelle, ont été signalés chez des patients traités par CYMBALTA. Ces cas se sont présentés comme une hépatite avec des douleurs abdominales, une hépatomégalie et une élévation des taux de transaminases à plus de vingt fois la limite supérieure de la normale (LSN) avec ou sans ictère, reflétant un schéma mixte ou hépatocellulaire de lésions hépatiques. CYMBALTA 30 mg doit être interrompu chez les patients qui développent un ictère ou d'autres signes de dysfonctionnement hépatique cliniquement significatif et ne doit pas être repris à moins qu'une autre cause puisse être établie.
Des cas d'ictère cholestatique avec élévation minime des taux de transaminases ont également été rapportés. D'autres rapports post-commercialisation indiquent que des taux élevés de transaminases, de bilirubine et de phosphatase alcaline sont survenus chez des patients atteints d'une maladie hépatique chronique ou d'une cirrhose.
CYMBALTA a augmenté le risque d'élévation des taux de transaminases sériques dans les essais cliniques du programme de développement. Les élévations des transaminases hépatiques ont entraîné l'arrêt du traitement chez 0,3 % (92/34 756) des patients traités par CYMBALTA. Chez la plupart des patients, le délai médian de détection de l'élévation des transaminases était d'environ deux mois. Dans les essais contrôlés par placebo chez des adultes, chez les patients présentant des valeurs initiales normales et anormales d'ALT, une élévation de l'ALT > 3 fois la LSN s'est produite chez 1,25 % (144/11 496) des patients traités par CYMBALTA par rapport à 0,45 % (39/8716) des patients sous placebo -patients traités. Dans des études contrôlées par placebo chez des adultes utilisant une conception à dose fixe, il y avait des preuves d'une relation dose-réponse de CYMBALTA pour l'élévation de l'ALT et de l'AST de > 3 fois la LSN et > 5 fois la LSN, respectivement.
Étant donné qu'il est possible que CYMBALTA et l'alcool interagissent pour causer des lésions hépatiques ou que CYMBALTA 20 mg puisse aggraver une maladie hépatique préexistante, CYMBALTA ne doit pas être prescrit aux patients ayant une consommation importante d'alcool ou des signes de maladie hépatique chronique.
Hypotension orthostatique, chutes et syncope
Une hypotension orthostatique, des chutes et des syncopes ont été signalées chez des patients traités aux doses recommandées de CYMBALTA. La syncope et l'hypotension orthostatique ont tendance à survenir au cours de la première semaine de traitement, mais peuvent survenir à tout moment pendant le traitement par CYMBALTA, en particulier après une augmentation de la dose. Le risque de chute semble être lié au degré de diminution orthostatique de la pression artérielle (TA) ainsi qu'à d'autres facteurs susceptibles d'augmenter le risque sous-jacent de chute.
Dans une analyse des patients de tous les essais contrôlés par placebo, les patients traités par CYMBALTA 20 mg ont signalé un taux de chutes plus élevé que les patients traités par placebo. Le risque semble être lié à la présence d'une diminution orthostatique de la PA. Le risque de diminution de la PA peut être plus élevé chez les patients prenant des médicaments concomitants qui induisent une hypotension orthostatique (comme les antihypertenseurs) ou qui sont de puissants inhibiteurs du CYP1A2 [voir AVERTISSEMENTS ET PRECAUTIONS et Interactions médicamenteuses cliniquement importantes ] et chez les patients prenant CYMBALTA 20 mg à des doses supérieures à 60 mg par jour. Il faut envisager de réduire la dose ou d'arrêter CYMBALTA chez les patients qui présentent une hypotension orthostatique symptomatique, des chutes et/ou une syncope pendant le traitement par CYMBALTA à 40 mg.
Le risque de chute semblait également être proportionnel au risque sous-jacent de chute d'un patient et semblait augmenter régulièrement avec l'âge. Comme les patients gériatriques ont tendance à avoir un risque sous-jacent plus élevé de chutes en raison d'une prévalence plus élevée de facteurs de risque tels que l'utilisation de plusieurs médicaments, les comorbidités médicales et les troubles de la marche, l'impact de l'augmentation de l'âge en soi n'est pas clair. Des chutes avec des conséquences graves, notamment des fractures et des hospitalisations, ont été signalées avec l'utilisation de CYMBALTA à 30 mg [voir EFFETS INDÉSIRABLES ].
Syndrome sérotoninergique
Le développement d'un syndrome sérotoninergique potentiellement mortel a été rapporté avec les IRSN et les ISRS, y compris CYMBALTA 60 mg, seuls mais particulièrement avec l'utilisation concomitante d'autres médicaments sérotoninergiques (y compris les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, le tryptophane, la buspirone, les amphétamines , et le millepertuis) et avec des médicaments qui altèrent le métabolisme de la sérotonine (en particulier, les IMAO, à la fois ceux destinés à traiter les troubles psychiatriques et aussi d'autres, comme le linézolide et le bleu de méthylène par voie intraveineuse).
Les symptômes du syndrome sérotoninergique peuvent inclure des modifications de l'état mental (p. ex., agitation, hallucinations, délire et coma), une instabilité autonome (p. ex., tachycardie, tension artérielle labile, étourdissements, diaphorèse, bouffées vasomotrices, hyperthermie), des symptômes neuromusculaires (p. ex., tremblements, rigidité, myoclonies, hyperréflexie, incoordination), convulsions et/ou symptômes gastro-intestinaux (p. ex., nausées, vomissements, diarrhée). Les patients doivent être surveillés pour détecter l'apparition d'un syndrome sérotoninergique.
L'utilisation concomitante de CYMBALTA 30 mg avec des antidépresseurs IMAO est contre-indiquée. CYMBALTA 60 mg ne doit pas non plus être instauré chez un patient traité par des IMAO tels que le linézolide ou le bleu de méthylène par voie intraveineuse. Tous les rapports avec le bleu de méthylène qui ont fourni des informations sur la voie d'administration impliquaient une administration intraveineuse dans la gamme de doses de 1 mg/kg à 8 mg/kg. Aucun rapport n'impliquait l'administration de bleu de méthylène par d'autres voies (telles que des comprimés oraux ou une injection tissulaire locale) ou à des doses plus faibles. Il peut y avoir des circonstances où il est nécessaire d'initier un traitement avec un IMAO tel que le linézolide ou le bleu de méthylène par voie intraveineuse chez un patient prenant CYMBALTA. CYMBALTA doit être interrompu avant de commencer le traitement par IMAO [voir DOSAGE ET ADMINISTRATION et CONTRE-INDICATIONS ].
Si l'utilisation concomitante de CYMBALTA 20 mg avec d'autres médicaments sérotoninergiques, y compris les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, la buspirone, le tryptophane, les amphétamines et le millepertuis est cliniquement justifiée, les patients doivent être informés d'un risque accru potentiel de syndrome sérotoninergique. , en particulier lors de l'initiation du traitement et des augmentations de dose. Le traitement par CYMBALTA 60 mg et tout agent sérotoninergique concomitant doit être interrompu immédiatement si les événements ci-dessus se produisent et un traitement symptomatique de soutien doit être instauré.
Risque accru de saignement
Les médicaments qui interfèrent avec l'inhibition du recaptage de la sérotonine, y compris CYMBALTA, peuvent augmenter le risque d'événements hémorragiques. Des rapports de cas et des études épidémiologiques (cas-témoins et conception de cohorte) ont démontré une association entre l'utilisation de médicaments qui interfèrent avec la recapture de la sérotonine et la survenue d'hémorragies gastro-intestinales. Une étude post-commercialisation a montré une incidence plus élevée d'hémorragie post-partum chez les mères prenant CYMBALTA. D'autres événements hémorragiques liés à l'utilisation des ISRS et des IRSN vont des ecchymoses, des hématomes, des épistaxis et des pétéchies aux hémorragies potentiellement mortelles. L'utilisation concomitante d'aspirine, d'anti-inflammatoires non stéroïdiens (AINS), de warfarine et d'autres anticoagulants peut augmenter ce risque.
Informer les patients du risque de saignement associé à l'utilisation concomitante de CYMBALTA et d'AINS, d'aspirine ou d'autres médicaments affectant la coagulation [voir INTERACTIONS MÉDICAMENTEUSES ].
Réactions cutanées sévères
Des réactions cutanées graves, y compris l'érythème polymorphe et le syndrome de Stevens-Johnson (SJS), peuvent survenir avec CYMBALTA. Le taux de déclaration de SJS associé à l'utilisation de CYMBALTA dépasse le taux d'incidence de fond de la population générale pour cette réaction cutanée grave (1 à 2 cas par million d'années-personnes). Le taux de déclaration est généralement considéré comme une sous-estimation en raison de la sous-déclaration.
CYMBALTA doit être arrêté dès la première apparition de cloques, d'éruption cutanée qui pèle, d'érosions des muqueuses ou de tout autre signe d'hypersensibilité si aucune autre étiologie ne peut être identifiée.
Syndrome d'arrêt
Les symptômes de sevrage ont été systématiquement évalués chez les patients prenant CYMBALTA. À la suite d'un arrêt brutal ou progressif lors d'essais cliniques contrôlés par placebo chez des adultes, les symptômes suivants sont survenus à 1 % ou plus et à un taux significativement plus élevé chez les patients traités par CYMBALTA par rapport à ceux qui ont arrêté le placebo : étourdissements, maux de tête, nausées, diarrhée, paresthésie, irritabilité, vomissements, insomnie, anxiété, hyperhidrose et fatigue.
Au cours de la commercialisation d'autres ISRS et IRSN (inhibiteurs de la recapture de la sérotonine et de la noradrénaline), des cas d'effets indésirables survenus à l'arrêt de ces médicaments, en particulier lorsqu'ils sont brusques, ont été rapportés spontanément, notamment : humeur dysphorique, irritabilité, agitation, étourdissements, troubles sensoriels ( paresthésies telles que des sensations de choc électrique), anxiété, confusion, maux de tête, léthargie, labilité émotionnelle, insomnie, hypomanie, acouphènes et convulsions. Bien que ces événements soient généralement spontanément résolutifs, certains ont été signalés comme étant graves.
Les patients doivent être surveillés pour ces symptômes lors de l'arrêt du traitement par CYMBALTA. Une réduction progressive de la dose plutôt qu'un arrêt brutal est recommandée dans la mesure du possible. Si des symptômes intolérables surviennent suite à une diminution de la dose ou à l'arrêt du traitement, la reprise de la dose précédemment prescrite peut être envisagée. Par la suite, le professionnel de la santé peut continuer à diminuer la dose, mais à un rythme plus graduel [voir DOSAGE ET ADMINISTRATION ].
Activation de la manie/hypomanie
Dans des essais contrôlés par placebo chez des adultes chez des patients atteints de TDM, une activation de la manie ou de l'hypomanie a été signalée chez 0,1 % (4/3 779) des patients traités par CYMBALTA et 0,04 % (1/2 536) des patients sous placebo. Aucune activation de la manie ou de l'hypomanie n'a été signalée dans les essais contrôlés par placebo sur le DPNP, le TAG, la fibromyalgie ou la douleur musculo-squelettique chronique. L'activation de la manie ou de l'hypomanie a été rapportée chez une petite proportion de patients souffrant de troubles de l'humeur qui ont été traités avec d'autres médicaments commercialisés efficaces dans le traitement du trouble dépressif majeur. Comme avec ces autres agents, CYMBALTA 60 mg doit être utilisé avec prudence chez les patients ayant des antécédents de manie.
Glaucome à angle fermé
La dilatation pupillaire qui survient après l'utilisation de nombreux antidépresseurs, y compris CYMBALTA, peut déclencher une attaque à angle fermé chez un patient présentant des angles anatomiquement étroits qui n'a pas subi d'iridectomie perméable.
Saisies
CYMBALTA n'a pas été systématiquement évalué chez les patients présentant un trouble convulsif, et ces patients ont été exclus des études cliniques. Lors d'essais cliniques contrôlés par placebo chez des adultes, des crises d'épilepsie/convulsions sont survenues chez 0,02 % (3/12 722) des patients traités par CYMBALTA à 60 mg et 0,01 % (1/9 513) des patients traités par placebo. CYMBALTA doit être prescrit avec prudence chez les patients ayant des antécédents de troubles convulsifs.
Augmentation de la pression artérielle
Dans des essais cliniques contrôlés par placebo chez des adultes menés auprès de populations adultes approuvées, du début à la fin, le traitement par CYMBALTA a été associé à des augmentations moyennes de 0,5 mm Hg de la tension artérielle systolique et de 0,8 mm Hg de la tension artérielle diastolique, comparativement à des diminutions moyennes de 0,6 mm Hg systolique et 0,3 mm Hg diastolique chez les patients traités par placebo. Il n'y avait pas de différence significative dans la fréquence de l'hypertension artérielle soutenue (3 visites consécutives). Dans une étude de pharmacologie clinique conçue pour évaluer les effets de CYMBALTA 60 mg sur divers paramètres, y compris la pression artérielle à des doses suprathérapeutiques avec une titration accélérée de la dose, il y avait des preuves d'augmentations de la pression artérielle en position couchée à des doses allant jusqu'à 200 mg deux fois par jour (environ 3,3 fois la dose maximale recommandée). À la dose la plus élevée de 200 mg deux fois par jour, l'augmentation du pouls moyen était de 5,0 à 6,8 battements et les augmentations de la pression artérielle moyenne étaient de 4,7 à 6,8 mm Hg (systolique) et de 4,5 à 7 mm Hg (diastolique) jusqu'à 12 heures après l'administration. .
La pression artérielle doit être mesurée avant le début du traitement et mesurée périodiquement tout au long du traitement [voir EFFETS INDÉSIRABLES ].
Interactions médicamenteuses cliniquement importantes
Le CYP1A2 et le CYP2D6 sont responsables du métabolisme de CYMBALTA.
Possibilité que d'autres médicaments affectent CYMBALTA
Inhibiteurs du CYP1A2
La co-administration de CYMBALTA 40 mg avec des inhibiteurs puissants du CYP1A2 doit être évitée [voir INTERACTIONS MÉDICAMENTEUSES ].
Inhibiteurs du CYP2D6
Étant donné que le CYP2D6 est impliqué dans le métabolisme de CYMBALTA, l'utilisation concomitante de CYMBALTA avec de puissants inhibiteurs du CYP2D6 devrait entraîner, et entraîne effectivement, des concentrations plus élevées (en moyenne de 60 %) de CYMBALTA [voir INTERACTIONS MÉDICAMENTEUSES ].
Potentiel pour CYMBALTA 30 mg d'affecter d'autres médicaments
Médicaments métabolisés par le CYP2D6
Co-administration de CYMBALTA 20 mg avec des médicaments qui sont largement métabolisés par le CYP2D6 et qui ont un index thérapeutique étroit, y compris certains antidépresseurs (antidépresseurs tricycliques [ATC], tels que la nortriptyline, l'amitriptyline et l'imipramine), les phénothiazines et les antiarythmiques de type 1C (p. propafénone, flécaïnide), doit être abordé avec prudence. Les concentrations plasmatiques de TCA peuvent devoir être surveillées et la dose de TCA peut devoir être réduite si un TCA est co-administré avec CYMBALTA. En raison du risque d'arythmies ventriculaires graves et de mort subite potentiellement associées à des taux plasmatiques élevés de thioridazine, CYMBALTA 30 mg et la thioridazine ne doivent pas être co-administrés [voir INTERACTIONS MÉDICAMENTEUSES ].
Autres interactions médicamenteuses cliniquement importantes
De l'alcool
L'utilisation concomitante de CYMBALTA 40 mg avec une forte consommation d'alcool peut être associée à des lésions hépatiques graves. Pour cette raison, CYMBALTA 60 mg ne doit pas être prescrit aux patients ayant une consommation importante d'alcool [voir Hépatotoxicité et INTERACTIONS MÉDICAMENTEUSES ].
Médicaments agissant sur le SNC
Compte tenu des principaux effets de CYMBALTA sur le SNC, il doit être utilisé avec prudence lorsqu'il est pris en association ou en remplacement d'autres médicaments à action centrale, y compris ceux ayant un mécanisme d'action similaire [voir Interactions médicamenteuses cliniquement importantes et INTERACTIONS MÉDICAMENTEUSES ].
Hyponatrémie
Une hyponatrémie peut survenir à la suite d'un traitement par des ISRS et des IRSN, y compris CYMBALTA. Dans de nombreux cas, cette hyponatrémie semble être la conséquence du syndrome de sécrétion inappropriée d'hormone antidiurétique (SIADH). Des cas de sodium sérique inférieur à 110 mmol/L ont été signalés avec l'utilisation de CYMBALTA à 40 mg et ont semblé réversibles lorsque CYMBALTA a été arrêté. Les patients gériatriques peuvent être plus à risque de développer une hyponatrémie avec les ISRS et les IRSN. De plus, les patients prenant des diurétiques ou qui présentent une hypovolémie peuvent être plus à risque [voir Utilisation dans des populations spécifiques ]. L'arrêt de CYMBALTA doit être envisagé chez les patients présentant une hyponatrémie symptomatique et une intervention médicale appropriée doit être instituée.
Les signes et symptômes de l'hyponatrémie comprennent des maux de tête, des difficultés de concentration, des troubles de la mémoire, de la confusion, de la faiblesse et une instabilité pouvant entraîner des chutes. Des cas plus graves et/ou aigus ont été associés à des hallucinations, des syncopes, des convulsions, un coma, un arrêt respiratoire et la mort.
Utilisation chez les patients atteints d'une maladie concomitante
L'expérience clinique avec CYMBALTA chez les patients atteints de maladies systémiques concomitantes est limitée. Il n'y a aucune information sur l'effet que les altérations de la motilité gastrique peuvent avoir sur la stabilité de l'enrobage entérique de CYMBALTA. Dans des conditions extrêmement acides, CYMBALTA, non protégé par l'enrobage entérique, peut subir une hydrolyse pour former du naphtol. La prudence est recommandée lors de l'utilisation de CYMBALTA chez les patients atteints d'affections susceptibles de ralentir la vidange gastrique (par exemple, certains diabétiques).
CYMBALTA 30 mg n'a pas été systématiquement évalué chez les patients ayant des antécédents récents d'infarctus du myocarde ou de coronaropathie instable. Les patients présentant ces diagnostics étaient généralement exclus des études cliniques lors des tests de précommercialisation du produit.
Insuffisance hépatique
Éviter l'utilisation chez les patients atteints d'une maladie hépatique chronique ou d'une cirrhose [voir DOSAGE ET ADMINISTRATION , Hépatotoxicité , et Utilisation dans des populations spécifiques ].
Insuffisance rénale sévère
Éviter l'utilisation chez les patients présentant une insuffisance rénale sévère, GFR DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ].
Contrôle glycémique chez les patients diabétiques
Comme observé dans les essais sur le DPNP, le traitement par CYMBALTA à 30 mg a aggravé le contrôle glycémique chez certains patients diabétiques. Dans trois essais cliniques sur CYMBALTA pour la prise en charge de la douleur neuropathique associée à la neuropathie périphérique diabétique [voir Etudes cliniques ], la durée moyenne du diabète était d'environ 12 ans, la glycémie à jeun initiale moyenne était de 176 mg/dL et l'hémoglobine A1c (HbA1c) initiale moyenne était de 7,8 %. Au cours de la phase de traitement aigu de 12 semaines de ces études, CYMBALTA a été associé à une légère augmentation de la glycémie moyenne à jeun par rapport au placebo. Dans la phase d'extension de ces études, qui a duré jusqu'à 52 semaines, la glycémie moyenne à jeun a augmenté de 12 mg/dL dans le groupe CYMBALTA 40 mg et diminué de 11,5 mg/dL dans le groupe de soins de routine. L'HbA1c a augmenté de 0,5 % dans le groupe CYMBALTA 40 mg et de 0,2 % dans le groupe soins de routine.
Hésitation et rétention urinaires
CYMBALTA 60 mg appartient à une classe de médicaments connus pour affecter la résistance urétrale. Si des symptômes d'hésitation urinaire se développent pendant le traitement par CYMBALTA 20 mg, il convient d'envisager la possibilité qu'ils soient liés au médicament.
Dans l'expérience post-commercialisation, des cas de rétention urinaire ont été observés. Dans certains cas de rétention urinaire associée à l'utilisation de CYMBALTA à 60 mg, une hospitalisation et/ou un cathétérisme ont été nécessaires.
Dysfonction sexuelle
L'utilisation d'IRSN, y compris CYMBALTA 60 mg, peut provoquer des symptômes de dysfonctionnement sexuel [voir EFFETS INDÉSIRABLES ]. Chez les hommes, l'utilisation d'IRSN peut entraîner un retard ou un échec de l'éjaculation, une diminution de la libido et une dysfonction érectile. Chez les patientes, l'utilisation d'IRSN peut entraîner une diminution de la libido et un orgasme retardé ou absent.
Il est important que les prescripteurs se renseignent sur la fonction sexuelle avant le début de CYMBALTA 40 mg et se renseignent spécifiquement sur les modifications de la fonction sexuelle pendant le traitement, car la fonction sexuelle peut ne pas être signalée spontanément. Lors de l'évaluation des modifications de la fonction sexuelle, il est important d'obtenir un historique détaillé (y compris le moment de l'apparition des symptômes) car les symptômes sexuels peuvent avoir d'autres causes, y compris le trouble psychiatrique sous-jacent. Discuter des stratégies de prise en charge potentielles pour aider les patients à prendre des décisions éclairées sur le traitement.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments ).
Pensées et comportements suicidaires
Conseillez aux patients, à leurs familles et à leurs soignants de rechercher l'apparition d'idées et de comportements suicidaires, en particulier pendant le traitement et lorsque la dose est ajustée à la hausse ou à la baisse, et demandez-leur de signaler ces symptômes à leur professionnel de la santé [voir AVERTISSEMENT DE BOÎTE et AVERTISSEMENTS ET PRECAUTIONS ].
Administration
Conseillez aux patients d'avaler CYMBALTA 20 mg entier et de ne pas mâcher, écraser ou ouvrir la gélule (ne pas saupoudrer le contenu sur les aliments ou le mélanger avec des liquides) car ces actions pourraient affecter l'enrobage entérique.
Hépatotoxicité
Informez les patients que des problèmes hépatiques graves, parfois mortels, ont été signalés chez des patients traités par CYMBALTA. Demandez aux patients de parler à leur fournisseur de soins de santé s'ils développent des démangeaisons, des douleurs dans le haut du ventre droit, une urine foncée ou une peau/yeux jaunes pendant la prise de CYMBALTA, qui peuvent être des signes de problèmes hépatiques. Demandez aux patients de parler à leur fournisseur de soins de santé de leur consommation d'alcool. L'utilisation de CYMBALTA avec une forte consommation d'alcool peut être associée à des lésions hépatiques graves [voir AVERTISSEMENTS ET PRECAUTIONS ].
De l'alcool
Bien que CYMBALTA n'augmente pas l'altération des capacités mentales et motrices causée par l'alcool, l'utilisation concomitante de CYMBALTA avec une forte consommation d'alcool peut être associée à des lésions hépatiques graves [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ].
Hypotension orthostatique, chutes et syncope
Informer les patients du risque d'hypotension orthostatique, de chutes et de syncope, en particulier pendant la période d'utilisation initiale et d'augmentation subséquente de la dose, et en association avec l'utilisation de médicaments concomitants qui pourraient potentialiser l'effet orthostatique de CYMBALTA [voir AVERTISSEMENTS ET PRECAUTIONS ].
Syndrome sérotoninergique
Avertir les patients du risque de syndrome sérotoninergique associé à l'utilisation concomitante de CYMBALTA 30 mg et d'autres agents sérotoninergiques, notamment les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, la buspirone, le tryptophane, les amphétamines et le millepertuis [voir CONTRE-INDICATIONS , AVERTISSEMENTS ET PRECAUTIONS , et INTERACTIONS MÉDICAMENTEUSES ]. Informer les patients des signes et symptômes associés au syndrome sérotoninergique pouvant inclure des modifications de l'état mental (p. ex., agitation, hallucinations, délire et coma), une instabilité autonome (p. ex., tachycardie, tension artérielle labile, étourdissements, diaphorèse, bouffées vasomotrices, hyperthermie), modifications neuromusculaires (p. ex. tremblements, rigidité, myoclonies, hyperréflexie, incoordination), convulsions et/ou symptômes gastro-intestinaux (p. ex. nausées, vomissements, diarrhée). Avertir les patients de consulter immédiatement un médecin s'ils ressentent ces symptômes.
Risque accru de saignement
Avertir les patients de l'utilisation concomitante de CYMBALTA 30 mg et d'AINS, d'aspirine, de warfarine ou d'autres médicaments qui affectent la coagulation, car l'utilisation combinée de médicaments psychotropes qui interfèrent avec la recapture de la sérotonine et ces agents a été associée à un risque accru de saignement [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Réactions cutanées sévères
Avertir les patients que CYMBALTA peut provoquer des réactions cutanées graves. Cela peut nécessiter un traitement à l'hôpital et peut mettre la vie en danger. Conseillez aux patients d'appeler immédiatement leur médecin ou d'obtenir une aide d'urgence s'ils ont des cloques cutanées, une éruption cutanée qui pèle, des plaies dans la bouche, de l'urticaire ou toute autre réaction allergique [voir AVERTISSEMENTS ET PRECAUTIONS ].
Arrêt du traitement
Dites aux patients que l'arrêt de CYMBALTA 30 mg peut être associé à des symptômes tels que des étourdissements, des maux de tête, des nausées, de la diarrhée, des paresthésies, de l'irritabilité, des vomissements, de l'insomnie, de l'anxiété, de l'hyperhidrose et de la fatigue, et qu'il doit leur être conseillé de ne pas modifier leur schéma posologique ou d'arrêter prendre CYMBALTA sans consulter leur fournisseur de soins de santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Activation de la manie ou de l'hypomanie
Effectuez un dépistage adéquat des patients présentant des symptômes dépressifs pour le risque de trouble bipolaire (par exemple, antécédents familiaux de suicide, trouble bipolaire et dépression) avant de commencer le traitement par CYMBALTA. Conseillez aux patients de signaler tout signe ou symptôme d'une réaction maniaque, tels qu'une énergie considérablement accrue, de graves troubles du sommeil, des pensées qui s'emballent, un comportement imprudent, le fait de parler plus ou plus vite que d'habitude, des idées exceptionnellement grandioses et une joie ou une irritabilité excessive [voir AVERTISSEMENTS ET PRECAUTIONS ].
Glaucome à angle fermé
Informez les patients que la prise de CYMBALTA 40 mg peut provoquer une légère dilatation pupillaire, qui, chez les personnes sensibles, peut entraîner un épisode de glaucome à angle fermé. Le glaucome préexistant est presque toujours un glaucome à angle ouvert car le glaucome à angle fermé, lorsqu'il est diagnostiqué, peut être traité définitivement par iridectomie. Le glaucome à angle ouvert n'est pas un facteur de risque de glaucome à angle fermé. Les patients peuvent souhaiter être examinés pour déterminer s'ils sont sensibles à la fermeture de l'angle et subir une procédure prophylactique (p. ex., iridectomie), s'ils sont sensibles [voir AVERTISSEMENTS ET PRECAUTIONS ].
Saisies
Conseillez aux patients d'informer leur fournisseur de soins de santé s'ils ont des antécédents de troubles épileptiques [voir AVERTISSEMENTS ET PRECAUTIONS ].
Effets sur la tension artérielle
Avertir les patients que CYMBALTA 60 mg peut provoquer une augmentation de la pression artérielle [voir AVERTISSEMENTS ET PRECAUTIONS ].
Médicaments concomitants
Conseillez aux patients d'informer leur fournisseur de soins de santé s'ils prennent ou prévoient de prendre des médicaments sur ordonnance ou en vente libre, car il existe un risque d'interactions [voir DOSAGE ET ADMINISTRATION , CONTRE-INDICATIONS , AVERTISSEMENTS ET PRECAUTIONS , et INTERACTIONS MÉDICAMENTEUSES ].
Hyponatrémie
Aviser les patients qu'une hyponatrémie a été signalée à la suite d'un traitement par des IRSN et des ISRS, y compris CYMBALTA. Informer les patients des signes et symptômes d'hyponatrémie [voir AVERTISSEMENTS ET PRECAUTIONS ].

Maladies concomitantes
Conseillez aux patients d'informer leur fournisseur de soins de santé de toutes leurs conditions médicales [voir AVERTISSEMENTS ET PRECAUTIONS ].
Hésitation et rétention urinaires
CYMBALTA appartient à une classe de médicaments pouvant affecter la miction. Demandez aux patients de consulter leur fournisseur de soins de santé s'ils développent des problèmes d'écoulement d'urine [voir AVERTISSEMENTS ET PRECAUTIONS ].
Dysfonction sexuelle
Informez les patients que l'utilisation de CYMBALTA 40 mg peut provoquer des symptômes de dysfonctionnement sexuel chez les hommes et les femmes. Informez les patients qu'ils doivent discuter de tout changement de la fonction sexuelle et des stratégies de gestion potentielles avec leur fournisseur de soins de santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Grossesse
- Conseillez aux femmes d'informer leur fournisseur de soins de santé si elles deviennent enceintes ou ont l'intention de devenir enceintes pendant le traitement par CYMBALTA.
- Avisez les femmes enceintes ou les patientes qui ont l'intention de devenir enceintes que l'utilisation de CYMBALTA 40 mg au cours du mois précédant l'accouchement peut entraîner un risque accru d'hémorragie post-partum et peut augmenter le risque de complications néonatales nécessitant une hospitalisation prolongée, une assistance respiratoire et une alimentation par sonde.
- Informez les femmes enceintes qu'il existe un risque de rechute à l'arrêt des antidépresseurs.
- Informez les patientes qu'il existe un registre d'exposition pendant la grossesse qui surveille l'issue de la grossesse chez les femmes exposées à la duloxétine pendant la grossesse [voir Utilisation dans des populations spécifiques ].
Lactation
Conseillez aux femmes allaitantes utilisant CYMBALTA 30 mg de surveiller les nourrissons pour une sédation, une mauvaise alimentation et une faible prise de poids et de consulter un médecin si elles remarquent ces signes [voir Utilisation dans des populations spécifiques ].
Interférence avec les performances psychomotrices
CYMBALTA 30 mg peut être associé à une sédation et à des étourdissements. Par conséquent, avertissez les patients de l'utilisation de machines dangereuses, y compris les automobiles, jusqu'à ce qu'ils soient raisonnablement certains que le traitement par CYMBALTA n'affecte pas leur capacité à se livrer à de telles activités.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
La duloxétine a été administrée dans l'alimentation de souris et de rats pendant 2 ans.
Chez les souris femelles recevant la duloxétine à raison de 140 mg/kg/jour (3 fois la dose maximale recommandée chez l'homme (MRHD) de 120 mg/jour administrée aux enfants sur une base en mg/m2), il y a eu une incidence accrue d'adénomes et de carcinomes hépatocellulaires. La dose sans effet était de 50 mg/kg/jour (1 fois la MRHD administrée aux enfants). L'incidence des tumeurs n'a pas augmenté chez les souris mâles recevant de la duloxétine à des doses allant jusqu'à 100 mg/kg/jour (2 fois la MRHD administrée aux enfants).
Chez le rat, des doses alimentaires de duloxétine allant jusqu'à 27 mg/kg/jour chez les femelles (1 fois la MRHD administrée aux enfants) et jusqu'à 36 mg/kg/jour chez les mâles (1,4 fois la MRHD administrée aux enfants) n'ont pas augmenté la incidence des tumeurs.
Mutagenèse
La duloxétine n'a pas été mutagène dans le test de mutation bactérienne inverse in vitro (test d'Ames) et n'a pas été clastogène dans un test d'aberration chromosomique in vivo sur des cellules de moelle osseuse de souris. De plus, la duloxétine ne s'est pas révélée génotoxique dans un essai in vitro de mutation génique directe de mammifère dans des cellules de lymphome de souris ou dans un essai in vitro de synthèse d'ADN non programmée (UDS) dans des hépatocytes primaires de rat, et n'a pas induit d'échange de chromatides sœurs dans la moelle osseuse de hamster chinois in vivo. .
Altération de la fertilité
La duloxétine administrée par voie orale à des rats mâles ou femelles avant et pendant l'accouplement à des doses allant jusqu'à 45 mg/kg/jour (3 fois la MRHD administrée aux adolescents sur une base en mg/m2) n'a pas altéré l'accouplement ou la fertilité.
Utilisation dans des populations spécifiques
Grossesse
Registre d'exposition pendant la grossesse
Il existe un registre d'exposition pendant la grossesse qui surveille l'issue de la grossesse chez les femmes exposées à CYMBALTA pendant la grossesse. Pour vous inscrire, contactez le registre des grossesses CYMBALTA au 1-866-814-6975 ou www.cymbalta 20mgpregnancyregistry.com.
Résumé des risques
Les données d'une étude de cohorte rétrospective post-commercialisation indiquent que l'utilisation de la duloxétine dans le mois précédant l'accouchement peut être associée à un risque accru d'hémorragie du post-partum. Les données issues de la littérature publiée et d'une étude de cohorte rétrospective post-commercialisation n'ont pas identifié de risque clair associé au médicament de malformations congénitales majeures ou d'autres effets indésirables sur le développement (voir Données ). Il existe des risques associés à la dépression et à la fibromyalgie non traitées pendant la grossesse, ainsi qu'à l'exposition aux IRSN et aux ISRS, y compris CYMBALTA, pendant la grossesse (voir Considérations cliniques ).
Chez les rats et les lapins traités par la duloxétine pendant la période d'organogenèse, le poids des fœtus a diminué, mais il n'y a eu aucune preuve d'effets sur le développement à des doses allant jusqu'à 3 et 6 fois, respectivement, la dose maximale recommandée chez l'homme (MRHD) de 120 mg/jour administrée. aux adolescents sur une base mg/m2. Lorsque la duloxétine a été administrée par voie orale à des rates gravides tout au long de la gestation et de la lactation, le poids des ratons à la naissance et la survie des ratons jusqu'à 1 jour après l'accouchement ont diminué à une dose 2 fois la MRHD administrée aux adolescentes sur une base en mg/m2. À cette dose, des comportements de chiots compatibles avec une réactivité accrue, tels qu'une réaction de sursaut accrue au bruit et une accoutumance réduite de l'activité locomotrice, ont été observés. La croissance post-sevrage n'a pas été affectée négativement.
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 à 4 % et de 15 à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
Les femmes qui arrêtent les antidépresseurs pendant la grossesse sont plus susceptibles de connaître une rechute de dépression majeure que les femmes qui continuent les antidépresseurs. Ce résultat provient d'une étude longitudinale prospective qui a suivi 201 femmes enceintes ayant des antécédents de trouble dépressif majeur qui étaient euthymiques et prenaient des antidépresseurs en début de grossesse. Tenez compte du risque de dépression non traitée lors de l'arrêt ou de la modification d'un traitement antidépresseur pendant la grossesse et le post-partum.
Les femmes enceintes atteintes de fibromyalgie courent un risque accru de résultats indésirables pour la mère et le nourrisson, notamment la rupture prématurée des membranes, l'accouchement prématuré, la petite taille pour l'âge gestationnel, la restriction de croissance intra-utérine, la rupture placentaire et la thrombose veineuse. On ne sait pas si ces résultats maternels et fœtaux indésirables sont le résultat direct de la fibromyalgie ou d'autres facteurs comorbides.
Effets indésirables maternels
L'utilisation de la duloxétine dans le mois précédant l'accouchement peut être associée à un risque accru d'hémorragie du post-partum [voir AVERTISSEMENTS ET PRECAUTIONS ].
Effet indésirable fœtal/néonatal
Les nouveau-nés exposés à CYMBALTA et à d'autres IRSN ou ISRS à la fin du troisième trimestre ont développé des complications nécessitant une hospitalisation prolongée, une assistance respiratoire et une alimentation par sonde. De telles complications peuvent survenir immédiatement après l'accouchement. Les signes cliniques signalés comprennent la détresse respiratoire, la cyanose, l'apnée, les convulsions, l'instabilité de la température, les difficultés d'alimentation, les vomissements, l'hypoglycémie, l'hypotonie, l'hypertonie, l'hyperréflexie, les tremblements, la nervosité, l'irritabilité et les pleurs constants. Ces résultats sont compatibles avec soit un effet toxique direct des SNRI ou des ISRS, soit éventuellement un syndrome d'arrêt du médicament. Il convient de noter que, dans certains cas, le tableau clinique est compatible avec le syndrome sérotoninergique [voir AVERTISSEMENTS ET PRECAUTIONS ].
Données
Données humaines
Les données d'une étude de cohorte rétrospective post-commercialisation basée sur les réclamations ont révélé un risque accru d'hémorragie post-partum chez 955 femmes enceintes exposées à la duloxétine au cours du dernier mois de grossesse par rapport à 4 128 460 femmes enceintes non exposées (risque relatif ajusté : 1,53 ; IC à 95 % : 1,08-2,18 ). La même étude n'a pas trouvé d'augmentation cliniquement significative du risque d'anomalies congénitales majeures dans la comparaison de 2 532 femmes exposées à la duloxétine au cours du premier trimestre de la grossesse à 1 284 827 femmes non exposées après ajustement pour plusieurs facteurs de confusion. Les limites méthodologiques comprennent une confusion résiduelle possible, une mauvaise classification de l'exposition et des résultats, le manque de mesures directes de la gravité de la maladie et le manque d'informations sur la consommation d'alcool, la nutrition et les expositions aux médicaments en vente libre.
Données animales
Dans les études de reproduction chez l'animal, il a été démontré que la duloxétine a des effets indésirables sur le développement embryonnaire/fœtal et postnatal.
Lorsque la duloxétine a été administrée par voie orale à des rates et des lapines gestantes pendant la période d'organogenèse, il n'y a eu aucun signe de malformations ou de variations du développement à des doses allant jusqu'à 45 mg/kg/jour [3 et 6 fois, respectivement, la MRHD de 120 mg/jour administré aux adolescents sur une base mg/m2]. Cependant, les poids foetaux ont été diminués à cette dose, avec une dose sans effet de 10 mgs/kg/jours (approximativement égal au MRHD dans les rats et 2 fois le MRHD dans les lapins).
Lorsque la duloxétine a été administrée par voie orale à des rates gravides tout au long de la gestation et de la lactation, la survie des ratons à 1 jour post-partum et le poids corporel des ratons à la naissance et pendant la période de lactation ont diminué à une dose de 30 mg/kg/jour (2 fois la MRHD administrée aux adolescents sur une base mg/m2); la dose sans effet était de 10 mg/kg/jour. De plus, des comportements compatibles avec une réactivité accrue, tels qu'une réaction de sursaut accrue au bruit et une diminution de l'accoutumance à l'activité locomotrice, ont été observés chez les ratons après une exposition maternelle à 30 mg/kg/jour. La croissance post-sevrage et les performances de reproduction de la progéniture n'ont pas été affectées négativement par le traitement maternel à la duloxétine.
Lactation
Résumé des risques
Les données de la littérature publiée rapportent la présence de duloxétine dans le lait maternel (voir Données ). Des cas de sédation, de mauvaise alimentation et de faible prise de poids ont été rapportés chez les nourrissons exposés à la duloxétine par le lait maternel (voir Considérations cliniques ). Il n'y a pas de données sur l'effet de la duloxétine sur la production de lait.
Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de CYMBALTA pour la mère et tout effet indésirable potentiel de CYMBALTA ou de l'affection maternelle sous-jacente sur l'enfant allaité.
Considérations cliniques
Les nourrissons exposés à CYMBALTA doivent être surveillés pour la sédation, une mauvaise alimentation et un faible gain de poids.
Données
L'utilisation de CYMBALTA 60 mg a été étudiée chez 6 femmes allaitantes qui étaient à au moins 12 semaines post-partum et avaient choisi de sevrer leurs nourrissons. Les femmes ont reçu 40 mg de CYMBALTA 60 mg deux fois par jour pendant 3,5 jours. La concentration maximale mesurée dans le lait maternel s'est produite à une médiane de 3 heures après la dose. La quantité de CYMBALTA dans le lait maternel était d'environ 7 mcg/jour pendant la prise de cette dose ; la dose quotidienne estimée pour le nourrisson était d'environ 2 mcg/kg/jour, soit moins de 1 % de la dose maternelle. La présence de métabolites de CYMBALTA à 40 mg dans le lait maternel n'a pas été examinée.
Utilisation pédiatrique
L'innocuité et l'efficacité de CYMBALTA 60 mg ont été établies pour le traitement du trouble anxieux généralisé (TAG) chez les patients âgés de 7 à 17 ans et pour le traitement du syndrome de fibromyalgie juvénile chez les patients âgés de 13 à 17 ans. L'innocuité et l'efficacité de CYMBALTA à 20 mg n'ont pas été établies chez les patients pédiatriques atteints de trouble dépressif majeur (TDM), de douleur neuropathique périphérique diabétique ou de douleur musculo-squelettique chronique.
Les antidépresseurs ont augmenté le risque de pensées et de comportements suicidaires chez les patients pédiatriques. Surveiller tous les patients pédiatriques traités avec des antidépresseurs pour déceler une aggravation clinique et l'apparition de pensées et de comportements suicidaires, en particulier pendant les premiers mois de traitement ou lors de changements de posologie [voir AVERTISSEMENTS ET PRECAUTIONS ]. Effectuer une surveillance régulière du poids et de la croissance des patients pédiatriques traités par CYMBALTA [voir EFFETS INDÉSIRABLES ].
Désordre anxieux généralisé
L'utilisation de CYMBALTA pour le traitement du TAG chez les patients âgés de 7 à 17 ans est étayée par un essai contrôlé par placebo de 10 semaines (GAD-6). L'étude a inclus 272 patients pédiatriques atteints de TAG dont 47 % étaient âgés de 7 à 11 ans (53 % étaient âgés de 12 à 17 ans). CYMBALTA a démontré une supériorité sur le placebo, mesurée par une plus grande amélioration de l'échelle d'évaluation de l'anxiété pédiatrique (PARS) pour le score de sévérité du TAG [voir Etudes cliniques ].
L'innocuité et l'efficacité de CYMBALTA 20 mg pour le traitement du TAG chez les patients pédiatriques de moins de 7 ans n'ont pas été établies.
Fibromyalgie
L'utilisation de CYMBALTA pour le traitement de la fibromyalgie chez les patients âgés de 13 à 17 ans est étayée par un essai contrôlé par placebo de 13 semaines chez 184 patients atteints du syndrome de fibromyalgie juvénile (étude FM-4). CYMBALTA a montré une amélioration par rapport au placebo sur le critère d'évaluation principal, le changement entre le début et la fin du traitement sur le Brief Pain Inventory (BPI) - Modified Short Form: Adolescent Version Évaluation moyenne de la sévérité de la douleur sur 24 heures [voir Etudes cliniques ].
L'innocuité et l'efficacité de CYMBALTA pour le traitement de la fibromyalgie chez les patients de moins de 13 ans n'ont pas été établies.
Trouble dépressif majeur
L'innocuité et l'efficacité de CYMBALTA n'ont pas été établies chez les patients pédiatriques pour le traitement du TDM.
L'efficacité de CYMBALTA n'a pas été démontrée dans deux essais contrôlés par placebo de 10 semaines menés auprès de 800 patients pédiatriques âgés de 7 à 17 ans atteints de TDM (MDD-6 et MDD-7). Ni CYMBALTA ni un contrôle actif (approuvé pour le traitement du TDM pédiatrique) n'étaient supérieurs au placebo.
Les effets indésirables les plus fréquemment observés dans les essais cliniques pédiatriques sur le TDM comprenaient des nausées, des maux de tête, une perte de poids et des douleurs abdominales. Une diminution de l'appétit et une perte de poids ont été observées en association avec l'utilisation d'ISRS et d'IRSN.
Données toxicologiques sur les animaux juvéniles
L'administration de duloxétine à de jeunes rats du jour postnatal 21 (sevrage) au jour postnatal 90 (adulte) a entraîné une diminution du poids corporel qui a persisté à l'âge adulte, mais qui s'est rétablie lorsque le traitement médicamenteux a été interrompu ; maturation sexuelle légèrement retardée (~1,5 jours) chez les femelles, sans aucun effet sur la fertilité; et un retard dans l'apprentissage d'une tâche complexe à l'âge adulte, qui n'a pas été observé après l'arrêt du traitement médicamenteux. Ces effets ont été observés à la dose élevée de 45 mg/kg/jour (2 fois la MRHD, pour un enfant) ; la dose sans effet était de 20 mg/kg/jour (≈1 fois la MRHD, pour un enfant).
Utilisation gériatrique
Exposition gériatrique dans les essais cliniques de précommercialisation de CYMBALTA
- Sur les 2 418 patients des essais sur le TDM, 6 % (143) étaient âgés de 65 ans ou plus.
- Sur les 1 041 patients participant aux essais sur la CLBP, 21 % (221) étaient âgés de 65 ans ou plus.
- Sur les 487 patients des essais sur l'arthrose, 41 % (197) étaient âgés de 65 ans ou plus.
- Sur les 1 074 patients des essais DPNP, 33 % (357) étaient âgés de 65 ans ou plus.
- Sur les 1 761 patients des essais sur la FM, 8 % (140) étaient âgés de 65 ans ou plus.
Dans les études MDD, GAD, DPNP, FM, OA et CLBP, aucune différence globale d'innocuité ou d'efficacité n'a été généralement observée entre ces patients et les patients adultes plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre ces patients gériatriques et plus jeunes. patients adultes, mais une plus grande sensibilité de certains patients plus âgés ne peut être exclue.
Les ISRS et les IRSN, y compris CYMBALTA, ont été associés à une hyponatrémie cliniquement significative chez les patients gériatriques, qui peuvent être plus à risque de présenter cet effet indésirable [voir AVERTISSEMENTS ET PRECAUTIONS ].
Dans une analyse des données de tous les essais contrôlés par placebo, les patients traités par CYMBALTA ont signalé un taux de chutes plus élevé que les patients traités par placebo. Le risque accru semble être proportionnel au risque sous-jacent de chute du patient. Le risque sous-jacent semble augmenter régulièrement avec l'âge. Étant donné que les patients gériatriques ont tendance à avoir une prévalence plus élevée de facteurs de risque de chutes tels que les médicaments, les comorbidités médicales et les troubles de la marche, l'impact de l'augmentation de l'âge sur les chutes pendant le traitement par CYMBALTA 30 mg n'est pas clair. Des chutes avec des conséquences graves, y compris des fractures osseuses et des hospitalisations, ont été signalées avec l'utilisation de CYMBALTA [voir AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ].
La pharmacocinétique de la duloxétine après une dose unique de 40 mg a été comparée chez des femmes âgées en bonne santé (65 à 77 ans) et chez des femmes d'âge moyen en bonne santé (32 à 50 ans). Il n'y avait pas de différence dans la Cmax, mais l'ASC de la duloxétine était quelque peu (environ 25 %) plus élevée et la demi-vie d'environ 4 heures plus longue chez les femmes âgées. Les analyses pharmacocinétiques de population suggèrent que les valeurs typiques de la clairance diminuent d'environ 1 % pour chaque année d'âge entre 25 et 75 ans ; mais l'âge en tant que facteur prédictif ne représente qu'un faible pourcentage de la variabilité inter-patients. Un ajustement posologique en fonction de l'âge du patient adulte n'est pas nécessaire.
Le genre
La demi-vie de la duloxétine est similaire chez les hommes et les femmes. Un ajustement posologique en fonction du sexe n'est pas nécessaire.
Statut de fumeur
La biodisponibilité de la duloxétine (AUC) semble être réduite d'environ un tiers chez les fumeurs. Les modifications de dosage ne sont pas recommandées pour les fumeurs.
Course
Aucune étude pharmacocinétique spécifique n'a été menée pour étudier les effets de la race.
Insuffisance hépatique
Les patients présentant une insuffisance hépatique cliniquement évidente ont une diminution du métabolisme et de l'élimination de la duloxétine. Après une dose unique de 20 mg de CYMBALTA 20 mg, 6 patients cirrhotiques présentant une insuffisance hépatique modérée (classe Child-Pugh B) présentaient une clairance plasmatique moyenne de la duloxétine d'environ 15 % de celle des sujets sains appariés selon l'âge et le sexe, avec une augmentation de 5 fois dans l'exposition moyenne (AUC). Bien que la Cmax ait été similaire à la normale chez les patients cirrhotiques, la demi-vie était environ 3 fois plus longue [voir DOSAGE ET ADMINISTRATION et AVERTISSEMENTS ET PRECAUTIONS ].
Insuffisance rénale sévère
Des données limitées sont disponibles sur les effets de CYMBALTA 40 mg chez les patients atteints d'insuffisance rénale terminale (IRT). Après une dose unique de 60 mg de CYMBALTA 20 mg, les valeurs de la Cmax et de l'ASC étaient environ 100 % plus élevées chez les patients atteints d'IRT recevant une hémodialyse chronique intermittente que chez les sujets ayant une fonction rénale normale. La demi-vie d'élimination, cependant, était similaire dans les deux groupes. Les ASC des principaux métabolites circulants, le glucuronide de 4-hydroxy-duloxétine et le sulfate de 5-hydroxy-6-méthoxy-duloxétine, largement excrétés dans l'urine, étaient environ 7 à 9 fois plus élevées et devraient encore augmenter avec des doses multiples. Les analyses pharmacocinétiques de population suggèrent que des degrés légers à modérés d'insuffisance rénale (ClCr estimée de 30 à 80 ml/min) n'ont aucun effet significatif sur la clairance apparente de la duloxétine [voir DOSAGE ET ADMINISTRATION et AVERTISSEMENTS ET PRECAUTIONS ].
SURDOSAGE
Signes et symptômes
Dans l'expérience post-commercialisation, des cas d'issue fatale ont été rapportés pour des surdosages aigus de CYMBALTA à 60 mg, principalement avec des surdosages mixtes, mais également avec CYMBALTA à 20 mg uniquement, dont 1000 mg de CYMBALTA (environ 8,3 fois la dose maximale recommandée). Les signes et symptômes de surdosage (CYMBALTA seul ou en association) comprenaient la somnolence, le coma, le syndrome sérotoninergique, les convulsions, la syncope, la tachycardie, l'hypotension, l'hypertension et les vomissements.
Gestion du surdosage
Il n'existe pas d'antidote spécifique à un surdosage de CYMBALTA à 60 mg, mais si un syndrome sérotoninergique survient, un traitement spécifique (comme la cyproheptadine et/ou le contrôle de la température) peut être envisagé.
En cas de surdosage aigu avec CYMBALTA 30 mg, le traitement doit consister en les mesures générales employées dans la prise en charge d'un surdosage avec tout médicament, telles que la garantie de voies respiratoires, d'une oxygénation et d'une ventilation adéquates et la surveillance du rythme cardiaque et des signes vitaux. Un lavage gastrique avec une sonde orogastrique de gros diamètre avec une protection appropriée des voies respiratoires, si nécessaire, peut être indiqué s'il est effectué peu de temps après l'ingestion ou chez des patients symptomatiques. L'induction de vomissements n'est pas recommandée.
Le charbon actif peut être utile pour limiter l'absorption de la duloxétine par le tractus gastro-intestinal. Il a été démontré que l'administration de charbon actif diminue l'ASC et la Cmax de la duloxétine d'un tiers en moyenne, bien que certains patients aient eu un effet limité du charbon actif. En raison du grand volume de distribution de la duloxétine, il est peu probable que la diurèse forcée, la dialyse, l'hémoperfusion et l'exsanguinotransfusion soient bénéfiques.
Lors de la prise en charge d'un surdosage, la possibilité d'une implication de plusieurs médicaments doit être envisagée. Une mise en garde particulière concerne les patients qui surdosent avec CYMBALTA 60 mg et les antidépresseurs tricycliques. Dans un tel cas, une diminution de la clairance du tricyclique parent et/ou de son métabolite actif peut augmenter la possibilité de séquelles cliniquement significatives et prolonger le temps nécessaire à une surveillance médicale étroite [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ].
Envisagez de contacter un centre anti-poison (1-800-222-1222 ou www.poison.org) pour des informations supplémentaires sur le traitement du surdosage.
CONTRE-INDICATIONS
L'utilisation des IMAO destinés à traiter les troubles psychiatriques avec CYMBALTA 40 mg ou dans les 5 jours suivant l'arrêt du traitement par CYMBALTA est contre-indiquée en raison d'un risque accru de syndrome sérotoninergique. L'utilisation de CYMBALTA dans les 14 jours suivant l'arrêt d'un IMAO destiné à traiter les troubles psychiatriques est contre-indiquée [voir DOSAGE ET ADMINISTRATION et AVERTISSEMENTS ET PRECAUTIONS ].
Commencer à CYMBALTA 30 mg chez un patient qui est traité avec des IMAO tels que le linézolide ou le bleu de méthylène par voie intraveineuse est également contre-indiqué en raison d'un risque accru de syndrome sérotoninergique [voir DOSAGE ET ADMINISTRATION et AVERTISSEMENTS ET PRECAUTIONS ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Bien que les mécanismes exacts des actions antidépressives, inhibitrices de la douleur centrale et anxiolytiques de la duloxétine chez l'homme soient inconnus, ces actions seraient liées à sa potentialisation de l'activité sérotoninergique et noradrénergique dans le SNC.
Pharmacodynamie
Des études précliniques ont montré que la duloxétine est un puissant inhibiteur de la recapture neuronale de la sérotonine et de la noradrénaline et un inhibiteur moins puissant de la recapture de la dopamine. La duloxétine n'a pas d'affinité significative pour les récepteurs dopaminergiques, adrénergiques, cholinergiques, histaminergiques, opioïdes, glutamate et GABA in vitro. La duloxétine n'inhibe pas la monoamine oxydase (MAO).
CYMBALTA appartient à une classe de médicaments connus pour affecter la résistance urétrale [voir AVERTISSEMENTS ET PRECAUTIONS ].
Électrophysiologie cardiaque
L'effet de CYMBALTA 160 mg et 200 mg administrés deux fois par jour (respectivement 2,7 et 3,3 fois la dose maximale recommandée) sur l'état d'équilibre a été évalué dans une étude croisée randomisée, à double insu et à double entrée chez 117 femmes adultes en bonne santé. Aucun allongement de l'intervalle QT n'a été détecté. CYMBALTA 40 mg semble être associé à un raccourcissement de l'intervalle QT dépendant de la concentration mais non cliniquement significatif.
Pharmacocinétique
La duloxétine a une demi-vie d'élimination d'environ 12 heures (intervalle de 8 à 17 heures) et sa pharmacocinétique est proportionnelle à la dose sur l'intervalle thérapeutique. Les concentrations plasmatiques à l'état d'équilibre sont généralement atteintes après 3 jours d'administration. L'élimination de la duloxétine se fait principalement par métabolisme hépatique impliquant deux isoenzymes P450, CYP1A2 et CYP2D6.
Absorption
Après administration orale de CYMBALTA 30 mg, le chlorhydrate de duloxétine est bien absorbé. Il y a un décalage médian de 2 heures jusqu'au début de l'absorption (Tlag), avec des concentrations plasmatiques maximales (Cmax) de duloxétine survenant 6 heures après l'administration. Il y a un délai d'absorption de 3 heures et une augmentation d'un tiers de la clairance apparente de la duloxétine après une dose du soir par rapport à une dose du matin.
Effet de la nourriture
La nourriture n'affecte pas la Cmax de la duloxétine, mais retarde le temps nécessaire pour atteindre la concentration maximale de 6 à 10 heures et diminue légèrement l'étendue de l'absorption (AUC) d'environ 10 %.
Distribution
Le volume de distribution apparent est en moyenne d'environ 1640 L. La duloxétine est fortement liée (> 90 %) aux protéines du plasma humain, se liant principalement à l'albumine et à la glycoprotéine α1-acide. L'interaction entre la duloxétine et d'autres médicaments fortement liés aux protéines n'a pas été entièrement évaluée. La liaison aux protéines plasmatiques de la duloxétine n'est pas affectée par une insuffisance rénale ou hépatique.
Élimination
Métabolisme
La biotransformation et l'élimination de la duloxétine chez l'homme ont été déterminées après administration orale de duloxétine marquée au 14C. La duloxétine représente environ 3 % du matériel radiomarqué total dans le plasma, ce qui indique qu'elle subit un métabolisme important en de nombreux métabolites. Les principales voies de biotransformation de la duloxétine impliquent l'oxydation du cycle naphtyle suivie d'une conjugaison et d'une oxydation supplémentaire. Le CYP1A2 et le CYP2D6 catalysent l'oxydation du cycle naphtyle in vitro. Les métabolites trouvés dans le plasma comprennent le glucuronide de 4-hydroxy duloxétine et le sulfate de 5-hydroxy, 6-méthoxy duloxétine.
Excrétion
De nombreux métabolites supplémentaires ont été identifiés dans l'urine, certains ne représentant que des voies d'élimination mineures. Seules des traces (
Populations spécifiques
Patients pédiatriques
La concentration plasmatique à l'état d'équilibre de la duloxétine était comparable chez les patients pédiatriques âgés de 7 à 17 ans et chez les patients adultes. La concentration moyenne de duloxétine à l'état d'équilibre était inférieure d'environ 30 % dans cette population pédiatrique par rapport aux patients adultes. Les concentrations plasmatiques à l'état d'équilibre de la duloxétine prédites par le modèle chez les patients pédiatriques âgés de 7 à 17 ans se situaient principalement dans la plage de concentration observée chez les patients adultes et ne dépassaient pas la plage de concentration chez les adultes.
Etudes cliniques
Aperçu des essais cliniques
L'efficacité de CYMBALTA 60 mg a été établie dans les populations suivantes lors d'essais adéquats et bien contrôlés :
Trouble dépressif majeur (TDM)
4 essais à court terme (études MDD-1, MDD-2, MDD-3 et MDD-4) et 1 essai d'entretien (étude MDD-5) chez l'adulte [voir Trouble dépressif majeur chez l'adulte ].
Trouble d'anxiété généralisée (TAG)
3 essais à court terme chez l'adulte (Études GAD-1, GAD-2 et GAD-3), 1 essai d'entretien chez l'adulte (Étude GAD-4), 1 essai à court terme chez les patients gériatriques (Étude GAD-5), et 1 essai à court terme chez des patients pédiatriques âgés de 7 à 17 ans (étude GAD-6) [voir Désordre anxieux généralisé ].
Douleur neuropathique périphérique diabétique (DPNP)
Deux essais de 12 semaines chez des adultes (études DPNP-1 et DPNP-2) [voir Douleur neuropathique périphérique diabétique chez l'adulte ].
Fibromyalgie (FM)
Deux essais chez des adultes (un de 3 mois et un de 6 mois) (Études FM-1 et FM-2) et un essai de 13 semaines chez des patients pédiatriques âgés de 13 à 17 ans (Étude FM-4) [voir Fibromyalgie ].
Douleur musculo-squelettique chronique
Deux essais de 12 à 13 semaines chez des patients adultes souffrant de lombalgie chronique (CLBP) (études CLBP-1 et CLBP-3) et un essai de 13 semaines chez des patients adultes souffrant de douleur chronique due à l'arthrose (OA) (étude OA -1) [voir Douleur musculo-squelettique chronique chez les adultes ].
De plus, un résumé des essais suivants qui n'ont pas démontré d'efficacité est présenté ci-dessous : étude FM-3 (un essai de 16 semaines chez des patients adultes atteints de fibromyalgie), étude CLBP-2 (un essai de 13 semaines chez des patients adultes atteints de CLBP) et Étude OA-2 (un essai de 13 semaines chez des patients adultes souffrant de douleur chronique due à l'arthrose).
Trouble dépressif majeur chez l'adulte
L'efficacité de CYMBALTA comme traitement du TDM chez l'adulte a été établie dans 4 essais randomisés, en double aveugle, contrôlés par placebo et à dose fixe chez des patients externes adultes (18 à 83 ans) répondant aux critères du DSM-IV pour le TDM :
- Dans les études MDD-1 et MDD-2, les patients ont été randomisés pour recevoir CYMBALTA à 60 mg une fois par jour (N=123 et N=128, respectivement) ou un placebo (N=122 et N=139, respectivement) pendant 9 semaines.
- Dans l'étude MDD-3, les patients ont été randomisés pour recevoir CYMBALTA 20 ou 40 mg deux fois par jour (N = 86 et N = 91, respectivement) ou un placebo (N = 89) pendant 8 semaines
- Dans l'étude MDD-4, les patients ont été randomisés pour recevoir CYMBALTA à 40 ou 60 mg deux fois par jour (N = 95 et N = 93, respectivement) ou un placebo (N = 93) pendant 8 semaines.
Dans les quatre essais, CYMBALTA à 40 mg a démontré une supériorité par rapport au placebo, mesurée par l'amélioration du score total à 17 éléments de l'échelle d'évaluation de la dépression de Hamilton (HAMD-17) (voir ). Il n'y a aucune preuve que des doses supérieures à 60 mg/jour confèrent des avantages supplémentaires.
Dans tous ces essais cliniques, les analyses de la relation entre les résultats du traitement et l'âge, le sexe et la race n'ont suggéré aucune réactivité différentielle sur la base de ces caractéristiques des patients.
Étude MDD-1 CYMBALTA (60 mg/jour)b Placebo 21,5 (4,10) 21,1 (3,71) -10,9 (0,70) -6,1 (0,69) -4,9 (-6,8, -2,9) --
Dans l'étude MDD-5, 533 patients adultes répondant aux critères du DSM-IV pour le TDM ont reçu 60 mg de CYMBALTA une fois par jour au cours d'une phase initiale de traitement en ouvert de 12 semaines. Deux cent soixante-dix-huit patients ayant répondu au traitement en ouvert [définis comme répondant aux critères suivants aux semaines 10 et 12 : un score total HAMD-17 ≤ 9, des impressions cliniques globales de sévérité (CGI-S) ≤ 2, et non répondant aux critères du DSM-IV pour le TDM] ont été assignés au hasard à la poursuite de CYMBALTA à la même posologie (N = 136) ou au placebo (N = 142) pendant 6 mois.
Dans l'étude MDD-5, les patients sous CYMBALTA ont présenté un délai statistiquement significativement plus long avant la rechute de la dépression que les patients sous placebo (voir Figure 1 ). La rechute a été définie comme une augmentation du score CGI-S de ≥ 2 points par rapport à celui obtenu à la semaine 12, ainsi que la satisfaction des critères du DSM-IV pour le TDM lors de 2 visites consécutives à au moins 2 semaines d'intervalle, où les 2 semaines le critère temporel ne devait être satisfait qu'à la deuxième visite.
Figure 1 : Proportion cumulée de patients adultes présentant une rechute du TDM (étude MDD-5)
Désordre anxieux généralisé
Essais GAD chez les adultes (y compris les patients gériatriques)
L'efficacité de CYMBALTA 20 mg dans le traitement du trouble anxieux généralisé (TAG) a été établie dans 1 essai randomisé à dose fixe, en double aveugle, contrôlé par placebo et 2 essais randomisés à dose flexible, en double aveugle, contrôlés par placebo chez des patients adultes ambulatoires entre 18 et 83 ans répondant aux critères du DSM-IV pour le TAG (études GAD-1, GAD-2 et GAD-3, respectivement).
Dans les études GAD-1 et GAD-2, la dose initiale était de 60 mg une fois par jour (une réduction à 30 mg une fois par jour était autorisée pour des raisons de tolérance ; la posologie pouvait être augmentée à 60 mg une fois par jour). Quinze pour cent des patients ont été titrés à la baisse. L'étude GAD-3 avait une dose initiale de 30 mg une fois par jour pendant 1 semaine avant de l'augmenter à 60 mg une fois par jour.
Les études GAD-2 et GAD-3 impliquaient une titration de la dose avec des doses de CYMBALTA allant de 60 mg une fois par jour à 120 mg une fois par jour (N = 168 et N = 162) par rapport au placebo (N = 159 et N = 161) sur une période de 10 - période de traitement d'une semaine. La posologie moyenne pour les finissants au point final de ces essais était de 104,8 mg/jour. L'étude GAD-1 a évalué des doses de 60 mg de CYMBALTA de 60 mg une fois par jour (N = 168) et de 120 mg une fois par jour (N = 170) par rapport à un placebo (N = 175) sur une période de traitement de 9 semaines. Alors qu'une dose de 120 mg/jour s'est avérée efficace, rien ne prouve que des doses supérieures à 60 mg/jour confèrent un bénéfice supplémentaire.
Dans les 3 essais, CYMBALTA a démontré une supériorité par rapport au placebo, mesurée par une plus grande amélioration du score total de l'échelle d'anxiété de Hamilton (HAM-A) (voir ) et par le score global de déficience fonctionnelle de l'échelle d'incapacité de Sheehan (SDS). Le SDS est une mesure composite de la mesure dans laquelle les symptômes émotionnels perturbent le fonctionnement du patient dans 3 domaines de la vie : travail/école, vie sociale/loisirs et vie familiale/responsabilités domestiques.
Dans l'étude GAD-4, 887 patients répondant aux critères du DSM-IV-TR pour le TAG ont reçu CYMBALTA à raison de 60 mg à 120 mg une fois par jour au cours d'une phase initiale de traitement en ouvert de 26 semaines. Quatre cent vingt-neuf patients qui ont répondu au traitement en ouvert [définis comme répondant aux critères suivants aux semaines 24 et 26 : une diminution d'au moins 50 % du score total HAM-A initial à un score ne dépassant pas 11, et un score Clinical Global Impressions of Improvement (CGI-Improvement) de 1 ou 2] ont été assignés au hasard à la poursuite de CYMBALTA 30 mg à la même posologie (N = 216) ou au placebo (N = 213) et ont été observés en cas de rechute. Parmi les patients randomisés, 73 % étaient répondeurs depuis au moins 10 semaines. La rechute a été définie comme une augmentation du score CGI-Severity d'au moins 2 points jusqu'à un score ≥4 et un diagnostic MINI (Mini-International Neuropsychiatric Interview) de TAG (hors durée), ou un arrêt pour manque d'efficacité. Les patients prenant CYMBALTA ont présenté un délai statistiquement significativement plus long avant la rechute du TAG que les patients prenant le placebo (voir Figure 2 ).
Les analyses de sous-groupes n'ont pas indiqué qu'il y avait des différences dans les résultats du traitement en fonction de l'âge ou du sexe.
Essai GAD chez des patients gériatriques
L'efficacité de CYMBALTA dans le traitement des patients ≥ 65 ans atteints de TAG a été établie dans un essai de 10 semaines à dose flexible, randomisé, en double aveugle, contrôlé par placebo chez des adultes ≥ 65 ans répondant aux critères du DSM-IV pour GAD (Etude GAD-5). Dans l'étude GAD-5, la dose initiale était de 30 mg une fois par jour pendant 2 semaines avant que d'autres augmentations de dose par paliers de 30 mg aux semaines de traitement 2, 4 et 7 jusqu'à 120 mg une fois par jour soient autorisées en fonction du jugement de l'investigateur sur la réponse clinique et tolérabilité. La posologie moyenne pour les patients ayant terminé la phase de traitement aigu de 10 semaines était de 51 mg. Les patients traités par CYMBALTA (N = 151) ont démontré une amélioration significativement plus importante par rapport au placebo (N = 140) sur le changement moyen de la ligne de base au point final, tel que mesuré par le score total HAM-A (voir ).
Essai GAD chez des patients pédiatriques âgés de 7 à 17 ans
L'efficacité de CYMBALTA dans le traitement de patients pédiatriques âgés de 7 à 17 ans atteints de TAG a été établie dans 1 essai à dose flexible, randomisé, en double aveugle, contrôlé par placebo chez des patients externes pédiatriques atteints de TAG (basé sur les critères du DSM-IV) (Étude GAD-6).
Dans l'étude GAD-6, la posologie initiale était de 30 mg une fois par jour pendant 2 semaines. D'autres augmentations de dose par paliers de 30 mg jusqu'à 120 mg une fois par jour ont été autorisées en fonction du jugement de l'investigateur sur la réponse clinique et la tolérabilité. La posologie moyenne pour les patients ayant terminé la phase de traitement de 10 semaines était de 57,6 mg/jour. Dans cette étude, CYMBALTA (N = 135) a démontré une supériorité sur le placebo (N = 137) du début à la fin, telle que mesurée par une plus grande amélioration de l'échelle d'évaluation de l'anxiété pédiatrique (PARS) pour le score de sévérité du TAG (voir ).
Figure 2 : Proportion cumulée de patients adultes présentant une rechute de TAG (étude GAD-4)
Douleur neuropathique périphérique diabétique chez l'adulte
L'efficacité de CYMBALTA 30 mg pour la prise en charge de la douleur neuropathique associée à la neuropathie périphérique diabétique chez l'adulte a été établie dans 2 essais randomisés, à double insu, contrôlés par placebo et à dose fixe de 12 semaines chez des patients adultes souffrant de douleur neuropathique périphérique diabétique (DPNP ) pendant au moins 6 mois (Étude DPNP-1 et Étude DPNP-2). Ces essais ont inscrit un total de 791 patients dont 592 (75 %) ont terminé les essais. Les patients inclus avaient un diabète sucré de type I ou II avec un diagnostic de polyneuropathie sensorimotrice symétrique distale douloureuse depuis au moins 6 mois. Les patients avaient un score de douleur de base ≥4 sur une échelle de 11 points allant de 0 (pas de douleur) à 10 (pire douleur possible). Les patients étaient autorisés à prendre jusqu'à 4 grammes d'acétaminophène par jour au besoin pour soulager la douleur, en plus de CYMBALTA. Les patients notaient quotidiennement leur douleur dans un journal.
Les deux essais ont comparé CYMBALTA 60 mg une fois par jour ou 60 mg deux fois par jour avec un placebo. L'étude DPNP-1 a également comparé CYMBALTA 20 mg à un placebo. Un total de 457 patients (342 CYMBALTA, 115 placebo) ont été inscrits à l'étude DPNP-1 et un total de 334 patients (226 CYMBALTA, 108 placebo) ont été inscrits à l'étude DPNP-2.
Le traitement par CYMBALTA à 60 mg une ou deux fois par jour a amélioré de manière statistiquement significative les scores moyens de douleur par rapport à l'inclusion et a augmenté la proportion de patients présentant une réduction d'au moins 50 % des scores de douleur par rapport à l'inclusion. Pour divers degrés d'amélioration de la douleur entre le début et le point final de l'étude, les figures 3 et 4 montrent la fraction de patients atteignant ce degré d'amélioration dans les études DPNP-1 et DPNP-2, respectivement. Les chiffres sont cumulatifs, de sorte que les patients dont le changement par rapport au départ est, par exemple, de 50 %, sont également inclus à chaque niveau d'amélioration inférieur à 50 %. Les patients qui n'ont pas terminé l'essai ont reçu une amélioration de 0 %. Certains patients ont ressenti une diminution de la douleur dès la semaine 1, qui a persisté tout au long de l'essai.
Figure 3 : Pourcentage de patients adultes DPNP atteignant divers niveaux de soulagement de la douleur, mesurés par l'intensité moyenne de la douleur sur 24 heures (étude DPNP-1)
Figure 4 : Pourcentage de patients adultes DPNP atteignant divers niveaux de soulagement de la douleur, mesurés par l'intensité moyenne de la douleur sur 24 heures (étude DPNP-2)
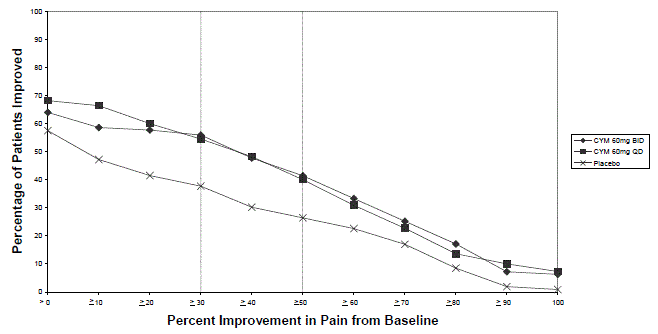
Fibromyalgie
Essais adultes sur la fibromyalgie
L'efficacité de CYMBALTA pour la prise en charge de la fibromyalgie chez l'adulte a été établie dans deux essais randomisés, en double aveugle, contrôlés par placebo et à dose fixe chez des patients adultes répondant aux critères de l'American College of Rheumatology pour la fibromyalgie (antécédents de douleur généralisée depuis 3 mois , et douleur présente à 11 ou plus des 18 sites spécifiques de points sensibles). L'étude FM-1 a duré trois mois et n'a recruté que des patientes. L'étude FM-2 a duré six mois et a recruté des hommes et des femmes. Environ 25 % des participants avaient un diagnostic comorbide de TDM. Les études FM1 et FM-2 ont recruté un total de 874 patients dont 541 (62 %) ont terminé les essais. Un total de 354 patients (234 CYMBALTA 40 mg, 120 placebo) ont été inscrits à l'étude FM-1 et un total de 520 patients (376 CYMBALTA, 144 placebo) ont été inscrits à l'étude FM-2 (5 % d'hommes, 95 % de femmes). Les patients avaient un score de douleur de base de 6,5 sur une échelle de 11 points allant de 0 (pas de douleur) à 10 (pire douleur possible).
Les études FM-1 et FM-2 ont comparé CYMBALTA à 60 mg une fois par jour ou à 120 mg par jour (administré en doses fractionnées dans l'étude FM-1 et en une seule dose quotidienne dans l'étude FM-2) à un placebo. L'étude FM-2 a également comparé CYMBALTA 20 mg à un placebo au cours des trois premiers mois d'un essai de six mois.
Le traitement par CYMBALTA à raison de 60 mg ou de 120 mg par jour a amélioré de manière statistiquement significative les scores de douleur moyens par rapport au départ et a augmenté la proportion de patients présentant une réduction d'au moins 50 % du score de douleur par rapport au départ. Une réduction de la douleur a été observée chez les patients avec et sans TDM comorbide. Cependant, le degré de réduction de la douleur peut être plus important chez les patients atteints de TDM comorbide. Pour divers degrés d'amélioration de la douleur entre le début et le point final de l'étude, les figures 5 et 6 montrent la fraction de patients atteignant ce degré d'amélioration dans les études FM-1 et FM-2, respectivement. Les chiffres sont cumulatifs afin que les patients dont le changement par rapport au départ est, par exemple, de 50 %, soient également inclus à chaque niveau d'amélioration inférieur à 50 %. Les patients qui n'ont pas terminé l'essai ont reçu une amélioration de 0 %. Certains patients ont ressenti une diminution de la douleur dès la semaine 1, qui a persisté tout au long de l'essai. Une amélioration a également été démontrée sur les mesures de la fonction (questionnaires sur l'impact de la fibromyalgie) et l'impression globale de changement (PGI) du patient. Aucun des deux essais n'a démontré un bénéfice de 120 mg par rapport à 60 mg, et une dose plus élevée a été associée à davantage d'effets indésirables et à des arrêts prématurés du traitement.
Figure 5 : Pourcentage de patients adultes atteints de fibromyalgie atteignant divers niveaux de soulagement de la douleur au point final de l'étude, mesuré par l'intensité moyenne de la douleur sur 24 heures (étude FM-1)
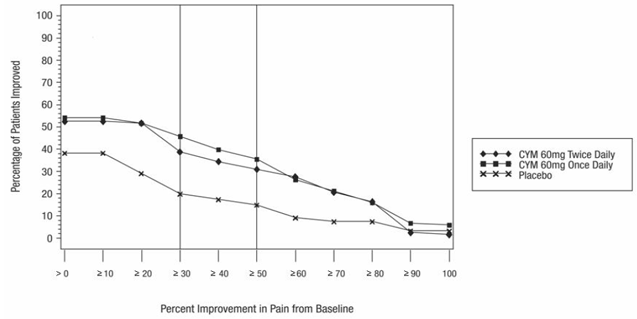
Figure 6 : Pourcentage de patients adultes atteints de fibromyalgie atteignant divers niveaux de soulagement de la douleur au point final de l'étude, mesuré par l'intensité moyenne de la douleur sur 24 heures (étude FM-2)
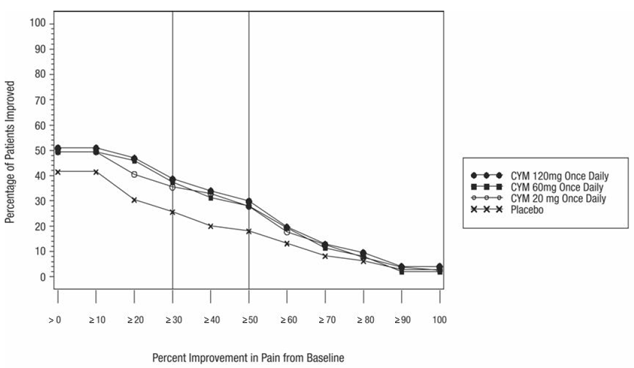
De plus, le bénéfice d'une augmentation de la dose chez les non-répondeurs à CYMBALTA à 60 mg/jour a été évalué dans un essai distinct (étude FM-3). Les patients adultes ont été initialement traités par CYMBALTA 60 mg une fois par jour pendant huit semaines en mode ouvert. Par la suite, les personnes ayant terminé cette phase ont été randomisées pour recevoir un traitement en double aveugle par CYMBALTA à raison de 60 mg une fois par jour ou de 120 mg une fois par jour. Les répondeurs ont été définis comme des patients qui présentaient une réduction d'au moins 30 % du score de douleur par rapport au départ à la fin du traitement de 8 semaines. Les patients qui n'avaient pas répondu à 8 semaines n'étaient pas plus susceptibles de répondre aux critères de réponse à la fin des 60 semaines de traitement s'ils étaient titrés en aveugle à CYMBALTA 120 mg par rapport à ceux qui avaient poursuivi aveuglément CYMBALTA 60 mg.
Essai pédiatrique sur la fibromyalgie
CYMBALTA a été étudié chez 184 patients pédiatriques âgés de 13 à 17 ans atteints du syndrome de fibromyalgie juvénile dans le cadre d'un essai contrôlé par placebo de 13 semaines (étude FM-4). Dans l'étude FM-4, 149 (81 %) patients ont terminé l'essai. CYMBALTA (N = 91) a été initié à une dose de 30 mg une fois par jour pendant une semaine et titré à 60 mg une fois par jour pendant 12 semaines, selon la tolérance. La posologie moyenne pour les patients ayant terminé la phase de traitement de 12 semaines était de 49 mg/jour. CYMBALTA a montré une amélioration par rapport au placebo sur le critère d'évaluation principal [changement entre le début et la fin du traitement sur le Brief Pain Inventory (BPI) - Modified Short Form: Adolescent Version 24-hour average pain gravity rating] avec une valeur de p de 0,052 à partir de l'analyse primaire prédéfinie et des valeurs de p allant de 0,011 à 0,020 à partir d'analyses de sensibilité qui ont attribué des valeurs de base aux évaluations manquantes de certains patients qui n'ont pas terminé l'essai pour diverses raisons. Les patients avaient un BPI initial de 5,7. Pour divers degrés d'amélioration de la douleur entre le début et le point final de l'étude, la figure 7 montre la fraction de patients atteignant ce degré d'amélioration dans l'étude FM-4.
Figure 7 : Pourcentage de patients pédiatriques âgés de 13 à 17 ans atteints du syndrome de fibromyalgie juvénile atteignant divers niveaux de soulagement de la douleur à la semaine 12 (étude FM-4)a
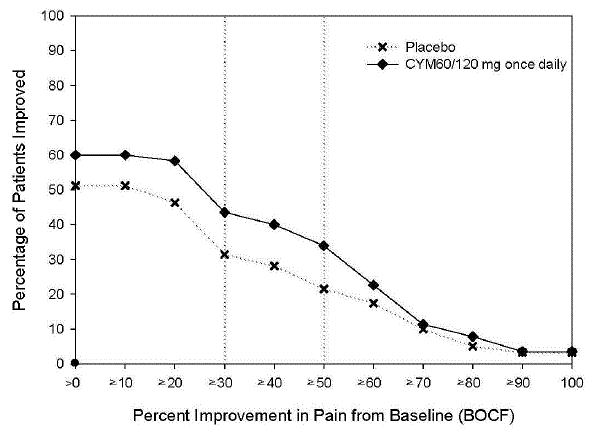
Douleur musculo-squelettique chronique chez l'adulte
CYMBALTA est indiqué pour le traitement des douleurs musculo-squelettiques chroniques chez l'adulte. Cela a été établi dans des essais chez des patients adultes souffrant de lombalgies chroniques et de douleurs chroniques dues à l'arthrose.
Essais sur la lombalgie chronique chez l'adulte
L'efficacité de CYMBALTA à 60 mg dans la lombalgie chronique (CLBP) chez l'adulte a été évaluée dans deux essais cliniques randomisés, en double aveugle, contrôlés par placebo, d'une durée de 13 semaines (études CLBP-1 et CLBP-2), et l'un des 12 -durée de semaines (CLBP-3). Les études CLBP-1 et CLBP-3 ont démontré l'efficacité de CYMBALTA dans le traitement de la CLBP. Les patients de tous les essais ne présentaient aucun signe de radiculopathie ou de sténose spinale.
Étude CLBP-1
Deux cent trente-six patients adultes (N = 115 sous CYMBALTA 40 mg, N = 121 sous placebo) se sont inscrits et 182 (77 %) ont terminé la phase de traitement de 13 semaines. Après 7 semaines de traitement, les patients traités par CYMBALTA présentant une réduction de moins de 30 % de la douleur quotidienne moyenne et qui étaient capables de tolérer 60 mg une fois par jour ont vu leur posologie de CYMBALTA, en double aveugle, augmentée à 120 mg une fois par jour pour le reste du procès. Les patients avaient une cote de douleur initiale moyenne de 6 sur une échelle d'évaluation numérique allant de 0 (pas de douleur) à 10 (pire douleur possible). Après 13 semaines de traitement, les patients prenant CYMBALTA à raison de 60 à 120 mg par jour ont présenté une réduction de la douleur significativement plus importante que les patients prenant un placebo. La randomisation a été stratifiée en fonction du statut d'utilisation des AINS à l'inclusion des patients. Les analyses de sous-groupes n'ont pas indiqué qu'il y avait des différences dans les résultats du traitement en fonction de l'utilisation des AINS.
Étude CLBP-2
Quatre cent quatre patients ont été randomisés pour recevoir des doses fixes de CYMBALTA 60 mg par jour ou un placebo correspondant (N = 59 sous CYMBALTA 20 mg, N = 116 sous CYMBALTA 60 mg, N = 112 sous CYMBALTA 120 mg, N = 117 sous placebo) et 267 (66 %) ont terminé l'intégralité de l'essai de 13 semaines. Après 13 semaines de traitement, aucune des trois doses de CYMBALTA à 30 mg n'a montré de différence statistiquement significative dans la réduction de la douleur par rapport au placebo.
Étude CLBP-3
Quatre cent un patients ont été randomisés pour recevoir des doses fixes de CYMBALTA 60 mg par jour ou un placebo (N = 198 sous CYMBALTA 20 mg, N = 203 sous placebo) et 303 (76 %) ont terminé l'essai. Les patients avaient une cote de douleur initiale moyenne de 6 sur une échelle d'évaluation numérique allant de 0 (pas de douleur) à 10 (pire douleur possible). Après 12 semaines de traitement, les patients prenant CYMBALTA à 60 mg par jour ont présenté une réduction de la douleur significativement plus importante que les patients prenant un placebo.
Pour divers degrés d'amélioration de la douleur entre le début et le point final de l'étude, les figures 8 et 9 montrent la fraction de patients des études CLBP-1 et CLBP-3 atteignant ce degré d'amélioration, respectivement. Les chiffres sont cumulatifs, de sorte que les patients dont le changement par rapport au départ est, par exemple, de 50 %, sont également inclus à chaque niveau d'amélioration inférieur à 50 %. Les patients qui n'ont pas terminé l'essai ont reçu la valeur de 0 % d'amélioration.
Figure 8 : Pourcentage de patients adultes atteints de CLBP atteignant divers niveaux de soulagement de la douleur, mesurés par l'intensité moyenne de la douleur sur 24 heures (étude CLBP-1)
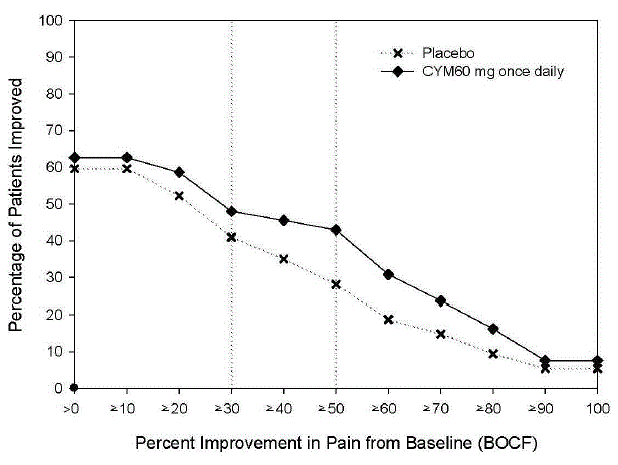
Figure 9 : Pourcentage de patients adultes atteints de CLBP atteignant divers niveaux de soulagement de la douleur, mesurés par l'intensité moyenne de la douleur sur 24 heures (étude CLBP-3)
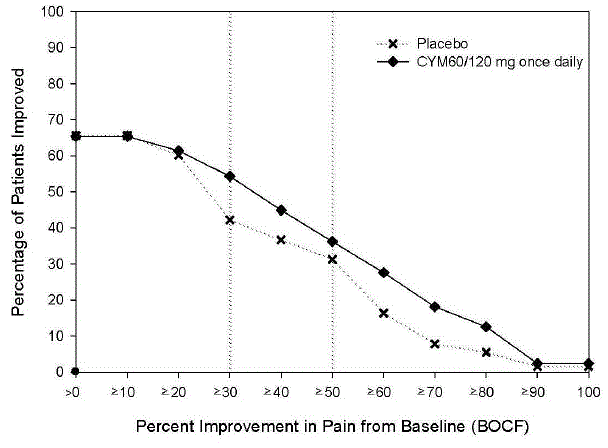
Essais sur la douleur chronique due à l'arthrose chez l'adulte
L'efficacité de CYMBALTA dans la douleur chronique due à l'arthrose (OA) chez l'adulte a été évaluée dans 2 essais cliniques randomisés, en double aveugle, contrôlés par placebo, d'une durée de 13 semaines (étude OA-1 et étude OA-2). Tous les patients des deux essais remplissaient les critères cliniques et radiographiques de l'ACR pour la classification de l'arthrose idiopathique du genou. La randomisation a été stratifiée en fonction du statut initial des patients en matière d'utilisation des AINS.
Les patients assignés à CYMBALTA ont commencé le traitement dans les deux essais à une dose de 30 mg une fois par jour pendant une semaine. Après la première semaine, la dose de CYMBALTA a été augmentée à 60 mg une fois par jour. Après 7 semaines de traitement par CYMBALTA à 60 mg une fois par jour, dans l'étude OA-1, les patients présentant une réponse sous-optimale au traitement (réduction de la douleur
Étude OA-1
Deux cent cinquante-six patients (N = 128 sous CYMBALTA 30 mg, N = 128 sous placebo) se sont inscrits et 204 (80 %) ont terminé l'essai. Les patients avaient une cote de douleur initiale moyenne de 6 sur une échelle d'évaluation numérique allant de 0 (pas de douleur) à 10 (pire douleur possible). Après 13 semaines de traitement, les patients prenant CYMBALTA 20 mg ont présenté une réduction de la douleur significativement plus importante que les patients prenant un placebo. Les analyses de sous-groupes n'ont pas indiqué qu'il y avait des différences dans les résultats du traitement en fonction de l'utilisation des AINS.
Étude OA-2
Deux cent trente et un patients (N = 111 sous CYMBALTA 30 mg, N = 120 sous placebo) se sont inscrits et 173 (75 %) ont terminé l'essai. Les patients avaient une douleur initiale moyenne de 6 sur une échelle d'évaluation numérique allant de 0 (pas de douleur) à 10 (pire douleur possible). Après 13 semaines de traitement, les patients prenant CYMBALTA 20 mg n'ont pas montré une réduction significativement plus importante de la douleur que les patients prenant un placebo.
Dans l'étude OA-1, pour divers degrés d'amélioration de la douleur entre le début et le point final de l'étude, la figure 10 montre la fraction de patients atteignant ce degré d'amélioration. Le chiffre est cumulatif, de sorte que les patients dont le changement par rapport au départ est, par exemple, de 50 %, sont également inclus à chaque niveau d'amélioration inférieur à 50 %. Les patients qui n'ont pas terminé l'essai ont reçu la valeur de 0 % d'amélioration.
Figure 10 : Pourcentage de patients adultes atteints d'arthrose atteignant divers niveaux de soulagement de la douleur, mesurés par l'intensité moyenne de la douleur sur 24 heures (étude OA-1)
INFORMATIONS PATIENTS
Cymbalta® [sim-BALL-tah] (capsules à libération retardée de duloxétine)
Lisez ce guide de médication avant que vous commenciez à prendre Cymbalta® et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas la discussion avec votre fournisseur de soins de santé au sujet de votre état de santé ou de votre traitement.
Parlez à votre fournisseur de soins de santé de :
- tous les risques et avantages du traitement avec des antidépresseurs
- tous les choix de traitement pour la dépression ou d'autres maladies mentales graves
Quelles sont les informations les plus importantes que je devrais connaître sur les médicaments antidépresseurs, la dépression, les autres maladies mentales graves et les pensées ou actions suicidaires ?
- Portez une attention particulière à tout changement d'humeur, de comportement, d'actions, de pensées ou de sentiments, en particulier les changements soudains. Ceci est très important lorsqu'un médicament antidépresseur est commencé ou lorsque la dose est modifiée.
- Appelez immédiatement votre fournisseur de soins de santé pour signaler des changements nouveaux ou soudains d'humeur, de comportement, de pensées ou de sentiments.
- Gardez toutes les visites de suivi avec votre fournisseur de soins de santé comme prévu. Appelez votre fournisseur de soins de santé entre les visites au besoin, surtout si vous avez des inquiétudes au sujet des symptômes.
Appelez immédiatement votre fournisseur de soins de santé si vous présentez l'un des symptômes ou sentiments suivants, en particulier s'ils sont nouveaux, s'aggravent ou vous inquiètent. En cas d'urgence, composez le 911.
- tentatives de suicide
- agir sur des impulsions dangereuses
- agir de manière agressive, être en colère ou violent
- pensées sur le suicide ou la mort
- dépression nouvelle ou pire
- anxiété nouvelle ou pire
- crises de panique
- se sentir très agité ou agité
- irritabilité nouvelle ou pire
- troubles du sommeil
- une augmentation extrême de l'activité ou de la conversation (manie)
- autres changements inhabituels de comportement ou d'humeur
Que dois-je savoir d'autre sur les médicaments antidépresseurs ?
- N'arrêtez jamais un médicament antidépresseur sans en parler d'abord à un fournisseur de soins de santé. L'arrêt soudain d'un médicament antidépresseur peut provoquer d'autres symptômes.
- Les antidépresseurs sont des médicaments utilisés pour traiter la dépression et d'autres maladies. Il est important de discuter de tous les risques de traiter la dépression et aussi des risques de ne pas la traiter. Les patients doivent discuter de tous les choix de traitement avec leur fournisseur de soins de santé, et pas seulement de l'utilisation d'antidépresseurs.
- Les antidépresseurs ont d'autres effets secondaires. Parlez à votre fournisseur de soins de santé des effets secondaires du médicament prescrit pour vous ou un membre de votre famille.
- Les médicaments antidépresseurs peuvent interagir avec d'autres médicaments. Connaissez tous les médicaments que vous ou un membre de votre famille prenez. Gardez une liste de tous les médicaments à montrer à votre fournisseur de soins de santé. Ne commencez pas de nouveaux médicaments sans d'abord consulter votre fournisseur de soins de santé.
Qu'est-ce que Cymbalta 60 mg ?
Cymbalta est un médicament sur ordonnance utilisé pour traiter un certain type de dépression appelé trouble dépressif majeur (TDM). Cymbalta 20 mg appartient à une classe de médicaments connus sous le nom d'IRSN (inhibiteurs de la recapture de l'orsérotonine-norépinéphrine).
Cymbalta 60 mg est également utilisé pour traiter ou gérer :
- Trouble d'anxiété généralisée (TAG)
- Douleur neuropathique périphérique diabétique (DPNP)
- Fibromyalgie (FM)
- Douleur musculo-squelettique chronique
Qui ne devrait pas prendre Cymbalta ?
Ne prenez pas Cymbalta 20 mg si vous :
- prenez un inhibiteur de la monoamine oxydase (IMAO). Demandez à votre fournisseur de soins de santé ou à votre pharmacien si vous n'êtes pas sûr de prendre un IMAO, y compris l'antibiotique linézolide ou le bleu de méthylène par voie intraveineuse.
- Ne prenez pas d'IMAO dans les 5 jours suivant l'arrêt de Cymbalta, sauf indication contraire de votre fournisseur de soins de santé.
- Ne commencez pas Cymbalta si vous avez arrêté de prendre un IMAO au cours des 14 derniers jours, sauf indication contraire de votre professionnel de la santé.
Les personnes qui prennent Cymbalta 60 mg peu de temps après un IMAO peuvent avoir un problème grave appelé syndrome sérotoninergique (voir « Quels sont les effets secondaires possibles de Cymbalta 60 mg ? »).
Que dois-je dire à mon fournisseur de soins de santé avant de prendre Cymbalta ?
Avant de commencer Cymbalta, informez votre fournisseur de soins de santé si vous :
- avez des problèmes cardiaques ou une pression artérielle élevée
- souffrez de diabète (le traitement par Cymbalta 40 mg rend plus difficile pour certaines personnes atteintes de diabète de contrôler leur glycémie)
- avoir des problèmes de foie
- avoir des problèmes rénaux
- avoir un glaucome
- avez ou avez eu des convulsions ou des convulsions
- souffrez de trouble bipolaire ou de manie
- avez un faible taux de sodium dans le sang
- ont retardé la vidange de l'estomac
- avez ou avez eu des problèmes de saignement
- êtes enceinte ou envisagez de devenir enceinte. Cymbalta peut nuire à votre bébé à naître. Parlez à votre fournisseur de soins de santé du risque pour votre bébé à naître si vous prenez Cymbalta pendant la grossesse.
- Informez immédiatement votre fournisseur de soins de santé si vous tombez enceinte ou pensez être enceinte pendant le traitement par Cymbalta.
- Si vous tombez enceinte pendant que vous prenez Cymbalta 30 mg, parlez-en à votre professionnel de la santé pour vous inscrire au registre des grossesses de Cymbalta. Vous pouvez vous inscrire en appelant le 1-866-8146975 ou en visitant www.cymbalta 40mgpregnancyregistry.com. Le but de ce registre est de surveiller les résultats de la grossesse chez les femmes qui ont été traitées par Cymbalta à tout moment de la grossesse.
- allaitez ou envisagez d'allaiter. Cymbalta passe dans votre lait maternel et peut nuire à votre bébé. Discutez avec votre fournisseur de soins de santé de la meilleure façon de nourrir votre bébé pendant que vous prenez Cymbalta.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Cymbalta et certains médicaments peuvent interagir les uns avec les autres, peuvent ne pas fonctionner aussi bien ou peuvent provoquer des effets secondaires graves.
Informez particulièrement votre fournisseur de soins de santé si vous prenez :
- triptans utilisés pour traiter la migraine
- médicaments utilisés pour traiter l'humeur, l'anxiété, les troubles psychotiques ou de la pensée, y compris les tricycliques, le lithium, la buspirone, les ISRS, les IRSN ou les IMAO
- tramadol et fentanyl
- amphétamines
- cimétidine
- les antibiotiques ciprofloxacine, énoxacine
- médicament pour traiter le rythme cardiaque irrégulier (comme la propafénone, la flécaïnide, la quinidine)
- théophylline
- l'anticoagulant warfarine (Coumadin, Jantoven)
- anti-inflammatoire non stéroïdien (AINS) (comme l'ibuprofène, le naproxène ou l'aspirine).
- suppléments en vente libre tels que le tryptophane ou le millepertuis
- thioridazine (Mellaril). Mellaril associé à Cymbalta peut provoquer de graves problèmes de rythme cardiaque ou une mort subite.
Demandez à votre fournisseur de soins de santé une liste de ces médicaments si vous n'êtes pas sûr.
Ne prenez pas Cymbalta avec d'autres médicaments contenant de la duloxétine.
Comment dois-je prendre Cymbalta 60 mg ?
- Prenez Cymbalta exactement comme votre professionnel de la santé vous a dit de le prendre. Votre professionnel de la santé devra peut-être modifier la dose de Cymbalta 20 mg jusqu'à ce qu'elle soit la bonne dose pour vous.
- Avalez Cymbalta entier. Ne pas mâcher ou écraser Cymbalta.
- Ne pas ouvrir la gélule et saupoudrer sur les aliments ou mélanger avec des liquides. L'ouverture de la capsule peut affecter l'efficacité de Cymbalta.
- Cymbalta peut être pris avec ou sans nourriture.
- Si vous oubliez une dose de Cymbalta 30 mg, prenez la dose oubliée dès que vous vous en souvenez. S'il est presque temps de prendre la dose suivante, sautez la dose oubliée et prenez la dose suivante à l'heure habituelle. Ne prenez pas deux doses de Cymbalta 30 mg en même temps.
- Si vous avez pris trop de Cymbalta, appelez immédiatement votre fournisseur de soins de santé ou votre centre antipoison au 1800-222-1222, ou obtenez un traitement d'urgence.
- Lors du passage d'un autre antidépresseur à Cymbalta, votre fournisseur de soins de santé peut vouloir réduire d'abord la dose de l'antidépresseur initial pour éviter potentiellement les effets secondaires.
Que dois-je éviter en prenant Cymbalta?
- Cymbalta peut causer de la somnolence ou affecter votre capacité à prendre des décisions, à penser clairement ou à réagir rapidement. Vous ne devez pas conduire, utiliser des machines lourdes ou faire d'autres activités dangereuses jusqu'à ce que vous sachiez comment Cymbalta vous affecte.
- L'utilisation concomitante de Cymbalta avec une forte consommation d'alcool peut être associée à des lésions hépatiques graves. Évitez la consommation excessive d'alcool pendant la prise de Cymbalta.
Quels sont les effets secondaires possibles de Cymbalta ?
Cymbalta 30 mg peut provoquer des effets secondaires graves, notamment : Voir « Quelles sont les informations les plus importantes que je devrais connaître sur Cymbalta ? »
Les effets secondaires possibles courants chez les personnes qui prennent Cymbalta 20 mg incluent :
Les symptômes chez les hommes peuvent inclure :
Les symptômes chez les femmes peuvent inclure :
Parlez à votre fournisseur de soins de santé si vous développez des changements dans votre fonction sexuelle ou si vous avez des questions ou des préoccupations concernant des problèmes sexuels pendant le traitement par CYMBALTA. Il peut y avoir des traitements que votre fournisseur de soins de santé peut suggérer.
- démangeaison
- douleur abdominale haute droite
- urine foncée
- peau ou yeux jaunes
- foie hypertrophié
- augmentation des enzymes hépatiques
- augmenter votre tension artérielle.
- diminuez votre tension artérielle en position debout et provoquez des étourdissements ou des évanouissements, principalement lors du premier démarrage de Cymbalta ou lors de l'augmentation de la dose.
- augmentent le risque de chutes, en particulier chez les personnes âgées.
- agitation, hallucinations, coma ou autres changements de l'état mental
- problèmes de coordination ou contractions musculaires (réflexes hyperactifs)
- rythme cardiaque accéléré, pression artérielle élevée ou basse
- transpiration ou fièvre
- nausées, vomissements ou diarrhée
- rigidité musculaire
- vertiges
- rinçage
- tremblement
- convulsions
- anxiété
- irritabilité
- sensation de fatigue ou problèmes de sommeil
- mal de tête
- transpiration
- vertiges
- sensations de choc électrique
- vomissements ou nausées
- diarrhée
- énergie considérablement augmentée
- gros troubles du sommeil
- pensées de course
- comportement imprudent
- des idées exceptionnellement grandioses
- bonheur excessif ou irritabilité
- parler plus ou plus vite que d'habitude
Seules certaines personnes sont à risque pour ces problèmes. Vous voudrez peut-être subir un examen de la vue pour voir si vous êtes à risque et recevoir un traitement préventif si vous l'êtes.
- douleur oculaire
- changements de vision
- gonflement ou rougeur dans ou autour de l'œil
- mal de tête
- faiblesse ou sensation d'instabilité
- confusion, problèmes de concentration ou de réflexion ou problèmes de mémoire
- augmentation du débit urinaire
- incapable d'uriner
- éjaculation retardée ou incapacité à avoir une éjaculation
- diminution de la libido
- problèmes pour obtenir ou maintenir une érection
- diminution de la libido
- orgasme retardé ou incapacité à avoir un orgasme
Les effets secondaires les plus courants de Cymbalta 20 mg incluent :
- nausée
- bouche sèche
- envie de dormir
- fatigue
- constipation
- perte d'appétit
- augmentation de la transpiration
- vertiges
Les effets secondaires possibles courants chez les enfants et les adolescents qui prennent Cymbalta 20 mg comprennent :
- nausée
- perte de poids
- vertiges
Les effets secondaires chez les adultes peuvent également survenir chez les enfants et les adolescents qui prennent Cymbalta. Les enfants et les adolescents doivent faire surveiller leur taille et leur poids pendant le traitement.
Dites à votre fournisseur de soins de santé si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Cymbalta. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires au 1800-FDA-1088.
Comment dois-je conserver Cymbalta 40 mg ?
Conservez Cymbalta à température ambiante entre 68 ° F et 77 ° F (20 ° C et 25 ° C).
Gardez Cymbalta et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de Cymbalta.
Les médecines sont quelquefois prescrites pour les buts autres que ceux énumérés dans un Guide de Médication. N'utilisez pas Cymbalta pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas Cymbalta 20 mg à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Ce Guide de Médication résume les informations les plus importantes sur Cymbalta. Si vous souhaitez plus d'informations, parlez-en à votre fournisseur de soins de santé. Vous pouvez demander à votre fournisseur de soins de santé ou à votre pharmacien des informations sur Cymbalta écrites pour les professionnels de la santé.
Pour plus d'informations, appelez le 1-800-545-5979.
Quels sont les ingrédients de Cymbalta 30mg ?
Ingrédient actif : chlorhydrate de duloxétine
Ingrédients inactifs:
FD&C Blue No. 2, gélatine, hypromellose, succinate d'acétate d'hydroxypropylméthylcellulose, laurylsulfate de sodium, saccharose, sphères de sucre, talc, dioxyde de titane et citrate de triéthyle. Les gélules de 20 et 60 mg contiennent également de l'oxyde de fer jaune.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
