Lexapro 10mg, 20mg, 5mg Escitalopram Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Lexapro et comment est-il utilisé ?
Lexapro est un médicament délivré sur ordonnance utilisé pour traiter les symptômes du trouble dépressif majeur et du trouble anxieux généralisé. Lexapro peut être utilisé seul ou avec d'autres médicaments.
- Lexapro appartient à une classe de médicaments appelés antidépresseurs, ISRS.
- On ne sait pas si Lexapro 10 mg est sûr et efficace chez les enfants de moins de 12 ans.
Quels sont les effets secondaires possibles de Lexapro ?
Lexapro peut provoquer des effets secondaires graves, notamment :
- Douleur abdominale,
- Saignements anormaux,
- Rêves anormaux,
- Allergie,
- Vision floue,
- vision tunnel,
- douleur thoracique,
- diminution de la concentration,
- hémostase,
- douleur ou gonflement des yeux,
- voir des halos autour des lumières,
- pensées de course,
- comportement inhabituel de prise de risque,
- sentiments de bonheur ou de tristesse extrême,
- mal de tête,
- brûlures d'estomac,
- les bouffées de chaleur,
- confusion,
- troubles de l'élocution,
- grande faiblesse,
- vomissement,
- perte de coordination,
- se sentir instable,
- muscles très raides (rigides),
- forte fièvre,
- transpiration,
- confusion,
- rythme cardiaque rapide ou irrégulier,
- tremblements et
- étourdissement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Lexapro incluent :
- vertiges,
- somnolence,
- la faiblesse,
- transpiration,
- se sentir tremblant ou anxieux,
- troubles du sommeil (insomnie),
- bouche sèche,
- perte d'appétit,
- nausée,
- constipation,
- bâillement,
- changements de poids,
- diminution de la libido,
- l'impuissance, et
- difficulté à avoir un orgasme
ATTENTION
SUICIDALITÉ ET MÉDICAMENTS ANTIDÉPRESSEURS
Les antidépresseurs ont augmenté le risque par rapport au placebo de pensées et de comportements suicidaires (suicidalité) chez les enfants, les adolescents et les jeunes adultes dans des études à court terme sur le trouble dépressif majeur (TDM) et d'autres troubles psychiatriques. Quiconque envisage l'utilisation de Lexapro ou de tout autre antidépresseur chez un enfant, un adolescent ou un jeune adulte doit équilibrer ce risque avec le besoin clinique. Les études à court terme n'ont pas montré d'augmentation du risque de suicide avec les antidépresseurs par rapport au placebo chez les adultes au-delà de 24 ans ; il y avait une réduction du risque avec les antidépresseurs par rapport au placebo chez les adultes âgés de 65 ans et plus. La dépression et certains autres troubles psychiatriques sont eux-mêmes associés à une augmentation du risque de suicide. Les patients de tous âges qui commencent un traitement antidépresseur doivent être surveillés de manière appropriée et observés de près pour déceler une aggravation clinique, des tendances suicidaires ou des changements inhabituels de comportement. Les familles et les soignants doivent être informés de la nécessité d'une surveillance étroite et d'une communication avec le prescripteur. Lexapro 5 mg n'est pas approuvé pour une utilisation chez les patients pédiatriques de moins de 12 ans. [Voir AVERTISSEMENTS ET PRECAUTIONS Aggravation clinique et risque suicidaire, INFORMATIONS PATIENTS , et Utilisation dans des populations spécifiques : Usage pédiatrique].
LA DESCRIPTION
Lexapro® (oxalate d'escitalopram) est un inhibiteur sélectif de la recapture de la sérotonine (ISRS) administré par voie orale. L'escitalopram est le sénantiomère pur (isomère unique) du citalopram, dérivé bicyclique racémique du phtalane. L'oxalate d'escitalopram est désigné oxalate de S-(+)-1-[3(diméthyl-amino)propyl]-1-(p-fluorophényl)-5-phtalancarbonitrile avec la formule structurale suivante :
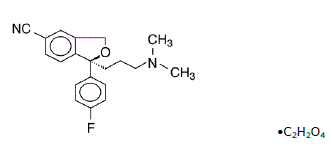
La formule moléculaire est C20H21FN2O • C2H2O4 et le poids moléculaire est de 414,40.
L'oxalate d'escitalopram se présente sous la forme d'une poudre fine, blanche à légèrement jaune et est librement soluble dans le méthanol et le diméthylsulfoxyde (DMSO), soluble dans une solution saline isotonique, peu soluble dans l'eau et l'éthanol, légèrement soluble dans l'acétate d'éthyle et insoluble dans l'heptane.
Lexapro (oxalate d'escitalopram) est disponible sous forme de comprimés ou de solution buvable.
Les comprimés Lexapro sont des comprimés pelliculés ronds contenant de l'oxalate d'escitalopram à des dosages équivalents à 5 mg, 10 mg et 20 mg d'escitalopram base. Les comprimés de 10 et 20 mg sont sécables. Les comprimés contiennent également les ingrédients inactifs suivants : talc, croscarmellose sodique, cellulose microcristalline/dioxyde de silicium colloïdal et stéarate de magnésium. Le pelliculage contient de l'hypromellose, du dioxyde de titane et du polyéthylène glycol.
La solution buvable Lexapro 5 mg contient de l'oxalate d'escitalopram équivalent à 1 mg/mL d'escitalopram base. Il contient également les ingrédients inactifs suivants : sorbitol, eau purifiée, acide citrique, citrate de sodium, acide malique, glycérine, propylène glycol, méthylparabène, propylparabène et arôme naturel de menthe poivrée.
LES INDICATIONS
Trouble dépressif majeur
Lexapro (escitalopram) est indiqué pour le traitement aigu et d'entretien du trouble dépressif majeur chez les adultes et les adolescents de 12 à 17 ans [voir Etudes cliniques ].
Un épisode dépressif majeur (DSM-IV) implique une humeur dépressive ou dysphorique importante et relativement persistante (presque tous les jours pendant au moins 2 semaines) qui interfère généralement avec le fonctionnement quotidien, et comprend au moins cinq des neuf symptômes suivants : humeur dépressive, perte d'intérêt pour les activités habituelles, modification importante du poids et/ou de l'appétit, insomnie ou hypersomnie, agitation ou ralentissement psychomoteur, fatigue accrue, sentiment de culpabilité ou d'inutilité, ralentissement de la réflexion ou troubles de la concentration, tentative de suicide ou idéation suicidaire.
Désordre anxieux généralisé
Lexapro 20 mg est indiqué pour le traitement aigu du Trouble Anxieux Généralisé (TAG) chez l'adulte [voir Etudes cliniques ].
Le trouble d'anxiété généralisée (DSM-IV) se caractérise par une anxiété et des inquiétudes excessives (attente appréhensive) qui persistent pendant au moins 6 mois et que la personne a du mal à contrôler. Elle doit être associée à au moins 3 des symptômes suivants : agitation ou sensation d'excitation ou d'énervement, être facilement fatigué, difficulté à se concentrer ou avoir l'esprit vide, irritabilité, tension musculaire et troubles du sommeil.
DOSAGE ET ADMINISTRATION
Lexapro 5 mg doit être administré une fois par jour, le matin ou le soir, avec ou sans nourriture.
Trouble dépressif majeur
Traitement initial
Adolescents
La dose recommandée de Lexapro est de 10 mg une fois par jour. Un essai à doses flexibles de Lexapro (10 à 20 mg/jour) a démontré l'efficacité de Lexapro [voir Etudes cliniques ]. Si la dose est augmentée à 20 mg, cela devrait se produire après un minimum de trois semaines.
Adultes
La dose recommandée de Lexapro 10 mg est de 10 mg une fois par jour. Un essai à dose fixe de Lexapro a démontré l'efficacité de 10 mg et 20 mg de Lexapro 5 mg, mais n'a pas réussi à démontrer un plus grand bénéfice de 20 mg par rapport à 10 mg [voir Etudes cliniques ]. Si la dose est augmentée à 20 mg, cela devrait se produire après un minimum d'une semaine.
Traitement d'entretien
Il est généralement admis que les épisodes aigus de trouble dépressif majeur nécessitent plusieurs mois ou plus de traitement pharmacologique soutenu au-delà de la réponse à l'épisode aigu. L'évaluation systématique de la poursuite de Lexapro 10 ou 20 mg/jour chez des patients adultes atteints de trouble dépressif majeur qui ont répondu à la prise de Lexapro pendant une phase de traitement aigu de 8 semaines a démontré un bénéfice d'un tel traitement d'entretien [voir Etudes cliniques ]. Néanmoins, le médecin qui choisit d'utiliser Lexapro 5 mg pendant de longues périodes doit réévaluer périodiquement l'utilité à long terme du médicament pour le patient individuel. Les patients doivent être réévalués périodiquement pour déterminer la nécessité d'un traitement d'entretien.
Désordre anxieux généralisé
Traitement initial
Adultes
La dose initiale recommandée de Lexapro est de 10 mg une fois par jour. Si la dose est augmentée à 20 mg, cela devrait se produire après un minimum d'une semaine.
Traitement d'entretien
Le trouble anxieux généralisé est reconnu comme une maladie chronique. L'efficacité de Lexapro dans le traitement du TAG au-delà de 8 semaines n'a pas été systématiquement étudiée. Le médecin qui choisit d'utiliser Lexapro pendant des périodes prolongées doit réévaluer périodiquement l'utilité à long terme du médicament pour le patient individuel.
Dépister le trouble bipolaire avant de commencer Lexapro
Avant de commencer un traitement avec Lexapro ou un autre antidépresseur, dépister les patients pour des antécédents familiaux personnels de trouble bipolaire, de manie ou d'hypomanie [voir AVERTISSEMENTS ET PRECAUTIONS ].
Populations particulières
10 mg/jour est la dose recommandée pour la plupart des patients âgés et des patients atteints d'insuffisance hépatique.
Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance rénale légère ou modérée. Lexapro doit être utilisé avec prudence chez les patients présentant une insuffisance rénale sévère.
Arrêt du traitement par Lexapro
Des symptômes associés à l'arrêt de Lexapro 5 mg et d'autres ISRS et IRSN ont été rapportés [voir AVERTISSEMENTS ET PRECAUTIONS ]. Les patients doivent être surveillés pour ces symptômes lors de l'arrêt du traitement. Une réduction progressive de la dose plutôt qu'un arrêt brutal est recommandée dans la mesure du possible. Si des symptômes intolérables surviennent suite à une diminution de la dose ou à l'arrêt du traitement, la reprise de la dose précédemment prescrite peut être envisagée. Par la suite, le médecin peut continuer à diminuer la dose, mais à un rythme plus graduel.
Passage d'un patient à ou à partir d'un inhibiteur de la monoamine oxydase (IMAO) destiné à traiter les troubles psychiatriques
Au moins 14 jours doivent s'écouler entre l'arrêt d'un IMAO destiné à traiter les troubles psychiatriques et l'initiation du traitement par Lexapro. A l'inverse, il faut attendre au moins 14 jours après l'arrêt de Lexapro 20mg avant de débuter un IMAO destiné à traiter les troubles psychiatriques [voir CONTRE-INDICATIONS ].
Utilisation de Lexapro avec d'autres IMAO tels que le linézolide ou le bleu de méthylène
Ne pas commencer Lexapro 5 mg chez un patient traité par linézolide ou bleu de méthylène par voie intraveineuse car il existe un risque accru de syndrome sérotoninergique. Chez un patient qui nécessite un traitement plus urgent d'une affection psychiatrique, d'autres interventions, y compris l'hospitalisation, doivent être envisagées [voir CONTRE-INDICATIONS ].
Dans certains cas, un patient recevant déjà un traitement par Lexapro 10 mg peut nécessiter un traitement urgent avec du linézolide ou du bleu de méthylène par voie intraveineuse. Si des alternatives acceptables au traitement par le linézolide ou le bleu de méthylène par voie intraveineuse ne sont pas disponibles et que les avantages potentiels du traitement par le linézolide ou le bleu de méthylène par voie intraveineuse sont jugés supérieurs aux risques de syndrome sérotoninergique chez un patient particulier, Lexapro doit être arrêté rapidement et le linézolide ou le bleu de méthylène par voie intraveineuse peut être administré. Le patient doit être surveillé pour des symptômes de syndrome sérotoninergique pendant 2 semaines ou jusqu'à 24 heures après la dernière dose de linézolide ou de bleu de méthylène par voie intraveineuse, selon la première éventualité. Le traitement par Lexapro peut être repris 24 heures après la dernière dose de linézolide ou de bleu de méthylène par voie intraveineuse [voir AVERTISSEMENTS ET PRECAUTIONS ].
Le risque d'administration de bleu de méthylène par des voies non intraveineuses (telles que des comprimés oraux ou par injection locale) ou à des doses intraveineuses bien inférieures à 1 mg/kg avec Lexapro 10 mg n'est pas clair. Le clinicien doit néanmoins être conscient de la possibilité d'apparition de symptômes de syndrome sérotoninergique lors d'une telle utilisation [voir AVERTISSEMENTS ET PRECAUTIONS ].
COMMENT FOURNIE
Formes posologiques et points forts
Comprimés
Les comprimés Lexapro 10 mg sont des comprimés pelliculés ronds contenant de l'oxalate d'escitalopram à des dosages équivalents à 5 mg, 10 mg et 20 mg d'escitalopram base. Les comprimés de 10 et 20 mg sont sécables. Imprimé avec "FL" d'un côté et "5", "10" ou "20" de l'autre côté selon leurs forces respectives.
Solution orale
Lexapro solution buvable contient de l'oxalate d'escitalopram équivalent à 1 mg/mL d'escitalopram base (non commercialisé actuellement).
Stockage et manutention
Comprimés
Comprimés de 5 mg
Flacon de 100 - CDN #0456-2005-01
Blanc à blanc cassé, rond, non sécable, pelliculé. Imprimez "FL" sur un côté de la tablette et "5" sur l'autre côté.
Comprimés de 10 mg
Flacon de 100 - CDN 0456-2010-01 Dose unitaire 10 x 10 - CDN #0456-2010-63
Blanc à blanc cassé, rond, sécable, pelliculé. Impression sur le côté marqué avec "F" sur le côté gauche et "L" sur le côté droit. Impression sur le côté non rainuré avec "10".
Comprimés de 20 mg
Flacon de 100 - CDN # 0456-2020-01 Dose unitaire 10 x 10 - CDN # 0456-2020-63
Blanc à blanc cassé, rond, sécable, pelliculé. Impression sur le côté marqué avec "F" sur le côté gauche et "L" sur le côté droit. Impression sur le côté non rainuré avec "20".
Solution orale
5 mg/5 mL, saveur menthe poivrée (240 mL) - CDN # 0456-2101-08. La solution buvable n'est pas commercialisée actuellement.
Stockage et manutention
Conserver entre 20 °C et 25 °C (68 °F et 77 °F); excursions autorisées jusqu'à 15 à 30°C (59° à 86°F).
Distribué par : Allergan USA, Inc. Madison, NJ 07940. Révisé : septembre 2021
EFFETS SECONDAIRES
Expérience des essais cliniques
Étant donné que les études cliniques sont menées dans des conditions très variables, les taux d'effets indésirables observés dans les études cliniques d'un médicament ne peuvent pas être directement comparés aux taux des études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Sources de données des essais cliniques
Pédiatrie (6 -17 ans)
Les événements indésirables ont été recueillis chez 576 patients pédiatriques (286 Lexapro 5 mg, 290 placebo) présentant un trouble dépressif majeur dans des études en double aveugle contrôlées par placebo. La sécurité et l'efficacité de Lexapro 5 mg chez les patients pédiatriques de moins de 12 ans n'ont pas été établies.
Adultes
Les informations sur les effets indésirables de Lexapro 5 mg ont été recueillies auprès de 715 patients atteints de trouble dépressif majeur qui ont été exposés à l'escitalopram et de 592 patients qui ont été exposés au placebo dans des essais en double aveugle contrôlés par placebo. 284 patients supplémentaires souffrant de trouble dépressif majeur ont été nouvellement exposés à l'escitalopram dans des essais en ouvert. Les informations sur les effets indésirables de Lexapro chez les patients atteints de TAG ont été recueillies auprès de 429 patients exposés à l'escitalopram et de 427 patients exposés au placebo dans des essais en double aveugle contrôlés par placebo.
Les événements indésirables au cours de l'exposition ont été obtenus principalement par une enquête générale et enregistrés par des investigateurs cliniques en utilisant la terminologie de leur choix. Par conséquent, il n'est pas possible de fournir une estimation significative de la proportion d'individus présentant des événements indésirables sans d'abord regrouper des types d'événements similaires dans un plus petit nombre de catégories d'événements standardisées. Dans les tableaux et tableaux qui suivent, la terminologie standard de l'Organisation mondiale de la santé (OMS) a été utilisée pour classer les événements indésirables signalés.
Les fréquences indiquées des effets indésirables représentent la proportion de personnes qui ont subi, au moins une fois, un événement indésirable lié au traitement du type indiqué. Un événement était considéré comme émergeant du traitement s'il survenait pour la première fois ou s'il s'était aggravé pendant le traitement après l'évaluation initiale.
Événements indésirables associés à l'arrêt du traitement
Trouble dépressif majeur
Pédiatrie (6 -17 ans)
Les événements indésirables ont été associés à l'arrêt de 3,5 % des 286 patients recevant Lexapro et 1 % des 290 patients recevant le placebo. L'événement indésirable le plus fréquent (incidence d'au moins 1 % pour Lexapro 10 mg et supérieure à celle du placebo) associé à l'arrêt était l'insomnie (1 % Lexapro, 0 % placebo).
Adultes
Parmi les 715 patients déprimés qui ont reçu Lexapro dans des essais contrôlés par placebo, 6 % ont arrêté le traitement en raison d'un événement indésirable, contre 2 % des 592 patients recevant le placebo. Dans deux études à dose fixe, le taux d'arrêt pour événement indésirable chez les patients recevant 10 mg/jour de Lexapro 20 mg n'était pas significativement différent du taux d'arrêt pour événement indésirable chez les patients recevant le placebo. Le taux d'arrêt pour événements indésirables chez les patients recevant une dose fixe de Lexapro à 20 mg/jour était de 10 %, ce qui était significativement différent du taux d'arrêt pour événements indésirables chez les patients recevant Lexapro à 10 mg/jour (4 %) et un placebo. (3%). Les événements indésirables qui ont été associés à l'arrêt d'au moins 1 % des patients traités par Lexapro 5 mg, et pour lesquels le taux était au moins deux fois supérieur à celui du placebo, étaient des nausées (2 %) et des troubles de l'éjaculation (2 % des patients de sexe masculin).
Désordre anxieux généralisé
Adultes
Parmi les 429 patients atteints de TAG qui ont reçu Lexapro 10-20 mg/jour dans des essais contrôlés par placebo, 8 % ont arrêté le traitement en raison d'un événement indésirable, contre 4 % des 427 patients recevant le placebo. Les événements indésirables qui ont été associés à l'arrêt d'au moins 1 % des patients traités par Lexapro 20 mg, et pour lesquels le taux était au moins le double du taux de placebo, étaient les nausées (2 %), l'insomnie (1 %) et la fatigue (1 %).
Incidence des effets indésirables dans les essais cliniques contrôlés par placebo
Trouble dépressif majeur
Pédiatrie (6 -17 ans)
Le profil global des effets indésirables chez les patients pédiatriques était généralement similaire à celui observé dans les études chez l'adulte, comme le montre le tableau 2. Cependant, les effets indésirables suivants (à l'exclusion de ceux qui apparaissent dans le tableau 2 et de ceux pour lesquels les termes codés n'étaient pas informatifs ou trompeurs) ) ont été rapportés à une incidence d'au moins 2 % pour Lexapro et supérieure au placebo : douleurs dorsales, infection des voies urinaires, vomissements et congestion nasale.
Adultes
Les effets indésirables les plus fréquemment observés chez les patients recevant Lexapro 10 mg (incidence d'environ 5 % ou plus et environ le double de l'incidence chez les patients sous placebo) étaient l'insomnie, les troubles de l'éjaculation (principalement un retard d'éjaculation), les nausées, l'augmentation de la transpiration, la fatigue et la somnolence.
Le tableau 2 énumère l'incidence, arrondie au pourcentage le plus proche, des événements indésirables liés au traitement survenus chez 715 patients déprimés qui ont reçu Lexapro 20 mg à des doses allant de 10 à 20 mg/jour dans des essais contrôlés par placebo. Les événements inclus sont ceux survenant chez 2 % ou plus des patients traités par Lexapro 20 mg et pour lesquels l'incidence chez les patients traités par Lexapro 10 mg était supérieure à l'incidence chez les patients traités par placebo.
TABLEAU 2 Effets indésirables apparus sous traitement observés avec une fréquence ≥ 2 % et supérieure au placebo pour le trouble dépressif majeur
Désordre anxieux généralisé
Adultes
Les effets indésirables les plus fréquemment observés chez les patients Lexapro (incidence d'environ 5 % ou plus et environ le double de l'incidence chez les patients sous placebo) étaient les nausées, les troubles de l'éjaculation (principalement un retard d'éjaculation), l'insomnie, la fatigue, la diminution de la libido et l'anorgasmie.
énumère l'incidence, arrondie au pourcentage le plus proche des événements indésirables liés au traitement survenus chez 429 patients atteints de TAG qui ont reçu Lexapro 10 à 20 mg/jour dans des essais contrôlés par placebo. Les événements inclus sont ceux survenus chez 2 % ou plus des patients traités par Lexapro et pour lesquels l'incidence chez les patients traités par Lexapro était supérieure à l'incidence chez les patients traités par placebo.
TABLEAU 3 Effets indésirables survenus au cours du traitement observés avec une fréquence ≥ 2 % et supérieure au placebo pour le trouble d'anxiété généralisée
Dépendance à la dose des effets indésirables
La dépendance potentielle à la dose des effets indésirables courants (définis comme un taux d'incidence ≥ 5 % dans les groupes Lexapro 10 mg ou 20 mg) a été examinée sur la base de l'incidence combinée des effets indésirables dans deux essais à dose fixe. Le taux d'incidence global des événements indésirables chez les patients traités par Lexapro 10 mg (66 %) était similaire à celui des patients traités par placebo (61 %), tandis que le taux d'incidence chez les patients traités par Lexapro 20 mg/jour était supérieur (86 %). Le tableau 4 montre les effets indésirables courants qui se sont produits dans le groupe Lexapro 20 mg/jour avec une incidence qui était environ deux fois celle du groupe Lexapro 10 mg/jour 10 mg et environ deux fois celle du groupe placebo.
TABLEAU 4 Incidence des effets indésirables courants chez les patients atteints de trouble dépressif majeur
Dysfonction sexuelle masculine et féminine avec les ISRS
Bien que les changements dans le désir sexuel, la performance sexuelle et la satisfaction sexuelle se produisent souvent comme des manifestations d'un trouble psychiatrique, ils peuvent également être une conséquence d'un traitement pharmacologique. En particulier, certaines preuves suggèrent que les ISRS peuvent provoquer de telles expériences sexuelles fâcheuses.
Des estimations fiables de l'incidence et de la gravité des expériences fâcheuses impliquant le désir sexuel, la performance et la satisfaction sont cependant difficiles à obtenir, en partie parce que les patients et les médecins peuvent être réticents à en discuter. En conséquence, les estimations de l'incidence des expériences et des performances sexuelles indésirables citées dans l'étiquetage des produits sous-estiment probablement leur incidence réelle.
TABLEAU 5 Incidence des effets secondaires sexuels dans les essais cliniques contrôlés par placebo
Il n'y a pas d'études conçues de manière adéquate examinant la dysfonction sexuelle avec le traitement par l'escitalopram.
Le priapisme a été signalé avec tous les ISRS.
Bien qu'il soit difficile de connaître le risque précis de dysfonctionnement sexuel associé à l'utilisation des ISRS, les médecins doivent régulièrement se renseigner sur ces effets secondaires possibles.
Modifications des signes vitaux
Les groupes Lexapro 5 mg et placebo ont été comparés en ce qui concerne (1) le changement moyen par rapport au départ des signes vitaux (pouls, pression artérielle systolique et tension artérielle diastolique) et (2) l'incidence des patients répondant aux critères de changements potentiellement cliniquement significatifs par rapport au départ dans ces variables. Ces analyses n'ont révélé aucun changement cliniquement important des signes vitaux associés au traitement par Lexapro 20 mg. De plus, une comparaison des mesures des signes vitaux en position couchée et debout chez les sujets recevant Lexapro 20 mg a indiqué que le traitement par Lexapro n'est pas associé à des modifications orthostatiques.
Changements de poids
Les patients traités par Lexapro dans des essais contrôlés ne différaient pas des patients traités par placebo en ce qui concerne les modifications cliniquement importantes du poids corporel.
Changements de laboratoire
Les groupes Lexapro 5 mg et placebo ont été comparés en ce qui concerne (1) le changement moyen par rapport au départ de diverses variables de chimie sérique, d'hématologie et d'analyse d'urine, et (2) l'incidence des patients répondant aux critères de changements potentiellement cliniquement significatifs par rapport au départ dans ces variables. Ces analyses n'ont révélé aucun changement cliniquement important dans les paramètres des tests de laboratoire associés au traitement par Lexapro.
Modifications de l'ECG
Les électrocardiogrammes des groupes Lexapro (N = 625) et placebo (N = 527) ont été comparés en ce qui concerne les valeurs aberrantes définies comme les sujets présentant des modifications de l'intervalle QTc sur 60 msec par rapport aux valeurs initiales ou absolues sur 500 msec après l'administration de la dose, et les sujets présentant une augmentation de la fréquence cardiaque jusqu'à plus de 100 bpm ou diminue à moins de 50 bpm avec un changement de 25 % par rapport à la ligne de base (valeurs aberrantes tachycardiques ou bradycardiques, respectivement). Aucun des patients du groupe Lexapro 20 mg n'avait un intervalle QTcF > 500 msec ou un allongement > 60 msec par rapport à 0,2 % des patients du groupe placebo. L'incidence des valeurs aberrantes de la tachycardie était de 0,2 % dans le groupe Lexapro 5 mg et le groupe placebo. L'incidence des cas extrêmes de bradycardie était de 0,5 % dans le groupe Lexapro 10 mg et de 0,2 % dans le groupe placebo.
L'intervalle QTcF a été évalué dans une étude randomisée, contrôlée par placebo et par traitement actif (moxifloxacine 400 mg), croisée et à doses multiples croissantes chez 113 sujets sains. La différence moyenne maximale (limite supérieure de l'intervalle de confiance à 95 %) par rapport au groupe placebo était de 4,5 (6,4) et 10,7 (12,7) msec pour 10 mg et 30 mg suprathérapeutiques d'escitalopram administrés une fois par jour, respectivement. Sur la base de la relation exposition-réponse établie, la variation prédite du QTcF par rapport au groupe placebo (intervalle de confiance à 95 %) sous la Cmax pour la dose de 20 mg est de 6,6 (7,9) msec. L'escitalopram 30 mg administré une fois par jour a entraîné une Cmax moyenne 1,7 fois supérieure à la Cmax moyenne pour la dose thérapeutique maximale recommandée à l'état d'équilibre (20 mg). L'exposition à une dose suprathérapeutique de 30 mg est similaire aux concentrations à l'état d'équilibre attendues chez les métaboliseurs lents du CYP2C19 après une dose thérapeutique de 20 mg.
Autres réactions observées lors de l'évaluation de précommercialisation de Lexapro
Voici une liste des événements indésirables liés au traitement, tels que définis dans l'introduction du EFFETS INDÉSIRABLES rapportée par les 1428 patients traités par Lexapro pendant des périodes allant jusqu'à un an dans des essais cliniques en double aveugle ou en ouvert lors de son évaluation précommercialisation. La liste n'inclut pas les événements déjà répertoriés dans les événements pour lesquels une cause médicamenteuse était éloignée et à un taux inférieur à 1 % ou inférieur au placebo, les événements qui étaient si généraux qu'ils n'étaient pas informatifs et les événements signalés une seule fois qui n'avait pas de probabilité substantielle d'être gravement mortelle. Les événements sont classés par système corporel. Les événements d'importance clinique majeure sont décrits dans le AVERTISSEMENTS ET PRECAUTIONS section.
Cardiovasculaire -hypertension, palpitations.
Troubles du système nerveux central et périphérique - sensation d'étourdissement, migraine.
Problèmes gastro-intestinaux - crampe abdominale, brûlures d'estomac, gastro-entérite.
Général - allergie, douleurs thoraciques, fièvre, bouffées de chaleur, douleurs dans les membres.
Troubles métaboliques et nutritionnels -augmentation du poids.
Troubles du système musculo-squelettique - arthralgie, myalgie raideur de la mâchoire.
Troubles psychiatriques augmentation de l'appétit, troubles de la concentration, irritabilité.
Troubles de la reproduction/Femme - crampes menstruelles, troubles menstruels.
Troubles du système respiratoire - bronchite, toux, congestion nasale, congestion des sinus, maux de tête sinusaux.
Troubles de la peau et des phanères - éruption.
Sens spéciaux - vision floue, acouphènes.
Troubles du système urinaire -fréquence urinaire, infection urinaire.
Expérience post-commercialisation
Effets indésirables rapportés suite à la commercialisation de l'escitalopram
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de Lexapro. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Troubles du système sanguin et lymphatique : anémie, agranulocytes, anémie aplasique, anémie hémolytique, purpura thrombocytopénique idiopathique, leucopénie, thrombocytopénie.
Troubles cardiaques : fibrillation auriculaire, bradycardie, insuffisance cardiaque, infarctus du myocarde, tachycardie, torsade de pointes, arythmie ventriculaire, tachycardie ventriculaire.
Troubles de l'oreille et du labyrinthe : vertige
Troubles endocriniens: diabète sucré, hyperprolactinémie, SIADH.
Troubles oculaires : glaucome à angle fermé, diplopie, mydriase, troubles visuels.
Trouble gastro-intestinal : dysphagie, hémorragie gastro-intestinale, reflux gastro-oesophagien, pancréatite, hémorragie rectale.
Troubles généraux et conditions au site d'administration : démarche anormale, asthénie, œdème, chute, sensation anormale, malaise.
Troubles hépatobiliaires : hépatite fulminante, insuffisance hépatique, nécrose hépatique, hépatite.
Troubles du système immunitaire : réaction allergique, anaphylaxie.
Enquêtes : augmentation de la bilirubine, perte de poids, allongement de l'intervalle QT à l'électrocardiogramme, augmentation des enzymes hépatiques, hypercholestérolémie, augmentation de l'INR, diminution de la prothrombine.
Troubles du métabolisme et de la nutrition : hyperglycémie, hypoglycémie, hypokaliémie, hyponatrémie.
Troubles musculosquelettiques et du tissu conjonctif : crampe musculaire, raideur musculaire, faiblesse musculaire, rhabdomyolyse.
Troubles du système nerveux : acathisie, amnésie, ataxie, choréoathétose, accident vasculaire cérébral, dysarthrie, dyskinésie, dystonie, troubles extrapyramidaux, crises de grand mal (ou convulsions), hypoesthésie, myoclonie, nystagmus, parkinsonisme, jambes sans repos, convulsions, syncope, dyskinésie tardive, tremblements.
Conditions de grossesse, puerpérales et périnatales : avortement spontané.
Troubles psychiatriques: psychose aiguë, agressivité, agitation, colère, anxiété, apathie, suicide réussi, confusion, dépersonnalisation, dépression aggravée, délire, illusion, désorientation, sentiment d'irréalité, hallucinations (visuelles et auditives), sautes d'humeur, nervosité, cauchemars, réaction de panique, paranoïa , agitation, automutilation ou pensées d'automutilation, tentative de suicide, idées suicidaires, tendance suicidaire.
Troubles rénaux et urinaires : insuffisance rénale aiguë, dysurie, rétention urinaire.
Troubles de l'appareil reproducteur et des seins : ménorragie, priapisme.
Troubles respiratoires, thoraciques et médiastinaux : dyspnée, épistaxis, embolie pulmonaire, hypertension pulmonaire du nouveau-né. Troubles de la peau et du tissu sous-cutané : alopécie, œdème de Quincke, dermatite, ecchymose, érythème polymorphe, réaction de photosensibilité, syndrome de Stevens Johnson, nécrolyse épidermique toxique, urticaire.
Troubles vasculaires : thrombose veineuse profonde, bouffées vasomotrices, crise hypertensive, hypotension, hypotension orthostatique, phlébite, thrombose.
INTERACTIONS MÉDICAMENTEUSES
Inhibiteurs de la monoamine oxydase (IMAO)
[Voir DOSAGE ET ADMINISTRATION et , CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Médicaments sérotoninergiques
[Voir DOSAGE ET ADMINISTRATION et , CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Triptans
Il y a eu de rares rapports post-commercialisation de syndrome sérotoninergique avec l'utilisation d'un ISRS et d'un triptan. Si le traitement concomitant de Lexapro 10 mg avec un triptan est cliniquement justifié, une surveillance attentive du patient est conseillée, en particulier lors de l'initiation du traitement et des augmentations de dose [voir AVERTISSEMENTS ET PRECAUTIONS ].
Médicaments du SNC
Compte tenu des principaux effets de l'escitalopram sur le SNC, la prudence s'impose lorsqu'il est pris en association avec d'autres médicaments à action centrale.
De l'alcool
Bien que Lexapro n'ait pas potentialisé les effets cognitifs et moteurs de l'alcool dans un essai clinique, comme avec d'autres médicaments psychotropes, la consommation d'alcool par les patients prenant Lexapro n'est pas recommandée.
Médicaments qui interfèrent avec l'hémostase (AINS, aspirine, warfarine, etc.)
La libération de sérotonine par les plaquettes joue un rôle important dans l'hémostase. Des études épidémiologiques de conception cas-témoins et de cohorte qui ont démontré une association entre l'utilisation de médicaments psychotropes qui interfèrent avec la recapture de la sérotonine et la survenue d'hémorragies digestives hautes ont également montré que l'utilisation concomitante d'un AINS ou d'aspirine peut potentialiser le risque d'hémorragie. Des effets anticoagulants modifiés, y compris une augmentation des saignements, ont été rapportés lorsque les ISRS et les IRSN sont co-administrés avec la warfarine. Les patients recevant un traitement par warfarine doivent être étroitement surveillés lors de l'instauration ou de l'arrêt de Lexapro.
Cimétidine
Chez les sujets ayant reçu 40 mg/jour de citalopram racémique pendant 21 jours, l'administration combinée de 400 mg de cimétidine deux fois par jour pendant 8 jours a entraîné une augmentation de l'ASC et de la Cmax du citalopram de 43 % et 39 %, respectivement. La signification clinique de ces résultats est inconnue.
Digoxine
Chez les sujets ayant reçu pendant 21 jours 40 mg/jour de citalopram racémique, l'administration combinée de citalopram et de digoxine (dose unique de 1 mg) n'a pas significativement affecté la pharmacocinétique du citalopram ou de la digoxine.
Lithium
L'administration concomitante de citalopram racémique (40 mg/jour pendant 10 jours) et de lithium (30 mmol/jour pendant 5 jours) n'a eu aucun effet significatif sur la pharmacocinétique du citalopram ou du lithium. Néanmoins, les taux plasmatiques de lithium doivent être surveillés avec un ajustement approprié de la dose de lithium conformément à la pratique clinique standard. Étant donné que le lithium peut augmenter les effets sérotoninergiques de l'escitalopram, la prudence s'impose lorsque Lexapro 5 mg et le lithium sont co-administrés.
Pimozide et Celexa
Dans une étude contrôlée, une dose unique de pimozide 2 mg co-administré avec du citalopram racémique 40 mg administré une fois par jour pendant 11 jours a été associée à une augmentation moyenne des valeurs QTc d'environ 10 msec par rapport au pimozide administré seul. Le citalopram racémique n'a pas modifié l'ASC ou la Cmax moyenne du pimozide. Le mécanisme de cette interaction pharmacodynamique n'est pas connu.
Sumatriptan
Il y a eu de rares rapports post-commercialisation décrivant des patients présentant une faiblesse, une hyperréflexie et une incoordination suite à l'utilisation d'un ISRS et de sumatriptan. Si un traitement concomitant par le sumatriptan et un ISRS (par exemple, la fluoxétine, la fluvoxamine, la paroxétine, la sertraline, le citalopram, l'escitalopram) est cliniquement justifié, une surveillance appropriée du patient est conseillée.
Théophylline
L'administration combinée de citalopram racémique (40 mg/jour pendant 21 jours) et de théophylline, un substrat du CYP1A2 (dose unique de 300 mg), n'a pas affecté la pharmacocinétique de la théophylline. L'effet de la théophylline sur la pharmacocinétique du citalopram n'a pas été évalué.
Warfarine
L'administration de 40 mg/jour de citalopram racémique pendant 21 jours n'a pas affecté la pharmacocinétique de la warfarine, un substrat du CYP3A4. Le temps de prothrombine a été augmenté de 5 %, dont la signification clinique est inconnue.
Carbamazépine
L'administration combinée de citalopram racémique (40 mg/jour pendant 14 jours) et de carbamazépine (titrée à 400 mg/jour pendant 35 jours) n'a pas affecté de manière significative la pharmacocinétique de la carbamazépine, un substrat du CYP3A4. Bien que les concentrations plasmatiques minimales de citalopram n'aient pas été affectées, étant donné les propriétés d'induction enzymatique de la carbamazépine, la possibilité que la carbamazépine puisse augmenter la clairance de l'escitalopram doit être envisagée si les deux médicaments sont co-administrés.
Triazolam
L'administration combinée de citalopram racémique (titré à 40 mg/jour pendant 28 jours) et du triazolam substrat du CYP3A4 (dose unique de 0,25 mg) n'a pas affecté de manière significative la pharmacocinétique du citalopram ou du triazolam.
Kétoconazole
L'administration combinée de citalopram racémique (40 mg) et de kétoconazole (200 mg), un puissant inhibiteur du CYP3A4, a diminué la Cmax et l'ASC du kétoconazole de 21 % et 10 %, respectivement, et n'a pas affecté de manière significative la pharmacocinétique du citalopram.
Ritonavir
L'administration combinée d'une dose unique de ritonavir (600 mg), à la fois un substrat du CYP3A4 et un puissant inhibiteur du CYP3A4, et d'escitalopram (20 mg) n'a pas affecté la pharmacocinétique du ritonavir ou de l'escitalopram.
Inhibiteurs du CYP3A4 et -2C19
Des études in vitro ont indiqué que le CYP3A4 et -2C19 sont les principales enzymes impliquées dans le métabolisme de l'escitalopram. Cependant, la co-administration d'escitalopram (20 mg) et de ritonavir (600 mg), un puissant inhibiteur du CYP3A4, n'a pas affecté de manière significative la pharmacocinétique de l'escitalopram. Étant donné que l'escitalopram est métabolisé par plusieurs systèmes enzymatiques, l'inhibition d'une seule enzyme peut ne pas diminuer de manière appréciable la clairance de l'escitalopram.
Médicaments métabolisés par le cytochrome P4502D6
Les études in vitro n'ont pas révélé d'effet inhibiteur de l'escitalopram sur le CYP2D6. De plus, les taux à l'état d'équilibre du citalopram racémique n'étaient pas significativement différents chez les métaboliseurs lents et les métaboliseurs rapides du CYP2D6 après l'administration de doses multiples de citalopram, ce qui suggère que la co-administration, avec l'escitalopram, d'un médicament qui inhibe le CYP2D6, est peu susceptible d'avoir des effets cliniquement significatifs sur métabolisme de l'escitalopram. Cependant, il existe peu de données in vivo suggérant un effet inhibiteur modeste du CYP2D6 pour l'escitalopram, c'est-à-dire que l'administration concomitante d'escitalopram (20 mg/jour pendant 21 jours) avec l'antidépresseur tricyclique désipramine (dose unique de 50 mg), un substrat du CYP2D6, a entraîné dans une augmentation de 40 % de la Cmax et une augmentation de 100 % de l'ASC de la désipramine. La signification clinique de cette découverte est inconnue. Néanmoins, la prudence s'impose en cas d'administration concomitante d'escitalopram et de médicaments métabolisés par le CYP2D6.
Métoprolol
L'administration de 20 mg/jour de Lexapro 20 mg pendant 21 jours chez des volontaires sains a entraîné une augmentation de 50 % de la Cmax et de 82 % de l'ASC du métoprolol, un bêta-bloquant (administré en une dose unique de 100 mg). Des taux plasmatiques accrus de métoprolol ont été associés à une diminution de la cardiosélectivité. L'administration concomitante de Lexapro 5 mg et de métoprolol n'a eu aucun effet cliniquement significatif sur la tension artérielle ou la fréquence cardiaque.
Thérapie électroconvulsive (ECT)
Il n'y a pas d'études cliniques sur l'utilisation combinée d'ECT et d'escitalopram.
Toxicomanie et dépendance
Abus et dépendance
Dépendance physique et psychologique
Les études animales suggèrent que le risque d'abus du citalopram racémique est faible. Lexapro 10 mg n'a pas été systématiquement étudié chez l'homme pour son potentiel d'abus, de tolérance ou de dépendance physique. L'expérience clinique de précommercialisation avec Lexapro n'a révélé aucun comportement de recherche de drogue. Cependant, ces observations n'étaient pas systématiques et il n'est pas possible de prédire sur la base de cette expérience limitée dans quelle mesure un médicament agissant sur le SNC sera mal utilisé, détourné et/ou abusé une fois commercialisé. Par conséquent, les médecins doivent évaluer attentivement les patients Lexapro pour des antécédents de toxicomanie et suivre ces patients de près, en les observant pour détecter des signes de mésusage ou d'abus (par exemple, développement d'une tolérance, incréments de dose, comportement de recherche de drogue).
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Pensées et comportements suicidaires chez les adolescents et les jeunes adultes
Dans les analyses groupées d'essais contrôlés par placebo portant sur des médicaments antidépresseurs (ISRS et autres classes d'antidépresseurs) qui incluaient environ 77 000 patients adultes et 4 500 patients pédiatriques, l'incidence des pensées et des comportements suicidaires chez les patients traités par antidépresseurs âgés de 24 ans et moins était supérieure à chez les patients traités par placebo. Il y avait une variation considérable du risque de pensées et de comportements suicidaires entre les médicaments, mais il y avait un risque accru identifié chez les jeunes patients pour la plupart des médicaments étudiés. Il y avait des différences dans le risque absolu de pensées et de comportements suicidaires dans les différentes indications, avec l'incidence la plus élevée chez les patients atteints de TDM. Les différences médicament-placebo dans le nombre de cas d'idées et de comportements suicidaires pour 1000 patients traités sont présentées dans
On ne sait pas si le risque de pensées et de comportements suicidaires chez les enfants, les adolescents et les jeunes adultes s'étend à une utilisation à plus long terme, c'est-à-dire au-delà de quatre mois. Cependant, il existe des preuves substantielles issues d'essais d'entretien contrôlés par placebo chez des adultes atteints de TDM que les antidépresseurs retardent la récurrence de la dépression et que la dépression elle-même est un facteur de risque de pensées et de comportements suicidaires.
Surveillez tous les patients traités par antidépresseurs pour toute indication d'aggravation clinique et d'émergence de pensées et de comportements suicidaires, en particulier pendant les premiers mois de traitement médicamenteux et lors des changements de posologie. Conseillez aux membres de la famille ou aux soignants des patients de surveiller les changements de comportement et d'alerter le fournisseur de soins de santé. Envisagez de modifier le schéma thérapeutique, y compris éventuellement d'arrêter Lexapro, chez les patients dont la dépression s'aggrave de manière persistante ou qui présentent des pensées ou des comportements suicidaires émergents.
Syndrome sérotoninergique
Le développement d'un syndrome sérotoninergique potentiellement mortel a été rapporté avec les IRSN et les ISRS, y compris Lexapro, seuls mais particulièrement avec l'utilisation concomitante d'autres médicaments sérotoninergiques (y compris les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, le tryptophane, la buspirone, les amphétamines, et millepertuis) et avec des médicaments qui altèrent le métabolisme de la sérotonine (en particulier, les IMAO, à la fois ceux destinés à traiter les troubles psychiatriques et aussi d'autres, comme le linézolide et le bleu de méthylène par voie intraveineuse).
Les symptômes du syndrome sérotoninergique peuvent inclure des modifications de l'état mental (p. ex., agitation, hallucinations, délire et coma), une instabilité autonome (p. ex., tachycardie, tension artérielle labile, étourdissements, diaphorèse, bouffées vasomotrices, hyperthermie), des symptômes neuromusculaires (p. ex., tremblements, rigidité, myoclonies, hyperréflexie, incoordination) convulsions et/ou symptômes gastro-intestinaux (p. ex., nausées, vomissements, diarrhée). Les patients doivent être surveillés pour détecter l'apparition d'un syndrome sérotoninergique.
L'utilisation concomitante de Lexapro 10 mg avec des IMAO destinés à traiter les troubles psychiatriques est contre-indiquée. Lexapro 5 mg ne doit pas non plus être instauré chez un patient traité par des IMAO tels que le linézolide ou le bleu de méthylène par voie intraveineuse. Tous les rapports avec le bleu de méthylène qui ont fourni des informations sur la voie d'administration impliquaient une administration intraveineuse dans la gamme de doses de 1 mg/kg à 8 mg/kg. Aucun rapport n'impliquait l'administration de bleu de méthylène par d'autres voies (telles que des comprimés oraux ou une injection tissulaire locale) ou à des doses plus faibles. Il peut y avoir des circonstances où il est nécessaire d'initier un traitement avec un IMAO tel que le linézolide ou le bleu de méthylène par voie intraveineuse chez un patient prenant Lexapro. Lexapro doit être arrêté avant de commencer le traitement par IMAO [voir CONTRE-INDICATIONS et DOSAGE ET ADMINISTRATION ].
Si l'utilisation concomitante de Lexapro 5 mg avec d'autres médicaments sérotoninergiques, y compris les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, la buspirone, le tryptophane, l'amphétamine et le millepertuis est cliniquement justifiée, les patients doivent être informés d'un risque accru potentiel de syndrome sérotoninergique. , en particulier lors de l'initiation du traitement et des augmentations de dose.
Le traitement par Lexapro et tout agent sérotoninergique concomitant doit être interrompu immédiatement si les événements ci-dessus se produisent et un traitement symptomatique de soutien doit être instauré.
Arrêt du traitement par Lexapro
Au cours de la commercialisation de Lexapro et d'autres ISRS et IRSN (inhibiteurs de la recapture de la sérotonine et de la noradrénaline), des cas d'effets indésirables survenant à l'arrêt de ces médicaments, en particulier lorsqu'ils sont brusques, ont été signalés spontanément, notamment les suivants : humeur dysphorique, irritabilité, agitation, étourdissements, troubles sensoriels. troubles (p. ex., paresthésies telles que des sensations de choc électrique), anxiété, confusion, maux de tête, léthargie, labilité émotionnelle, insomnie et hypomanie. Bien que ces événements soient généralement spontanément résolutifs, des symptômes graves de sevrage ont été signalés.
Les patients doivent être surveillés pour ces symptômes lors de l'arrêt du traitement par Lexapro. Une réduction progressive de la dose plutôt qu'un arrêt brutal est recommandée dans la mesure du possible. Si des symptômes intolérables surviennent suite à une diminution de la dose ou à l'arrêt du traitement, la reprise de la dose précédemment prescrite peut être envisagée. Par la suite, le médecin peut continuer à diminuer la dose, mais à un rythme plus graduel [voir DOSAGE ET ADMINISTRATION ].
Saisies
Bien que des effets anticonvulsivants du citalopram racémique aient été observés dans des études animales, Lexapro n'a pas été systématiquement évalué chez les patients présentant un trouble convulsif. Ces patients ont été exclus des études cliniques lors des tests de précommercialisation du produit. Dans les essais cliniques de Lexapro 5 mg, des cas de convulsions ont été rapportés en association avec le traitement par Lexapro. Comme d'autres médicaments efficaces dans le traitement du trouble dépressif majeur, Lexapro 20 mg doit être introduit avec précaution chez les patients ayant des antécédents de troubles épileptiques.
Activation de la manie ou de l'hypomanie
Chez les patients atteints de trouble bipolaire, le traitement d'un épisode dépressif avec Lexapro ou un autre antidépresseur peut précipiter un épisode mixte/maniaque. Dans les essais contrôlés par placebo de Lexapro 20 mg dans le trouble dépressif majeur, l'activation de la manie/hypomanie a été rapportée chez un (0,1 %) des 715 patients traités par Lexapro 20 mg et chez aucun des 592 patients traités par placebo. Un cas supplémentaire d'hypomanie a été rapporté en association avec le traitement par Lexapro 10 mg. L'activation de la manie/hypomanie a également été rapportée chez une petite proportion de patients atteints de troubles affectifs majeurs traités avec du citalopram racémique et d'autres médicaments commercialisés efficaces dans le traitement du trouble dépressif majeur. Avant de commencer le traitement par Lexapro, dépister chez les patients tout antécédent personnel ou familial de trouble bipolaire, de manie ou d'hypomanie [voir DOSAGE ET ADMINISTRATION ].
Hyponatrémie
Une hyponatrémie peut survenir à la suite d'un traitement par des ISRS et des IRSN, y compris Lexapro. Dans de nombreux cas, cette hyponatrémie semble être le résultat du syndrome de sécrétion inappropriée d'hormone antidiurétique (SIADH) et a été réversible à l'arrêt de Lexapro 20 mg. Des cas de sodium sérique inférieur à 110 mmol/L ont été rapportés. Les patients âgés peuvent être plus à risque de développer une hyponatrémie avec les ISRS et les IRSN. De plus, les patients prenant des diurétiques ou qui présentent une hypovolémie peuvent être plus à risque [voir Utilisation gériatrique ]. L'arrêt de Lexapro doit être envisagé chez les patients présentant une hyponatrémie symptomatique et une intervention médicale appropriée doit être instituée.
Les signes et symptômes de l'hyponatrémie comprennent des maux de tête, des difficultés de concentration, des troubles de la mémoire, de la confusion, de la faiblesse et une instabilité pouvant entraîner des chutes. Les signes et symptômes associés à des cas plus graves et/ou aigus comprennent des hallucinations, des syncopes, des convulsions, le coma, un arrêt respiratoire et la mort.
Saignement anormal
Les ISRS et les IRSN, y compris Lexapro 20 mg, peuvent augmenter le risque d'événements hémorragiques. L'utilisation concomitante d'aspirine, d'anti-inflammatoires non stéroïdiens, de warfarine et d'autres anticoagulants peut augmenter le risque. Des rapports de cas et des études épidémiologiques (cas-témoins et conception de cohorte) ont démontré une association entre l'utilisation de médicaments qui interfèrent avec la recapture de la sérotonine et la survenue d'hémorragies gastro-intestinales. Les événements hémorragiques liés à l'utilisation des ISRS et des IRSN vont des ecchymoses, des hématomes, des épistaxis et des pétéchies aux hémorragies potentiellement mortelles.
Les patients doivent être avertis du risque de saignement associé à l'utilisation concomitante de Lexapro 20 mg et d'AINS, d'aspirine ou d'autres médicaments affectant la coagulation.
Interférence avec les performances cognitives et motrices
Dans une étude chez des volontaires sains, Lexapro 10 mg/jour n'a pas produit d'altération de la fonction intellectuelle ou des performances psychomotrices. Étant donné que tout médicament psychoactif peut altérer le jugement, la réflexion ou la motricité, les patients doivent cependant être avertis de l'utilisation de machines dangereuses, y compris les automobiles, jusqu'à ce qu'ils soient raisonnablement certains que le traitement par Lexapro n'affecte pas leur capacité à se livrer à de telles activités.
Glaucome à angle fermé
Glaucome à angle fermé : la dilatation pupillaire qui survient après l'utilisation de nombreux antidépresseurs, dont Lexapro 20 mg, peut déclencher une attaque à angle fermé chez un patient présentant des angles anatomiquement étroits qui n'a pas subi d'iridectomie apparente.
Utilisation chez les patients atteints d'une maladie concomitante
L'expérience clinique avec Lexapro chez les patients atteints de certaines maladies systémiques concomitantes est limitée. La prudence est recommandée lors de l'utilisation de Lexapro 5 mg chez les patients atteints de maladies ou d'affections entraînant une altération du métabolisme ou des réponses hémodynamiques.
Lexapro n'a pas été systématiquement évalué chez les patients ayant des antécédents récents d'infarctus du myocarde ou de maladie cardiaque instable. Les patients présentant ces diagnostics étaient généralement exclus des études cliniques lors des tests de précommercialisation du produit.
Chez les sujets insuffisants hépatiques, la clairance du citalopram racémique a diminué et les concentrations plasmatiques ont augmenté. La dose recommandée de Lexapro chez les patients insuffisants hépatiques est de 10 mg/jour [voir DOSAGE ET ADMINISTRATION ].
Étant donné que l'escitalopram est largement métabolisé, l'excrétion du médicament inchangé dans l'urine est une voie d'élimination mineure. Jusqu'à ce qu'un nombre suffisant de patients atteints d'insuffisance rénale sévère aient été évalués pendant le traitement chronique par Lexapro 20 mg, il doit cependant être utilisé avec prudence chez ces patients [voir DOSAGE ET ADMINISTRATION ].
Dysfonction sexuelle
L'utilisation d'ISRS, y compris Lexapro, peut provoquer des symptômes de dysfonctionnement sexuel [voir EFFETS INDÉSIRABLES ]. Chez les patients de sexe masculin, l'utilisation d'ISRS peut entraîner un retard ou un échec de l'éjaculation, une diminution de la libido et une dysfonction érectile. Chez les patientes, l'utilisation d'ISRS peut entraîner une diminution de la libido et un orgasme retardé ou absent.
Il est important que les prescripteurs se renseignent sur la fonction sexuelle avant l'initiation de Lexapro et se renseignent spécifiquement sur les modifications de la fonction sexuelle pendant le traitement, car la fonction sexuelle peut ne pas être signalée spontanément. Lors de l'évaluation des modifications de la fonction sexuelle, il est important d'obtenir un historique détaillé (y compris le moment de l'apparition des symptômes) car les symptômes sexuels peuvent avoir d'autres causes, y compris le trouble psychiatrique sous-jacent. Discuter des stratégies de prise en charge potentielles pour aider les patients à prendre des décisions éclairées sur le traitement.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments ).
Pensées et comportements suicidaires
Conseillez aux patients, à leurs familles et aux soignants de rechercher l'apparition d'idées et de comportements suicidaires, en particulier pendant le traitement et lorsque la dose est ajustée à la hausse ou à la baisse, et demandez-leur de signaler ces symptômes à leur professionnel de la santé [voir AVERTISSEMENT DE BOÎTE et AVERTISSEMENTS ET PRECAUTIONS ].
Syndrome sérotoninergique
Les patients doivent être avertis du risque de syndrome sérotoninergique en cas d'utilisation concomitante de Lexapro avec d'autres médicaments sérotoninergiques, y compris les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, le tryptophane, la buspirone, les amphétamines et le millepertuis, et avec des médicaments qui altèrent le métabolisme de la sérotonine (en particulier les IMAO, aussi bien ceux destinés au traitement des troubles psychiatriques que d'autres comme le linézolide) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Activation de la manie ou de l'hypomanie
Conseillez aux patients et à leurs soignants d'observer les signes d'activation de la manie/hypomanie et demandez-leur de signaler ces symptômes au fournisseur de soins de santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Saignement anormal
Les patients doivent être avertis de l'utilisation concomitante de Lexapro 5 mg et d'AINS, d'aspirine, de warfarine ou d'autres médicaments affectant la coagulation, car l'utilisation combinée de médicaments psychotropes qui interfèrent avec la recapture de la sérotonine et de ces agents a été associée à un risque accru de saignement [voir AVERTISSEMENTS ET PRECAUTIONS ].
Glaucome à angle fermé
Les patients doivent être informés que la prise de Lexapro 5 mg peut provoquer une légère dilatation pupillaire qui, chez les personnes sensibles, peut entraîner un épisode de glaucome à angle fermé. Le glaucome préexistant est presque toujours un glaucome à angle ouvert car le glaucome à angle fermé, lorsqu'il est diagnostiqué, peut être traité définitivement par iridectomie. Le glaucome à angle ouvert n'est pas un facteur de risque de glaucome à angle fermé. Les patients peuvent souhaiter être examinés pour déterminer s'ils sont sensibles à la fermeture de l'angle et subir une procédure prophylactique (p. ex., iridectomie), s'ils sont sensibles [voir AVERTISSEMENTS ET PRECAUTIONS ].
Dysfonction sexuelle
Informez les patients que l'utilisation de Lexapro peut provoquer des symptômes de dysfonctionnement sexuel chez les patients masculins et féminins. Informez les patients qu'ils doivent discuter de tout changement de la fonction sexuelle et des stratégies de gestion potentielles avec leur fournisseur de soins de santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Médicaments concomitants
Étant donné que l'escitalopram est l'isomère actif du citalopram racémique (Celexa), les deux agents ne doivent pas être co-administrés. Les patients doivent être avisés d'informer leur médecin s'ils prennent ou prévoient de prendre des médicaments sur ordonnance ou en vente libre, car il existe un risque d'interactions.
Poursuivre la thérapie prescrite
Bien que les patients puissent remarquer une amélioration avec le traitement par Lexapro 10 mg en 1 à 4 semaines, il faut leur conseiller de poursuivre le traitement comme indiqué.
Interférence avec les performances psychomotrices
Étant donné que les médicaments psychoactifs peuvent altérer le jugement, la réflexion ou la motricité, les patients doivent être avertis de l'utilisation de machines dangereuses, y compris les automobiles, jusqu'à ce qu'ils soient raisonnablement certains que le traitement par Lexapro n'affecte pas leur capacité à se livrer à de telles activités.
De l'alcool
Les patients doivent être informés que, bien que Lexapro 5 mg n'ait pas montré dans des expériences sur des sujets normaux une augmentation des troubles mentaux et moteurs causés par l'alcool, l'utilisation concomitante de Lexapro 20 mg et d'alcool chez les patients déprimés n'est pas conseillée.
Grossesse
Conseillez aux femmes enceintes d'informer leurs fournisseurs de soins de santé si elles deviennent enceintes ou ont l'intention de devenir enceintes pendant le traitement par LEXAPRO. Informez les patientes que l'utilisation de LEXAPRO 10 mg plus tard au cours de la grossesse peut entraîner un risque accru de complications néonatales nécessitant une hospitalisation prolongée, une assistance respiratoire, une alimentation par sonde et/ou une hypertension pulmonaire persistante (PPHN) du nouveau-né [voir Utilisation dans des populations spécifiques ].
Informez les femmes qu'il existe un registre d'exposition pendant la grossesse qui surveille les résultats de la grossesse chez les femmes exposées à LEXAPRO pendant la grossesse [voir Utilisation dans des populations spécifiques ].
Lactation
Conseillez aux femmes allaitantes utilisant LEXAPRO de surveiller les nourrissons pour une sédation excessive, une agitation, une agitation, une mauvaise alimentation et une faible prise de poids et de consulter un médecin si elles remarquent ces signes [voir Utilisation dans des populations spécifiques ].
Besoin d'un programme de traitement complet
Lexapro 20 mg est indiqué dans le cadre d'un programme de traitement total du TDM pouvant inclure d'autres mesures (psychologiques, éducatives, sociales) pour les patients atteints de ce syndrome. Le traitement médicamenteux peut ne pas être indiqué pour tous les adolescents atteints de ce syndrome. L'innocuité et l'efficacité de Lexapro 10 mg dans le TDM n'ont pas été établies chez les patients pédiatriques de moins de 12 ans. Les antidépresseurs ne sont pas destinés à être utilisés chez l'adolescent qui présente des symptômes secondaires à des facteurs environnementaux et/ou à d'autres troubles psychiatriques primaires. Un placement éducatif approprié est essentiel et une intervention psychosociale est souvent utile. Lorsque les mesures correctives seules sont insuffisantes, la décision de prescrire un médicament antidépresseur dépendra de l'évaluation par le médecin de la chronicité et de la gravité des symptômes du patient.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Du citalopram racémique a été administré dans l'alimentation de souris de souche NMRI/BOM et de rats de souche COBS WI pendant 18 et 24 mois, respectivement. Il n'y avait aucune preuve de cancérogénicité du citalopram racémique chez les souris recevant jusqu'à 240 mg/kg/jour. Il y a eu une incidence accrue de carcinome de l'intestin grêle chez les rats recevant 8 ou 24 mg/kg/jour de citalopram racémique. Une dose sans effet pour cette constatation n'a pas été établie. La pertinence de ces découvertes pour les humains est inconnue.
Mutagenèse
Le citalopram racémique s'est révélé mutagène dans le test de mutation inverse bactérienne in vitro (test d'Ames) sur 2 des 5 souches bactériennes (Salmonella TA98 et TA1537) en l'absence d'activation métabolique. Il était clastogène dans le test in vitro sur cellules pulmonaires de hamster chinois pour les aberrations chromosomiques en présence et en l'absence d'activation métabolique. Le citalopram racémique n'a pas été mutagène dans le test in vitro de mutation génique directe (HPRT) de mammifère sur des cellules de lymphome de souris ou dans un test couplé in vitro/in vivo de synthèse d'ADN non programmée (UDS) dans le foie de rat. Il n'était pas clastogène dans le test d'aberration chromosomique in vitro sur des lymphocytes humains ou dans deux tests in vivo sur le micronoyau chez la souris.
Altération de la fertilité
Lorsque du citalopram racémique a été administré par voie orale à 16 rats mâles et 24 rats femelles avant et pendant l'accouplement et la gestation à des doses de 32, 48 et 72 mg/kg/jour, l'accouplement a diminué à toutes les doses et la fertilité a diminué à des doses ≥ 32 mg/kg/jour. La durée de gestation a été augmentée à 48 mg/kg/jour.
Utilisation dans des populations spécifiques
Grossesse
Registre d'exposition pendant la grossesse
Il existe un registre d'exposition pendant la grossesse qui surveille les résultats de la grossesse chez les femmes exposées aux antidépresseurs pendant la grossesse. Les fournisseurs de soins de santé sont encouragés à inscrire les patientes en appelant le Registre national des grossesses pour les antidépresseurs au 1-844-405-6185 ou en visitant en ligne à https://womensmentalhealth.org/clnical-and-research-programs/pregnancyregistry/antidepressants/
Résumé des risques
Les données disponibles provenant d'études épidémiologiques publiées et de rapports post-commercialisation n'ont pas établi de risque accru de malformations congénitales majeures ou de fausses couches. Il existe des risques d'hypertension pulmonaire persistante du nouveau-né (HPPN) (voir Données ) et une mauvaise adaptation néonatale (voir Considérations cliniques ) avec une exposition aux inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), y compris LEXAPRO 5 mg, pendant la grossesse. Il existe des risques associés à une dépression non traitée pendant la grossesse (voir Considérations cliniques ).
Dans les études de reproduction chez l'animal, il a été démontré que l'escitalopram et le citalopram racémique ont des effets indésirables sur le développement embryonnaire/fœtal et postnatal, y compris des anomalies structurelles fœtales, lorsqu'ils sont administrés à des doses supérieures aux doses thérapeutiques humaines (voir Données ).
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 à 4 % et de 15 à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou risque embryonnaire/fœtal associé à la maladie
Les femmes qui arrêtent les antidépresseurs sont plus susceptibles de connaître une rechute de dépression majeure que les femmes qui continuent les antidépresseurs. Ce résultat est issu d'une étude longitudinale prospective de 201 femmes enceintes ayant des antécédents de dépression majeure, euthymiques et prenant des antidépresseurs en début de grossesse. Tenez compte du risque de dépression non traitée lors de l'arrêt ou de la modification d'un traitement antidépresseur pendant la grossesse et le post-partum.
Effets indésirables fœtaux/néonatals
Les nouveau-nés exposés aux ISRS ou aux IRSN, y compris Lexapro 5 mg, à la fin du troisième trimestre ont développé des complications nécessitant une hospitalisation prolongée, une assistance respiratoire et une alimentation par sonde. De telles complications peuvent survenir immédiatement après l'accouchement. Les signes cliniques signalés comprennent la détresse respiratoire, la cyanose, l'apnée, les convulsions, l'instabilité de la température, les difficultés d'alimentation, les vomissements, l'hypoglycémie, l'hypotonie, l'hypertonie, l'hyperréflexie, les tremblements, la nervosité, l'irritabilité et les pleurs constants. Ces caractéristiques sont compatibles avec soit un effet toxique direct des ISRS et des IRSN, soit, éventuellement, un syndrome de sevrage médicamenteux. Il convient de noter que, dans certains cas, le tableau clinique est compatible avec le syndrome sérotoninergique [voir AVERTISSEMENTS ET PRECAUTIONS ].
Données
Données humaines
L'exposition aux ISRS, en particulier plus tard dans la grossesse, peut augmenter le risque de PPHN. L'HPPN survient chez 1 à 2 pour 1000 naissances vivantes dans la population générale et est associée à une morbidité et une mortalité néonatales substantielles.
Données animales
Dans une étude sur le développement embryonnaire/fœtal chez le rat, l'administration orale d'escitalopram (56, 112 ou 150 mg/kg/jour) à des femelles gravides pendant la période d'organogenèse a entraîné une diminution du poids corporel du fœtus et des retards associés d'ossification aux deux doses les plus élevées. [approximativement ≥ 55 fois la dose humaine recommandée maximum (MRHD) de 20 mgs/jours sur une base mg/m2]. La toxicité maternelle (signes cliniques et diminution du gain de poids corporel et de la consommation alimentaire), légère à 56 mg/kg/jour, était présente à toutes les doses. La dose sans effet sur le développement de 56 mg/kg/jour est environ 27 fois la MRHD de 20 mg sur une base mg/m2. Aucune malformation n'a été observée à aucune des doses testées (jusqu'à 73 fois la MRHD sur une base mg/m2).
Lorsque des rats femelles ont été traitées avec de l'escitalopram (6, 12, 24 ou 48 mg/kg/jour) pendant la gestation et pendant le sevrage, une légère augmentation de la mortalité de la progéniture et un retard de croissance ont été notés à 48 mg/kg/jour, soit environ 23 fois la MRHD de 20 mg sur une base mg/m2. Une légère toxicité maternelle (signes cliniques et diminution du gain de poids corporel et de la consommation alimentaire) a été observée à cette dose. Une légère augmentation de la mortalité de la progéniture a également été observée à 24 mg/kg/jour. La dose sans effet était de 12 mg/kg/jour, soit environ 6 fois la MRHD de 20 mg sur une base mg/m2.
Dans deux études sur le développement de l'embryon/du fœtus chez le rat, l'administration orale de citalopram racémique (32, 56 ou 112 mg/kg/jour) à des femelles gravides pendant la période d'organogenèse a entraîné une diminution de la croissance et de la survie de l'embryon/du fœtus et une incidence accrue de anomalies (y compris les défauts cardiovasculaires et squelettiques) à la dose élevée, qui est environ 18 fois la MRHD de 60 mg/jour sur une base mg/m2. Cette dose a également été associée à une toxicité maternelle (signes cliniques, diminution du gain de poids corporel). La dose sans effet sur le développement était de 56 mg/kg/jour soit environ 9 fois la MRHD sur une base en mg/m2. Dans une étude de lapin, aucun effet défavorable sur le développement d'embryon/foetus n'a été observé aux doses de citalopram racémique de jusqu'à 16 mgs/kg/jours, ou environ 5 fois le MRHD sur une base mg/m2. Ainsi, des effets sur le développement du citalopram racémique ont été observés à une dose toxique pour la mère chez le rat et n'ont pas été observés chez le lapin.
Lorsque des rats femelles ont été traitées avec du citalopram racémique (4,8, 12,8 ou 32 mg/kg/jour) de la fin de la gestation jusqu'au sevrage, une augmentation de la mortalité de la progéniture au cours des 4 premiers jours suivant la naissance et un retard de croissance persistant de la progéniture ont été observés à la dose la plus élevée, ce qui est approximativement 5 fois le MRHD de 60 mgs sur une base mg/m2. La dose sans effet était de 12,8 mg/kg/jour soit environ 2 fois la MRHD sur une base en mg/m2. Des effets similaires sur la mortalité et la croissance de la progéniture ont été observés lorsque les mères ont été traitées tout au long de la gestation et au début de la lactation à des doses ≥ 24 mg/kg/jour, environ 4 fois la MRHD sur une base en mg/m2. Une dose sans effet n'a pas été déterminée dans cette étude.
Lactation
Résumé des risques
Les données de la littérature publiée rapportent la présence d'escitalopram et de desméthylescitalopram dans le lait maternel (voir Données ). Des cas de sédation excessive, d'agitation, d'agitation, de mauvaise alimentation et de faible gain de poids ont été rapportés chez les nourrissons exposés à l'escitalopram par le lait maternel (voir Considérations cliniques ),. Il n'existe aucune donnée sur les effets de l'escitalopram ou de ses métabolites sur la production de lait. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de la mère pour LEXAPRO 5 mg et tout effet indésirable potentiel de LEXAPRO ou de l'affection maternelle sous-jacente sur l'enfant allaité.
Considérations cliniques
Les nourrissons exposés à LEXAPRO 20 mg doivent être surveillés pour une sédation excessive, une agitation, une agitation, une mauvaise alimentation et une faible prise de poids.
Données
Une étude portant sur 8 mères allaitantes sous escitalopram à des doses quotidiennes de 10 à 20 mg/jour a montré que les nourrissons exclusivement allaités recevaient environ 3,9 % de la dose maternelle d'escitalopram ajustée en fonction du poids et 1,7 % de la dose maternelle ajustée en fonction du poids de desméthylcitalopram. .
Utilisation pédiatrique
La sécurité et l'efficacité de Lexapro 10 mg ont été établies chez les adolescents (âgés de 12 à 17 ans) pour le traitement du trouble dépressif majeur [voir Etudes cliniques ]. Bien que l'efficacité du traitement d'entretien chez les patients adolescents atteints de trouble dépressif majeur n'ait pas été systématiquement évaluée, l'efficacité du traitement d'entretien peut être extrapolée à partir des données sur les adultes ainsi que des comparaisons des paramètres pharmacocinétiques de l'escitalopram chez les patients adultes et adolescents.
L'innocuité et l'efficacité de Lexapro n'ont pas été établies chez les patients pédiatriques (âgés de moins de 12 ans) atteints d'un trouble dépressif majeur. Dans une étude d'innocuité ouverte de 24 semaines menée auprès de 118 enfants (âgés de 7 à 11 ans) souffrant de trouble dépressif majeur, les résultats d'innocuité étaient cohérents avec le profil d'innocuité et de tolérabilité connu de Lexapro.
L'innocuité et l'efficacité de Lexapro n'ont pas été établies chez les patients pédiatriques de moins de 18 ans atteints de trouble d'anxiété généralisée.
Une diminution de l'appétit et une perte de poids ont été observées en association avec l'utilisation d'ISRS. Par conséquent, une surveillance régulière du poids et de la croissance doit être effectuée chez les enfants et les adolescents traités par un ISRS tel que Lexapro.
Utilisation gériatrique
Environ 6 % des 1144 patients recevant de l'escitalopram dans les essais contrôlés de Lexapro 10 mg dans le trouble dépressif majeur et le TAG étaient âgés de 60 ans ou plus ; les patients assez âgés dans ces procès ont reçu des doses quotidiennes de Lexapro entre 10 et 20 mgs. Le nombre de patients âgés dans ces essais était insuffisant pour évaluer de manière adéquate d'éventuelles mesures différentielles d'efficacité et de sécurité en fonction de l'âge. Néanmoins, une plus grande sensibilité de certaines personnes âgées aux effets de Lexapro ne peut être exclue.
Les ISRS et les IRSN, y compris Lexapro 5 mg, ont été associés à des cas d'hyponatrémie cliniquement significative chez les patients âgés, qui peuvent être plus à risque de cet événement indésirable [voir Hyponatrémie ].
Dans deux études pharmacocinétiques, la demi-vie de l'escitalopram a été augmentée d'environ 50 % chez les sujets âgés par rapport aux sujets jeunes et la Cmax est restée inchangée [voir PHARMACOLOGIE CLINIQUE ]. 10 mg/jour est la dose recommandée pour les patients âgés [voir DOSAGE ET ADMINISTRATION ].
Sur 4 422 patients ayant participé aux études cliniques sur le citalopram racémique, 1 357 avaient 60 ans et plus, 1 034 avaient 65 ans et plus et 457 avaient 75 ans et plus. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais encore une fois, une plus grande sensibilité de certaines personnes âgées ne peut être exclue.
SURDOSAGE
Les effets suivants ont été rapportés avec un surdosage en comprimés de Lexapro :
- Convulsions, qui peuvent être retardées, et état mental altéré, y compris le coma.
- Toxicité cardiovasculaire, qui peut être retardée, y compris l'allongement de l'intervalle QRS et QTc, les tachyarythmies complexes étendues et les torsades de pointes. L'hypertension est la plus souvent observée, mais peut rarement voir l'hypotension seule ou avec des co-ingestants, y compris l'alcool.
- Syndrome sérotoninergique (les patients présentant un surdosage médicamenteux multiple avec d'autres médicaments prosérotoninergiques peuvent avoir un risque plus élevé).
Une surveillance cardiaque prolongée est recommandée en cas d'ingestion de surdosage de Lexapro en raison du risque d'arythmie.
La décontamination gastro-intestinale avec du charbon actif doit être envisagée chez les patients qui se présentent tôt après un surdosage de Lexapro.
Envisagez de contacter un centre antipoison (1-800-221-2222) ou un toxicologue médical pour obtenir des recommandations sur la gestion du surdosage.
CONTRE-INDICATIONS
Inhibiteurs de la monoamine oxydase (IMAO)
L'utilisation des IMAO destinés à traiter les troubles psychiatriques avec Lexapro ou dans les 14 jours suivant l'arrêt du traitement avec Lexapro 5 mg est contre-indiquée en raison d'un risque accru de syndrome sérotoninergique. L'utilisation de Lexapro 20 mg dans les 14 jours suivant l'arrêt d'un IMAO destiné à traiter les troubles psychiatriques est également contre-indiquée [voir DOSAGE ET ADMINISTRATION , et AVERTISSEMENTS ET PRECAUTIONS ].
Commencer Lexapro 20 mg chez un patient qui est traité avec des IMAO tels que le linézolide ou le bleu de méthylène intraveineux est également contre-indiqué en raison d'un risque accru de syndrome sérotoninergique [voir DOSAGE ET ADMINISTRATION , et AVERTISSEMENTS ET PRECAUTIONS ].
Pimozide
L'utilisation concomitante chez les patients prenant du pimozide est contre-indiquée [voir INTERACTIONS MÉDICAMENTEUSES ].
Hypersensibilité à l'escitalopram ou au citalopram
Lexapro 20 mg est contre-indiqué chez les patients présentant une hypersensibilité à l'escitalopram ou au citalopram ou à l'un des ingrédients inactifs de Lexapro.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le mécanisme de l'action antidépressive de l'escitalopram, l'énantiomère S du citalopram racémique, est présumé être lié à la potentialisation de l'activité sérotoninergique dans le système nerveux central (SNC) résultant de son inhibition de la recapture neuronale de la sérotonine (5-HT) par le SNC.
Pharmacodynamie
Des études in vitro et in vivo chez l'animal suggèrent que l'escitalopram est un inhibiteur hautement sélectif de la recapture de la sérotonine (ISRS) avec des effets minimes sur la recapture neuronale de la noradrénaline et de la dopamine. L'escitalopram est au moins 100 fois plus puissant que l'énantiomère R en ce qui concerne l'inhibition de la recapture de la 5-HT et l'inhibition de la vitesse de décharge neuronale de la 5-HT. La tolérance à un modèle d'effet antidépresseur chez le rat n'a pas été induite par un traitement à long terme (jusqu'à 5 semaines) avec l'escitalopram. L'escitalopram n'a pas ou très peu d'affinité pour les récepteurs sérotoninergiques (5-HT1-7) ou d'autres récepteurs, notamment les récepteurs alpha et bêta-adrénergiques, la dopamine (D1-5), l'histamine (H1-3), les muscariniques (M1-5) et les benzodiazépines récepteurs. L'escitalopram ne se lie pas non plus ou a une faible affinité pour divers canaux ioniques, notamment les canaux Na+, K+, Cl- et Ca++. L'antagonisme des récepteurs muscariniques, histaminergiques et adrénergiques a été supposé être associé à divers effets secondaires anticholinergiques, sédatifs et cardiovasculaires d'autres médicaments psychotropes.
Pharmacocinétique
La pharmacocinétique à dose unique et à doses multiples d'escitalopram est linéaire et proportionnelle à la dose dans un intervalle de doses de 10 à 30 mg/jour. La biotransformation de l'escitalopram est principalement hépatique, avec une demi-vie terminale moyenne d'environ 27 à 32 heures. Avec une administration une fois par jour, les concentrations plasmatiques à l'état d'équilibre sont atteintes en une semaine environ. À l'état d'équilibre, l'ampleur de l'accumulation d'escitalopram dans le plasma chez les jeunes sujets sains était de 2,2 à 2,5 fois les concentrations plasmatiques observées après une dose unique. Les formes posologiques d'oxalate d'escitalopram en comprimé et en solution buvable sont bioéquivalentes.
Absorption et distribution
Après une dose orale unique (comprimé ou solution de 20 mg) d'escitalopram, les concentrations sanguines maximales surviennent après environ 5 heures. L'absorption de l'escitalopram n'est pas affectée par les aliments.
La biodisponibilité absolue du citalopram est d'environ 80 % par rapport à une dose intraveineuse et le volume de distribution du citalopram est d'environ 12 L/kg. Les données spécifiques à l'escitalopram ne sont pas disponibles.
La liaison de l'escitalopram aux protéines plasmatiques humaines est d'environ 56 %.
Métabolisme et élimination
Après administration orale d'escitalopram, la fraction de médicament récupérée dans l'urine sous forme d'escitalopram et de S-déméthylcitalopram (S-DCT) est d'environ 8 % et 10 %, respectivement. La clairance orale de l'escitalopram est de 600 mL/min, dont environ 7 % sont dus à la clairance rénale.
L'escitalopram est métabolisé en S-DCT et S-didéméthylcitalopram (S-DDCT). Chez l'homme, l'escitalopram inchangé est le composé prédominant dans le plasma. À l'état d'équilibre, la concentration plasmatique du métabolite S-DCT de l'escitalopram est d'environ un tiers de celle de l'escitalopram. Le niveau de S-DDCT n'était pas détectable chez la plupart des sujets. Des études in vitro montrent que l'escitalopram est au moins 7 et 27 fois plus puissant que le S-DCT et le S-DDCT, respectivement, dans l'inhibition de la recapture de la sérotonine, ce qui suggère que les métabolites de l'escitalopram ne contribuent pas de manière significative aux actions antidépressives de l'escitalopram. Le S-DCT et le SDDCT n'ont également aucune ou très peu d'affinité pour les récepteurs sérotoninergiques (5-HT1-7) ou d'autres récepteurs, notamment les récepteurs alpha et bêta-adrénergiques, la dopamine (D1-5), l'histamine (H1-3), les muscariniques (M1- 5) et les récepteurs des benzodiazépines. S-DCT et S-DDCT ne se lient pas non plus à divers canaux ioniques, notamment les canaux Na+, K+, Cl- et Ca++.
Des études in vitro utilisant des microsomes hépatiques humains ont indiqué que le CYP3A4 et le CYP2C19 sont les principales isoenzymes impliquées dans la N-déméthylation de l'escitalopram.
Sous-groupes de population
Âge
Adolescents
Dans une étude à dose unique de 10 mg d'escitalopram, l'ASC de l'escitalopram a diminué de 19 % et la Cmax a augmenté de 26 % chez des sujets adolescents sains (âgés de 12 à 17 ans) par rapport aux adultes. Après administration répétée de 40 mg/jour de citalopram, la demi-vie d'élimination de l'escitalopram, la Cmax et l'ASC à l'état d'équilibre étaient similaires chez les patients atteints de TDM (âgés de 12 à 17 ans) par rapport aux patients adultes. Aucun ajustement posologique n'est nécessaire chez les patients adolescents.
Âgé
La pharmacocinétique de l'escitalopram chez des sujets âgés de ≥ 65 ans a été comparée à celle de sujets plus jeunes dans une étude à dose unique et à doses multiples. L'ASC et la demi-vie de l'escitalopram ont augmenté d'environ 50 % chez les sujets âgés, et la Cmax est restée inchangée. 10 mg est la dose recommandée pour les patients âgés [voir DOSAGE ET ADMINISTRATION ].
Le genre
D'après les données d'études à doses uniques et multiples mesurant l'escitalopram chez les personnes âgées, les jeunes adultes et les adolescents, aucun ajustement posologique en fonction du sexe n'est nécessaire.
Fonction hépatique réduite
La clairance orale du citalopram a été réduite de 37 % et la demi-vie a été doublée chez les patients présentant une fonction hépatique réduite par rapport aux sujets normaux. 10 mg est la dose recommandée d'escitalopram pour la plupart des patients atteints d'insuffisance hépatique [voir DOSAGE ET ADMINISTRATION ].
Fonction rénale réduite
Chez les patients présentant une insuffisance rénale légère à modérée, la clairance orale du citalopram a été réduite de 17 % par rapport aux sujets normaux. Aucun ajustement de la posologie chez ces patients n'est recommandé. Aucune information n'est disponible sur la pharmacocinétique de l'escitalopram chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine
Interactions médicament-médicament
Les données d'inhibition enzymatique in vitro n'ont pas révélé d'effet inhibiteur de l'escitalopram sur les CYP3A4, -1A2, -2C9, -2C19 et -2E1. D'après les données in vitro, l'escitalopram devrait avoir peu d'effet inhibiteur sur le métabolisme in vivo médié par ces cytochromes. Bien que les données in vivo pour répondre à cette question soient limitées, les résultats d'études d'interactions médicamenteuses suggèrent que l'escitalopram, à une dose de 20 mg, n'a aucun effet inhibiteur sur 3A4 et un effet inhibiteur modeste sur 2D6. Voir INTERACTIONS MÉDICAMENTEUSES pour des informations plus détaillées sur les données disponibles sur les interactions médicamenteuses.
Toxicologie animale et/ou pharmacologie
Changements rétiniens chez les rats
Des changements pathologiques (dégénérescence/atrophie) ont été observés dans les rétines de rats albinos dans l'étude de cancérogénicité de 2 ans avec le citalopram racémique. Il y a eu une augmentation de l'incidence et de la gravité de la pathologie rétinienne chez les rats mâles et femelles recevant 80 mg/kg/jour. Des résultats similaires n'ont pas été observés chez les rats recevant 24 mg/kg/jour de citalopram racémique pendant deux ans, chez les souris recevant jusqu'à 240 mg/kg/jour de citalopram racémique pendant 18 mois ou chez les chiens recevant jusqu'à 20 mg/kg/jour. jour de citalopram racémique pendant un an.
Des études supplémentaires pour étudier le mécanisme de cette pathologie n'ont pas été réalisées et l'importance potentielle de cet effet chez l'homme n'a pas été établie.
Changements cardiovasculaires chez les chiens
Dans une étude toxicologique d'un an, 5 des 10 chiens beagles recevant des doses orales de citalopram racémique de 8 mg/kg/jour sont morts subitement entre les semaines 17 et 31 après le début du traitement. Aucune mort subite n'a été observée chez le rat à des doses de citalopram racémique allant jusqu'à 120 mg/kg/jour, ce qui a produit des taux plasmatiques de citalopram et de ses métabolites déméthylcitalopram et didéméthylcitalopram (DDCT) similaires à ceux observés chez le chien à 8 mg/kg/jour. Une étude de dosage intraveineuse ultérieure a démontré que chez les chiens beagle, le DDCT racémique provoquait un allongement de l'intervalle QT, un facteur de risque connu pour le résultat observé chez les chiens.
Etudes cliniques
Trouble dépressif majeur
Adolescents
L'efficacité de Lexapro en tant que traitement aigu du trouble dépressif majeur chez les patients adolescents a été établie dans une étude contrôlée par placebo de 8 semaines à dose flexible qui a comparé Lexapro 10-20 mg/jour à un placebo chez des patients ambulatoires âgés de 12 à 17 ans. inclus qui répondaient aux critères du DSM-IV pour le trouble dépressif majeur. Le critère de jugement principal était le changement entre le point de départ et le point final dans l'échelle d'évaluation de la dépression des enfants - révisée (CDRS-R). Dans cette étude, Lexapro 5 mg a montré une amélioration moyenne statistiquement significative supérieure à celle du placebo sur le CDRS-R.
L'efficacité de Lexapro dans le traitement aigu du trouble dépressif majeur chez les adolescents a été établie, en partie, sur la base d'une extrapolation à partir de l'étude de 8 semaines, à dose flexible, contrôlée par placebo avec le citalopram racémique 20-40 mg/jour. Dans cette étude ambulatoire menée auprès d'enfants et d'adolescents âgés de 7 à 17 ans qui répondaient aux critères du DSM-IV pour le trouble dépressif majeur, le traitement par citalopram a montré une amélioration moyenne statistiquement plus importante par rapport au départ, par rapport au placebo, sur le CDRS-R ; les résultats positifs de cet essai provenaient en grande partie du sous-groupe d'adolescents.
Deux études supplémentaires sur le TDM à doses flexibles et contrôlées par placebo (une étude Lexapro chez des patients âgés de 7 à 17 ans et une étude sur le citalopram chez des adolescents) n'ont pas démontré d'efficacité.
Bien que l'efficacité de la maintenance chez les patients adolescents n'ait pas été systématiquement évaluée, l'efficacité de la maintenance peut être extrapolée à partir des données sur les adultes ainsi que des comparaisons des paramètres pharmacocinétiques de l'escitalopram chez les patients adultes et adolescents.
Adultes
L'efficacité de Lexapro 5 mg en tant que traitement du trouble dépressif majeur a été établie dans trois études contrôlées par placebo de 8 semaines menées chez des patients ambulatoires âgés de 18 à 65 ans qui répondaient aux critères du DSM-IV pour le trouble dépressif majeur. Le critère de jugement principal dans les trois études était le changement entre l'inclusion et le critère d'évaluation dans l'échelle d'évaluation de la dépression de Montgomery Asberg (MADRS).
Une étude à dose fixe a comparé 10 mg/jour de Lexapro et 20 mg/jour de Lexapro à un placebo et 40 mg/jour de citalopram. Les groupes de traitement 10 mg/jour et 20 mg/jour Lexapro 5 mg ont montré une amélioration moyenne statistiquement significative supérieure à celle du placebo sur le MADRS. Les groupes Lexapro 10 mg et 20 mg étaient similaires sur cette mesure de résultat.
Dans une deuxième étude à dose fixe de 10 mg/jour de Lexapro et d'un placebo, le groupe de traitement de 10 mg/jour de Lexapro a montré une amélioration moyenne statistiquement significative supérieure à celle du placebo sur le MADRS.
Dans une étude à dose flexible, comparant Lexapro 20 mg, titré entre 10 et 20 mg/jour, à un placebo et au citalopram, titré entre 20 et 40 mg/jour, le groupe de traitement Lexapro 5 mg a montré une amélioration moyenne statistiquement significative supérieure à celle du placebo sur la MADRS.
Les analyses de la relation entre les résultats du traitement et l'âge, le sexe et la race n'ont suggéré aucune réactivité différentielle sur la base de ces caractéristiques des patients.
Dans un essai à plus long terme, 274 patients répondant aux critères (DSM-IV) de trouble dépressif majeur, qui avaient répondu au cours d'une phase initiale de traitement en ouvert de 8 semaines avec Lexapro 10 ou 20 mg/jour, ont été randomisés pour poursuivre le traitement par Lexapro à leur même dose, ou à un placebo, jusqu'à 36 semaines d'observation en cas de rechute. La réponse au cours de la phase en ouvert a été définie par une diminution du score total MADRS à ≤ 12. La rechute au cours de la phase en double aveugle a été définie comme une augmentation du score total MADRS à ≥ 22, ou un arrêt en raison d'une réponse clinique insuffisante . Les patients recevant du Lexapro continu ont connu un temps de rechute statistiquement plus long que ceux recevant un placebo.
Désordre anxieux généralisé
L'efficacité de Lexapro 5 mg dans le traitement aigu du trouble anxieux généralisé (TAG) a été démontrée dans trois études multicentriques, à doses flexibles, contrôlées par placebo, d'une durée de 8 semaines, qui ont comparé Lexapro 10-20 mg/jour à un placebo chez des patients adultes ambulatoires entre 18 et 80 ans qui répondaient aux critères du DSM-IV pour le TAG. Dans les trois études, Lexapro a montré une amélioration moyenne statistiquement significative supérieure à celle du placebo sur l'échelle d'anxiété de Hamilton (HAM-A).
Il y avait trop peu de patients dans différents groupes ethniques et d'âge pour évaluer de manière adéquate si Lexapro a ou non des effets différentiels dans ces groupes. Il n'y avait pas de différence de réponse à Lexapro entre les hommes et les femmes.
INFORMATIONS PATIENTS
Lexapro® (leks-a-pro) (escitalopram) Comprimés/Solution orale
Lisez le Guide des médicaments fourni avec Lexapro avant de commencer à le prendre et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ce Guide de Médication ne prend pas l'endroit de parler à votre pourvoyeur de soins de santé de votre condition médicale ou traitement. Discutez avec votre fournisseur de soins de santé s'il y a quelque chose que vous ne comprenez pas ou si vous voulez en savoir plus.
Quelle est l'information la plus importante que je devrais connaître sur Lexapro 20mg ?
Lexapro 10 mg et d'autres médicaments antidépresseurs peuvent provoquer des effets indésirables graves, notamment :
Gardez toutes les visites de suivi avec votre fournisseur de soins de santé et appelez entre les visites si vous vous inquiétez des symptômes.
Appelez immédiatement votre fournisseur de soins de santé si vous présentez l'un des symptômes suivants, ou appelez le 911 en cas d'urgence, surtout s'ils sont nouveaux, s'aggravent ou vous inquiètent :
Appelez immédiatement votre fournisseur de soins de santé si vous présentez l'un des symptômes suivants ou appelez le 911 en cas d'urgence. Lexapro peut être associé à ces effets secondaires graves :
Les symptômes chez les hommes peuvent inclure :
Les symptômes chez les femmes peuvent inclure :
Parlez à votre fournisseur de soins de santé si vous développez des changements dans votre fonction sexuelle ou si vous avez des questions ou des préoccupations concernant des problèmes sexuels pendant le traitement avec Lexapro. Il peut y avoir des traitements que votre fournisseur de soins de santé peut suggérer.
- Lexapro 5 mg et d'autres médicaments antidépresseurs peuvent augmenter les pensées ou actions suicidaires chez certains enfants, adolescents ou jeunes adultes au sein de la premiers mois de traitement ou lorsque la dose est modifiée.
- La dépression ou d'autres maladies mentales graves sont les causes les plus importantes de pensées ou d'actions suicidaires.
- Surveillez ces changements et appelez immédiatement votre fournisseur de soins de santé si vous remarquez :
- Changements nouveaux ou soudains d'humeur, de comportement, d'actions, de pensées ou de sentiments, surtout s'ils sont graves.
- Portez une attention particulière à ces changements lorsque Lexapro 5 mg est démarré ou lorsque la dose est modifiée.
- tentatives de suicide
- agir sur des impulsions dangereuses
- comportement agressif ou violent
- pensées sur le suicide ou la mort
- dépression nouvelle ou pire
- crises d'anxiété ou de panique nouvelles ou pires
- se sentir agité, agité, en colère ou irritable
- troubles du sommeil
- une augmentation de l'activité ou parler plus que ce qui est normal pour vous
- autres changements inhabituels de comportement ou d'humeur
- agitation, hallucinations, coma ou autres changements de l'état mental
- problèmes de coordination ou contractions musculaires (réflexes hyperactifs)
- rythme cardiaque accéléré, pression artérielle élevée ou basse
- transpiration ou fièvre
- nausées, vomissements ou diarrhée
- rigidité musculaire
- difficulté à respirer
- gonflement du visage, de la langue, des yeux ou de la bouche
- éruption cutanée, démangeaisons (urticaire) ou cloques, seules ou accompagnées de fièvre ou de douleurs articulaires
- énergie légèrement augmentée
- gros troubles du sommeil
- pensées de course
- comportement imprudent
- des idées exceptionnellement grandioses
- bonheur excessif ou irritabilité
- parler plus ou plus vite que d'habitude
- mal de tête
- faiblesse ou sensation d'instabilité
- confusion, problèmes de concentration ou de réflexion ou problèmes de mémoire
Seules certaines personnes sont à risque pour ces problèmes. Vous voudrez peut-être subir un examen de la vue pour voir si vous êtes à risque et recevoir un traitement préventif si vous l'êtes.
- douleur oculaire
- changements de vision
- gonflement ou rougeur dans ou autour de l'œil
- Éjaculation retardée ou incapacité d'avoir une éjaculation
- Diminution de la libido
- Problèmes pour obtenir ou maintenir une érection
- Diminution de la libido
- Orgasme retardé ou incapacité à avoir un orgasme
N'arrêtez pas Lexapro sans en parler d'abord à votre fournisseur de soins de santé. L'arrêt trop rapide de Lexapro 5 mg peut entraîner des symptômes graves, notamment :
- anxiété, irritabilité, humeur haute ou basse, sensation d'agitation ou changements dans les habitudes de sommeil
- maux de tête, sueurs, nausées, étourdissements
- sensations de choc électrique, tremblements, confusion
Qu'est-ce que Lexapro ?
Lexapro 20mg est un médicament délivré sur ordonnance utilisé pour traiter la dépression. Il est important de discuter avec votre fournisseur de soins de santé des risques de traiter la dépression et aussi des risques de ne pas la traiter. Vous devriez discuter de tous les choix de traitement avec votre fournisseur de soins de santé. Lexapro est également utilisé pour traiter :
- Trouble dépressif majeur (TDM)
- Trouble d'anxiété généralisée (TAG)
Parlez-en à votre fournisseur de soins de santé si vous ne pensez pas que votre état s'améliore avec le traitement Lexapro.
Qui ne devrait pas prendre Lexapro 5mg ?
Ne prenez pas Lexapro 10 mg si vous :
Les personnes qui prennent Lexapro 20 mg à temps proche d'un IMAO peuvent avoir des effets secondaires graves, voire mortels. Consultez immédiatement un médecin si vous présentez l'un de ces symptômes :
- êtes allergique à l'escitalopram ou au citalopram ou à l'un des ingrédients de Lexapro. Voir la fin de ce guide de médication pour une liste complète d'ingrédients dans Lexapro.
- Prenez un inhibiteur de la monoamine oxydase (IMAO). Demandez à votre fournisseur de soins de santé ou à un pharmacien si vous n'êtes pas sûr de prendre un IMAO, y compris le linézolide.
- Ne prenez pas d'IMAO dans les 2 semaines suivant l'arrêt de Lexapro 10 mg, sauf indication contraire de votre médecin.
- Ne commencez pas Lexapro 20 mg si vous avez arrêté de prendre un IMAO au cours des 2 dernières semaines, sauf indication contraire de votre médecin.
- forte fièvre
- spasmes musculaires incontrôlés
- muscles raides
- changements rapides de la fréquence cardiaque ou de la pression artérielle
- confusion
- perte de connaissance (évanouissement)
- Ne prenez pas Lexapro avec Orap® (pimozide) car la prise de ces deux médicaments ensemble peut causer de graves problèmes cardiaques.
Que dois-je dire à mon fournisseur de soins de santé avant de prendre Lexapro 20 mg ? Demandez si vous n'êtes pas sûr.
Avant de commencer Lexapro 20 mg, informez votre professionnel de la santé si vous :
- Prenez certains médicaments tels que :
- Triptans utilisés pour traiter la migraine
- Médicaments utilisés pour traiter l'humeur, l'anxiété, les troubles psychotiques ou de la pensée, y compris les tricycliques, le lithium, les ISRS, les IRSN, les amphétamines ou les antipsychotiques
- Tramadol
- Suppléments en vente libre tels que le tryptophane ou le millepertuis
- avoir des problèmes de foie
- avoir des problèmes rénaux
- avoir des problèmes cardiaques
- avez ou avez eu des convulsions ou des convulsions
- souffrez de trouble bipolaire ou de manie
- avez un faible taux de sodium dans le sang
- avoir des antécédents d'accident vasculaire cérébral
- avoir une pression artérielle élevée
- avez ou avez eu des problèmes de saignement
- êtes enceinte ou envisagez de devenir enceinte. La prise de LEXAPRO en fin de grossesse peut entraîner un risque accru de certains problèmes chez votre nouveau-né. Parlez à votre fournisseur de soins de santé des avantages et des risques du traitement de la dépression pendant la grossesse
- Si vous tombez enceinte pendant que vous prenez LEXAPRO, parlez à votre fournisseur de soins de santé de l'inscription au registre national des grossesses pour les antidépresseurs. Vous pouvez vous inscrire en appelant le 1-844-405-6185 ou en allant sur https://womensmentalhealth.org/clinicaland-researchprograms/pregnancyregistry/antidepressants/
- allaitez ou envisagez d'allaiter. Lexapro peut passer dans votre lait maternel. Discutez avec votre fournisseur de soins de santé de la meilleure façon de nourrir votre bébé si vous prenez Lexapro.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Lexapro 10 mg et certains médicaments peuvent interagir les uns avec les autres, peuvent ne pas fonctionner aussi bien ou peuvent provoquer des effets secondaires graves.
Votre fournisseur de soins de santé ou votre pharmacien peut vous dire s'il est sécuritaire de prendre Lexapro 20 mg avec vos autres médicaments. Ne commencez ni n'arrêtez aucun médicament pendant que vous prenez Lexapro 10 mg sans en parler d'abord à votre professionnel de la santé.
Si vous prenez Lexapro, vous ne devez prendre aucun autre médicament contenant de l'escitalopram ou du citalopram, notamment : Celexa.
Comment dois-je prendre Lexapro ?
- Prenez Lexapro exactement comme prescrit. Votre fournisseur de soins de santé devra peut-être modifier la dose de Lexapro jusqu'à ce que ce soit la bonne dose pour vous.
- Lexapro 5 mg peut être pris avec ou sans nourriture.
- Si vous oubliez une dose de Lexapro, prenez la dose oubliée dès que vous vous en souvenez. S'il est presque l'heure de la prochaine dose, sautez la dose oubliée et prenez votre prochaine dose à l'heure habituelle. Ne prenez pas deux doses de Lexapro en même temps.
- Si vous avez pris trop de Lexapro, appelez immédiatement votre fournisseur de soins de santé ou un centre antipoison, ou obtenez un traitement d'urgence.
Que dois-je éviter en prenant Lexapro ?
Lexapro 5 mg peut provoquer de la somnolence ou affecter votre capacité à prendre des décisions, à penser clairement ou à réagir rapidement. Vous ne devez pas conduire, utiliser des machines lourdes ou faire d'autres activités dangereuses jusqu'à ce que vous sachiez comment Lexapro vous affecte. Ne buvez pas d'alcool pendant l'utilisation de Lexapro.
Quels sont les effets secondaires possibles de Lexapro 20mg ?
Lexapro 10 mg peut provoquer des effets indésirables graves, y compris tous de celles décrites dans la section intitulée « Quelles sont les informations les plus importantes que je devrais connaître sur Lexapro ? »
Les effets secondaires possibles courants chez les personnes qui prennent Lexapro 5 mg incluent :
- Nausée
- Envie de dormir
- La faiblesse
- Vertiges
- Se sentir anxieux
- Troubles du sommeil
- Problèmes sexuels
- Transpiration
- Tremblement
- Ne pas avoir faim
- Bouche sèche
- Constipation
- Infection
- Bâillement
Les autres effets indésirables chez les enfants et les adolescents comprennent :
- augmentation de la soif
- augmentation anormale des mouvements musculaires ou de l'agitation
- saignement de nez
- miction difficile
- menstruations abondantes
- taux de croissance et changement de poids éventuellement ralentis. La taille et le poids de votre enfant doivent être surveillés pendant le traitement par Lexapro.
Dites à votre fournisseur de soins de santé si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas. Ce ne sont pas tous les effets secondaires possibles de Lexapro. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou votre pharmacien.
APPELER VOTRE MEDECIN POUR OBTENIR DES CONSEILS MEDICAUX SUR LES EFFETS SECONDAIRES. VOUS POUVEZ SIGNALER LES EFFETS SECONDAIRES À LA FDA AU 1-800-FDA-1088.
Comment dois-je conserver Lexapro 20 mg ?
- Conservez Lexapro entre 68 °F et 77 °F (20 °C à 25 °C) ; excursions autorisées jusqu'à 59 °F à 86 °F (15 °C à 30 °C).
- Gardez la bouteille de Lexapro bien fermée.
Gardez Lexapro 10 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur Lexapro
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. N'utilisez pas Lexapro pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas Lexapro 10mg à d'autres personnes, même si elles ont la même condition. Cela peut leur nuire.
Ce Guide de Médication résume les informations les plus importantes sur Lexapro. Si vous souhaitez plus d'informations, parlez-en à votre fournisseur de soins de santé. Vous pouvez demander à votre fournisseur de soins de santé ou à votre pharmacien des informations sur Lexapro qui sont écrites pour les professionnels de la santé.
Pour plus d'informations sur Lexapro 20mg appelez 1-800-678-1605 ou rendez-vous sur www.Lexapro.com.
Quels sont les ingrédients de Lexapro 20mg ?
Ingrédient actif : oxalate d'escitalopram Ingrédients inactifs :
- talc, croscarmellose sodique, cellulose microcristalline/dioxyde de silicium colloïdal et stéarate de magnésium. Le pelliculage contient de l'hypromellose, du dioxyde de titane et du polyéthylène glycol.
- Solution orale: sorbitol, eau purifiée, acide citrique, citrate de sodium, acide malique, glycérine, propylène glycol, méthylparabène, propylparabène et arôme naturel de menthe poivrée (la solution buvable n'est pas commercialisée actuellement).
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
