Wellbutrin 150mg, 300mg Bupropion Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Wellbutrin 150 mg et comment est-il utilisé ?
Wellbutrin 150 mg est un médicament sur ordonnance utilisé pour traiter les symptômes de la dépression majeure et des troubles affectifs saisonniers. Wellbutrin 150 mg peut être utilisé seul ou avec d'autres médicaments.
Wellbutrin 150 mg appartient à une classe de médicaments appelés antidépresseurs, inhibiteurs de la recapture de la dopamine, antidépresseurs, autres, aides à l'arrêt du tabac.
Quels sont les effets secondaires possibles de Wellbutrin 150mg ?
Wellbutrin peut provoquer des effets secondaires graves, notamment :
- saisie (convulsions),
- confusion,
- changements inhabituels d'humeur ou de comportement,
- Vision floue,
- vision tunnel,
- douleur ou gonflement des yeux,
- voir des halos autour des lumières,
- rythme cardiaque rapide ou irrégulier,
- pensées de course,
- augmentation de l'énergie,
- comportement imprudent,
- se sentir extrêmement heureux ou irritable,
- parler plus que d'habitude, et
- graves problèmes de sommeil
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Wellbutrin incluent :
- bouche sèche,
- nez encombré,
- problèmes de vue,
- problèmes auditifs,
- nausée,
- vomissement,
- constipation,
- troubles du sommeil (insomnie),
- tremblements,
- transpiration,
- se sentir anxieux ou nerveux,
- battements de coeur rapides,
- confusion,
- agitation,
- hostilité,
- éruption,
- mal de tête,
- des étourdissements et
- douleur articulaire
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Wellbutrin. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088
ATTENTION
PENSÉES ET COMPORTEMENTS SUICIDAIRES
SUICIDALITÉ ET MÉDICAMENTS ANTIDÉPRESSEURS
Les antidépresseurs ont augmenté le risque de pensées et de comportements suicidaires chez les enfants, les adolescents et les jeunes adultes dans les essais à court terme. Ces essais n'ont pas montré d'augmentation du risque de pensées et de comportements suicidaires avec l'utilisation d'antidépresseurs chez les sujets de plus de 24 ans ; il y avait une réduction du risque avec l'utilisation d'antidépresseurs chez les sujets âgés de 65 ans et plus [voir MISES EN GARDE ET PRÉCAUTIONS].
Chez les patients de tous âges qui commencent un traitement antidépresseur, surveiller étroitement l'aggravation et l'apparition de pensées et de comportements suicidaires. Informez les familles et les soignants de la nécessité d'une surveillance étroite et de la communication avec le prescripteur [voir MISES EN GARDE ET PRÉCAUTIONS].
LA DESCRIPTION
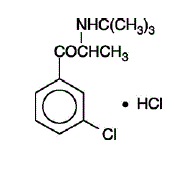
WELLBUTRIN (chlorhydrate de bupropion), un antidépresseur de la classe des aminocétones, n'est chimiquement pas apparenté aux inhibiteurs tricycliques, tétracycliques, sélectifs de la recapture de la sérotonine ou à d'autres agents antidépresseurs connus. Sa structure ressemble étroitement à celle du diéthylpropion ; il est apparenté aux phényléthylamines. Il est désigné sous le nom de chlorhydrate de (±)-1-(3-chlorophényl)-2-[(1,1-diméthyléthyl)amino]-1-propanone. Le poids moléculaire est de 276,2. La formule moléculaire est C13H18ClNO•HCl. La poudre de chlorhydrate de bupropion est blanche, cristalline et très soluble dans l'eau. Il a un goût amer et produit la sensation d'anesthésie locale sur la muqueuse buccale. La formule structurale est :
WELLBUTRIN est fourni pour administration orale sous forme de comprimés pelliculés de 75 mg (or jaune) et de 100 mg (rouge). Chaque comprimé contient la quantité indiquée sur l'étiquette de chlorhydrate de bupropion et les ingrédients inactifs : comprimé de 75 mg - D&C Yellow No. 10 Lake, FD&C Yellow No. 6 Lake, hydroxypropylcellulose, hypromellose, cellulose microcristalline, polyéthylèneglycol, talc et dioxyde de titane ; Comprimé de 100 mg - FD&C Red No. 40 Lake, FD&C Yellow No. 6 Lake, hydroxypropylcellulose, hypromellose, cellulose microcristalline, polyéthylèneglycol, talc et dioxyde de titane.
LES INDICATIONS
WELLBUTRIN (chlorhydrate de bupropion) est indiqué pour le traitement du trouble dépressif majeur (TDM), tel que défini par le Manuel diagnostique et statistique (DSM).
L'efficacité de WELLBUTRIN 300 mg dans le traitement d'un épisode dépressif majeur a été établie dans deux essais cliniques contrôlés de 4 semaines et un essai clinique ambulatoire contrôlé de 6 semaines chez des sujets adultes atteints de TDM [voir Etudes cliniques ].
DOSAGE ET ADMINISTRATION
Instructions générales d'utilisation
Pour minimiser le risque de convulsions, augmentez progressivement la dose [voir AVERTISSEMENTS ET PRECAUTIONS ]. Les augmentations de dose ne doivent pas dépasser 100 mg/jour sur une période de 3 jours. Les comprimés WELLBUTRIN doivent être avalés entiers et non écrasés, divisés ou mâchés. WELLBUTRIN 300 mg peut être pris avec ou sans nourriture.
La dose initiale recommandée est de 200 mg/jour, administrée à raison de 100 mg deux fois par jour. Après 3 jours d'administration, la dose peut être augmentée à 300 mg/jour, administrée à raison de 100 mg 3 fois par jour, avec au moins 6 heures entre les doses successives. Un dosage supérieur à 300 mg/jour peut être réalisé en utilisant les comprimés de 75 ou 100 mg.
Un maximum de 450 mg/jour, administré en doses fractionnées ne dépassant pas 150 mg chacune, peut être envisagé chez les patients ne présentant aucune amélioration clinique après plusieurs semaines de traitement à 300 mg/jour. Administrer le comprimé à 100 mg 4 fois par jour pour ne pas dépasser la limite de 150 mg en une seule prise.
Il est généralement admis que les épisodes aigus de dépression nécessitent plusieurs mois ou plus de traitement antidépresseur au-delà de la réponse à l'épisode aigu. On ne sait pas si la dose de WELLBUTRIN nécessaire pour le traitement d'entretien est identique à la dose qui a fourni une réponse initiale. Réévaluer périodiquement la nécessité d'un traitement d'entretien et la dose appropriée pour un tel traitement.
Ajustement de la dose chez les patients atteints d'insuffisance hépatique
Chez les patients présentant une insuffisance hépatique modérée à sévère (score de Child-Pugh : 7 à 15), la dose maximale de WELLBUTRIN 150 mg est de 75 mg/jour. Chez les patients présentant une insuffisance hépatique légère (score de Child-Pugh : 5 à 6), envisager de réduire la dose et/ou la fréquence d'administration [voir Utilisation dans des populations spécifiques , PHARMACOLOGIE CLINIQUE ].
Ajustement posologique chez les patients insuffisants rénaux
Envisager de réduire la dose et/ou la fréquence de WELLBUTRIN 150 mg chez les patients présentant une insuffisance rénale (taux de filtration glomérulaire inférieur à 90 ml/min) [voir Utilisation dans des populations spécifiques , PHARMACOLOGIE CLINIQUE ].
Basculement d'un patient vers ou depuis un antidépresseur inhibiteur de la monoamine oxydase (IMAO)
Au moins 14 jours doivent s'écouler entre l'arrêt d'un IMAO destiné à traiter la dépression et le début du traitement par WELLBUTRIN. Inversement, il faut attendre au moins 14 jours après l'arrêt de WELLBUTRIN avant de commencer un antidépresseur IMAO [voir CONTRE-INDICATIONS , INTERACTIONS MÉDICAMENTEUSES ].
Utilisation de WELLBUTRIN avec des IMAO réversibles tels que le linézolide ou le bleu de méthylène
Ne pas commencer WELLBUTRIN 300 mg chez un patient qui est traité par un IMAO réversible tel que le linézolide ou le bleu de méthylène par voie intraveineuse. Les interactions médicamenteuses peuvent augmenter le risque de réactions hypertensives. Chez un patient qui nécessite un traitement plus urgent d'une affection psychiatrique, des interventions non pharmacologiques, y compris une hospitalisation, doivent être envisagées [voir CONTRE-INDICATIONS , INTERACTIONS MÉDICAMENTEUSES ].
Dans certains cas, un patient recevant déjà un traitement par WELLBUTRIN peut nécessiter un traitement urgent avec du linézolide ou du bleu de méthylène par voie intraveineuse. Si des alternatives acceptables au traitement par le linézolide ou le bleu de méthylène par voie intraveineuse ne sont pas disponibles et que les avantages potentiels du traitement par le linézolide ou le bleu de méthylène par voie intraveineuse sont jugés supérieurs aux risques de réactions hypertensives chez un patient particulier, WELLBUTRIN 300 mg doit être arrêté rapidement et le linézolide ou le méthylène par voie intraveineuse bleu peut être administré. Le patient doit être surveillé pendant 2 semaines ou jusqu'à 24 heures après la dernière dose de linézolide ou de bleu de méthylène par voie intraveineuse, selon la première éventualité. Le traitement par WELLBUTRIN 300 mg peut être repris 24 heures après la dernière dose de linézolide ou de bleu de méthylène par voie intraveineuse.
Le risque d'administration de bleu de méthylène par des voies non intraveineuses (telles que des comprimés oraux ou par injection locale) ou à des doses intraveineuses bien inférieures à 1 mg/kg avec WELLBUTRIN 300 mg n'est pas clair. Le clinicien doit néanmoins être conscient de la possibilité d'une interaction médicamenteuse avec une telle utilisation [voir CONTRE-INDICATIONS , INTERACTIONS MÉDICAMENTEUSES ].
COMMENT FOURNIE
Formes posologiques et points forts
- 75 mg – comprimés jaune-or, ronds, biconvexes portant l'inscription « WELLBUTRIN 75 ».
- 100 mg – comprimés rouges, ronds, biconvexes portant l'inscription « WELLBUTRIN 100 ».
Stockage et manutention
Les comprimés WELLBUTRIN 150mg, 75 mg de chlorhydrate de bupropion, sont des comprimés jaune-or, ronds, biconvexes imprimés avec "WELLBUTRIN 75" en flacons de 100 ( CDN 0173-0177-55).
Les comprimés WELLBUTRIN, 100 mg de chlorhydrate de bupropion, sont des comprimés rouges, ronds, biconvexes portant l'inscription « WELLBUTRIN 100 » en flacons de 100 ( CDN 0173-0178-55).
Conserver à température ambiante, 20° à 25°C (68° à 77°F); excursions autorisées entre 15°C et 30°C (59°F et 86°F) [Voir Température ambiante contrôlée USP ]. Protégez de la lumière et de l'humidité.
Fabriqué pour : GlaxoSmithKline, Research Triangle Park,. Révisé : novembre 2019
EFFETS SECONDAIRES
Les effets indésirables suivants sont discutés plus en détail dans d'autres sections de l'étiquetage :
- Pensées et comportements suicidaires chez les adolescents et les jeunes adultes [voir AVERTISSEMENT ENCADRÉ , AVERTISSEMENTS ET PRECAUTIONS ]
- Symptômes neuropsychiatriques et risque suicidaire dans le traitement de sevrage tabagique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Saisie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypertension [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Activation de la manie ou de l'hypomanie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Psychose et autres réactions neuropsychiatriques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Glaucome à angle fermé [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions d'hypersensibilité [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
Effets indésirables entraînant l'arrêt du traitement
Les effets indésirables ont été suffisamment gênants pour entraîner l'arrêt du traitement par WELLBUTRIN chez environ 10 % des 2 400 sujets et volontaires sains ayant participé aux essais cliniques lors du développement initial du produit. Les événements les plus courants entraînant l'arrêt comprennent les troubles neuropsychiatriques (3,0 %), principalement l'agitation et les anomalies de l'état mental ; troubles gastro-intestinaux (2,1 %), principalement nausées et vomissements ; troubles neurologiques (1,7 %), principalement convulsions, maux de tête et troubles du sommeil ; et des problèmes dermatologiques (1,4 %), principalement des éruptions cutanées. Il est important de noter, cependant, que bon nombre de ces événements sont survenus à des doses supérieures à la dose quotidienne recommandée.
Effets indésirables couramment observés
Les effets indésirables fréquemment rencontrés chez les sujets traités par WELLBUTRIN sont l'agitation, la bouche sèche, l'insomnie, les maux de tête/migraine, les nausées/vomissements, la constipation, les tremblements, les étourdissements, la transpiration excessive, la vision floue, la tachycardie, la confusion, les éruptions cutanées, l'hostilité, l'arythmie cardiaque et les troubles auditifs. perturbation.
Le tableau 2 résume les effets indésirables survenus dans les essais contrôlés par placebo à une incidence d'au moins 1 % des sujets recevant WELLBUTRIN 150 mg et plus fréquemment chez ces sujets que dans le groupe placebo.
Autres effets indésirables observés au cours du développement clinique de WELLBUTRIN
Les conditions et la durée d'exposition à WELLBUTRIN variaient considérablement, et une part importante de l'expérience a été acquise dans des contextes cliniques ouverts et non contrôlés. Au cours de cette expérience, de nombreux événements indésirables ont été rapportés ; cependant, sans contrôles appropriés, il est impossible de déterminer avec certitude quels événements ont été ou n'ont pas été causés par WELLBUTRIN. L'énumération suivante est organisée par système d'organes et décrit les événements en fonction de leur fréquence relative de signalement dans la base de données.
Les définitions de fréquence suivantes sont utilisées : Les effets indésirables fréquents sont définis comme ceux qui surviennent chez au moins 1/100 sujets. Les effets indésirables peu fréquents sont ceux qui surviennent chez 1/100 à 1/1 000 sujets, tandis que les événements rares sont ceux qui surviennent chez moins de 1/1 000 sujets.
Cardiovasculaire Fréquent était l'œdème; les douleurs thoraciques, les anomalies de l'électrocardiogramme (ECG) (battements prématurés et modifications ST-T non spécifiques) et l'essoufflement/dyspnée étaient peu fréquents ; rares étaient les bouffées vasomotrices et l'infarctus du myocarde.
Dermatologique : Rare était l'alopécie.
Endocrine: Rare était la gynécomastie; rare était la glycosurie.
Gastro-intestinal : Peu fréquents étaient la dysphagie, les troubles de la soif et les lésions hépatiques/la jaunisse ; rare était la perforation intestinale.
Génito-urinaire : Fréquent était la nycturie; peu fréquents étaient une irritation vaginale, un gonflement des testicules, une infection des voies urinaires, une érection douloureuse et un retard de l'éjaculation; rares étaient l'énurésie et l'incontinence urinaire.
Neurologique : Fréquents étaient l'ataxie/l'incoordination, les convulsions, les myoclonies, la dyskinésie et la dystonie ; rares étaient la mydriase, les vertiges et la dysarthrie; rares étaient les anomalies de l'électroencéphalogramme (EEG) et les troubles de l'attention.
Neuropsychiatrique : Fréquents étaient manie/hypomanie, augmentation de la libido, hallucinations, diminution de la fonction sexuelle et dépression ; rares étaient les troubles de la mémoire, la dépersonnalisation, la psychose, la dysphorie, l'instabilité de l'humeur, la paranoïa et les troubles de la pensée formelle ; rares étaient les idées suicidaires.
Plaintes orales : Fréquent était la stomatite; rares étaient les maux de dents, le bruxisme, l'irritation des gencives et l'œdème buccal.
Respiratoire: Peu fréquents étaient la bronchite et l'essoufflement/dyspnée ; rare était l'embolie pulmonaire.
Sens spéciaux : Les troubles visuels étaient peu fréquents ; rare était la diplopie.
Non spécifique : Les symptômes pseudo-grippaux étaient fréquents ; la douleur non spécifique était peu fréquente ; rare était le surdosage.
Altération de l'appétit et du poids
Une perte de poids supérieure à 5 livres. survenue chez 28 % des sujets recevant WELLBUTRIN. Cette incidence est environ le double de celle observée chez des sujets comparables traités avec des tricycliques ou un placebo. De plus, alors que 35 % des sujets recevant des antidépresseurs tricycliques ont pris du poids, seuls 9,4 % des sujets traités par WELLBUTRIN l'ont fait. Par conséquent, si la perte de poids est un signe révélateur majeur de la maladie dépressive d'un patient, le potentiel anorexigène et/ou amaigrissant de WELLBUTRIN doit être pris en compte.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de WELLBUTRIN et ne sont pas décrits ailleurs sur l'étiquette. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Corps (Général)
Arthralgie, myalgie et fièvre avec éruption cutanée et autres symptômes suggérant une hypersensibilité retardée. Ces symptômes peuvent ressembler à une maladie sérique [voir AVERTISSEMENTS ET PRECAUTIONS ].
Cardiovasculaire
Hypertension (dans certains cas sévère), hypotension orthostatique, bloc cardiaque du troisième degré.
Endocrine
Hyponatrémie, syndrome de sécrétion inappropriée d'hormone antidiurétique, hyperglycémie, hypoglycémie.
Gastro-intestinal
Oesophagite, hépatite.
Hémique et lymphatique
Ecchymose, leucocytose, leucopénie, thrombocytopénie. Des modifications du PT et/ou de l'INR, rarement associées à des complications hémorragiques ou thrombotiques, ont été observées lorsque le bupropion était co-administré avec la warfarine.
Musculo-squelettique
Rigidité musculaire/fièvre/rhabdomyolyse, faiblesse musculaire.
Système nerveux
Agression, coma, suicide réussi, délire, rêves anormaux, idéation paranoïaque, paresthésie, parkinsonisme, agitation, tentative de suicide, démasquage de la dyskinésie tardive.
Peau et appendices
Syndrome de Stevens-Johnson, œdème de Quincke, dermatite exfoliative, urticaire.
Sens spéciaux
Acouphènes, augmentation de la pression intraoculaire.
INTERACTIONS MÉDICAMENTEUSES
Possibilité que d'autres médicaments affectent WELLBUTRIN
Le bupropion est principalement métabolisé en hydroxybupropion par le CYP2B6. Par conséquent, il existe un potentiel d'interactions médicamenteuses entre WELLBUTRIN et des médicaments qui sont des inhibiteurs ou des inducteurs du CYP2B6.
Inhibiteurs du CYP2B6
Ticlopidine Et Clopidogrel
Un traitement concomitant avec ces médicaments peut augmenter l'exposition au bupropion mais diminuer l'exposition à l'hydroxybupropion. En fonction de la réponse clinique, un ajustement posologique de WELLBUTRIN peut être nécessaire en cas de co-administration avec des inhibiteurs du CYP2B6 (par exemple, ticlopidine ou clopidogrel) [voir PHARMACOLOGIE CLINIQUE ].
Inducteurs du CYP2B6
Ritonavir, Lopinavir et Efavirenz
Un traitement concomitant avec ces médicaments peut diminuer l'exposition au bupropion et à l'hydroxybupropion. Une augmentation de la posologie de WELLBUTRIN peut être nécessaire en cas de co-administration avec le ritonavir, le lopinavir ou l'éfavirenz [voir PHARMACOLOGIE CLINIQUE ] mais ne doit pas dépasser la dose maximale recommandée.
Carbamazépine, Phénobarbital, Phénytoïne
Bien qu'ils n'aient pas été systématiquement étudiés, ces médicaments peuvent induire le métabolisme du bupropion et diminuer l'exposition au bupropion [voir PHARMACOLOGIE CLINIQUE ]. Si le bupropion est utilisé en concomitance avec un inducteur du CYP, il peut être nécessaire d'augmenter la dose de bupropion, mais la dose maximale recommandée ne doit pas être dépassée.
Potentiel pour WELLBUTRIN 300mg d'affecter d'autres médicaments
Médicaments métabolisés par le CYP2D6
Le bupropion et ses métabolites (érythrohydrobupropion, thréohydrobupropion, hydroxybupropion) sont des inhibiteurs du CYP2D6. Par conséquent, la co-administration de WELLBUTRIN avec des médicaments métabolisés par le CYP2D6 peut augmenter les expositions aux médicaments qui sont des substrats du CYP2D6. Ces médicaments comprennent certains antidépresseurs (p. ex., venlafaxine, nortriptyline, imipramine, désipramine, paroxétine, fluoxétine et sertraline), des antipsychotiques (p. ex., halopéridol, rispéridone, thioridazine), des bêta-bloquants (p. ex., métoprolol) et des antiarythmiques de type 1C (p. ex. , propafénone et flécaïnide). En cas d'utilisation concomitante avec WELLBUTRIN, il peut être nécessaire de diminuer la dose de ces substrats du CYP2D6, en particulier pour les médicaments à index thérapeutique étroit.
Les médicaments qui nécessitent une activation métabolique par le CYP2D6 pour être efficaces (par exemple, le tamoxifène) pourraient théoriquement avoir une efficacité réduite lorsqu'ils sont administrés en concomitance avec des inhibiteurs du CYP2D6 tels que le bupropion. Les patients traités simultanément avec WELLBUTRIN et de tels médicaments peuvent nécessiter des doses plus élevées du médicament [voir PHARMACOLOGIE CLINIQUE ].
Digoxine
L'administration concomitante de WELLBUTRIN avec la digoxine peut diminuer les taux plasmatiques de digoxine. Surveiller les taux plasmatiques de digoxine chez les patients traités simultanément par WELLBUTRIN et la digoxine [voir PHARMACOLOGIE CLINIQUE ].
Médicaments qui abaissent le seuil de crise
Soyez extrêmement prudent lors de la co-administration de WELLBUTRIN avec d'autres médicaments qui abaissent le seuil épileptogène (par exemple, d'autres produits à base de bupropion, des antipsychotiques, des antidépresseurs, de la théophylline ou des corticostéroïdes systémiques). Utiliser de faibles doses initiales et augmenter progressivement la dose [voir CONTRE-INDICATIONS , AVERTISSEMENTS ET PRECAUTIONS ].
Médicaments dopaminergiques (lévodopa et amantadine)
Le bupropion, la lévodopa et l'amantadine ont des effets agonistes de la dopamine. Une toxicité sur le SNC a été rapportée lorsque le bupropion était co-administré avec la lévodopa ou l'amantadine. Les effets indésirables ont inclus agitation, agitation, tremblements, ataxie, troubles de la marche, vertiges et étourdissements. On suppose que la toxicité résulte des effets cumulatifs des agonistes de la dopamine. Soyez prudent lors de l'administration concomitante de WELLBUTRIN 150 mg avec ces médicaments.
Utiliser avec de l'alcool
Dans l'expérience post-commercialisation, de rares cas d'événements neuropsychiatriques indésirables ou de diminution de la tolérance à l'alcool ont été rapportés chez des patients qui buvaient de l'alcool pendant le traitement par WELLBUTRIN. La consommation d'alcool pendant le traitement par WELLBUTRIN doit être minimisée ou évitée.
Inhibiteurs MAO
Le bupropion inhibe la recapture de la dopamine et de la noradrénaline. L'utilisation concomitante d'IMAO et de bupropion est contre-indiquée car il existe un risque accru de réactions hypertensives si le bupropion est utilisé en même temps que les IMAO. Des études chez l'animal démontrent que la toxicité aiguë du bupropion est renforcée par la phénelzine, un inhibiteur de la MAO. Au moins 14 jours doivent s'écouler entre l'arrêt d'un IMAO destiné à traiter la dépression et le début du traitement par WELLBUTRIN. À l'inverse, il faut attendre au moins 14 jours après l'arrêt de WELLBUTRIN 150 mg avant de commencer un antidépresseur IMAO [voir DOSAGE ET ADMINISTRATION , CONTRE-INDICATIONS ].
Interactions médicament-test de laboratoire
Des tests de dépistage immunologique urinaire faussement positifs pour les amphétamines ont été rapportés chez des patients prenant du bupropion. Cela est dû au manque de spécificité de certains tests de dépistage. Des résultats de test faussement positifs peuvent survenir même après l'arrêt du traitement par bupropion. Des tests de confirmation, tels que la chromatographie en phase gazeuse/spectrométrie de masse, permettront de distinguer le bupropion des amphétamines.
Toxicomanie et dépendance
Substance contrôlée
Le bupropion n'est pas une substance contrôlée.
Abuser de
Humains
Des essais cliniques contrôlés menés chez des volontaires sains, chez des sujets ayant des antécédents de polytoxicomanie et chez des sujets déprimés ont montré une certaine augmentation de l'activité motrice et de l'agitation/excitation, souvent typique de l'activité stimulante centrale.
Dans une population d'individus ayant consommé des drogues, une dose orale unique de 400 mg de bupropion a produit une légère activité semblable à celle de l'amphétamine par rapport au placebo sur la sous-échelle Morphine-Benzédrine des inventaires du Centre de recherche sur la toxicomanie (ARCI) et un score supérieur à placebo mais moins de 15 mg de dextroamphétamine stimulante de l'annexe II sur l'échelle d'appréciation de l'ARCI. Ces échelles mesurent les sentiments généraux d'euphorie et de goût de la drogue qui sont souvent associés à un potentiel d'abus.
Cependant, les résultats des essais cliniques ne sont pas connus pour prédire de manière fiable le potentiel d'abus des drogues. Néanmoins, les preuves issues d'essais à dose unique suggèrent que la dose quotidienne recommandée de bupropion lorsqu'il est administré par voie orale en doses fractionnées n'est pas susceptible de renforcer de manière significative les consommateurs d'amphétamines ou de stimulants du SNC. Cependant, des doses plus élevées (qui n'ont pas pu être testées en raison du risque de convulsions) pourraient être légèrement attrayantes pour ceux qui abusent des stimulants du SNC.
WELLBUTRIN est destiné à un usage oral uniquement. L'inhalation de comprimés écrasés ou l'injection de bupropion dissous ont été rapportées. Des convulsions et/ou des cas de décès ont été rapportés lorsque le bupropion a été administré par voie intranasale ou par injection parentérale.
Animaux
Des études chez les rongeurs et les primates ont démontré que le bupropion présente certaines actions pharmacologiques communes aux psychostimulants. Chez les rongeurs, il a été démontré qu'il augmente l'activité locomotrice, provoque une réponse comportementale stéréotypée légère et augmente les taux de réponse dans plusieurs paradigmes de comportement contrôlés par l'horaire. Dans les modèles de primates évaluant les effets positifs de renforcement des médicaments psychoactifs, le bupropion était auto-administré par voie intraveineuse. Chez le rat, le bupropion a produit des effets de stimulus discriminatifs de type amphétamine et cocaïne dans les paradigmes de discrimination des drogues utilisés pour caractériser les effets subjectifs des drogues psychoactives.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Pensées et comportements suicidaires chez les enfants, les adolescents et les jeunes adultes
Les patients atteints de TDM, adultes et pédiatriques, peuvent présenter une aggravation de leur dépression et/ou l'émergence d'idées et de comportements suicidaires (suicidalité) ou des changements de comportement inhabituels, qu'ils prennent ou non des antidépresseurs, et ce risque peut persister jusqu'à ce qu'il soit significatif. rémission se produit. Le suicide est un risque connu de dépression et de certains autres troubles psychiatriques, et ces troubles eux-mêmes sont les meilleurs prédicteurs du suicide. On craint depuis longtemps que les antidépresseurs puissent jouer un rôle dans l'aggravation de la dépression et l'émergence de comportements suicidaires chez certains patients au cours des premières phases du traitement.
Des analyses groupées d'essais contrôlés par placebo à court terme portant sur des antidépresseurs (inhibiteurs sélectifs de la recapture de la sérotonine [ISRS] et autres) montrent que ces médicaments augmentent le risque de pensées et de comportements suicidaires (suicidalité) chez les enfants, les adolescents et les jeunes adultes (âgés de 18 ans). à 24) avec un TDM et d'autres troubles psychiatriques. Les essais cliniques à court terme n'ont pas montré d'augmentation du risque de suicide avec les antidépresseurs par rapport au placebo chez les adultes de plus de 24 ans ; il y avait une réduction avec les antidépresseurs par rapport au placebo chez les adultes âgés de 65 ans et plus.
Les analyses groupées d'essais contrôlés par placebo chez des enfants et des adolescents atteints de TDM, de trouble obsessionnel-compulsif (TOC) ou d'autres troubles psychiatriques comprenaient un total de 24 essais à court terme de 9 antidépresseurs chez plus de 4 400 sujets. Les analyses groupées d'essais contrôlés par placebo chez des adultes atteints de TDM ou d'autres troubles psychiatriques comprenaient un total de 295 essais à court terme (durée médiane de 2 mois) de 11 antidépresseurs chez plus de 77 000 sujets. Il y avait une variation considérable du risque de suicide parmi les médicaments, mais une tendance à une augmentation chez les sujets plus jeunes pour presque tous les médicaments étudiés. Il y avait des différences dans le risque absolu de suicidalité entre les différentes indications, avec l'incidence la plus élevée dans le TDM. Les différences de risque (médicament contre placebo) étaient toutefois relativement stables au sein des tranches d'âge et entre les indications. Ces différences de risque (différence médicament-placebo dans le nombre de cas de suicide pour 1 000 sujets traités) sont fournies dans le tableau 1.
Aucun suicide n'est survenu dans aucun des essais pédiatriques. Il y a eu des suicides dans les essais sur les adultes, mais le nombre n'était pas suffisant pour tirer une conclusion sur l'effet du médicament sur le suicide.
On ne sait pas si le risque de suicide s'étend à une utilisation à plus long terme, c'est-à-dire au-delà de plusieurs mois. Cependant, il existe des preuves substantielles provenant d'essais d'entretien contrôlés par placebo chez des adultes souffrant de dépression que l'utilisation d'antidépresseurs peut retarder la récurrence de la dépression.
Tous les patients traités avec des antidépresseurs pour toute indication doivent être surveillés de manière appropriée et observés de près pour déceler une aggravation clinique, des tendances suicidaires et des changements inhabituels de comportement, en particulier au cours des premiers mois d'un traitement médicamenteux, ou lors de changements de dose, soit des augmentations ou diminue [voir l'AVERTISSEMENT ENCADRÉ].
Les symptômes suivants, anxiété, agitation, attaques de panique, insomnie, irritabilité, hostilité, agressivité, impulsivité, akathisie (agitation psychomotrice), hypomanie et manie, ont été rapportés chez des patients adultes et pédiatriques traités avec des antidépresseurs pour un trouble dépressif majeur ainsi comme pour les autres indications, tant psychiatriques que non psychiatriques. Bien qu'un lien de causalité entre l'apparition de tels symptômes et soit l'aggravation de la dépression et/ou l'émergence d'impulsions suicidaires n'ait pas été établi, on craint que ces symptômes puissent représenter des précurseurs d'une suicidalité émergente.
Il convient d'envisager de modifier le schéma thérapeutique, y compris éventuellement d'arrêter le médicament, chez les patients dont la dépression s'aggrave de manière persistante, ou qui présentent des tendances suicidaires émergentes ou des symptômes qui pourraient être des précurseurs d'une aggravation de la dépression ou des tendances suicidaires, en particulier si ces symptômes sont graves, brusques. au début ou ne faisaient pas partie des symptômes présentés par le patient.
Les familles et les soignants des patients traités avec des antidépresseurs pour un TDM ou d'autres indications, à la fois psychiatriques et non psychiatriques, doivent être alertés de la nécessité de surveiller les patients pour l'apparition d'agitation, d'irritabilité, de changements inhabituels de comportement et des autres symptômes décrits ci-dessus, comme ainsi que l'émergence de tendances suicidaires, et de signaler immédiatement ces symptômes aux prestataires de soins de santé. Une telle surveillance devrait inclure une observation quotidienne par les familles et les soignants. Les prescriptions de WELLBUTRIN 150 mg doivent être rédigées pour la plus petite quantité de comprimés compatible avec une bonne prise en charge du patient, afin de réduire le risque de surdosage.
Événements indésirables neuropsychiatriques et risque de suicide dans le traitement de sevrage tabagique
WELLBUTRIN n'est pas approuvé pour le traitement de sevrage tabagique ; cependant, il contient le même ingrédient actif que le médicament de sevrage tabagique ZYBAN. Des événements indésirables neuropsychiatriques graves ont été rapportés chez des patients prenant du bupropion pour arrêter de fumer. Ces rapports post-commercialisation ont inclus des changements d'humeur (y compris la dépression et la manie), la psychose, les hallucinations, la paranoïa, les délires, les idées d'homicide, l'agressivité, l'hostilité, l'agitation, l'anxiété et la panique, ainsi que les idées suicidaires, les tentatives de suicide et les suicides réussis. voir EFFETS INDÉSIRABLES ]. Certains patients qui ont arrêté de fumer peuvent avoir présenté des symptômes de sevrage à la nicotine, notamment une humeur dépressive. La dépression, incluant rarement des idées suicidaires, a été rapportée chez des fumeurs tentant d'arrêter de fumer sans médicament. Cependant, certains de ces événements indésirables sont survenus chez des patients prenant du bupropion qui continuaient à fumer.
Des événements indésirables neuropsychiatriques sont survenus chez des patients sans et avec une maladie psychiatrique préexistante ; certains patients ont connu une aggravation de leurs maladies psychiatriques. Observer les patients pour la survenue d'événements indésirables neuropsychiatriques. Informez les patients et les soignants que le patient doit arrêter de prendre WELLBUTRIN 300 mg et contacter immédiatement un fournisseur de soins de santé si une agitation, une humeur dépressive ou des changements de comportement ou de pensée qui ne sont pas typiques du patient sont observés, ou si le patient développe des idées suicidaires ou un comportement suicidaire . Dans de nombreux cas post-commercialisation, une résolution des symptômes après l'arrêt du bupropion a été rapportée. Cependant, les symptômes ont persisté dans certains cas; par conséquent, une surveillance continue et des soins de soutien doivent être fournis jusqu'à la résolution des symptômes.
Saisie
WELLBUTRIN 300 mg peut provoquer des convulsions. Le risque de convulsions est lié à la dose. La dose ne doit pas dépasser 450 mg/jour. Augmentez la dose progressivement. Arrêtez WELLBUTRIN 150 mg et ne recommencez pas le traitement si le patient fait une crise.
Le risque de convulsions est également lié aux facteurs liés au patient, aux situations cliniques et aux médicaments concomitants qui abaissent le seuil convulsif. Considérez ces risques avant de commencer un traitement avec WELLBUTRIN. WELLBUTRIN 300 mg est contre-indiqué chez les patients présentant un trouble convulsif, un diagnostic actuel ou antérieur d'anorexie mentale ou de boulimie, ou subissant un arrêt brutal de l'alcool, des benzodiazépines, des barbituriques et des médicaments antiépileptiques [voir CONTRE-INDICATIONS , INTERACTIONS MÉDICAMENTEUSES ]. Les conditions suivantes peuvent également augmenter le risque de convulsion : traumatisme crânien grave; malformation artérioveineuse; Tumeur du SNC ou infection du SNC ; accident vasculaire cérébral grave; utilisation concomitante d'autres médicaments qui abaissent le seuil épileptogène (p. ex., autres produits à base de bupropion, antipsychotiques, antidépresseurs tricycliques, théophylline et corticostéroïdes systémiques); troubles métaboliques (par exemple, hypoglycémie, hyponatrémie, insuffisance hépatique sévère et hypoxie) ; consommation de drogues illicites (p. ex., cocaïne); ou l'abus ou la mauvaise utilisation de médicaments sur ordonnance tels que les stimulants du SNC. Les conditions prédisposantes supplémentaires comprennent le diabète sucré traité avec des médicaments hypoglycémiants oraux ou de l'insuline; utilisation de médicaments anorexiques; et consommation excessive d'alcool, de benzodiazépines, de sédatifs/hypnotiques ou d'opiacés.
Incidence de saisie avec l'utilisation de bupropion
Le bupropion est associé à des convulsions chez environ 0,4 % (4/1 000) des patients traités à des doses allant jusqu'à 450 mg/jour. L'incidence estimée des convulsions pour WELLBUTRIN augmente de près de 10 fois entre 450 et 600 mg/jour.
Le risque de convulsions peut être réduit si la dose de WELLBUTRIN 300 mg ne dépasse pas 450 mg/jour, administrée à raison de 150 mg 3 fois par jour, et si la vitesse de titration est progressive.
Hypertension
Le traitement par WELLBUTRIN peut entraîner une augmentation de la pression artérielle et de l'hypertension. Évaluez la tension artérielle avant de commencer le traitement avec WELLBUTRIN 150 mg et surveillez-la périodiquement pendant le traitement. Le risque d'hypertension est augmenté si WELLBUTRIN 150 mg est utilisé en même temps que des IMAO ou d'autres médicaments qui augmentent l'activité dopaminergique ou noradrénergique [voir CONTRE-INDICATIONS ].
Les données d'un essai comparatif de la formulation à libération prolongée de bupropion HCl, du système transdermique de nicotine (NTS), de la combinaison de bupropion à libération prolongée plus NTS et d'un placebo comme aide au sevrage tabagique suggèrent une incidence plus élevée d'hypertension liée au traitement chez les patients traités par l'association bupropion à libération prolongée et NTS. Dans cet essai, 6,1 % des sujets traités par l'association de bupropion à libération prolongée et de NTS présentaient une hypertension apparue sous traitement, contre 2,5 %, 1,6 % et 3,1 % des sujets traités par le bupropion à libération prolongée, le NTS et le placebo, respectivement . La majorité de ces sujets présentaient des signes d'hypertension préexistante. Trois sujets (1,2 %) traités par l'association de bupropion à libération prolongée et de NTS et 1 sujet (0,4 %) traité par NTS ont vu leur traitement à l'étude interrompu en raison d'une hypertension, comparativement à aucun des sujets traités par le bupropion à libération prolongée ou un placebo. La surveillance de la pression artérielle est recommandée chez les patients qui reçoivent l'association bupropion et substituts nicotiniques.
Dans un essai clinique sur le bupropion à libération immédiate chez des sujets TDM atteints d'insuffisance cardiaque congestive stable (N = 36), le bupropion a été associé à une exacerbation de l'hypertension préexistante chez 2 sujets, conduisant à l'arrêt du traitement par le bupropion. Il n'y a pas d'essais contrôlés évaluant l'innocuité du bupropion chez les patients ayant des antécédents récents d'infarctus du myocarde ou de maladie cardiaque instable.
Activation de la manie/hypomanie
Un traitement antidépresseur peut précipiter un épisode maniaque maniaque, mixte ou hypomaniaque. Le risque semble être accru chez les patients atteints de trouble bipolaire ou qui présentent des facteurs de risque de trouble bipolaire. Avant d'initier WELLBUTRIN, dépister les patients pour des antécédents de trouble bipolaire et la présence de facteurs de risque de trouble bipolaire (par exemple, antécédents familiaux de trouble bipolaire, suicide ou dépression). WELLBUTRIN 150 mg n'est pas approuvé pour une utilisation dans le traitement de la dépression bipolaire.
Psychose et autres réactions neuropsychiatriques
Les patients déprimés traités par WELLBUTRIN ont présenté divers signes et symptômes neuropsychiatriques, notamment des délires, des hallucinations, une psychose, des troubles de la concentration, de la paranoïa et de la confusion. Certains de ces patients avaient un diagnostic de trouble bipolaire. Dans certains cas, ces symptômes se sont atténués lors de la réduction de la dose et/ou de l'arrêt du traitement. Demandez aux patients de contacter un professionnel de la santé si de telles réactions se produisent.
Glaucome à angle fermé
La dilatation pupillaire qui survient suite à l'utilisation de nombreux antidépresseurs, dont WELLBUTRIN 300 mg, peut déclencher une attaque à angle fermé chez un patient présentant des angles anatomiquement étroits qui n'a pas subi d'iridectomie perméable.
Réactions d'hypersensibilité
Des réactions anaphylactoïdes/anaphylactiques sont survenues au cours des essais cliniques avec le bupropion. Les réactions ont été caractérisées par un prurit, une urticaire, un œdème de Quincke et une dyspnée nécessitant un traitement médical. De plus, de rares cas spontanés d'érythème polymorphe, de syndrome de Stevens-Johnson et de choc anaphylactique associés au bupropion ont été signalés après commercialisation. Demandez aux patients d'arrêter WELLBUTRIN 150 mg et de consulter un professionnel de la santé s'ils développent une réaction allergique ou anaphylactoïde/anaphylactique (par exemple, éruption cutanée, prurit, urticaire, douleur thoracique, œdème et essoufflement) pendant le traitement.
Des cas d'arthralgie, de myalgie, de fièvre avec éruption cutanée et d'autres symptômes de type maladie sérique suggérant une hypersensibilité retardée ont été rapportés.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments ).
Pensées et comportements suicidaires
Demandez aux patients, à leurs familles et/ou à leurs soignants d'être attentifs à l'émergence d'anxiété, d'agitation, d'attaques de panique, d'insomnie, d'irritabilité, d'hostilité, d'agressivité, d'impulsivité, d'akathisie (agitation psychomotrice), d'hypomanie, de manie, d'autres changements inhabituels de comportement , aggravation de la dépression et idées suicidaires, en particulier au début du traitement antidépresseur et lorsque la dose est ajustée à la hausse ou à la baisse. Conseillez aux familles et aux soignants des patients d'observer l'apparition de tels symptômes au jour le jour, car les changements peuvent être brusques. De tels symptômes doivent être signalés au médecin prescripteur ou au professionnel de la santé du patient, en particulier s'ils sont graves, d'apparition brutale ou ne font pas partie des symptômes présentés par le patient. De tels symptômes peuvent être associés à un risque accru de pensées et de comportements suicidaires et indiquent la nécessité d'une surveillance très étroite et éventuellement de modifications de la médication.
Événements indésirables neuropsychiatriques et risque de suicide dans le traitement de sevrage tabagique
Bien que WELLBUTRIN 150mg ne soit pas indiqué dans le traitement de sevrage tabagique, il contient le même principe actif que ZYBAN qui est homologué pour cet usage. Informer les patients que certains patients ont connu des changements d'humeur (y compris la dépression et la manie), une psychose, des hallucinations, de la paranoïa, des idées délirantes, des idées meurtrières, de l'agressivité, de l'hostilité, de l'agitation, de l'anxiété et de la panique, ainsi que des idées suicidaires et le suicide lorsqu'ils tentent d'arrêter de fumer fumer en prenant du bupropion. Demandez aux patients d'arrêter le bupropion et de contacter un professionnel de la santé s'ils ressentent de tels symptômes [voir AVERTISSEMENTS ET PRECAUTIONS , EFFETS INDÉSIRABLES ].
Réactions allergiques graves
Éduquer les patients sur les symptômes d'hypersensibilité et d'arrêter WELLBUTRIN 300 mg s'ils ont une réaction allergique sévère.
Saisie
Demandez aux patients d'arrêter et de ne pas reprendre WELLBUTRIN s'ils subissent une crise pendant le traitement. Informez les patients que la consommation excessive ou l'arrêt brutal de l'alcool, des benzodiazépines, des médicaments antiépileptiques ou des sédatifs/hypnotiques peut augmenter le risque de convulsions. Conseillez aux patients de minimiser ou d'éviter la consommation d'alcool.
Glaucome à angle fermé
Les patients doivent être informés que la prise de WELLBUTRIN 150 mg peut provoquer une légère dilatation pupillaire qui, chez les personnes sensibles, peut entraîner un épisode de glaucome à angle fermé. Le glaucome préexistant est presque toujours un glaucome à angle ouvert car le glaucome à angle fermé, lorsqu'il est diagnostiqué, peut être traité définitivement par iridectomie. Le glaucome à angle ouvert n'est pas un facteur de risque de glaucome à angle fermé. Les patients peuvent souhaiter être examinés pour déterminer s'ils sont sensibles à la fermeture de l'angle et subir une procédure prophylactique (p. ex., iridectomie), s'ils sont sensibles [voir AVERTISSEMENTS ET PRECAUTIONS ].
Produits contenant du bupropion
Éduquer les patients que WELLBUTRIN 150 mg contient le même ingrédient actif (chlorhydrate de bupropion) trouvé dans ZYBAN, qui est utilisé comme aide au traitement de sevrage tabagique, et que WELLBUTRIN 150 mg ne doit pas être utilisé en association avec ZYBAN ou tout autre médicament contenant du bupropion (tel comme WELLBUTRIN 150 mg SR, la formulation à libération prolongée et WELLBUTRIN XL ou FORFIVO XL, les formulations à libération prolongée, et APLENZIN, la formulation à libération prolongée de bromhydrate de bupropion). En outre, il existe un certain nombre de produits génériques de bupropion HCl pour les formulations à libération immédiate, prolongée et prolongée.
Potentiel de déficience cognitive et motrice
Informez les patients que tout médicament agissant sur le SNC comme WELLBUTRIN peut altérer leur capacité à effectuer des tâches nécessitant du jugement ou des habiletés motrices et cognitives. Avisez les patients que jusqu'à ce qu'ils soient raisonnablement certains que WELLBUTRIN 300 mg n'affecte pas leurs performances, ils doivent s'abstenir de conduire une automobile ou d'utiliser des machines complexes et dangereuses. WELLBUTRIN 150 mg peut entraîner une diminution de la tolérance à l'alcool.
Médicaments concomitants
Conseillez aux patients d'informer leur fournisseur de soins de santé s'ils prennent ou prévoient de prendre des médicaments sur ordonnance ou en vente libre, car WELLBUTRIN 150 mg et d'autres médicaments peuvent affecter les métabolismes des autres.
Grossesse
Conseillez aux patientes d'informer leur fournisseur de soins de santé si elles tombent enceintes ou ont l'intention de tomber enceintes pendant le traitement par WELLBUTRIN. Informez les patients qu'il existe un registre d'exposition pendant la grossesse qui surveille les résultats de la grossesse chez les femmes exposées à WELLBUTRIN 150 mg pendant la grossesse [voir Utilisation dans des populations spécifiques ].
Informations de stockage
Demandez aux patients de conserver WELLBUTRIN à température ambiante, entre 68 °F et 77 °F (20 °C à 25 °C) et de garder les comprimés au sec et à l'abri de la lumière.
Informations administratives
Demandez aux patients de prendre WELLBUTRIN en doses égales 3 ou 4 fois par jour, avec des doses séparées d'au moins 6 heures pour minimiser le risque de convulsions. En cas d'oubli d'une dose, indiquer aux patients de ne pas prendre de comprimé supplémentaire pour compenser la dose oubliée et de prendre le comprimé suivant à l'heure habituelle en raison du risque de convulsions lié à la dose. Informez les patients que les comprimés WELLBUTRIN doivent être avalés entiers et non écrasés, divisés ou mâchés. WELLBUTRIN peut être pris avec ou sans nourriture.
WELLBUTRIN, WELLBUTRIN SR, WELLBUTRIN 150 mg XL et ZYBAN sont des marques déposées détenues ou sous licence par le groupe de sociétés GSK. Les autres marques répertoriées sont des marques commerciales détenues ou concédées sous licence à leurs propriétaires respectifs et ne sont pas détenues ou concédées sous licence au groupe de sociétés GSK. Les fabricants de ces marques ne sont pas affiliés et ne cautionnent pas le groupe de sociétés GSK ou ses produits.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Des études de cancérogénicité à vie ont été réalisées chez des rats et des souris à des doses de bupropion allant jusqu'à 300 et 150 mg/kg/jour, respectivement. Ces doses sont d'environ 6 et 2 fois la MRHD, respectivement, sur une base mg/m2. Dans l'étude de rat il y avait une augmentation dans les lésions prolifératives nodulaires du foie aux doses de 100 à 300 mgs/kg/jours (environ 2 à 6 fois le MRHD sur une base mg/m2) ; des doses plus faibles n'ont pas été testées. La question de savoir si de telles lésions peuvent ou non être des précurseurs de néoplasmes du foie n'est actuellement pas résolue. Des lésions hépatiques similaires n'ont pas été observées dans l'étude sur la souris, et aucune augmentation des tumeurs malignes du foie et d'autres organes n'a été observée dans l'une ou l'autre des études.
Le bupropion a produit une réponse positive (2 à 3 fois le taux de mutation témoin) dans 2 des 5 souches du test de mutagénicité bactérienne d'Ames. Le bupropion a entraîné une augmentation des aberrations chromosomiques dans 1 des 3 études cytogénétiques in vivo sur la moelle osseuse de rat.
Il n'y a eu aucun effet sur la fertilité des mâles et des femelles lorsque des rats ont reçu des doses orales de bupropion allant jusqu'à 300 mg/kg/jour (environ 6 fois la MRHD sur une base en mg/m2) aux femelles avant l'accouplement et jusqu'au jour 13 de la gestation. ou pendant l'allaitement, et aux mâles pendant 60 jours avant et pendant l'accouplement. Cependant, les doses de 200 mgs/kg/jours (approximativement 4 fois le MRHD sur une base mg/m2) ou plus grands, ont causé l'ataxie passagère ou les changements comportementaux dans les rats femelles adultes. Il n'y avait pas non plus d'effets indésirables sur la fertilité, la reproduction ou la croissance et le développement de la progéniture mâle ou femelle.
Utilisation dans des populations spécifiques
Grossesse
Registre d'exposition pendant la grossesse
Il existe un registre indépendant de l'exposition pendant la grossesse qui surveille les résultats de la grossesse chez les femmes exposées à des antidépresseurs pendant la grossesse. Les prestataires de soins de santé sont encouragés à enregistrer les patientes en appelant le Registre national des grossesses pour les antidépresseurs au 1-844-4056185 ou en visitant en ligne à https://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/antidepressants.
Résumé des risques
Les données des études épidémiologiques chez les femmes enceintes exposées au bupropion au cours du premier trimestre n'ont pas identifié de risque accru de malformations congénitales dans l'ensemble (voir Données ). Il existe des risques pour la mère associés à une dépression non traitée pendant la grossesse (voir Considérations cliniques ). Quand bupropion a été administré aux rats enceintes pendant organogenesis, il n'y avait aucune évidence de malformations foetales aux doses jusqu'à environ 10 fois la dose humaine recommandée maximum (MRHD) de 450 mgs/jours. Lorsqu'il est administré à des lapines gestantes pendant l'organogenèse, des augmentations non liées à la dose de l'incidence des malformations fœtales et des variations squelettiques ont été observées à des doses approximativement égales à la MRHD et supérieures. Des poids fœtaux diminués ont été observés à des doses deux fois supérieures à la MRHD (voir Données animales ).
Le risque de fond estimé pour les malformations congénitales majeures et les fausses couches est inconnu pour la population indiquée. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
Une étude longitudinale prospective a suivi 201 femmes enceintes ayant des antécédents de trouble dépressif majeur qui étaient euthymiques et prenaient des antidépresseurs pendant la grossesse au début de la grossesse. Les femmes qui ont arrêté les antidépresseurs pendant la grossesse étaient plus susceptibles de connaître une rechute de dépression majeure que les femmes qui ont continué les antidépresseurs. Considérez les risques pour la mère d'une dépression non traitée et les effets potentiels sur le fœtus lors de l'arrêt ou de la modification du traitement avec des antidépresseurs pendant la grossesse et le post-partum.
Données
Données humaines
Les données du registre international des grossesses au bupropion (675 expositions au premier trimestre) et une étude de cohorte rétrospective utilisant la base de données United Healthcare (1 213 expositions au premier trimestre) n'ont pas montré de risque accru de malformations dans l'ensemble. Le registre n'a pas été conçu ou alimenté pour évaluer des défauts spécifiques, mais a suggéré une augmentation possible des malformations cardiaques.
Aucune augmentation du risque global de malformations cardiovasculaires n'a été observée après une exposition au bupropion au cours du premier trimestre. Le taux de malformations cardiovasculaires observé prospectivement dans les grossesses avec exposition au bupropion au cours du premier trimestre du registre international des grossesses était de 1,3 % (9 malformations cardiovasculaires/675 expositions maternelles au bupropion au premier trimestre), ce qui est similaire au taux de fond des malformations cardiovasculaires (environ 1%). Les données de la base de données United Healthcare, qui comportaient un nombre limité de cas exposés de malformations cardiovasculaires, et une étude cas-témoins (6 853 nourrissons atteints de malformations cardiovasculaires et 5 763 de malformations non cardiovasculaires) sur l'utilisation autodéclarée du bupropion par le National Birth Defects L'étude de prévention (NBDPS) n'a pas montré de risque accru de malformations cardiovasculaires dans l'ensemble après une exposition au bupropion au cours du premier trimestre.
Les résultats de l'étude sur l'exposition au bupropion au cours du premier trimestre et le risque d'obstruction des voies d'éjection du ventricule gauche (OLVTO) sont incohérents et ne permettent pas de tirer des conclusions concernant une éventuelle association. La base de données United Healthcare manquait de puissance pour évaluer cette association ; le NBDPS a trouvé un risque accru de LVOTO (n = 10 ; OR ajusté = 2,6 ; IC à 95 % : 1,2, 5,7) et l'étude cas-témoins de Slone Epidemiology n'a pas trouvé de risque accru de LVOTO.
Les résultats de l'étude sur l'exposition au bupropion au cours du premier trimestre et le risque de communication interventriculaire (VSD) sont incohérents et ne permettent pas de tirer des conclusions concernant une éventuelle association. La Slone Epidemiology Study a trouvé un risque accru de VSD après une exposition maternelle au bupropion au cours du premier trimestre (n = 17 ; OR ajusté = 2,5 ; IC à 95 % : 1,3, 5,0) mais n'a trouvé aucun risque accru pour les autres malformations cardiovasculaires étudiées (y compris LVOTO comme au dessus). L'étude de la base de données NBDPS et United Healthcare n'a pas trouvé d'association entre l'exposition maternelle au bupropion au premier trimestre et la VSD.
Pour les résultats de LVOTO et VSD, les études étaient limitées par le petit nombre de cas exposés, des résultats incohérents entre les études et le potentiel de résultats aléatoires à partir de comparaisons multiples dans des études cas-témoins.
Données animales
Dans des études menées chez des rats et des lapins gravides, le bupropion a été administré par voie orale pendant la période d'organogenèse à des doses allant jusqu'à 450 et 150 mg/kg/jour, respectivement (environ 10 et 6 fois la MRHD, respectivement, sur une base mg/m2 ). Il n'y avait aucune preuve de malformations fœtales chez les rats. Lorsqu'il est administré à des lapines gravides pendant l'organogenèse, des augmentations non liées à la dose de l'incidence des malformations fœtales et des variations squelettiques ont été observées à la dose la plus faible testée (25 mg/kg/jour, environ égale à la MRHD sur une base en mg/m2) et plus grand. Des poids foetaux diminués ont été observés aux doses de 50 mgs/kg/jours (environ 2 fois le MRHD sur une base mg/m2) et plus grand. Aucune toxicité maternelle n'a été mise en évidence à des doses de 50 mg/kg/jour ou moins.
Dans une étude sur le développement prénatal et postnatal, le bupropion administré par voie orale à des rates gravides à des doses allant jusqu'à 150 mg/kg/jour (environ 3 fois la MRHD sur une base en mg/m2) depuis l'implantation embryonnaire jusqu'à la lactation n'a eu aucun effet sur la croissance des ratons. ou développement.
Lactation
Résumé des risques
Les données de la littérature publiée rapportent la présence de bupropion et de ses métabolites dans le lait maternel (voir Données ). Il n'y a pas de données sur les effets du bupropion ou de ses métabolites sur la production de lait. Des données limitées provenant de rapports post-commercialisation n'ont pas identifié d'association claire d'effets indésirables chez le nourrisson allaité. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de WELLBUTRIN pour la mère et tout effet indésirable potentiel de WELLBUTRIN ou de l'affection maternelle sous-jacente sur l'enfant allaité.
Données
Dans une étude sur l'allaitement chez 10 femmes, les taux de bupropion administré par voie orale et de ses métabolites actifs ont été mesurés dans le lait exprimé. L'exposition quotidienne moyenne du nourrisson (en supposant une consommation quotidienne de 150 mL/kg) au bupropion et à ses métabolites actifs était de 2 % de la dose maternelle ajustée en fonction du poids. Des rapports post-commercialisation ont décrit des convulsions chez des nourrissons allaités. La relation entre l'exposition au bupropion et ces crises n'est pas claire.
Utilisation pédiatrique
La sécurité et l'efficacité dans la population pédiatrique n'ont pas été établies [voir AVERTISSEMENT ENCADRÉ , AVERTISSEMENTS ET PRECAUTIONS ].
Utilisation gériatrique
Sur les quelque 6 000 sujets qui ont participé aux essais cliniques avec les comprimés à libération prolongée de bupropion (essais sur la dépression et le sevrage tabagique), 275 étaient âgés de ≥ 65 ans et 47 étaient âgés de ≥ 75 ans. De plus, plusieurs centaines de sujets âgés de ≥ 65 ans ont participé à des essais cliniques utilisant la formulation à libération immédiate de bupropion (essais sur la dépression). Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes. L'expérience clinique rapportée n'a pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certaines personnes âgées ne peut être exclue.
Le bupropion est largement métabolisé dans le foie en métabolites actifs, qui sont ensuite métabolisés et excrétés par les reins. Le risque d'effets indésirables peut être plus élevé chez les patients dont la fonction rénale est altérée. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, il peut être nécessaire de prendre en compte ce facteur dans le choix de la dose ; il peut être utile de surveiller la fonction rénale [voir DOSAGE ET ADMINISTRATION , Utilisation dans des populations spécifiques , PHARMACOLOGIE CLINIQUE ].
Insuffisance rénale
Envisager une réduction de la dose et/ou de la fréquence d'administration de WELLBUTRIN chez les patients présentant une insuffisance rénale (taux de filtration glomérulaire : moins de 90 mL/min). Le bupropion et ses métabolites sont éliminés par les reins et peuvent s'accumuler plus que d'habitude chez ces patients. Surveiller de près les effets indésirables qui pourraient indiquer une exposition élevée au bupropion ou à un métabolite [voir DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE ].
Insuffisance hépatique
Chez les patients présentant une insuffisance hépatique modérée à sévère (score de Child-Pugh : 7 à 15), la dose maximale de WELLBUTRIN 150 mg est de 75 mg par jour. Chez les patients présentant une insuffisance hépatique légère (score de Child-Pugh : 5 à 6), envisager de réduire la dose et/ou la fréquence d'administration [voir DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Expérience de surdose humaine
Des surdosages allant jusqu'à 30 grammes ou plus de bupropion ont été signalés. Des convulsions ont été signalées dans environ un tiers de tous les cas. D'autres réactions graves signalées lors de surdosages de bupropion seul comprenaient des hallucinations, une perte de conscience, une tachycardie sinusale et des modifications de l'ECG telles que des troubles de la conduction (y compris l'allongement du QRS) ou des arythmies. La fièvre, la rigidité musculaire, la rhabdomyolyse, l'hypotension, la stupeur, le coma et l'insuffisance respiratoire ont été signalés principalement lorsque le bupropion faisait partie de surdosages multiples.
Bien que la plupart des patients se soient rétablis sans séquelles, des décès associés à des surdoses de bupropion seul ont été signalés chez des patients ingérant de fortes doses du médicament. De multiples convulsions incontrôlées, une bradycardie, une insuffisance cardiaque et un arrêt cardiaque avant le décès ont été signalés chez ces patients.
Gestion du surdosage
Consultez un centre antipoison certifié pour obtenir des conseils et des conseils à jour. Les numéros de téléphone des centres antipoison certifiés sont répertoriés dans le Physician's Desk Reference (PDR). Appelez le 1-800-222-1222 ou consultez www.poison.org.
Il n'y a pas d'antidote connu pour le bupropion. En cas de surdosage, fournir des soins de soutien, y compris une surveillance et une surveillance médicales étroites. Envisagez la possibilité d'une surdose de médicaments multiples. Assurer une ventilation adéquate, l'oxygénation et la ventilation. Surveiller le rythme cardiaque et les signes vitaux. L'induction de vomissements n'est pas recommandée.
CONTRE-INDICATIONS
- WELLBUTRIN 150 mg est contre-indiqué chez les patients présentant un trouble convulsif.
- WELLBUTRIN est contre-indiqué chez les patients ayant un diagnostic actuel ou antérieur de boulimie ou d'anorexie mentale, car une incidence plus élevée de convulsions a été observée chez ces patients traités par WELLBUTRIN [voir AVERTISSEMENTS ET PRECAUTIONS ].
- WELLBUTRIN 300 mg est contre-indiqué chez les patients subissant un arrêt brutal de l'alcool, des benzodiazépines, des barbituriques et des antiépileptiques [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
- L'utilisation d'IMAO (destinés à traiter les troubles psychiatriques) en concomitance avec WELLBUTRIN 300 mg ou dans les 14 jours suivant l'arrêt du traitement par WELLBUTRIN 150 mg est contre-indiquée. Il existe un risque accru de réactions hypertensives lorsque WELLBUTRIN est utilisé en concomitance avec des IMAO. L'utilisation de WELLBUTRIN dans les 14 jours suivant l'arrêt du traitement par un IMAO est également contre-indiquée. Il est contre-indiqué de commencer WELLBUTRIN 150 mg chez un patient traité par des IMAO réversibles tels que le linézolide ou le bleu de méthylène par voie intraveineuse [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
- WELLBUTRIN est contre-indiqué chez les patients présentant une hypersensibilité connue au bupropion ou à d'autres composants de WELLBUTRIN. Des réactions anaphylactoïdes/anaphylactiques et le syndrome de Stevens-Johnson ont été rapportés [voir AVERTISSEMENTS ET PRECAUTIONS ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le mécanisme exact de l'action antidépressive du bupropion n'est pas connu mais il est présumé être lié à des mécanismes noradrénergiques et/ou dopaminergiques. Le bupropion est un inhibiteur relativement faible de la recapture neuronale de la noradrénaline et de la dopamine et n'inhibe pas la recapture de la sérotonine. Le bupropion n'inhibe pas la monoamine oxydase.
Pharmacocinétique
Le bupropion est un mélange racémique. L'activité pharmacologique et la pharmacocinétique des énantiomères individuels n'ont pas été étudiées. La demi-vie d'élimination moyenne (± ET) du bupropion après administration chronique est de 21 (± 9) heures et les concentrations plasmatiques à l'état d'équilibre du bupropion sont atteintes en 8 jours.
Absorption
La biodisponibilité absolue de WELLBUTRIN chez l'homme n'a pas été déterminée car aucune formulation intraveineuse à usage humain n'est disponible. Cependant, il semble probable que seule une petite proportion de toute dose administrée par voie orale atteint la circulation systémique intacte. Dans des études chez le rat et le chien, la biodisponibilité du bupropion variait de 5 % à 20 %.
Chez l'homme, après administration orale de WELLBUTRIN 300 mg, les concentrations plasmatiques maximales de bupropion sont généralement atteintes en 2 heures. Les concentrations plasmatiques de bupropion sont proportionnelles à la dose après des doses uniques de 100 à 250 mg; cependant, on ne sait pas si la proportionnalité entre la dose et le taux plasmatique est maintenue en cas d'utilisation chronique.
Distribution
Des tests in vitro montrent que le bupropion est lié à 84 % aux protéines plasmatiques humaines à des concentrations allant jusqu'à 200 mcg/mL. L'étendue de la liaison aux protéines du métabolite hydroxybupropion est similaire à celle du bupropion, tandis que l'étendue de la liaison aux protéines du métabolite thréohydrobupropion est environ la moitié de celle observée avec le bupropion.
Métabolisme
Le bupropion est largement métabolisé chez l'homme. Trois métabolites sont actifs : l'hydroxybupropion, qui se forme par hydroxylation du groupe tert-butyle du bupropion, et les isomères d'aminoalcools thréohydrobupropion et érythrohydrobupropion, qui se forment par réduction du groupe carbonyle. Les résultats in vitro suggèrent que le CYP2B6 est la principale isoenzyme impliquée dans la formation de l'hydroxybupropion, tandis que les enzymes du cytochrome P450 ne sont pas impliquées dans la formation du thréohydrobupropion. L'oxydation de la chaîne latérale du bupropion entraîne la formation d'un conjugué glycine d'acide méta-chlorobenzoïque, qui est ensuite excrété en tant que principal métabolite urinaire. La puissance et la toxicité des métabolites par rapport au bupropion n'ont pas été entièrement caractérisées. Cependant, il a été démontré dans un test de dépistage d'antidépresseurs chez la souris que l'hydroxybupropion est deux fois moins puissant que le bupropion, tandis que le thréohydrobupropion et l'érythrohydrobupropion sont 5 fois moins puissants que le bupropion. Cela peut avoir une importance clinique car les concentrations plasmatiques des métabolites sont aussi élevées ou supérieures à celles du bupropion.
Après une dose unique chez l'homme, les concentrations plasmatiques maximales d'hydroxybupropion se produisent environ 3 heures après l'administration de WELLBUTRIN et sont environ 10 fois supérieures au niveau maximal du médicament mère à l'état d'équilibre. La demi-vie d'élimination de l'hydroxybupropion est d'environ 20 (± 5) heures et son ASC à l'état d'équilibre est d'environ 17 fois celle du bupropion. Les temps d'atteinte des concentrations maximales pour les métabolites érythrohydrobupropion et thréohydrobupropion sont similaires à ceux du métabolite hydroxybupropion. Cependant, leurs demi-vies d'élimination sont plus longues, 33 (± 10) et 37 (± 13) heures, respectivement, et les ASC à l'état d'équilibre sont respectivement 1,5 et 7 fois celle du bupropion.
Le bupropion et ses métabolites présentent une cinétique linéaire après administration chronique de 300 à 450 mg/jour.
Élimination
Après administration orale de 200 mg de 14C-bupropion chez l'homme, 87 % et 10 % de la dose radioactive ont été récupérés dans l'urine et les fèces, respectivement. Seulement 0,5 % de la dose orale a été excrété sous forme de bupropion inchangé.
Populations spécifiques
On peut s'attendre à ce que des facteurs ou des conditions altérant la capacité métabolique (p. ex., maladie du foie, insuffisance cardiaque congestive [ICC], âge, médicaments concomitants, etc.) ou l'élimination influencent le degré et l'étendue de l'accumulation des métabolites actifs du bupropion. L'élimination des principaux métabolites du bupropion peut être affectée par une fonction rénale ou hépatique réduite car ce sont des composés modérément polaires et sont susceptibles de subir un métabolisme ou une conjugaison supplémentaire dans le foie avant l'excrétion urinaire.
Patients atteints d'insuffisance rénale
Il existe peu d'informations sur la pharmacocinétique du bupropion chez les patients insuffisants rénaux. Une comparaison inter-essais entre des sujets normaux et des sujets atteints d'insuffisance rénale terminale a démontré que les valeurs de la Cmax et de l'ASC du médicament parent étaient comparables dans les 2 groupes, alors que les métabolites hydroxybupropion et thréohydrobupropion avaient une augmentation de 2,3 et 2,8 fois, respectivement, de l'ASC chez les sujets atteints d'insuffisance rénale terminale. Un deuxième essai, comparant des sujets normaux et des sujets présentant une insuffisance rénale modérée à sévère (DFG 30,9 ± 10,8 mL/min) a montré qu'après une dose unique de 150 mg de bupropion à libération prolongée, l'exposition au bupropion était environ 2 fois plus élevée chez les sujets présentant une fonction rénale altérée, tandis que les taux des métabolites hydroxybupropion et thréo/érythrohydrobupropion (combinés) étaient similaires dans les 2 groupes. Le bupropion est largement métabolisé dans le foie en métabolites actifs, qui sont ensuite métabolisés puis excrétés par les reins. L'élimination des principaux métabolites du bupropion peut être réduite par une fonction rénale altérée. WELLBUTRIN doit être utilisé avec prudence chez les patients insuffisants rénaux et une fréquence et/ou une dose réduites doivent être envisagées [voir Utilisation dans des populations spécifiques ].
Patients atteints d'insuffisance hépatique
L'effet de l'insuffisance hépatique sur la pharmacocinétique du bupropion a été caractérisé dans 2 essais à dose unique, l'un chez des sujets atteints d'hépatopathie alcoolique et l'autre chez des sujets atteints de cirrhose légère à sévère. Le premier essai a démontré que la demi-vie de l'hydroxybupropion était significativement plus longue chez 8 sujets atteints d'hépatopathie alcoolique que chez 8 volontaires sains (32 ± 14 heures contre 21 ± 5 heures, respectivement). Bien qu'elles ne soient pas statistiquement significatives, les ASC du bupropion et de l'hydroxybupropion étaient plus variables et avaient tendance à être supérieures (de 53 % à 57 %) chez les volontaires atteints d'une maladie alcoolique du foie. Les différences de demi-vie du bupropion et des autres métabolites dans les 2 groupes étaient minimes.
Le deuxième essai n'a démontré aucune différence statistiquement significative dans la pharmacocinétique du bupropion et de ses métabolites actifs chez 9 sujets atteints de cirrhose hépatique légère à modérée par rapport à 8 volontaires sains. Cependant, une plus grande variabilité a été observée dans certains des paramètres pharmacocinétiques du bupropion (ASC, Cmax et Tmax) et de ses métabolites actifs (t½) chez les sujets atteints de cirrhose hépatique légère à modérée. Chez les sujets atteints de cirrhose hépatique sévère, des altérations significatives de la pharmacocinétique du bupropion et de ses métabolites ont été observées (tableau 3).
Patients atteints de dysfonction ventriculaire gauche
Au cours d'un essai de dosage chronique du bupropion chez 14 sujets déprimés présentant une dysfonction ventriculaire gauche (antécédents d'ICC ou hypertrophie cardiaque aux rayons X), il n'y a eu aucun effet apparent sur la pharmacocinétique du bupropion ou de ses métabolites, par rapport à des volontaires sains.
Âge
Les effets de l'âge sur la pharmacocinétique du bupropion et de ses métabolites n'ont pas été complètement caractérisés, mais une exploration des concentrations de bupropion à l'état d'équilibre à partir de plusieurs essais d'efficacité sur la dépression impliquant des sujets ayant reçu une dose de 300 à 750 mg/jour, sur une période de 3 fois par jour, n'a révélé aucune relation entre l'âge (18 à 83 ans) et la concentration plasmatique de bupropion. Un essai pharmacocinétique à dose unique a démontré que la disposition du bupropion et de ses métabolites chez les sujets âgés était similaire à celle des sujets plus jeunes. Ces données suggèrent qu'il n'y a pas d'effet important de l'âge sur la concentration de bupropion ; cependant, un autre essai pharmacocinétique à dose unique et à doses multiples a suggéré que les personnes âgées courent un risque accru d'accumulation de bupropion et de ses métabolites [voir Utilisation dans des populations spécifiques ].
Patients masculins et féminins
L'analyse groupée des données pharmacocinétiques du bupropion provenant de 90 volontaires sains de sexe masculin et de 90 volontaires de sexe féminin n'a révélé aucune différence liée au sexe dans les concentrations plasmatiques maximales de bupropion. L'exposition systémique moyenne (AUC) était environ 13 % plus élevée chez les hommes volontaires que chez les femmes volontaires. La signification clinique de cette découverte est inconnue.
Les fumeurs
Les effets du tabagisme sur la pharmacocinétique du bupropion ont été étudiés chez 34 volontaires masculins et féminins en bonne santé ; 17 étaient des fumeurs chroniques de cigarettes et 17 étaient des non-fumeurs. Suite à l'administration orale d'une dose unique de 150 mg de bupropion, il n'y avait pas de différences statistiquement significatives dans la Cmax, la demi-vie, le Tmax, l'ASC ou la clairance du bupropion ou de ses métabolites actifs entre les fumeurs et les non-fumeurs.
Études sur les interactions médicamenteuses
Possibilité que d'autres médicaments affectent WELLBUTRIN
Des études in vitro indiquent que le bupropion est principalement métabolisé en hydroxybupropion par le CYP2B6. Par conséquent, il existe un potentiel d'interactions médicamenteuses entre WELLBUTRIN et des médicaments qui sont des inhibiteurs ou des inducteurs du CYP2B6. De plus, des études in vitro suggèrent que la paroxétine, la sertraline, la norfluoxétine, la fluvoxamine et le nelfinavir inhibent l'hydroxylation du bupropion.
Inhibiteurs du CYP2B6
Ticlopidine, Clopidogrel : Dans un essai chez des hommes volontaires sains, le clopidogrel 75 mg une fois par jour ou la ticlopidine 250 mg deux fois par jour ont augmenté les expositions (Cmax et ASC) au bupropion de 40 % et 60 % pour le clopidogrel, et de 38 % et 85 % pour la ticlopidine , respectivement. Les expositions (Cmax et ASC) de l'hydroxybupropion ont été diminuées de 50 % et 52 %, respectivement, par le clopidogrel, et de 78 % et 84 %, respectivement, par la ticlopidine. On pense que cet effet est dû à l'inhibition de l'hydroxylation du bupropion catalysée par le CYP2B6.
Prasugrel : Le prasugrel est un faible inhibiteur du CYP2B6. Chez les sujets sains, le prasugrel a augmenté les valeurs de la Cmax et de l'ASC du bupropion de 14 % et 18 %, respectivement, et a diminué les valeurs de la Cmax et de l'ASC de l'hydroxybupropion, un métabolite actif du bupropion, de 32 % et 24 %, respectivement.
Cimétidine : Le métabolite thréohydrobupropion du bupropion ne semble pas être produit par les enzymes du cytochrome P450. Les effets de l'administration concomitante de cimétidine sur la pharmacocinétique du bupropion et de ses métabolites actifs ont été étudiés chez 24 jeunes volontaires sains de sexe masculin. Après administration orale de bupropion 300 mg avec et sans cimétidine 800 mg, la pharmacocinétique du bupropion et de l'hydroxybupropion n'a pas été affectée. Cependant, il y a eu des augmentations de 16 % et 32 % de l'ASC et de la Cmax, respectivement des fractions combinées du thréohydrobupropion et de l'érythrohydrobupropion.
Citalopram : Le citalopram n'a pas affecté la pharmacocinétique du bupropion et de ses trois métabolites.
Inducteurs du CYP2B6
Ritonavir et Lopinavir : Dans un essai sur des volontaires sains, le ritonavir 100 mg deux fois par jour a réduit l'ASC et la Cmax du bupropion de 22 % et 21 %, respectivement. L'exposition au métabolite hydroxybupropion a diminué de 23 %, le thréohydrobupropion a diminué de 38 % et l'érythrohydrobupropion a diminué de 48 %.
Dans un deuxième essai sur des volontaires sains, le ritonavir à une dose de 600 mg deux fois par jour a diminué l'ASC et la Cmax du bupropion de 66 % et 62 %, respectivement. L'exposition au métabolite hydroxybupropion a diminué de 78 %, le thréohydrobupropion a diminué de 50 % et l'érythrohydrobupropion a diminué de 68 %.
Dans un autre essai sur des volontaires sains, le lopinavir 400 mg/ritonavir 100 mg deux fois par jour a diminué l'ASC et la Cmax du bupropion de 57 %. L'ASC et la Cmax de l'hydroxybupropion ont été diminuées de 50 % et 31 %, respectivement.
Efavirenz : Dans un essai chez des volontaires sains, l'efavirenz 600 mg une fois par jour pendant 2 semaines a réduit l'ASC et la Cmax du bupropion d'environ 55 % et 34 %, respectivement. L'ASC de l'hydroxybupropion est restée inchangée, tandis que la Cmax de l'hydroxybupropion a augmenté de 50 %.
Carbamazépine, phénobarbital, phénytoïne : bien qu'ils n'aient pas fait l'objet d'études systématiques, ces médicaments peuvent induire le métabolisme du bupropion.
Potentiel pour WELLBUTRIN d'affecter d'autres médicaments
Les données animales ont indiqué que le bupropion pourrait être un inducteur d'enzymes métabolisant les médicaments chez l'homme. Dans un essai, suite à l'administration chronique de bupropion 100 mg trois fois par jour à 8 volontaires sains de sexe masculin pendant 14 jours, il n'y avait aucune preuve d'induction de son propre métabolisme. Néanmoins, il peut exister un risque d'altérations cliniquement importantes des taux sanguins des médicaments co-administrés.
Médicaments métabolisés par le CYP2D6
In vitro, le bupropion et ses métabolites (érythrohydrobupropion, thréohydrobupropion, hydroxybupropion) sont des inhibiteurs du CYP2D6. Dans un essai clinique portant sur 15 sujets masculins (âgés de 19 à 35 ans) métaboliseurs rapides du CYP2D6, le bupropion 300 mg/jour suivi d'une dose unique de 50 mg de désipramine a augmenté la Cmax, l'ASC et la t½ de la désipramine en moyenne de environ 2, 5 et 2 fois, respectivement. L'effet était présent pendant au moins 7 jours après la dernière dose de bupropion. L'utilisation concomitante de bupropion avec d'autres médicaments métabolisés par le CYP2D6 n'a pas été formellement étudiée.
Citalopram : Bien que le citalopram ne soit pas principalement métabolisé par le CYP2D6, dans un essai, le bupropion a augmenté la Cmax et l'ASC du citalopram de 30 % et 40 %, respectivement.
Lamotrigine : Des doses orales multiples de bupropion n'ont eu aucun effet statistiquement significatif sur la pharmacocinétique d'une dose unique de lamotrigine chez 12 volontaires sains.
Digoxine : les données de la littérature ont montré que l'exposition à la digoxine était réduite lorsqu'une dose orale unique de 0,5 mg de digoxine était administrée 24 heures après une dose orale unique de 150 mg de bupropion à libération prolongée chez des volontaires sains.
Etudes cliniques
L'efficacité de WELLBUTRIN 150 mg dans le traitement du trouble dépressif majeur a été établie dans deux essais contrôlés par placebo de 4 semaines chez des patients adultes hospitalisés atteints de TDM (essais 1 et 2 dans le tableau 4) et dans un essai contrôlé par placebo de 6 semaines chez adultes ambulatoires atteints de TDM (Essai 3 dans le Tableau 4). Dans le premier essai, la gamme de doses de WELLBUTRIN 300 mg était de 300 mg à 600 mg/jour administrés en 3 doses fractionnées ; 78 % des sujets ont été traités avec des doses de 300 mg à 450 mg/jour. L'essai a démontré l'efficacité de WELLBUTRIN 300 mg telle que mesurée par le score total de l'échelle d'évaluation de la dépression de Hamilton (HDRS), l'élément d'humeur dépressive HDRS (élément 1) et le score de gravité des impressions cliniques globales (CGI-S). Le deuxième essai comprenait 2 doses de WELLBUTRIN (300 et 450 mg/jour) et un placebo. Cet essai a démontré l'efficacité de WELLBUTRIN 150 mg uniquement pour la dose de 450 mg/jour. Les résultats d'efficacité étaient statistiquement significatifs pour le score total HDRS et le score CGI-S, mais pas pour l'élément HDRS 1. Dans le troisième essai, des patients ambulatoires ont été traités avec 300 mg/jour de WELLBUTRIN. Cet essai a démontré l'efficacité de WELLBUTRIN 150 mg telle que mesurée par le score total HDRS, l'élément HDRS 1, l'échelle d'évaluation de la dépression Montgomery-Asberg (MADRS), le score CGI-S et le score CGI-Improvement Scale (CGI-I) . L'efficacité de WELLBUTRIN 300 mg en utilisation à long terme, c'est-à-dire pendant plus de 6 semaines, n'a pas été systématiquement évaluée dans des essais contrôlés.
INFORMATIONS PATIENTS
BIENBUTRIN (WELL byu-trin) (chlorhydrate de bupropion) Comprimés
IMPORTANT : Soyez sûr de lire les trois sections de ce Guide de Médication. La première section porte sur le risque de pensées et d'actions suicidaires avec les antidépresseurs ; la deuxième section porte sur le risque de changements dans la pensée et le comportement, la dépression et les pensées ou actions suicidaires avec les médicaments utilisés pour arrêter de fumer ; et la troisième section est intitulée « Quelles autres informations importantes dois-je connaître sur WELLBUTRIN 150 mg ? »
Médicaments antidépresseurs, dépression et autres maladies mentales graves, et pensées ou actions suicidaires
Cette section du Guide des médicaments ne concerne que le risque de pensées et d'actions suicidaires avec les médicaments antidépresseurs.
Quelles sont les informations les plus importantes que je devrais connaître sur les médicaments antidépresseurs, la dépression et autres maladies mentales graves, et les pensées ou actions suicidaires ?
1. Les médicaments antidépresseurs peuvent augmenter le risque de pensées ou d'actions suicidaires chez certains enfants, adolescents ou jeunes adultes au cours des premiers mois de traitement.
2. La dépression ou d'autres maladies mentales graves sont les causes les plus importantes de pensées et d'actions suicidaires. Certaines personnes peuvent avoir un risque particulièrement élevé d'avoir des pensées ou des actions suicidaires. Ceux-ci incluent les personnes qui ont (ou ont des antécédents familiaux de) maladie bipolaire (également appelée maladie maniaco-dépressive) ou des pensées ou actions suicidaires.
3. Comment puis-je surveiller et essayer de prévenir les pensées et actions suicidaires chez moi-même ou chez un membre de ma famille ?
- Portez une attention particulière à tout changement, en particulier les changements soudains, d'humeur, de comportement, de pensées ou de sentiments. Ceci est très important lorsqu'un médicament antidépresseur est commencé ou lorsque la dose est modifiée.
- Appelez immédiatement votre fournisseur de soins de santé pour signaler des changements nouveaux ou soudains d'humeur, de comportement, de pensées ou de sentiments.
- Gardez toutes les visites de suivi avec votre fournisseur de soins de santé comme prévu. Appelez le fournisseur de soins de santé entre les visites au besoin, surtout si vous avez des inquiétudes au sujet des symptômes.
Appelez immédiatement votre fournisseur de soins de santé si vous ou un membre de votre famille présentez l'un des symptômes suivants, surtout s'ils sont nouveaux, s'aggravent ou vous inquiètent :
- pensées sur le suicide ou la mort
- tentatives de suicide
- dépression nouvelle ou pire
- anxiété nouvelle ou pire
- se sentir très agité ou agité
- crises de panique
- troubles du sommeil (insomnie)
- irritabilité nouvelle ou pire
- agir de manière agressive, être en colère ou violent
- agir sur des impulsions dangereuses
- une augmentation extrême de l'activité et de la conversation (manie)
- autres changements inhabituels de comportement ou d'humeur
Que dois-je savoir d'autre sur les médicaments antidépresseurs ?
- N'arrêtez jamais un médicament antidépresseur sans en parler d'abord à un fournisseur de soins de santé. L'arrêt soudain d'un médicament antidépresseur peut provoquer d'autres symptômes.
- Les antidépresseurs sont des médicaments utilisés pour traiter la dépression et d'autres maladies. Il est important de discuter de tous les risques de traiter la dépression et aussi des risques de ne pas la traiter. Les patients et leurs familles ou autres soignants doivent discuter de tous les choix de traitement avec le fournisseur de soins de santé, et pas seulement de l'utilisation d'antidépresseurs.
- Les antidépresseurs ont d'autres effets secondaires. Parlez au fournisseur de soins de santé des effets secondaires du médicament prescrit pour vous ou un membre de votre famille.
- Les médicaments antidépresseurs peuvent interagir avec d'autres médicaments. Connaissez tous les médicaments que vous ou un membre de votre famille prenez. Gardez une liste de tous les médicaments à montrer au professionnel de la santé. Ne commencez pas de nouveaux médicaments sans d'abord consulter votre fournisseur de soins de santé.
On ne sait pas si WELLBUTRIN est sûr et efficace chez les enfants de moins de 18 ans.
Arrêt du tabac, médicaments pour arrêter de fumer, changements dans la pensée et le comportement, dépression et pensées ou actions suicidaires
Cette section du Guide des médicaments ne concerne que le risque de changements dans la pensée et le comportement, la dépression et les pensées ou actions suicidaires avec les médicaments utilisés pour arrêter de fumer. Bien que WELLBUTRIN ne soit pas un traitement pour arrêter de fumer, il contient le même principe actif (chlorhydrate de bupropion) que ZYBAN qui est utilisé pour aider les patients à arrêter de fumer.
Parlez à votre fournisseur de soins de santé ou au fournisseur de soins de santé du membre de votre famille de :
- tous les risques et avantages des médicaments pour arrêter de fumer.
- tous les choix de traitement pour arrêter de fumer.
Lorsque vous essayez d'arrêter de fumer, avec ou sans bupropion, vous pouvez avoir des symptômes pouvant être dus au sevrage de la nicotine, notamment :
- envie de fumer
- frustration
- agitation
- humeur dépressive
- colère
- diminution du rythme cardiaque
- troubles du sommeil
- se sentir anxieux
- Augmentation de l'appétit
- irritabilité
- difficulté de concentration
- gain de poids
Certaines personnes ont même eu des pensées suicidaires en essayant d'arrêter de fumer sans médicament.
Parfois, arrêter de fumer peut entraîner une aggravation de problèmes de santé mentale que vous avez déjà, comme la dépression.
Certaines personnes ont eu des effets secondaires graves en prenant du bupropion pour les aider à arrêter de fumer, notamment : Problèmes de santé mentale nouveaux ou aggravés, tels que des changements de comportement ou de pensée, de l'agressivité, de l'hostilité, de l'agitation, de la dépression ou des pensées ou actions suicidaires. Certaines personnes ont présenté ces symptômes lorsqu'elles ont commencé à prendre du bupropion et d'autres les ont développés après plusieurs semaines de traitement ou après l'arrêt du bupropion. Ces symptômes sont apparus plus souvent chez les personnes qui avaient des antécédents de problèmes de santé mentale avant de prendre du bupropion que chez les personnes sans antécédents de problèmes de santé mentale.
Arrêtez de prendre WELLBUTRIN et appelez immédiatement votre fournisseur de soins de santé si vous, votre famille ou votre soignant remarquez l'un de ces symptômes. Travaillez avec votre fournisseur de soins de santé pour décider si vous devez continuer à prendre WELLBUTRIN. Chez de nombreuses personnes, ces symptômes ont disparu après l'arrêt de WELLBUTRIN 300 mg, mais chez certaines personnes, les symptômes ont persisté après l'arrêt de WELLBUTRIN. Il est important que vous suiviez votre fournisseur de soins de santé jusqu'à ce que vos symptômes disparaissent. Avant de prendre WELLBUTRIN 150 mg, informez votre professionnel de la santé si vous avez déjà souffert de dépression ou d'autres problèmes de santé mentale. Vous devez également informer votre fournisseur de soins de santé de tout symptôme que vous avez ressenti à d'autres moments où vous avez essayé d'arrêter de fumer, avec ou sans bupropion.
Quelles autres informations importantes dois-je connaître sur WELLBUTRIN ?
- Convulsions : Il existe un risque de convulsions (convulsions, convulsions) avec WELLBUTRIN 150 mg, en particulier chez les personnes :
- avec certains problèmes médicaux.
- qui prennent certains médicaments. Le risque d'avoir des convulsions augmente avec des doses plus élevées de WELLBUTRIN. Pour plus d'informations, consultez les rubriques « Qui ne doit pas prendre WELLBUTRIN ? » et « Que dois-je dire à mon professionnel de la santé avant de prendre WELLBUTRIN 300 mg ? Informez votre fournisseur de soins de santé de toutes vos conditions médicales et de tous les médicaments que vous prenez. Ne prenez aucun autre médicament pendant que vous prenez WELLBUTRIN 150 mg, sauf si votre professionnel de la santé vous a autorisé à les prendre. Si vous avez une crise pendant que vous prenez WELLBUTRIN, arrêtez de prendre les comprimés et appelez immédiatement votre professionnel de la santé. Ne prenez plus WELLBUTRIN 150 mg si vous avez une crise.
- Hypertension artérielle (hypertension). Certaines personnes souffrent d'hypertension artérielle qui peut être sévère pendant la prise de WELLBUTRIN. Le risque d'hypertension artérielle peut être plus élevé si vous utilisez également une thérapie de remplacement de la nicotine (comme un timbre à la nicotine) pour vous aider à arrêter de fumer (voir la section de ce Guide des médicaments intitulée « Comment dois-je prendre WELLBUTRIN 150 mg ? »).
- Épisodes maniaques. Certaines personnes peuvent avoir des périodes de manie lors de la prise de WELLBUTRIN 300 mg, notamment :
- Énergie considérablement augmentée
- Gros troubles du sommeil
- Pensées de course
- Comportement imprudent
- Des idées exceptionnellement grandioses
- Joie excessive ou irritabilité
- Parler plus ou plus vite que d'habitude Si vous présentez l'un des symptômes de manie ci-dessus, appelez votre fournisseur de soins de santé.
- Pensées ou comportements inhabituels. Certains patients ont des pensées ou des comportements inhabituels pendant la prise de WELLBUTRIN, y compris des délires (croire que vous êtes quelqu'un d'autre), des hallucinations (voir ou entendre des choses qui n'existent pas), de la paranoïa (sentir que les gens sont contre vous) ou un sentiment de confusion. Si cela vous arrive, appelez votre fournisseur de soins de santé.
- Problèmes visuels.
- douleur oculaire
- changements de vision
- gonflement ou rougeur dans ou autour de l'œil Seules certaines personnes sont à risque de ces problèmes. Vous voudrez peut-être subir un examen de la vue pour voir si vous êtes à risque et recevoir un traitement préventif si vous l'êtes.
- Réactions allergiques sévères. Certaines personnes peuvent avoir de graves réactions allergiques à WELLBUTRIN. Arrêtez de prendre WELLBUTRIN 300 mg et appelez immédiatement votre professionnel de la santé si vous avez une éruption cutanée, des démangeaisons, de l'urticaire, de la fièvre, des ganglions lymphatiques enflés, des plaies douloureuses dans la bouche ou autour des yeux, un gonflement des lèvres ou de la langue, des douleurs thoraciques ou si vous avez des difficultés à respirer. Ceux-ci pourraient être des signes d'une réaction allergique grave.
Qu'est-ce que WELLBUTRIN ?
WELLBUTRIN est un médicament délivré sur ordonnance utilisé pour traiter les adultes souffrant d'un certain type de dépression appelé trouble dépressif majeur.
Qui ne devrait pas prendre WELLBUTRIN 150mg ?
Ne prenez pas WELLBUTRIN si vous
- avez ou avez eu un trouble convulsif ou une épilepsie.
- avez ou avez eu un trouble de l'alimentation tel que l'anorexie mentale ou la boulimie.
- prenez tout autre médicament contenant du bupropion, y compris ZYBAN (utilisé pour aider les personnes à arrêter de fumer), WELLBUTRIN 300 mg SR, WELLBUTRIN 150 mg XL, APLENZIN ou FORFIVO XL. Le bupropion est le même ingrédient actif qui se trouve dans WELLBUTRIN.
- buvez beaucoup d'alcool et arrêtez brusquement de boire, ou utilisez des médicaments appelés sédatifs (ils vous rendent somnolent), des benzodiazépines ou des médicaments anti-épileptiques, et vous arrêtez de les utiliser tout d'un coup.
- prendre un inhibiteur de la monoamine oxydase (IMAO). Demandez à votre fournisseur de soins de santé ou à votre pharmacien si vous n'êtes pas sûr de prendre un IMAO, y compris l'antibiotique linézolide.
- ne prenez pas d'IMAO dans les 2 semaines suivant l'arrêt de WELLBUTRIN, sauf indication contraire de votre professionnel de la santé.
- ne commencez pas WELLBUTRIN 150 mg si vous avez arrêté de prendre un IMAO au cours des 2 dernières semaines, sauf indication contraire de votre professionnel de la santé.
- êtes allergique à l'ingrédient actif de WELLBUTRIN 300 mg, au bupropion ou à l'un des ingrédients inactifs. Voir la fin de ce Guide de Médication pour une liste complète d'ingrédients dans WELLBUTRIN.
Que dois-je dire à mon fournisseur de soins de santé avant de prendre WELLBUTRIN ?
Dites à votre fournisseur de soins de santé si vous avez déjà eu une dépression, des pensées ou des actions suicidaires ou d'autres problèmes de santé mentale. Voir « Médicaments antidépresseurs, dépression et autres maladies mentales graves, et pensées ou actions suicidaires ».
- Informez votre fournisseur de soins de santé de vos autres conditions médicales, y compris si vous :
- avez des problèmes de foie, en particulier une cirrhose du foie.
- avoir des problèmes rénaux.
- avez ou avez eu un trouble de l'alimentation, comme l'anorexie mentale ou la boulimie.
- ont subi une blessure à la tête.
- avez eu une crise (convulsion, crise).
- avez une tumeur dans votre système nerveux (cerveau ou colonne vertébrale).
- avez eu une crise cardiaque, des problèmes cardiaques ou de l'hypertension artérielle.
- êtes diabétique et prenez de l'insuline ou d'autres médicaments pour contrôler votre glycémie.
- boire de l'alcool.
- abuser de médicaments sur ordonnance ou de drogues illicites.
- êtes enceinte ou envisagez de devenir enceinte. Parlez à votre fournisseur de soins de santé du risque pour votre bébé à naître si vous prenez WELLBUTRIN 300 mg pendant la grossesse.
- Informez votre professionnel de la santé si vous tombez enceinte ou pensez l'être pendant le traitement par WELLBUTRIN.
- Si vous tombez enceinte pendant le traitement par WELLBUTRIN, parlez à votre fournisseur de soins de santé de l'inscription au registre national des grossesses pour les antidépresseurs. Vous pouvez vous inscrire en composant le 1-844-405-6185.
- allaitez ou envisagez d'allaiter pendant le traitement par WELLBUTRIN. WELLBUTRIN passe dans votre lait. Discutez avec votre professionnel de la santé de la meilleure façon de nourrir votre bébé pendant le traitement par WELLBUTRIN.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance, les médicaments en vente libre, les vitamines et les suppléments à base de plantes. De nombreux médicaments augmentent vos risques de convulsions ou d'autres effets secondaires graves si vous les prenez pendant que vous prenez WELLBUTRIN.
Comment dois-je prendre WELLBUTRIN 300 mg ?
- Prenez WELLBUTRIN 300 mg exactement comme prescrit par votre professionnel de la santé. Ne changez pas votre dose et n'arrêtez pas de prendre WELLBUTRIN sans en parler d'abord avec votre fournisseur de soins de santé.
- Avalez les comprimés WELLBUTRIN entiers. Ne pas mâcher, couper ou écraser les comprimés WELLBUTRIN 300 mg.
- Prenez WELLBUTRIN 300 mg à la même heure chaque jour.
- Prenez vos doses de WELLBUTRIN 300 mg à au moins 6 heures d'intervalle.
- Vous pouvez prendre WELLBUTRIN avec ou sans nourriture.
- Si vous oubliez une dose, ne prenez pas de dose supplémentaire pour compenser la dose oubliée. Attendez et prenez votre prochaine dose à l'heure habituelle. C'est très important. Trop de WELLBUTRIN peut augmenter votre risque d'avoir une crise.
- Si vous prenez trop de WELLBUTRIN ou si vous êtes en surdosage, appelez immédiatement votre service d'urgence local ou votre centre antipoison.
- Ne prenez aucun autre médicament pendant que vous prenez WELLBUTRIN 300 mg à moins que votre professionnel de la santé ne vous ait dit que cela vous convient.
- Si vous prenez WELLBUTRIN 150 mg pour le traitement d'un trouble dépressif majeur, cela peut prendre plusieurs semaines avant que vous sentiez que WELLBUTRIN 150 mg fonctionne. Une fois que vous vous sentez mieux, il est important de continuer à prendre WELLBUTRIN exactement comme indiqué par votre professionnel de la santé. Appelez votre fournisseur de soins de santé si vous pensez que WELLBUTRIN ne fonctionne pas pour vous.
Que dois-je éviter pendant que je prends WELLBUTRIN 300 mg ?
- Limitez ou évitez la consommation d'alcool pendant le traitement par WELLBUTRIN. Si vous buvez habituellement beaucoup d'alcool, parlez-en à votre fournisseur de soins de santé avant d'arrêter brusquement. Si vous arrêtez soudainement de boire de l'alcool, vous pouvez augmenter votre risque d'avoir des convulsions.
- Ne conduisez pas de voiture et n'utilisez pas de machinerie lourde tant que vous ne savez pas comment WELLBUTRIN 150 mg vous affecte. WELLBUTRIN peut affecter votre capacité à faire ces choses en toute sécurité.
Quels sont les effets secondaires possibles de WELLBUTRIN 300 mg ?
WELLBUTRIN peut provoquer des effets secondaires graves. Voir les sections au début de ce Guide de Médication pour les informations sur les effets secondaires sérieux de WELLBUTRIN.
Les effets secondaires les plus courants de WELLBUTRIN incluent :
- nervosité
- transpiration abondante
- bouche sèche
- tremblement (tremblement)
- constipation
- troubles du sommeil
- mal de tête
- Vision floue
- nausées ou vomissements
- rythme cardiaque rapide
- vertiges
Si vous avez des nausées, prenez votre médicament avec de la nourriture. Si vous avez du mal à dormir, ne prenez pas votre médicament trop près de l'heure du coucher.
Informez immédiatement votre fournisseur de soins de santé de tout effet secondaire qui vous dérange.
Ce ne sont pas tous les effets secondaires possibles de WELLBUTRIN. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou votre pharmacien.
Appelez votre fournisseur de soins de santé pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Vous pouvez également signaler les effets secondaires à GlaxoSmithKline au 1-888-825-5249.
Comment dois-je conserver WELLBUTRIN 300 mg ?
- Conservez WELLBUTRIN à température ambiante entre 68°F et 77°F (20°C à 25°C).
- Gardez les comprimés WELLBUTRIN au sec et à l'abri de la lumière.
Gardez WELLBUTRIN et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de WELLBUTRIN.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. N'utilisez pas WELLBUTRIN 300 mg pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas WELLBUTRIN à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Si vous passez un test de dépistage de drogue dans l'urine, WELLBUTRIN peut rendre le résultat du test positif pour les amphétamines. Si vous dites à la personne qui vous fait passer le test de dépistage de drogue que vous prenez WELLBUTRIN 300 mg, elle peut faire un test de dépistage de drogue plus spécifique qui ne devrait pas avoir ce problème.
Ce Guide de Médication résume les informations importantes sur WELLBUTRIN. Si vous souhaitez plus d'informations, parlez-en à votre fournisseur de soins de santé. Vous pouvez demander à votre fournisseur de soins de santé ou à votre pharmacien des informations sur WELLBUTRIN rédigées pour les professionnels de la santé.
Pour plus d'informations sur WELLBUTRIN, appelez le 1-888-825-5249.
Quels sont les ingrédients de WELLBUTRIN 300mg ?
Ingrédient actif : chlorhydrate de bupropion.
Ingrédients inactifs : Comprimé de 75 mg - D&C Yellow No. 10 Lake, FD&C Yellow No. 6 Lake, hydroxypropylcellulose, hypromellose, cellulose microcristalline, polyéthylène glycol, talc et dioxyde de titane ; Comprimé de 100 mg - FD&C Red No. 40 Lake, FD&C Yellow No. 6 Lake, hydroxypropylcellulose, hypromellose, cellulose microcristalline, polyéthylèneglycol, talc et dioxyde de titane.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
