Tofranil 25mg, 50mg, 75mg Imipramine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que le Tofranil et comment est-il utilisé ?
Tofranil 50 mg est un médicament d'ordonnance utilisé pour traiter les symptômes de la dépression. Tofranil 25 mg peut être utilisé seul ou avec d'autres médicaments.
Le tofranil appartient à une classe de médicaments appelés antidépresseurs, TCA.
On ne sait pas si Tofranil est sûr et efficace chez les enfants de moins de 6 ans.
Quels sont les effets secondaires possibles du Tofranil 50 mg ?
Le tofranil peut provoquer des effets secondaires graves, notamment :
- changements d'humeur ou de comportement,
- anxiété,
- crises de panique,
- troubles du sommeil,
- comportement impulsif,
- irritabilité,
- agitation,
- hostilité,
- agression,
- agitation,
- hyperactivité (mentale ou physique),
- plus de dépression,
- pensées suicidaires,
- Vision floue,
- vision tunnel,
- douleur ou gonflement des yeux,
- voir des halos autour des lumières,
- étourdissement,
- douleur thoracique nouvelle ou aggravée,
- des battements de cœur battants,
- flottant dans ta poitrine,
- engourdissement ou faiblesse soudaine,
- problèmes de vision, d'élocution ou d'équilibre,
- fièvre,
- mal de gorge,
- confusion,
- hallucinations,
- pensées ou comportements inhabituels,
- miction douloureuse ou difficile,
- saisies, et
- jaunissement de la peau ou des yeux (jaunisse)
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants du Tofranil incluent :
- sensation de picotement,
- la faiblesse,
- manque de coordination,
- bouche sèche,
- nausée,
- vomissement,
- constipation,
- diarrhée,
- changements de vision,
- résonne dans tes oreilles,
- gonflement des seins (hommes et femmes),
- diminution de la libido,
- l'impuissance, et
- difficulté à avoir un orgasme
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles du Tofranil. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Suicidalité et antidépresseurs
Les antidépresseurs ont augmenté le risque par rapport au placebo de pensées et de comportements suicidaires (suicidalité) chez les enfants, les adolescents et les jeunes adultes dans des études à court terme sur le trouble dépressif majeur (TDM) et d'autres troubles psychiatriques. Quiconque envisage l'utilisation du chlorhydrate d'imipramine ou de tout autre antidépresseur chez un enfant, un adolescent ou un jeune adulte doit équilibrer ce risque avec le besoin clinique. Les études à court terme n'ont pas montré d'augmentation du risque de suicide avec les antidépresseurs par rapport au placebo chez les adultes au-delà de 24 ans ; il y avait une réduction du risque avec les antidépresseurs par rapport au placebo chez les adultes âgés de 65 ans et plus. La dépression et certains autres troubles psychiatriques sont eux-mêmes associés à une augmentation du risque de suicide. Les patients de tous âges qui commencent un traitement antidépresseur doivent être surveillés de manière appropriée et observés de près pour déceler une aggravation clinique, des tendances suicidaires ou des changements inhabituels de comportement. Les familles et les soignants doivent être informés de la nécessité d'une surveillance étroite et d'une communication avec le prescripteur. Le chlorhydrate d'imipramine n'est pas approuvé pour une utilisation chez les patients pédiatriques (voir AVERTISSEMENTS aggravation clinique et risque suicidaire ; PRÉCAUTIONS Informations pour les patients ; et PRÉCAUTIONS , Usage pédiatrique).
LA DESCRIPTION
Tofranil™ est fourni sous forme de comprimés pour administration orale.
Tofranil 75 mg, chlorhydrate d'imipramine USP, l'antidépresseur tricyclique original, fait partie du groupe de composés dibenzazépines. Il est désigné monochlorhydrate de 5-3-(diméthylamino)propyl-10,11-dihydro-5Hdibenz[b,f]-azépine. Sa formule structurale est :
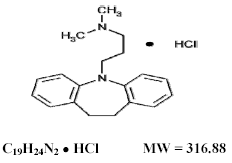
Le chlorhydrate d'imipramine USP est une poudre cristalline blanche à blanc cassé, inodore ou pratiquement inodore. Il est librement soluble dans l'eau et dans l'alcool, soluble dans l'acétone et insoluble dans l'éther et le benzène.
ingrédients inactifs
Phosphate de calcium, composés de cellulose, docusate de sodium, oxydes de fer, stéarate de magnésium, polyéthylèneglycol, povidone, glycolate d'amidon sodique, saccharose, talc et dioxyde de titane.
LES INDICATIONS
La dépression
Pour le soulagement des symptômes de la dépression. La dépression endogène est plus susceptible d'être atténuée que les autres états dépressifs. Une à trois semaines de traitement peuvent être nécessaires avant que les effets thérapeutiques optimaux soient évidents.
Énurésie infantile
Peut être utile comme thérapie d'appoint temporaire pour réduire l'énurésie chez les enfants âgés de 6 ans et plus, après que les causes organiques possibles ont été exclues par des tests appropriés. Chez les patients présentant des symptômes diurnes de fréquence et d'urgence, l'examen doit inclure une cystouréthrographie mictionnelle et une cystoscopie, si nécessaire. L'efficacité du traitement peut diminuer avec la poursuite de l'administration du médicament.
DOSAGE ET ADMINISTRATION
La dépression
Des doses plus faibles sont recommandées pour les patients âgés et les adolescents. Des doses plus faibles sont également recommandées pour les patients externes par rapport aux patients hospitalisés qui seront sous surveillance étroite. La posologie doit être initiée à un niveau bas et augmentée progressivement, en notant attentivement la réponse clinique et tout signe d'intolérance. Après la rémission, des médicaments d'entretien peuvent être nécessaires pendant une période plus longue, à la dose la plus faible qui maintiendra la rémission.
Dose habituelle pour adultes
Patients hospitalisés
Initialement, 100 mg/jour en doses fractionnées augmentées progressivement jusqu'à 200 mg/jour selon les besoins. Si pas de réponse après deux semaines, augmenter à 250 à 300 mg/jour.
Patients externes
Initialement, 75 mg/jour augmenté à 150 mg/jour. Les doses supérieures à 200 mg/jour ne sont pas recommandées. Entretien, 50 à 150 mg/jour.
Patients adolescents et gériatriques
Initialement, 30 à 40 mg/jour ; il n'est généralement pas nécessaire de dépasser 100 mg/jour.
Énurésie infantile
Initialement, une dose orale de 25 mg/jour doit être essayée chez les enfants âgés de 6 ans et plus. Les médicaments doivent être administrés une heure avant le coucher. Si une réponse satisfaisante ne se produit pas dans la semaine, augmenter la dose à 50 mg le soir chez les enfants de moins de 12 ans ; les enfants de plus de 12 ans peuvent recevoir jusqu'à 75 mg par nuit. Une dose quotidienne supérieure à 75 mg n'augmente pas l'efficacité et tend à augmenter les effets secondaires. Les preuves suggèrent que chez ceux qui mouillent tôt le soir, le médicament est plus efficace lorsqu'il est administré plus tôt et en quantités fractionnées, c'est-à-dire 25 mg en milieu d'après-midi, répétés au coucher. Il faut envisager d'instituer une période sans médicament après un essai thérapeutique adéquat avec une réponse favorable. La posologie doit être diminuée progressivement plutôt que brutalement interrompue ; cela peut réduire la tendance à la rechute. Les enfants qui rechutent lorsque le médicament est arrêté ne répondent pas toujours à un traitement ultérieur.
Une dose de 2,5 mg/kg/jour ne doit pas être dépassée. Des modifications de l'ECG de signification inconnue ont été signalées chez des patients pédiatriques recevant des doses deux fois plus élevées.
La sécurité et l'efficacité de Tofranil en tant que traitement d'appoint temporaire de l'énurésie nocturne chez les enfants de moins de 6 ans n'ont pas été établies.
COMMENT FOURNIE
Les trois concentrations de Tofranil™ (chlorhydrate d'imipramine USP) sont disponibles comme suit :
– comprimé dragéifié triangulaire, biconvexe, brun corail rougeâtre, portant l'inscription d'un côté et « 10 » de l'autre côté en noir.
Bouteilles de 30 CDN 0406-9920-03 Flacons de 100 CDN 0406-9920-01
– Comprimé dragéifié rond, biconvexe, brun corail-rougeâtre, portant l'inscription d'un côté et « 25 » de l'autre côté en noir.
Bouteilles de 30 CDN 0406-9921-03 Flacons de 100 CDN 0406-9921-01
– Comprimé dragéifié rond, biconvexe, brun corail-rougeâtre, portant l'inscription d'un côté et « 50 » de l'autre en noir.
Bouteilles de 30 CDN 0406-9922-03 Flacons de 100 CDN 0406-9922-01
Le magasin à 20 ° à 25°C (68 ° à 77°F) [voit USP la Température de Pièce Contrôlée].
Distribuer dans un récipient étanche (USP) avec une fermeture à l'épreuve des enfants.
Fabriqué par : Patheon Inc. Whitby, Ontario, Canada, L1N 5Z5. Révisé : avril 2017
EFFETS SECONDAIRES
Noter – Bien que la liste qui suit inclue quelques effets indésirables qui n'ont pas été rapportés avec ce médicament spécifique, les similitudes pharmacologiques entre les antidépresseurs tricycliques nécessitent que chacune des réactions soit prise en compte lors de l'administration de Tofranil 25 mg.
Cardiovasculaire: Hypotension orthostatique, hypertension, tachycardie, palpitations, infarctus du myocarde, arythmies, bloc cardiaque, modifications de l'ECG, précipitation de l'insuffisance cardiaque congestive, accident vasculaire cérébral.
Psychiatrique: États confusionnels (en particulier chez les personnes âgées) avec hallucinations, désorientation, délires ; anxiété, agitation, agitation; insomnie et cauchemars; hypomanie; exacerbation de la psychose.
Neurologique : Engourdissement, picotements, paresthésies des extrémités ; incoordination, ataxie, tremblements; neuropathie périphérique; symptômes extrapyramidaux; convulsions, altérations des schémas EEG ; acouphène.
Anticholinergique : Bouche sèche et, rarement, adénite sublinguale associée ; vision floue, troubles de l'accommodation, mydriase ; constipation, iléus paralytique; rétention urinaire, miction retardée, dilatation des voies urinaires.
Allergique: Éruption cutanée, pétéchies, urticaire, démangeaisons, photosensibilisation; œdème (général ou du visage et de la langue); fièvre médicamenteuse; sensibilité croisée avec la désipramine.
Hématologique : Dépression de la moelle osseuse, y compris agranulocytose ; éosinophilie; purpura; thrombocytopénie.
Gastro-intestinal : Nausées et vomissements, anorexie, détresse épigastrique, diarrhée ; goût particulier, stomatite, crampes abdominales, langue noire.
Endocrine: Gynécomastie chez l'homme ; hypertrophie mammaire et galactorrhée chez la femme; augmentation ou diminution de la libido, impuissance; gonflement testiculaire; élévation ou dépression du taux de sucre dans le sang ; syndrome de sécrétion inappropriée d'hormone antidiurétique (ADH).
Autre: Jaunisse (simulant une obstruction); fonction hépatique altérée; gain ou perte de poids; transpiration; rinçage; fréquence urinaire; somnolence, étourdissements, faiblesse et fatigue; mal de tête; gonflement parotide; alopécie; tendance à tomber.
Les symptômes de sevrage: Bien qu'il ne soit pas indicatif d'une dépendance, l'arrêt brutal du traitement après un traitement prolongé peut entraîner des nausées, des maux de tête et des malaises.
Noter – Chez les enfants énurétiques traités par Tofranil 75 mg, les effets indésirables les plus fréquents ont été la nervosité, les troubles du sommeil, la fatigue et les troubles gastro-intestinaux légers. Ceux-ci disparaissent généralement lors de l'administration continue du médicament ou lorsque la posologie est diminuée. D'autres réactions qui ont été signalées comprennent la constipation, les convulsions, l'anxiété, l'instabilité émotionnelle, la syncope et l'effondrement. Tous les effets indésirables signalés chez les adultes doivent être pris en compte.
INTERACTIONS MÉDICAMENTEUSES
Médicaments métabolisés par le P450 2D6
L'activité biochimique du médicament métabolisant l'isoenzyme cytochrome P450 2D6 (débrisoquine hydroxylase) est réduite dans un sous-ensemble de la population caucasienne (environ 7 % à 10 % des Caucasiens sont dits "métaboliseurs lents") ; des estimations fiables de la prévalence de l'activité réduite de l'isoenzyme P450 2D6 parmi les populations asiatiques, africaines et autres ne sont pas encore disponibles. Les métaboliseurs lents ont des concentrations plasmatiques d'antidépresseurs tricycliques (ATC) plus élevées que prévu lorsqu'ils reçoivent des doses habituelles. Selon la fraction de médicament métabolisée par le P450 2D6, l'augmentation de la concentration plasmatique peut être faible ou assez importante (augmentation de 8 fois de l'ASC plasmatique du TCA).
De plus, certains médicaments inhibent l'activité de cette isozyme et font ressembler les métaboliseurs normaux aux métaboliseurs lents. Un individu qui est stable avec une dose donnée de TCA peut devenir brusquement toxique lorsqu'il reçoit l'un de ces médicaments inhibiteurs en traitement concomitant. Les médicaments qui inhibent le cytochrome P450 2D6 comprennent certains qui ne sont pas métabolisés par l'enzyme (quinidine, cimétidine) et beaucoup qui sont des substrats pour P450 2D6 (de nombreux autres antidépresseurs, phénothiazines et les antiarythmiques de type 1C propafénone et flécaïnide). Bien que tous les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), par exemple la fluoxétine, la sertraline et la paroxétine, inhibent P450 2D6, leur degré d'inhibition peut varier. La mesure dans laquelle l'interaction ISRS-TCA peut poser des problèmes cliniques dépendra du degré d'inhibition et de la pharmacocinétique de l'ISRS impliqué. Néanmoins, la prudence est de mise lors de la co-administration des ATC avec l'un des ISRS et également lors du passage d'une classe à l'autre. Il est particulièrement important de veiller à ce qu'un délai suffisant s'écoule avant d'initier un traitement par TCA chez un patient sevré de la fluoxétine, compte tenu de la longue demi-vie du parent et du métabolite actif (au moins 5 semaines peuvent être nécessaires).
L'utilisation concomitante d'antidépresseurs tricycliques avec des médicaments qui peuvent inhiber le cytochrome P450 2D6 peut nécessiter des doses plus faibles que celles habituellement prescrites pour l'antidépresseur tricyclique ou l'autre médicament. De plus, chaque fois que l'un de ces autres médicaments est retiré de la co-thérapie, une dose accrue d'antidépresseur tricyclique peut être nécessaire. Il est souhaitable de surveiller les taux plasmatiques de TCA chaque fois qu'un TCA va être co-administré avec un autre médicament connu pour être un inhibiteur de P450 2D6.
La concentration plasmatique d'imipramine peut augmenter lorsque le médicament est administré en concomitance avec des inhibiteurs des enzymes hépatiques (par exemple, la cimétidine, la fluoxétine) et diminuer en cas d'administration concomitante avec des inducteurs des enzymes hépatiques (par exemple, les barbituriques, la phénytoïne), et l'ajustement de la posologie de l'imipramine peut donc être nécessaire.
Chez les patients occasionnellement sensibles ou chez ceux qui reçoivent en plus des médicaments anticholinergiques (y compris des agents antiparkinsoniens), les effets de type atropinique peuvent devenir plus prononcés (p. ex., iléus paralytique). Une surveillance étroite et un ajustement soigneux de la posologie sont nécessaires lorsque le chlorhydrate d'imipramine est administré en concomitance avec des médicaments anticholinergiques.
Éviter l'utilisation de préparations, comme les décongestionnants et les anesthésiques locaux, qui contiennent une amine sympathomimétique (p. ex., épinéphrine, noradrénaline), car il a été rapporté que les antidépresseurs tricycliques peuvent potentialiser les effets des catécholamines.
La prudence s'impose lorsque le chlorhydrate d'imipramine est utilisé avec des agents qui abaissent la tension artérielle. Le chlorhydrate d'imipramine peut potentialiser les effets des dépresseurs du SNC.
Les patients doivent être avertis que le chlorhydrate d'imipramine peut augmenter les effets dépresseurs de l'alcool sur le SNC (voir AVERTISSEMENTS ).
AVERTISSEMENTS
Aggravation clinique et risque de suicide
Les patients atteints de trouble dépressif majeur (TDM), à la fois adultes et pédiatriques, peuvent présenter une aggravation de leur dépression et/ou l'émergence d'idées et de comportements suicidaires (suicidalité) ou des changements de comportement inhabituels, qu'ils prennent ou non des antidépresseurs, et cela le risque peut persister jusqu'à ce qu'une rémission significative se produise. Le suicide est un risque connu de dépression et de certains autres troubles psychiatriques, et ces troubles eux-mêmes sont les meilleurs prédicteurs du suicide. Cependant, on craint depuis longtemps que les antidépresseurs puissent jouer un rôle dans l'aggravation de la dépression et l'émergence de comportements suicidaires chez certains patients au cours des premières phases du traitement. Des analyses groupées d'essais contrôlés par placebo à court terme portant sur des antidépresseurs (ISRS et autres) ont montré que ces médicaments augmentent le risque de pensées et de comportements suicidaires (suicidalité) chez les enfants, les adolescents et les jeunes adultes (âgés de 18 à 24 ans) atteints de dépression majeure. (MDD) et d'autres troubles psychiatriques. Les études à court terme n'ont pas montré d'augmentation du risque de suicide avec les antidépresseurs par rapport au placebo chez les adultes au-delà de 24 ans ; il y avait une réduction avec les antidépresseurs par rapport au placebo chez les adultes âgés de 65 ans et plus.
Les analyses groupées d'essais contrôlés par placebo chez des enfants et des adolescents atteints de TDM, de trouble obsessionnel-compulsif (TOC) ou d'autres troubles psychiatriques comprenaient un total de 24 essais à court terme de 9 antidépresseurs chez plus de 4 400 patients. Les analyses groupées d'essais contrôlés par placebo chez des adultes atteints de TDM ou d'autres troubles psychiatriques comprenaient un total de 295 essais à court terme (durée médiane de 2 mois) de 11 antidépresseurs chez plus de 77 000 patients. Il y avait une variation considérable du risque de suicidalité entre les médicaments, mais une tendance à une augmentation chez les patients plus jeunes pour presque tous les médicaments étudiés. Il y avait des différences dans le risque absolu de suicidalité entre les différentes indications, avec l'incidence la plus élevée dans le TDM. Les différences de risque (médicament contre placebo) étaient toutefois relativement stables au sein des tranches d'âge et entre les indications. Ces différences de risque (différence médicament-placebo dans le nombre de cas de suicide pour 1000 patients traités) sont présentées dans le tableau 1.
Aucun suicide n'est survenu dans aucun des essais pédiatriques. Il y a eu des suicides dans les essais sur les adultes, mais le nombre n'était pas suffisant pour tirer une conclusion sur l'effet du médicament sur le suicide.
On ne sait pas si le risque de suicide s'étend à une utilisation à plus long terme, c'est-à-dire au-delà de plusieurs mois. Cependant, il existe des preuves substantielles provenant d'essais d'entretien contrôlés par placebo chez des adultes souffrant de dépression que l'utilisation d'antidépresseurs peut retarder la récurrence de la dépression.
Tous les patients traités avec des antidépresseurs pour toute indication doivent être surveillés de manière appropriée et observés de près pour déceler une aggravation clinique, des tendances suicidaires et des changements inhabituels de comportement, en particulier au cours des premiers mois d'un traitement médicamenteux, ou lors de changements de dose, soit des augmentations ou diminue.
Les symptômes suivants, anxiété, agitation, attaques de panique, insomnie, irritabilité, hostilité, agressivité, impulsivité, akathisie (agitation psychomotrice), hypomanie et manie, ont été rapportés chez des patients adultes et pédiatriques traités avec des antidépresseurs pour un trouble dépressif majeur ainsi comme pour les autres indications, tant psychiatriques que non psychiatriques. Bien qu'un lien de causalité entre l'apparition de tels symptômes et soit l'aggravation de la dépression et/ou l'émergence d'impulsions suicidaires n'ait pas été établi, on craint que ces symptômes puissent représenter des précurseurs d'une suicidalité émergente.
Il convient d'envisager de modifier le schéma thérapeutique, y compris éventuellement d'arrêter le médicament, chez les patients dont la dépression s'aggrave de manière persistante, ou qui présentent des tendances suicidaires émergentes ou des symptômes qui pourraient être des précurseurs d'une aggravation de la dépression ou des tendances suicidaires, en particulier si ces symptômes sont graves, brusques. au début ou ne faisaient pas partie des symptômes présentés par le patient.
Les familles et les soignants des patients traités avec des antidépresseurs pour un trouble dépressif majeur ou d'autres indications, à la fois psychiatriques et non psychiatriques, doivent être alertés de la nécessité de surveiller les patients pour l'apparition d'agitation, d'irritabilité, de changements inhabituels de comportement et des autres symptômes décrits ci-dessus. , ainsi que l'émergence de tendances suicidaires, et de signaler immédiatement ces symptômes aux professionnels de la santé. Une telle surveillance devrait inclure une observation quotidienne par les familles et les soignants. Les prescriptions de chlorhydrate d'imipramine doivent être rédigées pour la plus petite quantité de comprimés compatible avec une bonne prise en charge du patient, afin de réduire le risque de surdosage.
Dépistage des patients pour le trouble bipolaire
Un épisode dépressif majeur peut être la présentation initiale d'un trouble bipolaire. Il est généralement admis (bien que non établi dans des essais contrôlés) que le traitement d'un tel épisode avec un antidépresseur seul peut augmenter la probabilité de précipitation d'un épisode mixte/maniaque chez les patients à risque de trouble bipolaire. On ne sait pas si l'un des symptômes décrits ci-dessus représente une telle conversion. Cependant, avant d'initier un traitement avec un antidépresseur, les patients présentant des symptômes dépressifs doivent faire l'objet d'un dépistage adéquat pour déterminer s'ils présentent un risque de trouble bipolaire ; un tel dépistage devrait inclure des antécédents psychiatriques détaillés, y compris des antécédents familiaux de suicide, de trouble bipolaire et de dépression. Il convient de noter que le chlorhydrate d'imipramine n'est pas approuvé pour une utilisation dans le traitement de la dépression bipolaire.
Glaucome à angle fermé
La dilatation pupillaire qui survient après l'utilisation de nombreux antidépresseurs, dont le tofranil, peut déclencher une attaque à angle fermé chez un patient présentant des angles anatomiquement étroits qui n'a pas subi d'iridectomie perméable.
Enfants
La dose de 2,5 mg/kg/jour de Tofranil 25mg ne doit pas être dépassée chez l'enfant. Des modifications de l'ECG de signification inconnue ont été signalées chez des patients pédiatriques recevant des doses deux fois plus élevées.
Une extrême prudence doit être utilisée lorsque ce médicament est administré à: des patients atteints de maladies cardiovasculaires en raison de la possibilité de troubles de la conduction, d'arythmies, d'insuffisance cardiaque congestive, d'infarctus du myocarde, d'accidents vasculaires cérébraux et de tachycardie. Ces patients nécessitent une surveillance cardiaque à tous les niveaux de dosage du médicament ;
les patients ayant des antécédents de rétention urinaire ou des antécédents de glaucome à angle fermé en raison des propriétés anticholinergiques du médicament ; les patients hyperthyroïdiens ou ceux qui prennent des médicaments pour la thyroïde en raison de la possibilité de toxicité cardiovasculaire ;
les patients ayant des antécédents de troubles épileptiques, car il a été démontré que ce médicament abaisse le seuil épileptogène ;
les patients recevant de la guanéthidine, de la clonidine ou des agents similaires, car le Tofranil peut bloquer les effets pharmacologiques de ces médicaments ;
patients recevant du chlorhydrate de méthylphénidate. Étant donné que le chlorhydrate de méthylphénidate peut inhiber le métabolisme de Tofranil 75 mg, un ajustement posologique à la baisse du chlorhydrate d'imipramine peut être nécessaire lorsqu'il est administré en concomitance avec le chlorhydrate de méthylphénidate.
Le tofranil peut renforcer les effets dépresseurs de l'alcool sur le SNC. Par conséquent, il convient de garder à l'esprit que les dangers inhérents à une tentative de suicide ou à un surdosage accidentel avec le médicament peuvent être accrus pour le patient qui consomme des quantités excessives d'alcool (voir PRÉCAUTIONS ).
Étant donné que Tofranil peut altérer les capacités mentales et/ou physiques nécessaires à l'exécution de tâches potentiellement dangereuses, telles que la conduite d'une automobile ou de machines, le patient doit être averti en conséquence.
PRÉCAUTIONS
Général
Un enregistrement ECG doit être effectué avant le début de doses plus importantes que d'habitude de Tofranil et à des intervalles appropriés par la suite jusqu'à ce que l'état d'équilibre soit atteint. (Les patients présentant des signes de maladie cardiovasculaire nécessitent une surveillance cardiaque à tous les niveaux de dosage du médicament. Voir AVERTISSEMENTS .) Les patients âgés et les patients atteints de maladie cardiaque ou ayant des antécédents de maladie cardiaque présentent un risque particulier de développer des anomalies cardiaques associées à l'utilisation de Tofranil.
Il faut garder à l'esprit que la possibilité de suicide chez les patients gravement déprimés est inhérente à la maladie et peut persister jusqu'à ce qu'une rémission significative se produise. Ces patients doivent être étroitement surveillés pendant la phase initiale du traitement par Tofranil 75 mg et peuvent nécessiter une hospitalisation. Les ordonnances doivent être écrites pour le plus petit montant possible. Des épisodes hypomaniaques ou maniaques peuvent survenir, en particulier chez les patients présentant des troubles cycliques. De telles réactions peuvent nécessiter l'arrêt du médicament. Si besoin, Tofranil 75mg peut être repris à dose plus faible lorsque ces épisodes sont soulagés.
L'administration d'un tranquillisant peut être utile pour contrôler de tels épisodes.
Une activation de la psychose peut parfois être observée chez les patients schizophrènes et peut nécessiter une réduction de la posologie et l'ajout d'une phénothiazine.
L'administration concomitante de Tofranil 50 mg avec une thérapie par électrochocs peut augmenter les risques ; un tel traitement doit être limité aux patients pour lesquels il est essentiel, car l'expérience clinique est limitée.
Les patients prenant du chlorhydrate d'imipramine doivent éviter une exposition excessive au soleil car des cas de photosensibilisation ont été rapportés.
L'élévation et l'abaissement des niveaux de sucre dans le sang ont été rapportés avec l'utilisation de chlorhydrate d'imipramine.
Le chlorhydrate d'imipramine doit être utilisé avec prudence chez les patients présentant une insuffisance rénale ou hépatique significative.
Les patients qui développent de la fièvre et un mal de gorge pendant le traitement par le chlorhydrate d'imipramine doivent subir une numération leucocytaire et une numération globulaire différentielle. Le chlorhydrate d'imipramine doit être arrêté s'il existe des signes de dépression pathologique des neutrophiles.
Avant une intervention chirurgicale programmée, le chlorhydrate d'imipramine doit être interrompu aussi longtemps que la situation clinique le permet.
Informations pour les patients
Les prescripteurs ou autres professionnels de la santé doivent informer les patients, leurs familles et leurs soignants des avantages et des risques associés au traitement par le chlorhydrate d'imipramine et doivent les conseiller sur son utilisation appropriée. Un patient Guide des médicaments à propos de "Médicaments antidépresseurs, dépression et autres maladies mentales graves, et pensées ou actions suicidaires" est disponible pour le chlorhydrate d'imipramine. Le prescripteur ou le professionnel de la santé doit demander aux patients, à leurs familles et à leurs soignants de lire le Guide des médicaments et doit les aider à comprendre son contenu. Les patients doivent avoir la possibilité de discuter du contenu du Guide de Médication et d'obtenir des réponses à toutes les questions qu'ils pourraient avoir. Le texte complet du Guide de Médication est réimprimé à la fin de ce document.
Les patients doivent être informés des problèmes suivants et invités à alerter leur médecin traitant si ceux-ci surviennent lors de la prise de chlorhydrate d'imipramine.
Les patients doivent être informés que la prise de Tofranil peut provoquer une légère dilatation pupillaire qui, chez les personnes sensibles, peut entraîner un épisode de glaucome à angle fermé. Le glaucome préexistant est presque toujours un glaucome à angle ouvert car le glaucome à angle fermé, lorsqu'il est diagnostiqué, peut être traité définitivement par iridectomie. Le glaucome à angle ouvert n'est pas un facteur de risque de glaucome à angle fermé. Les patients peuvent souhaiter être examinés pour déterminer s'ils sont sensibles à la fermeture de l'angle et subir une intervention prophylactique (p. ex., iridectomie), s'ils y sont sensibles.
Aggravation clinique et risque de suicide
Les patients, leurs familles et leurs soignants doivent être encouragés à être attentifs à l'émergence d'anxiété, d'agitation, d'attaques de panique, d'insomnie, d'irritabilité, d'hostilité, d'agressivité, d'impulsivité, d'akathisie (agitation psychomotrice), d'hypomanie, de manie, d'autres changements inhabituels de comportement , aggravation de la dépression et idées suicidaires, en particulier au début du traitement antidépresseur et lorsque la dose est ajustée à la hausse ou à la baisse. Il faut conseiller aux familles et aux soignants des patients de rechercher l'apparition de tels symptômes au jour le jour, car les changements peuvent être brusques. De tels symptômes doivent être signalés au médecin prescripteur ou au professionnel de la santé du patient, en particulier s'ils sont graves, d'apparition brutale ou ne font pas partie des symptômes présentés par le patient. De tels symptômes peuvent être associés à un risque accru de pensées et de comportements suicidaires et indiquent la nécessité d'une surveillance très étroite et éventuellement de modifications de la médication.
Grossesse
Les études de reproduction animale ont donné des résultats peu concluants (voir aussi Pharmacologie animale ).
Aucune étude bien contrôlée n'a été menée auprès de femmes enceintes pour déterminer l'effet de Tofranil sur le fœtus. Cependant, il y a eu des rapports cliniques de malformations congénitales associées à l'utilisation du médicament. Bien qu'une relation causale entre ces effets et le médicament n'ait pas pu être établie, la possibilité d'un risque fœtal lié à l'ingestion maternelle de Tofranil ne peut être exclue. Par conséquent, Tofranil ne doit être utilisé chez les femmes enceintes ou susceptibles de l'être que si l'état clinique justifie clairement le risque potentiel pour le fœtus.
Mères allaitantes
Des données limitées suggèrent que Tofranil 75 mg est susceptible d'être excrété dans le lait maternel humain. En règle générale, une femme qui prend un médicament ne doit pas allaiter car il est possible que le médicament soit excrété dans le lait maternel et soit nocif pour l'enfant.
Utilisation pédiatrique
La sécurité et l'efficacité dans la population pédiatrique autre que les patients pédiatriques souffrant d'énurésie nocturne n'ont pas été établies (voir AVERTISSEMENT DE BOÎTE et AVERTISSEMENTS , Aggravation clinique et risque de suicide ). Quiconque envisage l'utilisation du chlorhydrate d'imipramine chez un enfant ou un adolescent doit équilibrer les risques potentiels avec le besoin clinique.
L'innocuité et l'efficacité du médicament en tant que traitement d'appoint temporaire de l'énurésie nocturne chez les patients pédiatriques de moins de 6 ans n'ont pas été établies.
L'innocuité du médicament pour une utilisation chronique à long terme en tant que traitement d'appoint de l'énurésie nocturne chez les patients pédiatriques de 6 ans ou plus n'a pas été établie; il faut envisager d'instituer une période sans médicament après un essai thérapeutique adéquat avec une réponse favorable.
Une dose de 2,5 mg/kg/jour ne doit pas être dépassée chez l'enfant. Des modifications de l'ECG de signification inconnue ont été signalées chez des patients pédiatriques recevant des doses deux fois plus élevées.
Utilisation gériatrique
Dans la littérature, il y avait quatre études cliniques bien contrôlées, randomisées, en double aveugle, de comparaison de groupes parallèles réalisées avec Tofranil 50 mg dans la population âgée. Il y avait un nombre total de 651 sujets inclus dans ces études. Ces études n'ont pas fourni de comparaison avec des sujets plus jeunes. Aucun effet indésirable supplémentaire n'a été identifié chez les personnes âgées.
Les études cliniques de Tofranil 75 mg dans la demande initiale n'incluaient pas un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils réagissent différemment des sujets plus jeunes. L'expérience clinique post-commercialisation n'a pas identifié de différences dans les réponses entre les sujets âgés et les sujets plus jeunes. En général, la sélection de la dose pour les personnes âgées doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant une fréquence plus élevée de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
(Voir également DOSAGE ET ADMINISTRATION , Adolescente et Patients gériatriques .)
(Voir également PRÉCAUTIONS , Général. )
SURDOSAGE
Des décès peuvent survenir à la suite d'un surdosage avec cette classe de médicaments. L'ingestion de plusieurs médicaments (y compris l'alcool) est fréquente en cas de surdosage tricyclique délibéré. Comme la prise en charge est complexe et changeante, il est recommandé au médecin de contacter un centre antipoison pour obtenir des informations à jour sur le traitement. Les signes et symptômes de toxicité se développent rapidement après un surdosage tricyclique. Par conséquent, une surveillance hospitalière est requise dès que possible.
On a annoncé que des enfants sont plus sensibles que des adultes à un surdosage aigu d'hydrochlorure d'imipramine. Un surdosage aigu de n'importe quelle quantité chez les nourrissons ou les jeunes enfants, en particulier, doit être considéré comme grave et potentiellement mortel.
manifestations
Ceux-ci peuvent varier en gravité en fonction de facteurs tels que la quantité de médicament absorbée, l'âge du patient et l'intervalle entre l'ingestion du médicament et le début du traitement. Les manifestations critiques d'un surdosage comprennent des troubles du rythme cardiaque, une hypotension sévère, des convulsions et une dépression du SNC, y compris le coma. Les modifications de l'électrocardiogramme, en particulier de l'axe ou de la largeur du QRS, sont des indicateurs cliniquement significatifs de la toxicité tricyclique.
D'autres manifestations du SNC peuvent inclure la somnolence, la stupeur, l'ataxie, l'agitation, l'agitation, les réflexes hyperactifs, la rigidité musculaire, les mouvements athétoides et choréiformes.
Les anomalies cardiaques peuvent inclure une tachycardie et des signes d'insuffisance congestive. Une dépression respiratoire, une cyanose, un choc, des vomissements, une hyperpyrexie, une mydriase et une diaphorèse peuvent également être présents.
La gestion
Obtenir un ECG et commencer immédiatement la surveillance cardiaque. Protégez les voies respiratoires du patient, établissez une ligne intraveineuse et lancez la décontamination gastrique. Un minimum de 6 heures d'observation avec surveillance cardiaque et observation des signes de dépression du SNC ou respiratoire, d'hypotension, de troubles du rythme cardiaque et/ou de blocs de conduction et de convulsions est nécessaire. Si des signes de toxicité apparaissent à tout moment au cours de cette période, une surveillance prolongée est requise. Il existe des rapports de cas de patients succombant à des troubles du rythme mortels tard après un surdosage; ces patients présentaient des signes cliniques d'empoisonnement important avant le décès et la plupart ont reçu une décontamination gastro-intestinale inadéquate. La surveillance des concentrations plasmatiques du médicament ne doit pas guider la prise en charge du patient.
Décontamination gastro-intestinale
Tous les patients suspectés de surdosage tricyclique doivent recevoir une décontamination gastro-intestinale. Cela devrait inclure un lavage gastrique à grand volume suivi de charbon actif. Si la conscience est altérée, les voies respiratoires doivent être sécurisées avant le lavage. Les vomissements sont contre-indiqués.
Cardiovasculaire
Une durée maximale du QRS des dérivations des membres de ≥ 0,10 seconde peut être la meilleure indication de la gravité du surdosage. Le bicarbonate de sodium intraveineux doit être utilisé pour maintenir le pH sérique entre 7,45 et 7,55. Si la réponse du pH est inadéquate, l'hyperventilation peut également être utilisée. L'utilisation concomitante d'hyperventilation et de bicarbonate de sodium doit être effectuée avec une extrême prudence, avec une surveillance fréquente du pH. Un pH >7,60 ou un pCO2
Dans de rares cas, l'hémoperfusion peut être bénéfique en cas d'instabilité cardiovasculaire aiguë réfractaire chez les patients présentant une toxicité aiguë. Cependant, l'hémodialyse, la dialyse péritonéale, les exsanguinotransfusions et la diurèse forcée ont généralement été signalées comme inefficaces dans l'intoxication tricyclique.
SNC
Chez les patients souffrant de dépression du SNC, une intubation précoce est conseillée en raison du risque de détérioration brutale. Les convulsions doivent être contrôlées avec des benzodiazépines ou, si celles-ci sont inefficaces, avec d'autres anticonvulsivants (p. ex., phénobarbital, phénytoïne). La physostigmine n'est pas recommandée, sauf pour traiter les symptômes potentiellement mortels qui n'ont pas répondu aux autres traitements, et uniquement en consultation avec un centre antipoison.
Suivi psychiatrique
Étant donné que le surdosage est souvent délibéré, les patients peuvent tenter de se suicider par d'autres moyens pendant la phase de récupération. Une référence psychiatrique peut être appropriée.
Gestion pédiatrique
Les principes de prise en charge des surdosages chez l'enfant et chez l'adulte sont similaires. Il est fortement recommandé que le médecin contacte le centre antipoison local pour un traitement pédiatrique spécifique.
CONTRE-INDICATIONS
L'utilisation concomitante de composés inhibiteurs de la monoamine oxydase est contre-indiquée. Des crises hyperpyrétiques ou des convulsions sévères peuvent survenir chez les patients recevant de telles associations. La potentialisation des effets indésirables peut être grave, voire mortelle. Lorsqu'il est souhaité de substituer le Tofranil chez les patients recevant un inhibiteur de la monoamine oxydase, un intervalle aussi long que la situation clinique le permet, avec un minimum de 14 jours. La posologie initiale doit être faible et les augmentations doivent être progressives et prudemment prescrites.
Le médicament est contre-indiqué pendant la période de récupération aiguë après un infarctus du myocarde. Les patients présentant une hypersensibilité connue à ce composé ne doivent pas recevoir le médicament. La possibilité d'une sensibilité croisée à d'autres composés dibenzazépines doit être gardée à l'esprit.
PHARMACOLOGIE CLINIQUE
Le mécanisme d'action de Tofranil 25mg n'est pas définitivement connu. Cependant, il n'agit pas principalement par stimulation du système nerveux central. L'effet clinique est supposé être dû à la potentialisation des synapses adrénergiques en bloquant l'absorption de noradrénaline au niveau des terminaisons nerveuses. On pense que le mode d'action du médicament dans le contrôle de l'énurésie infantile est indépendant de son effet antidépresseur.
Pharmacologie et toxicologie animales
A. Aiguë
Les plages de DL50 orales sont les suivantes :
Rat 355 à 682 mg/kg Chien 100 à 215 mg/kg
Selon le dosage chez les deux espèces, les signes toxiques sont passés progressivement de la dépression, de la respiration irrégulière et de l'ataxie aux convulsions et à la mort.
B. Reproduction/Tératogène
L'évaluation globale peut se résumer de la manière suivante :
Oral : des études indépendantes menées sur trois espèces (rat, souris et lapin) ont révélé que lorsque le tofranil est administré par voie orale à des doses pouvant atteindre environ 2 1/2 fois la dose maximale chez l'humain chez les 2 premières espèces et jusqu'à 25 fois la dose maximale chez l'humain. dose chez la troisième espèce, le médicament est essentiellement exempt de potentiel tératogène. Dans les trois espèces étudiées, un seul cas d'anomalie fœtale s'est produit (chez le lapin) et dans cette étude, il y avait également une anomalie dans le groupe témoin. Cependant, des preuves existent à partir des études sur les rats qu'un certain potentiel systémique et embryotoxique est démontrable. Cela se manifeste par une taille de portée réduite, une légère augmentation du taux de mort-nés et une réduction du poids moyen à la naissance.
