Les médicaments antidépresseurs: Celexa 10mg, 20mg Citalopram Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Celexa et comment est-il utilisé ?
Celexa est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de la dépression. Celexa peut être utilisé seul ou avec d'autres médicaments.
Celexa 20 mg appartient à une classe de médicaments appelés antidépresseurs, ISRS.
Quels sont les effets secondaires possibles de Celexa ?
Celexa peut provoquer des effets secondaires graves, notamment :
- étourdissement,
- Vision floue,
- vision tunnel,
- douleur ou gonflement des yeux,
- voir des halos autour des lumières,
- maux de tête avec douleurs thoraciques et étourdissements sévères,
- évanouissement,
- rythme cardiaque rapide ou battant,
- muscles très raides (rigides),
- fièvre ou forte fièvre,
- transpiration,
- confusion,
- tremblements,
- agitation,
- hallucinations,
- réflexes hyperactifs,
- nausée,
- vomissement,
- diarrhée,
- perte de coordination,
- mal de tête,
- troubles de l'élocution,
- grande faiblesse et
- se sentir instable
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Celexa 20 mg incluent :
- problèmes de mémoire,
- difficulté de concentration,
- mal de tête,
- somnolence,
- bouche sèche,
- augmenter la transpiration,
- engourdissement ou fourmillement,
- Augmentation de l'appétit,
- nausée,
- diarrhée,
- gaz,
- battements de coeur rapides,
- se sentir tremblant,
- problème de sommeil (insomnie),
- se sentir fatigué,
- symptômes du rhume (nez bouché, éternuements, mal de gorge),
- changements de poids, et
- difficulté à avoir un orgasme
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Celexa. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Suicidalité et antidépresseurs
Les antidépresseurs ont augmenté le risque par rapport au placebo de pensées et de comportements suicidaires (suicidalité) chez les enfants, les adolescents et les jeunes adultes dans des études à court terme sur le trouble dépressif majeur (TDM) et d'autres troubles psychiatriques. Quiconque envisage l'utilisation de Celexa ou de tout autre antidépresseur chez un enfant, un adolescent ou un jeune adulte doit équilibrer ce risque avec le besoin clinique. Les études à court terme n'ont pas montré d'augmentation du risque de suicide avec les antidépresseurs par rapport au placebo chez les adultes au-delà de 24 ans ; il y avait une réduction du risque avec les antidépresseurs par rapport au placebo chez les adultes âgés de 65 ans et plus. La dépression et certains autres troubles psychiatriques sont eux-mêmes associés à une augmentation du risque de suicide. Les patients de tous âges qui commencent un traitement antidépresseur doivent être surveillés de manière appropriée et observés de près pour déceler une aggravation clinique, des tendances suicidaires ou des changements inhabituels de comportement. Les familles et les soignants doivent être informés de la nécessité d'une surveillance étroite et d'une communication avec le prescripteur. Celexa 10 mg n'est pas approuvé pour une utilisation chez les patients pédiatriques. (Voir MISES EN GARDE : Aggravation clinique et risque de suicide, RENSEIGNEMENTS POUR LES PATIENTS et PRÉCAUTIONS : Utilisation pédiatrique.)
LA DESCRIPTION
Celexa® (citalopram HBr) est un inhibiteur sélectif de la recapture de la sérotonine (ISRS) administré par voie orale avec une structure chimique sans rapport avec celle des autres ISRS ou des agents antidépresseurs tricycliques, tétracycliques ou autres disponibles. Le citalopram HBr est un dérivé de phtalane bicyclique racémique appelé (±)-1-(3-diméthylaminopropyl)-1-(4-fluorophényl)-1,3-dihydroisobenzofuran-5-carbonitrile, HBr avec la formule structurale suivante :
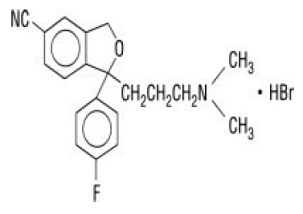
La formule moléculaire est C20H22BrFN2O et son poids moléculaire est de 405,35.
Le citalopram HBr se présente sous la forme d'une fine poudre blanche à blanc cassé. Le citalopram HBr est peu soluble dans l'eau et soluble dans l'éthanol.
Celexa (bromhydrate de citalopram) est disponible uniquement sous forme de comprimés.
Celexa 10 mg se présente sous la forme de comprimés pelliculés ovales contenant du citalopram HBr à des dosages équivalents à 10 mg de citalopram base. Celexa 20 mg et 40 mg sont des comprimés pelliculés, ovales et sécables contenant du citalopram HBr à des dosages équivalents à 20 mg ou 40 mg de citalopram base. Les comprimés contiennent également les ingrédients inactifs suivants : copolyvidone, amidon de maïs, crosscarmellose sodique, glycérine, lactose monohydraté, stéarate de magnésium, hypromellose, cellulose microcristalline, polyéthylèneglycol et dioxyde de titane. Les oxydes de fer sont utilisés comme colorants dans les comprimés beige (10 mg) et rose (20 mg).
LES INDICATIONS
CELEXA 20 mg est indiqué dans le traitement du trouble dépressif majeur (TDM) chez l'adulte [voir Etudes cliniques ].
DOSAGE ET ADMINISTRATION
Dosage recommandé
Administrez CELEXA une fois par jour, avec ou sans nourriture, à une dose initiale de 20 mg une fois par jour, avec une augmentation jusqu'à une dose maximale de 40 mg une fois par jour à un intervalle d'au moins une semaine.
Les doses supérieures à 40 mg une fois par jour ne sont pas recommandées en raison du risque d'allongement de l'intervalle QT [voir AVERTISSEMENTS ET PRECAUTIONS ].
Dépister le trouble bipolaire avant de commencer CELEXA
Avant de commencer un traitement avec CELEXA 20 mg ou un autre antidépresseur, dépister les patients pour des antécédents personnels ou familiaux de trouble bipolaire, de manie ou d'hypomanie [voir AVERTISSEMENTS ET PRECAUTIONS ].
Posologie recommandée pour des populations spécifiques
La posologie maximale recommandée de CELEXA 10 mg pour les patients âgés de plus de 60 ans, les patients atteints d'insuffisance hépatique et pour les métaboliseurs lents du CYP2C19 est de 20 mg une fois par jour [voir AVERTISSEMENTS ET PRECAUTIONS , PHARMACOLOGIE CLINIQUE ].
Modifications posologiques avec utilisation concomitante d'inhibiteurs du CYP2C19
La posologie maximale recommandée de CELEXA 20 mg lorsqu'il est utilisé en concomitance avec un inhibiteur du CYP2C19 est de 20 mg une fois par jour [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
Changement de patients vers ou depuis un antidépresseur inhibiteur de la monoamine oxydase
Au moins 14 jours doivent s'écouler entre l'arrêt d'un antidépresseur inhibiteur de la monoamine oxydase (IMAO) et le début du traitement par CELEXA. À l'inverse, au moins 14 jours doivent s'écouler après l'arrêt de CELEXA avant de commencer un antidépresseur IMAO [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Arrêt du traitement par CELEXA
Des effets indésirables peuvent survenir à l'arrêt de CELEXA [voir AVERTISSEMENTS ET PRECAUTIONS ]. Réduisez progressivement la posologie plutôt que d'arrêter brutalement CELEXA dans la mesure du possible.
COMMENT FOURNIE
Formes posologiques et points forts
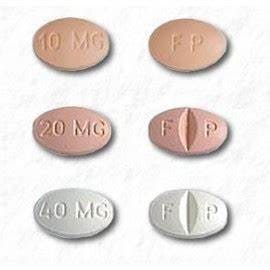
Les comprimés de CELEXA 10 mg sont disponibles en :
- 10 mg : beige, ovale avec « FP » imprimé d'un côté, « 10 mg » imprimé de l'autre côté
- 20 mg : rose, ovale, sécable avec « F » imprimé sur le côté gauche de la ligne de sécabilité et « P » imprimé sur le côté droit de la ligne de sécabilité, « 20 mg » imprimé sur le côté non sécable
- 40 mg : blanc, ovale, sécable avec « F » imprimé sur le côté gauche de la ligne de sécabilité et « P » imprimé sur le côté droit de la ligne de sécabilité, « 40 mg » imprimé sur le côté non sécable
CELEXA (citalopram) comprimés sont fournis comme suit :
Stockage et manutention
Les comprimés CELEXA 10 mg doivent être conservés entre 20 et 25 °C (68 à 77 °F); excursions autorisées entre 15 et 30°C (59-86°F) [voir Température ambiante contrôlée USP ].
Distribué par : Allergan USA, Inc. Révisé : février 2022
EFFETS SECONDAIRES
Les effets indésirables suivants sont discutés plus en détail dans d'autres sections de l'étiquetage :
- Réactions d'hypersensibilité [voir CONTRE-INDICATIONS ]
- Pensées et comportements suicidaires chez les adolescents et les jeunes adultes [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Allongement de l'intervalle QT et torsades de pointes [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Syndrome sérotoninergique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Risque accru de saignement [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Activation de la manie ou de l'hypomanie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Syndrome de sevrage [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Saisies [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Glaucome à angle fermé [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hyponatrémie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Dysfonction sexuelle [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
L'innocuité de CELEXA 20 mg comprenait des expositions au citalopram chez des patients et/ou des sujets sains issus de 3 groupes d'études différents : 429 sujets sains dans des études cliniques de pharmacologie/pharmacocinétique ; 4 422 expositions de patients dans des essais cliniques contrôlés et non contrôlés, correspondant à environ 1 370 années d'exposition de patients. Il y a eu, en outre, plus de 19 000 expositions issues d'études post-commercialisation européennes, pour la plupart ouvertes. Les conditions et la durée du traitement par CELEXA 10 mg variaient considérablement et incluaient (dans des catégories qui se chevauchent) des études en ouvert et en double aveugle, des études sur des patients hospitalisés et ambulatoires, des études à dose fixe et de titration de dose, et une exposition à court terme et à long terme. .
Effets indésirables associés à l'arrêt du traitement
Parmi 1 063 patients atteints de TDM qui ont reçu CELEXA 10 mg à des doses allant de 10 mg à 80 mg une fois par jour dans des essais contrôlés par placebo d'une durée allant jusqu'à 6 semaines, 16 % ont arrêté le traitement en raison d'un effet indésirable, contre 8 % des 446 patients recevoir un placebo. Les effets indésirables associés à l'arrêt du traitement (c'est-à-dire associés à l'arrêt du traitement chez au moins 1 % des patients traités par CELEXA à un taux au moins deux fois supérieur à celui du placebo) sont présentés dans le tableau 2.
Le tableau 3 énumère l'incidence des effets indésirables survenus chez 1 063 patients atteints de TDM qui ont reçu CELEXA 20 mg à des doses allant de 10 mg à 80 mg une fois par jour dans des essais contrôlés par placebo d'une durée allant jusqu'à 6 semaines.
L'effet indésirable le plus fréquemment survenu chez les patients traités par CELEXA, avec une incidence de 5 % ou plus et une incidence au moins deux fois supérieure chez les patients sous placebo, était le trouble de l'éjaculation (principalement un retard d'éjaculation) chez les patients de sexe masculin (voir tableau 3).
Effets indésirables dose-dépendants
La relation potentielle entre la posologie de CELEXA 10 mg et l'incidence des effets indésirables a été examinée dans une étude à dose fixe chez des patients atteints de TDM recevant un placebo ou CELEXA 10 mg, 20 mg 40 mg ou 60 mg (1,5 fois la dose maximale recommandée) . Une dose-réponse positive (p
Dysfonction sexuelle masculine et féminine avec les ISRS
Bien que les changements dans le désir sexuel, la performance sexuelle et la satisfaction sexuelle se produisent souvent comme des manifestations d'un trouble psychiatrique, ils peuvent également être une conséquence du traitement par ISRS. Cependant, il est difficile d'obtenir des estimations fiables de l'incidence et de la gravité des expériences fâcheuses impliquant le désir sexuel, la performance et la satisfaction, en partie parce que les patients et les prestataires de soins de santé peuvent être réticents à en discuter. En conséquence, les estimations de l'incidence des expériences et des performances sexuelles indésirables citées dans l'étiquetage peuvent sous-estimer leur incidence réelle.
Le tableau 4 présente l'incidence des effets indésirables sexuels signalés par au moins 2 % des patients de sexe masculin prenant CELEXA à 20 mg dans un pool d'essais cliniques contrôlés par placebo menés chez des patients souffrant de dépression.
Chez les patientes déprimées recevant CELEXA à 20 mg, l'incidence signalée de diminution de la libido et d'anorgasmie était de 1,3 % (n = 638 femmes) et de 1,1 % (n = 252 femmes), respectivement.
Changements de poids
Les patients traités par CELEXA dans le cadre d'essais contrôlés ont subi une perte de poids d'environ 0,5 kg par rapport à aucun changement chez les patients sous placebo.
Modifications de l'ECG
Dans une étude approfondie sur l'intervalle QT, CELEXA s'est avéré associé à une augmentation dose-dépendante de l'intervalle QTc.
Les électrocardiogrammes des groupes CELEXA (N = 802) et placebo (N = 241) ont été comparés en ce qui concerne les valeurs aberrantes définies comme les sujets présentant des modifications de l'intervalle QTc sur 60 msec par rapport aux valeurs initiales ou absolues sur 500 msec après l'administration de la dose, et les sujets présentant une augmentation de la fréquence cardiaque jusqu'à plus de 100 bpm ou diminue à moins de 50 bpm avec un changement de 25 % par rapport à la ligne de base (valeurs aberrantes tachycardiques ou bradycardiques, respectivement). Dans le groupe CELEXA, 1,9 % des patients ont présenté une modification de l'intervalle QTcF > 60 msec par rapport à l'inclusion, contre 1,2 % des patients du groupe placebo. Aucun des patients du groupe placebo n'a présenté un QTcF post-dose > 500 msec comparativement à 0,5 % des patients du groupe CELEXA 10 mg. L'incidence des valeurs aberrantes de tachycardie était de 0,5 % dans le groupe CELEXA et de 0,4 % dans le groupe placebo. L'incidence des valeurs aberrantes de la bradycardie était de 0,9 % dans le groupe CELEXA 10 mg et de 0,4 % dans le groupe placebo.
Autres effets indésirables observés au cours de l'évaluation précommercialisation de CELEXA
La liste suivante d'effets indésirables n'inclut pas les effets qui sont : 1) inclus dans le tableau 3 ou ailleurs dans l'étiquetage, 2) pour lesquels une cause médicamenteuse était éloignée, 3) qui étaient si générales qu'elles ne sont pas informatives et celles qui se produisent uniquement un malade.
Les effets indésirables sont classés par système corporel et classés par ordre de fréquence décroissante selon les définitions suivantes : les effets indésirables fréquents sont ceux qui surviennent en une ou plusieurs occasions chez au moins 1 patient sur 100 ; les effets indésirables peu fréquents sont ceux qui surviennent chez moins de 1/100 patients à 1/1000 patients ; les effets indésirables rares sont ceux qui surviennent chez moins de 1/1000 patients.
Cardiovasculaire - Fréquents : tachycardie, hypotension orthostatique, hypotension. Peu fréquents : hypertension, bradycardie, œdème (extrémités), angine de poitrine, extrasystoles, insuffisance cardiaque, bouffées vasomotrices, infarctus du myocarde, accident vasculaire cérébral, ischémie myocardique. Rare : accident ischémique transitoire, phlébite, fibrillation auriculaire, arrêt cardiaque, bloc de branche.
Troubles du système nerveux central et périphérique - Fréquent : paresthésie, migraine. Peu fréquents : hyperkinésie, vertiges, hypertonie, trouble extrapyramidal, crampes dans les jambes, contractions musculaires involontaires, hypokinésie, névralgie, dystonie, démarche anormale, hypoesthésie, ataxie. Rare : coordination anormale, hyperesthésie, ptosis, stupeur.
Troubles endocriniens -Rares : hypothyroïdie, goitre, gynécomastie.
Problèmes gastro-intestinaux -Fréquents : augmentation de la salive, flatulences. Peu fréquents : gastrite, gastro-entérite, stomatite, éructation, hémorroïdes, dysphagie, grincements de dents, gingivite, œsophagite. Rare : colite, ulcère gastrique, cholécystite, cholélithiase, ulcère duodénal, reflux gastro-oesophagien, glossite, ictère, diverticulite, hémorragie rectale, hoquet.
Général - Peu fréquent : bouffées de chaleur, frissons, intolérance à l'alcool, syncope, syndrome grippal. Rare : rhume des foins.
Troubles sanguins et lymphatiques -Peu fréquents : purpura, anémie, épistaxis, leucocytose, leucopénie, lymphadénopathie. Rare : embolie pulmonaire, granulocytopénie, lymphocytose, lymphopénie, anémie hypochrome, trouble de la coagulation, saignement gingival.
Troubles métaboliques et nutritionnels -Fréquent : perte de poids, prise de poids. Peu fréquents : augmentation des enzymes hépatiques, soif, sécheresse oculaire, augmentation de la phosphatase alcaline, tolérance anormale au glucose. Rare : bilirubinémie, hypokaliémie, obésité, hypoglycémie, hépatite, déshydratation.
Troubles du système musculo-squelettique - Peu fréquents : arthrite, faiblesse musculaire, douleurs squelettiques. Rare : bursite, ostéoporose.
Troubles psychiatriques -Fréquents : troubles de la concentration, amnésie, apathie, dépression, augmentation de l'appétit, dépression aggravée, tentative de suicide, confusion. Peu fréquents : augmentation de la libido, réaction agressive, paronirie, toxicomanie, dépersonnalisation, hallucination, euphorie, dépression psychotique, délire, réaction paranoïaque, labilité émotionnelle, réaction de panique, psychose. Rare : réaction catatonique, mélancolie.
Troubles de la reproduction/Femme* - Fréquent : aménorrhée. Peu fréquents : galactorrhée, douleur mammaire, hypertrophie mammaire, hémorragie vaginale. (* % basé sur des sujets féminins uniquement : 2 955)
Troubles du système respiratoire -Fréquent : toux. Peu fréquents : bronchite, dyspnée, pneumonie. Rare : asthme, laryngite, bronchospasme, pneumonite, augmentation des expectorations.
Troubles de la peau et des phanères - Fréquents : rash, prurit. Peu fréquents : réaction de photosensibilité, urticaire, acné, décoloration de la peau, eczéma, alopécie, dermatite, peau sèche, psoriasis. Rare : hypertrichose, diminution de la transpiration, mélanose, kératite, cellulite, prurit anal.
Sens spéciaux - Fréquents : accommodation anormale, altération du goût. Peu fréquents : acouphènes, conjonctivite, douleur oculaire. Rare : mydriase, photophobie, diplopie, larmoiement anormal, cataracte, perte du goût.
Troubles du système urinaire - Fréquent : polyurie. Peu fréquents : fréquence des mictions, incontinence urinaire, rétention urinaire, dysurie. Rare : œdème facial, hématurie, oligurie, pyélonéphrite, calculs rénaux, douleur rénale.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation du citalopram, le racémate, ou de l'escitalopram, l'énantiomère S du citalopram. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Troubles du système sanguin et lymphatique : anémie hémolytique, thrombocytopénie, diminution de la prothrombine
Troubles cardiaques : torsade de pointes, arythmie ventriculaire, allongement de l'intervalle QT
Troubles endocriniens: hyperprolactinémie
Troubles oculaires : glaucome à angle fermé
Problèmes gastro-intestinaux: hémorragie gastro-intestinale, pancréatite
Troubles généraux et conditions administratives du site : syndrome de sevrage
Troubles hépatobiliaires : nécrose hépatique
Troubles du système immunitaire : anaphylaxie, réaction allergique
Troubles musculosquelettiques et du tissu conjonctif : rhabdomyolyse
Troubles du système nerveux : convulsion(s) grand mal, myoclonie, choréoathétose, dyskinésie, akathisie, nystagmus
Conditions de grossesse, puerpérales et périnatales : avortement spontané
Troubles psychiatriques: délire
Troubles rénaux et urinaires : insuffisance rénale aiguë
Troubles de l'appareil reproducteur et des seins : priapisme
Troubles de la peau et du tissu sous-cutané : Syndrome de Stevens Johnson, nécrolyse épidermique, œdème de Quincke, érythème polymorphe, ecchymose
Troubles vasculaires : thrombose
INTERACTIONS MÉDICAMENTEUSES
Le tableau 5 présente les interactions médicamenteuses cliniquement importantes avec CELEXA.
Toxicomanie et dépendance
Substance contrôlée
CELEXA (citalopram HBr) n'est pas une substance contrôlée.
Abuser de
Les études animales suggèrent que le risque d'abus de CELEXA 20 mg est faible. CELEXA n'a pas été systématiquement étudié chez l'homme pour son potentiel d'abus, de tolérance ou de dépendance physique. L'expérience clinique précommercialisation avec CELEXA n'a révélé aucun comportement de recherche de drogue. Cependant, ces observations n'étaient pas systématiques et il n'est pas possible de prédire, sur la base de cette expérience limitée, dans quelle mesure un médicament agissant sur le SNC sera mal utilisé, détourné et/ou abusé une fois commercialisé. Par conséquent, les prestataires de soins de santé doivent évaluer attentivement les patients sous CELEXA 20 mg pour des antécédents de toxicomanie et suivre ces patients de près, en les observant pour détecter des signes de mésusage ou d'abus (p. ex., développement d'une tolérance, augmentations de dose, comportement de recherche de drogue).
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Pensées et comportements suicidaires chez les adolescents et les jeunes adultes
Dans les analyses groupées d'essais contrôlés par placebo portant sur des médicaments antidépresseurs (ISRS et autres classes d'antidépresseurs) qui incluaient environ 77 000 patients adultes et 4 500 patients pédiatriques, l'incidence des pensées et des comportements suicidaires chez les patients traités par antidépresseurs âgés de 24 ans et moins était supérieure à chez les patients traités par placebo. Il y avait une variation considérable du risque de pensées et de comportements suicidaires entre les médicaments, mais il y avait un risque accru identifié chez les jeunes patients pour la plupart des médicaments étudiés. Il y avait des différences dans le risque absolu de pensées et de comportements suicidaires dans les différentes indications, avec l'incidence la plus élevée chez les patients atteints de TDM. Les différences médicament-placebo dans le nombre de cas d'idées et de comportements suicidaires pour 1000 patients traités sont présentées dans le tableau 1.
On ne sait pas si le risque de pensées et de comportements suicidaires chez les enfants, les adolescents et les jeunes adultes s'étend à une utilisation à plus long terme, c'est-à-dire au-delà de quatre mois. Cependant, il existe des preuves substantielles issues d'essais d'entretien contrôlés par placebo chez des adultes atteints de TDM que les antidépresseurs retardent la récurrence de la dépression et que la dépression elle-même est un facteur de risque de pensées et de comportements suicidaires.
Surveillez tous les patients traités par antidépresseurs pour déceler une aggravation clinique et l'émergence de pensées et de comportements suicidaires, en particulier au cours des premiers mois de traitement médicamenteux et lors des changements de posologie. Conseillez aux membres de la famille ou aux soignants des patients de surveiller les changements de comportement et d'alerter le fournisseur de soins de santé. Envisagez de modifier le schéma thérapeutique, y compris éventuellement d'arrêter CELEXA, chez les patients dont la dépression s'aggrave de manière persistante ou qui présentent des pensées ou des comportements suicidaires émergents.
Allongement QT Et Torsade De Pointes
CELEXA provoque un allongement dose-dépendant de l'intervalle QTc, une anomalie de l'ECG qui a été associée à la torsade de pointes (TdP), à la tachycardie ventriculaire et à la mort subite, qui ont toutes été observées dans les rapports post-commercialisation du citalopram [voir EFFETS INDÉSIRABLES ].
En raison du risque d'allongement de l'intervalle QTc à des doses plus élevées de CELEXA de 20 mg, il est recommandé de ne pas administrer CELEXA à des doses supérieures à 40 mg une fois par jour [voir DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE ].
CELEXA doit être évité chez les patients atteints du syndrome du QT long congénital, de bradycardie, d'hypokaliémie ou d'hypomagnésémie, d'infarctus aigu du myocarde récent ou d'insuffisance cardiaque non compensée, sauf si les avantages l'emportent sur les risques pour un patient particulier. CELEXA doit également être évité chez les patients qui prennent d'autres médicaments qui allongent l'intervalle QTc [voir INTERACTIONS MÉDICAMENTEUSES ]. Ces médicaments comprennent les antiarythmiques de classe 1A (p. ex., quinidine, procaïnamide) ou de classe III (p. ex., amiodarone, sotalol), les antipsychotiques (p. ex., chlorpromazine, thioridazine), les antibiotiques (p. ex., gatifloxacine, moxifloxacine) ou toute autre classe de médicaments. connus pour allonger l'intervalle QTc (p. ex., pentamidine, acétate de lévométhadyle, méthadone).
La dose de citalopram doit être limitée dans certaines populations. La dose maximale doit être limitée à 20 mg une fois par jour chez les patients qui sont des métaboliseurs lents du CYP2C19 ou les patients recevant de façon concomitante de la cimétidine ou un autre inhibiteur du CYP2C19, car des expositions plus élevées au citalopram seraient attendues. La dose maximale doit également être limitée à 20 mg une fois par jour chez les patients atteints d'insuffisance hépatique et chez les patients âgés de plus de 60 ans en raison d'expositions plus élevées attendues [voir DOSAGE ET ADMINISTRATION , INTERACTIONS MÉDICAMENTEUSES , Utilisation dans des populations spécifiques , PHARMACOLOGIE CLINIQUE ].
Une surveillance électrolytique et/ou ECG est recommandée dans certaines circonstances. Les patients dont le traitement par CELEXA 20 mg est envisagé et qui présentent un risque de troubles électrolytiques importants doivent subir des dosages sériques initiaux de potassium et de magnésium avec une surveillance périodique. L'hypokaliémie (et/ou l'hypomagnésémie) peut augmenter le risque d'allongement de l'intervalle QTc et d'arythmie, et doit être corrigée avant le début du traitement et surveillée périodiquement. Une surveillance ECG est recommandée chez les patients pour lesquels l'utilisation de CELEXA 10 mg n'est pas recommandée, sauf si les bénéfices l'emportent clairement sur les risques pour un patient particulier (voir au dessus ). Il s'agit notamment des patients atteints des affections cardiaques mentionnées ci-dessus et de ceux qui prennent d'autres médicaments susceptibles de prolonger l'intervalle QTc.
Interrompre CELEXA 10 mg chez les patients présentant des mesures persistantes de l'intervalle QTc > 500 ms. Si les patients prenant CELEXA présentent des symptômes qui pourraient indiquer la survenue d'arythmies cardiaques, par exemple des étourdissements, des palpitations ou une syncope, le prescripteur doit entreprendre une évaluation plus approfondie, y compris une surveillance cardiaque.
Syndrome sérotoninergique
Les ISRS, y compris CELEXA 20 mg, peuvent précipiter le syndrome sérotoninergique, une affection potentiellement mortelle. Le risque est accru avec l'utilisation concomitante d'autres médicaments sérotoninergiques (y compris les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, le tryptophane, la buspirone, les amphétamines et le millepertuis) et avec des médicaments qui altèrent le métabolisme de la sérotonine, c'est-à-dire, IMAO [voir CONTRE-INDICATIONS , INTERACTIONS MÉDICAMENTEUSES ]. Le syndrome sérotoninergique peut également survenir lorsque ces médicaments sont utilisés seuls. Des symptômes de syndrome sérotoninergique ont été observés chez 0,1 % des patients atteints de TDM traités par CELEXA à 20 mg lors des essais cliniques de précommercialisation.
Les signes et symptômes du syndrome sérotoninergique peuvent inclure des modifications de l'état mental (p. ex., agitation, hallucinations, délire et coma), une instabilité autonome (p. ex., tachycardie, tension artérielle labile, étourdissements, diaphorèse, bouffées vasomotrices, hyperthermie), des symptômes neuromusculaires (p. ex., tremblements, rigidité, myoclonies, hyperréflexie, incoordination), convulsions et symptômes gastro-intestinaux (p. ex., nausées, vomissements, diarrhée).
L'utilisation concomitante de CELEXA avec des IMAO est contre-indiquée. De plus, ne pas initier CELEXA 20 mg chez un patient traité avec des IMAO tels que le linézolide ou le bleu de méthylène par voie intraveineuse. Aucun rapport n'impliquait l'administration de bleu de méthylène par d'autres voies (telles que des comprimés oraux ou une injection tissulaire locale). S'il est nécessaire d'initier un traitement avec un IMAO tel que le linézolide ou le bleu de méthylène par voie intraveineuse chez un patient prenant CELEXA 10 mg, arrêter CELEXA 20 mg avant d'initier le traitement avec l'IMAO [voir CONTRE-INDICATIONS , INTERACTIONS MÉDICAMENTEUSES ].
Surveiller tous les patients prenant CELEXA 20 mg pour l'apparition d'un syndrome sérotoninergique. Interrompre immédiatement le traitement par CELEXA et tout agent sérotoninergique concomitant si les symptômes ci-dessus apparaissent et amorcer un traitement symptomatique de soutien. Si l'utilisation concomitante de CELEXA avec d'autres médicaments sérotoninergiques est cliniquement justifiée, informer les patients du risque accru de syndrome sérotoninergique et surveiller les symptômes.
Risque accru de saignement
Les médicaments qui interfèrent avec l'inhibition de la recapture de la sérotonine, y compris CELEXA 20 mg, augmentent le risque d'événements hémorragiques. L'utilisation concomitante d'aspirine, d'anti-inflammatoires non stéroïdiens (AINS), d'autres médicaments antiplaquettaires, de warfarine et d'autres anticoagulants peut augmenter ce risque. Des rapports de cas et des études épidémiologiques (cas-témoins et conception de cohorte) ont démontré une association entre l'utilisation de médicaments qui interfèrent avec la recapture de la sérotonine et la survenue d'hémorragies gastro-intestinales. Les événements hémorragiques liés aux médicaments qui interfèrent avec la recapture de la sérotonine vont de l'ecchymose, de l'hématome, de l'épistaxis et des pétéchies à des hémorragies potentiellement mortelles.
Informer les patients du risque accru de saignement associé à l'utilisation concomitante de CELEXA 20 mg et d'agents antiplaquettaires ou d'anticoagulants. Pour les patients prenant de la warfarine, surveiller attentivement le rapport international normalisé [voir INTERACTIONS MÉDICAMENTEUSES ].
Activation de la manie ou de l'hypomanie
Chez les patients atteints de trouble bipolaire, le traitement d'un épisode dépressif avec CELEXA ou un autre antidépresseur peut précipiter un épisode mixte/maniaque. Dans les essais cliniques contrôlés, les patients atteints de trouble bipolaire ont été exclus ; cependant, des symptômes de manie ou d'hypomanie ont été signalés chez 0,1 % des patients non diagnostiqués traités par CELEXA. Avant de commencer le traitement par CELEXA 10 mg, dépister chez les patients tout antécédent personnel ou familial de trouble bipolaire, de manie ou d'hypomanie [voir DOSAGE ET ADMINISTRATION ].
Syndrome d'arrêt
Les effets indésirables après l'arrêt des antidépresseurs sérotoninergiques, en particulier après un arrêt brutal, comprennent : léthargie, labilité émotionnelle, insomnie, hypomanie, acouphènes et convulsions. Une réduction progressive de la posologie plutôt qu'un arrêt brutal est recommandée dans la mesure du possible [voir DOSAGE ET ADMINISTRATION ].
Saisies
CELEXA 20 mg n'a pas été systématiquement évalué chez les patients présentant des troubles épileptiques. Les patients ayant des antécédents de convulsions ont été exclus des études cliniques. Dans les essais cliniques de CELEXA 20 mg, des convulsions sont survenues chez 0,3 % des patients traités par CELEXA (un taux d'un patient pour 98 ans d'exposition) et 0,5 % des patients traités par placebo (un taux d'un patient pour 50 ans d'exposition). CELEXA 10 mg doit être prescrit avec prudence chez les patients présentant un trouble convulsif.
Glaucome à angle fermé
La dilatation pupillaire qui survient après l'utilisation de nombreux médicaments antidépresseurs, y compris CELEXA, peut déclencher une attaque à angle fermé chez un patient présentant des angles anatomiquement étroits qui n'a pas subi d'iridectomie perméable. Éviter l'utilisation d'antidépresseurs, y compris CELEXA, chez les patients présentant des angles anatomiquement étroits non traités.
Hyponatrémie
Une hyponatrémie peut survenir à la suite d'un traitement par ISRS, y compris CELEXA. Des cas de sodium sérique inférieur à 110 mmol/L ont été rapportés. Les signes et symptômes de l'hyponatrémie comprennent des maux de tête, des difficultés de concentration, des troubles de la mémoire, de la confusion, de la faiblesse et une instabilité pouvant entraîner des chutes. Les signes et symptômes associés à des cas plus graves et/ou aigus comprennent des hallucinations, des syncopes, des convulsions, le coma, un arrêt respiratoire et la mort. Dans de nombreux cas, cette hyponatrémie semble être la conséquence du syndrome de sécrétion inappropriée d'hormone antidiurétique (SIADH).
Chez les patients présentant une hyponatrémie symptomatique, arrêter CELEXA et instituer une intervention médicale appropriée. Les patients âgés, les patients prenant des diurétiques et ceux qui présentent une hypovolémie peuvent être plus à risque de développer une hyponatrémie avec les ISRS [voir Utilisation dans des populations spécifiques ].
Dysfonction sexuelle
L'utilisation d'ISRS, y compris CELEXA, peut provoquer des symptômes de dysfonctionnement sexuel [voir EFFETS INDÉSIRABLES ]. Chez les patients de sexe masculin, l'utilisation d'ISRS peut entraîner un retard ou un échec de l'éjaculation, une diminution de la libido et une dysfonction érectile. Chez les patientes, l'utilisation d'ISRS peut entraîner une diminution de la libido et un orgasme retardé ou absent.
Il est important que les prescripteurs se renseignent sur la fonction sexuelle avant le début de CELEXA et se renseignent spécifiquement sur les modifications de la fonction sexuelle pendant le traitement, car la fonction sexuelle peut ne pas être signalée spontanément. Lors de l'évaluation des modifications de la fonction sexuelle, il est important d'obtenir un historique détaillé (y compris le moment de l'apparition des symptômes) car les symptômes sexuels peuvent avoir d'autres causes, y compris le trouble psychiatrique sous-jacent. Discuter des stratégies de prise en charge potentielles pour aider les patients à prendre des décisions éclairées sur le traitement.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments ).
Pensées et comportements suicidaires
Conseillez aux patients et aux soignants de rechercher l'apparition de comportements suicidaires, en particulier au début du traitement et lorsque la posologie est ajustée à la hausse ou à la baisse, et demandez-leur de signaler ces symptômes au professionnel de la santé [voir AVERTISSEMENT ENCADRÉ , AVERTISSEMENTS ET PRECAUTIONS ].
Allongement QT Et Torsade De Pointes
Conseillez aux patients de consulter immédiatement leur fournisseur de soins de santé s'ils se sentent faibles, perdent connaissance ou ont des palpitations cardiaques. Demandez aux patients d'informer leur fournisseur de soins de santé qu'ils prennent CELEXA avant de prendre tout nouveau médicament [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
Syndrome sérotoninergique
Avertir les patients du risque de syndrome sérotoninergique, en particulier en cas d'utilisation concomitante de CELEXA 20 mg avec d'autres médicaments sérotoninergiques, notamment les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, le tryptophane, la buspirone, les amphétamines, le millepertuis et avec les médicaments qui altèrent le métabolisme de la sérotonine (en particulier les IMAO, tant ceux destinés à traiter les troubles psychiatriques que d'autres, comme le linézolide). Demandez aux patients de contacter leur fournisseur de soins de santé ou de se présenter aux urgences s'ils présentent des signes ou des symptômes de syndrome sérotoninergique [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
Risque accru de saignement
Informer les patients de l'utilisation concomitante de CELEXA 10 mg avec de l'aspirine, des AINS, d'autres médicaments antiplaquettaires, de la warfarine ou d'autres anticoagulants car l'utilisation combinée a été associée à un risque accru de saignement. Conseillez aux patients d'informer leurs fournisseurs de soins de santé s'ils prennent ou prévoient de prendre des médicaments sur ordonnance ou en vente libre qui augmentent le risque de saignement [voir AVERTISSEMENTS ET PRECAUTIONS ].
Activation de la manie ou de l'hypomanie
Conseillez aux patients et à leurs soignants d'observer les signes d'activation de la manie/hypomanie et demandez-leur de signaler ces symptômes au fournisseur de soins de santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Syndrome d'arrêt
Conseillez aux patients de ne pas interrompre brusquement CELEXA et de discuter de tout régime de réduction progressive avec leur fournisseur de soins de santé. Informer les patients que des effets indésirables peuvent survenir à l'arrêt de CELEXA 20 mg [voir AVERTISSEMENTS ET PRECAUTIONS ].
Dysfonction sexuelle
Aviser les patients que l'utilisation de CELEXA peut provoquer des symptômes de dysfonctionnement sexuel chez les hommes et les femmes. Informez les patients qu'ils doivent discuter de tout changement de la fonction sexuelle et des stratégies de gestion potentielles avec leur fournisseur de soins de santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Grossesse
- Conseillez aux patientes d'informer leur fournisseur de soins de santé si elles tombent enceintes ou ont l'intention de tomber enceintes pendant le traitement par CELEXA [voir Utilisation dans des populations spécifiques ].
- Aviser les patientes que l'utilisation de CELEXA en fin de grossesse peut entraîner un risque accru de complications néonatales nécessitant une hospitalisation prolongée, une assistance respiratoire, une alimentation par sonde et/ou une hypertension pulmonaire persistante du nouveau-né (HPPN) [voir Utilisation dans des populations spécifiques ].
- Informez les femmes qu'il existe un registre d'exposition pendant la grossesse qui surveille l'issue de la grossesse chez les femmes exposées au citalopram pendant la grossesse [voir Utilisation dans des populations spécifiques ].
Lactation
Conseillez aux femmes qui allaitent de surveiller les nourrissons pour une sédation excessive, une agitation, une agitation, une mauvaise alimentation et une faible prise de poids et de consulter un médecin si elles remarquent ces signes [voir Utilisation dans des populations spécifiques ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Le citalopram a augmenté l'incidence du carcinome de l'intestin grêle chez les rats traités pendant 24 mois à des doses de 8 et 24 mg/kg/jour dans l'alimentation, soit environ 2 et 6 fois la dose maximale recommandée chez l'homme (MRHD) de 40 mg, respectivement, basé sur la surface corporelle en mg/m². Un niveau sans effet (NOEL) pour cette découverte n'a pas été établi.
Le citalopram n'a pas augmenté l'incidence des tumeurs chez les souris traitées pendant 18 mois à des doses allant jusqu'à 240 mg/kg/jour dans l'alimentation, soit environ 30 fois la MRDH de 40 mg basée sur la surface corporelle en mg/m².
Mutagenèse
Le citalopram s'est révélé mutagène dans le test de mutation inverse bactérienne in vitro (test d'Ames) sur 2 des 5 souches bactériennes (Salmonella TA98 et TA1537) en l'absence d'activation métabolique. Il était clastogène dans le test in vitro sur cellules pulmonaires de hamster chinois pour les aberrations chromosomiques en présence et en l'absence d'activation métabolique. Le citalopram ne s'est pas révélé mutagène dans le test in vitro de mutation génique directe de mammifère (HPRT) dans des cellules de lymphome de souris ou dans le test in vitro/in vivo de synthèse d'ADN non programmée (UDS) dans le foie de rat. Il n'était pas clastogène dans le test d'aberration chromosomique in vitro sur des lymphocytes humains ou dans deux tests in vivo sur le micronoyau chez la souris.
Altération de la fertilité
Le citalopram a été administré par voie orale à des rats femelles et mâles à des doses de 32, 48 et 72 mg/kg/jour avant et pendant l'accouplement et la poursuite de la gestation. Ces doses sont environ 8, 12 et 17 fois la MRHD de 40 mg basée sur la surface corporelle en mg/m². L'accouplement et la fertilité ont diminué à des doses ≥ 32 mg/kg/jour, soit environ 8 fois la MRHD.
La durée de gestation a été augmentée à 48 mgs/kg/jours, qui est environ 12 fois le MRHD.
Utilisation dans des populations spécifiques
Grossesse
Registre d'exposition pendant la grossesse
Il existe un registre d'exposition pendant la grossesse qui surveille les résultats de la grossesse chez les femmes exposées aux antidépresseurs pendant la grossesse. Les fournisseurs de soins de santé sont encouragés à inscrire les patientes en appelant le Registre national des grossesses pour les antidépresseurs au 1-844-405-6185 ou en visitant en ligne à https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
Résumé des risques
Les données disponibles provenant d'études épidémiologiques publiées et de rapports post-commercialisation sur l'utilisation de citalopram pendant la grossesse n'ont pas établi de risque accru d'anomalies congénitales majeures ou de fausse couche. Des études publiées ont démontré que les concentrations de citalopram dans le sang du cordon ombilical et dans le liquide amniotique sont semblables à celles observées dans le sérum maternel. Il existe des risques d'hypertension pulmonaire persistante du nouveau-né (HPPN) (voir Données ) et/ou une mauvaise adaptation néonatale avec exposition aux inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), dont CELEXA, pendant la grossesse. Il existe également des risques associés à une dépression non traitée pendant la grossesse (voir Considérations cliniques ).
Dans les études de reproduction chez l'animal, le citalopram a provoqué des effets indésirables sur l'embryon/le fœtus à des doses entraînant une toxicité maternelle (voir Données ).
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
Les femmes qui arrêtent les antidépresseurs pendant la grossesse sont plus susceptibles de connaître une rechute de dépression majeure que les femmes qui continuent les antidépresseurs. Ce résultat provient d'une étude longitudinale prospective de 201 femmes enceintes ayant des antécédents de trouble dépressif majeur qui étaient euthymiques et prenaient des antidépresseurs au début de la grossesse. Tenez compte du risque de dépression non traitée lors de l'arrêt ou de la modification d'un traitement antidépresseur pendant la grossesse et le post-partum.
Effets indésirables fœtaux/néonatals
Les nouveau-nés exposés à CELEXA et à d'autres ISRS à la fin du troisième trimestre ont développé des complications nécessitant une hospitalisation prolongée, une assistance respiratoire et une alimentation par sonde. De telles complications peuvent survenir immédiatement après l'accouchement. Les signes cliniques signalés comprennent la détresse respiratoire, la cyanose, l'apnée, les convulsions, l'instabilité de la température, les difficultés d'alimentation, les vomissements, l'hypoglycémie, l'hypotonie, l'hypertonie, l'hyperréflexie, les tremblements, la nervosité, l'irritabilité et les pleurs constants. Ces résultats correspondent soit à un effet toxique direct des ISRS, soit éventuellement à un syndrome d'arrêt du traitement. Il convient de noter que, dans certains cas, le tableau clinique est compatible avec le syndrome sérotoninergique [voir AVERTISSEMENTS ET PRECAUTIONS ].
Données
Données humaines
L'exposition en fin de grossesse aux ISRS peut avoir un risque accru d'hypertension pulmonaire persistante du nouveau-né (PPHN). L'HPPN survient chez 1 à 2 pour 1 000 naissances vivantes dans la population générale et est associée à une morbidité et une mortalité néonatales substantielles.
Données animales
Le citalopram a été administré par voie orale à des rates gravides pendant la période d'organogenèse à des doses de 32, 56 et 112 mg/kg/jour, soit environ 8, 14 et 27 fois la dose maximale recommandée chez l'homme (MRHD) de 40 mg, basée sur mg/m² de surface corporelle. Le citalopram a provoqué une toxicité maternelle des signes cliniques du SNC et une diminution du gain de poids à 112 mg/kg/jour, soit 27 fois la MRHD. À cette dose toxique pour la mère, le citalopram a diminué la croissance et la survie de l'embryon/du fœtus et a augmenté les anomalies fœtales (y compris les malformations cardiovasculaires et squelettiques). La dose sans effet indésirable observé (NOAEL) pour la toxicité maternelle et embryofœtale est de 56 mg/kg/jour, soit environ 14 fois la MRHD.
Le citalopram a été administré par voie orale à des lapines gravides pendant la période d'organogenèse à des doses allant jusqu'à 16 mg/kg/jour, soit environ 8 fois la MRHD de 40 mg, basée sur la surface corporelle en mg/m². Aucune toxicité maternelle ou embryofœtale n'a été observée. La NOAEL pour la toxicité maternelle et embryofœtale est de 16 mg/kg/jour, soit environ 8 fois la MRHD.
Le citalopram a été administré par voie orale à des rates gravides en fin de gestation et en lactation à des doses de 4,8, 12,8 et 32 mg/kg/jour, soit environ 1, 3 et 8 fois la MRHD de 40 mg, sur la base de mg/m² corporel superficie. Le citalopram a augmenté la mortalité de la progéniture pendant les 4 premiers jours de naissance et a diminué la croissance de la progéniture à 32 mg/kg/jour, soit environ 8 fois la MRHD. La NOAEL pour la toxicité pour le développement est de 12,8 mg/kg/jour, soit environ 3 fois la MRHD. Dans une étude distincte, des effets similaires sur la mortalité et la croissance de la progéniture ont été observés lorsque les mères ont été traitées tout au long de la gestation et au début de la lactation à des doses ≥ 24 mg/kg/jour, soit environ 6 fois la MRHD. Une NOAEL n'a pas été déterminée dans cette étude.
Lactation
Résumé des risques
Les données de la littérature publiée rapportent la présence de citalopram dans le lait maternel à des doses relatives infantiles comprises entre 0,7 et 9,4 % de la posologie maternelle ajustée en fonction du poids et un rapport lait/plasma compris entre 0,78 et 4,3. Des cas d'irritabilité, d'agitation, de somnolence excessive, de diminution de l'alimentation et de perte de poids ont été signalés chez des nourrissons allaités exposés au citalopram (voir Considérations cliniques ). Il n'existe aucune information sur les effets du citalopram sur la production de lait.
Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de CELEXA 20 mg pour la mère et tout effet indésirable potentiel sur l'enfant allaité de CELEXA 20 mg ou de l'affection maternelle sous-jacente.
Considérations cliniques
Surveiller les nourrissons allaités pour détecter les effets indésirables, tels que l'irritabilité, l'agitation, la somnolence excessive, la diminution de l'alimentation et la perte de poids.
Utilisation pédiatrique
L'innocuité et l'efficacité de CELEXA n'ont pas été établies chez les patients pédiatriques. Deux essais contrôlés par placebo portant sur 407 patients pédiatriques atteints de TDM ont été menés avec CELEXA 20 mg, et les données n'étaient pas suffisantes pour justifier l'utilisation chez les patients pédiatriques.
Les antidépresseurs augmentent le risque de pensées et de comportements suicidaires chez les patients pédiatriques [voir AVERTISSEMENT ENCADRÉ , AVERTISSEMENTS ET PRECAUTIONS ]. Une diminution de l'appétit et une perte de poids ont été observées en association avec l'utilisation d'ISRS chez des patients pédiatriques.
Utilisation gériatrique
Parmi les 4 422 patients ayant participé aux études cliniques sur CELEXA 20 mg, 1 357 avaient 60 ans et plus, 1 034 avaient 65 ans et plus et 457 avaient 75 ans et plus. Dans deux études pharmacocinétiques, l'ASC du citalopram a été augmentée de 23 % et 30 %, respectivement, chez les sujets âgés de ≥ 60 ans par rapport aux sujets plus jeunes, et sa demi-vie a été augmentée de 30 % et 50 %, respectivement [voir PHARMACOLOGIE CLINIQUE ]. Par conséquent, la posologie maximale recommandée chez les patients de 60 ans et plus est inférieure à celle des patients plus jeunes [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS ].
Les ISRS, y compris CELEXA, ont été associés à des cas d'hyponatrémie cliniquement significative chez les patients âgés, qui peuvent être plus à risque de présenter cet effet indésirable [voir AVERTISSEMENTS ET PRECAUTIONS ].
Insuffisance hépatique
Une exposition accrue au citalopram survient chez les patients atteints d'insuffisance hépatique. La posologie maximale recommandée de CELEXA 10 mg est plus faible chez les patients insuffisants hépatiques [voir DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Les effets suivants ont été rapportés avec un surdosage en comprimés de Celexa :
- Convulsions, qui peuvent être retardées, et état mental altéré, y compris le coma.
- Toxicité cardiovasculaire, qui peut être retardée, y compris l'allongement de l'intervalle QRS et QTc, les tachyarythmies complexes étendues et les torsades de pointes. L'hypertension est la plus souvent observée, mais peut rarement voir l'hypotension seule ou avec des co-ingestants, y compris l'alcool.
- Syndrome sérotoninergique (les patients présentant un surdosage médicamenteux multiple avec d'autres médicaments prosérotoninergiques peuvent avoir un risque plus élevé).
Une surveillance cardiaque prolongée est recommandée en cas d'ingestion de surdosage de Celexa en raison du risque d'arythmie. Une décontamination gastro-intestinale avec du charbon actif doit être envisagée chez les patients qui se présentent tôt après un surdosage de Celexa 10 mg. Envisagez de contacter un centre antipoison (1-800-221-2222) ou un toxicologue médical pour des recommandations supplémentaires sur la gestion du surdosage.
CONTRE-INDICATIONS
CELEXA est contre-indiqué chez les patients :
- prendre, ou dans les 14 jours suivant l'arrêt, des IMAO (y compris les IMAO tels que le linézolide ou le bleu de méthylène par voie intraveineuse) en raison d'un risque accru de syndrome sérotoninergique [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
- prendre du pimozide en raison du risque d'allongement de l'intervalle QT [voir INTERACTIONS MÉDICAMENTEUSES ].
- présentant une hypersensibilité connue au citalopram ou à l'un des ingrédients inactifs de CELEXA. Les réactions ont inclus l'œdème de Quincke et l'anaphylaxie [voir EFFETS INDÉSIRABLES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le mécanisme d'action du citalopram n'est pas clair, mais on suppose qu'il est lié à la potentialisation de l'activité sérotoninergique dans le système nerveux central (SNC) résultant de son inhibition de la recapture neuronale de la sérotonine (5-HT).
Pharmacodynamie
Des études in vitro et in vivo chez l'animal suggèrent que le citalopram est un inhibiteur sélectif de la recapture de la sérotonine (ISRS) avec des effets minimes sur la recapture neuronale de la noradrénaline (NE) et de la dopamine (DA).
Le citalopram n'a pas ou très peu d'affinité pour les récepteurs 5-HT1A, 5-HT2A, dopamine D1 et D2, α1-, α2- et β-adrénergiques, histamine H1, acide gamma-aminobutyrique (GABA), cholinergiques muscariniques et benzodiazépines.
Électrophysiologie cardiaque
L'intervalle QTc corrigé individuellement (QTcNi) a été évalué dans une étude randomisée, contrôlée par placebo et par agent actif (moxifloxacine 400 mg), croisée et croissante à doses multiples chez 119 sujets sains. La différence moyenne maximale (limite supérieure de l'intervalle de confiance unilatéral à 95 %) par rapport au placebo était de 8,5 (10,8) et 18,5 (21,0) msec pour 20 mg et 60 mg (1,5 fois la dose maximale recommandée) de citalopram, respectivement. Sur la base de la relation exposition-réponse établie, la variation prédite du QTcNi par rapport au placebo (limite supérieure de l'intervalle de confiance unilatéral à 95 %) sous la Cmax pour la dose de 40 mg est de 12,6 (14,3) msec [voir AVERTISSEMENTS ET PRECAUTIONS ].
Pharmacocinétique
La pharmacocinétique à dose unique et à doses multiples de citalopram est linéaire et proportionnelle à la dose dans un intervalle de doses de 10 à 40 mg/jour. La biotransformation du citalopram est principalement hépatique, avec une demi-vie terminale moyenne d'environ 35 heures. Avec une administration une fois par jour, les concentrations plasmatiques à l'état d'équilibre sont atteintes en une semaine environ. À l'état d'équilibre, l'ampleur de l'accumulation de citalopram dans le plasma, basée sur la demi-vie, devrait être de 2,5 fois les concentrations plasmatiques observées après une dose unique.
Absorption
Après une dose orale unique (comprimé de 40 mg) de citalopram, les concentrations sanguines maximales surviennent après environ 4 heures. La biodisponibilité absolue du citalopram était d'environ 80 % par rapport à une dose intraveineuse, et l'absorption n'est pas affectée par la nourriture.
Distribution
Le volume de distribution du citalopram est d'environ 12 L/kg et la liaison du citalopram (CT), du déméthylcitalopram (DCT) et du didéméthylcitalopram (DDCT) aux protéines plasmatiques humaines est d'environ 80 %.
Élimination
Métabolisme
Le citalopram est métabolisé en déméthylcitalopram (DCT), en didéméthylcitalopram (DDCT), en citalopram-N-oxyde et en un dérivé d'acide propionique désaminé. Chez l'homme, le citalopram inchangé est le composé prédominant dans le plasma. À l'état d'équilibre, les concentrations des métabolites du citalopram, DCT et DDCT, dans le plasma sont respectivement d'environ la moitié et le dixième de celles du médicament mère. Des études in vitro montrent que le citalopram est au moins 8 fois plus puissant que ses métabolites dans l'inhibition de la recapture de la sérotonine, ce qui suggère que les métabolites évalués ne contribuent probablement pas de manière significative aux actions antidépressives du citalopram.
Des études in vitro utilisant des microsomes hépatiques humains ont indiqué que le CYP3A4 et le CYP2C19 sont les principales isoenzymes impliquées dans la N-déméthylation du citalopram.
Excrétion
Après administration intraveineuse de citalopram, la fraction de médicament récupérée dans l'urine sous forme de citalopram et de DCT était d'environ 10 % et 5 %, respectivement. La clairance systémique du citalopram était de 330 ml/min, dont environ 20 % étaient dus à la clairance rénale.
Populations spécifiques
Patients gériatriques
La pharmacocinétique du citalopram chez des sujets âgés de ≥ 60 ans a été comparée à celle de sujets plus jeunes dans deux études sur des volontaires sains. Dans une étude à dose unique, l'ASC et la demi-vie du citalopram ont été augmentées chez les sujets âgés de ≥ 60 ans de 30 % et 50 %, respectivement, alors que dans une étude à doses multiples, elles ont augmenté de 23 % et 30 %, respectivement [ voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS , Utilisation dans des populations spécifiques ].
Patients masculins et féminins
Dans trois études pharmacocinétiques (N total = 32), l'ASC du citalopram chez les femmes était une fois et demie à deux fois supérieure à celle observée chez les hommes. Cette différence n'a pas été observée dans cinq autres études pharmacocinétiques (N total = 114). Dans les études cliniques, aucune différence dans les taux sériques de citalopram à l'état d'équilibre n'a été observée entre les hommes (N = 237) et les femmes (N = 388). Il n'y avait aucune différence entre les sexes dans la pharmacocinétique du DCT et du DDCT.
Patients atteints d'insuffisance hépatique
La clairance orale du citalopram a été réduite de 37 % et la demi-vie a été doublée chez les patients présentant une fonction hépatique réduite par rapport aux sujets normaux [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS , Utilisation dans des populations spécifiques ].
Patients atteints d'insuffisance rénale
Chez les patients présentant une insuffisance rénale légère à modérée, la clairance orale du citalopram a été réduite de 17 % par rapport aux sujets normaux. Aucun ajustement de la posologie chez ces patients n'est recommandé. Aucune information n'est disponible sur la pharmacocinétique du citalopram chez les patients atteints d'insuffisance rénale sévère (clairance de la créatinine
CYP2C19 Métaboliseurs lents
Chez les métaboliseurs lents du CYP2C19, la Cmax et l'ASC à l'état d'équilibre du citalopram ont augmenté respectivement de 68 % et 107 % [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS ].
CYP2D6 Métaboliseurs lents
Les concentrations de citalopram à l'état d'équilibre n'étaient pas significativement différentes chez les métaboliseurs lents et les métaboliseurs rapides du CYP2D6.
Études sur les interactions médicamenteuses
Les données d'inhibition enzymatique in vitro n'ont pas révélé d'effet inhibiteur du citalopram sur le CYP3A4, -2C9 ou -2E1, mais ont suggéré qu'il s'agit d'un faible inhibiteur du CYP1A2, -2D6 et -2C19. On s'attendrait à ce que le citalopram ait peu d'effet inhibiteur sur le métabolisme in vivo médié par ces enzymes. Cependant, les données in vivo pour répondre à cette question sont limitées.
Inhibiteurs du CYP3A4 et du CYP2C19
Étant donné que le CYP3A4 et le CYP2C19 sont les principales enzymes impliquées dans le métabolisme du citalopram, on s'attend à ce que les inhibiteurs puissants du CYP3A4 (p. ex., kétoconazole, itraconazole et antibiotiques macrolides) et les inhibiteurs du CYP2C19 (p. citalopram. Cependant, la co-administration de citalopram et du puissant inhibiteur du CYP3A4, le kétoconazole, n'a pas significativement affecté la pharmacocinétique du citalopram. 20 mg/jour est la dose maximale recommandée de citalopram chez les patients prenant simultanément de la cimétidine ou un autre inhibiteur du CYP2C19, en raison du risque d'allongement de l'intervalle QT [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS ].
Cimétidine
Chez les sujets ayant reçu 40 mg/jour de CELEXA 10 mg pendant 21 jours, l'administration combinée de 400 mg de cimétidine deux fois par jour pendant 8 jours a entraîné une augmentation de l'ASC et de la Cmax du citalopram de 43 % et 39 %, respectivement [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
Inhibiteurs du CYP2D6
L'administration concomitante d'un médicament qui inhibe le CYP2D6 avec le citalopram est peu susceptible d'avoir des effets cliniquement significatifs sur le métabolisme du citalopram, d'après les résultats de l'étude chez les métaboliseurs lents du CYP2D6.
Digoxine
Chez les sujets ayant reçu 21 jours de 40 mg/jour de CELEXA 20 mg, l'administration combinée de CELEXA et de digoxine (dose unique de 1 mg) n'a pas significativement affecté la pharmacocinétique du citalopram ou de la digoxine.
Lithium
L'administration concomitante de CELEXA (40 mg/jour pendant 10 jours) et de lithium (30 mmol/jour pendant 5 jours) n'a eu aucun effet significatif sur la pharmacocinétique du citalopram ou du lithium.
Pimozide
Dans une étude contrôlée, une dose unique de pimozide 2 mg co-administré avec du citalopram 40 mg administré une fois par jour pendant 11 jours a été associée à une augmentation moyenne des valeurs QTc d'environ 10 msec par rapport au pimozide administré seul. Le citalopram n'a pas modifié l'ASC ou la Cmax moyenne du pimozide. Le mécanisme de cette interaction pharmacodynamique n'est pas connu [voir CONTRE-INDICATIONS , AVERTISSEMENTS ET PRECAUTIONS ].
Théophylline
L'administration combinée de CELEXA (40 mg/jour pendant 21 jours) et de théophylline, un substrat du CYP1A2 (dose unique de 300 mg), n'a pas modifié la pharmacocinétique de la théophylline. L'effet de la théophylline sur la pharmacocinétique du citalopram n'a pas été évalué.
Warfarine
L'administration de 40 mg/jour de CELEXA pendant 21 jours n'a pas modifié la pharmacocinétique de la warfarine, un substrat du CYP3A4. Le temps de prothrombine a été augmenté de 5 %, dont la signification clinique est inconnue.
Carbamazépine
L'administration combinée de CELEXA (40 mg/jour pendant 14 jours) et de carbamazépine (titrée à 400 mg/jour pendant 35 jours) n'a pas affecté de manière significative la pharmacocinétique de la carbamazépine, un substrat du CYP3A4. Bien que les concentrations plasmatiques minimales de citalopram n'aient pas été affectées, étant donné les propriétés d'induction enzymatique de la carbamazépine, la possibilité que la carbamazépine puisse augmenter la clairance du citalopram doit être envisagée si les deux médicaments sont co-administrés.
Triazolam
L'administration combinée de CELEXA (titré à 40 mg/jour pendant 28 jours) et du triazolam, un substrat du CYP3A4 (dose unique de 0,25 mg), n'a pas eu d'effet significatif sur la pharmacocinétique du citalopram ou du triazolam.
Kétoconazole
L'administration combinée de CELEXA (40 mg) et de kétoconazole (200 mg) a diminué la Cmax et l'ASC du kétoconazole de 21 % et 10 %, respectivement, et n'a pas affecté de manière significative la pharmacocinétique du citalopram.
Métoprolol
L'administration de 40 mg/jour de CELEXA 20 mg pendant 22 jours a entraîné une multiplication par deux des taux plasmatiques du métoprolol, un inhibiteur bêta-adrénergique. Des taux plasmatiques accrus de métoprolol ont été associés à une diminution de la cardiosélectivité. L'administration concomitante de CELEXA 10 mg et de métoprolol n'a eu aucun effet cliniquement significatif sur la tension artérielle ou la fréquence cardiaque.
Imipramine et autres antidépresseurs tricycliques (TCA)
Des études in vitro suggèrent que le citalopram est un inhibiteur relativement faible du CYP2D6. L'administration concomitante de CELEXA (40 mg/jour pendant 10 jours) avec l'imipramine TCA (dose unique de 100 mg), un substrat du CYP2D6, n'a pas modifié significativement les concentrations plasmatiques d'imipramine ou de citalopram. Cependant, la concentration du métabolite imipramine désipramine a été augmentée d'environ 50 %. La signification clinique du changement de désipramine est inconnue.
Toxicologie animale et/ou pharmacologie
Changements rétiniens chez les rats
Des changements pathologiques (dégénérescence/atrophie) ont été observés dans les rétines de rats albinos dans l'étude de cancérogénicité de 2 ans avec le citalopram. Il y a eu une augmentation de l'incidence et de la gravité de la pathologie rétinienne chez les rats mâles et femelles recevant 80 mg/kg/jour, soit environ 19 fois la MRHD de 40 mg basée sur la surface corporelle en mg/m². Des résultats similaires n'ont pas été observés chez les rats traités pendant deux ans à la dose de 24 mg/kg/jour, chez les souris traitées pendant 18 mois à des doses allant jusqu'à 240 mg/kg/jour ou chez les chiens traités pendant un an à des doses allant jusqu'à 20 mg/kg/jour, soit environ 6, 29 et 17 fois la MRHD, respectivement, sur la base de la surface corporelle en mg/m².
Des études supplémentaires pour étudier le mécanisme de cette pathologie n'ont pas été réalisées et l'importance potentielle de cet effet chez l'homme n'a pas été établie.
Etudes cliniques
L'efficacité de CELEXA comme traitement du trouble dépressif majeur a été établie dans deux études contrôlées contre placebo (d'une durée de 4 à 6 semaines) chez des patients externes adultes (âgés de 18 à 66 ans) répondant aux critères du DSM-III ou du DSM-III-R pour la dépression majeure. (TDM) (Études 1 et 2).
L'étude 1, un essai de 6 semaines au cours duquel des patients ont reçu des doses fixes de CELEXA de 10 mg de 10 mg, 20 mg, 40 mg et 60 mg par jour, a montré que CELEXA à 40 mg et à 60 mg par jour (1,5 fois la dose quotidienne maximale recommandée) était efficace tel que mesuré par le score total de l'échelle d'évaluation de la dépression de Hamilton (HAMD), le critère principal d'évaluation de l'efficacité. Le HAMD-17 est une échelle de 17 points, évaluée par un clinicien, utilisée pour évaluer la gravité des symptômes dépressifs. Les scores du HAMD-17 vont de 0 à 52, les scores les plus élevés indiquant une dépression plus sévère. Cette étude n'a montré aucun effet clair des doses quotidiennes de 10 mg et 20 mg, et la dose quotidienne de 60 mg n'était pas plus efficace que la dose quotidienne de 40 mg. En raison du risque d'allongement de l'intervalle QTc et d'arythmies ventriculaires, la posologie maximale recommandée de CELEXA 10 mg est de 40 mg une fois par jour.
Dans l'étude 2, un essai contrôlé par placebo de 4 semaines chez des patients atteints de TDM, la dose initiale était de 20 mg par jour, suivie d'une titration à la dose maximale tolérée ou à une dose maximale de 80 mg par jour (2 fois la dose quotidienne maximale recommandée ). Les patients traités par CELEXA 20 mg ont montré une amélioration statistiquement significativement plus importante que les patients sous placebo sur le score total HAMD, le critère principal d'évaluation de l'efficacité. Dans trois autres essais contrôlés par placebo chez des patients atteints de TDM, la différence de réponse au traitement entre les patients recevant CELEXA et les patients recevant le placebo n'était pas statistiquement significative.
Dans deux études à long terme, les patients atteints de TDM qui avaient répondu à CELEXA à 10 mg au cours des 6 ou 8 premières semaines de traitement aigu ont été randomisés pour continuer à prendre CELEXA à 10 mg ou un placebo. Dans une étude, les patients ont reçu des doses fixes de CELEXA de 20 mg ou de 40 mg par jour et dans la seconde étude, les patients ont reçu des doses flexibles de CELEXA de 20 mg à 60 mg par jour (1,5 fois la dose quotidienne maximale recommandée). Dans les deux études, les patients recevant un traitement continu par CELEXA ont présenté des taux de rechute statistiquement significativement plus faibles au cours des 6 mois suivants par rapport à ceux recevant un placebo. Dans l'étude à dose fixe, la diminution du taux de rechute de la dépression était similaire chez les patients recevant 20 mg ou 40 mg par jour de CELEXA. En raison du risque d'allongement de l'intervalle QTc et d'arythmies ventriculaires, la posologie maximale recommandée de CELEXA 20 mg est de 40 mg une fois par jour.
Les analyses de la relation entre les résultats du traitement et l'âge, le sexe et la race n'ont suggéré aucune réactivité différentielle sur la base de ces caractéristiques des patients.
INFORMATIONS PATIENTS
CELEXA® (Suh-leks-uh) (citalopram) Comprimés, à usage oral
Quelles sont les informations les plus importantes que je devrais connaître sur CELEXA ?
CELEXA 20 mg peut provoquer des effets indésirables graves, notamment :
- Risque accru de pensées et d'actions suicidaires. CELEXA 10 mg et d'autres médicaments antidépresseurs peuvent augmenter les pensées et actions suicidaires chez certains enfants, adolescents et jeunes adultes surtout au cours des premiers mois de traitement ou lorsque la dose est modifiée. CELEXA ne doit pas être utilisé chez les enfants.
- La dépression et les autres maladies mentales sont les causes les plus importantes de pensées et d'actions suicidaires.
Comment puis-je surveiller et essayer de prévenir les pensées et actions suicidaires chez moi-même ou chez un membre de ma famille ?
- Portez une attention particulière à tout changement, en particulier les changements soudains d'humeur, de comportement, de pensées ou de sentiments, ou si vous développez des pensées ou des actions suicidaires. Ceci est très important lorsqu'un médicament antidépresseur est commencé ou lorsque la dose est modifiée.
- Appelez immédiatement votre fournisseur de soins de santé pour signaler des changements nouveaux ou soudains d'humeur, de comportement, de pensées ou de sentiments.
- Gardez toutes les visites de suivi avec votre fournisseur de soins de santé comme prévu. Appelez votre fournisseur de soins de santé entre les visites au besoin, surtout si vous avez des inquiétudes au sujet des symptômes.
Appelez votre fournisseur de soins de santé ou obtenez immédiatement une aide médicale d'urgence si vous ou un membre de votre famille présentez l'un des symptômes suivants, en particulier s'ils sont nouveaux, s'aggravent ou vous inquiètent :
- pensées sur le suicide ou la mort
- dépression nouvelle ou pire
- se sentir très agité ou agité
- troubles du sommeil (insomnie)
- agir de manière agressive, être en colère ou violent
- une augmentation extrême de l'activité ou de la conversation (manie)
- tentatives de suicide
- anxiété nouvelle ou pire
- agir sur des impulsions dangereuses
- crises de panique
- irritabilité nouvelle ou pire
- autres changements inhabituels de comportement ou d'humeur
Qu'est-ce que CELEXA ?
CELEXA 10 mg est un médicament délivré sur ordonnance utilisé pour traiter un certain type de dépression appelé trouble dépressif majeur (TDM) chez l'adulte.
On ne sait pas si CELEXA 10 mg est sûr et efficace chez les enfants.
Qui ne devrait pas prendre CELEXA?
Ne prenez pas CELEXA si vous :
- prendre un inhibiteur de la monoamine oxydase (IMAO)
- avez cessé de prendre un IMAO au cours des 14 derniers jours
- sont traités avec l'antibiotique linézolide ou le bleu de méthylène par voie intraveineuse
- prendre du pimozide
- êtes allergique au citalopram ou à l'un des ingrédients de CELEXA. Voir la fin de ce Guide de Médication pour une liste complète d'ingrédients dans CELEXA.
Demandez à votre fournisseur de soins de santé ou à votre pharmacien si vous n'êtes pas sûr de prendre un IMAO, y compris des IMAO tels que le linézolide ou le bleu de méthylène par voie intraveineuse.
Ne commencez pas à prendre un IMAO pendant au moins 14 jours après l'arrêt du traitement par CELEXA.
Avant de prendre CELEXA, informez votre fournisseur de soins de santé de toutes vos conditions médicales, y compris si vous :
- avez ou avez des antécédents familiaux de suicide, de dépression, de trouble bipolaire, de manie ou d'hypomanie
- avez un rythme cardiaque anormal appelé allongement de l'intervalle QT
- avez ou avez eu des problèmes cardiaques, y compris une crise cardiaque, une insuffisance cardiaque, un rythme cardiaque anormal ou un syndrome du QT long
- avez de faibles niveaux de potassium, de magnésium ou de sodium dans votre sang
- avez ou avez eu des problèmes de saignement
- avez ou avez eu des convulsions (convulsions)
- avoir une pression élevée dans l'œil (glaucome)
- avez ou avez eu des problèmes rénaux ou hépatiques
- êtes enceinte ou envisagez de devenir enceinte. CELEXA 20 mg peut nuire à votre bébé à naître. La prise de CELEXA en fin de grossesse peut entraîner un risque accru de certains problèmes chez votre nouveau-né. Discutez avec votre fournisseur de soins de santé des risques et des avantages du traitement de la dépression pendant la grossesse.
- Informez immédiatement votre professionnel de la santé si vous tombez enceinte ou si vous pensez être enceinte pendant le traitement par CELEXA.
- Il existe un registre des grossesses pour les femmes qui sont exposées à CELEXA pendant la grossesse. Le but du registre est de recueillir des informations sur la santé des femmes exposées à CELEXA et de leur bébé. Si vous tombez enceinte pendant le traitement par CELEXA 10 mg, parlez à votre fournisseur de soins de santé de l'inscription au registre national des grossesses pour les antidépresseurs. Vous pouvez vous inscrire en appelant le 1-844-405-6185 ou en visitant en ligne à https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
- allaitez ou envisagez d'allaiter. On ne sait pas si CELEXA passe dans votre lait maternel. Discutez avec votre fournisseur de soins de santé de la meilleure façon de nourrir votre bébé pendant le traitement par CELEXA.
- Si vous allaitez pendant le traitement par CELEXA 20 mg, appelez immédiatement votre fournisseur de soins de santé si votre bébé développe de la somnolence ou de l'irritabilité, ou s'il ne s'alimente pas bien ou ne prend pas de poids correctement.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
CELEXA 10 mg et d'autres médicaments peuvent interagir les uns avec les autres et provoquer des effets indésirables graves. CELEXA peut modifier le mode d'action d'autres médicaments et d'autres médicaments peuvent modifier le mode d'action de CELEXA.
Informez particulièrement votre fournisseur de soins de santé si vous prenez :
- médicaments utilisés pour traiter les migraines appelés triptans
- antidépresseurs tricycliques
- fentanyl
- lithium
- tramadol
- tryptophane
- buspirone
- amphétamines
- Millepertuis
- les médicaments qui peuvent affecter la coagulation du sang tels que l'aspirine, les anti-inflammatoires non stéroïdiens (AINS) et la warfarine
- diurétiques
- méthadone
- gatifloxacine ou moxifloxacine
- médicaments utilisés pour contrôler votre fréquence cardiaque ou votre rythme (antiarythmiques)
- médicaments utilisés pour traiter les troubles de l'humeur, de l'anxiété, psychotiques ou de la pensée, y compris les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN)
Demandez à votre fournisseur de soins de santé si vous n'êtes pas sûr de prendre l'un de ces médicaments. Votre fournisseur de soins de santé peut vous dire s'il est sécuritaire de prendre CELEXA 10 mg avec vos autres médicaments.
Ne commencez pas ou n'arrêtez pas d'autres médicaments pendant le traitement par CELEXA sans en parler d'abord à votre fournisseur de soins de santé. L'arrêt soudain de CELEXA peut entraîner des effets secondaires graves. Voir, « Quels sont les effets secondaires possibles de CELEXA ? »
Connaissez les médicaments que vous prenez. Gardez-en une liste à montrer à votre fournisseur de soins de santé et à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je prendre CELEXA 10 mg ?
- Prenez CELEXA 20 mg exactement comme votre professionnel de la santé vous l'a indiqué. Ne changez pas votre dose et n'arrêtez pas de prendre CELEXA sans en parler d'abord à votre fournisseur de soins de santé.
- Votre professionnel de la santé devra peut-être modifier la dose de CELEXA jusqu'à ce qu'elle vous convienne.
- Prenez CELEXA 1 fois par jour avec ou sans nourriture.
- Si vous avez pris trop de CELEXA 20 mg, appelez votre fournisseur de soins de santé ou votre centre antipoison au 1-800-222-1222, ou rendez-vous immédiatement à l'urgence de l'hôpital le plus proche.
Quels sont les effets secondaires possibles de CELEXA 20mg ?
CELEXA peut provoquer des effets secondaires graves, notamment :
- Voir, « Quelle est l'information la plus importante que je devrais connaître sur CELEXA ? »
- Problèmes de rythme cardiaque. CELEXA peut provoquer une modification importante de votre rythme cardiaque (un rythme cardiaque rapide ou irrégulier) pouvant entraîner la mort. Informez immédiatement votre fournisseur de soins de santé si vous vous sentez faible ou évanoui, ou si vous avez un changement dans votre rythme cardiaque.
- Syndrome sérotoninergique. La prise de CELEXA peut causer un problème potentiellement mortel appelé syndrome sérotoninergique. Le risque de développer un syndrome sérotoninergique est accru lorsque CELEXA 20 mg est pris avec certains autres médicaments. Voir, « Qui ne devrait pas prendre CELEXA ? » Appelez votre fournisseur de soins de santé ou rendez-vous immédiatement à l'urgence de l'hôpital le plus proche si vous présentez l'un des signes et symptômes suivants du syndrome sérotoninergique :
- agitation
- voir ou entendre des choses qui ne sont pas réelles (hallucinations)
- confusion
- coma
- rythme cardiaque rapide
- changements de pression artérielle
- vertiges
- transpiration
- rinçage
- température corporelle élevée (hyperthermie)
- tremblements, muscles raides ou contractions musculaires
- perte de coordination
- convulsions
- nausées, vomissements, diarrhée
- Risque accru de saignement. La prise de CELEXA 20 mg avec de l'aspirine, des anti-inflammatoires non stéroïdiens (AINS), de la warfarine ou des anticoagulants peut accroître ce risque. Informez immédiatement votre fournisseur de soins de santé de tout saignement ou ecchymose inhabituel.
- Épisodes maniaques. Des épisodes maniaques peuvent survenir chez les personnes atteintes de trouble bipolaire qui prennent CELEXA. Les symptômes peuvent inclure :
- énergie considérablement augmentée
- gros troubles du sommeil
- pensées de course
- comportement imprudent
- des idées exceptionnellement grandioses
- bonheur excessif ou irritabilité
- parler plus ou plus vite que d'habitude
- Syndrome de sevrage. L'arrêt soudain de CELEXA 20 mg peut entraîner des effets indésirables graves. Votre fournisseur de soins de santé voudra peut-être diminuer votre dose lentement. Les symptômes peuvent inclure :
- nausée
- transpiration
- changements d'humeur
- mal de tête
- irritabilité et agitation
- fatigue
- vertiges
- problèmes de sommeil
- sensation de choc électrique (paresthésie)
- hypomanie
- anxiété
- bourdonnements dans les oreilles (acouphènes)
- confusion
- convulsions
- Convulsions (convulsions).
- Problèmes oculaires (glaucome à angle fermé). De nombreux médicaments antidépresseurs, y compris CELEXA, peuvent causer un certain type de problème oculaire appelé glaucome à angle fermé. Appelez votre fournisseur de soins de santé si vous avez des changements dans votre vision ou des douleurs oculaires.
- Faible taux de sodium dans le sang (hyponatrémie). Un faible taux de sodium dans votre sang peut être grave et entraîner la mort. Les personnes âgées peuvent être plus à risque pour cela. Informez immédiatement votre fournisseur de soins de santé si vous développez des signes ou des symptômes de faible taux de sodium dans votre sang pendant le traitement par CELEXA. Les signes et symptômes d'un faible taux de sodium dans le sang peuvent inclure :
- mal de tête
- difficulté de concentration
- changements de mémoire
- confusion
- faiblesse et instabilité des pieds pouvant entraîner des chutes
Dans les cas graves ou plus soudains, les signes et symptômes comprennent :
-
- hallucinations (voir ou entendre des choses qui ne sont pas réelles)
- évanouissement
- convulsions
- coma
- arrêter de respirer
- décès
- Problèmes sexuels (dysfonctionnement). La prise d'inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), y compris CELEXA, peut causer des problèmes sexuels.
Les symptômes chez les hommes peuvent inclure :
- Éjaculation retardée ou incapacité d'avoir une éjaculation
- Diminution de la libido
- Problèmes pour obtenir ou maintenir une érection
Les symptômes chez les femmes peuvent inclure :
- Diminution de la libido
- Orgasme retardé ou incapacité à avoir un orgasme
Parlez à votre fournisseur de soins de santé si vous développez des changements dans votre fonction sexuelle ou si vous avez des questions ou des préoccupations concernant des problèmes sexuels pendant le traitement par DRIZALMA SPRINKLE. Il peut y avoir des traitements que votre fournisseur de soins de santé peut suggérer.
L'effet secondaire le plus courant de CELEXA est l'éjaculation retardée.
Ce ne sont pas tous les effets secondaires possibles de CELEXA.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver CELEXA ?
- Conservez CELEXA à température ambiante entre 68 °F et 77 °F (20 °C et 25 °C).
- Gardez CELEXA 20 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de CELEXA
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. Ne pas utiliser CELEXA 20 mg pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas CELEXA à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire. Vous pouvez demander à votre fournisseur de soins de santé ou à votre pharmacien des renseignements sur CELEXA rédigés à l'intention des professionnels de la santé.
Quels sont les ingrédients de CELEXA?
Ingrédient actif: bromhydrate de citalopram
Ingrédients inactifs: copolyvidone, amidon de maïs, crosscarmellose sodique, glycérine, lactose monohydraté, stéarate de magnésium, hypromellose, cellulose microcristalline, polyéthylèneglycol, dioxyde de titane et dioxyde de fer pour la coloration.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
