Neurontin 100mg, 300mg, 400mg, 600mg Gabapentin Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Neurontin et comment est-il utilisé ?
Neurontin 400 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de la douleur nerveuse et des convulsions. Neurontin peut être utilisé seul ou avec d'autres médicaments.
Neurontin est un analogue du GABA, médicament anti-épileptique.
On ne sait pas si Neurontin est sûr et efficace chez les enfants de moins de 3 ans.
Quels sont les effets secondaires possibles de Neurontin 400mg ?
Neurontin peut provoquer des effets secondaires graves, notamment :
- augmentation des crises
- faiblesse ou fatigue sévère
- problèmes d'équilibre ou de mouvement musculaire
- douleur dans le haut de l'estomac
- douleur thoracique
- toux nouvelle ou aggravée avec fièvre
- difficulté à respirer
- picotements ou engourdissements sévères
- mouvement rapide des yeux
- peu ou pas de miction
- miction douloureuse ou difficile
- gonflement des pieds ou des chevilles
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Neurontin comprennent :
- mal de tête
- vertiges
- somnolence
- fatigue
- gonflement des mains ou des pieds
- problèmes avec vos yeux
- problèmes de coordination
- Les effets secondaires les plus courants de Neurontin 600 mg chez les enfants comprennent :
- fièvre
- nausée
- vomissement
- changements de comportement
- problèmes de mémoire
- difficulté à se concentrer
- agir de manière agitée, hostile ou agressive
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Neurontin. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
L'ingrédient actif des gélules, des comprimés et de la solution buvable NEURONTIN est la gabapentine, dont le nom chimique est l'acide 1-(aminométhyl)cyclohexaneacétique.
La formule moléculaire de la gabapentine est C9H17NO2 et le poids moléculaire est de 171,24. La formule structurelle de la gabapentine est :
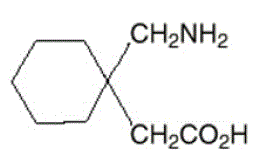
La gabapentine est un solide cristallin blanc à blanc cassé avec un pKa1 de 3,7 et un pKa2 de 10,7. Il est librement soluble dans l'eau et les solutions aqueuses basiques et acides. Le logarithme du coefficient de partage (noctanol/tampon phosphate 0,05 M) à pH 7,4 est de –1,25.
Chaque gélule Neurontin 100 mg contient 100 mg, 300 mg ou 400 mg de gabapentine et les ingrédients inactifs suivants : lactose, amidon de maïs, talc, gélatine, dioxyde de titane, FD&C bleu n° 2, oxyde de fer jaune (300 mg et 400 mg uniquement) , et oxyde de fer rouge (400 mg seulement).
Chaque comprimé Neurontin contient 600 mg ou 800 mg de gabapentine et les ingrédients inactifs suivants : poloxamère 407, copovidone, amidon de maïs, stéarate de magnésium, hydroxypropylcellulose, talc et cire de candelilla.
La solution buvable Neurontin contient 250 mg de gabapentine par 5 ml (50 mg par ml) et les ingrédients inactifs suivants : glycérine, xylitol, eau purifiée et arôme artificiel de fraise et d'anis frais.
LES INDICATIONS
NEURONTIN® est indiqué pour :
- Prise en charge de la névralgie post-zostérienne chez l'adulte
- Traitement d'appoint dans le traitement des crises partielles, avec et sans généralisation secondaire, chez les adultes et les patients pédiatriques de 3 ans et plus atteints d'épilepsie
DOSAGE ET ADMINISTRATION
Posologie pour la névralgie post-zostérienne
Chez l'adulte atteint de névralgie post-zostérienne, NEURONTIN peut être instauré le jour 1 à la dose unique de 300 mg, le jour 2 à la dose de 600 mg/jour (300 mg deux fois par jour) et le jour 3 à la dose de 900 mg/jour (300 mg trois fois par jour). La dose peut ensuite être augmentée selon les besoins pour soulager la douleur jusqu'à une dose de 1800 mg/jour (600 mg trois fois par jour). Dans les études cliniques, l'efficacité a été démontrée sur une gamme de doses allant de 1800 mg/jour à 3600 mg/jour avec des effets comparables sur toute la gamme de doses ; cependant, dans ces études cliniques, le bénéfice supplémentaire de l'utilisation de doses supérieures à 1800 mg/jour n'a pas été démontré.
Posologie pour l'épilepsie avec crises d'épilepsie partielles
Patients de 12 ans et plus
La dose initiale est de 300 mg trois fois par jour. La dose d'entretien recommandée de NEURONTIN est de 300 mg à 600 mg trois fois par jour. Des doses allant jusqu'à 2400 mg/jour ont été bien tolérées dans les études cliniques à long terme. Des doses de 3600 mg/jour ont également été administrées à un petit nombre de patients pendant une durée relativement courte et ont été bien tolérées. Administrez NEURONTIN trois fois par jour en utilisant des gélules de 300 mg ou 400 mg, ou des comprimés de 600 mg ou 800 mg. L'intervalle maximal entre les doses ne doit pas dépasser 12 heures.
Patients pédiatriques âgés de 3 à 11 ans
La gamme de doses initiales est de 10 mg/kg/jour à 15 mg/kg/jour, administrée en trois doses fractionnées, et la dose d'entretien recommandée est atteinte par augmentation de la dose sur une période d'environ 3 jours. La dose d'entretien recommandée de NEURONTIN chez les patients âgés de 3 à 4 ans est de 40 mg/kg/jour, administrée en trois doses fractionnées. La dose d'entretien recommandée de NEURONTIN 100 mg chez les patients âgés de 5 à 11 ans est de 25 mg/kg/jour à 35 mg/kg/jour, administrée en trois doses fractionnées. NEURONTIN 300 mg peut être administré sous forme de solution buvable, de gélule ou de comprimé, ou en utilisant des combinaisons de ces formulations. Des doses allant jusqu'à 50 mg/kg/jour ont été bien tolérées dans une étude clinique à long terme. L'intervalle de temps maximal entre les doses ne doit pas dépasser 12 heures.
Ajustement posologique chez les patients atteints d'insuffisance rénale
Un ajustement posologique chez les patients âgés de 12 ans et plus atteints d'insuffisance rénale ou sous hémodialyse est recommandé, comme suit (voir les recommandations posologiques ci-dessus pour les doses efficaces dans chaque indication) :
TABLEAU 1 : Posologie de NEURONTIN en fonction de la fonction rénale
La clairance de la créatinine (CLCr) est difficile à mesurer en ambulatoire. Chez les patients dont la fonction rénale est stable, la clairance de la créatinine peut être raisonnablement bien estimée à l'aide de l'équation de Cockcroft et Gault :
L'utilisation de NEURONTIN chez les patients de moins de 12 ans présentant une fonction rénale altérée n'a pas été étudiée.
Posologie chez les personnes âgées
Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises dans le choix de la dose et la dose doit être ajustée en fonction des valeurs de clairance de la créatinine chez ces patients.
Informations administratives
Administrer NEURONTIN par voie orale avec ou sans nourriture.
Les gélules de NEURONTIN 100 mg doivent être avalées entières avec de l'eau.
Informer les patients que s'ils divisent le comprimé sécable de NEURONTIN à 600 mg ou à 800 mg pour administrer un demi-comprimé, ils doivent prendre le demi-comprimé non utilisé comme dose suivante. Les demi-comprimés non utilisés dans les 28 jours suivant la division du comprimé sécable doivent être jetés.
Si la dose de NEURONTIN est réduite, interrompue ou remplacée par un autre médicament, cela doit être fait progressivement sur au moins 1 semaine (une période plus longue peut être nécessaire à la discrétion du prescripteur).
COMMENT FOURNIE
Formes posologiques et points forts
Gélules
- 100 mg : gélules blanches en gélatine dure portant l'inscription « PD » sur le corps et « Neurontin/100 mg » sur la coiffe
- 300 mg : gélules jaunes en gélatine dure portant l'inscription « PD » sur le corps et « Neurontin/300 mg » sur la coiffe
- 400 mg : gélules de gélatine dure orange portant l'inscription « PD » sur le corps et « Neurontin/400 mg » sur la coiffe
Comprimés
- 600 mg : comprimés pelliculés sécables blancs elliptiques gravés « NT » et « 16 » sur une face
- 800 mg : comprimés pelliculés sécables blancs elliptiques gravés « NT » et « 26 » sur une face
Solution orale
- 250 mg par 5 ml (50 mg par ml), solution limpide incolore à légèrement jaune
Stockage et manutention
NEURONTIN (gabapentine) gélules, comprimés et solution buvable sont fournis comme suit :
Gélules de 100 mg
Gélules blanches en gélatine dure portant l'inscription « PD » sur le corps et « Neurontin/100 mg » sur la coiffe ; disponible en:
Bouteilles de 100 : CDN 0071-0803-24
Gélules de 300 mg
Gélules jaunes en gélatine dure portant l'inscription « PD » sur le corps et « Neurontin/300 mg » sur la coiffe ; disponible en:
Bouteilles de 100 : CDN 0071-0805-24 Dose unitaire 50's : CDN 0071-0805-40
Gélules de 400 mg
Gélules de gélatine dure orange portant l'inscription « PD » sur le corps et « Neurontin/400 mg » sur la coiffe ; disponible en:
Bouteilles de 100 : CDN 0071-0806-24 Dose unitaire 50's : CDN 0071-0806-40
Comprimés de 600 mg
Comprimés pelliculés elliptiques blancs sécables portant l'inscription « NT » et « 16 » sur une face ; disponible en:
Bouteilles de 100 : CDN 0071-0513-24
Comprimés de 800 mg
Comprimés pelliculés elliptiques blancs sécables portant les inscriptions en creux « NT » et « 26 » sur une face ; disponible en:
Bouteilles de 100 : CDN 0071-0401-24
250 mg par 5 ml de solution buvable
Solution limpide incolore à légèrement jaune; chaque 5 mL de solution buvable contient 250 mg de gabapentine; disponible en:
Bouteilles en verre contenant 470 ml : CDN 0071-2012-23 Bouteilles contenant 470 ml : CDN 0071-2012-44
Conserver les comprimés et gélules NEURONTIN 400 mg à 25 °C (77 °F) ; excursions autorisées entre 15°C et 30°C (59°F à 86°F) [voir Température ambiante contrôlée USP ].
Conservez la solution orale NEURONTIN au réfrigérateur, entre 2 °C et 8 °C (36 °F et 46 °F).
Distribué par : Parke-Davis, Division of Pfizer Inc., NY, NY 10017. Révisé : décembre 2020
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont traités plus en détail dans d'autres rubriques :
- Réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS)/hypersensibilité multiorganique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Anaphylaxie et œdème de Quincke [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Somnolence/sédation et étourdissements [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Sevrage Convulsions précipitées, état de mal épileptique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Comportement suicidaire et idéation [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Dépression respiratoire [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Effets indésirables neuropsychiatriques (patients pédiatriques âgés de 3 à 12 ans) [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Mort subite et inexpliquée chez les patients épileptiques [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Névralgie post-zostérienne
Les effets indésirables les plus fréquemment associés à l'utilisation de NEURONTIN chez l'adulte, non observés à une fréquence équivalente chez les patients traités par placebo, étaient les étourdissements, la somnolence et l'œdème périphérique.
Dans les 2 essais contrôlés dans la névralgie post-zostérienne, 16 % des 336 patients ayant reçu NEURONTIN et 9 % des 227 patients ayant reçu le placebo ont arrêté le traitement en raison d'un effet indésirable. Les effets indésirables qui ont le plus fréquemment entraîné l'arrêt du traitement chez les patients traités par NEURONTIN étaient les étourdissements, la somnolence et les nausées.
Le tableau 3 répertorie les effets indésirables survenus chez au moins 1 % des patients traités par NEURONTIN atteints de névralgie post-zostérienne participant à des essais contrôlés par placebo et qui étaient numériquement plus fréquents dans le groupe NEURONTIN que dans le groupe placebo.
TABLEAU 3 : Effets indésirables dans les essais contrôlés par placebo regroupés sur la névralgie post-zostérienne
D'autres réactions chez plus de 1 % des patients mais également ou plus fréquentes dans le groupe placebo comprenaient la douleur, les tremblements, la névralgie, les douleurs dorsales, la dyspepsie, la dyspnée et le syndrome grippal.
Il n'y avait pas de différences cliniquement importantes entre les hommes et les femmes dans les types et l'incidence des effets indésirables. Parce qu'il y avait peu de patients dont la race a été signalée comme autre que blanche, il n'y a pas suffisamment de données pour étayer une déclaration concernant la distribution des effets indésirables par race.
Épilepsie avec crises d'épilepsie partielles (thérapie d'appoint)
Les effets indésirables les plus fréquents avec NEURONTIN 300 mg en association avec d'autres médicaments antiépileptiques chez les patients âgés de plus de 12 ans, non observés à une fréquence équivalente chez les patients traités par placebo, étaient la somnolence, les étourdissements, l'ataxie, la fatigue et le nystagmus.
Les effets indésirables les plus fréquents avec NEURONTIN en association avec d'autres médicaments antiépileptiques chez les patients pédiatriques âgés de 3 à 12 ans, non observés à une fréquence égale chez les patients traités par placebo, étaient une infection virale, de la fièvre, des nausées et/ou des vomissements, de la somnolence et hostilité [voir AVERTISSEMENTS ET PRECAUTIONS ].
Environ 7 % des 2 074 patients âgés de plus de 12 ans et environ 7 % des 449 patients pédiatriques âgés de 3 à 12 ans qui ont reçu NEURONTIN dans les essais cliniques de précommercialisation ont interrompu le traitement en raison d'un effet indésirable. Les effets indésirables les plus fréquemment associés au sevrage chez les patients de plus de 12 ans étaient la somnolence (1,2 %), l'ataxie (0,8 %), la fatigue (0,6 %), les nausées et/ou les vomissements (0,6 %) et les étourdissements (0,6 %). . Les effets indésirables les plus fréquemment associés au sevrage chez les patients pédiatriques étaient la labilité émotionnelle (1,6 %), l'hostilité (1,3 %) et l'hyperkinésie (1,1 %).
Le tableau 4 énumère les effets indésirables survenus chez au moins 1 % des patients épileptiques traités par NEURONTIN âgés de plus de 12 ans et participant à des essais contrôlés par placebo et qui étaient numériquement plus fréquents dans le groupe NEURONTIN. Dans ces études, NEURONTIN 300 mg ou un placebo a été ajouté au traitement antiépileptique actuel du patient.
TABLEAU 4 : Réactions indésirables dans les essais complémentaires contrôlés par placebo regroupés chez des patients épileptiques âgés de plus de 12 ans
Parmi les effets indésirables survenus avec une incidence d'au moins 10% chez les patients traités par NEURONTIN, la somnolence et l'ataxie semblaient présenter une relation dose-réponse positive.
L'incidence globale des effets indésirables et les types d'effets indésirables observés étaient similaires chez les hommes et les femmes traités par NEURONTIN. L'incidence des effets indésirables a légèrement augmenté avec l'âge chez les patients traités soit par NEURONTIN, soit par placebo. Étant donné que seuls 3 % des patients (28/921) dans les études contrôlées par placebo ont été identifiés comme non blancs (noirs ou autres), les données sont insuffisantes pour étayer une affirmation concernant la distribution des effets indésirables par race.
Le tableau 5 énumère les effets indésirables survenus chez au moins 2 % des patients traités par NEURONTIN, âgés de 3 à 12 ans atteints d'épilepsie et participant à des essais contrôlés par placebo, et qui étaient numériquement plus fréquents dans le groupe NEURONTIN.
TABLEAU 5 : Effets indésirables dans un essai complémentaire contrôlé par placebo chez des patients épileptiques pédiatriques âgés de 3 à 12 ans
D'autres réactions chez plus de 2 % des patients pédiatriques âgés de 3 à 12 ans mais également ou plus fréquentes dans le groupe placebo comprenaient : pharyngite, infection des voies respiratoires supérieures, céphalées, rhinite, convulsions, diarrhée, anorexie, toux et otite moyenne.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-commercialisation de NEURONTIN. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Affections hépatobiliaires : jaunisse
Enquêtes : créatine kinase élevée, tests de la fonction hépatique élevés
Troubles du métabolisme et de la nutrition : hyponatrémie
Trouble musculo-squelettique et du tissu conjonctif : rhabdomyolyse
Troubles du système nerveux : trouble du mouvement
Troubles psychiatriques: agitation
Troubles de l'appareil reproducteur et des seins : hypertrophie mammaire, modifications de la libido, troubles de l'éjaculation et anorgasmie
Affections de la peau et du tissu sous-cutané : œdème de Quincke [voir AVERTISSEMENTS ET PRECAUTIONS ], pemphigoïde bulleuse, érythème polymorphe, syndrome de Stevens-Johnson.
Il existe des rapports post-commercialisation de dépression respiratoire potentiellement mortelle ou mortelle chez des patients prenant NEURONTIN avec des opioïdes ou d'autres dépresseurs du SNC, ou dans le cadre d'une insuffisance respiratoire sous-jacente [voir AVERTISSEMENTS ET PRECAUTIONS ].
Des effets indésirables suite à l'arrêt brutal de la gabapentine ont également été rapportés. Les réactions les plus fréquemment signalées étaient l'anxiété, l'insomnie, les nausées, la douleur et la transpiration.
INTERACTIONS MÉDICAMENTEUSES
Opioïdes
Une dépression respiratoire et une sédation, entraînant parfois la mort, ont été rapportées suite à l'administration concomitante de gabapentine avec des opioïdes (par exemple, morphine, hydrocodone, oxycodone, buprénorphine) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Hydrocodone
La co-administration de NEURONTIN 300 mg avec l'hydrocodone diminue l'exposition à l'hydrocodone [voir PHARMACOLOGIE CLINIQUE ]. Le potentiel de modification de l'exposition et de l'effet de l'hydrocodone doit être pris en compte lorsque NEURONTIN 100 mg est démarré ou arrêté chez un patient prenant de l'hydrocodone.
Morphine
Lorsque la gabapentine est administrée avec de la morphine, les patients doivent être surveillés à la recherche de signes de dépression du SNC, tels que somnolence, sédation et dépression respiratoire [voir PHARMACOLOGIE CLINIQUE ].
Autres médicaments antiépileptiques
La gabapentine n'est pas métabolisée de manière appréciable et n'interfère pas avec le métabolisme des médicaments antiépileptiques couramment co-administrés [voir PHARMACOLOGIE CLINIQUE ].
Maalox® (hydroxyde d'aluminium, hydroxyde de magnésium)
La biodisponibilité moyenne de la gabapentine a été réduite d'environ 20 % avec l'utilisation concomitante d'un antiacide (Maalox) contenant des hydroxydes de magnésium et d'aluminium. Il est recommandé de prendre la gabapentine au moins 2 heures après l'administration de Maalox [voir PHARMACOLOGIE CLINIQUE ].
Interactions médicament/test de laboratoire
Étant donné que des lectures faussement positives ont été signalées avec le test de bandelette réactive Ames N-Multistix SG pour les protéines urinaires lorsque la gabapentine a été ajoutée à d'autres médicaments antiépileptiques, la procédure de précipitation à l'acide sulfosalicylique plus spécifique est recommandée pour déterminer la présence de protéines urinaires.
Toxicomanie et dépendance
Substance contrôlée
La gabapentine n'est pas un médicament programmé.
Abuser de
L'abus est l'usage intentionnel et non thérapeutique d'un médicament, ne serait-ce qu'une seule fois, pour ses effets psychologiques ou physiologiques souhaitables. Le mésusage est l'usage intentionnel, à des fins thérapeutiques, d'un médicament par une personne d'une manière autre que celle prescrite par un fournisseur de soins de santé ou à qui il n'a pas été prescrit.
La gabapentine ne présente aucune affinité pour les récepteurs des benzodiazépines, des opioïdes (mu, delta ou kappa) ou des cannabinoïdes 1. Une mauvaise utilisation et un abus de la gabapentine ont été signalés après la commercialisation et dans la littérature publiée. La plupart des personnes décrites dans ces rapports avaient des antécédents de polytoxicomanie. Certaines de ces personnes prenaient des doses de gabapentine supérieures aux doses recommandées pour des utilisations non approuvées. Lors de la prescription de NEURONTIN, évaluer soigneusement les patients pour des antécédents de toxicomanie et les observer pour déceler les signes et symptômes d'une mauvaise utilisation ou d'un abus de gabapentine (par exemple, augmentation de l'auto-dose et comportement de recherche de drogue). Le potentiel d'abus de la gabapentine n'a pas été évalué dans les études humaines.
Dépendance
La dépendance physique est un état qui se développe à la suite d'une adaptation physiologique en réponse à la consommation répétée de drogues, se manifestant par des signes et des symptômes de sevrage après un arrêt brutal ou une réduction significative de la dose d'un médicament. Il existe de rares rapports post-commercialisation de personnes présentant des symptômes de sevrage peu de temps après avoir arrêté des doses supérieures aux doses recommandées de gabapentine utilisées pour traiter des maladies pour lesquelles le médicament n'est pas approuvé. Ces symptômes comprenaient l'agitation, la désorientation et la confusion après l'arrêt soudain de la gabapentine qui se sont résolus après le redémarrage de la gabapentine. Le potentiel de dépendance de la gabapentine n'a pas été évalué dans les études humaines.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS)/hypersensibilité multiorganique
Une réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS), également connue sous le nom d'hypersensibilité multiorganique, s'est produite avec NEURONTIN. Certaines de ces réactions ont été mortelles ou potentiellement mortelles. Le DRESS se présente généralement, mais pas exclusivement, avec de la fièvre, une éruption cutanée et/ou une lymphadénopathie, en association avec d'autres atteintes du système organique, telles qu'une hépatite, une néphrite, des anomalies hématologiques, une myocardite ou une myosite ressemblant parfois à une infection virale aiguë. L'éosinophilie est souvent présente. Ce trouble est variable dans son expression, et d'autres systèmes d'organes non notés ici peuvent être impliqués.
Il est important de noter que des manifestations précoces d'hypersensibilité, comme de la fièvre ou une adénopathie, peuvent être présentes même si l'éruption cutanée n'est pas évidente. Si de tels signes ou symptômes sont présents, le patient doit être évalué immédiatement. NEURONTIN doit être arrêté si une autre étiologie des signes ou symptômes ne peut être établie.
Anaphylaxie et œdème de Quincke
NEURONTIN peut provoquer une anaphylaxie et un œdème de Quincke après la première dose ou à tout moment pendant le traitement. Les signes et symptômes des cas signalés comprenaient des difficultés respiratoires, un gonflement des lèvres, de la gorge et de la langue et une hypotension nécessitant un traitement d'urgence. Les patients doivent être informés qu'ils doivent arrêter NEURONTIN 300 mg et consulter immédiatement un médecin s'ils présentent des signes ou des symptômes d'anaphylaxie ou d'œdème de Quincke.
Effets sur la conduite et l'utilisation de machinerie lourde
Les patients prenant NEURONTIN ne doivent pas conduire avant d'avoir acquis une expérience suffisante pour évaluer si NEURONTIN 100 mg altère leur aptitude à conduire. Des études sur les performances de conduite menées avec un promédicament de la gabapentine (comprimé de gabapentine énacarbil, à libération prolongée) indiquent que la gabapentine peut entraîner une altération significative de la conduite. Les prescripteurs et les patients doivent être conscients que les patients & # 39; leur capacité à évaluer leur propre compétence de conduite, ainsi que leur capacité à évaluer le degré de somnolence causée par NEURONTIN, peuvent être imparfaites. La durée des troubles de la conduite après le début du traitement par NEURONTIN 300 mg n'est pas connue. Si la déficience est liée à la somnolence [voir AVERTISSEMENTS ET PRECAUTIONS ] ou d'autres effets de NEURONTIN est inconnue.
De plus, parce que NEURONTIN 300mg provoque de la somnolence et des vertiges [voir AVERTISSEMENTS ET PRECAUTIONS ], les patients doivent être avertis de ne pas utiliser de machines complexes jusqu'à ce qu'ils aient acquis une expérience suffisante sur NEURONTIN pour évaluer si NEURONTIN 300 mg altère leur capacité à effectuer de telles tâches.
Somnolence/sédation et étourdissements
Au cours des essais contrôlés sur l'épilepsie chez des patients âgés de plus de 12 ans recevant des doses de NEURONTIN allant de 100 mg à 1800 mg par jour, une somnolence, des étourdissements et une ataxie ont été rapportés à un taux plus élevé chez les patients recevant NEURONTIN par rapport au placebo : c'est-à-dire 19 % dans le traitement médicamenteux. contre 9 % dans le placebo pour la somnolence, 17 % dans le médicament contre 7 % dans le placebo pour les étourdissements et 13 % dans le médicament contre 6 % dans le placebo pour l'ataxie. Dans ces essais, la somnolence, l'ataxie et la fatigue étaient des effets indésirables fréquents conduisant à l'arrêt de NEURONTIN chez les patients âgés de plus de 12 ans, avec respectivement 1,2 %, 0,8 % et 0,6 % d'arrêts pour ces événements.
Au cours des essais contrôlés chez les patients souffrant de névralgie post-herpétique, de somnolence et d'étourdissements ont été signalés à un taux plus élevé par rapport au placebo chez les patients recevant NEURONTIN, à des doses allant jusqu'à 3600 mg par jour : soit 21 % chez les patients traités par NEURONTIN contre 5 % chez les patients sous placebo pour la somnolence et 28 % chez les patients sous NEURONTIN versus 8 % chez les patients sous placebo pour les étourdissements. Les sensations vertigineuses et la somnolence ont été parmi les effets indésirables les plus fréquents ayant conduit à l'arrêt de NEURONTIN.
Les patients doivent être étroitement surveillés pour déceler des signes de dépression du système nerveux central (SNC), tels que somnolence et sédation, lorsque NEURONTIN 400 mg est utilisé avec d'autres médicaments aux propriétés sédatives en raison d'une synergie potentielle. De plus, les patients qui nécessitent un traitement concomitant avec de la morphine peuvent présenter une augmentation des concentrations de gabapentine et peuvent nécessiter un ajustement de la dose [voir INTERACTIONS MÉDICAMENTEUSES ].
Crise d'épilepsie précipitée, état de mal épileptique
Les médicaments antiépileptiques ne doivent pas être interrompus brusquement en raison du risque d'augmentation de la fréquence des crises.
Dans les études contrôlées par placebo sur l'épilepsie chez des patients âgés de plus de 12 ans, l'incidence de l'état de mal épileptique chez les patients recevant NEURONTIN était de 0,6 % (3 sur 543) contre 0,5 % chez les patients recevant le placebo (2 sur 378). Parmi les 2 074 patients âgés de plus de 12 ans traités par NEURONTIN 300 mg dans toutes les études sur l'épilepsie (contrôlées et non contrôlées), 31 (1,5 %) présentaient un état de mal épileptique. Parmi ceux-ci, 14 patients n'avaient aucun antécédent d'état de mal épileptique avant le traitement ou pendant qu'ils prenaient d'autres médicaments. En l'absence de données historiques adéquates, il est impossible de dire si le traitement par NEURONTIN est associé ou non à un taux d'état de mal épileptique supérieur ou inférieur à celui auquel on pourrait s'attendre dans une population similaire non traitée par NEURONTIN.
Comportement suicidaire et idées
Les médicaments antiépileptiques (MAE), dont NEURONTIN 100 mg, augmentent le risque d'idées ou de comportements suicidaires chez les patients prenant ces médicaments pour toute indication. Les patients traités avec n'importe quel AED pour n'importe quelle indication doivent être surveillés pour l'apparition ou l'aggravation d'une dépression, de pensées ou de comportements suicidaires et/ou de tout changement inhabituel d'humeur ou de comportement.
Les analyses groupées de 199 essais cliniques contrôlés par placebo (monothérapie et traitement d'appoint) portant sur 11 antiépileptiques différents ont montré que les patients randomisés pour recevoir l'un des antiépileptiques présentaient environ deux fois plus de risques (risque relatif ajusté 1,8, IC à 95 % : 1,2, 2,7) de suicide. la pensée ou le comportement par rapport aux patients randomisés pour recevoir un placebo. Dans ces essais, qui avaient une durée médiane de traitement de 12 semaines, le taux d'incidence estimé de comportements ou d'idées suicidaires chez 27 863 patients sous AED était de 0,43 %, contre 0,24 % chez 16 029 patients sous placebo, ce qui représente une augmentation d'environ un cas d'idées ou de comportements suicidaires pour 530 patients traités. Il y a eu quatre suicides chez les patients traités par médicament dans les essais et aucun chez les patients traités par placebo, mais le nombre est trop petit pour permettre une conclusion sur l'effet du médicament sur le suicide.
Le risque accru de pensées ou de comportements suicidaires avec les antiépileptiques a été observé dès une semaine après le début du traitement médicamenteux avec les antiépileptiques et a persisté pendant toute la durée du traitement évalué. Étant donné que la plupart des essais inclus dans l'analyse ne se sont pas prolongés au-delà de 24 semaines, le risque de pensées ou de comportements suicidaires au-delà de 24 semaines n'a pas pu être évalué.
Le risque de pensées ou de comportements suicidaires était généralement constant parmi les médicaments dans les données analysées. La découverte d'un risque accru avec les antiépileptiques aux mécanismes d'action variables et dans une gamme d'indications suggère que le risque s'applique à tous les antiépileptiques utilisés pour n'importe quelle indication. Le risque ne variait pas sensiblement selon l'âge (5 à 100 ans) dans les essais cliniques analysés. Le tableau 2 montre le risque absolu et relatif par indication pour tous les antiépileptiques évalués.
TABLEAU 2 : Risque par indication pour les médicaments antiépileptiques dans l'analyse groupée
Le risque relatif de pensées ou de comportements suicidaires était plus élevé dans les essais cliniques sur l'épilepsie que dans les essais cliniques sur les affections psychiatriques ou autres, mais les différences de risque absolu étaient similaires pour l'épilepsie et les indications psychiatriques.
Toute personne envisageant de prescrire NEURONTIN 100 mg ou tout autre antiépileptique doit équilibrer le risque de pensées ou de comportements suicidaires avec le risque de maladie non traitée. L'épilepsie et de nombreuses autres maladies pour lesquelles des DEA sont prescrits sont elles-mêmes associées à la morbidité et à la mortalité et à un risque accru d'idées et de comportements suicidaires. Si des pensées et des comportements suicidaires apparaissent pendant le traitement, le prescripteur doit déterminer si l'apparition de ces symptômes chez un patient donné peut être liée à la maladie traitée.
Les patients, leurs soignants et leurs familles doivent être informés que les DEA augmentent le risque de pensées et de comportements suicidaires et doivent être informés de la nécessité d'être attentifs à l'apparition ou à l'aggravation des signes et symptômes de dépression, de tout changement inhabituel d'humeur ou de comportement. , ou l'émergence de pensées suicidaires, de comportements ou de pensées d'automutilation. Les comportements préoccupants doivent être signalés immédiatement aux fournisseurs de soins de santé.
Dépression respiratoire
Il existe des preuves issues de rapports de cas, d'études sur l'homme et d'études sur l'animal associant la gabapentine à une dépression respiratoire grave, potentiellement mortelle ou fatale lorsqu'elle est administrée en concomitance avec des dépresseurs du SNC, y compris des opioïdes, ou dans le cadre d'une insuffisance respiratoire sous-jacente. Lorsque la décision est prise de co-prescrire NEURONTIN 100 mg avec un autre dépresseur du SNC, en particulier un opioïde, ou de prescrire NEURONTIN 100 mg à des patients présentant une insuffisance respiratoire sous-jacente, surveiller les patients pour des symptômes de dépression respiratoire et de sédation, et envisager d'initier NEURONTIN à faible dose . La prise en charge de la dépression respiratoire peut inclure une surveillance étroite, des mesures de soutien et la réduction ou l'arrêt des dépresseurs du SNC (y compris NEURONTIN).
Effets indésirables neuropsychiatriques (patients pédiatriques âgés de 3 à 12 ans)
L'utilisation de la gabapentine chez les patients pédiatriques épileptiques âgés de 3 à 12 ans est associée à la survenue d'effets indésirables liés au SNC. Les plus importants d'entre eux peuvent être classés dans les catégories suivantes : 1) labilité émotionnelle (principalement des problèmes de comportement), 2) l'hostilité, y compris les comportements agressifs, 3) les troubles de la pensée, y compris les problèmes de concentration et les changements dans les performances scolaires, et 4) l'hyperkinésie ( principalement agitation et hyperactivité). Parmi les patients traités par la gabapentine, la plupart des réactions étaient d'intensité légère à modérée.
Dans des essais cliniques contrôlés sur l'épilepsie chez des patients pédiatriques âgés de 3 à 12 ans, l'incidence de ces effets indésirables était : labilité émotionnelle 6 % (patients traités par la gabapentine) versus 1,3 % (patients traités par placebo) ; hostilité 5,2 % contre 1,3 % ; hyperkinésie 4,7 % versus 2,9 % ; et trouble de la pensée 1,7 % contre 0 %. L'une de ces réactions, un rapport d'hostilité, a été considérée comme grave. L'arrêt du traitement par la gabapentine est survenu chez 1,3 % des patients signalant une labilité émotionnelle et une hyperkinésie et 0,9 % des patients traités par la gabapentine signalant une hostilité et un trouble de la pensée. Un patient traité par placebo (0,4 %) s'est retiré en raison d'une labilité émotionnelle.
Potentiel tumorigène
Dans une étude de cancérogénicité par voie orale, la gabapentine a augmenté l'incidence des tumeurs des cellules acineuses pancréatiques chez le rat [voir Toxicologie non clinique ]. La signification clinique de cette découverte est inconnue. L'expérience clinique au cours du développement préalable à la commercialisation de la gabapentine ne fournit aucun moyen direct d'évaluer son potentiel d'induction de tumeurs chez l'homme.
Dans des études cliniques sur le traitement adjuvant de l'épilepsie comprenant 2 085 patients-années d'exposition chez des patients > 12 ans, de nouvelles tumeurs ont été signalées chez 10 patients (2 seins, 3 cerveau, 2 poumon, 1 surrénale, 1 non hodgkinienne). s lymphome, 1 carcinome de l'endomètre in situ) et tumeurs préexistantes aggravées chez 11 patients (9 cerveaux, 1 sein, 1 prostate) pendant ou jusqu'à 2 ans après l'arrêt de NEURONTIN. Sans connaissance de l'incidence de fond et de la récidive dans une population similaire non traitée par NEURONTIN 100 mg, il est impossible de savoir si l'incidence observée dans cette cohorte est ou non affectée par le traitement.
Mort subite et inexpliquée chez les patients épileptiques
Au cours du développement précommercialisation de NEURONTIN 400 mg, 8 morts subites et inexpliquées ont été enregistrées parmi une cohorte de 2203 patients épileptiques traités (2103 patients-années d'exposition) par NEURONTIN.
Certains d'entre eux pourraient représenter des décès liés à des crises dans lesquels la crise n'a pas été observée, par exemple, la nuit. Cela représente une incidence de 0,0038 décès par patient-année. Bien que ce taux soit supérieur à celui attendu dans une population saine appariée pour l'âge et le sexe, il se situe dans la fourchette des estimations de l'incidence des morts subites inexpliquées chez les patients épileptiques ne recevant pas NEURONTIN (allant de 0,0005 pour la population générale des épileptiques à 0,003 pour une population de l'essai clinique similaire à celle du programme NEURONTIN, à 0,005 pour les patients épileptiques réfractaires). Par conséquent, le caractère rassurant ou préoccupant de ces chiffres dépend de la comparabilité des populations rapportées à la cohorte NEURONTIN et de la précision des estimations fournies.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments ).
Informations administratives
Informez les patients que NEURONTIN est pris par voie orale avec ou sans nourriture. Informez les patients que s'ils divisent le comprimé sécable de 600 mg ou de 800 mg pour administrer un demi-comprimé, ils doivent prendre le demi-comprimé inutilisé comme dose suivante. Conseillez aux patients de jeter les demi-comprimés non utilisés dans les 28 jours suivant la division du comprimé sécable.
Réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS)/hypersensibilité multiorganique
Avant le début du traitement par NEURONTIN, informer les patients qu'une éruption cutanée ou d'autres signes ou symptômes d'hypersensibilité (tels que fièvre ou lymphadénopathie) peuvent annoncer un événement médical grave et que le patient doit signaler immédiatement tout événement de ce type à un médecin [voir AVERTISSEMENTS ET PRECAUTIONS ].
Anaphylaxie et œdème de Quincke
Conseiller aux patients d'arrêter NEURONTIN 300 mg et de consulter un médecin s'ils développent des signes ou des symptômes d'anaphylaxie ou d'œdème de Quincke [voir AVERTISSEMENTS ET PRECAUTIONS ].
Étourdissements et somnolence et effets sur la conduite et l'utilisation de machinerie lourde
Aviser les patients que NEURONTIN 100 mg peut provoquer des étourdissements, de la somnolence et d'autres symptômes et signes de dépression du SNC. D'autres médicaments aux propriétés sédatives peuvent augmenter ces symptômes. En conséquence, bien que les patients & # 39; capacité à déterminer leur niveau de déficience peut ne pas être fiable, conseillez-leur de ne pas conduire de voiture ni d'utiliser d'autres machines complexes jusqu'à ce qu'ils aient acquis suffisamment d'expérience sur NEURONTIN pour évaluer si cela affecte ou non leurs performances mentales et/ou motrices. Informez les patients que la durée de cet effet n'est pas connue [voir AVERTISSEMENTS ET PRECAUTIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Pensées et comportements suicidaires
Informez le patient, ses soignants et sa famille que les DEA, y compris NEURONTIN, peuvent augmenter le risque de pensées et de comportements suicidaires. Informez les patients de la nécessité d'être attentifs à l'apparition ou à l'aggravation de symptômes de dépression, à tout changement inhabituel d'humeur ou de comportement, ou à l'émergence de pensées, de comportements ou de pensées suicidaires sur l'automutilation. Demandez aux patients de signaler immédiatement les comportements préoccupants aux fournisseurs de soins de santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Dépression respiratoire
Informer les patients du risque de dépression respiratoire. Inclure des informations indiquant que le risque est le plus élevé pour les personnes utilisant des dépresseurs du SNC concomitants (tels que les analgésiques opioïdes) ou celles souffrant d'une insuffisance respiratoire sous-jacente. Apprenez aux patients à reconnaître la dépression respiratoire et conseillez-leur de consulter immédiatement un médecin si cela se produit [voir AVERTISSEMENTS ET PRECAUTIONS ].
Utilisation pendant la grossesse
Demandez aux patientes d'informer leur médecin si elles deviennent enceintes ou ont l'intention de devenir enceintes pendant le traitement, et d'informer leur médecin si elles allaitent ou ont l'intention d'allaiter pendant le traitement [voir Utilisation dans des populations spécifiques ].
Encouragez les patientes à s'inscrire au registre des grossesses de la NAAED si elles tombent enceintes. Ce registre recueille des informations sur la sécurité des médicaments antiépileptiques pendant la grossesse. Pour s'inscrire, les patients peuvent appeler le numéro sans frais 1-888-233-2334 [voir Utilisation dans des populations spécifiques ].
L'étiquetage de ce produit a peut-être été mis à jour. Pour les informations de prescription les plus récentes, veuillez visiter www.pfizer.com.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
La gabapentine a été administrée par voie orale à des souris et à des rats dans le cadre d'études de cancérogénicité de 2 ans. Aucune preuve de cancérogénicité liée au médicament n'a été observée chez les souris traitées à des doses allant jusqu'à 2 000 mg/kg/jour. À 2000 mg/kg, l'exposition plasmatique à la gabapentine (AUC) chez la souris était environ 2 fois celle chez l'homme à la MRHD de 3600 mg/jour. Chez les rats, des augmentations de l'incidence des adénomes et des carcinomes des cellules acineuses pancréatiques ont été observées chez les rats mâles recevant la dose la plus élevée (2 000 mg/kg), mais pas à des doses de 250 ou 1 000 mg/kg/jour. À 1000 mg/kg, l'exposition plasmatique à la gabapentine (AUC) chez le rat était environ 5 fois celle chez l'homme à la MRHD.
Des études conçues pour étudier le mécanisme de la carcinogenèse pancréatique induite par la gabapentine chez le rat indiquent que la gabapentine stimule la synthèse d'ADN dans les cellules acineuses pancréatiques du rat in vitro et, par conséquent, peut agir comme un promoteur tumoral en augmentant l'activité mitogène. On ne sait pas si la gabapentine a la capacité d'augmenter la prolifération cellulaire dans d'autres types de cellules ou dans d'autres espèces, y compris les humains.
Mutagenèse
La gabapentine n'a pas démontré de potentiel mutagène ou génotoxique in vitro (test d'Ames, essai de mutation directe HGPRT dans des cellules pulmonaires de hamster chinois) et in vivo (test d'aberration chromosomique et de micronoyau dans la moelle osseuse de hamster chinois, micronoyau de souris, synthèse d'ADN non programmée dans des hépatocytes de rat) dosages.
Altération de la fertilité
Aucun effet indésirable sur la fertilité ou la reproduction n'a été observé chez le rat à des doses allant jusqu'à 2 000 mg/kg. À 2000 mg/kg, l'exposition plasmatique à la gabapentine (AUC) chez le rat est environ 8 fois celle chez l'homme à la MRHD.
Utilisation dans des populations spécifiques
Grossesse
Registre d'exposition pendant la grossesse
Il existe un registre d'exposition pendant la grossesse qui surveille les résultats de la grossesse chez les femmes exposées à des médicaments antiépileptiques (MAE), tels que NEURONTIN 300 mg, pendant la grossesse. Encouragez les femmes qui prennent NEURONTIN pendant leur grossesse à s'inscrire au registre des grossesses des antiépileptiques nord-américains (NAAED) en appelant le numéro sans frais 1-888-233-2334 ou en visitant http://www.aedpregnancyregistry.org/.
Résumé des risques
Il n'existe pas de données adéquates sur les risques développementaux associés à l'utilisation de NEURONTIN chez la femme enceinte. Dans des études non cliniques chez des souris, des rats et des lapins, la gabapentine s'est révélée toxique pour le développement (augmentation des anomalies squelettiques et viscérales fœtales et augmentation de la mortalité embryofœtale) lorsqu'elle a été administrée à des animaux gravides à des doses similaires ou inférieures à celles utilisées en clinique [voir Données ].
Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 à 4 % et de 15 à 20 %, respectivement. Le risque de fond de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu.

Données
Données animales
Lorsque des souris gravides ont reçu des doses orales de gabapentine (500, 1 000 ou 3 000 mg/kg/jour) pendant la période d'organogenèse, une toxicité embryofœtale (incidence accrue de variations squelettiques) a été observée aux deux doses les plus élevées. La dose sans effet sur la toxicité pour le développement embryofœtal chez la souris (500 mg/kg/jour) est inférieure à la dose humaine maximale recommandée (MRHD) de 3 600 mg sur une base de surface corporelle (mg/m²).
Dans les études au cours desquelles des rats ont reçu des doses orales de gabapentine (500 à 2000 mg/kg/jour) pendant la grossesse, des effets indésirables sur le développement de la progéniture (incidence accrue d'hydrouretère et/ou d'hydronéphrose) ont été observés à toutes les doses. La dose la plus faible testée est similaire à la MRHD exprimée en mg/m².
Lorsque des lapines gestantes ont été traitées avec de la gabapentine pendant la période d'organogenèse, une augmentation de la mortalité embryofœtale a été observée à toutes les doses testées (60, 300 ou 1500 mg/kg). La dose la plus faible testée est inférieure à la MRHD exprimée en mg/m².
Dans une étude publiée, la gabapentine (400 mg/kg/jour) a été administrée par injection intrapéritonéale à des souris nouveau-nées au cours de la première semaine postnatale, période de synaptogenèse chez les rongeurs (correspondant au dernier trimestre de la grossesse chez l'homme). La gabapentine a provoqué une diminution marquée de la formation de synapses neuronales dans le cerveau de souris intactes et une formation anormale de synapses neuronales dans un modèle murin de réparation synaptique. Il a été démontré in vitro que la gabapentine interfère avec l'activité de la sous-unité α2δ des canaux calciques voltage-activés, un récepteur impliqué dans la synaptogenèse neuronale. La signification clinique de ces résultats est inconnue.
Lactation
Résumé des risques
La gabapentine est sécrétée dans le lait maternel après administration orale. Les effets sur le nourrisson allaité et sur la production de lait sont inconnus. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de NEURONTIN pour la mère et tout effet indésirable potentiel de NEURONTIN ou de l'affection maternelle sous-jacente sur le nourrisson allaité.
Utilisation pédiatrique
La sécurité et l'efficacité de NEURONTIN 600 mg dans la prise en charge des névralgies post-zostériennes chez les patients pédiatriques n'ont pas été établies.
L'innocuité et l'efficacité en tant que traitement d'appoint dans le traitement des crises partielles chez les patients pédiatriques de moins de 3 ans n'ont pas été établies [voir Etudes cliniques ].
Utilisation gériatrique
Le nombre total de patients traités par NEURONTIN dans les essais cliniques contrôlés chez des patients atteints de névralgie post-zostérienne était de 336, dont 102 (30 %) étaient âgés de 65 à 74 ans et 168 (50 %) étaient âgés de 75 ans et plus. L'effet du traitement était plus important chez les patients âgés de 75 ans et plus par rapport aux patients plus jeunes ayant reçu la même dose. Étant donné que la gabapentine est presque exclusivement éliminée par excrétion rénale, l'effet plus important du traitement observé chez les patients ≥ 75 ans peut être la conséquence d'une exposition accrue à la gabapentine pour une dose donnée résultant d'une diminution de la fonction rénale liée à l'âge. Cependant, d'autres facteurs ne peuvent être exclus. Les types et l'incidence des effets indésirables étaient similaires dans tous les groupes d'âge, à l'exception de l'œdème périphérique et de l'ataxie, dont l'incidence avait tendance à augmenter avec l'âge.
Les études cliniques de NEURONTIN dans l'épilepsie n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondaient différemment des sujets plus jeunes. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
Ce médicament est connu pour être en grande partie excrété par les reins et le risque de réactions toxiques à ce médicament peut être plus élevé chez les patients présentant une insuffisance rénale. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises dans le choix de la dose et la dose doit être ajustée en fonction des valeurs de clairance de la créatinine chez ces patients [voir DOSAGE ET ADMINISTRATION , EFFETS INDÉSIRABLES , et PHARMACOLOGIE CLINIQUE ].
Insuffisance rénale
Un ajustement posologique chez les patients adultes dont la fonction rénale est altérée est nécessaire [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ]. Les patients pédiatriques insuffisants rénaux n'ont pas été étudiés.
Un ajustement posologique chez les patients sous hémodialyse est nécessaire [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Les signes de toxicité aiguë chez les animaux comprenaient l'ataxie, la respiration laborieuse, le ptosis, la sédation, l'hypoactivité ou l'excitation.
Des surdosages aigus par voie orale de NEURONTIN 300 mg ont été rapportés. Les symptômes comprennent une vision double, des tremblements, des troubles de l'élocution, de la somnolence, une altération de l'état mental, des étourdissements, de la léthargie et de la diarrhée. Une dépression respiratoire mortelle a été rapportée avec un surdosage de NEURONTIN 400 mg, seul et en association avec d'autres dépresseurs du SNC.
La gabapentine peut être éliminée par hémodialyse.
En cas de surexposition, appelez votre centre antipoison au 1-800-222-1222.
CONTRE-INDICATIONS
NEURONTIN est contre-indiqué chez les patients qui ont démontré une hypersensibilité au médicament ou à ses ingrédients.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Les mécanismes précis par lesquels la gabapentine produit ses actions analgésiques et antiépileptiques sont inconnus. La gabapentine est structurellement liée au neurotransmetteur acide gamma-aminobutyrique (GABA) mais n'a aucun effet sur la liaison, l'absorption ou la dégradation du GABA. Des études in vitro ont montré que la gabapentine se lie avec une haute affinité à la sous-unité α2δ des canaux calciques activés par la tension ; cependant, la relation entre cette liaison et les effets thérapeutiques de la gabapentine est inconnue.
Pharmacocinétique
Toutes les actions pharmacologiques consécutives à l'administration de gabapentine sont dues à l'activité du composé parent ; la gabapentine n'est pas métabolisée de manière appréciable chez l'homme.
Biodisponibilité orale
La biodisponibilité de la gabapentine n'est pas proportionnelle à la dose ; c'est-à-dire que lorsque la dose est augmentée, la biodisponibilité diminue. La biodisponibilité de la gabapentine est d'environ 60 %, 47 %, 34 %, 33 % et 27 % après 900, 1 200, 2 400, 3 600 et 4 800 mg/jour administrés en 3 doses fractionnées, respectivement. La nourriture n'a qu'un léger effet sur la vitesse et le degré d'absorption de la gabapentine (augmentation de 14 % de l'ASC et de la Cmax).
Distribution
Moins de 3 % de la gabapentine circule liée aux protéines plasmatiques. Le volume de distribution apparent de la gabapentine après administration intraveineuse de 150 mg est de 58 ± 6 L (moyenne ± ET). Chez les patients épileptiques, les concentrations à l'état d'équilibre avant dose (Cmin) de gabapentine dans le liquide céphalo-rachidien étaient d'environ 20 % des concentrations plasmatiques correspondantes.
Élimination
La gabapentine est éliminée de la circulation systémique par excrétion rénale sous forme inchangée. La gabapentine n'est pas métabolisée de manière appréciable chez l'homme.
La demi-vie d'élimination de la gabapentine est de 5 à 7 heures et n'est pas modifiée par la dose ou après plusieurs doses. La constante de vitesse d'élimination de la gabapentine, la clairance plasmatique et la clairance rénale sont directement proportionnelles à la clairance de la créatinine. Chez les patients âgés et chez les patients présentant une insuffisance rénale, la clairance plasmatique de la gabapentine est réduite. La gabapentine peut être éliminée du plasma par hémodialyse.
Populations spécifiques
Âge
L'effet de l'âge a été étudié chez des sujets âgés de 20 à 80 ans. La clairance orale apparente (CL/F) de la gabapentine a diminué avec l'âge, passant d'environ 225 ml/min chez les moins de 30 ans à environ 125 ml/min chez les plus de 70 ans. La clairance rénale (CLr) et la CLr ajustée à la surface corporelle diminuaient également avec l'âge ; cependant, la diminution de la clairance rénale de la gabapentine avec l'âge peut en grande partie s'expliquer par la diminution de la fonction rénale. [voir DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ].
Le genre
Bien qu'aucune étude formelle n'ait été menée pour comparer la pharmacocinétique de la gabapentine chez les hommes et les femmes, il semble que les paramètres pharmacocinétiques pour les hommes et les femmes soient similaires et qu'il n'y ait pas de différences significatives entre les sexes.
Course
Les différences pharmacocinétiques dues à la race n'ont pas été étudiées. Étant donné que la gabapentine est principalement excrétée par les reins et qu'il n'y a pas de différences raciales importantes dans la clairance de la créatinine, des différences pharmacocinétiques dues à la race ne sont pas attendues.
Pédiatrique
La pharmacocinétique de la gabapentine a été déterminée chez 48 sujets pédiatriques âgés de 1 mois à 12 ans après une dose d'environ 10 mg/kg. Les concentrations plasmatiques maximales étaient similaires dans tout le groupe d'âge et se sont produites 2 à 3 heures après l'administration. En général, les sujets pédiatriques âgés de 1 mois à moins de 5 ans ont atteint une exposition (ASC) inférieure d'environ 30 % à celle observée chez les sujets âgés de 5 ans et plus. En conséquence, la clairance orale normalisée par poids corporel était plus élevée chez les enfants plus jeunes. La clairance orale apparente de la gabapentine était directement proportionnelle à la clairance de la créatinine. La demi-vie d'élimination de la gabapentine était en moyenne de 4,7 heures et était similaire dans tous les groupes d'âge étudiés.
Une analyse pharmacocinétique de population a été réalisée chez 253 sujets pédiatriques âgés de 1 mois à 13 ans. Les patients ont reçu 10 à 65 mg/kg/jour trois fois par jour. La clairance orale apparente (CL/F) était directement proportionnelle à la clairance de la créatinine et cette relation était similaire après une dose unique et à l'état d'équilibre. Des valeurs de clairance orale plus élevées ont été observées chez les enfants de moins de 5 ans par rapport à celles observées chez les enfants de 5 ans et plus, une fois normalisées par poids corporel. La clairance était très variable chez les nourrissons de moins de 1 an. Les valeurs normalisées de CL/F observées chez les patients pédiatriques âgés de 5 ans et plus correspondaient aux valeurs observées chez les adultes après une dose unique. Le volume de distribution oral normalisé par poids corporel était constant dans toute la tranche d'âge.
Ces données pharmacocinétiques indiquent que la dose quotidienne efficace chez les patients pédiatriques épileptiques âgés de 3 et 4 ans doit être de 40 mg/kg/jour pour atteindre des concentrations plasmatiques moyennes similaires à celles obtenues chez les patients âgés de 5 ans et plus recevant de la gabapentine à 30 mg/jour. kg/jour [voir DOSAGE ET ADMINISTRATION ].
Patients adultes atteints d'insuffisance rénale
Les sujets (N = 60) atteints d'insuffisance rénale (clairance moyenne de la créatinine allant de 13 à 114 mL/min) ont reçu des doses orales uniques de 400 mg de gabapentine. La demi-vie moyenne de la gabapentine variait d'environ 6,5 heures (patients avec une clairance de la créatinine > 60 ml/min) à 52 heures (clairance de la créatinine 60 ml/min groupe) à environ 10 mL/min ( DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ]. Les patients pédiatriques insuffisants rénaux n'ont pas été étudiés.
Hémodialyse
Dans une étude menée chez des sujets adultes anuriques (N = 11), la demi-vie d'élimination apparente de la gabapentine les jours sans dialyse était d'environ 132 heures ; pendant la dialyse, la demi-vie apparente de la gabapentine a été réduite à 3,8 heures. L'hémodialyse a donc un effet significatif sur l'élimination de la gabapentine chez les sujets anuriques [voir DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ].
Maladie hépatique
La gabapentine n'étant pas métabolisée, aucune étude n'a été réalisée chez des patients insuffisants hépatiques.
Interactions médicamenteuses
Études in vitro
Des études in vitro ont été menées pour étudier le potentiel de la gabapentine à inhiber les principales enzymes du cytochrome P450 (CYP1A2, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1 et CYP3A4) qui interviennent dans le métabolisme des médicaments et des xénobiotiques à l'aide de substrats marqueurs sélectifs d'isoformes et de préparations de microsomes hépatiques humains. . Ce n'est qu'à la concentration la plus élevée testée (171 mcg/mL; 1 mM) qu'un léger degré d'inhibition (14 % à 30 %) de l'isoforme CYP2A6 a été observé. Aucune inhibition d'aucune des autres isoformes testées n'a été observée à des concentrations de gabapentine jusqu'à 171 mcg/mL (environ 15 fois la Cmax à 3 600 mg/jour) de l'isoforme CYP2A6 observée. Aucune inhibition d'aucune des autres isoformes testées n'a été observée à des concentrations de gabapentine allant jusqu'à 171 mcg/mL (environ 15 fois la Cmax à 3 600 mg/jour).
Études in vivo
Les données sur les interactions médicamenteuses décrites dans cette section ont été obtenues à partir d'études impliquant des adultes en bonne santé et des patients adultes atteints d'épilepsie.
Phénytoïne
Dans une étude à dose unique (400 mg) et à doses multiples (400 mg trois fois par jour) de NEURONTIN 400 mg chez des patients épileptiques (N = 8) maintenus sous monothérapie par phénytoïne pendant au moins 2 mois, la gabapentine n'a eu aucun effet sur le creux à l'état d'équilibre les concentrations plasmatiques de phénytoïne et de phénytoïne n'ont eu aucun effet sur la pharmacocinétique de la gabapentine.
Carbamazépine
L'administration concomitante de gabapentine (400 mg trois fois par jour ; N = 12) n'a pas eu d'incidence sur les concentrations plasmatiques de carbamazépine et d'époxyde de carbamazépine 10, 11 à l'état d'équilibre. De même, la pharmacocinétique de la gabapentine n'a pas été modifiée par l'administration de carbamazépine.
Acide valproïque
Les concentrations minimales moyennes d'acide valproïque sérique à l'état d'équilibre avant et pendant l'administration concomitante de gabapentine (400 mg trois fois par jour ; N = 17) n'étaient pas différentes et les paramètres pharmacocinétiques de la gabapentine n'étaient pas non plus affectés par l'acide valproïque.
Phénobarbital
Les estimations des paramètres pharmacocinétiques à l'état d'équilibre pour le phénobarbital ou la gabapentine (300 mg trois fois par jour ; N = 12) sont identiques, que les médicaments soient administrés seuls ou ensemble.
Naproxène
L'administration concomitante (N = 18) de gélules de naproxène sodique (250 mg) avec NEURONTIN (125 mg) semble augmenter la quantité de gabapentine absorbée de 12 % à 15 %. La gabapentine n'a eu aucun effet sur les paramètres pharmacocinétiques du naproxène. Ces doses sont inférieures aux doses thérapeutiques des deux médicaments. L'ampleur de l'interaction dans les plages de doses recommandées de l'un ou l'autre des médicaments n'est pas connue.
Hydrocodone
L'administration concomitante de NEURONTIN (125 à 500 mg ; N = 48) diminue les valeurs de Cmax et d'ASC de l'hydrocodone (10 mg ; N = 50) de manière dose-dépendante par rapport à l'administration d'hydrocodone seule ; Les valeurs de Cmax et d'ASC sont respectivement inférieures de 3 % à 4 % après administration de 125 mg de NEURONTIN et de 21 % à 22 % inférieures, respectivement, après administration de 500 mg de NEURONTIN. Le mécanisme de cette interaction est inconnu. L'hydrocodone augmente les valeurs d'ASC de la gabapentine de 14 %. L'ampleur de l'interaction à d'autres doses n'est pas connue.
Morphine
Un article de la littérature a rapporté que lorsqu'une gélule de morphine à libération contrôlée de 60 mg était administrée 2 heures avant une gélule de NEURONTIN de 600 mg (N = 12), l'ASC moyenne de la gabapentine augmentait de 44 % par rapport à la gabapentine administrée sans morphine. Les valeurs des paramètres pharmacocinétiques de la morphine n'ont pas été affectées par l'administration de NEURONTIN 2 heures après la morphine. L'ampleur de l'interaction à d'autres doses n'est pas connue.
Cimétidine
En présence de cimétidine à raison de 300 mg quatre fois par jour (N = 12), la clairance orale apparente moyenne de la gabapentine a diminué de 14 % et la clairance de la créatinine a diminué de 10 %. Ainsi, la cimétidine semble altérer l'excrétion rénale de la gabapentine et de la créatinine, un marqueur endogène de la fonction rénale. Cette petite diminution de l'excrétion de la gabapentine par la cimétidine ne devrait pas avoir d'importance clinique. L'effet de la gabapentine sur la cimétidine n'a pas été évalué.
Contraceptif oral
Sur la base de l'ASC et de la demi-vie, les profils pharmacocinétiques de doses multiples de noréthindrone et d'éthinylestradiol après l'administration de comprimés contenant 2,5 mg d'acétate de noréthindrone et 50 mcg d'éthinylestradiol étaient similaires avec et sans co-administration de gabapentine (400 mg trois fois par jour ; n=13). La Cmax de la noréthindrone était supérieure de 13 % lorsqu'elle était co-administrée avec la gabapentine ; cette interaction ne devrait pas avoir d'importance clinique.
Antiacide (Maalox®) (hydroxyde d'aluminium, hydroxyde de magnésium)
Un antiacide (Maalox®) contenant des hydroxydes de magnésium et d'aluminium a réduit la biodisponibilité moyenne de la gabapentine (N = 16) d'environ 20 %. Cette diminution de la biodisponibilité était d'environ 10 % lorsque la gabapentine était administrée 2 heures après Maalox.
Probénécide
Le probénécide est un bloqueur de la sécrétion tubulaire rénale. Les paramètres pharmacocinétiques de la gabapentine sans et avec probénécide étaient comparables. Cela indique que la gabapentine ne subit pas de sécrétion tubulaire rénale par la voie bloquée par le probénécide.
Etudes cliniques
Névralgie post-zostérienne
NEURONTIN a été évalué pour la prise en charge de la névralgie post-zostérienne (PHN) dans deux études multicentriques randomisées, en double aveugle, contrôlées par placebo. La population en intention de traiter (ITT) comprenait un total de 563 patients souffrant de douleur pendant plus de 3 mois après la guérison de l'éruption cutanée due au zona (tableau 6).
TABLEAU 6. Études contrôlées sur la PHN : durée, dosages et nombre de patients
Chaque étude comprenait une phase en double aveugle de 7 ou 8 semaines (3 ou 4 semaines de titration et 4 semaines de dose fixe). Les patients ont commencé le traitement avec une titration jusqu'à un maximum de 900 mg/jour de gabapentine pendant 3 jours. Les doses devaient ensuite être titrées par paliers de 600 à 1200 mg/jour à des intervalles de 3 à 7 jours jusqu'à la dose cible sur 3 à 4 semaines. Les patients ont noté leur douleur dans un journal quotidien à l'aide d'une échelle numérique d'évaluation de la douleur en 11 points allant de 0 (pas de douleur) à 10 (pire douleur possible). Un score moyen de douleur au départ d'au moins 4 était requis pour la randomisation. Les analyses ont été menées sur la population ITT (tous les patients randomisés ayant reçu au moins une dose du médicament à l'étude).
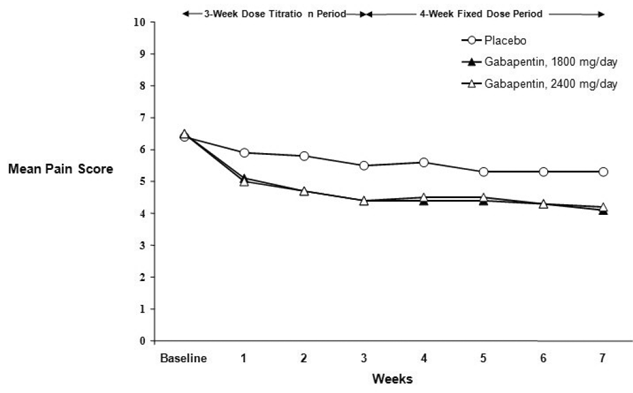
Les deux études ont démontré une efficacité par rapport au placebo à toutes les doses testées.
La réduction des scores moyens hebdomadaires de douleur a été observée à la semaine 1 dans les deux études et s'est maintenue jusqu'à la fin du traitement. Des effets de traitement comparables ont été observés dans tous les bras de traitement actif. La modélisation pharmacocinétique/pharmacodynamique a fourni des preuves confirmatives de l'efficacité à toutes les doses. Les figures 1 et 2 montrent les scores d'intensité de la douleur au fil du temps pour les études 1 et 2.
Figure 1. Scores hebdomadaires moyens de la douleur (cas observés dans la population ITT) : étude 1
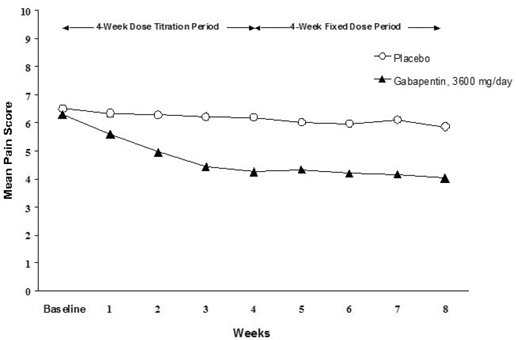
Figure 2. Scores hebdomadaires moyens de la douleur (cas observés dans la population ITT) : étude 2
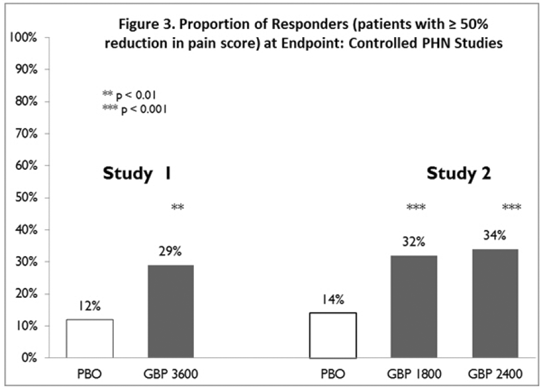
La proportion de répondeurs (les patients signalant une amélioration d'au moins 50 % du score de douleur au critère d'évaluation par rapport à la valeur initiale) a été calculée pour chaque étude (Figure 3).
Figure 3. Proportion de répondeurs (patients présentant une réduction ≥ 50 % du score de douleur) au point final : études contrôlées sur la PHN
Épilepsie pour les crises d'épilepsie partielles (thérapie d'appoint)
L'efficacité de NEURONTIN 400 mg en traitement d'appoint (ajouté à d'autres médicaments antiépileptiques) a été établie dans des essais cliniques multicentriques, contrôlés par placebo, en double aveugle, en groupes parallèles chez des patients adultes et pédiatriques (3 ans et plus) présentant des crises partielles réfractaires.
Des preuves d'efficacité ont été obtenues dans trois essais menés auprès de 705 patients (âgés de 12 ans et plus) et un essai mené auprès de 247 patients pédiatriques (âgés de 3 à 12 ans). Les patients inclus avaient des antécédents d'au moins 4 crises partielles par mois malgré l'administration d'un ou plusieurs médicaments antiépileptiques à des niveaux thérapeutiques et ont été observés sous leur traitement antiépileptique établi pendant une période de référence de 12 semaines (6 semaines dans l'étude les patients). Chez les patients continuant à avoir au moins 2 (ou 4 dans certaines études) crises par mois, NEURONTIN 300 mg ou un placebo a ensuite été ajouté au traitement existant pendant une période de traitement de 12 semaines. L'efficacité a été évaluée principalement sur la base du pourcentage de patients présentant une réduction de 50 % ou plus de la fréquence des crises entre le début et le traitement (le « taux de réponse ») et une mesure dérivée appelée rapport de réponse, une mesure du changement définie comme (T - B)/(T + B), où B est la fréquence initiale des crises du patient et T est la fréquence des crises du patient pendant le traitement. Le rapport de réponse est distribué dans la plage -1 à +1. Une valeur nulle indique aucun changement alors qu'une élimination complète des crises donnerait une valeur de -1 ; des taux de saisie accrus donneraient des valeurs positives. Un rapport de réponse de -0,33 correspond à une réduction de 50 % de la fréquence des crises. Les résultats indiqués ci-dessous concernent toutes les crises partielles dans la population en intention de traiter (tous les patients ayant reçu une dose de traitement) dans chaque étude, sauf indication contraire.
Une étude a comparé NEURONTIN 1200 mg/jour, en trois doses fractionnées, à un placebo. Le taux de répondeurs a été de 23% (14/61) dans le groupe NEURONTIN 600mg et de 9% (6/66) dans le groupe placebo ; la différence entre les groupes était statistiquement significative. Le taux de réponse a également été meilleur dans le groupe NEURONTIN (-0,199) que dans le groupe placebo (-0,044), différence également statistiquement significative.
Une deuxième étude a comparé principalement NEURONTIN 1200 mg/jour, en trois prises fractionnées (N=101), à un placebo (N=98). D'autres groupes de dosage plus petits de NEURONTIN 300 mg (600 mg/jour, N = 53 ; 1 800 mg/jour, N = 54) ont également été étudiés pour obtenir des informations sur la réponse à la dose. Le taux de répondeurs a été plus élevé dans le groupe NEURONTIN 1200 mg/j (16 %) que dans le groupe placebo (8 %), mais la différence n'a pas été statistiquement significative. Le taux de répondeurs à 600 mg (17 %) n'était pas non plus significativement plus élevé que dans le groupe placebo, mais le taux de répondeurs dans le groupe à 1 800 mg (26 %) était statistiquement significativement supérieur au taux de placebo. Le taux de réponse a été meilleur dans le groupe NEURONTIN 1200 mg/j (-0,103) que dans le groupe placebo (-0,022) ; mais cette différence n'était pas non plus statistiquement significative (p = 0,224). Une meilleure réponse a été observée dans le groupe NEURONTIN 600 mg/jour (-0,105) et le groupe 1800 mg/jour (-0,222) que dans le groupe 1200 mg/jour, le groupe 1800 mg/jour atteignant une signification statistique par rapport au placebo groupe.
Une troisième étude a comparé NEURONTIN 900 mg/jour, en trois doses fractionnées (N=111), et un placebo (N=109). Un groupe posologique supplémentaire de NEURONTIN à 1200 mg/jour (N = 52) a fourni des données dose-réponse. Une différence statistiquement significative du taux de répondeurs a été observée dans le groupe NEURONTIN 900 mg/jour (22 %) par rapport à celui du groupe placebo (10 %). Le taux de réponse a également été statistiquement significativement supérieur dans le groupe NEURONTIN 900 mg/jour (-0,119) par rapport à celui du groupe placebo (-0,027), de même que le taux de réponse dans NEURONTIN 1200 mg/jour (-0,184) par rapport au placebo.
Des analyses ont également été effectuées dans chaque étude pour examiner l'effet de NEURONTIN 300 mg sur la prévention des crises tonico-cloniques secondairement généralisées. Les patients qui ont subi une crise tonico-clonique secondairement généralisée au départ ou pendant la période de traitement dans les trois études contrôlées par placebo ont été inclus dans ces analyses. Plusieurs comparaisons des rapports de réponse ont montré un avantage statistiquement significatif pour NEURONTIN par rapport au placebo et des tendances favorables pour presque toutes les comparaisons.
L'analyse du taux de répondeurs à l'aide des données combinées des trois études et de toutes les doses (N=162, NEURONTIN ; N=89, placebo) a également montré un avantage significatif de NEURONTIN par rapport au placebo dans la réduction de la fréquence des crises tonico-cloniques secondairement généralisées.
Dans deux des trois études contrôlées, plus d'une dose de NEURONTIN a été utilisée. Dans chaque étude, les résultats n'ont pas montré une augmentation constante de la réponse à la dose. Cependant, en regardant à travers les études, une tendance à l'augmentation de l'efficacité avec l'augmentation de la dose est évidente (voir Figure 4).
Figure 4. Taux de répondeurs chez les patients recevant NEURONTIN à 600 mg, exprimé sous forme de différence par rapport au placebo selon la dose et l'étude : études sur le traitement d'appoint chez des patients âgés de ≥ 12 ans présentant des crises partielles
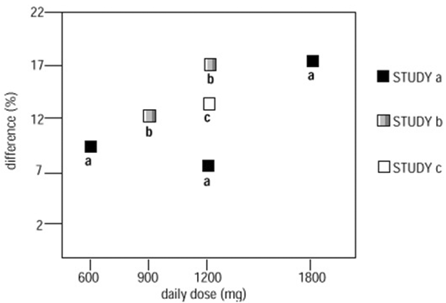
Dans la figure, l'ampleur de l'effet du traitement, mesurée sur l'axe Y en termes de différence dans la proportion de patients recevant de la gabapentine et du groupe placebo atteignant une réduction de 50 % ou plus de la fréquence des crises par rapport au départ, est tracée par rapport à la dose quotidienne de gabapentine administrée (axe X).
Bien qu'aucune analyse formelle par sexe n'ait été effectuée, les estimations de la réponse (taux de réponse) dérivées des essais cliniques (398 hommes, 307 femmes) indiquent qu'il n'existe aucune différence importante entre les sexes. Il n'y avait pas de tendance cohérente indiquant que l'âge avait un effet sur la réponse à NEURONTIN. Il y avait un nombre insuffisant de patients de races autres que caucasiennes pour permettre une comparaison de l'efficacité entre les groupes raciaux.
Une quatrième étude chez des patients pédiatriques âgés de 3 à 12 ans a comparé 25 à 35 mg/kg/jour de NEURONTIN (N=118) à un placebo (N=127). Pour toutes les crises partielles dans la population en intention de traiter, le taux de réponse a été statistiquement significativement meilleur pour le groupe NEURONTIN (-0,146) que pour le groupe placebo (-0,079). Pour la même population, le taux de répondeur pour NEURONTIN (21 %) n'a pas été significativement différent du placebo (18 %).
Une étude menée chez des patients pédiatriques âgés de 1 mois à 3 ans a comparé 40 mg/kg/jour de NEURONTIN (N = 38) à un placebo (N = 38) chez des patients recevant au moins un antiépileptique commercialisé et ayant eu au moins une crise partielle pendant la période de dépistage (dans les 2 semaines précédant la ligne de base). Les patients avaient jusqu'à 48 heures de référence et jusqu'à 72 heures de surveillance vidéo EEG en double aveugle pour enregistrer et compter la survenue de crises. Aucune différence statistiquement significative n'a été observée entre les traitements, que ce soit en termes de taux de réponse ou de taux de réponse.
INFORMATIONS PATIENTS
NEURONTIN (Neu ron'tin) (Gabapentine) Capsules, comprimés et solution buvable
Quelles sont les informations les plus importantes que je devrais connaître sur NEURONTIN ?
N'arrêtez pas de prendre NEURONTIN 300 mg sans en parler au préalable avec votre professionnel de la santé.
L'arrêt brutal de NEURONTIN peut entraîner de graves problèmes.
NEURONTIN 400mg peut provoquer des effets indésirables graves dont :
1. Pensées suicidaires. Comme les autres médicaments antiépileptiques, NEURONTIN 100 mg peut provoquer des pensées ou des actions suicidaires chez un très petit nombre de personnes, environ 1 personne sur 500.
Appelez immédiatement un fournisseur de soins de santé si vous présentez l'un de ces symptômes, en particulier s'ils sont nouveaux, s'aggravent ou vous inquiètent :
- pensées sur le suicide ou la mort
- tentatives de suicide
- dépression nouvelle ou pire
- anxiété nouvelle ou pire
- se sentir agité ou agité
- crises de panique
- troubles du sommeil (insomnie)
- irritabilité nouvelle ou pire
- agir de manière agressive, être en colère ou violent
- agir sur des impulsions dangereuses
- une augmentation extrême de l'activité et de la conversation (manie)
- autres changements inhabituels de comportement ou d'humeur
Comment puis-je surveiller les premiers symptômes de pensées et d'actions suicidaires ?
- Faites attention à tout changement, en particulier les changements soudains, dans l'humeur, les comportements, les pensées ou les sentiments.
- Gardez toutes les visites de suivi avec votre fournisseur de soins de santé comme prévu.
Appelez votre fournisseur de soins de santé entre les visites au besoin, surtout si vous vous inquiétez des symptômes.
N'arrêtez pas de prendre NEURONTIN sans en parler d'abord à un professionnel de la santé.
- L'arrêt brutal de NEURONTIN 100mg peut entraîner de graves problèmes. L'arrêt soudain d'un médicament contre les crises chez un patient épileptique peut provoquer des crises qui ne s'arrêteront pas (état de mal épileptique).
- Les pensées ou actions suicidaires peuvent être causées par des choses autres que des médicaments. Si vous avez des pensées ou des actions suicidaires, votre fournisseur de soins de santé peut rechercher d'autres causes.
2. Changements de comportement et de pensée - L'utilisation de NEURONTIN 100 mg chez les enfants de 3 à 12 ans peut entraîner des changements émotionnels, un comportement agressif, des problèmes de concentration, de l'agitation, des modifications des performances scolaires et de l'hyperactivité.
3. NEURONTIN peut provoquer des réactions allergiques graves, voire mortelles qui peuvent affecter votre peau ou d'autres parties de votre corps telles que votre foie ou vos cellules sanguines. Cela peut entraîner une hospitalisation ou l'arrêt de NEURONTIN. Vous pouvez ou non avoir une éruption cutanée avec une réaction allergique causée par NEURONTIN. Appelez immédiatement un fournisseur de soins de santé si vous présentez l'un des symptômes suivants :
- démangeaison de la peau
- urticaire
- difficulté à respirer
- fièvre
- glandes enflées qui ne disparaissent pas
- gonflement du visage, des lèvres, de la gorge ou de la langue
- jaunissement de la peau ou du blanc des yeux
- ecchymoses ou saignements inhabituels
- grande fatigue ou faiblesse
- douleurs musculaires inattendues
- infections fréquentes
Ces symptômes peuvent être les premiers signes d'une réaction grave. Un professionnel de la santé doit vous examiner pour décider si vous devez continuer à prendre NEURONTIN.
4. Problèmes respiratoires graves. Des problèmes respiratoires graves peuvent survenir lorsque NEURONTIN est pris avec d'autres médicaments susceptibles de provoquer une somnolence sévère ou une diminution de la conscience, ou lorsqu'il est pris par une personne qui a déjà des problèmes respiratoires. Surveillez l'augmentation de la somnolence ou la diminution de la respiration au début de NEURONTIN 300 mg ou lorsque la dose est augmentée. Obtenez de l'aide immédiatement si des problèmes respiratoires surviennent.
Qu'est-ce que NEURONTIN 400mg ?
NEURONTIN 400 mg est un médicament délivré sur ordonnance utilisé pour traiter :
- Douleur causée par des nerfs endommagés (douleur post-zostérienne) qui suit la guérison du zona (une éruption cutanée douloureuse qui survient après une infection à l'herpès zoster) chez l'adulte.
- Crises partielles lorsqu'il est pris avec d'autres médicaments chez les adultes et les enfants de 3 ans et plus souffrant de crises.
Qui ne devrait pas prendre NEURONTIN ?
Ne prenez pas NEURONTIN si vous êtes allergique à la gabapentine ou à l'un des autres composants contenus dans NEURONTIN. Voir la fin de ce guide de médication pour une liste complète d'ingrédients dans NEURONTIN.
Que dois-je dire à mon professionnel de la santé avant de prendre NEURONTIN 300 mg ?
Avant de prendre NEURONTIN 400 mg, informez votre professionnel de la santé si vous :
- avez ou avez eu des problèmes rénaux ou êtes sous hémodialyse
- souffrez ou avez souffert de dépression, de troubles de l'humeur ou de pensées ou comportements suicidaires
- avoir le diabète
- avoir des problèmes respiratoires
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si NEURONTIN peut nuire à votre bébé à naître. Informez immédiatement votre fournisseur de soins de santé si vous tombez enceinte pendant que vous prenez NEURONTIN. Vous et votre professionnel de la santé déciderez si vous devez prendre NEURONTIN 100 mg pendant votre grossesse. Registre des grossesses : Si vous tombez enceinte pendant que vous prenez NEURONTIN, parlez à votre fournisseur de soins de santé de l'inscription au registre des grossesses des médicaments antiépileptiques nord-américains (NAAED). Le but de ce registre est de recueillir des informations sur la sécurité des médicaments antiépileptiques pendant la grossesse. Vous pouvez vous inscrire à ce registre en composant le 1-888-233-2334.
- allaitez ou envisagez d'allaiter. NEURONTIN peut passer dans le lait maternel. Vous et votre fournisseur de soins de santé devez décider comment vous allez nourrir votre bébé pendant que vous prenez NEURONTIN.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Informez en particulier votre professionnel de la santé si vous prenez des analgésiques opioïdes (comme l'oxycodone), des médicaments contre l'anxiété (comme le lorazépam) ou l'insomnie (comme le zolpidem), ou des médicaments qui vous rendent somnolent.
Vous pouvez avoir un risque plus élevé d'étourdissements, de somnolence ou de problèmes respiratoires si ces médicaments sont pris avec NEURONTIN.
La prise de NEURONTIN 100 mg avec certains autres médicaments peut provoquer des effets indésirables ou affecter leur efficacité. Ne commencez pas ou n'arrêtez pas d'autres médicaments sans en parler à votre fournisseur de soins de santé.
Connaissez les médicaments que vous prenez. Gardez-en une liste et montrez-la à votre fournisseur de soins de santé et à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je prendre NEURONTIN 400 mg ?
- Prenez NEURONTIN exactement comme prescrit. Votre professionnel de la santé vous indiquera la quantité de NEURONTIN 600 mg à prendre.
- Ne changez pas votre dose de NEURONTIN sans en parler à votre fournisseur de soins de santé.
- Si vous prenez des comprimés NEURONTIN et que vous cassez un comprimé en deux, la moitié inutilisée du comprimé doit être prise à la prochaine dose prévue. Les demi-comprimés non utilisés dans les 28 jours suivant la rupture doivent être jetés.
- Prenez les capsules NEURONTIN avec de l'eau.
- Les comprimés NEURONTIN peuvent être pris avec ou sans aliments. Si vous prenez un antiacide contenant de l'aluminium et du magnésium, tel que Maalox®, Mylanta®, Gelusil®, Gaviscon® ou Di-Gel®, vous devez attendre au moins 2 heures avant de prendre votre prochaine dose de NEURONTIN. Si vous avez pris trop de NEURONTIN 600 mg, appelez immédiatement votre fournisseur de soins de santé ou votre centre antipoison local au 1-800-222-1222.
Que dois-je éviter pendant que je prends NEURONTIN ?
- Ne buvez pas d'alcool ou ne prenez pas d'autres médicaments qui vous rendent somnolent ou étourdi pendant que vous prenez NEURONTIN sans en parler au préalable avec votre fournisseur de soins de santé. La prise de NEURONTIN 600 mg avec de l'alcool ou des médicaments qui provoquent de la somnolence ou des étourdissements peut aggraver votre somnolence ou vos étourdissements.
- Ne conduisez pas, n'utilisez pas de machinerie lourde ou ne faites pas d'autres activités dangereuses jusqu'à ce que vous sachiez comment NEURONTIN 100 mg vous affecte. NEURONTIN 600 mg peut ralentir votre réflexion et votre motricité.
Quels sont les effets secondaires possibles de NEURONTIN 300mg ?
NEURONTIN 100mg peut provoquer des effets indésirables graves dont :
Voir « Quelle est l'information la plus importante que je devrais connaître sur NEURONTIN ? »
- problèmes de conduite lors de l'utilisation de NEURONTIN. Voir « Ce que je devrais éviter en prenant Neurontin 600 mg ? »
- somnolence et étourdissements, qui pourraient augmenter la survenue de blessures accidentelles, y compris les chutes
- Les effets indésirables les plus courants de NEURONTIN 100 mg incluent :
- manque de coordination
- infection virale
- se sentir somnolent
- nausée et vomissements
- difficulté à parler
- tremblement
- gonflement, généralement des jambes et des pieds
- se sentir fatigué
- fièvre
- mouvements saccadés
- difficulté de coordination
- vision double
- mouvement oculaire inhabituel
Dites à votre fournisseur de soins de santé si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de NEURONTIN. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment conserver NEURONTIN ?
- Conservez NEURONTIN 400mg Capsules et Comprimés entre 68°F et 77°F (20°C à 25°C).
- Conservez la solution orale NEURONTIN 400 mg au réfrigérateur entre 36 °F et 46 °F (2 °C et 8 °C).
Gardez NEURONTIN 600 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de NEURONTIN
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. Ne pas utiliser NEURONTIN 300mg pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas NEURONTIN à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Ce Guide de Médication résume les informations les plus importantes sur NEURONTIN. Si vous souhaitez plus d'informations, parlez-en à votre fournisseur de soins de santé. Vous pouvez demander à votre fournisseur de soins de santé ou à votre pharmacien des informations sur NEURONTIN 100 mg qui ont été rédigées pour les professionnels de la santé.
Pour plus d'informations, rendez-vous sur http://www.pfizer.com ou appelez le 1-800-438-1985.
Quels sont les ingrédients de NEURONTIN 400mg ?
Ingrédient actif: la gabapentine
Ingrédients inactifs dans les gélules : lactose, amidon de maïs, talc, gélatine, dioxyde de titane et FD&C bleu n° 2.
L'enveloppe de la gélule de 300 mg contient également : oxyde de fer jaune.
L'enveloppe de la gélule de 400 mg contient également : de l'oxyde de fer rouge et de l'oxyde de fer jaune.
Ingrédients inactifs dans les comprimés : poloxamère 407, copovidone, amidon de maïs, stéarate de magnésium, hydroxypropylcellulose, talc et cire de candelilla
Ingrédients inactifs de la solution buvable : glycérine, xylitol, eau purifiée et arôme artificiel.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
