Imdur 40mg, 20mg, 30mg, 60mg Isosorbide Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Imdur 30 mg et comment est-il utilisé ?
Imdur 30 mg est un médicament sur ordonnance utilisé pour traiter les symptômes de la douleur thoracique (angine de poitrine). Imdur 30 mg peut être utilisé seul ou avec d'autres médicaments.
Imdur 20mg appartient à une classe de médicaments appelés Nitrates, Angine.
On ne sait pas si Imdur 60 mg est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles d'Imdur?
Les effets secondaires d'Imdur comprennent:
- évanouissement,
- battements cardiaques rapides, irréguliers ou forts,
- éruption,
- démangeaison,
- gonflement du visage, de la langue et de la gorge,
- étourdissements sévères et
- difficulté à respirer
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Imdur 30mg incluent:
- mal de tête,
- vertiges,
- étourdissements, et
- nausée
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Imdur. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
Le mononitrate d'isosorbide (ISMN), un nitrate organique et le principal métabolite biologiquement actif du dinitrate d'isosorbide (ISDN), est un vasodilatateur ayant des effets sur les artères et les veines.
Les comprimés IMDUR®, pour administration orale, contiennent 30 mg, 60 mg ou 120 mg de mononitrate d'isosorbide dans une formulation à libération prolongée. De plus, chaque comprimé contient les ingrédients inactifs suivants : dioxyde de silicium colloïdal, huile de ricin hydrogénée, hypromellose, lactose monohydraté, stéarate de magnésium, cellulose microcristalline et talc.
La formule moléculaire de l'ISMN est C6H9NO6 et le poids moléculaire est de 191,14. Le nom chimique de l'ISMN est 1,4:3,6-dianhydro-,D-glucitol 5-nitrate ; le composé a la formule structurale suivante :
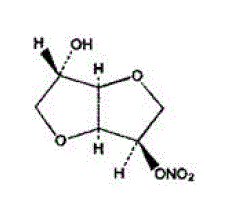
L'ISMN est un composé blanc, cristallin, inodore, stable à l'air et en solution, avec un point de fusion d'environ 90°C et un pouvoir rotatoire de +144° (2% dans l'eau, 20°C).
Le mononitrate d'isosorbide est librement soluble dans l'eau, l'éthanol, le méthanol, le chloroforme, l'acétate d'éthyle et le dichlorométhane.
LES INDICATIONS
Les comprimés IMDUR sont indiqués pour la prévention de l'angine de poitrine due à une maladie coronarienne. Le début d'action du mononitrate d'isosorbide par voie orale n'est pas suffisamment rapide pour que ce produit soit utile pour faire avorter un épisode angineux aigu.
DOSAGE ET ADMINISTRATION
La dose initiale recommandée de comprimés IMDUR est de 30 mg (administrée en un seul comprimé de 30 mg ou en 1/2 d'un comprimé de 60 mg) ou de 60 mg (administrée en un seul comprimé) une fois par jour. Après plusieurs jours, la posologie peut être augmentée à 120 mg (administrée sous forme d'un seul comprimé de 120 mg ou de deux comprimés de 60 mg) une fois par jour. Rarement, 240 mg peuvent être nécessaires. La dose quotidienne de comprimés IMDUR doit être prise le matin au lever. Les comprimés à libération prolongée IMDUR ne doivent pas être mâchés ni écrasés et doivent être avalés avec un demi-verre de liquide. Ne cassez pas le comprimé de 30 mg.
COMMENT FOURNIE
Comprimés à libération prolongée IMDUR 30 mg sont des comprimés blancs en forme de gélule sécables sur une face et gravés « IMDUR » sur la face non sécable. Ils sont fournis comme suit :
Bouteilles de 100 CDN 0085-1374-01
Comprimés à libération prolongée IMDUR 60 mg sont des comprimés blancs, en forme de gélule, sécables sur une face avec quot; 60-60" et gravés "IMDUR" sur la face non sécable. Ils se présentent comme suit :
Bouteilles de 100 CDN 0085-2028-01
IMDUR 30 mg comprimés à libération prolongée 120 mg sont des comprimés blancs en forme de gélule gravés « IMDUR » sur une face et « 120 » sur l'autre face. Ils sont fournis comme suit :
Bouteilles de 100 CDN 0085-0091-01
Le magasin à la température de pièce contrôlée 20°-25°C (68°-77°F) [Voir USP].
Fabriqué par : Kremers Urban Pharmaceuticals Inc, Seymour, IN47274, États-Unis. Révisé : décembre 2010
EFFETS SECONDAIRES
Le tableau ci-dessous montre les fréquences des événements indésirables survenus chez > 5 % des sujets dans trois études nord-américaines contrôlées par placebo dans lesquelles les patients du bras de traitement actif ont reçu 30 mg, 60 mg, 120 mg ou 240 mg d'isosorbide. mononitrate sous forme de comprimés IMDUR 60 mg une fois par jour. Entre parenthèses, le même tableau indique les fréquences avec lesquelles ces événements indésirables ont été associés à l'arrêt du traitement. Dans l'ensemble, 8 % des patients ayant reçu 30 mg, 60 mg, 120 mg ou 240 mg de mononitrate d'isosorbide dans les trois études nord-américaines contrôlées par placebo ont interrompu le traitement en raison d'événements indésirables. La plupart d'entre eux ont été interrompus en raison de maux de tête. Les étourdissements étaient rarement associés à l'abandon de ces études. La céphalée semblant être un effet indésirable lié à la dose et ayant tendance à disparaître avec la poursuite du traitement, il est recommandé d'initier le traitement par IMDUR à faibles doses pendant plusieurs jours avant de l'augmenter jusqu'aux niveaux souhaités.
FRÉQUENCE ET ÉVÉNEMENTS INDÉSIRABLES (DISCONTINUÉ) *
De plus, les trois essais nord-américains ont été regroupés avec 11 essais contrôlés menés en Europe. Parmi les 14 essais contrôlés, un total de 711 patients ont été randomisés pour recevoir les comprimés IMDUR. Lorsque les données regroupées ont été examinées, les maux de tête et les étourdissements étaient les seuls événements indésirables signalés par > 5 % des patients. D'autres événements indésirables, signalés chacun par ≤ 5 % des patients exposés et, dans de nombreux cas, de relation incertaine avec le traitement médicamenteux, ont été :
Troubles du système nerveux autonome : Bouche sèche, bouffées de chaleur.
Corps dans son ensemble : Asthénie, dorsalgie, douleur thoracique, œdème, fatigue, fièvre, états grippaux, malaise, frissons.
Troubles cardiovasculaires, généraux : Insuffisance cardiaque, hypertension, hypotension.
Troubles du système nerveux central et périphérique : Étourdissements, céphalées, hypoesthésie, migraine, névrite, parésie, paresthésie, ptosis, tremblement, vertige.
Troubles du système gastro-intestinal Douleurs abdominales, constipation, diarrhée, dyspepsie, flatulence, ulcère gastrique, gastrite, glossite, ulcère gastrique hémorragique, hémorroïdes, selles molles, méléna, nausées, vomissements.
Troubles auditifs et vestibulaires : Maux d'oreilles, acouphènes, perforation de la membrane tympanique.
Troubles de la fréquence cardiaque et du rythme : Arythmie, arythmie auriculaire, fibrillation auriculaire, bradycardie, bloc de branche, extrasystole, palpitations, tachycardie, tachycardie ventriculaire.
Troubles du système hépatique et biliaire : augmentation du SGOT, augmentation du SGPT.
Troubles métaboliques et nutritionnels : Hyperuricémie, hypokaliémie.
Troubles du système musculo-squelettique : Arthralgie, épaule gelée, faiblesse musculaire, douleur musculo-squelettique, myalgie, myosite, trouble tendineux, torticolis.
Troubles myo-, endo-, péricardiques et valvulaires : Angine de poitrine aggravée, souffle cardiaque, bruit cardiaque anormal, infarctus du myocarde, onde Q anormale.
Troubles plaquettaires, hémorragiques et de la coagulation : Purpura, thrombocytopénie.
Troubles psychiatriques Anxiété, troubles de la concentration, confusion, diminution de la libido, dépression, impuissance, insomnie, nervosité, paronirie, somnolence.
Trouble des globules rouges : Anémie hypochrome.
Troubles de la reproduction, femme : Vaginite atrophique, douleurs mammaires.
Troubles du mécanisme de résistance : Infection bactérienne, candidose, infection virale.
Troubles du système respiratoire : Bronchite, bronchospasme, toux, dyspnée, augmentation des expectorations, congestion nasale, pharyngite, pneumonie, infiltration pulmonaire, râles, rhinite, sinusite.
Troubles de la peau et des phanères : Acné, texture anormale des cheveux, augmentation de la transpiration, prurit, éruption cutanée, nodule cutané.
Troubles du système urinaire : Polyurie, calculs rénaux, infection des voies urinaires.
Troubles vasculaires (extracardiaques) : Bouffées vasomotrices, claudication intermittente, ulcère de jambe, varices.
Troubles de la vision : Conjonctivite, photophobie, vision anormale.
Par ailleurs, l'événement indésirable spontané suivant a été rapporté lors de la commercialisation du mononitrate d'isosorbide : syncope.

INTERACTIONS MÉDICAMENTEUSES
Les effets vasodilatateurs du mononitrate d'isosorbide peuvent s'ajouter à ceux d'autres vasodilatateurs. L'alcool, en particulier, s'est avéré présenter des effets additifs de cette variété.
Une hypotension orthostatique symptomatique marquée a été rapportée lorsque des inhibiteurs calciques et des nitrates organiques étaient utilisés en association. Des ajustements de dose de l'une ou l'autre classe d'agents peuvent être nécessaires.
Interactions médicament/test de laboratoire
Les nitrates et les nitrites peuvent interférer avec la réaction colorée de Zlatkis-Zak, provoquant des lectures faussement basses dans les déterminations de cholestérol sérique.
AVERTISSEMENTS
L'amplification des effets vasodilatateurs de l'IMDUR par le sildénafil peut entraîner une hypotension sévère. L'évolution dans le temps et la dose-dépendance de cette interaction n'ont pas été étudiées. Les soins de support appropriés n'ont pas été étudiés, mais il semble raisonnable de traiter cela comme un surdosage en nitrate, avec élévation des extrémités et avec expansion du volume central.
Les avantages de l'ISMN chez les patients atteints d'infarctus aigu du myocarde ou d'insuffisance cardiaque congestive n'ont pas été établis ; étant donné que les effets du mononitrate d'isosorbide sont difficiles à éliminer rapidement, ce médicament n'est pas recommandé dans ces contextes.
Si le mononitrate d'isosorbide est utilisé dans ces conditions, une surveillance clinique ou hémodynamique attentive doit être utilisée pour éviter les risques d'hypotension et de tachycardie.
PRÉCAUTIONS
Général
Une hypotension sévère, en particulier en position debout, peut survenir même avec de petites doses de mononitrate d'isosorbide. Ce médicament doit donc être utilisé avec prudence chez les patients qui peuvent présenter une déplétion volémique ou qui, pour une raison quelconque, sont déjà hypotendus. L'hypotension induite par le mononitrate d'isosorbide peut s'accompagner d'une bradycardie paradoxale et d'une augmentation de l'angine de poitrine.
La thérapie au nitrate peut aggraver l'angor causé par la cardiomyopathie hypertrophique.
Chez les travailleurs industriels qui ont été exposés à long terme à des doses inconnues (vraisemblablement élevées) de nitrates organiques, une tolérance apparaît clairement. Des douleurs thoraciques, des infarctus aigus du myocarde, voire des morts subites sont survenus lors du sevrage temporaire des nitrates chez ces travailleurs, démontrant l'existence d'une véritable dépendance physique. L'importance de ces observations pour l'utilisation clinique de routine du mononitrate d'isosorbide par voie orale n'est pas connue.
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune preuve de cancérogénicité n'a été observée chez les rats exposés au mononitrate d'isosorbide dans leur alimentation à des doses allant jusqu'à 900 mg/kg/jour pendant les 6 premiers mois et 500 mg/kg/jour pendant la durée restante d'une étude dans laquelle des mâles ont reçu une dose jusqu'à 121 semaines et les femelles ont reçu des doses jusqu'à 137 semaines. Aucune preuve de cancérogénicité n'a été observée chez les souris exposées au mononitrate d'isosorbide dans leur régime alimentaire pendant jusqu'à 104 semaines à des doses allant jusqu'à 900 mg/kg/jour.
Le mononitrate d'isosorbide n'a pas produit de mutations géniques (test d'Ames, test de lymphome de souris) ni d'aberrations chromosomiques (tests de lymphocytes humains et de micronoyaux de souris) à des concentrations biologiquement pertinentes.
Aucun effet sur la fertilité n'a été observé dans une étude dans laquelle des rats mâles et femelles ont reçu des doses allant jusqu'à 750 mg/kg/jour en commençant, chez les mâles, 9 semaines avant l'accouplement, et chez les femelles, 2 semaines avant l'accouplement.
Grossesse
Effets tératogènes
Catégorie de grossesse B
Dans les études conçues pour détecter les effets du mononitrate d'isosorbide sur le développement embryo-fœtal, des doses allant jusqu'à 240 ou 248 mg/kg/jour, administrées à des rats et des lapins gravides, n'ont pas été associées à la preuve de tels effets. Ces doses animales sont environ 100 fois la dose humaine maximale recommandée (120 mg chez une femme de 50 kg) lorsque la comparaison est basée sur le poids corporel; lorsque la comparaison est basée sur la surface corporelle, la dose chez le rat est d'environ 17 fois la dose chez l'homme et la dose chez le lapin est d'environ 38 fois la dose chez l'homme. Il n'y a cependant pas d'études adéquates et bien contrôlées chez les femmes enceintes. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, les comprimés IMDUR ne doivent être utilisés pendant la grossesse qu'en cas de nécessité absolue.
Effets non tératogènes
La survie et le développement néonatals et l'incidence des mortinaissances ont été négativement affectés lorsque des rats gravides ont reçu des doses orales de 750 (mais pas 300) mg de mononitrate d'isosorbide/kg/jour pendant la fin de la gestation et la lactation. Cette dose (environ 312 fois la dose humaine lorsque la comparaison est basée sur le poids corporel et 54 fois la dose humaine lorsque la comparaison est basée sur la surface corporelle) a été associée à une diminution du gain de poids et de l'activité motrice de la mère et à des signes d'altération de la lactation.
Mères allaitantes
On ne sait pas si ce médicament est excrété dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, la prudence s'impose lorsque l'ISMN est administré à une mère qui allaite.
Utilisation pédiatrique
La sécurité et l'efficacité de l'ISMN chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Les études cliniques sur les comprimés IMDUR 60 mg n'incluaient pas suffisamment d'informations sur les patients âgés de 65 ans et plus pour déterminer s'ils réagissent différemment des patients plus jeunes. D'autres expériences cliniques rapportées pour IMDUR 20 mg n'ont pas identifié de différences de réponse entre les patients âgés et les patients plus jeunes. L'expérience clinique des nitrates organiques rapportée dans la littérature a identifié un potentiel d'hypotension sévère et une sensibilité accrue aux nitrates chez les personnes âgées. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
Les patients âgés peuvent avoir une fonction baroréceptrice réduite et peuvent développer une hypotension orthostatique sévère lorsque des vasodilatateurs sont utilisés. IMDUR 60 mg doit donc être utilisé avec prudence chez les patients âgés qui peuvent présenter une déplétion volémique, prendre plusieurs médicaments ou qui, pour quelque raison que ce soit, sont déjà hypotendus. L'hypotension induite par le mononitrate d'isosorbide peut s'accompagner d'une bradycardie paradoxale et d'une augmentation de l'angine de poitrine.
Les patients âgés peuvent être plus sensibles à l'hypotension et peuvent être plus à risque de tomber à des doses thérapeutiques de nitroglycérine.
La thérapie au nitrate peut aggraver l'angor causé par la cardiomyopathie hypertrophique, en particulier chez les personnes âgées.
SURDOSAGE
Effets hémodynamiques
Les effets néfastes d'un surdosage en mononitrate d'isosorbide sont généralement le résultat de la capacité du mononitrate d'isosorbide à induire une vasodilatation, un regroupement veineux, un débit cardiaque réduit et une hypotension. Ces changements hémodynamiques peuvent avoir des manifestations protéiformes, y compris une augmentation de la pression intracrânienne, avec tout ou partie des maux de tête lancinants persistants, confusion et fièvre modérée ; vertiges, palpitations ; troubles visuels; nausées et vomissements (éventuellement accompagnés de coliques et même de diarrhée sanglante); syncope (surtout en position debout); faim d'air et dyspnée, suivies plus tard d'un effort ventilatoire réduit ; diaphorèse, avec la peau rouge ou froide et moite ; bloc cardiaque et bradycardie ; paralysie; coma; convulsions et décès.
Les déterminations en laboratoire des taux sériques de mononitrate d'isosorbide et de ses métabolites ne sont pas largement disponibles, et de telles déterminations n'ont, en tout état de cause, aucun rôle établi dans la prise en charge d'un surdosage en mononitrate d'isosorbide.
Il n'y a pas de données suggérant quelle dose de mononitrate d'isosorbide est susceptible de mettre la vie en danger chez l'homme. Chez les rats et les souris, il existe une létalité significative à des doses de 2000 mg/kg et 3000 mg/kg, respectivement.
Aucune donnée n'est disponible pour suggérer des manœuvres physiologiques (p. ex., des manœuvres pour modifier le pH de l'urine) susceptibles d'accélérer l'élimination du mononitrate d'isosorbide. En particulier, la dialyse est connue pour être inefficace pour éliminer le mononitrate d'isosorbide du corps.
Aucun antagoniste spécifique des effets vasodilatateurs du mononitrate d'isosorbide n'est connu et aucune intervention n'est connue. Étant donné que l'hypotension associée à un surdosage en mononitrate d'isosorbide est le résultat d'une veinodilatation et d'une hypovolémie artérielle, un traitement prudent dans cette situation doit être orienté vers une augmentation du volume liquidien central. L'élévation passive des jambes du patient peut être suffisante, mais une perfusion intraveineuse de solution saline normale ou d'un liquide similaire peut également être nécessaire.
L'utilisation d'épinéphrine ou d'autres vasoconstricteurs artériels dans ce contexte est susceptible de faire plus de mal que de bien.
Chez les patients atteints d'insuffisance rénale ou d'insuffisance cardiaque congestive, le traitement entraînant une expansion du volume central n'est pas sans danger. Le traitement d'un surdosage en mononitrate d'isosorbide chez ces patients peut être subtil et difficile, et une surveillance invasive peut être nécessaire.
Méthémoglobinémie
La méthémoglobinémie a été rapportée chez des patients recevant d'autres nitrates organiques, et elle pourrait probablement également se produire comme effet secondaire du mononitrate d'isosorbide. Certes, les ions nitrate libérés au cours du métabolisme du mononitrate d'isosorbide peuvent oxyder l'hémoglobine en méthémoglobine. Cependant, même chez les patients totalement dépourvus d'activité de la cytochrome b réductase, et même en supposant que la fraction nitrate du mononitrate d'isosorbide est appliquée quantitativement à l'oxydation de l'hémoglobine, environ 2 mg/kg de mononitrate d'isosorbide devraient être nécessaires avant que l'un de ces patients ne manifeste une signification clinique ( ≥ 10 %) méthémoglobinémie. Chez les patients ayant une fonction réductase normale, une production importante de méthémoglobine devrait nécessiter des doses encore plus importantes de mononitrate d'isosorbide. Dans une étude au cours de laquelle 36 patients ont reçu 2 à 4 semaines de traitement continu à la nitroglycérine à raison de 3,1 à 4,4 mg/h (équivalent, en dose totale administrée d'ions nitrate, à 7,8 à 11,1 mg de mononitrate d'isosorbide par heure), le taux moyen de méthémoglobine mesuré était de 0,2 % ; celle-ci était comparable à celle observée chez des patients parallèles ayant reçu un placebo.
Nonobstant ces observations, il existe des rapports de cas de méthémoglobinémie importante en association avec des surdoses modérées de nitrates organiques. Aucun des patients concernés n'avait été considéré comme exceptionnellement sensible.
Les niveaux de méthémoglobine sont disponibles dans la plupart des laboratoires cliniques. Le diagnostic doit être suspecté chez les patients qui présentent des signes d'apport d'oxygène altéré malgré un débit cardiaque et une pO2 artérielle adéquats. Classiquement, le sang méthémoglobinémique est décrit comme brun chocolat sans changement de couleur lors de l'exposition à l'air. Lorsque la méthémoglobinémie est diagnostiquée, le traitement de choix est le bleu de méthylène, 1-2 mg/kg par voie intraveineuse.
CONTRE-INDICATIONS
Les comprimés IMDUR 20 mg sont contre-indiqués chez les patients qui ont présenté une hypersensibilité ou des réactions idiosyncrasiques à d'autres nitrates ou nitrites.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le produit IMDUR est une formulation orale à libération prolongée d'ISMN, le principal métabolite actif du dinitrate d'isosorbide ; la majeure partie de l'activité clinique du dinitrate est attribuable au mononitrate.
La principale action pharmacologique de l'ISMN et de tous les nitrates organiques en général est la relaxation des muscles lisses vasculaires, produisant une dilatation des artères et des veines périphériques, en particulier ces dernières. La dilatation des veines favorise l'accumulation périphérique de sang, diminue le retour veineux vers le cœur, réduisant ainsi la pression télédiastolique ventriculaire gauche et la pression capillaire pulmonaire (précharge). La relaxation artériolaire réduit la résistance vasculaire systémique, la pression artérielle systolique et la pression artérielle moyenne (postcharge). La dilatation des artères coronaires se produit également. L'importance relative de la réduction de la précharge, de la réduction de la postcharge et de la dilatation coronarienne reste indéfinie.
Pharmacodynamie
Les schémas posologiques pour la plupart des médicaments utilisés de manière chronique sont conçus pour fournir des concentrations plasmatiques qui sont continuellement supérieures à une concentration minimalement efficace. Cette stratégie est inappropriée pour les nitrates organiques. Plusieurs essais cliniques bien contrôlés ont utilisé des tests d'effort pour évaluer l'efficacité anti-angineuse des nitrates délivrés en continu. Dans la grande majorité de ces essais, les agents actifs étaient indiscernables du placebo après 24 heures (ou moins) de traitement continu. Les tentatives de surmonter la tolérance par escalade de dose, même à des doses bien supérieures à celles utilisées de manière aiguë, ont systématiquement échoué. Ce n'est qu'après plusieurs heures d'absence des nitrates dans l'organisme que leur efficacité anti-angineuse a été restaurée. Les comprimés IMDUR, lors d'une utilisation à long terme sur 42 jours dosés à 120 mg une fois par jour, ont continué à améliorer les performances physiques à 4 heures et à 12 heures après l'administration, mais ses effets (bien que meilleurs que le placebo) sont inférieurs ou au mieux égaux aux effets de la première dose de 60 mg.
Pharmacocinétique et métabolisme
Après administration orale d'ISMN sous forme de solution ou de comprimés à libération immédiate, les concentrations plasmatiques maximales d'ISMN sont atteintes en 30 à 60 minutes, avec une biodisponibilité absolue d'environ 100 %. Après administration intraveineuse, l'ISMN est distribué dans l'eau corporelle totale en environ 9 minutes avec un volume de distribution d'environ 0,6 à 0,7 L/kg. Le mononitrate d'isosorbide est lié à environ 5 % aux protéines plasmatiques humaines et est distribué dans les cellules sanguines et la salive. Le mononitrate d'isosorbide est principalement métabolisé par le foie, mais contrairement au dinitrate d'isosorbide oral, il n'est pas soumis à un métabolisme de premier passage. Le mononitrate d'isosorbide est éliminé par dénitration en isosorbide et glucuronidation sous forme de mononitrate, avec 96 % de la dose administrée excrétée dans l'urine dans les 5 jours et seulement environ 1 % éliminé dans les fèces. Au moins six composés différents ont été détectés dans l'urine, avec environ 2 % de la dose excrétée sous forme inchangée et au moins cinq métabolites. Les métabolites ne sont pas pharmacologiquement actifs. La clairance rénale ne représente qu'environ 4 % de la clairance corporelle totale. La demi-vie d'élimination plasmatique moyenne de l'ISMN est d'environ 5 heures.
La disposition de l'ISMN chez les patients présentant divers degrés d'insuffisance rénale, de cirrhose du foie ou de dysfonctionnement cardiaque a été évaluée et s'est avérée similaire à celle observée chez les sujets sains. La demi-vie d'élimination de l'ISMN n'a pas été prolongée et il n'y a pas eu d'accumulation de médicament chez les patients atteints d'insuffisance rénale chronique après plusieurs doses orales.
La pharmacocinétique et/ou la biodisponibilité des comprimés d'IMDUR 40 mg ont été étudiées chez des volontaires sains et des patients après administration d'une dose unique et de doses multiples. Les données de ces études suggèrent que la pharmacocinétique de l'ISMN administré sous forme de comprimés IMDUR est similaire entre les volontaires sains normaux et les patients souffrant d'angine de poitrine. Dans les études à dose unique et à doses multiples, la pharmacocinétique de l'ISMN était proportionnelle à la dose entre 30 mg et 240 mg.
Dans une étude à doses multiples, l'effet de l'âge sur le profil pharmacocinétique d'IMDUR 60 mg et 120 mg (2 × 60 mg) a été évalué chez des sujets ≥ 45 ans. Les résultats de cette étude indiquent qu'il n'y a pas de différences significatives dans l'une des variables pharmacocinétiques de l'ISMN entre les personnes âgées (≥ 65 ans) et les personnes plus jeunes (45 à 64 ans) pour la dose d'IMDUR de 60 mg. L'administration de comprimés IMDUR 120 mg (2 comprimés de 60 mg toutes les 24 heures pendant 7 jours) a entraîné une augmentation proportionnelle à la dose de la Cmax et de l'ASC, sans modification du Tmax ni de la demi-vie terminale. Le groupe plus âgé (65-74 ans) a montré une clairance orale apparente (Cl/F) inférieure de 30 % après la dose la plus élevée, c'est-à-dire 120 mg, par rapport au groupe plus jeune (45-64 ans) ; Cl/F n'était pas différent entre les deux groupes après le régime de 60 mg. Alors que le Cl/F était indépendant de la dose dans le groupe plus jeune, le groupe plus âgé a montré un Cl/F légèrement inférieur après le régime de 120 mg par rapport au régime de 60 mg. Cependant, les différences entre les deux groupes d'âge n'étaient pas statistiquement significatives. Dans la même étude, les femmes ont montré une légère réduction (15 %) de la clairance lorsque la dose a été augmentée. Les femmes ont montré des ASC et des Cmax plus élevées que les hommes, mais ces différences s'expliquaient par des différences de poids corporel entre les deux groupes. Lorsque les données ont été analysées en utilisant l'âge comme variable, les résultats ont indiqué qu'il n'y avait aucune différence significative dans aucune des variables pharmacocinétiques de l'ISMN entre les personnes âgées (≥ 65 ans) et les personnes plus jeunes (45 à 64 ans). Les résultats de cette étude doivent cependant être considérés avec prudence en raison du faible nombre de sujets dans chaque sous-groupe d'âge et par conséquent du manque de puissance statistique suffisante.
Le tableau suivant résume les principaux paramètres pharmacocinétiques de l'ISMN après l'administration d'une ou plusieurs doses d'ISMN sous forme de solution buvable ou de comprimés IMDUR :
Effets alimentaires
L'influence de la nourriture sur la biodisponibilité de l'ISMN après administration d'une dose unique d'IMDUR comprimés 60 mg a été évaluée dans trois études différentes impliquant soit un petit-déjeuner "léger", soit un petit-déjeuner riche en calories et en graisses. Les résultats de ces études indiquent que la prise alimentaire concomitante peut diminuer le taux (augmentation du Tmax) mais pas l'étendue (AUC) de l'absorption de l'ISMN.
Essais cliniques
Des essais contrôlés avec les comprimés IMDUR ont démontré une activité anti-angineuse après une administration aiguë et chronique. L'administration d'IMDUR 40 mg comprimés une fois par jour, pris tôt le matin au lever, a fourni au moins 12 heures d'activité anti-angineuse.
Dans une étude parallèle contrôlée par placebo, 30, 60, 120 et 240 mg de comprimés IMDUR 60 mg ont été administrés une fois par jour pendant 6 semaines maximum. Avant la randomisation, tous les patients ont suivi une phase placebo en simple aveugle de 1 à 3 semaines pour démontrer la réactivité au nitrate et la reproductibilité de la durée totale de l'exercice sur tapis roulant. Des tests de tolérance à l'effort utilisant le protocole de Bruce ont été effectués avant et 4 et 12 heures après la dose du matin les jours 1, 7, 14, 28 et 42 de la période en double aveugle. Les comprimés d'IMDUR 60 mg à 30 et 60 mg (uniquement les doses évaluées de manière aiguë) ont démontré une augmentation significative par rapport au départ du temps total sur tapis roulant par rapport au placebo à 4 et 12 heures après l'administration de la première dose. Au jour 42, les doses de 120 et 240 mg de comprimés d'IMDUR à 40 mg ont démontré une augmentation significative du temps total sur tapis roulant 4 et 12 heures après l'administration, mais au jour 42, les doses de 30 et 60 mg n'étaient plus différenciables du placebo. Tout au long de l'administration chronique, aucun rebond n'a été observé dans aucun groupe de traitement IMDUR.
Les données regroupées de deux autres essais, comparant les comprimés IMDUR 40 mg à 60 mg une fois par jour, le RNIS 30 mg QID et le placebo QID chez des patients souffrant d'angor chronique stable à l'aide d'un plan croisé randomisé, à double insu et à trois voies ont révélé des augmentations statistiquement significatives de la tolérance à l'exercice fois pour IMDUR 20 mg comprimés par rapport au placebo aux heures 4, 8 et 12 et au RNIS à l'heure 4. Les augmentations de la tolérance à l'exercice au jour 14, bien que statistiquement significatives par rapport au placebo, étaient environ la moitié de celles observées au jour 1 de l'essai .
INFORMATIONS PATIENTS
Les patients doivent être informés que l'efficacité anti-angineuse des comprimés d'IMDUR 60 mg peut être maintenue en suivant attentivement le schéma posologique prescrit. Pour la plupart des patients, cela peut être accompli en prenant la dose au lever.
Comme avec les autres nitrates, des maux de tête quotidiens accompagnent parfois le traitement par le mononitrate d'isosorbide. Chez les patients qui souffrent de ces maux de tête, les maux de tête sont un marqueur de l'activité du médicament. Les patients doivent résister à la tentation d'éviter les céphalées en modifiant le schéma de leur traitement par le mononitrate d'isosorbide, car la disparition des céphalées peut être associée à une perte simultanée d'efficacité anti-angineuse. L'aspirine ou l'acétaminophène soulagent souvent avec succès les maux de tête induits par le mononitrate d'isosorbide sans effet délétère sur l'efficacité anti-angineuse du mononitrate d'isosorbide.
Le traitement par le mononitrate d'isosorbide peut être associé à des étourdissements en position debout, en particulier juste après s'être levé d'une position couchée ou assise. Cet effet peut être plus fréquent chez les patients qui ont également consommé de l'alcool.
