Imitrex 100mg, 25mg, 50mg Sumatriptan Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Imitrex 25 mg et comment est-il utilisé ?
Imitrex 100 mg est un médicament sur ordonnance utilisé pour traiter les symptômes de la migraine et de l'algie vasculaire de la face. Imitrex peut être utilisé seul ou avec d'autres médicaments.
Imitrex 50 mg est un agent antimigraineux, agoniste des récepteurs 5-HT de la sérotonine.
On ne sait pas si Imitrex 50 mg est sûr et efficace chez les enfants de moins de 18 ans et son utilisation n'est pas recommandée chez les patients gériatriques.
Quels sont les effets secondaires possibles d'Imitrex 50mg ?
Imitrex 25 mg peut provoquer des effets secondaires graves, notamment :
- douleurs abdominales soudaines et intenses,
- diarrhée avec ou sans présence de sang,
- fortes douleurs thoraciques,
- douleur à la mâchoire ou à l'épaule,
- essoufflement,
- battements cardiaques irréguliers,
- saisie (convulsions),
- crampes dans les jambes,
- engourdissements ou picotements dans les jambes ou les pieds,
- douleur brûlante dans les jambes ou les pieds,
- sensation de froid dans les jambes ou les pieds,
- changements de couleur dans vos jambes ou vos pieds,
- Douleur à la hanche,
- nausée,
- vomissement,
- transpirer ou frissonner,
- agitation,
- hallucinations,
- fièvre,
- rigidité musculaire,
- perte de coordination,
- engourdissement soudain ou faiblesse d'un côté du corps,
- troubles de l'élocution,
- difficulté à voir,
- mauvais équilibre et
- maux de tête intenses et soudains
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Imitrex comprennent:
- douleur ou oppression dans la poitrine, la gorge ou la mâchoire,
- pression dans n'importe quelle partie de votre corps,
- engourdissement ou fourmillement ,
- sensation de chaud ou de froid,
- vertiges,
- somnolence,
- la faiblesse,
- goût désagréable après l'utilisation du médicament nasal,
- douleur, brûlure, engourdissement ou picotement dans le nez ou la gorge après l'utilisation du médicament nasal, et
- nez qui coule ou congestionné après l'utilisation du médicament nasal
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Imitrex. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
IMITREX 50 mg injectable contient du succinate de sumatriptan, un agoniste sélectif des récepteurs 5-HT1B/1D. Le succinate de sumatriptan est chimiquement désigné sous le nom de succinate de 3-[2-(diméthylamino)éthyl]-N-méthyl-indole5-méthanesulfonamide (1:1) et a la structure suivante :
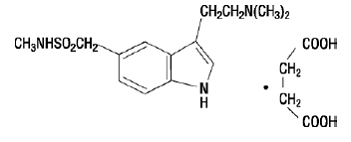
La formule empirique est C14H21N3O2S•C4H6O4, représentant un poids moléculaire de 413,5. Le succinate de sumatriptan est une poudre blanche à blanc cassé qui est facilement soluble dans l'eau et dans une solution saline.
L'injection d'IMITREX est une solution claire, incolore à jaune pâle, stérile et apyrogène pour injection sous-cutanée. Chaque 0,5 mL de solution injectable IMITREX à 8 mg/mL contient 4 mg de sumatriptan (base) sous forme de sel de succinate et 3,8 mg de chlorure de sodium, USP dans de l'eau pour injection, USP. Chaque 0,5 mL de solution injectable IMITREX à 12 mg/mL contient 6 mg de sumatriptan (base) sous forme de succinate et 3,5 mg de chlorure de sodium, USP dans de l'eau pour injection, USP. La plage de pH des deux solutions est d'environ 4,2 à 5,3. L'osmolalité des deux injections est de 291 mOsmol.
LES INDICATIONS
IMITREX® Injection est indiqué chez les adultes pour (1) le traitement aigu de la migraine, avec ou sans aura, et (2) le traitement aigu de l'algie vasculaire de la face.
Limites d'utilisation
- Utiliser uniquement si un diagnostic clair de migraine ou d'algie vasculaire de la face a été établi. Si un patient ne répond pas à la première crise de migraine ou d'algie vasculaire de la face traitée avec IMITREX 50 mg injectable, reconsidérez le diagnostic avant l'administration d'IMITREX injectable pour traiter toute crise ultérieure.
- IMITREX Injection n'est pas indiqué pour la prévention des crises de migraine ou d'algie vasculaire de la face.
DOSAGE ET ADMINISTRATION
Informations sur le dosage
La dose unique maximale recommandée pour un adulte d'IMITREX 25 mg injectable pour le traitement aigu de la migraine ou de l'algie vasculaire de la face est de 6 mg injectés par voie sous-cutanée. Pour le traitement de la migraine, si les effets indésirables limitent la dose, des doses plus faibles (1 mg à 5 mg) peuvent être utilisées [voir Etudes cliniques ]. Pour le traitement de l'algie vasculaire de la face, l'efficacité de doses plus faibles n'a pas été établie.
La dose cumulée maximale pouvant être administrée en 24 heures est de 12 mg, en deux injections de 6 mg séparées d'au moins 1 heure. Une deuxième dose de 6 mg ne doit être envisagée que si une certaine réponse à une première injection a été observée.
Administration à l'aide du stylo IMITREX STATdose Pen®
Un dispositif auto-injecteur (IMITREX 25mg STATdose Pen) est disponible pour une utilisation avec des cartouches de seringues préremplies de 4 mg et 6 mg. Avec cet appareil, l'aiguille pénètre d'environ 1/4 de pouce (5 à 6 mm). L'injection est destinée à être administrée par voie sous-cutanée et l'administration intramusculaire ou intravasculaire doit être évitée. Informez les patients sur l'utilisation appropriée du stylo STATdose IMITREX 100 mg et demandez-leur d'utiliser des sites d'injection avec une peau et une épaisseur sous-cutanée adéquates pour s'adapter à la longueur de l'aiguille.
Administration de doses d'IMITREX autres que 4 ou 6 mg
Chez les patients recevant des doses autres que 4 mg ou 6 mg, utiliser le flacon unidose de 6 mg ; n'utilisez pas le stylo STATdose IMITREX 50 mg. Inspectez visuellement le flacon à la recherche de particules et de décoloration avant l'administration. Ne pas utiliser si des particules et des décolorations sont notées.
COMMENT FOURNIE
Formes posologiques et points forts
- Injection : cartouches de seringues préremplies à dose unique de 4 mg et 6 mg à utiliser avec le stylo IMITREX STATdose.
- Solution injectable : flacon unidose de 6 mg.
Stockage et manutention
IMITREX 100 mg injectable contient du sumatriptan (base) sous forme de succinate et se présente sous la forme d'une solution limpide, incolore à jaune pâle, stérile et apyrogène, comme suit :
Seringue préremplie et/ou stylo auto-injecteur
Chaque boîte contient une notice d'information pour le patient et des instructions d'utilisation pour le patient.
IMITREX 100 mg STATdose System®, 4 mg , contenant 1 stylo STATdose IMITREX 25 mg, 2 cartouches de seringues préremplies unidoses et 1 étui de transport ( CDN 0173-0739-00).
IMITREX 100mg Système STATdose, 6 mg contenant 1 stylo IMITREX STATdose, 2 cartouches de seringues préremplies à dose unique et 1 étui de transport ( CDN 0173-0479-00).
Deux seringues préremplies unidoses de 4 mg cartouches à utiliser avec le système IMITREX STATdose ( CDN 0173-0739-02).
Deux seringues préremplies unidoses de 6 mg cartouches à utiliser avec le système STATdose IMITREX 25 mg ( CDN 0173-0478-00).
Flacon unidose
IMITREX 25mg Injection flacon unidose (6 mg/0,5 mL) dans des cartons contenant 5 flacons ( CDN 01730449-02).
Conserver entre 2° et 30°C (36° et 86°F). Protéger de la lumière.
GlaxoSmithKline, Research Triangle Park, Caroline du Nord 27709
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont décrits ci-dessous et ailleurs dans l'étiquetage :
- Ischémie myocardique, infarctus du myocarde et angor de Prinzmetal [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Arythmies [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Douleur/oppression/pression à la poitrine, à la gorge, au cou et/ou à la mâchoire [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Événements cérébrovasculaires [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Autres réactions de vasospasme [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Céphalée par abus médicamenteux [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Syndrome sérotoninergique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Augmentation de la pression artérielle [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions d'hypersensibilité [voir CONTRE-INDICATIONS , AVERTISSEMENTS ET PRECAUTIONS ]
- Saisies [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Céphalée migraineuse
Le tableau 1 énumère les effets indésirables survenus dans 2 essais cliniques contrôlés par placebo aux États-Unis chez des patients migraineux (études 2 et 3) après une dose unique de 6 mg d'IMITREX 100 mg injectable ou un placebo. Seulement les réactions qui se sont produites à une fréquence de 2 % ou plus dans les groupes ont traité avec l'Injection IMITREX 6 mgs et qui se sont produites à une fréquence plus grande que le groupe de placebo sont incluses dans la Table 1.
L'incidence des effets indésirables dans les essais cliniques contrôlés n'a pas été affectée par le sexe ou l'âge des patients. Il n'y avait pas suffisamment de données pour évaluer l'impact de la race sur l'incidence des effets indésirables.
Céphalée en grappe
Dans les essais cliniques contrôlés évaluant l'efficacité d'IMITREX 50 mg injectable comme traitement de l'algie vasculaire de la face (études 4 et 5), aucun nouvel effet indésirable significatif n'a été détecté qui n'ait déjà été identifié dans les essais d'IMITREX 100 mg chez des patients souffrant de migraine.
Dans l'ensemble, la fréquence des effets indésirables signalés dans les essais sur l'algie vasculaire de la face était généralement inférieure à celle des essais sur la migraine. Les exceptions incluent les cas de paresthésie (5 % IMITREX, 0 % placebo), de nausées et de vomissements (4 % IMITREX, 0 % placebo) et de bronchospasme (1 % IMITREX 50 mg, 0 % placebo).
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation des comprimés IMITREX 50 mg, du spray nasal IMITREX et de l'injection IMITREX 50 mg. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Cardiovasculaire
Hypotension, palpitations.
Neurologique
Dystonie, tremblement.
INTERACTIONS MÉDICAMENTEUSES
Médicaments contenant de l'ergot
Il a été rapporté que les médicaments contenant de l'ergot provoquent des réactions vasospastiques prolongées. Étant donné que ces effets peuvent être additifs, l'utilisation de médicaments contenant de l'ergotamine ou de type ergot (comme la dihydroergotamine ou le méthysergide) et d'IMITREX 25 mg injectable dans les 24 heures l'un de l'autre est contre-indiquée.
Inhibiteurs de la monoamine oxydase-A
Les inhibiteurs de la MAO-A multiplient par 2 l'exposition systémique. Par conséquent, l'utilisation d'IMITREX injectable chez les patients recevant des inhibiteurs de la MAO-A est contre-indiquée [voir PHARMACOLOGIE CLINIQUE ].
Autres agonistes 5-HT1
Étant donné que leurs effets vasospastiques peuvent être additifs, la co-administration d'IMITREX injectable et d'autres agonistes 5-HT1 (par exemple, les triptans) dans les 24 heures l'un de l'autre est contre-indiquée.
Inhibiteurs sélectifs de la recapture de la sérotonine/Inhibiteurs de la recapture de la sérotonine et de la noradrénaline et syndrome sérotoninergique
Des cas de syndrome sérotoninergique ont été rapportés lors de la co-administration de triptans et d'ISRS, d'IRSN, d'ATC et d'inhibiteurs de la MAO [voir AVERTISSEMENTS ET PRECAUTIONS ].
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Ischémie myocardique, infarctus du myocarde et angine de Prinzmetal
L'utilisation d'IMITREX injectable est contre-indiquée chez les patients atteints de coronaropathie ischémique ou vasospastique. De rares cas d'effets indésirables cardiaques graves, y compris un infarctus aigu du myocarde, survenant dans les quelques heures suivant l'administration d'IMITREX injectable ont été signalés. Certaines de ces réactions sont survenues chez des patients sans coronaropathie connue. IMITREX 100 mg injectable peut provoquer un vasospasme de l'artère coronaire (angor de Prinzmetal), même chez les patients sans antécédent de coronaropathie.
Effectuez une évaluation cardiovasculaire chez les patients naïfs de triptan qui présentent de multiples facteurs de risque cardiovasculaire (par exemple, augmentation de l'âge, diabète, hypertension, tabagisme, obésité, antécédents familiaux importants de coronaropathie) avant de recevoir l'injection d'IMITREX. S'il existe des signes de coronaropathie ou de vasospasme de l'artère coronaire, IMITREX 100 mg injectable est contre-indiqué. Pour les patients présentant de multiples facteurs de risque cardiovasculaire qui ont une évaluation cardiovasculaire négative, envisagez d'administrer la première dose d'injection IMITREX dans un cadre médicalement supervisé et d'effectuer un électrocardiogramme (ECG) immédiatement après l'administration d'injection IMITREX. Pour ces patients, envisager une évaluation cardiovasculaire périodique chez les utilisateurs intermittents à long terme d'IMITREX 100 mg injectable.
Arythmies
Des troubles du rythme cardiaque menaçant le pronostic vital, y compris la tachycardie ventriculaire et la fibrillation ventriculaire entraînant la mort, ont été signalés dans les heures suivant l'administration d'agonistes 5-HT1. Arrêtez IMITREX Injection si ces troubles se produisent. IMITREX Injection est contre-indiqué chez les patients atteints du syndrome de Wolff-Parkinson-White ou d'arythmies associées à d'autres troubles des voies de conduction accessoires cardiaques.
Douleur/oppression/pression à la poitrine, à la gorge, au cou et/ou à la mâchoire
Des sensations d'oppression, de douleur, de pression et de lourdeur dans le précordium, la gorge, le cou et la mâchoire surviennent fréquemment après le traitement par IMITREX injectable et sont généralement d'origine non cardiaque. Cependant, effectuez une évaluation cardiaque si ces patients présentent un risque cardiaque élevé. L'utilisation d'IMITREX Injection est contre-indiquée chez les patients atteints de coronaropathie et chez ceux atteints de la variante de l'angor de Prinzmetal.
Événements cérébrovasculaires
Des hémorragies cérébrales, des hémorragies sous-arachnoïdiennes et des accidents vasculaires cérébraux sont survenus chez des patients traités par des agonistes 5-HT1, et certains ont entraîné la mort. Dans un certain nombre de cas, il semble possible que les événements cérébrovasculaires aient été primaires, l'agoniste 5-HT1 ayant été administré dans la croyance erronée que les symptômes ressentis étaient une conséquence de la migraine alors qu'ils ne l'étaient pas. De plus, les patients souffrant de migraine peuvent présenter un risque accru de certains événements cérébrovasculaires (p. ex., accident vasculaire cérébral, hémorragie, AIT). Arrêtez IMITREX Injection si un événement cérébrovasculaire se produit.
Avant de traiter les maux de tête chez les patients qui n'ont pas été diagnostiqués auparavant avec une migraine ou une algie vasculaire de la face ou chez les patients qui présentent des symptômes atypiques, exclure d'autres affections neurologiques potentiellement graves. IMITREX Injection est contre-indiqué chez les patients ayant des antécédents d'AVC ou d'AIT.
Autres réactions de vasospasme
IMITREX 25 mg injectable peut provoquer des réactions vasospastiques non coronariennes, telles qu'une ischémie vasculaire périphérique, une ischémie vasculaire gastro-intestinale et un infarctus (se présentant avec des douleurs abdominales et une diarrhée sanglante), un infarctus splénique et le syndrome de Raynaud. Chez les patients qui présentent des symptômes ou des signes évocateurs d'une réaction de vasospasme non coronaire suite à l'utilisation de tout agoniste 5-HT1, exclure une réaction vasospastique avant de recevoir des injections d'IMITREX supplémentaires.
Des cas de cécité transitoire et permanente et de perte de vision partielle importante ont été rapportés avec l'utilisation d'agonistes 5-HT1. Étant donné que les troubles visuels peuvent faire partie d'une crise de migraine, une relation causale entre ces événements et l'utilisation d'agonistes 5-HT1 n'a pas été clairement établie.
Maux de tête par surconsommation de médicaments
La surutilisation de médicaments contre la migraine aiguë (p. ex., ergotamine, triptans, opioïdes ou une combinaison de ces médicaments pendant 10 jours ou plus par mois) peut entraîner une exacerbation des maux de tête (céphalées par abus de médicaments). Les céphalées par abus médicamenteux peuvent se présenter sous la forme de céphalées quotidiennes de type migraineux ou sous la forme d'une augmentation marquée de la fréquence des crises de migraine. La désintoxication des patients, y compris le sevrage des médicaments surutilisés, et le traitement des symptômes de sevrage (qui incluent souvent une aggravation transitoire des maux de tête) peuvent être nécessaires.
Syndrome sérotoninergique
Un syndrome sérotoninergique peut survenir avec IMITREX injectable, en particulier lors de la co-administration avec des inhibiteurs sélectifs du recaptage de la sérotonine (ISRS), des inhibiteurs du recaptage de la sérotonine et de la noradrénaline (IRSN), des antidépresseurs tricycliques (ATC) et des inhibiteurs de la MAO [voir INTERACTIONS MÉDICAMENTEUSES ]. Les symptômes du syndrome sérotoninergique peuvent inclure des modifications de l'état mental (p. ex., agitation, hallucinations, coma), une instabilité autonome (p. ex., tachycardie, tension artérielle labile, hyperthermie), des aberrations neuromusculaires (p. ex., hyperréflexie, incoordination) et/ou des symptômes gastro-intestinaux (p. ex., nausées, vomissements, diarrhée). L'apparition des symptômes survient généralement quelques minutes à quelques heures après l'administration d'une dose nouvelle ou supérieure d'un médicament sérotoninergique. Cesser l'injection d'IMITREX si un syndrome sérotoninergique est suspecté.
Augmentation de la pression artérielle
Une élévation significative de la pression artérielle, y compris une crise hypertensive avec altération aiguë des systèmes d'organes, a été rapportée en de rares occasions chez des patients traités par des agonistes des récepteurs 5-HT1, y compris des patients sans antécédent d'hypertension. Surveiller la tension artérielle chez les patients traités par IMITREX. L'injection d'IMITREX est contre-indiquée dans les patients avec l'hypertension incontrôlée.
Réactions anaphylactiques/anaphylactoïdes
Des réactions anaphylactiques/anaphylactoïdes sont survenues chez des patients recevant IMITREX. De telles réactions peuvent être mortelles ou mortelles. En général, les réactions anaphylactiques aux médicaments sont plus susceptibles de se produire chez les personnes ayant des antécédents de sensibilité à de multiples allergènes. IMITREX 50 mg injectable est contre-indiqué chez les patients ayant des antécédents de réaction d'hypersensibilité à IMITREX.
Saisies
Des convulsions ont été signalées après l'administration d'IMITREX. Certains sont survenus chez des patients ayant des antécédents de convulsions ou des affections concomitantes prédisposant aux convulsions. Il existe également des rapports chez des patients chez lesquels aucun de ces facteurs prédisposants n'est apparent. IMITREX Injection doit être utilisé avec prudence chez les patients ayant des antécédents d'épilepsie ou d'affections associées à un seuil épileptogène abaissé.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( RENSEIGNEMENTS POUR LE PATIENT et mode d'emploi ).
Risque d'ischémie et/ou d'infarctus du myocarde, d'angine de Prinzmetal, d'autres événements liés au vasospasme, d'arythmies et d'événements cérébrovasculaires
Informez les patients qu'IMITREX 50 mg injectable peut provoquer des effets secondaires cardiovasculaires graves tels qu'un infarctus du myocarde ou un accident vasculaire cérébral. Bien que des événements cardiovasculaires graves puissent survenir sans symptômes d'avertissement, les patients doivent être attentifs aux signes et symptômes de douleur thoracique, d'essoufflement, de battements cardiaques irréguliers, d'augmentation significative de la tension artérielle, de faiblesse et de troubles de l'élocution, et doivent demander un avis médical si aucun signe ou symptôme indicatif n'est observé. Informer les patients de l'importance de ce suivi [voir AVERTISSEMENTS ET PRECAUTIONS ].
Réactions anaphylactiques/anaphylactoïdes
Informez les patients que des réactions anaphylactiques/anaphylactoïdes se sont produites chez des patients recevant IMITREX 100 mg injectable. De telles réactions peuvent être mortelles ou mortelles. En général, les réactions anaphylactiques aux médicaments sont plus susceptibles de se produire chez les personnes ayant des antécédents de sensibilité à de multiples allergènes [voir CONTRE-INDICATIONS , AVERTISSEMENTS ET PRECAUTIONS ].
Utilisation concomitante avec d'autres triptans ou médicaments contre l'ergot
Informez les patients que l'utilisation d'IMITREX 50 mg injectable dans les 24 heures suivant un autre triptan ou un médicament de type ergot (y compris la dihydroergotamine ou le méthysergide) est contre-indiquée [voir CONTRE-INDICATIONS , INTERACTIONS MÉDICAMENTEUSES ].
Syndrome sérotoninergique
Avertir les patients du risque de syndrome sérotoninergique avec l'utilisation d'IMITREX injectable ou d'autres triptans, en particulier lors d'une utilisation combinée avec des ISRS, des IRSN, des ATC et des inhibiteurs de la MAO [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
Maux de tête par surconsommation de médicaments
Informez les patients que l'utilisation de médicaments contre la migraine aiguë pendant 10 jours ou plus par mois peut entraîner une exacerbation des maux de tête et encouragez les patients à enregistrer la fréquence des maux de tête et la consommation de médicaments (par exemple, en tenant un journal des maux de tête) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Grossesse
Informez les patientes qu'IMITREX 25 mg injectable ne doit pas être utilisé pendant la grossesse à moins que le bénéfice potentiel ne justifie le risque potentiel pour le fœtus [voir Utilisation dans des populations spécifiques ].
Mères allaitantes
Conseillez aux patientes d'informer leur fournisseur de soins de santé si elles allaitent ou prévoient d'allaiter [voir Utilisation dans des populations spécifiques ].
Capacité à effectuer des tâches complexes
Le traitement par IMITREX 25 mg injectable peut provoquer de la somnolence et des étourdissements ; demander aux patients d'évaluer leur capacité à effectuer des tâches complexes après l'administration d'IMITREX 25 mg injectable.
Comment utiliser IMITREX 100 mg injectable
Fournir aux patients des instructions sur l'utilisation appropriée d'IMITREX 100 mg injectable s'ils sont capables de s'auto-administrer IMITREX 50 mg injectable dans des situations médicalement non supervisées.
Informez les patients que l'aiguille du stylo IMITREX STATdose Pen pénètre d'environ 1/4 de pouce (5 à 6 mm). Informez les patients que l'injection est destinée à être administrée par voie sous-cutanée et que l'administration intramusculaire ou intravasculaire doit être évitée. Demandez aux patients d'utiliser des sites d'injection avec une peau et une épaisseur sous-cutanée adéquates pour s'adapter à la longueur de l'aiguille.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Dans les études de cancérogénicité chez la souris et le rat dans lesquelles le sumatriptan a été administré par voie orale pendant 78 semaines et 104 semaines, respectivement, à des doses allant jusqu'à 160 mg/kg/jour (la dose la plus élevée chez le rat a été réduite de 360 mg/kg/jour au cours de la semaine 21 ). La dose la plus élevée chez les souris et les rats était d'environ 130 et 260 fois la MRHD unique de 6 mg administrée par voie sous-cutanée sur une base mg/m². Il n'y avait aucune preuve chez l'une ou l'autre des espèces d'une augmentation des tumeurs liées à l'administration de sumatriptan.
Mutagenèse
Le sumatriptan s'est avéré négatif dans les tests in vitro (mutation bactérienne inverse [Ames], mutation des cellules géniques chez le hamster chinois V79/HGPRT, aberration chromosomique dans les lymphocytes humains) et in vivo (micronoyau de rat).
Altération de la fertilité
Lorsque le sumatriptan a été administré par injection sous-cutanée à des rats mâles et femelles avant et pendant toute la période d'accouplement, il n'y a eu aucun signe d'altération de la fertilité à des doses allant jusqu'à 60 mg/kg/jour ou environ 100 fois la dose humaine unique de 6 mg sur un base mg/m². Lorsque le sumatriptan (5, 50, 500 mg/kg/jour) a été administré par voie orale à des rats mâles et femelles avant et tout au long de la période d'accouplement, il y a eu une diminution de la fertilité liée au traitement secondaire à une diminution de l'accouplement chez les animaux traités avec des doses supérieure à 5 mg/kg/jour. Il n'est pas clair si cette découverte était due à un effet sur les hommes ou les femmes ou les deux.
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse C
Il n'y a pas d'essais adéquats et bien contrôlés d'IMITREX 50 mg injectable chez les femmes enceintes. Dans des études de toxicité pour le développement chez le rat et le lapin, l'administration orale de sumatriptan à des femelles gravides a été associée à une embryolétalité, des anomalies fœtales et une mortalité des petits. Lorsqu'il est administré par voie intraveineuse à des lapines gestantes, le sumatriptan est embryolétal. IMITREX 100 mg injectable ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
L'administration orale de sumatriptan à des rates gravides pendant la période d'organogenèse a entraîné une incidence accrue d'anomalies des vaisseaux sanguins fœtaux (cervicothoraciques et ombilicaux). La dose la plus élevée sans effet pour la toxicité pour le développement embryofœtal était de 60 mg/kg/jour, soit environ 100 fois la dose humaine maximale recommandée (MRHD) de 6 mg administrée par voie sous-cutanée sur une base de mg/m². L'administration orale de sumatriptan à des lapines gestantes au cours de la période d'organogenèse a entraîné une incidence accrue d'embryolétalité et d'anomalies vasculaires et squelettiques cervicothoraciques fœtales. L'administration intraveineuse de sumatriptan à des lapines gestantes pendant la période d'organogénèse a entraîné une augmentation de l'incidence de l'embryolétalité. Les doses sans effet orales et intraveineuses les plus élevées pour la toxicité développementale chez les lapins étaient de 15 et 0,75 mg/kg/jour, soit environ 50 et 2 fois, respectivement, la MRHD unique de 6 mg administrée par voie sous-cutanée sur une base mg/m².
L'administration orale de sumatriptan à des rats avant et tout au long de la gestation a entraîné une toxicité embryofœtale (diminution du poids corporel, diminution de l'ossification, incidence accrue d'anomalies squelettiques). La dose sans effet la plus élevée était de 50 mg/kg/jour, soit environ 80 fois la MRHD unique de 6 mg administrée par voie sous-cutanée sur une base mg/m². Chez la progéniture de rates gravides traitées par voie orale avec du sumatriptan pendant l'organogenèse, il y a eu une diminution de la survie des ratons. La dose sans effet la plus élevée pour cet effet était de 60 mg/kg/jour, soit environ 100 fois la MRHD unique de 6 mg administrée par voie sous-cutanée sur une base de mg/m². Le traitement par voie orale de rats gravides avec du sumatriptan pendant la dernière partie de la gestation et tout au long de la lactation a entraîné une diminution de la survie des ratons. La dose sans effet la plus élevée pour cette constatation était de 100 mg/kg/jour, soit environ 160 fois la MRHD unique de 6 mg administrée par voie sous-cutanée sur une base de mg/m².
Mères allaitantes
Le sumatriptan est excrété dans le lait maternel après administration sous-cutanée. L'exposition du nourrisson au sumatriptan peut être minimisée en évitant l'allaitement pendant 12 heures après le traitement par IMITREX 50 mg injectable.
Utilisation pédiatrique
L'innocuité et l'efficacité chez les patients pédiatriques n'ont pas été établies. IMITREX 100 mg injectable n'est pas recommandé chez les patients de moins de 18 ans.
Deux essais cliniques contrôlés ont évalué le vaporisateur nasal IMITREX (5 à 20 mg) chez 1 248 migraineux pédiatriques âgés de 12 à 17 ans qui ont traité une seule crise. Les essais n'ont pas établi l'efficacité du spray nasal IMITREX par rapport au placebo dans le traitement de la migraine chez les patients pédiatriques. Les effets indésirables observés dans ces essais cliniques étaient de nature similaire à ceux rapportés dans les essais cliniques chez l'adulte.
Cinq essais cliniques contrôlés (2 essais à attaque unique, 3 essais à attaque multiple) évaluant IMITREX oral (25 à 100 mg) chez des patients pédiatriques âgés de 12 à 17 ans ont recruté un total de 701 migraineux pédiatriques. Ces essais n'ont pas établi l'efficacité d'IMITREX 25 mg par voie orale par rapport à un placebo dans le traitement de la migraine chez les patients pédiatriques. Les effets indésirables observés dans ces essais cliniques étaient de nature similaire à ceux rapportés dans les essais cliniques chez l'adulte. La fréquence de tous les effets indésirables chez ces patients semblait dépendre à la fois de la dose et de l'âge, les patients plus jeunes signalant des réactions plus fréquemment que les patients pédiatriques plus âgés.
L'expérience post-commercialisation documente que des effets indésirables graves sont survenus dans la population pédiatrique après l'utilisation d'IMITREX sous-cutané, oral et/ou intranasal. Ces rapports incluent des réactions de nature similaire à celles rapportées rarement chez les adultes, y compris les accidents vasculaires cérébraux, la perte de vision et la mort. Un infarctus du myocarde a été signalé chez un garçon de 14 ans après l'utilisation d'IMITREX par voie orale; les signes cliniques sont apparus dans la journée suivant l'administration du médicament. Les données cliniques permettant de déterminer la fréquence des effets indésirables graves chez les patients pédiatriques susceptibles de recevoir IMITREX par voie sous-cutanée, orale ou intranasale ne sont pas actuellement disponibles.
Utilisation gériatrique
Les essais cliniques d'IMITREX 100 mg injectable n'ont pas inclus un nombre suffisant de patients âgés de 65 ans et plus pour déterminer s'ils répondent différemment des patients plus jeunes. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la fréquence plus élevée de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
Une évaluation cardiovasculaire est recommandée pour les patients gériatriques qui ont d'autres facteurs de risque cardiovasculaire (par exemple, le diabète, l'hypertension, le tabagisme, l'obésité, de forts antécédents familiaux de coronaropathie) avant de recevoir l'injection IMITREX [voir AVERTISSEMENTS ET PRECAUTIONS ].
SURDOSAGE
Un vasospasme coronaire a été observé après l'administration intraveineuse d'IMITREX 50 mg injectable [voir CONTRE-INDICATIONS ]. D'après les données sur les animaux (chiens à 0,1 g/kg, rats à 2 g/kg), on s'attendrait à ce que des surdosages provoquent des convulsions, des tremblements, une inactivité, un érythème des extrémités, une fréquence respiratoire réduite, une cyanose, une ataxie, une mydriase, des réactions au point d'injection ( desquamation, perte de cheveux et formation de croûtes) et paralysie.
La demi-vie d'élimination du sumatriptan est d'environ 2 heures [voir PHARMACOLOGIE CLINIQUE ] ; par conséquent, la surveillance des patients après un surdosage avec IMITREX Injection doit se poursuivre pendant au moins 10 heures ou pendant que les symptômes ou les signes persistent.
On ne sait pas quel effet l'hémodialyse ou la dialyse péritonéale a sur les concentrations sériques de sumatriptan.
CONTRE-INDICATIONS
L'injection d'IMITREX est contre-indiquée dans les patients avec :
- Maladie ischémique de l'artère coronaire (CAD) (angine de poitrine, antécédents d'infarctus du myocarde ou ischémie silencieuse documentée) ou vasospasme de l'artère coronaire, y compris l'angor de Prinzmetal [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Syndrome de Wolff-Parkinson-White ou arythmies associées à d'autres troubles des voies de conduction accessoires cardiaques [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Antécédents d'accident vasculaire cérébral ou d'accident ischémique transitoire (AIT) ou antécédents d'hémiplégie ou de migraine basilaire car ces patients présentent un risque plus élevé d'accident vasculaire cérébral [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Maladie vasculaire périphérique [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Maladie ischémique intestinale [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Hypertension non contrôlée [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Utilisation récente (c'est-à-dire dans les 24 heures) d'un médicament contenant de l'ergotamine, d'un médicament de type ergot (comme la dihydroergotamine ou le méthysergide) ou d'un autre agoniste de la 5-hydroxytryptamine1 (5-HT1) [voir INTERACTIONS MÉDICAMENTEUSES ].
- Administration concomitante d'un inhibiteur de la monoamine oxydase (MAO)-A ou utilisation récente (dans les 2 semaines) d'un inhibiteur de la MAO-A [voir INTERACTIONS MÉDICAMENTEUSES , PHARMACOLOGIE CLINIQUE ].
- Hypersensibilité à IMITREX (œdème de Quincke et anaphylaxie observés) [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Insuffisance hépatique sévère [voir PHARMACOLOGIE CLINIQUE ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le sumatriptan se lie avec une haute affinité aux récepteurs humains clonés 5-HT1B/1D. Le sumatriptan exerce vraisemblablement ses effets thérapeutiques dans le traitement de la migraine et des céphalées en grappe par le biais d'effets agonistes au niveau des récepteurs 5-HT1B/1D sur les vaisseaux sanguins intracrâniens et les nerfs sensoriels du système trijumeau, ce qui entraîne une constriction des vaisseaux crâniens et une inhibition du neuropeptide pro-inflammatoire. Libération.
Pharmacodynamie
Pression artérielle
Une élévation significative de la pression artérielle, y compris une crise hypertensive, a été rapportée chez des patients avec et sans antécédents d'hypertension [voir AVERTISSEMENTS ET PRECAUTIONS ].
Artères périphériques (petites)
Chez des volontaires sains (N = 18), un essai évaluant les effets du sumatriptan sur la réactivité artérielle périphérique (petits vaisseaux) n'a pas permis de détecter une augmentation cliniquement significative de la résistance périphérique.
Rythme cardiaque
Les augmentations transitoires de la pression artérielle observées chez certains patients lors d'essais cliniques menés au cours du développement du sumatriptan en tant que traitement de la migraine n'ont pas été accompagnées de modifications cliniquement significatives de la fréquence cardiaque.
Pharmacocinétique
Absorption et biodisponibilité
La biodisponibilité du sumatriptan par injection sous-cutanée chez 18 sujets sains de sexe masculin était de 97 % ± 16 % de celle obtenue après injection intraveineuse.
Après une seule injection manuelle sous-cutanée de 6 mg dans la zone deltoïde du bras chez 18 hommes en bonne santé (âge : 24 ± 6 ans, poids : 70 kg), la concentration sérique maximale (Cmax) du sumatriptan était (moyenne ± écart type) 74 ± 15 ng/mL et le temps jusqu'au pic de concentration (Tmax) était de 12 minutes après l'injection (intervalle : 5 à 20 minutes). Dans cet essai, la même dose injectée par voie sous-cutanée dans la cuisse a donné une Cmax de 61 ± 15 ng/mL par injection manuelle contre 52 ± 15 ng/mL par les techniques d'auto-injection. Le Tmax ou la quantité absorbée n'a pas été significativement modifié par le site ou la technique d'injection.
Distribution
La liaison aux protéines, déterminée par dialyse à l'équilibre sur la plage de concentration de 10 à 1 000 ng/mL, est faible, environ 14 % à 21 %. L'effet du sumatriptan sur la liaison aux protéines d'autres médicaments n'a pas été évalué.
Après une injection sous-cutanée de 6 mg dans la région deltoïde du bras chez 9 hommes (âge moyen : 33 ans, poids moyen : 77 kg), le volume de distribution dans le compartiment central du sumatriptan était de 50 ± 8 litres et la demi-vie de distribution était de 15 ± 2 minutes.
Métabolisme
Des études in vitro avec des microsomes humains suggèrent que le sumatriptan est métabolisé par la MAO, principalement l'isoenzyme A. La majeure partie d'une dose radiomarquée de sumatriptan excrétée dans l'urine est le principal métabolite acide indole acétique (IAA) ou le glucuronide IAA, tous deux inactifs.
Élimination
Après une dose sous-cutanée unique de 6 mg, 22 % ± 4 % ont été excrétés dans les urines sous forme inchangée de sumatriptan et 38 % ± 7 % sous forme de métabolite IAA.
Suite à une injection sous-cutanée de 6 mg dans la région deltoïde du bras, la clairance systémique du sumatriptan était de 1 194 ± 149 mL/min et la demi-vie terminale était de 115 ± 19 minutes.
Populations spécifiques
Âge
La pharmacocinétique du sumatriptan chez les personnes âgées (âge moyen : 72 ans, 2 hommes et 4 femmes) et chez les sujets souffrant de migraine (âge moyen : 38 ans, 25 hommes et 155 femmes) était similaire à celle des sujets sains de sexe masculin (âge moyen : 30 ans).
Insuffisance hépatique
L'effet d'une maladie hépatique légère à modérée sur la pharmacocinétique du sumatriptan administré par voie sous-cutanée a été évalué. Il n'y avait pas de différences significatives dans la pharmacocinétique du sumatriptan administré par voie sous-cutanée chez les sujets modérément insuffisants hépatiques par rapport aux témoins sains. La pharmacocinétique du sumatriptan administré par voie sous-cutanée chez les patients présentant une insuffisance hépatique sévère n'a pas été étudiée. L'utilisation d'IMITREX injectable dans cette population est contre-indiquée [voir CONTRE-INDICATIONS ].
Course
La clairance systémique et la Cmax du sumatriptan sous-cutané étaient similaires chez les sujets masculins sains noirs (n = 34) et caucasiens (n = 38).
Études sur les interactions médicamenteuses
Inhibiteurs de la monoamine oxydase-A
Dans un essai portant sur 14 femmes en bonne santé, un prétraitement avec un inhibiteur de la MAO-A a diminué la clairance du sumatriptan sous-cutané, ce qui a entraîné une multiplication par deux de l'aire sous la courbe concentration plasmatique-temps (ASC) du sumatriptan, correspondant à une augmentation de 40 %. dans la demi-vie d'élimination.
Toxicologie animale et/ou pharmacologie
Opacités cornéennes
Les chiens recevant du sumatriptan par voie orale ont développé des opacités cornéennes et des anomalies de l'épithélium cornéen. Des opacités cornéennes ont été observées à la plus faible dose testée, 2 mg/kg/jour, et étaient présentes après 1 mois de traitement. Des défauts dans l'épithélium cornéen ont été notés dans une étude de 60 semaines. Les examens antérieurs de ces toxicités n'ont pas été effectués et les doses sans effet n'ont pas été établies ; cependant, l'exposition plasmatique relative à la plus faible dose testée était d'environ 3 fois l'exposition humaine après une dose sous-cutanée de 6 mg.
Etudes cliniques
Migraine
Dans des essais cliniques contrôlés portant sur plus de 1 000 patients pendant des crises de migraine qui éprouvaient une douleur modérée ou sévère et 1 ou plusieurs des symptômes énumérés dans le tableau 3, le début du soulagement a commencé dès 10 minutes après une injection de 6 mg d'IMITREX 50 mg. Des doses plus faibles d'IMITREX 100 mg injectable peuvent également s'avérer efficaces, bien que la proportion de patients obtenant un soulagement adéquat ait diminué et que la latence de ce soulagement soit plus grande avec des doses plus faibles.
Dans l'étude 1, 6 doses différentes d'IMITREX 100 mg injectable (n = 30 dans chaque groupe) ont été comparées à un placebo (n = 62), dans une conception à attaque unique et à groupes parallèles, la relation dose-réponse s'est avérée être comme indiqué dans le tableau 2.
Dans 2 essais cliniques randomisés et contrôlés par placebo sur IMITREX 25 mg injectable 6 mg chez 1 104 patients souffrant de migraines modérées ou sévères (études 2 et 3), le début du soulagement était inférieur à 10 minutes. Le soulagement des maux de tête, tel que défini par une réduction de la douleur d'un mal de tête sévère ou modérément sévère à léger ou nul, a été obtenu chez 70 % des patients dans l'heure qui a suivi une dose sous-cutanée unique de 6 mg d'IMITREX injectable. Environ 82 % et 65 % des patients traités par IMITREX 6 mg ont eu un soulagement des maux de tête et n'ont plus eu de douleur dans les 2 heures, respectivement.
La table 3 montre les résultats d'efficacité de 1 et 2 heures pour l'Injection IMITREX 6 mgs dans les Études 2 et 3.
IMITREX 100 mg injectable a également soulagé la photophobie, la phonophobie (sensibilité au son), les nausées et les vomissements associés aux crises de migraine. Une efficacité similaire a été observée lorsque les patients se sont auto-administrés l'injection d'IMITREX 50 mg à l'aide du stylo IMITREX 100 mg STATdose.
L'efficacité d'IMITREX Injection n'a pas été affectée par le fait que la migraine soit associée ou non à l'aura, la durée de la crise, le sexe ou l'âge du patient, ou l'utilisation concomitante de médicaments prophylactiques courants contre la migraine (par exemple, les bêta-bloquants).
Céphalée en grappe
L'efficacité d'IMITREX injectable dans le traitement aigu de l'algie vasculaire de la face a été démontrée dans 2 essais croisés randomisés, à double insu, contrôlés par placebo et à 2 périodes (études 4 et 5). Des patients âgés de 21 à 65 ans ont été recrutés et ont reçu pour instruction de traiter un mal de tête modéré à très sévère dans les 10 minutes suivant son apparition. Le soulagement des maux de tête a été défini comme une réduction de la gravité des maux de tête à une douleur légère ou nulle. Dans les deux procès, la proportion d'individus gagnant le soulagement à 10 ou 15 minutes était de façon significative plus grande parmi les patients recevant 6 mgs d'Injection IMITREX comparés avec ceux qui ont reçu le placebo (voir la Table 4).
Une estimation de la probabilité cumulée qu'un patient souffrant d'algie vasculaire de la face obtienne un soulagement après avoir été traité avec IMITREX 25 mg injectable ou un placebo est présentée à la figure 1.
Figure 1 : Délai de soulagement de l'algie vasculaire de la face à partir du moment de l'injectiona 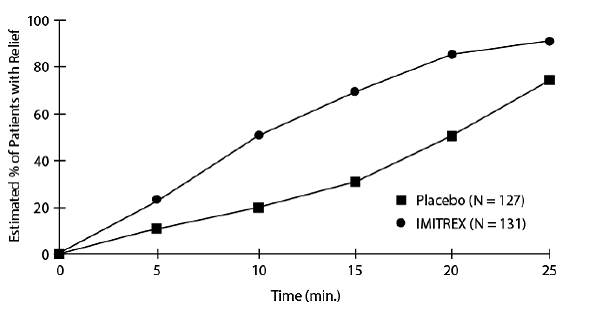
aLa figure utilise le diagramme de survie de Kaplan-Meier (limite de produit). Les patients prenant des médicaments de secours ont été censurés à 15 minutes.
Le graphique a été construit avec des données provenant de patients qui ont soit ressenti un soulagement, soit n'ont pas eu besoin (demandé) de médicament de secours dans les 2 heures suivant le traitement. Par conséquent, les données du graphique ne sont dérivées que d'un sous-ensemble des 258 maux de tête traités (un médicament de secours a été nécessaire dans 52 des 127 maux de tête traités par placebo et 18 des 131 maux de tête traités avec IMITREX 50 mg injectable).
D'autres données suggèrent que le traitement par IMITREX 25 mg injectable n'est pas associé à une augmentation de la récidive précoce des céphalées et a peu d'effet sur l'incidence des céphalées tardives (c'est-à-dire celles qui surviennent après 2, mais avant 18 ou 24 heures).
INFORMATIONS PATIENTS
IMITREX® (IM-i-trex) (succinate de sumatriptan) Solution injectable
Lisez ces informations patient avant de commencer à prendre IMITREX et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre fournisseur de soins de santé au sujet de votre état de santé ou de votre traitement.
Quelles sont les informations les plus importantes que je devrais connaître sur IMITREX ?
IMITREX peut provoquer des effets secondaires graves, notamment :
Crise cardiaque et autres problèmes cardiaques. Les problèmes cardiaques peuvent entraîner la mort.
Arrêtez de prendre IMITREX 25 mg et obtenez immédiatement une aide médicale d'urgence si vous présentez l'un des symptômes suivants d'une crise cardiaque :
- inconfort au centre de la poitrine qui dure plus de quelques minutes, ou qui disparaît et revient
- oppression sévère, douleur, pression ou lourdeur dans la poitrine, la gorge, le cou ou la mâchoire
- douleur ou inconfort dans les bras, le dos, le cou, la mâchoire ou l'estomac
- essoufflement avec ou sans gêne thoracique
- avoir des sueurs froides
- nausées ou vomissements
- se sentir étourdi
IMITREX n'est pas destiné aux personnes présentant des facteurs de risque de maladie cardiaque, à moins qu'un examen cardiaque ne soit effectué et ne montre aucun problème. Vous avez un risque plus élevé de maladie cardiaque si vous :
- avoir une pression artérielle élevée
- avoir un taux de cholestérol élevé
- fumée
- sont en surpoids
- avoir le diabète
- avoir des antécédents familiaux de maladie cardiaque
Qu'est-ce qu'IMITREX ?
IMITREX Injection est un médicament sur ordonnance utilisé pour traiter les migraines aiguës avec ou sans aura et les céphalées en grappe aiguës chez les adultes chez qui on a diagnostiqué une migraine ou des céphalées en grappe.
IMITREX 50 mg n'est pas utilisé pour traiter d'autres types de maux de tête tels que les migraines hémiplégiques (qui vous empêchent de bouger d'un côté de votre corps) ou les migraines basilaires (forme rare de migraine avec aura).
IMITREX 100 mg n'est pas utilisé pour prévenir ou diminuer le nombre de migraines ou d'algies vasculaires de la face que vous avez.
On ne sait pas si IMITREX 100 mg est sûr et efficace chez les enfants de moins de 18 ans.
Qui ne devrait pas prendre IMITREX 100mg ?
Ne prenez jamais IMITREX 50mg si vous avez :
- problèmes cardiaques ou antécédents de problèmes cardiaques
- rétrécissement des vaisseaux sanguins des jambes, des bras, de l'estomac ou des reins (maladie vasculaire périphérique)
- hypertension artérielle non contrôlée
- graves problèmes de foie
- migraines hémiplégiques ou migraines basilaires. Si vous ne savez pas si vous souffrez de ces types de migraines, demandez à votre fournisseur de soins de santé.
- avez eu un accident vasculaire cérébral, des accidents ischémiques transitoires (AIT) ou des problèmes de circulation sanguine
- pris l'un des médicaments suivants au cours des dernières 24 heures :
- almotriptan (AXERT®)
- élétriptan (RELPAX®)
- frovatriptan (FROVA®)
- naratriptan (AMERGE®)
- rizatriptan (MAXALT®, MAXALT-MLT®)
- sumatriptan et naproxène (TREXIMET®)
- ergotamines (CAFERGOT®, ERGOMAR®, MIGERGOT®)
- dihydroergotamine (DHE 45®, MIGRANAL®) Demandez à votre professionnel de la santé si vous n'êtes pas sûr que votre médicament figure dans la liste ci-dessus.
- une allergie au sumatriptan ou à l'un des ingrédients d'IMITREX. Voir la fin de cette notice pour la liste complète des ingrédients d'IMITREX.
Que dois-je dire à mon fournisseur de soins de santé avant de prendre IMITREX ?
Avant de prendre IMITREX, informez votre fournisseur de soins de santé de toutes vos conditions médicales, y compris si vous :
- avoir une pression artérielle élevée
- avoir un taux de cholestérol élevé
- avoir le diabète
- fumée
- sont en surpoids
- avez des problèmes cardiaques ou des antécédents familiaux de problèmes cardiaques ou d'accident vasculaire cérébral
- avoir des problèmes rénaux
- avoir des problèmes de foie
- avez eu de l'épilepsie ou des convulsions
- n'utilisent pas de contraception efficace
- tomber enceinte en prenant IMITREX
- allaitez ou envisagez d'allaiter. IMITREX 25 mg passe dans votre lait maternel et peut être nocif pour votre bébé. Discutez avec votre fournisseur de soins de santé de la meilleure façon de nourrir votre bébé si vous prenez IMITREX.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
IMITREX et certains autres médicaments peuvent interagir les uns avec les autres, entraînant des effets indésirables graves.
Dites surtout à votre fournisseur de soins de santé si vous prenez des médicaments antidépresseurs appelés :
- les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS)
- inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN)
- antidépresseurs tricycliques (ATC)
- les inhibiteurs de la monoamine oxydase (IMAO)
Demandez à votre fournisseur de soins de santé ou à votre pharmacien une liste de ces médicaments si vous n'êtes pas sûr.
Connaissez les médicaments que vous prenez. Conservez-en une liste pour la montrer à votre fournisseur de soins de santé ou à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je prendre IMITREX 100mg ?
- Certaines personnes devraient prendre leur première dose d'IMITREX 25 mg au cabinet de leur professionnel de la santé ou dans un autre établissement médical. Demandez à votre fournisseur de soins de santé si vous devriez prendre votre première dose dans un cadre médical.
- Utilisez IMITREX 50 mg exactement comme votre professionnel de la santé vous l'a indiqué.
- Votre fournisseur de soins de santé peut modifier votre dose. Ne changez pas votre dose sans en parler d'abord avec votre fournisseur de soins de santé.
- Pour les adultes, la dose habituelle est une injection unique administrée juste sous la peau.
- Vous devez administrer une injection dès l'apparition des symptômes de votre mal de tête, mais elle peut être administrée à tout moment pendant une crise de migraine ou d'algie vasculaire de la face.
- Si vous n'obtenez aucun soulagement après la première injection, ne donnez pas une deuxième injection sans en parler d'abord avec votre fournisseur de soins de santé.
- Si votre mal de tête réapparaît ou si vous n'obtenez qu'un certain soulagement après votre première injection, vous pouvez prendre une deuxième injection 1 heure après la première injection, mais pas avant.
- Ne prenez pas plus de 12 mg par période de 24 heures.
- Si vous avez utilisé trop d'IMITREX 25 mg, appelez votre professionnel de la santé ou rendez-vous immédiatement aux urgences de l'hôpital le plus proche.
- Vous devez noter quand vous avez des maux de tête et quand vous prenez IMITREX afin que vous puissiez discuter avec votre fournisseur de soins de santé de la façon dont IMITREX 25 mg agit pour vous.
Que dois-je éviter pendant que je prends IMITREX ?
IMITREX peut provoquer des étourdissements, une faiblesse ou une somnolence. Si vous présentez ces symptômes, ne conduisez pas de voiture, n'utilisez pas de machines et ne faites rien pour lequel vous devez être vigilant.
Quels sont les effets secondaires possibles d'IMITREX 25mg ?
IMITREX peut provoquer des effets secondaires graves. Voir "Quelles sont les informations les plus importantes que je devrais connaître sur IMITREX ?"
Ces effets secondaires graves comprennent :
- changements de couleur ou de sensation dans les doigts et les orteils (syndrome de Raynaud)
- problèmes gastriques et intestinaux (événements ischémiques gastro-intestinaux et coliques). Les symptômes des événements ischémiques gastro-intestinaux et coliques comprennent :
- douleur à l'estomac soudaine ou sévère
- mal de ventre après les repas
- perte de poids
- nausées ou vomissements
- constipation ou diarrhée
- diarrhée sanglante
- fièvre
- problèmes de circulation sanguine dans les jambes et les pieds (ischémie vasculaire périphérique). Les symptômes de l'ischémie vasculaire périphérique comprennent :
- crampes et douleurs dans les jambes ou les hanches
- sensation de lourdeur ou d'oppression dans les muscles de vos jambes
- douleur brûlante ou douloureuse dans les pieds ou les orteils au repos
- engourdissement, picotements ou faiblesse dans les jambes
- sensation de froid ou changements de couleur dans une ou les deux jambes ou pieds
- urticaire (bosses qui démangent); gonflement de la langue, de la bouche ou de la gorge
- maux de tête par abus de médicaments. Certaines personnes qui utilisent trop d'injections d'IMITREX 100 mg peuvent avoir des maux de tête plus graves (maux de tête par abus de médicaments). Si vos maux de tête s'aggravent, votre fournisseur de soins de santé peut décider d'arrêter votre traitement par IMITREX.
- syndrome sérotoninergique. Le syndrome sérotoninergique est un problème rare mais grave qui peut survenir chez les personnes utilisant IMITREX, en particulier si IMITREX 50 mg est utilisé avec des médicaments antidépresseurs appelés ISRS ou IRSN. Appelez immédiatement votre fournisseur de soins de santé si vous présentez l'un des symptômes suivants du syndrome sérotoninergique :
- changements mentaux tels que voir des choses qui ne sont pas là (hallucinations), agitation ou coma
- rythme cardiaque rapide
- changements de la pression artérielle
- température corporelle élevée
- muscles tendus
- difficulté à marcher
- convulsions. Des convulsions sont survenues chez des personnes prenant IMITREX qui n'avaient jamais eu de convulsions auparavant. Discutez avec votre fournisseur de soins de santé de votre risque d'avoir des convulsions pendant que vous prenez IMITREX.
Les effets secondaires les plus courants d'IMITREX 50 mg injectable comprennent :
- douleur ou rougeur au site d'injection
- picotements ou engourdissements dans les doigts ou les orteils
- vertiges
- sensation de chaleur, de chaleur et de brûlure au visage (bouffées de chaleur)
- inconfort ou raideur dans le cou
- se sentir faible, somnolent ou fatigué
Dites à votre fournisseur de soins de santé si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'IMITREX. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver l'injection d'IMITREX ?
- Conservez IMITREX entre 36°F et 86°F (2°C et 30°C).
- Conservez votre médicament à l'abri de la lumière.
- Conservez votre médicament dans l'emballage ou la mallette de transport qui l'accompagne.
Gardez IMITREX et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace d'IMITREX
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans les notices d'information destinées aux patients. N'utilisez pas IMITREX pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas IMITREX 25 mg à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Cette notice d'information destinée aux patients résume les informations les plus importantes sur IMITREX. Si vous souhaitez plus d'informations, parlez-en à votre fournisseur de soins de santé. Vous pouvez demander à votre professionnel de la santé ou à votre pharmacien des informations sur IMITREX rédigées à l'intention des professionnels de la santé.
Pour plus d'informations, rendez-vous sur www.gsk.com ou appelez le 1-888-825-5249.
Quels sont les ingrédients d'IMITREX Injection?
Ingrédient actif : succinate de sumatriptan
Ingrédients inactifs : chlorure de sodium, eau pour injection
Ces informations pour les patients et instructions d'utilisation ont été approuvées par la Food and Drug Administration des États-Unis.
Instructions d'utilisation pour les patients
Système de dosage IMITREX STAT
Lisez ce mode d'emploi pour le patient avant de commencer à utiliser le système IMITREX STATdose. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre fournisseur de soins de santé au sujet de votre état de santé ou de votre traitement. Vous et votre fournisseur de soins de santé devez parler d'IMITREX 25 mg injectable lorsque vous commencez à le prendre et lors des examens réguliers.
Gardez le système IMITREX STATdose hors de la portée des enfants.
Avant d'utiliser le système IMITREX STATdose
Lorsque vous ouvrez pour la première fois la boîte du système IMITREX 25 mg STATdose, la cartouche et le stylo IMITREX STATdose Pen® sont déjà dans la mallette de transport pour votre commodité.
Le gris et le bleu Mallette de transport est utilisé pour stocker le stylo déchargé et le pack de cartouches lorsqu'ils ne sont pas utilisés.
La Paquet de cartouches contient 2 scellés individuellement Cartouches de seringue Chaque cartouche de seringue contient 1 dose d'injection IMITREX® (succinate de sumatriptan). La cartouche de la dose de 4 mg de ce médicament est jaune et la cartouche de la dose de 6 mg est bleue (comme illustré). Des packs de cartouches de recharge sont disponibles.
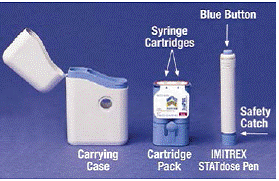
Le gris et le bleu Stylo est utilisé pour injecter automatiquement 1 dose de médicament à partir d'une cartouche de seringue. Ne touchez pas le Bouton bleu jusqu'à ce que vous ayez pressé le stylo contre votre peau pour administrer une dose. Si vous appuyez dessus à tout autre moment, vous risquez de perdre une dose. La Loquet de sécurité empêche le stylet de tirer accidentellement jusqu'à ce que vous soyez prêt. Le stylet ne fonctionnera que lorsque vous faites glisser la partie grise du corps vers la partie bleue. Assurez-vous toujours que la tige d'amorçage blanche ne dépasse pas de l'extrémité du stylo (comme illustré à la figure B) avant de charger une nouvelle cartouche de seringue. S'il dépasse, vous perdrez cette dose.
Comment charger le stylo IMITREX STATdose
Ne chargez pas le stylo tant que vous n'êtes pas prêt à vous faire une injection. Ne touchez pas le bouton bleu sur le dessus du stylo (voir Figure A) pendant que vous chargez le stylo.
Figure A 
Figure B 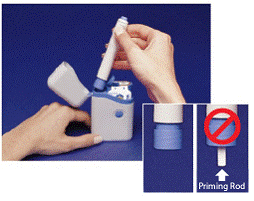
1. Ouvrez le couvercle de la mallette de transport. Les sceaux inviolables sur les 2 cartouches de seringue sont étiquetés « A » et « B » (voir Figure A encart ).
Utilisez toujours la cartouche de seringue marquée « A » avant celle marquée « B » pour vous aider à garder une trace de vos doses. Ne pas utiliser si l'un des sceaux est brisé ou manquant lorsque vous ouvrez la mallette de transport pour la première fois.
2. Détachez l'un des sceaux d'inviolabilité (voir Figure A ). Jetez le sceau. Ouvrez le couvercle sur la cartouche de seringue.
3. Tenez le stylo par les arêtes en haut. Sortez le stylo de l'étui de transport (voir Figure B ).
Assurez-vous que la tige d'amorçage blanche ne dépasse pas de l'extrémité inférieure du stylo (voir Figure B en médaillon ). S'il dépasse, remettez le stylo dans l'étui de transport et appuyez fermement jusqu'à ce que vous sentiez un déclic. Sortez le stylo de la mallette de transport.
Figure C 
4. Placez le stylo dans la cartouche. Tournez-le vers la droite (dans le sens des aiguilles d'une montre) jusqu'à ce qu'il ne tourne plus (environ un demi-tour) (voir Figure C ).
5. Tenez le stylo chargé par les arêtes et tirez-le tout droit (voir Figure D ). Vous devrez peut-être tirer fort sur le stylet, mais c'est normal. N'appuyez pas encore sur le bouton bleu.
Figure D 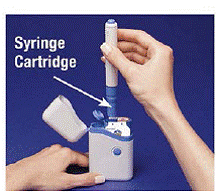
Le stylet est maintenant prêt à être utilisé. Ne pas remettez le stylo chargé dans l'étui de transport car cela endommagerait l'aiguille.
Comment utiliser le stylo doseur IMITREX STAT pour prendre votre médicament
Avant d'injecter votre médicament, choisissez une zone avec une couche de tissu adipeux (voir Figure E ou Figure F). Demandez à votre fournisseur de soins de santé si vous avez une question sur l'endroit où injecter votre médicament.
Pour préparer la zone de peau où IMITREX doit être injecté, essuyez le site d'injection avec un tampon imbibé d'alcool. Ne touchez plus cette zone avant de faire l'injection.
Figure E ou Figure F Figure G 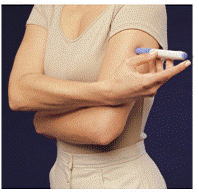
6. Sans appuyer sur le bouton bleu, appuyez fermement le stylo chargé contre la peau afin que le corps gris glisse vers la section bleue qui contient la cartouche de seringue (voir Figure D ). (Cela libère le loquet de sécurité qui empêche le stylo de tirer par erreur jusqu'à ce que vous soyez prêt.)
7. Appuyez sur le bouton bleu. Tenez le stylo immobile pendant au moins 5 secondes . Si le stylo est retiré de la peau trop tôt, tout le médicament ne sortira pas.
8 Après 5 secondes , retirez délicatement le stylo de votre peau. L'aiguille apparaîtra (voir Chiffre G ). Ne touchez pas l'aiguille.
Comment décharger le stylo doseur IMITREX STAT après avoir pris votre médicament
Juste après avoir pris une dose avec le stylo, vous devez remettre la cartouche de seringue usagée dans le paquet de cartouches.
Figure H Figure I et Figure J 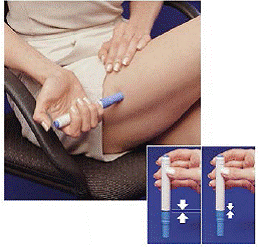
9. Poussez le stylo vers le bas dans le côté vide de la cartouche aussi loin que possible (voir Chiffre H ).
10. Tournez le stylo vers la gauche (dans le sens inverse des aiguilles d'une montre) d'environ un demi-tour jusqu'à ce qu'il se dégage de la cartouche de seringue (voir Je figure ).
11. Retirez le stylo vide de la cartouche (voir Figure J ).
Étant donné que le stylo a maintenant été utilisé, la tige d'amorçage blanche dépassera de l'extrémité inférieure du stylo (voir Figure J ).
12. Fermez le couvercle du pack de cartouches sur la cartouche de seringue usagée. Lorsque les cartouches de seringues usagées sont insérées correctement, le pack de cartouches est un étui de protection jetable pour vous aider à éviter les piqûres d'aiguille et à utiliser les seringues correctement.
13. Remettez le stylet dans l'étui de transport et appuyez fermement dessus jusqu'à ce que vous sentiez un déclic. Fermez le couvercle de la mallette de transport. Cela prépare le stylo pour la prochaine utilisation.
Si le couvercle ne se ferme pas, poussez le stylo vers le bas jusqu'à ce que vous sentiez un déclic. Fermez ensuite le couvercle.
Comment retirer un pack de cartouches usagées
Une fois que les deux cartouches de seringue ont été utilisées, sortez le paquet de cartouches de la mallette de transport. Ne réutilisez ou ne recyclez jamais une cartouche de seringue.
Chiffre K Chiffre L 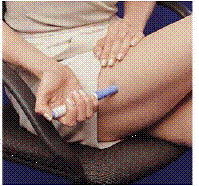
14. Ouvrez le couvercle de la mallette de transport.
15. Tenez l'étui de transport d'une main et appuyez sur les 2 boutons de chaque côté de l'étui de transport (voir Figure K ).
16. Retirez délicatement le pack de cartouches avec l'autre main (voir Chiffre L ).
17. Jetez la cartouche ou jetez-la selon les instructions de votre professionnel de la santé. Il peut y avoir des lois nationales et locales spéciales pour l'élimination des aiguilles et des seringues usagées. Tenir toujours hors de la portée des enfants.
Comment insérer un nouveau pack de cartouches
Figure M Figure N et Figure O 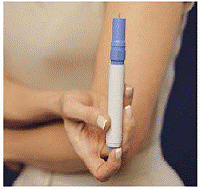
18. Sortez le nouveau pack de cartouches de sa boîte. Ne retirez pas les scellés inviolables (voir Figure M).
19. Placez le pack de cartouches dans la mallette de transport. Faites-le glisser doucement (voir Chiffre N ).
20. Le pack de cartouches s'enclenche lorsque les 2 boutons apparaissent à travers les trous de la mallette de transport (voir Chiffre O ). Ferme la couverture.
Ces informations pour les patients et instructions d'utilisation ont été approuvées par la Food and Drug Administration des États-Unis.
