Maxalt 5mg, 10mg Rizatriptan Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Maxalt et comment est-il utilisé ?
Maxalt est un médicament d'ordonnance utilisé pour traiter les symptômes de la migraine. Maxalt 10 mg peut être utilisé seul ou avec d'autres médicaments.
Maxalt appartient à une classe de médicaments appelés agonistes des récepteurs de la sérotonine 5-HT ; Agents antimigraineux.
On ne sait pas si Maxalt 5 mg est sûr et efficace chez les enfants de moins de 6 ans.
Quels sont les effets secondaires possibles de Maxalt ?
Maxalt peut provoquer des effets secondaires graves, notamment :
- douleurs abdominales soudaines et intenses,
- diarrhée sanglante,
- sensation de froid,
- engourdissement des pieds et des mains,
- Maux de tête sévères,
- Vision floue,
- battant dans votre cou ou vos oreilles,
- douleur ou pression thoracique,
- douleur se propageant à la mâchoire ou à l'épaule,
- nausée,
- transpiration,
- agitation,
- hallucinations,
- fièvre,
- frissons,
- rythme cardiaque rapide,
- rigidité musculaire,
- contractions musculaires,
- perte de coordination,
- nausée,
- perte de coordination,
- vomissement,
- diarrhée,
- engourdissement ou faiblesse soudaine (surtout d'un côté du corps),
- maux de tête intenses et soudains,
- troubles de l'élocution, et
- problèmes de vision ou d'équilibre
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Maxalt incluent :
- vertiges,
- somnolence,
- se sentir fatigué, et
- douleur ou sensation de pression dans la gorge ou la poitrine
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Maxalt. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
MAXALT 10 mg contient du benzoate de rizatriptan, un agoniste sélectif des récepteurs 5-hydroxytryptamine1B/1D (5-HT1B/1D).
Le benzoate de rizatriptan est décrit chimiquement comme : monobenzoate de N,N-diméthyl-5-(1H-1,2,4-triazol-1-ylméthyl)-1Hindole-3-éthanamine et sa formule structurale est :
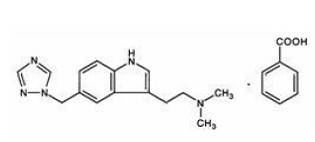
Sa formule empirique est C15H19N5•C7H6O2, représentant un poids moléculaire de la base libre de 269,4. Le benzoate de rizatriptan est un solide cristallin blanc à blanc cassé qui est soluble dans l'eau à environ 42 mg par mL (exprimé en base libre) à 25 °C.
Les comprimés MAXALT à 5 mg et les comprimés à désintégration orale MAXALT-MLT sont disponibles pour une administration orale en dosages de 5 et 10 mg (correspondant à 7,265 mg ou 14,53 mg de sel de benzoate, respectivement). Chaque comprimé comprimé contient les ingrédients inactifs suivants : lactose monohydraté, cellulose microcristalline, amidon prégélatinisé, oxyde de fer (rouge) et stéarate de magnésium. Chaque comprimé lyophilisé à désintégration orale contient les ingrédients inactifs suivants : gélatine, mannitol, glycine, aspartame et arôme de menthe poivrée.
LES INDICATIONS
MAXALT® et MAXALT-MLT® sont indiqués pour le traitement aigu de la migraine avec ou sans aura chez les adultes et chez les patients pédiatriques de 6 à 17 ans.
Limites d'utilisation
- MAXALT ne doit être utilisé que lorsqu'un diagnostic clair de migraine a été établi. Si un patient ne répond pas à la première crise de migraine traitée par MAXALT 10 mg, le diagnostic de migraine doit être reconsidéré avant que MAXALT 5 mg ne soit administré pour traiter toute crise ultérieure.
- MAXALT 10 mg n'est pas indiqué dans la prise en charge de la migraine hémiplégique ou basilaire [voir CONTRE-INDICATIONS ].
- MAXALT 10 mg n'est pas indiqué dans la prévention des crises de migraine.
- L'innocuité et l'efficacité de MAXALT 5 mg n'ont pas été établies pour l'algie vasculaire de la face.
DOSAGE ET ADMINISTRATION
Informations posologiques chez les adultes
La dose initiale recommandée de MAXALT est de 5 mg ou de 10 mg pour le traitement aigu des migraines chez l'adulte. La dose de 10 mg peut fournir un effet plus important que la dose de 5 mg, mais peut avoir un plus grand risque d'effets indésirables [voir Etudes cliniques ].
Redose chez les adultes
Bien que l'efficacité d'une deuxième dose ou de doses ultérieures n'ait pas été établie dans des essais contrôlés par placebo, si la migraine réapparaît, une deuxième dose peut être administrée 2 heures après la première dose. La dose quotidienne maximale ne doit pas dépasser 30 mg par période de 24 heures. L'innocuité du traitement, en moyenne, de plus de quatre maux de tête sur une période de 30 jours n'a pas été établie.
Informations posologiques chez les patients pédiatriques (âgés de 6 à 17 ans)
La posologie chez les patients pédiatriques est basée sur le poids corporel du patient. La dose recommandée de MAXALT 10 mg est de 5 mg chez les patients pesant moins de 40 kg (88 lb) et de 10 mg chez les patients pesant 40 kg (88 lb) ou plus.
L'efficacité et la sécurité d'un traitement avec plus d'une dose de MAXALT dans les 24 heures chez les patients pédiatriques âgés de 6 à 17 ans n'ont pas été établies.
Administration de comprimés à désintégration orale MAXALT-MLT
Pour les comprimés à désintégration orale MAXALT-MLT, l'administration avec un liquide n'est pas nécessaire. Les comprimés à désintégration orale sont emballés dans une plaquette alvéolée à l'intérieur d'un sachet extérieur en aluminium et les patients ne doivent retirer le blister du sachet extérieur que juste avant le dosage. La plaquette thermoformée doit ensuite être ouverte avec les mains sèches et le comprimé à dissolution orale placé sur la langue, où il se dissout et est avalé avec la salive.
Ajustement posologique pour les patients sous propranolol
Patients adultes
Chez les patients adultes prenant du propranolol, seule la dose de 5 mg de MAXALT 5 mg est recommandée, jusqu'à un maximum de 3 doses par période de 24 heures (15 mg) [voir INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
Patients pédiatriques
Pour les patients pédiatriques pesant 40 kg (88 lb) ou plus et prenant du propranolol, une seule dose unique de 5 mg de MAXALT est recommandée (dose maximale de 5 mg sur une période de 24 heures). MAXALT ne doit pas être prescrit aux patients pédiatriques traités au propranolol qui pèsent moins de 40 kg (88 lb) [voir INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
COMMENT FOURNIE
Formes posologiques et points forts
Comprimés MAXALT
- Les comprimés à 5 mg sont des comprimés rose pâle, en forme de capsule, portant le code MRK d'un côté et 266 de l'autre.
- Les comprimés à 10 mg sont des comprimés rose pâle, en forme de capsule, codés MAXALT 5 mg d'un côté et MRK 267 de l'autre.
MAXALT-MLT comprimés à désintégration orale
- Les comprimés à désintégration orale de 5 mg sont des comprimés lyophilisés blancs à blanc cassé, ronds, gravés d'un triangle modifié sur un côté.
- Les comprimés à désintégration orale de 10 mg sont des comprimés lyophilisés ronds, blancs à blanc cassé, gravés d'un carré modifié sur une face.
Stockage et manutention
N° 3732 - Comprimés MAXALT, 5 mg , sont des comprimés rose pâle, en forme de capsule, codés
MRK d'un côté et 266 de l'autre :
CDN 0006-0266-18, boîte de 18 comprimés.
N° 3733 - MAXALT 5mg Comprimés, 10 mg , sont des comprimés rose pâle, en forme de capsule, codés MAXALT 10 mg d'un côté et MRK 267 de l'autre :
CDN 0006-0267-18, boîte de 18 comprimés.
N° 3800 - MAXALT-MLT comprimés à désintégration orale, 5 mg sont des comprimés blancs à blanc cassé, ronds, lyophilisés, à désintégration orale, gravés d'un triangle modifié sur une face et mesurant 10,0 à 11,5 mm (d'un côté à l'autre) avec un arôme de menthe poivrée. Chaque comprimé à dissolution orale est emballé individuellement dans un blister à l'intérieur d'une pochette en aluminium (sachet). Ils sont fournis comme suit :
CDN 0006-3800-18, 6 x unité d'utilisation étui de transport de 3 comprimés à dissolution orale (18 comprimés au total).
N° 3801 - MAXALT-MLT comprimés à désintégration orale, 10 mg , sont des comprimés blancs à blanc cassé, ronds, lyophilisés, à désintégration orale, gravés d'un carré modifié sur une face et mesurant 12,0 à 13,8 mm (d'un côté à l'autre) avec un arôme de menthe poivrée. Chaque comprimé à dissolution orale est emballé individuellement dans un blister à l'intérieur d'une pochette en aluminium (sachet). Ils sont fournis comme suit :
CDN 0006-3801-18, 6 unités d'utilisation étui de transport de 3 comprimés à dissolution orale (18 comprimés au total).
Stockage
Conservez les comprimés MAXALT 5 mg à température ambiante, entre 15 °C et 30 °C (59 °F et 86 °F).
Conservez les comprimés à désintégration orale MAXALT-MLT à température ambiante, entre 15 °C et 30 °C (59 °F et 86 °F).
Distribué par : Merck Sharp & Dohme Corp., une filiale de MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Révisé : octobre 2019
EFFETS SECONDAIRES
Les effets indésirables suivants sont discutés plus en détail dans d'autres sections de l'étiquetage :
- Ischémie myocardique, infarctus du myocarde et angor de Prinzmetal [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Arythmies [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Douleur/oppression/pression à la poitrine, à la gorge, au cou et/ou à la mâchoire [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Événements cérébrovasculaires [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Autres réactions de vasospasme [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Céphalée par abus de médicaments [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Syndrome sérotoninergique [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Augmentation de la tension artérielle [voir AVERTISSEMENTS ET PRECAUTIONS ].
Expérience des essais cliniques
Étant donné que les études cliniques sont menées dans des conditions très variables, les taux d'effets indésirables observés dans les études cliniques d'un médicament ne peuvent pas être directement comparés aux taux des études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Adultes
Incidence dans les essais cliniques contrôlés
Les effets indésirables de MAXALT ont été évalués dans des essais cliniques contrôlés qui ont inclus plus de 3700 patients adultes qui ont reçu des doses uniques ou multiples de comprimés MAXALT. Les effets indésirables les plus fréquents pendant le traitement par MAXALT (≥ 5 % dans l'un ou l'autre groupe de traitement et supérieur au placebo) étaient l'asthénie/fatigue, la somnolence, la douleur/sensation de pression et les étourdissements. Ces effets indésirables semblaient être liés à la dose.
Le tableau 1 répertorie les effets indésirables (incidence ≥ 2 % et supérieure au placebo) après une dose unique de MAXALT 5 mg chez l'adulte.
La fréquence des effets indésirables dans les essais cliniques n'a pas augmenté lorsque jusqu'à trois doses ont été prises en 24 heures. La fréquence des effets indésirables était également inchangée lors de l'utilisation concomitante de médicaments couramment pris pour la prophylaxie de la migraine (y compris le propranolol), de contraceptifs oraux ou d'analgésiques. L'incidence des effets indésirables n'a pas été affectée par l'âge ou le sexe. Il n'y avait pas suffisamment de données pour évaluer l'impact de la race sur l'incidence des effets indésirables.
Autres événements observés en association avec l'administration de MAXALT chez les adultes
Dans la section suivante, les fréquences des événements indésirables moins fréquemment signalés sont présentées et n'ont pas été signalées dans d'autres sections de l'étiquetage. Étant donné que les rapports incluent des événements observés dans des études ouvertes, le rôle de MAXALT 5 mg dans leur causalité ne peut être déterminé de manière fiable. De plus, la variabilité associée à la notification des événements indésirables, la terminologie utilisée pour décrire les événements indésirables, limitent la valeur des estimations quantitatives de fréquence fournies. Les fréquences d'événements sont calculées comme le nombre de patients qui ont utilisé MAXALT et ont signalé un événement divisé par le nombre total de patients exposés à MAXALT (N=3716). Tous les événements signalés sont survenus à une incidence ≥ 1 % ou sont censés être raisonnablement associés à l'utilisation du médicament. Les événements sont en outre classés dans les catégories de systèmes corporels et énumérés par ordre de fréquence décroissante à l'aide des définitions suivantes : les événements indésirables fréquents sont ceux définis comme ceux survenant chez au moins (>) 1/100 patients ; les effets indésirables peu fréquents sont ceux qui surviennent chez 1/100 à 1/1000 patients ; et les effets indésirables rares sont ceux qui surviennent chez moins de 1 patient sur 1 000.
Général: Rare était l'œdème facial. Rares étaient la syncope et l'œdème/l'enflure.
Sensations atypiques : Les sensations de chaleur étaient fréquentes.
Cardiovasculaire: Les palpitations étaient fréquentes. Rares étaient la tachycardie, les extrémités froides et la bradycardie.
Digestif: Fréquent étaient la diarrhée et les vomissements. Rares étaient la dyspepsie, l'œdème de la langue et la distension abdominale.
Musculo-squelettique : Rares étaient la faiblesse musculaire, la raideur, la myalgie et les crampes/spasmes musculaires.
Neurologique/Psychiatrique : L'hypoesthésie, l'euphorie et les tremblements étaient fréquents. Les vertiges, l'insomnie, la confusion/désorientation, les anomalies de la démarche, les troubles de la mémoire et l'agitation étaient peu fréquents.
Respiratoire: La dyspnée était fréquente. Rare était l'œdème pharyngé.
Sens spéciaux : Rares étaient la vision floue et les acouphènes. Rare était un gonflement des yeux.
Peau et appendice cutané : Les bouffées de chaleur étaient fréquentes. Rares étaient la transpiration, le prurit, les éruptions cutanées et l'urticaire. Rare était l'érythème, les bouffées de chaleur.
Le profil des effets indésirables observé avec les comprimés à désintégration orale MAXALT-MLT était similaire à celui observé avec les comprimés MAXALT à 10 mg.
Patients pédiatriques âgés de 6 à 17 ans
Incidence dans les essais cliniques contrôlés chez les patients pédiatriques
Les effets indésirables de MAXALT-MLT ont été évalués dans un essai clinique contrôlé dans le traitement aigu des migraines (étude 7) qui comprenait un total de 1382 patients pédiatriques âgés de 6 à 17 ans, dont 977 (72 %) ont reçu au moins une dose du traitement à l'étude (MAXALT-MLT et/ou placebo) [voir Etudes cliniques ]. L'incidence des effets indésirables signalés chez les patients pédiatriques de l'essai clinique aigu était similaire chez les patients ayant reçu MAXALT et chez ceux ayant reçu le placebo. Le schéma des effets indésirables chez les patients pédiatriques devrait être similaire à celui des adultes.
Autres événements observés en association avec l'administration de MAXALT-MLT chez les patients pédiatriques
Dans la section suivante, les fréquences des événements indésirables moins fréquemment signalés sont présentées. Étant donné que les rapports incluent des événements observés dans des études ouvertes, le rôle de MAXALT-MLT dans leur causalité ne peut être déterminé de manière fiable. De plus, la variabilité associée à la notification des événements indésirables, la terminologie utilisée pour décrire les événements indésirables, limitent la valeur des estimations quantitatives de fréquence fournies.
Les fréquences des événements sont calculées comme le nombre de patients pédiatriques âgés de 6 à 17 ans qui ont utilisé MAXALT-MLT et ont signalé un événement divisé par le nombre total de patients exposés à MAXALT-MLT (N = 1068). Tous les événements signalés sont survenus à une incidence ≥ 1 % ou sont censés être raisonnablement associés à l'utilisation du médicament. Les événements sont en outre classés au sein de la classe de systèmes d'organes et énumérés par ordre décroissant de fréquence en utilisant les définitions suivantes : les événements indésirables fréquents sont ceux qui surviennent chez (>) 1/100 patients pédiatriques ; les effets indésirables peu fréquents sont ceux qui surviennent chez 1/100 à 1/1000 patients pédiatriques ; et les effets indésirables rares sont ceux qui surviennent chez moins de 1 patient sur 1 000.
Général: La fatigue était fréquente.
Troubles de l'oreille et du labyrinthe : Rare était l'hypoacousie.
Problèmes gastro-intestinaux: L'inconfort abdominal était fréquent.
Troubles du système nerveux : Rares étaient la coordination anormale, les troubles de l'attention et la présyncope.
Troubles psychiatriques: Rare était l'hallucination.
Expérience post-commercialisation
La section suivante énumère les événements indésirables potentiellement importants qui se sont produits dans la pratique clinique et qui ont été signalés spontanément à divers systèmes de surveillance. Les événements énumérés comprennent tous sauf ceux déjà énumérés dans d'autres sections de l'étiquetage ou ceux qui sont trop généraux pour être informatifs. Étant donné que les rapports citent des événements signalés spontanément à partir de l'expérience post-commercialisation dans le monde entier, la fréquence des événements et le rôle de MAXALT 5 mg dans leur causalité ne peuvent pas être déterminés de manière fiable.
Neurologique/Psychiatrique : Saisie.
Général: Conditions allergiques, y compris anaphylaxie/réaction anaphylactoïde, œdème de Quincke, respiration sifflante et nécrolyse épidermique toxique [voir CONTRE-INDICATIONS ].
Sens spéciaux : Dysgueusie.
INTERACTIONS MÉDICAMENTEUSES
Propranolol
La dose de MAXALT 5 mg doit être ajustée chez les patients traités par le propranolol, car il a été démontré que le propranolol augmente l'ASC plasmatique du rizatriptan de 70 % [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
Médicaments contenant de l'ergot
Il a été rapporté que les médicaments contenant de l'ergot provoquent des réactions vasospastiques prolongées. Étant donné que ces effets peuvent être additifs, l'utilisation de médicaments contenant de l'ergotamine ou de type ergot (comme la dihydroergotamine ou le méthysergide) et de MAXALT 5 mg dans les 24 heures est contre-indiquée [voir CONTRE-INDICATIONS ].
Autres agonistes 5-HT1
Étant donné que leurs effets vasospastiques peuvent être additifs, la co-administration de MAXALT 10 mg et d'autres agonistes des récepteurs 5-HT1 dans les 24 heures l'un de l'autre est contre-indiquée [voir CONTRE-INDICATIONS ].
ISRS/IRSN et syndrome sérotoninergique
Des cas de syndrome sérotoninergique ont été rapportés lors de la co-administration de triptans et d'inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) ou d'inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Inhibiteurs de la monoamine oxydase
MAXALT est contre-indiqué chez les patients prenant des inhibiteurs de la MAO-A et des inhibiteurs de la MAO non sélectifs. Un inhibiteur spécifique de la MAO-A a augmenté l'exposition systémique au rizatriptan et à son métabolite [voir CONTRE-INDICATIONS et PHARMACOLOGIE CLINIQUE ].
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Ischémie myocardique, infarctus du myocarde et angine de Prinzmetal
MAXALT ne doit pas être administré aux patients atteints de coronaropathie ischémique ou vasospastique. De rares cas d'effets indésirables cardiaques graves, y compris un infarctus aigu du myocarde, survenant dans les heures suivant l'administration de MAXALT ont été signalés. Certaines de ces réactions sont survenues chez des patients sans maladie coronarienne (CAD) connue. Les agonistes 5-HT1, y compris MAXALT 5 mg, peuvent provoquer un vasospasme de l'artère coronaire (angor de Prinzmetal), même chez les patients sans antécédent de coronaropathie.
Les patients qui n'ont jamais reçu de triptan et qui présentent de multiples facteurs de risque cardiovasculaire (p. ex. âge avancé, diabète, hypertension, tabagisme, obésité, antécédents familiaux importants de coronaropathie) doivent subir une évaluation cardiovasculaire avant de recevoir MAXALT. En cas de coronaropathie ou de vasospasme coronarien, MAXALT ne doit pas être administré [voir CONTRE-INDICATIONS ]. Pour les patients dont l'évaluation cardiovasculaire est négative, il convient d'envisager l'administration de la première dose de MAXALT dans un cadre médicalement supervisé et la réalisation d'un électrocardiogramme (ECG) immédiatement après l'administration de MAXALT 10 mg. Une évaluation cardiovasculaire périodique doit être envisagée chez les utilisateurs intermittents à long terme de MAXALT qui présentent des facteurs de risque cardiovasculaire.
Arythmies
Des troubles du rythme cardiaque menaçant le pronostic vital, y compris la tachycardie ventriculaire et la fibrillation ventriculaire entraînant la mort, ont été signalés dans les heures suivant l'administration d'agonistes 5-HT1. Arrêtez MAXALT 10 mg si ces troubles surviennent.
Douleur/oppression/pression à la poitrine, à la gorge, au cou et/ou à la mâchoire
Comme avec les autres agonistes 5-HT1, des sensations d'oppression, de douleur, de pression et de lourdeur dans le précordium, la gorge, le cou et la mâchoire surviennent fréquemment après le traitement par MAXALT 5 mg et sont généralement d'origine non cardiaque. Cependant, si une origine cardiaque est suspectée, les patients doivent être évalués. Les patients atteints de coronaropathie et ceux atteints de la variante de l'angor de Prinzmetal ne doivent pas recevoir d'agonistes 5-HT1.
Événements cérébrovasculaires
Des hémorragies cérébrales, des hémorragies sous-arachnoïdiennes et des accidents vasculaires cérébraux sont survenus chez des patients traités par des agonistes 5-HT1, et certains ont entraîné la mort. Dans un certain nombre de cas, il semble possible que les événements cérébrovasculaires aient été primaires, l'agoniste 5-HT1 ayant été administré dans la croyance erronée que les symptômes ressentis étaient une conséquence de la migraine, alors qu'ils ne l'étaient pas. De plus, les patients souffrant de migraine peuvent présenter un risque accru de certains événements cérébrovasculaires (p. ex., accident vasculaire cérébral, hémorragie, accident ischémique transitoire). Arrêtez MAXALT si un événement cérébrovasculaire se produit.
Comme avec d'autres thérapies contre la migraine aiguë, avant de traiter des maux de tête chez des patients qui n'ont pas été précédemment diagnostiqués comme migraineux et chez des migraineux qui présentent des symptômes atypiques, il faut veiller à exclure d'autres affections neurologiques potentiellement graves. MAXALT ne doit pas être administré aux patients ayant des antécédents d'accident vasculaire cérébral ou d'accident ischémique transitoire [voir CONTRE-INDICATIONS ].
Autres réactions de vasospasme
Les agonistes 5-HT1, y compris MAXALT, peuvent provoquer des réactions vasospastiques non coronariennes, telles qu'une ischémie vasculaire périphérique, une ischémie vasculaire gastro-intestinale et un infarctus (se manifestant par des douleurs abdominales et une diarrhée sanglante), un infarctus splénique et le syndrome de Raynaud. Chez les patients qui présentent des symptômes ou des signes évoquant une réaction vasospasme non coronarienne après l'utilisation de tout agoniste 5-HT1, la réaction vasospasme suspectée doit être exclue avant de recevoir des doses supplémentaires de MAXALT 10 mg.
Des cas de cécité transitoire et permanente et de perte de vision partielle importante ont été rapportés avec l'utilisation d'agonistes 5-HT1. Étant donné que les troubles visuels peuvent faire partie d'une crise de migraine, une relation causale entre ces événements et l'utilisation d'agonistes 5-HT1 n'a pas été clairement établie.
Maux de tête par surconsommation de médicaments
La surutilisation de médicaments contre la migraine aiguë (p. ex., ergotamine, triptans, opioïdes ou une combinaison de médicaments pendant 10 jours ou plus par mois) peut entraîner une exacerbation des céphalées (céphalée par abus de médicaments). Les céphalées par abus médicamenteux peuvent se présenter sous la forme de céphalées quotidiennes de type migraineux ou sous la forme d'une augmentation marquée de la fréquence des crises de migraine. La désintoxication des patients, y compris le sevrage des médicaments surutilisés, et le traitement des symptômes de sevrage (qui incluent souvent une aggravation transitoire des maux de tête) peuvent être nécessaires.
Syndrome sérotoninergique
Un syndrome sérotoninergique peut survenir avec les triptans, y compris MAXALT 10 mg, en particulier lors de la co-administration avec des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), des inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN), des antidépresseurs tricycliques (ATC) et des inhibiteurs de la MAO [voir INTERACTIONS MÉDICAMENTEUSES ]. Les symptômes du syndrome sérotoninergique peuvent inclure des modifications de l'état mental (p. ex., agitation, hallucinations, coma), une instabilité autonome (p. ex., tachycardie, tension artérielle labile, hyperthermie), des aberrations neuromusculaires (p. ex., hyperréflexie, incoordination) et/ou des symptômes gastro-intestinaux (p. ex., nausées , vomissements, diarrhée). L'apparition des symptômes peut survenir quelques minutes à quelques heures après avoir reçu une nouvelle dose ou une dose plus importante d'un médicament sérotoninergique. Le traitement par MAXALT doit être interrompu si un syndrome sérotoninergique est suspecté [voir INTERACTIONS MÉDICAMENTEUSES et INFORMATIONS PATIENTS ].
Augmentation de la pression artérielle
Une élévation significative de la pression artérielle, y compris une crise hypertensive avec altération aiguë des systèmes d'organes, a été signalée à de rares occasions chez des patients avec ou sans antécédents d'hypertension recevant des agonistes des récepteurs 5-HT1, y compris MAXALT. Chez de jeunes adultes sains de sexe masculin et féminin ayant reçu des doses maximales de MAXALT (10 mg toutes les 2 heures pour 3 doses), de légères augmentations de la pression artérielle (environ 2 à 3 mmHg) ont été observées. MAXALT est contre-indiqué chez les patients souffrant d'hypertension non contrôlée [voir CONTRE-INDICATIONS ].
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( INFORMATIONS PATIENTS ).
Risque d'ischémie et/ou d'infarctus du myocarde, d'angor de Prinzmetal, d'autres événements liés au vasospasme et d'événements cérébrovasculaires
Informez les patients que MAXALT peut provoquer des effets secondaires cardiovasculaires graves tels qu'un infarctus du myocarde ou un accident vasculaire cérébral. Bien que des événements cardiovasculaires graves puissent survenir sans symptômes d'avertissement, les patients doivent être attentifs aux signes et symptômes de douleur thoracique, d'essoufflement, de faiblesse, de troubles de l'élocution et doivent demander un avis médical lorsqu'ils observent des signes ou symptômes indicatifs. Les patients doivent être informés de l'importance de ce suivi [voir AVERTISSEMENTS ET PRECAUTIONS ].
Syndrome sérotoninergique
Les patients doivent être avertis du risque de syndrome sérotoninergique lié à l'utilisation de MAXALT 10 mg ou d'autres triptans, en particulier lors d'une utilisation combinée avec des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) ou des inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES , et PHARMACOLOGIE CLINIQUE ].
Grossesse
Informer les patientes que MAXALT ne doit pas être utilisé pendant la grossesse à moins que le bénéfice potentiel ne justifie le risque potentiel pour le fœtus [voir Utilisation dans des populations spécifiques ].
Lactation
Conseillez aux patientes d'informer leur fournisseur de soins de santé si elles allaitent ou prévoient d'allaiter [voir Utilisation dans des populations spécifiques ].
Capacité à effectuer des tâches complexes
Étant donné que les migraines ou le traitement par MAXALT 10 mg peuvent provoquer de la somnolence et des étourdissements, demandez aux patients d'évaluer leur capacité à effectuer des tâches complexes pendant les crises de migraine et après l'administration de MAXALT.
Maux de tête par surconsommation de médicaments
Informez les patients que l'utilisation de médicaments contre la migraine aiguë pendant 10 jours ou plus par mois peut entraîner une exacerbation des maux de tête et encouragez les patients à enregistrer la fréquence des maux de tête et la consommation de médicaments (par exemple, en tenant un journal des maux de tête) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Manipulation des emballages de comprimés à désintégration orale
Demandez aux patients de ne pas retirer la plaquette thermoformée de la pochette extérieure en aluminium tant qu'ils ne sont pas prêts à utiliser le comprimé à désintégration orale à l'intérieur [voir DOSAGE ET ADMINISTRATION ].
Patients atteints de phénylcétonurie
Informez les patients phénylcétonuriques que les comprimés à désintégration orale MAXALT-MLT contiennent de la phénylalanine (un composant de l'aspartame). Chaque comprimé à dissolution orale de 5 mg contient 1,1 mg de phénylalanine et chaque comprimé à dissolution orale de 10 mg contient 2,1 mg de phénylalanine [voir Utilisation dans des populations spécifiques ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Des études de carcinogénicité orale du rizatriptan ont été menées chez la souris (100 semaines) et le rat (106 semaines) à des doses allant jusqu'à 125 mg/kg/jour. Il n'y avait aucune preuve d'une augmentation de l'incidence des tumeurs liée au rizatriptan chez l'une ou l'autre des espèces. Les expositions plasmatiques (AUC) à la dose la plus élevée testée étaient environ 150 (souris) et 240 fois (rats) que chez l'homme à la dose maximale recommandée chez l'humain (MRHD) de 30 mg/jour.
Mutagenèse
Le rizatriptan n'a été ni mutagène ni clastogène dans une batterie d'études de toxicité génétique in vitro et in vivo, y compris : le test de mutagenèse microbienne (Ames), les tests in vitro de mutagenèse sur des cellules de mammifères et d'aberration chromosomique, et le test d'aberration chromosomique in vivo chez la souris.
Altération de la fertilité
L'administration orale de rizatriptan (0, 2, 10 ou 100 mg/kg/jour) à des rats femelles avant et pendant l'accouplement et pendant toute la gestation et la lactation n'a eu aucun effet sur la fertilité ; cependant, une altération du cycle oestral et des retards dans le temps jusqu'à l'accouplement ont été observés à la dose la plus élevée testée. L'exposition plasmatique à la dose sans effet (10 mg/kg/jour) pour la toxicité pour la reproduction était environ 15 fois celle chez l'homme à la MRHD.
L'administration orale de rizatriptan (0, 5, 35 ou 250 mg/kg/jour) à des rats mâles avant et pendant l'accouplement n'a entraîné aucune altération de la fertilité ou des performances de reproduction. L'exposition au plasma (AUC) à la dose la plus élevée testée était environ 550 fois celle chez l'homme au MRHD.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Les données humaines disponibles sur l'utilisation de MAXALT chez les femmes enceintes ne sont pas suffisantes pour tirer des conclusions sur le risque associé au médicament de malformations congénitales majeures et de fausse couche.
Dans les études chez l'animal, une toxicité pour le développement a été observée suite à l'administration orale de rizatriptan pendant la grossesse (diminution du poids corporel du fœtus chez le rat) ou tout au long de la grossesse et de l'allaitement (augmentation de la mortalité, diminution du poids corporel et troubles neurocomportementaux chez la progéniture du rat) à des expositions plasmatiques maternelles supérieures à celles attendu aux doses thérapeutiques chez l'homme [voir Données animales ].
Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement. Le taux signalé de malformations congénitales majeures parmi les accouchements chez les femmes souffrant de migraine varie de 2,2 % à 2,9 % et le taux de fausses couches signalé est de 17 %, ce qui est similaire aux taux signalés chez les femmes sans migraine.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
Chez les femmes souffrant de migraine, il existe un risque accru d'issues périnatales indésirables chez la mère, y compris la pré-éclampsie et l'hypertension gestationnelle.
Données
Données humaines
Le registre des grossesses pour MAXALT n'a identifié aucun schéma d'anomalies congénitales ou d'autres résultats indésirables à la naissance au cours de la période de 1998 à 2018. Cependant, l'absence d'identification de tout schéma doit être considérée avec prudence, car le nombre de rapports prospectifs contenant des informations sur les résultats était faible et n'a pas fourni une puissance suffisante pour détecter un risque accru de malformations congénitales individuelles associées à l'utilisation de MAXALT. De plus, il y avait une importante perte de suivi dans les rapports de grossesse prospectifs, ce qui complique davantage cette évaluation d'une association entre MAXALT et tout type d'anomalies congénitales ou d'autres résultats indésirables à la naissance.
Dans une étude utilisant les données du registre médical suédois des naissances, les naissances vivantes de femmes qui ont déclaré avoir utilisé des triptans ou des ergots pendant la grossesse ont été comparées à celles de femmes qui n'en ont pas utilisé. Sur les 157 naissances avec exposition au rizatriptan au cours du premier trimestre, 7 nourrissons sont nés avec des malformations (risque relatif 1,01 [IC 95 % : 0,40 à 2,08]). Une étude utilisant des données liées du registre médical des naissances de Norvège à la base de données norvégienne sur les ordonnances a comparé les résultats de la grossesse chez les femmes qui ont fait racheter des ordonnances de triptans pendant la grossesse, ainsi qu'un groupe de comparaison de la maladie migraineuse qui a fait racheter des ordonnances de triptans avant la grossesse uniquement, par rapport à un groupe de contrôle de la population. Sur les 310 femmes qui ont fait racheter des ordonnances de rizatriptan au cours du premier trimestre, 10 avaient des enfants atteints de malformations congénitales majeures (OR 1,03 [IC à 95 % : 0,55 à 1,93]), tandis que pour les 271 femmes qui ont fait racheter des ordonnances de rizatriptan avant, mais pas pendant , grossesse, 12 avaient des nourrissons avec des malformations congénitales majeures (OR 1,48 [IC à 95 % : 0,83 à 2,64]), chacun par rapport au groupe de comparaison de la population.
Données animales
Lorsque le rizatriptan (0, 2, 10 ou 100 mg/kg/jour) a été administré par voie orale à des rates gravides tout au long de l'organogenèse, une diminution du poids corporel du fœtus a été observée aux doses les plus élevées testées. À la dose moyenne (10 mg/kg/jour), qui était une dose sans effet pour les effets indésirables sur le développement embryofœtal, l'exposition plasmatique (ASC) était environ 15 fois celle chez l'homme à la dose humaine maximale recommandée (MRHD) de 30 mg/jour. Lorsque le rizatriptan (0, 5, 10 ou 50 mg/kg/jour) a été administré par voie orale à des lapines gravides tout au long de l'organogenèse, aucun effet indésirable sur le fœtus n'a été observé. L'exposition au plasma (AUC) à la dose la plus élevée testée était 115 fois celle chez l'homme à la MRHD. Le transfert placentaire du médicament au fœtus a été démontré chez les deux espèces.
L'administration orale de rizatriptan (0, 2, 10 ou 100 mg/kg/jour) à des rats femelles avant et pendant l'accouplement et tout au long de la gestation et de la lactation a entraîné une réduction du poids corporel de la progéniture dès la naissance et tout au long de la lactation à tous les niveaux sauf au plus bas. dose testée (2 mg/kg/jour). L'exposition au plasma (AUC) à la dose sans effet (2 mg/kg/jour) pour les effets indésirables sur le développement postnatal était similaire à celle chez l'homme au MRHD.
L'administration orale de rizatriptan (0, 5, 100 ou 250 mg/kg/jour) tout au long de l'organogenèse et de l'allaitement a entraîné une mortalité néonatale, une réduction du poids corporel (qui a persisté jusqu'à l'âge adulte) et une altération de la fonction neurocomportementale chez la progéniture à toutes les doses sauf à la dose la plus faible. testé. L'exposition plasmatique (AUC) à la dose sans effet pour les effets indésirables sur le développement postnatal (5 mg/kg/jour) était environ 8 fois celle chez l'homme à la MRHD.
Lactation
Résumé des risques
Il n'existe aucune donnée sur la présence de rizatriptan ou de tout métabolite actif dans le lait maternel, ou sur les effets du rizatriptan sur le nourrisson allaité ou sur la production de lait.
Le rizatriptan a été excrété dans le lait de rat, avec des niveaux dans le lait environ 6 fois supérieurs à ceux du plasma maternel.
Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de la mère pour MAXALT ou MAXALT-MLT et tout effet indésirable potentiel sur le nourrisson allaité de MAXALT ou MAXALT-MLT ou de l'affection maternelle sous-jacente.
Données
Suite à l'administration orale de rizatriptan à des rates allaitantes à une dose de 100 mg/kg/jour, les concentrations de médicament de rizatriptan dans les échantillons de lait ont dépassé d'environ 6 fois les concentrations plasmatiques maternelles de médicament.

Utilisation pédiatrique
L'innocuité et l'efficacité chez les patients pédiatriques de moins de 6 ans n'ont pas été établies. L'efficacité et la sécurité de MAXALT 5 mg dans le traitement aigu de la migraine chez les patients âgés de 6 à 17 ans ont été établies dans une étude adéquate et bien contrôlée [voir Etudes cliniques ].
L'incidence des effets indésirables rapportés chez les patients pédiatriques dans l'essai clinique de courte durée était similaire chez les patients ayant reçu MAXALT 5 mg par rapport à ceux ayant reçu le placebo. Le schéma des effets indésirables chez les patients pédiatriques devrait être similaire à celui des adultes.
Utilisation gériatrique
Les études cliniques de MAXALT 5 mg n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment des sujets plus jeunes. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes.
Bien que la pharmacocinétique du rizatriptan ait été similaire chez les personnes âgées (≥ 65 ans) et chez les jeunes adultes (n = 17), en général, la sélection de la dose pour un patient âgé doit être prudente, en commençant par le bas de l'intervalle posologique. Cela reflète la fréquence plus élevée de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'autres traitements médicamenteux.
Les patients gériatriques qui présentent d'autres facteurs de risque cardiovasculaire (p. ex., diabète, hypertension, tabagisme, obésité, antécédents familiaux importants de maladie coronarienne) doivent subir une évaluation cardiovasculaire avant de recevoir MAXALT [voir AVERTISSEMENTS ET PRECAUTIONS ].
Patients atteints de phénylcétonurie
Les comprimés à désintégration orale contiennent de la phénylalanine (un composant de l'aspartame). Les comprimés à dissolution orale de 5 et 10 mg contiennent respectivement 1,1 et 2,1 mg de phénylalanine.
SURDOSAGE
Aucun surdosage de MAXALT n'a été signalé au cours des essais cliniques chez l'adulte.
Certains patients adultes qui ont reçu 40 mg de MAXALT 5 mg en dose unique ou en deux doses avec un intervalle interdose de 2 heures ont présenté des étourdissements et de la somnolence.
Dans une étude de pharmacologie clinique au cours de laquelle 12 sujets adultes ont reçu MAXALT 5 mg, à des doses cumulées totales de 80 mg (administrées dans les quatre heures), deux des sujets ont présenté une syncope, des étourdissements, une bradycardie, y compris un bloc AV du troisième degré, des vomissements et/ou une incontinence .
Dans l'étude ouverte à long terme, impliquant 606 migraineux pédiatriques traités âgés de 12 à 17 ans (dont 432 ont été traités pendant au moins 12 mois), 151 patients (25 %) ont pris deux doses de 10 mg de MAXALT-MLT dans un délai de 24 heures. Les effets indésirables pour 3 de ces patients comprenaient des malaises abdominaux, de la fatigue et de la dyspnée.
De plus, sur la base de la pharmacologie de MAXALT 10 mg, une hypertension ou une ischémie myocardique pourraient survenir après un surdosage. Une décontamination gastro-intestinale (c'est-à-dire un lavage gastrique suivi de charbon activé) doit être envisagée chez les patients suspectés d'un surdosage avec MAXALT. La surveillance clinique et électrocardiographique doit être poursuivie pendant au moins 12 heures, même si aucun symptôme clinique n'est observé.
Les effets de l'hémodialyse ou de la dialyse péritonéale sur les concentrations sériques de rizatriptan ne sont pas connus.
CONTRE-INDICATIONS
MAXALT 5 mg est contre-indiqué chez les patients présentant :
- Maladie coronarienne ischémique (angine de poitrine, antécédents d'infarctus du myocarde ou ischémie silencieuse documentée), ou autre maladie cardiovasculaire sous-jacente importante [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Vasospasme de l'artère coronaire, y compris l'angor de Prinzmetal [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Antécédents d'accident vasculaire cérébral ou d'accident ischémique transitoire (AIT) [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Maladie vasculaire périphérique (PVD) [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Maladie ischémique intestinale [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Hypertension non contrôlée [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Utilisation récente (c'est-à-dire dans les 24 heures) d'un autre agoniste 5-HT1, d'un médicament contenant de l'ergotamine ou d'un médicament de type ergot (comme la dihydroergotamine ou le méthysergide) [voir INTERACTIONS MÉDICAMENTEUSES ].
- Migraine hémiplégique ou basilaire [voir LES INDICATIONS ].
- Administration concomitante ou arrêt récent (c'est-à-dire dans les 2 semaines) d'un inhibiteur de la MAO-A [voir INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
- Hypersensibilité au rizatriptan ou à l'un des excipients (œdème de Quincke et anaphylaxie observés) [voir EFFETS INDÉSIRABLES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le rizatriptan se lie avec une grande affinité aux récepteurs humains clonés 5-HT1B/1D. MAXALT 10 mg exerce vraisemblablement ses effets thérapeutiques dans le traitement de la migraine en se liant aux récepteurs 5-HT1B/1D situés sur les vaisseaux sanguins intracrâniens et les nerfs sensoriels du système trijumeau.
Pharmacocinétique
Absorption
Le rizatriptan est complètement absorbé après administration orale. La biodisponibilité orale absolue moyenne du comprimé MAXALT 10 mg est d'environ 45 % et les concentrations plasmatiques maximales moyennes (Cmax) sont atteintes en environ 1 à 1,5 heure (Tmax). La présence d'une migraine n'a pas semblé affecter l'absorption ou la pharmacocinétique du rizatriptan. La nourriture n'a pas d'effet significatif sur la biodisponibilité du rizatriptan mais retarde d'une heure le temps nécessaire pour atteindre la concentration maximale. Dans les essais cliniques, MAXALT 10 mg a été administré sans tenir compte de la nourriture.
La biodisponibilité et la Cmax du rizatriptan étaient similaires après l'administration de comprimés MAXALT et de comprimés à désintégration orale MAXALT-MLT, mais le taux d'absorption est un peu plus lent avec MAXALT-MLT, le Tmax étant retardé jusqu'à 0,7 heure. L'ASC du rizatriptan est environ 30 % plus élevée chez les femmes que chez les hommes. Aucune accumulation ne s'est produite lors de doses multiples.
Distribution
Le volume moyen de distribution est d'environ 140 litres chez les hommes et de 110 litres chez les femmes. Le rizatriptan est faiblement lié (14 %) aux protéines plasmatiques.
Métabolisme
La voie principale du métabolisme du rizatriptan est la désamination oxydative par la monoamine oxydase-A (MAO-A) en métabolite acide indole acétique, qui n'est pas actif au niveau du récepteur 5-HT1B/1D. Le N-monodesméthyl-rizatriptan, un métabolite ayant une activité similaire à celle du composé parent au niveau du récepteur 5-HT1B/1D, est formé à un degré mineur. Les concentrations plasmatiques de N-monodesméthyl-rizatriptan sont d'environ 14 % de celles du composé d'origine, et il est éliminé à un rythme similaire. D'autres métabolites mineurs, le N-oxyde, le composé 6-hydroxy et le sulfate conjugué du métabolite 6-hydroxy ne sont pas actifs au niveau du récepteur 5-HT1B/1D.
Élimination
La radioactivité totale de la dose administrée récupérée sur 120 heures dans l'urine et les fèces était de 82 % et 12 %, respectivement, après une seule administration orale de 10 mg de 14C-rizatriptan. Après administration orale de 14C-rizatriptan, le rizatriptan représentait environ 17 % de la radioactivité plasmatique circulante. Environ 14 % d'une dose orale sont excrétés dans l'urine sous forme de rizatriptan inchangé, tandis que 51 % sont excrétés sous forme de métabolite de l'acide indole acétique, ce qui indique un important métabolisme de premier passage.
La demi-vie plasmatique du rizatriptan chez les hommes et les femmes est en moyenne de 2 à 3 heures.
Isoformes du cytochrome P450
Le rizatriptan n'est pas un inhibiteur des activités des isoformes 3A4/5, 1A2, 2C9, 2C19 ou 2E1 du cytochrome P450 du foie humain ; Le rizatriptan est un inhibiteur compétitif (Ki = 1400 nM) du cytochrome P450 2D6, mais uniquement à des concentrations élevées, cliniquement non pertinentes.
Populations particulières
Gériatrique
La pharmacocinétique du rizatriptan chez des volontaires sains âgés non migraineux (65-77 ans) était similaire à celle des volontaires plus jeunes non migraineux (18-45 ans).
Pédiatrique
La pharmacocinétique du rizatriptan a été déterminée chez des enfants migraineux âgés de 6 à 17 ans. Les expositions après l'administration d'une dose unique de 5 mg de MAXALT-MLT à des patients pédiatriques pesant de 20 à 39 kg (44 à 87 lb) ou de 10 mg de MAXALT-MLT à des patients pédiatriques pesant ≥ 40 kg (88 lb) étaient similaires à celles observées après une dose unique administration de 10 mg de MAXALT-MLT à des adultes.
Le genre
L'ASC0-∞ et la Cmax moyennes du rizatriptan (10 mg par voie orale) étaient respectivement d'environ 30 % et 11 % plus élevées chez les femmes que chez les hommes, tandis que le Tmax est survenu à peu près au même moment.
Insuffisance hépatique
Après administration orale chez des patients présentant une insuffisance hépatique causée par une cirrhose alcoolique légère à modérée du foie, les concentrations plasmatiques de rizatriptan étaient similaires chez les patients présentant une insuffisance hépatique légère par rapport à un groupe témoin de sujets ayant une fonction hépatique normale ; les concentrations plasmatiques de rizatriptan étaient environ 30 % plus élevées chez les patients présentant une insuffisance hépatique modérée.
Insuffisance rénale
Chez les patients insuffisants rénaux (clairance de la créatinine de 10 à 60 mL/min/1,73 m2), l'ASC0-∞ du rizatriptan n'était pas significativement différente de celle des sujets ayant une fonction rénale normale. Chez les patients hémodialysés (clairance de la créatinine
Course
Les données pharmacocinétiques n'ont révélé aucune différence significative entre les sujets afro-américains et caucasiens.
Interactions médicamenteuses
[Voir également INTERACTIONS MÉDICAMENTEUSES ]
Inhibiteurs de la monoamine oxydase
Le rizatriptan est principalement métabolisé via la monoamine oxydase, sous-type « A » (MAO-A). Les concentrations plasmatiques de rizatriptan peuvent être augmentées par des médicaments qui sont des inhibiteurs sélectifs de la MAO-A (par exemple, le moclobémide) ou des inhibiteurs non sélectifs de la MAO [type A et B] (par exemple, l'isocarboxazide, la phénelzine, la tranylcypromine et la pargyline). Dans une étude sur les interactions médicamenteuses, lorsque MAXALT 10 mg a été administré à des sujets (n = 12) recevant un traitement concomitant avec l'inhibiteur sélectif et réversible de la MAO-A, le moclobémide 150 mg tid, il y a eu des augmentations moyennes de l'ASC et de la Cmax du rizatriptan de 119 % et 41 % respectivement ; et l'ASC du métabolite actif N-monodesméthyl du rizatriptan a augmenté de plus de 400 %. On s'attendrait à ce que l'interaction soit plus importante avec les inhibiteurs irréversibles de la MAO. Aucune interaction pharmacocinétique n'est anticipée chez les patients recevant des inhibiteurs sélectifs de la MAO-B [voir CONTRE-INDICATIONS et INTERACTIONS MÉDICAMENTEUSES ].
Propranolol
Dans une étude portant sur l'administration concomitante de propranolol 240 mg/jour et d'une dose unique de rizatriptan 10 mg chez des sujets adultes sains (n = 11), l'ASC plasmatique moyenne du rizatriptan a augmenté de 70 % pendant l'administration de propranolol, et une augmentation de quatre fois a été observée chez un sujet. L'ASC du métabolite actif N-monodesméthyl du rizatriptan n'a pas été affectée par le propranolol [voir DOSAGE ET ADMINISTRATION et INTERACTIONS MÉDICAMENTEUSES ].
Nadolol/Métoprolol
Dans une étude d'interactions médicamenteuses, les effets de doses multiples de nadolol 80 mg ou de métoprolol 100 mg toutes les 12 heures sur la pharmacocinétique d'une dose unique de 10 mg de rizatriptan ont été évalués chez des sujets sains (n = 12). Aucune interaction pharmacocinétique n'a été observée.
Paroxétine
Dans une étude d'interaction entre l'inhibiteur sélectif de la recapture de la sérotonine (ISRS) paroxétine 20 mg/jour pendant deux semaines et une dose unique de MAXALT 10 mg chez des sujets sains (n = 12), ni les concentrations plasmatiques du rizatriptan ni son profil de sécurité ont été affectés par la paroxétine [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES , et INFORMATIONS PATIENTS ].
Contraceptifs oraux
Dans une étude d'administration concomitante d'un contraceptif oral pendant 6 jours d'administration de MAXALT (10-30 mg/jour) chez des volontaires sains de sexe féminin (n = 18), le rizatriptan n'a pas affecté les concentrations plasmatiques d'éthinylestradiol ou de noréthindrone.
Etudes cliniques
Adultes
L'efficacité de MAXALT 5 mg comprimés a été établie dans quatre essais multicentriques, randomisés et contrôlés par placebo. Les patients inclus dans ces études étaient principalement des femmes (84 %) et de race blanche (88 %), avec un âge moyen de 40 ans (intervalle de 18 à 71). Les patients ont été invités à traiter un mal de tête modéré à sévère. La réponse aux maux de tête, définie comme une réduction des maux de tête modérés ou sévères à des maux de tête nuls ou légers, a été évaluée jusqu'à 2 heures (étude 1) ou jusqu'à 4 heures après l'administration (études 2, 3 et 4). Les symptômes associés de nausées, de photophobie et de phonophobie et le maintien de la réponse jusqu'à 24 heures après l'administration ont été évalués. Une deuxième dose de comprimés MAXALT 10 mg a été autorisée 2 à 24 heures après l'administration pour le traitement des céphalées récurrentes dans les études 1 et 2. Des analgésiques et/ou antiémétiques supplémentaires ont été autorisés 2 heures après le traitement initial pour le sauvetage dans les quatre études.
Dans toutes les études, le pourcentage de patients obtenant une réponse à la céphalée 2 heures après le traitement était significativement plus élevé chez les patients ayant reçu MAXALT 5 ou 10 mg par rapport à ceux ayant reçu le placebo. Dans une étude distincte, les doses de 2,5 mg n'étaient pas différentes du placebo. Des doses supérieures à 10 mg ont été associées à une incidence accrue d'effets indésirables. Les résultats des quatre études contrôlées sont résumés dans le tableau 2.
Les comparaisons des performances des médicaments basées sur les résultats obtenus dans différents essais cliniques peuvent ne pas être fiables. Étant donné que les études sont menées à des moments différents, avec des échantillons de patients différents, par des investigateurs différents, utilisant des critères différents et/ou des interprétations différentes des mêmes critères, dans des conditions différentes (dose, schéma posologique, etc.), les estimations quantitatives de la réponse au traitement et on peut s'attendre à ce que le moment de la réponse varie considérablement d'une étude à l'autre.
La probabilité estimée d'obtenir une réponse initiale à la céphalée dans les 2 heures suivant le traitement dans les études regroupées 1, 2, 3 et 4 est illustrée à la figure 1.
Figure 1 : Probabilité estimée d'obtenir une réponse initiale au mal de tête en 2 heures dans les études regroupées 1, 2, 3 et 4* 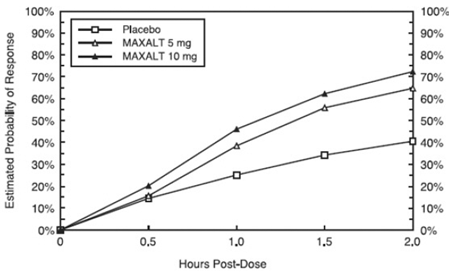
Chez les patients atteints de photophobie, de phonophobie et de nausées associées à la migraine au départ, il y a eu une diminution de l'incidence de ces symptômes après l'administration de MAXALT par rapport au placebo.
Deux à 24 heures après la dose initiale du traitement à l'étude, les patients étaient autorisés à utiliser un traitement supplémentaire pour la réponse à la douleur sous la forme d'une deuxième dose du traitement à l'étude ou d'un autre médicament. La probabilité estimée que les patients prennent une deuxième dose ou un autre médicament contre la migraine au cours des 24 heures suivant la dose initiale du traitement à l'étude est résumée dans la figure 2.
Figure 2 : Probabilité estimée de patients prenant une deuxième dose de comprimés MAXALT à 10 mg ou d'un autre médicament contre les migraines au cours des 24 heures suivant la dose initiale du traitement à l'étude dans les études regroupées 1, 2, 3 et 4* 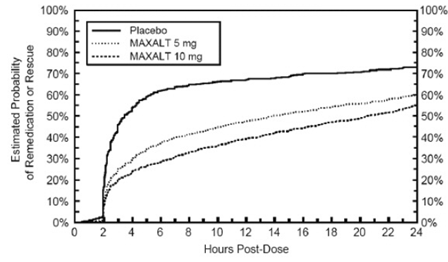
L'efficacité n'a pas été affectée par la présence d'aura; par le sexe ou l'âge du patient ; ou par l'utilisation concomitante de médicaments prophylactiques courants contre la migraine (p. ex., bêta-bloquants, inhibiteurs calciques, antidépresseurs tricycliques) ou de contraceptifs oraux. Dans deux autres études similaires, l'efficacité n'a pas été affectée par la relation avec les règles. Il n'y avait pas suffisamment de données pour évaluer l'impact de la race sur l'efficacité.
MAXALT-MLT comprimés à désintégration orale
L'efficacité de MAXALT-MLT a été établie dans deux essais multicentriques, randomisés et contrôlés par placebo dont la conception était similaire à celle des essais de MAXALT en comprimés (études 5 et 6). Les patients ont été invités à traiter un mal de tête modéré à sévère. Les patients traités dans ces études étaient principalement des femmes (88 %) et de race blanche (95 %), avec un âge moyen de 42 ans (intervalle 18-72).
Dans les deux études, le pourcentage de patients obtenant une réponse à la céphalée 2 heures après le traitement était significativement plus élevé chez les patients ayant reçu MAXALT-MLT 5 ou 10 mg par rapport à ceux ayant reçu le placebo. Les résultats des études 5 et 6 sont résumés dans le tableau 3.
La probabilité estimée d'obtenir une réponse initiale à la céphalée dans les 2 heures suivant le traitement par MAXALT-MLT dans les études regroupées 5 et 6 est illustrée à la figure 3.
Figure 3 : Probabilité estimée d'obtenir une réponse initiale au mal de tête avec MAXALT-MLT en 2 heures dans les études regroupées 5 et 6* 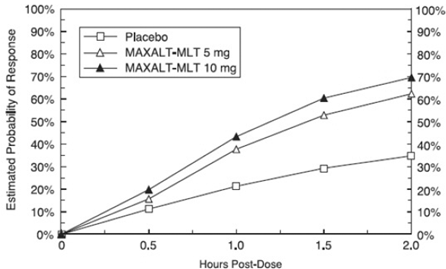
Pour les patients atteints de photophobie et de phonophobie associées à la migraine au départ, il y avait une diminution de l'incidence de ces symptômes après l'administration de MAXALT-MLT par rapport au placebo.
Deux à 24 heures après la dose initiale du traitement à l'étude, les patients étaient autorisés à utiliser un traitement supplémentaire pour la réponse à la douleur sous la forme d'une deuxième dose du traitement à l'étude ou d'un autre médicament. La probabilité estimée que les patients prennent une deuxième dose ou un autre médicament contre la migraine au cours des 24 heures suivant la dose initiale du traitement à l'étude est résumée à la figure 4.
Figure 4 : Probabilité estimée des patients prenant une deuxième dose de MAXALT-MLT ou d'un autre médicament contre les migraines au cours des 24 heures suivant la dose initiale du traitement à l'étude dans les études regroupées 5 et 6* 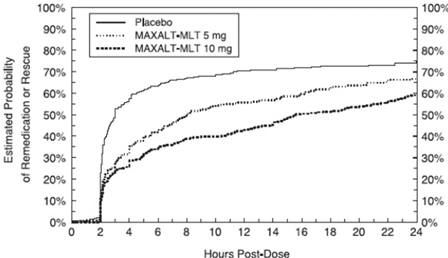
Patients pédiatriques âgés de 6 à 17 ans
L'efficacité de MAXALT-MLT chez les patients pédiatriques de 6 à 17 ans a été évaluée dans un essai clinique multicentrique, randomisé, en double aveugle, contrôlé par placebo, en groupes parallèles (étude 7). Les patients devaient avoir au moins 6 mois d'antécédents de crises de migraine (avec ou sans aura) durant habituellement 3 heures ou plus (en l'absence de traitement). La population de patients était historiquement insensible aux AINS et au traitement par acétaminophène.
Les patients ont été invités à traiter une seule crise de migraine avec des maux de tête d'intensité modérée à sévère. La phase de traitement de l'étude comportait deux étapes. L'étape 1 a été utilisée pour identifier les non-répondeurs au placebo, qui sont ensuite entrés dans l'étape 2, au cours de laquelle les patients ont été randomisés pour recevoir MAXALT-MLT ou un placebo. En utilisant une stratégie de dosage basée sur le poids, les patients de 20 kg à
L'âge moyen de la population de patients étudiée était de 13 ans. Soixante et un pour cent des patients étaient de race blanche et cinquante-six pour cent des patients étaient des femmes. Le pourcentage de patients atteignant le critère principal d'évaluation de l'efficacité de l'absence de céphalées 2 heures après le traitement était significativement plus élevé chez les patients ayant reçu MAXALT-MLT, par rapport à ceux ayant reçu le placebo (33 % contre 24 %). Les résultats de l'étude 7 sont résumés dans le tableau 4.
Le pourcentage observé de patients pédiatriques ne ressentant aucune céphalée dans les 2 heures suivant le traitement initial avec MAXALT-MLT est illustré à la figure 5.
Figure 5 : Pourcentage observé de patients ne signalant aucune douleur de céphalée dans les 2 heures suivant l'administration de la dose dans l'étude 7 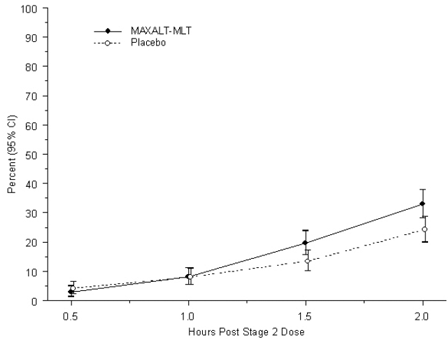
La prévalence des critères d'évaluation exploratoires d'absence de symptômes associés à la migraine (nausées, photophobie et phonophobie) 2 heures après la prise de la dose n'était pas statistiquement significativement différente entre les patients ayant reçu MAXALT-MLT et ceux ayant reçu le placebo.
INFORMATIONS PATIENTS
MAXALT® (max-awlt)
MAXALT-MLT® (benzoate de rizatriptan) Comprimés et comprimés à dissolution orale
Lisez ces renseignements destinés aux patients avant de commencer à prendre MAXALT® et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre médecin au sujet de votre état de santé ou de votre traitement.
Sauf indication contraire, les informations contenues dans cette notice d'information destinée aux patients s'appliquent à la fois aux comprimés MAXALT à 10 mg et aux comprimés à désintégration orale MAXALT-MLT®.
Qu'est-ce que MAXALT ?
MAXALT est un médicament délivré sur ordonnance qui appartient à une classe de médicaments appelés triptans. MAXALT est disponible sous forme de comprimé traditionnel (MAXALT) et de comprimé à dissolution orale (MAXALT-MLT).
MAXALT 5 mg et MAXALT-MLT sont utilisés pour traiter les crises de migraine avec ou sans aura chez les adultes et les enfants de 6 à 17 ans.
MAXALT 5 mg ne doit pas être utilisé pour prévenir les crises de migraine.
MAXALT n'est pas destiné au traitement des migraines hémiplégiques ou basilaires.
On ne sait pas si MAXALT est sûr et efficace pour le traitement des céphalées en grappe.
On ne sait pas si la prise de plus d'une dose de MAXALT en 24 heures est sûre et efficace chez les enfants de 6 à 17 ans.
On ne sait pas si MAXALT est sûr et efficace chez les enfants de moins de 6 ans.
Qui ne devrait pas prendre MAXALT ?
Ne prenez pas MAXALT si vous :
- avez ou avez eu des problèmes cardiaques
- avez ou avez eu un accident vasculaire cérébral ou un accident ischémique transitoire (AIT)
- avez ou avez eu des problèmes de vaisseaux sanguins, y compris une maladie intestinale ischémique
- avoir une hypertension artérielle non contrôlée
- avez pris d'autres médicaments Triptan au cours des dernières 24 heures
- avez pris des médicaments contenant de l'ergot au cours des dernières 24 heures
- avez des migraines hémiplégiques ou basilaires
- prenez un inhibiteur de la monoamine oxydase (MAO) ou avez pris un inhibiteur de la MAO au cours des 2 dernières semaines
- êtes allergique au benzoate de rizatriptan ou à l'un des ingrédients de MAXALT. Voir la fin de cette notice pour une liste complète des ingrédients de MAXALT.
Adressez-vous à votre médecin avant de prendre ce médicament si vous souffrez de l'une des conditions énumérées ci-dessus ou si vous n'êtes pas sûr de prendre l'un de ces médicaments.
Que dois-je dire à mon médecin avant de prendre MAXALT ?
Avant de prendre MAXALT, informez votre médecin si vous :
- avez ou avez eu des problèmes cardiaques, de l'hypertension artérielle, des douleurs thoraciques ou un essoufflement
- avez des facteurs de risque de problèmes cardiaques ou de problèmes de vaisseaux sanguins tels que :
- hypertension artérielle
- taux de cholestérol élevé
- fumeur
- obésité
- Diabète
- antécédents familiaux de problèmes cardiaques
- vous êtes post ménopausée
- vous êtes un homme de plus de 40 ans
- souffrez de phénylcétonurie (PCU). Les comprimés à dissolution orale MAXALT-MLT contiennent de la phénylalanine.
- avez des problèmes rénaux ou hépatiques
- avoir une autre condition médicale
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si MAXALT nuira à votre bébé à naître. Si vous tombez enceinte pendant que vous prenez MAXALT 5 mg, parlez-en à votre fournisseur de soins de santé.
- allaitez ou envisagez d'allaiter. On ne sait pas si MAXALT 10 mg passe dans votre lait maternel. Discutez avec votre médecin de la meilleure façon de nourrir votre bébé si vous prenez MAXALT.
Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
MAXALT 10 mg et d'autres médicaments peuvent s'influencer mutuellement et provoquer des effets secondaires. MAXALT peut affecter le mode d'action d'autres médicaments, et d'autres médicaments peuvent affecter le mode d'action de MAXALT 5 mg.
Prévenez surtout votre médecin si vous prenez :
- médicaments contenant du propranolol tels que Inderal®, Inderal® LA ou Innopran® XL
- les médicaments utilisés pour traiter les troubles de l'humeur, y compris les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) ou les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN).
Demandez à votre médecin ou à votre pharmacien une liste de ces médicaments, si vous n'êtes pas sûr.
Connaissez les médicaments que vous prenez. Conservez-en une liste pour la montrer à votre médecin et à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je prendre MAXALT ?
- Prenez MAXALT exactement comme votre médecin vous l'a dit.
- Votre médecin vous dira quelle quantité de MAXALT 5 mg prendre et quand le prendre.
- Pour prendre MAXALT-MLT :
- Laissez les comprimés à dissolution orale MAXALT-MLT dans leur emballage jusqu'à ce que vous soyez prêt à les prendre. Lorsque vous êtes prêt à le prendre :
- Retirez le blister de la pochette en aluminium. Ne poussez pas le comprimé à désintégration orale MAXALT-MLT à travers la plaquette.
- Ouvrez la plaquette alvéolée avec les mains sèches et placez le comprimé à désintégration orale MAXALT-MLT sur votre langue. Le comprimé se dissoudra et sera avalé avec votre salive. Aucun liquide n'est nécessaire pour prendre le comprimé à désintégration orale.
- Laissez les comprimés à dissolution orale MAXALT-MLT dans leur emballage jusqu'à ce que vous soyez prêt à les prendre. Lorsque vous êtes prêt à le prendre :
- Si votre mal de tête réapparaît après votre première dose de MAXALT 10 mg :
- Pour les adultes : une deuxième dose peut être prise 2 heures après la première dose. Ne prenez pas plus de 30 mg de MAXALT sur une période de 24 heures (par exemple, ne prenez pas plus de 3 comprimés de 10 mg sur une période de 24 heures).
- Pour les enfants de 6 à 17 ans : On ne sait pas si la prise de plus d'une dose de MAXALT 5 mg en 24 heures est sûre et efficace. Discutez avec votre médecin de ce qu'il faut faire si votre mal de tête ne disparaît pas ou réapparaît.
- Si vous avez pris trop de MAXALT 5 mg, appelez votre médecin ou rendez-vous immédiatement aux urgences de l'hôpital le plus proche.
Que dois-je éviter pendant que je prends MAXALT ?
MAXALT 5 mg peut provoquer des étourdissements, une faiblesse ou un évanouissement. Si vous présentez ces symptômes, ne conduisez pas de voiture, n'utilisez pas de machines et ne faites rien qui nécessite que vous soyez vigilant.
Quels sont les effets secondaires possibles de MAXALT 5mg ?
MAXALT 5mg peut provoquer des effets secondaires graves. Appelez votre médecin ou rendez-vous immédiatement aux urgences de l'hôpital le plus proche si vous pensez avoir l'un des effets secondaires graves de MAXALT, notamment :
- crise cardiaque. Les symptômes d'une crise cardiaque peuvent inclure :
- gêne thoracique au centre de la poitrine qui dure plus de quelques minutes ou qui disparaît et revient
- gêne thoracique qui ressemble à une pression inconfortable, une compression, une plénitude ou une douleur
- douleur ou inconfort dans les bras, le dos, le cou, la mâchoire ou l'estomac
- essoufflement avec ou sans gêne thoracique
- avoir des sueurs froides
- nausées ou vomissements
- se sentir étourdi
- accident vasculaire cérébral. Les symptômes d'un AVC peuvent inclure les symptômes soudains suivants :
- engourdissement ou faiblesse du visage, du bras ou de la jambe, en particulier d'un côté du corps
- confusion, problèmes d'élocution ou de compréhension
- problèmes de vision dans 1 ou les deux yeux
- problèmes de marche, étourdissements, perte d'équilibre ou de coordination
- maux de tête sévères sans cause connue
- problèmes de vaisseaux sanguins. Les symptômes de problèmes de vaisseaux sanguins peuvent inclure :
- Douleur d'estomac
- diarrhée sanglante
- problèmes de vue
- froideur et engourdissement des mains et des pieds
- syndrome sérotoninergique. Une affection appelée syndrome sérotoninergique peut survenir lorsque des médicaments Triptan tels que MAXALT sont pris avec certains autres médicaments. Les symptômes du syndrome sérotoninergique peuvent inclure :
- agitation
- hallucinations
- coma
- rythme cardiaque rapide
- changements rapides de votre tension artérielle
- augmentation de la température corporelle
- spasmes musculaires
- perte de coordination
- nausées, vomissements ou diarrhée
- augmentation de la pression artérielle.
Les effets secondaires les plus courants de MAXALT chez les adultes comprennent :
- sensation de somnolence ou de fatigue
- douleur ou pression dans la poitrine ou la gorge
- vertiges
Dites à votre médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Si vous prenez MAXALT 10 mg trop souvent, cela peut entraîner des maux de tête chroniques. Dans de tels cas, vous devez contacter votre médecin car vous devrez peut-être arrêter de prendre MAXALT.
Ce ne sont pas tous les effets secondaires possibles de MAXALT. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA1088.
Comment dois-je conserver MAXALT ?
- Conservez MAXALT à température ambiante entre 59 °F et 86 °F (15 °C et 30 °C).
- Jetez en toute sécurité les médicaments périmés ou dont vous n'avez plus besoin.
Gardez MAXALT 10 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de MAXALT.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans une notice d'information destinée aux patients. N'utilisez pas MAXALT pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas MAXALT à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Cette notice d'information destinée aux patients résume les informations les plus importantes sur MAXALT. Si vous souhaitez plus d'informations, parlez-en à votre médecin. Vous pouvez demander à votre pharmacien ou à votre médecin des informations sur MAXALT destinées aux professionnels de la santé.
Pour plus d'informations, rendez-vous sur www.maxalt.com.
Quels sont les ingrédients de MAXALT ?
Ingrédient actif dans les comprimés à dissolution orale MAXALT 10mg et MAXALT-MLT :
benzoate de rizatriptan.
Ingrédients inactifs dans MAXALT : lactose monohydraté, cellulose microcristalline, amidon prégélatinisé, oxyde de fer (rouge) et stéarate de magnésium.
Ingrédients inactifs des comprimés à dissolution orale MAXALT-MLT : gélatine, mannitol, glycine, aspartame et arôme de menthe poivrée.
Les comprimés à dissolution orale MAXALT-MLT contiennent de l'aspartame, une source de phénylalanine.
Phénylcétonuriques :
Les comprimés à dissolution orale MAXALT-MLT à 5 mg contiennent 1,1 mg de phénylalanine. Les comprimés à dissolution orale MAXALT-MLT à 10 mg contiennent 2,1 mg de phénylalanine.
Ces informations destinées aux patients ont été approuvées par la Food and Drug Administration des États-Unis.
