Celebrex 100mg, 200mg Celecoxib Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Celebrex 100 mg et comment est-il utilisé ?
Celebrex 200 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de douleur aiguë ou d'inflammation. Celebrex peut être utilisé seul ou avec d'autres médicaments.
Celebrex 100 mg appartient à une classe de médicaments appelés anti-inflammatoires non stéroïdiens (AINS).
On ne sait pas si Celebrex est sûr et efficace chez les enfants de moins de 2 ans.
Quels sont les effets secondaires possibles de Celebrex 100mg ?
Celebrex 200 mg peut provoquer des effets secondaires graves, notamment :
- gonflement,
- prise de poids rapide,
- essoufflement,
- selles sanglantes ou goudronneuses,
- crachats de sang ou de vomi ressemblant à du marc de café,
- nausée,
- douleurs abdominales en haut à droite,
- démangeaison,
- fatigue,
- urine foncée,
- jaunissement de la peau ou des yeux (jaunisse),
- peu ou pas de miction,
- gonflement des pieds ou des chevilles,
- se sentir fatigué,
- peau pâle,
- étourdissements, et
- mains et pieds froids
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Celebrex comprennent :
- Douleur d'estomac,
- brûlures d'estomac,
- gaz,
- diarrhée,
- constipation,
- nausée,
- vomissement,
- gonflement des mains ou des pieds,
- vertiges, un
- ré
- symptômes du rhume (nez bouché, éternuements, mal de gorge)
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Celebrex. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
RISQUE D'ÉVÉNEMENTS CARDIO-VASCULAIRES ET GASTRO-INTESTINAUX GRAVES
Événements thrombotiques cardiovasculaires
- Les anti-inflammatoires non stéroïdiens (AINS) entraînent un risque accru d'événements thrombotiques cardiovasculaires graves, notamment d'infarctus du myocarde et d'accident vasculaire cérébral, qui peuvent être mortels. Ce risque peut survenir au début du traitement et peut augmenter avec la durée d'utilisation. [voir MISES EN GARDE ET PRÉCAUTIONS]
- CELEBREX est contre-indiqué dans le cadre d'un pontage aortocoronarien (PAC). [voir CONTRE-INDICATIONS et MISES EN GARDE ET PRÉCAUTIONS]
Saignement gastro-intestinal, ulcération et perforation
- Les AINS entraînent un risque accru d'effets indésirables gastro-intestinaux (GI) graves, notamment des saignements, des ulcérations et des perforations de l'estomac ou des intestins, qui peuvent être fatals. Ces événements peuvent survenir à tout moment pendant l'utilisation et sans symptômes d'avertissement. Les patients âgés et les patients ayant des antécédents d'ulcère peptique et/ou d'hémorragie gastro-intestinale sont plus à risque d'événements (GI) graves. [voir MISES EN GARDE ET PRÉCAUTIONS]
LA DESCRIPTION
La capsule CELEBREX (célécoxib) est un anti-inflammatoire non stéroïdien, disponible sous forme de capsules contenant 50 mg, 100 mg, 200 mg et 400 mg de célécoxib pour administration orale. Le nom chimique est 4-[5-(4-méthylphényl)-3-(trifluorométhyl)-1H-pyrazol-1-yl] benzènesulfonamide et est un pyrazole substitué par un diaryle. Le poids moléculaire est de 381,38. Sa formule moléculaire est C17H14F3N3O2S et sa structure chimique est la suivante :
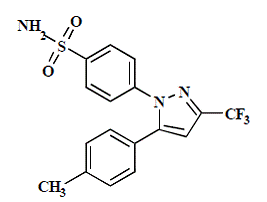
Le célécoxib est une poudre blanche à blanc cassé avec un pKa de 11,1 (fraction sulfonamide). Le célécoxib est hydrophobe (log P = 3,5) et est pratiquement insoluble dans les milieux aqueux à un pH physiologique.
Les ingrédients inactifs de CELEBREX 200 mg comprennent : croscarmellose sodique, encres comestibles, gélatine, lactose monohydraté, stéarate de magnésium, povidone et laurylsulfate de sodium.
LES INDICATIONS
CELEBREX est indiqué
Arthrose (OA)
Pour la prise en charge des signes et symptômes de l'arthrose [voir Etudes cliniques ].
Polyarthrite rhumatoïde (PR)
Pour la prise en charge des signes et symptômes de PR [voir Etudes cliniques ].
Arthrite rhumatoïde juvénile (ARJ)
Pour la prise en charge des signes et symptômes de l'ARJ chez les patients de 2 ans et plus [voir Etudes cliniques ].
Spondylarthrite ankylosante (SA)
Pour la prise en charge des signes et symptômes de la SA [voir Etudes cliniques ].
La douleur aiguë
Pour la prise en charge de la douleur aiguë chez l'adulte [voir Etudes cliniques ].
Dysménorrhée primaire
Pour la prise en charge de la dysménorrhée primaire [voir Etudes cliniques ].
DOSAGE ET ADMINISTRATION
Instructions générales de dosage
Examinez attentivement les avantages et les risques potentiels de CELEBREX et des autres options de traitement avant de décider d'utiliser CELEBREX. Utilisez la dose efficace la plus faible pendant la durée la plus courte compatible avec les objectifs de traitement de chaque patient [voir AVERTISSEMENTS ET PRECAUTIONS ].
Ces doses peuvent être administrées sans égard au moment des repas.
Arthrose
Pour l'arthrose, la posologie est de 200 mg par jour administrés en dose unique ou de 100 mg deux fois par jour.
La polyarthrite rhumatoïde
Pour la PR, la posologie est de 100 mg à 200 mg deux fois par jour.
Polyarthrite rhumatoïde juvénile
Pour JRA, la posologie pour les patients pédiatriques (âgés de 2 ans et plus) est basée sur le poids. Pour les patients ≥10 kg à ≤25 kg, la dose recommandée est de 50 mg deux fois par jour. Pour les patients > 25 kg, la dose recommandée est de 100 mg deux fois par jour.
Pour les patients qui ont des difficultés à avaler les gélules, le contenu d'une gélule de CELEBREX peut être ajouté à la compote de pommes. Le contenu entier de la capsule est soigneusement vidé sur une cuillère à café rase de compote de pommes fraîche ou à température ambiante et ingéré immédiatement avec de l'eau. Le contenu de la capsule saupoudrée sur la compote de pommes est stable jusqu'à 6 heures dans des conditions réfrigérées (2°C à 8°C/35°F à 45°F).
Spondylarthrite ankylosante
Pour la SA, la posologie de CELEBREX est de 200 mg par jour en dose unique (une fois par jour) ou fractionnée (deux fois par jour). Si aucun effet n'est observé après 6 semaines, un essai de 400 mg par jour peut être intéressant. Si aucun effet n'est observé après 6 semaines avec 400 mg par jour, une réponse est peu probable et il faut envisager d'autres options de traitement.
Prise en charge de la douleur aiguë et traitement de la dysménorrhée primaire
Pour la prise en charge de la douleur aiguë et le traitement de la dysménorrhée primaire, la posologie est de 400 mg initialement, suivie d'une dose supplémentaire de 200 mg si nécessaire le premier jour. Les jours suivants, la dose recommandée est de 200 mg deux fois par jour selon les besoins.
Populations particulières
Insuffisance hépatique
Chez les patients présentant une insuffisance hépatique modérée (Child-Pugh Classe B), réduire la dose de 50 %. L'utilisation de CELEBREX 100 mg chez les patients présentant une insuffisance hépatique sévère n'est pas recommandée [voir AVERTISSEMENTS ET PRECAUTIONS , Utilisation dans des populations spécifiques , et PHARMACOLOGIE CLINIQUE ].
Métaboliseurs lents des substrats du CYP2C9
Chez les patients adultes connus ou suspectés d'être des métaboliseurs lents du CYP2C9 sur la base du génotype ou d'antécédents/d'expérience avec d'autres substrats du CYP2C9 (tels que la warfarine, la phénytoïne), initier le traitement avec la moitié de la dose la plus faible recommandée.
Chez les patients atteints d'ARJ connus ou suspectés d'être des métaboliseurs lents du CYP2C9, envisagez d'utiliser d'autres traitements [voir Utilisation dans des populations spécifiques et PHARMACOLOGIE CLINIQUE ].
COMMENT FOURNIE
Formes posologiques et points forts
Gélules CELEBREX (célécoxib) :
50 mg blanc, avec une bande blanche imprimée au verso sur la bande rouge du corps et du capuchon avec les inscriptions 7767 sur le capuchon et 50 sur le corps.
100 mg blanc, avec une bande blanche imprimée au verso sur la bande bleue du corps et du capuchon avec les inscriptions 7767 sur le capuchon et 100 sur le corps.
200 mg blanc, avec une bande blanche imprimée au verso sur une bande dorée avec les marquages 7767 sur le capuchon et 200 sur le corps.
400 mg blanc, avec une bande blanche imprimée au verso sur une bande verte avec les marquages 7767 sur le capuchon et 400 sur le corps.
Stockage et manutention
CELEBREX (célécoxib) 50 mg les gélules sont blanches, avec une impression inversée blanche sur la bande rouge du corps et du capuchon avec les inscriptions 7767 sur le capuchon et 50 sur le corps, fournies sous la forme :
CELEBREX (célécoxib) 100 mg les gélules sont blanches, avec une impression inversée blanche sur la bande bleue du corps et du capuchon avec les inscriptions 7767 sur le capuchon et 100 sur le corps, fournies sous la forme :
CELEBREX (célécoxib) 200 mg les gélules sont blanches, avec une bande blanche imprimée au verso sur une bande dorée portant les inscriptions 7767 sur le capuchon et 200 sur le corps, fournies sous la forme :
CELEBREX (célécoxib) 400 mg les gélules sont blanches, avec une bande blanche imprimée au verso sur une bande verte avec les inscriptions 7767 sur la thèque et 400 sur le corps, fournies sous la forme :
Stockage
Conserver à température ambiante 20°C à 25°C (68°F à 77°F); excursions autorisées entre 15°C et 30°C (59°F à 86°F) [voir Température ambiante contrôlée USP ].
Distribué par : GD Searle LLC, Division de Pfizer Inc, NY, NY 10017. Révisé : avril 2021
EFFETS SECONDAIRES
Les effets indésirables suivants sont discutés plus en détail dans d'autres sections de l'étiquetage :
- Événements thrombotiques cardiovasculaires [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Saignement gastro-intestinal, ulcération et perforation [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hépatotoxicité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypertension [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Insuffisance cardiaque et œdème [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Toxicité rénale et hyperkaliémie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions anaphylactiques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions cutanées graves [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Toxicité hématologique [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique. Les informations sur les effets indésirables issues des essais cliniques fournissent cependant une base pour identifier les événements indésirables qui semblent être liés à l'utilisation de médicaments et pour estimer les taux.
Parmi les patients traités par CELEBREX dans les essais cliniques contrôlés de pré-commercialisation, environ 4 250 étaient des patients atteints d'arthrose, environ 2 100 étaient des patients atteints de polyarthrite rhumatoïde et environ 1 050 étaient des patients souffrant de douleur post-chirurgicale. Plus de 8 500 patients ont reçu une dose quotidienne totale de CELEBREX 200 mg de 200 mg (100 mg deux fois par jour ou 200 mg une fois par jour) ou plus, dont plus de 400 traités à 800 mg (400 mg deux fois par jour). Environ 3 900 patients ont reçu CELEBREX à ces doses pendant 6 mois ou plus ; environ 2 300 d'entre eux en bénéficient depuis 1 an ou plus et 124 d'entre eux en bénéficient depuis 2 ans ou plus.
Essais contrôlés sur l'arthrite avant commercialisation
Le tableau 1 répertorie tous les événements indésirables, quelle qu'en soit la cause, survenus chez ≥ 2 % des patients recevant CELEBREX 100 mg dans 12 études contrôlées menées chez des patients atteints d'arthrose ou de PR qui incluaient un groupe placebo et/ou un groupe témoin positif. Étant donné que ces 12 essais étaient de durées différentes et que les patients des essais n'avaient peut-être pas été exposés pendant la même durée, ces pourcentages ne reflètent pas les taux cumulés d'occurrence.
Dans les essais cliniques contrôlés contre placebo ou contre comparateur actif, le taux d'abandon en raison d'événements indésirables était de 7,1 % pour les patients recevant CELEBREX et de 6,1 % pour les patients recevant le placebo. Parmi les raisons les plus courantes d'arrêt du traitement en raison d'événements indésirables dans les groupes de traitement par CELEBREX figuraient la dyspepsie et les douleurs abdominales (citées comme raisons d'arrêt chez 0,8 % et 0,7 % des patients CELEBREX, respectivement). Parmi les patients recevant le placebo, 0,6 % ont arrêté en raison d'une dyspepsie et 0,6 % ont arrêté en raison de douleurs abdominales.
Les effets indésirables suivants sont survenus chez 0,1 % à 1,9 % des patients traités par CELEBREX (100 mg à 200 mg deux fois par jour ou 200 mg une fois par jour) :
Gastro-intestinal : Constipation, diverticulite, dysphagie, éructation, œsophagite, gastrite, gastro-entérite, reflux gastro-œsophagien, hémorroïdes, hernie hiatale, méléna, bouche sèche, stomatite, ténesme, vomissements
Cardiovasculaire: HTA aggravée, angine de poitrine, trouble coronarien, infarctus du myocarde
Général: Hypersensibilité, réaction allergique, douleur thoracique, kyste SAI, œdème généralisé, œdème facial, fatigue, fièvre, bouffées de chaleur, symptômes pseudo-grippaux, douleur, douleur périphérique
Système nerveux central et périphérique : Crampes dans les jambes, hypertonie, hypoesthésie, migraine, paresthésie, vertige
Auditif et vestibulaire : Surdité, acouphènes
Fréquence cardiaque et rythme : Palpitations, tachycardie
Foie et biliaire : Augmentation des enzymes hépatiques (y compris augmentation de la SGOT, augmentation de la SGPT)
Métabolique et nutritionnel : augmentation de l'urée sanguine (BUN), augmentation de la créatine phosphokinase (CPK), hypercholestérolémie, hyperglycémie, hypokaliémie, augmentation du NPN, augmentation de la créatinine, augmentation de la phosphatase alcaline, prise de poids
Musculo-squelettique : Arthralgie, arthrose, myalgie, synovite, tendinite
Plaquettes (saignement ou coagulation) : Ecchymoses, épistaxis, thrombocytémie,
Psychiatrique: Anorexie, anxiété, augmentation de l'appétit, dépression, nervosité, somnolence
Hémique : Anémie
Respiratoire: Bronchite, bronchospasme, bronchospasme aggravé, toux, dyspnée, laryngite, pneumonie
Peau et phanères : Alopécie, dermatite, réaction de photosensibilité, prurit, rash érythémateux, rash maculopapulaire, troubles cutanés, peau sèche, transpiration accrue, urticaire
Troubles au site d'application : Cellulite, dermatite de contact
Urinaire: Albuminurie, cystite, dysurie, hématurie, fréquence mictionnelle, calculs rénaux
Les événements indésirables graves suivants (causalité non évaluée) sont survenus chez
Cardiovasculaire: Syncope, insuffisance cardiaque congestive, fibrillation ventriculaire, embolie pulmonaire, accident vasculaire cérébral, gangrène périphérique, thrombophlébite
Gastro-intestinal : Obstruction intestinale, perforation intestinale, saignement gastro-intestinal, colite avec saignement, perforation œsophagienne, pancréatite, iléus
Général: Septicémie, mort subite
Foie et biliaire : Lithiase biliaire
Hémique et lymphatique : Thrombocytopénie
Nerveux: Ataxie, suicide [voir INTERACTIONS MÉDICAMENTEUSES ]
Rénal: Insuffisance rénale aiguë
L'étude sur l'innocuité à long terme du célécoxib dans l'arthrite
[voir Etudes cliniques ]
Événements hématologiques : L'incidence des diminutions cliniquement significatives de l'hémoglobine (> 2 g/dL) était plus faible chez les patients sous CELEBREX 400 mg deux fois par jour (0,5 %) que chez les patients sous diclofénac 75 mg deux fois par jour (1,3 %) ou ibuprofène 800 mg trois fois par jour 1,9 %. La plus faible incidence d'événements avec CELEBREX a été maintenue avec ou sans utilisation d'aspirine [voir PHARMACOLOGIE CLINIQUE ].
Retraits/Événements indésirables graves : Les taux cumulés de Kaplan-Meier à 9 mois pour les arrêts prématurés dus à des événements indésirables pour CELEBREX 100 mg, le diclofénac et l'ibuprofène étaient de 24 %, 29 % et 26 %, respectivement. Les taux d'événements indésirables graves (c'est-à-dire entraînant une hospitalisation ou jugés menaçant le pronostic vital ou autrement médicalement significatifs), quelle que soit la causalité, n'étaient pas différents entre les groupes de traitement (8 %, 7 % et 8 %, respectivement).
Étude sur la polyarthrite rhumatoïde juvénile
Dans une étude de 12 semaines, en double aveugle, contrôlée contre comparateur actif, 242 patients atteints d'ARJ âgés de 2 à 17 ans ont été traités par le célécoxib ou le naproxène ; 77 patients atteints d'ARJ ont été traités par célécoxib 3 mg/kg deux fois par jour, 82 patients ont été traités par célécoxib 6 mg/kg deux fois par jour et 83 patients ont été traités par naproxène 7,5 mg/kg deux fois par jour. Les effets indésirables les plus fréquents (≥ 5 %) chez les patients traités par le célécoxib étaient les maux de tête, la fièvre (pyrexie), les douleurs abdominales hautes, la toux, la rhinopharyngite, les douleurs abdominales, les nausées, l'arthralgie, la diarrhée et les vomissements. Les effets indésirables les plus fréquents (≥ 5 %) chez les patients traités au naproxène étaient les maux de tête, les nausées, les vomissements, la fièvre, les douleurs abdominales hautes, la diarrhée, la toux, les douleurs abdominales et les étourdissements (tableau 2). Comparativement au naproxène, le célécoxib aux doses de 3 et 6 mg/kg deux fois par jour n'a eu aucun effet délétère observable sur la croissance et le développement au cours de l'étude en double aveugle de 12 semaines. Il n'y avait pas de différence substantielle dans le nombre d'exacerbations cliniques d'uvéite ou de caractéristiques systémiques de l'ARJ parmi les groupes de traitement.
Dans une extension ouverte de 12 semaines de l'étude en double aveugle décrite ci-dessus, 202 patients atteints d'ARJ ont été traités avec du célécoxib 6 mg/kg deux fois par jour. L'incidence des événements indésirables a été similaire à celle observée lors de l'étude en double aveugle ; aucun événement indésirable inattendu d'importance clinique n'est apparu.
Autres études de pré-approbation
Événements indésirables des études sur la spondylarthrite ankylosante
Au total, 378 patients ont été traités par CELEBREX 200 mg dans des études sur la SA contrôlées par placebo et par comparateur actif. Des doses allant jusqu'à 400 mg une fois par jour ont été étudiées. Les types d'événements indésirables rapportés dans les études sur la SA étaient similaires à ceux rapportés dans les études sur l'OA/PR.
Événements indésirables des études sur l'analgésie et la dysménorrhée
Environ 1 700 patientes ont été traitées par CELEBREX 200 mg dans des études sur l'analgésie et la dysménorrhée. Tous les patients des études sur la douleur post-chirurgie buccale ont reçu une dose unique du médicament à l'étude. Des doses allant jusqu'à 600 mg/jour de CELEBREX 200 mg ont été étudiées dans des études sur la dysménorrhée primaire et la douleur post-chirurgie orthopédique. Les types d'événements indésirables dans les études sur l'analgésie et la dysménorrhée étaient similaires à ceux rapportés dans les études sur l'arthrite. Le seul événement indésirable supplémentaire rapporté était l'ostéite alvéolaire post-extraction dentaire (alvéolite sèche) dans les études sur la douleur post-chirurgie buccale.
Les essais APC et PreSAP
Effets indésirables des études de prévention des polypes à long terme contrôlées par placebo
L'exposition à CELEBREX dans les essais APC et PreSAP était de 400 mg à 800 mg par jour pendant 3 ans maximum [voir Etudes cliniques ].
Certains effets indésirables sont survenus chez des pourcentages de patients plus élevés que dans les essais de pré-commercialisation sur l'arthrite (durées de traitement allant jusqu'à 12 semaines ; voir Effets indésirables des essais contrôlés sur l'arthrite pré-commercialisation de CELEBREX 200 mg, ci-dessus). Les effets indésirables pour lesquels ces différences chez les patients traités par CELEBREX étaient plus importantes par rapport aux essais pré-commercialisation sur l'arthrite étaient les suivants :
Les effets indésirables supplémentaires suivants sont survenus chez ≥ 0,1 % et
Troubles du système nerveux : Infarctus cérébral
Troubles oculaires : Corps flottants du vitré, hémorragie conjonctivale
Oreille et labyrinthe : Labyrinthite
Troubles cardiaques : Angine instable, insuffisance valvulaire aortique, athérosclérose coronarienne, bradycardie sinusale, hypertrophie ventriculaire
Affections vasculaires : Thrombose veineuse profonde
Troubles de l'appareil reproducteur et des seins : Kyste de l'ovaire
Enquêtes : Augmentation du potassium sanguin, augmentation du sodium sanguin, diminution de la testostérone sanguine
Blessures, empoisonnements et complications procédurales : Épicondylite, rupture de tendon
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de CELEBREX. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Cardiovasculaire: Vascularite, thrombose veineuse profonde
Général: Réaction anaphylactoïde, œdème de Quincke
Foie et biliaire : Nécrose hépatique, hépatite, ictère, insuffisance hépatique
Hémique et lymphatique : Agranulocytose, anémie aplasique, pancytopénie, leucopénie
Métabolique: Hypoglycémie, hyponatrémie
Nerveux: Méningite aseptique, agueusie, anosmie, hémorragie intracrânienne mortelle
Rénal: Néphrite interstitielle
INTERACTIONS MÉDICAMENTEUSES
Voir le tableau 3 pour les interactions médicamenteuses cliniquement significatives avec le célécoxib.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Événements thrombotiques cardiovasculaires
Des essais cliniques portant sur plusieurs AINS sélectifs et non sélectifs de la cyclooxygénase-2 (COX-2) d'une durée pouvant aller jusqu'à trois ans ont montré un risque accru d'événements thrombotiques cardiovasculaires (CV) graves, y compris l'infarctus du myocarde (IM) et les accidents vasculaires cérébraux, qui peuvent être mortels. Sur la base des données disponibles, il n'est pas clair que le risque d'événements thrombotiques CV soit similaire pour tous les AINS. L'augmentation relative des événements thrombotiques CV graves par rapport au niveau de référence conférée par l'utilisation d'AINS semble être similaire chez les personnes avec et sans maladie CV connue ou facteurs de risque de maladie CV. Cependant, les patients présentant une maladie CV ou des facteurs de risque connus présentaient une incidence absolue plus élevée d'événements thrombotiques CV graves en excès, en raison de leur taux de base plus élevé. Certaines études observationnelles ont montré que ce risque accru d'événements thrombotiques CV graves commençait dès les premières semaines de traitement. L'augmentation du risque thrombotique CV a été observée le plus systématiquement à des doses plus élevées.
Dans l'essai APC (Adenoma Prevention with Celecoxib), le risque du critère composite de décès cardiovasculaire, d'infarctus du myocarde ou d'accident vasculaire cérébral était environ trois fois plus élevé dans les bras de traitement CELEBREX 400 mg deux fois par jour et CELEBREX 200 mg deux fois par jour par rapport au placebo. Les augmentations dans les deux groupes de doses de célécoxib par rapport aux patients traités par placebo étaient principalement dues à une incidence accrue d'infarctus du myocarde [voir Etudes cliniques ].
Un essai contrôlé randomisé intitulé Prospective Randomized Evaluation of Celecoxib Integrated Safety vs. Ibuprofen Or Naproxen (PRECISION) a été mené pour évaluer le risque thrombotique cardiovasculaire relatif d'un inhibiteur de la COX-2, le célécoxib, par rapport aux AINS non sélectifs naproxène et ibuprofène. Le célécoxib 100 mg deux fois par jour était non inférieur au naproxène375 à 500 mg deux fois par jour et à l'ibuprofène 600 à 800 mg trois fois par jour pour le critère composite des Antiplatelet Trialists & #39; Collaboration (APTC), qui comprend les décès cardiovasculaires (y compris les décès hémorragiques), les infarctus du myocarde non mortels et les accidents vasculaires cérébraux non mortels [voir Etudes cliniques ].
Pour minimiser le risque potentiel d'événement CV indésirable chez les patients traités par AINS, utiliser la dose efficace la plus faible pendant la durée la plus courte possible. Les médecins et les patients doivent rester attentifs à l'apparition de tels événements, tout au long du traitement, même en l'absence de symptômes CV antérieurs. Les patients doivent être informés des symptômes des événements CV graves et des mesures à prendre s'ils surviennent.
Il n'existe aucune preuve cohérente que l'utilisation concomitante d'aspirine atténue le risque accru d'événements thrombotiques CV graves associés à l'utilisation d'AINS. L'utilisation concomitante d'aspirine et d'un AINS, tel que le célécoxib, augmente le risque d'événements gastro-intestinaux (GI) graves [voir AVERTISSEMENTS ET PRECAUTIONS ].
Chirurgie post pontage aortocoronarien (CABG)
Deux grands essais cliniques contrôlés portant sur un AINS sélectif de la COX-2 pour le traitement de la douleur au cours des 10 à 14 premiers jours suivant un pontage coronarien ont révélé une incidence accrue d'infarctus du myocarde et d'accident vasculaire cérébral. Les AINS sont contre-indiqués dans le cadre d'un PAC [voir CONTRE-INDICATIONS ].
Patients post-IM
Des études observationnelles menées dans le registre national danois ont démontré que les patients traités par AINS dans la période post-IM présentaient un risque accru de récidive d'infarctus, de décès d'origine CV et de mortalité toutes causes confondues dès la première semaine de traitement. Dans cette même cohorte, l'incidence des décès au cours de la première année suivant l'IM était de 20 pour 100 années-personnes chez les patients traités par AINS contre 12 pour 100 années-personnes chez les patients non exposés aux AINS. Bien que le taux absolu de décès ait quelque peu diminué après la première année après l'infarctus du myocarde, le risque relatif accru de décès chez les utilisateurs d'AINS a persisté pendant au moins les quatre années de suivi suivantes.
Éviter l'utilisation de CELEBREX 100 mg chez les patients ayant récemment subi un IM à moins que les bénéfices ne soient censés l'emporter sur le risque d'événements thrombotiques CV récurrents. Si CELEBREX est utilisé chez des patients ayant récemment subi un IM, surveiller les patients afin de détecter tout signe d'ischémie cardiaque.
Saignement gastro-intestinal, ulcération et perforation
Les AINS, y compris le célécoxib, provoquent des effets indésirables gastro-intestinaux (GI) graves, notamment une inflammation, des saignements, une ulcération et une perforation de l'œsophage, de l'estomac, de l'intestin grêle ou du gros intestin, qui peuvent être fatals. Ces événements indésirables graves peuvent survenir à tout moment, avec ou sans symptômes précurseurs, chez les patients traités par CELEBREX. Seul un patient sur cinq qui développe un événement indésirable gastro-intestinal supérieur grave sous traitement par AINS est symptomatique. Des ulcères gastro-intestinaux supérieurs, des saignements macroscopiques ou des perforations causés par les AINS sont survenus chez environ 1 % des patients traités pendant 3 à 6 mois et chez environ 2 % à 4 % des patients traités pendant un an. Cependant, même un traitement à court terme par AINS n'est pas sans risque.
Facteurs de risque de saignement gastro-intestinal, d'ulcération et de perforation
Les patients ayant des antécédents d'ulcère peptique et/ou d'hémorragie gastro-intestinale qui utilisaient des AINS avaient un risque plus de 10 fois plus élevé de développer une hémorragie gastro-intestinale par rapport aux patients sans ces facteurs de risque. D'autres facteurs qui augmentent le risque d'hémorragie gastro-intestinale chez les patients traités avec des AINS comprennent une durée plus longue du traitement par AINS ; utilisation concomitante de corticostéroïdes oraux, d'antiagrégants plaquettaires (tels que l'aspirine), d'anticoagulants ; ou les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS); fumeur; Utilisation d'alcool; âge avancé; et un mauvais état de santé général. La plupart des rapports post-commercialisation d'événements gastro-intestinaux mortels sont survenus chez des patients âgés ou affaiblis. De plus, les patients atteints d'une maladie hépatique avancée et/ou d'une coagulopathie présentent un risque accru d'hémorragie gastro-intestinale.
Les taux d'ulcères compliqués et symptomatiques étaient de 0,78 % à neuf mois pour tous les patients de l'essai CLASS et de 2,19 % pour le sous-groupe sous AAS à faible dose. Les patients de 65 ans et plus avaient une incidence de 1,40 % à neuf mois, 3,06 % lorsqu'ils prenaient également de l'AAS [voir Etudes cliniques ].
Stratégies pour minimiser les risques gastro-intestinaux chez les patients traités par AINS
- Utilisez la dose efficace la plus faible pendant la durée la plus courte possible.
- Évitez l'administration de plus d'un AINS à la fois.
- Éviter l'utilisation chez les patients à risque plus élevé à moins que les bénéfices attendus ne l'emportent sur le risque accru de saignement. Pour ces patients, ainsi que ceux présentant des saignements gastro-intestinaux actifs, envisagez des thérapies alternatives autres que les AINS.
- Restez attentif aux signes et symptômes d'ulcération et de saignement gastro-intestinaux pendant le traitement par AINS.
- Si un événement indésirable GI grave est suspecté, initier rapidement une évaluation et un traitement, et interrompre CELEBREX 200 mg jusqu'à ce qu'un événement indésirable GI grave soit exclu.
- Dans le cadre de l'utilisation concomitante d'aspirine à faible dose pour la prophylaxie cardiaque, surveiller de plus près les patients afin de déceler tout signe d'hémorragie gastro-intestinale [voir INTERACTIONS MÉDICAMENTEUSES ].
Hépatotoxicité
Des élévations de l'ALT ou de l'AST (trois fois ou plus la limite supérieure de la normale [LSN]) ont été signalées chez environ 1 % des patients traités par AINS dans les essais cliniques. De plus, des cas rares, parfois mortels, d'atteinte hépatique grave, y compris une hépatite fulminante, une nécrose hépatique et une insuffisance hépatique, ont été signalés.
Des élévations de l'ALT ou de l'AST (moins de trois fois la LSN) peuvent survenir chez jusqu'à 15 % des patients traités par des AINS, y compris le célécoxib.
Dans les essais cliniques contrôlés de CELEBREX 200 mg, l'incidence des élévations limites (supérieures ou égales à 1,2 fois et inférieures à 3 fois la limite supérieure de la normale) des enzymes hépatiques était de 6 % pour CELEBREX et de 5 % pour le placebo, et d'environ 0,2 % des patients sous CELEBREX et 0,3 % des patients sous placebo ont présenté des élévations notables des ALAT et ASAT.
Informer les patients des signes avant-coureurs et des symptômes d'hépatotoxicité (p. ex., nausées, fatigue, léthargie, diarrhée, prurit, jaunisse, sensibilité du quadrant supérieur droit et symptômes « pseudo-grippaux »). Si des signes cliniques et des symptômes compatibles avec une maladie du foie se développent, ou si des manifestations systémiques se produisent (par exemple, éosinophilie, éruption cutanée), arrêter CELEBREX immédiatement et effectuer une évaluation clinique du patient.
Hypertension
Les AINS, y compris CELEBREX 200 mg, peuvent entraîner une nouvelle apparition d'hypertension ou une aggravation d'une hypertension préexistante, l'un ou l'autre pouvant contribuer à l'augmentation de l'incidence des événements CV. Les patients prenant des inhibiteurs de l'enzyme de conversion de l'angiotensine (ECA), des diurétiques thiazidiques ou des diurétiques de l'anse peuvent présenter une réponse altérée à ces traitements lorsqu'ils prennent des AINS [voir INTERACTIONS MÉDICAMENTEUSES ].
Voir Etudes cliniques pour des données supplémentaires sur la tension artérielle pour CELEBREX.
Surveiller la tension artérielle (TA) au début du traitement par AINS et tout au long du traitement.
Insuffisance cardiaque et œdème
Les expérimentateurs du Coxib et des AINS traditionnels & # 39; Une méta-analyse collaborative d'essais contrôlés randomisés a démontré une augmentation d'environ deux fois des hospitalisations pour insuffisance cardiaque chez les patients traités sélectivement par COX-2 et les patients traités par AINS non sélectifs par rapport aux patients traités par placebo. Dans une étude du registre national danois sur des patients souffrant d'insuffisance cardiaque, l'utilisation d'AINS a augmenté le risque d'infarctus du myocarde, d'hospitalisation pour insuffisance cardiaque et de décès.
De plus, une rétention hydrique et un œdème ont été observés chez certains patients traités par AINS. L'utilisation du célécoxib peut atténuer les effets CV de plusieurs agents thérapeutiques utilisés pour traiter ces affections médicales (par exemple, les diurétiques, les inhibiteurs de l'ECA ou les antagonistes des récepteurs de l'angiotensine [ARA]) [voir INTERACTIONS MÉDICAMENTEUSES ].
Dans l'étude CLASS [voir Etudes cliniques ], les taux cumulatifs de Kaplan-Meier à 9 mois de patients hospitalisés avec œdème périphérique sous CELEBREX 400 mg deux fois par jour (respectivement 4 fois et 2 fois les doses recommandées pour l'OA et la PR), ibuprofène 800 mg trois fois par jour et diclofénac 75 mg deux fois par jour étaient respectivement de 4,5 %, 6,9 % et 4,7 %.
Éviter l'utilisation de CELEBREX 200 mg chez les patients atteints d'insuffisance cardiaque sévère à moins que les bénéfices attendus ne l'emportent sur le risque d'aggravation de l'insuffisance cardiaque. Si CELEBREX 100 mg est utilisé chez des patients souffrant d'insuffisance cardiaque sévère, surveiller les patients afin de détecter tout signe d'aggravation de l'insuffisance cardiaque.
Toxicité rénale et hyperkaliémie
Toxicité rénale
L'administration à long terme d'AINS a entraîné une nécrose papillaire rénale et d'autres lésions rénales.
Une toxicité rénale a également été observée chez des patients chez qui les prostaglandines rénales ont un rôle compensateur dans le maintien de la perfusion rénale. Chez ces patients, l'administration d'un AINS peut entraîner une réduction dose-dépendante de l'information des prostaglandes et, accessoirement, du débit sanguin rénal, ce qui peut précipiter une décompensation rénale manifeste. Les patients les plus à risque de cette réaction sont ceux qui présentent une fonction rénale altérée, une déshydratation, une hypovolémie, une insuffisance cardiaque, un dysfonctionnement hépatique, ceux qui prennent des diurétiques, des inhibiteurs de l'ECA ou des ARA et les personnes âgées. L'arrêt du traitement par AINS est généralement suivi d'un retour à l'état antérieur au traitement.
Aucune information issue d'études cliniques contrôlées n'est disponible concernant l'utilisation de CELEBREX 100 mg chez les patients atteints d'insuffisance rénale avancée. Les effets rénaux de CELEBREX peuvent accélérer la progression de l'insuffisance rénale chez les patients atteints d'insuffisance rénale préexistante.
Corriger le statut volémique chez les patients déshydratés ou hypovolémiques avant de commencer CELEBREX. Surveiller la fonction rénale chez les patients atteints d'insuffisance rénale ou hépatique, d'insuffisance cardiaque, de déshydratation ou d'hypovolémie pendant l'utilisation de CELEBREX [voir INTERACTIONS MÉDICAMENTEUSES ]. Éviter l'utilisation de CELEBREX 200 mg chez les patients atteints d'insuffisance rénale avancée à moins que les bénéfices attendus ne l'emportent sur le risque d'aggravation de la fonction rénale. Si CELEBREX 200 mg est utilisé chez des patients atteints d'insuffisance rénale avancée, surveiller les patients afin de détecter tout signe d'aggravation de la fonction rénale.
Hyperkaliémie
Des augmentations de la concentration sérique de potassium, y compris une hyperkaliémie, ont été rapportées avec l'utilisation d'AINS, même chez certains patients sans insuffisance rénale. Chez les patients ayant une fonction rénale normale, ces effets ont été attribués à un état d'hyporénine-hypoaldostéronisme.
Réactions anaphylactiques
Le célécoxib a été associé à des réactions anaphylactiques chez des patients avec ou sans hypersensibilité connue au célécoxib et chez des patients asthmatiques sensibles à l'aspirine. Celebrex 200 mg est un sulfamide et les AINS et les sulfamides peuvent provoquer des réactions de type allergique, notamment des symptômes anaphylactiques et des épisodes asthmatiques potentiellement mortels ou moins graves chez certaines personnes sensibles [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Cherchez de l'aide d'urgence si une réaction anaphylactique se produit.
Exacerbation de l'asthme lié à la sensibilité à l'aspirine
Une sous-population de patients asthmatiques peut avoir un asthme sensible à l'aspirine qui peut inclure une rhinosinusite chronique compliquée par des polypes nasaux ; bronchospasme sévère, potentiellement mortel ; et/ou intolérance à l'aspirine et aux autres AINS. Étant donné qu'une réactivité croisée entre l'aspirine et d'autres AINS a été rapportée chez ces patients sensibles à l'aspirine, CELEBREX est contre-indiqué chez les patients présentant cette forme de sensibilité à l'aspirine [voir CONTRE-INDICATIONS ]. Lorsque CELEBREX est utilisé chez des patients souffrant d'asthme préexistant (sans sensibilité connue à l'aspirine), surveiller l'évolution des signes et symptômes de l'asthme.
Réactions cutanées graves
Des réactions cutanées graves sont survenues après le traitement par Celebrex 200 mg, notamment un érythème polymorphe, une dermatite exfoliative, le syndrome de Stevens-Johnson (SJS), une nécrolyse épidermique toxique (NET), une réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) et une pustulose exanthématique aiguë généralisée ( AGEP). Ces événements graves peuvent survenir sans avertissement et peuvent être mortels.
Informer les patients des signes et symptômes des réactions cutanées graves et leur demander d'arrêter l'utilisation de CELEBREX 100 mg dès la première apparition d'une éruption cutanée ou de tout autre signe d'hypersensibilité. CELEBREX 200 mg est contre-indiqué chez les patients ayant déjà présenté des réactions cutanées graves aux AINS [voir CONTRE-INDICATIONS ].
Réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS)
Une réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) a été signalée chez des patients prenant des AINS tels que CELEBREX. Certains de ces événements ont été mortels ou potentiellement mortels. Le syndrome DRESS se manifeste généralement, mais pas exclusivement, par de la fièvre, une éruption cutanée, une lymphadénopathie et/ou un gonflement du visage. D'autres manifestations cliniques peuvent inclure une hépatite, une néphrite, des anomalies hématologiques, une myocardite ou une myosite. Parfois, les symptômes du DRESS peuvent ressembler à une infection virale aiguë. L'éosinophilie est souvent présente. Parce que ce trouble est variable dans sa présentation, d'autres systèmes d'organes non notés ici peuvent être impliqués. Il est important de noter que des manifestations précoces d'hypersensibilité, comme de la fièvre ou une adénopathie, peuvent être présentes même si l'éruption cutanée n'est pas évidente. Si de tels signes ou symptômes sont présents, arrêtez CELEBREX 200 mg et évaluez immédiatement le patient.
Toxicité fœtale
Fermeture prématurée du canal artériel fœtal
Évitez l'utilisation d'AINS, y compris CELEBREX 100 mg, chez les femmes enceintes à environ 30 semaines de gestation et plus tard. Les AINS, y compris CELEBREX, augmentent le risque de fermeture prématurée du canal artériel fœtal à environ cet âge gestationnel.
Oligohydramnios/Insuffisance rénale néonatale
L'utilisation d'AINS, y compris CELEBREX, à environ 20 semaines de gestation ou plus tard au cours de la grossesse peut entraîner un dysfonctionnement rénal fœtal entraînant un oligohydramnios et, dans certains cas, une insuffisance rénale néonatale. Ces résultats indésirables sont observés, en moyenne, après des jours à des semaines de traitement, bien que l'oligohydramnios ait été rarement signalé dès 48 heures après le début des AINS. L'oligohydramnios est souvent, mais pas toujours, réversible à l'arrêt du traitement. Les complications d'un oligohydramnios prolongé peuvent, par exemple, inclure des contractures des membres et un retard de maturation pulmonaire. Dans certains cas post-commercialisation d'insuffisance rénale néonatale, des procédures invasives telles que l'exsanguinotransfusion ou la dialyse ont été nécessaires.
Si un traitement par AINS est nécessaire entre environ 20 semaines et 30 semaines de gestation, limiter l'utilisation de CELEBREX à la dose efficace la plus faible et à la durée la plus courte possible. Envisager une surveillance échographique du liquide amniotique si le traitement par CELEBREX se prolonge au-delà de 48 heures. Arrêtez CELEBREX en cas d'oligohydramnios et effectuez un suivi conformément à la pratique clinique[voir Utilisation dans des populations spécifiques ].
Toxicité hématologique
Une anémie est survenue chez des patients traités par AINS. Cela peut être dû à une perte de sang occulte ou importante, à une rétention d'eau ou à un effet incomplètement décrit sur l'érythropoïèse. Si un patient traité par CELEBREX présente des signes ou des symptômes d'anémie, surveiller l'hémoglobine ou l'hématocrite.
Dans les essais cliniques contrôlés, l'incidence de l'anémie était de 0,6 % avec CELEBREX et de 0,4 % avec le placebo. Les patients sous traitement à long terme par CELEBREX 200 mg doivent faire vérifier leur hémoglobine ou leur hématocrite s'ils présentent des signes ou des symptômes d'anémie ou de perte de sang.
Les AINS, y compris CELEBREX 100 mg, peuvent augmenter le risque d'événements hémorragiques. Les affections comorbides telles que les troubles de la coagulation ou l'utilisation concomitante de warfarine, d'autres anticoagulants, d'antiplaquettaires (p. ex., aspirine), d'ISRS et d'inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) peuvent augmenter ce risque. Surveiller ces patients pour des signes de saignement [voir INTERACTIONS MÉDICAMENTEUSES ].
Masquage de l'inflammation et de la fièvre
L'activité pharmacologique de CELEBREX 100 mg dans la réduction de l'inflammation, et éventuellement de la fièvre, peut diminuer l'utilité des signes diagnostiques dans la détection des infections.
Surveillance en laboratoire
Étant donné que des saignements gastro-intestinaux graves, une hépatotoxicité et des lésions rénales peuvent survenir sans symptômes ou signes avant-coureurs, envisagez de surveiller périodiquement les patients sous traitement AINS à long terme avec un CBC et un profil chimique [voir AVERTISSEMENTS ET PRECAUTIONS ].
Dans les essais cliniques contrôlés, une élévation de l'urée s'est produite plus fréquemment chez les patients recevant CELEBREX que chez les patients recevant le placebo. Cette anomalie de laboratoire a également été observée chez les patients ayant reçu des AINS comparateurs dans ces études. La signification clinique de cette anomalie n'a pas été établie.
Coagulation intravasculaire disséminée (CIVD)
En raison du risque de coagulation intravasculaire disséminée lors de l'utilisation de CELEBREX 200 mg chez les patients pédiatriques atteints d'ARJ d'apparition systémique, surveiller les patients pour détecter tout signe et symptôme de coagulation ou de saignement anormal, et informer les patients et leurs soignants de signaler les symptômes dès que possible.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments ) qui accompagne chaque ordonnance délivrée. Informez les patients, les familles ou leurs soignants des informations suivantes avant de commencer le traitement par CELEBREX et périodiquement au cours du traitement en cours.
Événements thrombotiques cardiovasculaires
Conseillez aux patients d'être attentifs aux symptômes d'événements thrombotiques cardiovasculaires, y compris les douleurs thoraciques, l'essoufflement, la faiblesse ou les troubles de l'élocution, et de signaler immédiatement tout symptôme à leur fournisseur de soins de santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Saignement gastro-intestinal, ulcération et perforation
Conseillez aux patients de signaler les symptômes d'ulcérations et de saignements, y compris la douleur épigastrique, la dyspepsie, le méléna et l'hématémèse à leur fournisseur de soins de santé. En cas d'utilisation concomitante d'aspirine à faible dose pour la prophylaxie cardiaque, informer les patients du risque accru et des signes et symptômes d'hémorragie gastro-intestinale [voir AVERTISSEMENTS ET PRECAUTIONS ].
Hépatotoxicité
Informer les patients des signes avant-coureurs et des symptômes d'hépatotoxicité (p. ex., nausées, fatigue, léthargie, prurit, diarrhée, jaunisse, sensibilité de l'hypochondre droit et symptômes « pseudo-grippaux »). Si cela se produit, demandez aux patients d'arrêter CELEBREX 200 mg et de consulter immédiatement un médecin [voir AVERTISSEMENTS ET PRECAUTIONS , Utilisation dans des populations spécifiques ].
Insuffisance cardiaque et œdème
Conseillez aux patients d'être attentifs aux symptômes d'insuffisance cardiaque congestive, y compris l'essoufflement, la prise de poids inexpliquée ou l'œdème, et de contacter leur fournisseur de soins de santé si de tels symptômes surviennent [voir AVERTISSEMENTS ET PRECAUTIONS ].
Réactions anaphylactiques
Informer les patients des signes d'une réaction anaphylactique (par exemple, difficulté à respirer, gonflement du visage ou de la gorge). Demandez aux patients de demander de l'aide d'urgence immédiate si ceux-ci se produisent [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Réactions cutanées graves, y compris DRESS
Conseillez aux patients d'arrêter immédiatement de prendre CELEBREX 100 mg s'ils développent tout type d'éruption cutanée ou de fièvre et de contacter leur médecin dès que possible [voir AVERTISSEMENTS ET PRECAUTIONS ].
Fertilité féminine
Informez les femmes en âge de procréer qui désirent une grossesse que les AINS, y compris CELEBREX 200 mg, peuvent être associés à un retard réversible de l'ovulation [voir Utilisation dans des populations spécifiques ].
Toxicité fœtale
Informer les femmes enceintes qu'elles doivent éviter l'utilisation de CELEBREX et d'autres AINS à partir de 30 semaines de gestation en raison du risque de fermeture prématurée du canal artériel fœtal. Si le traitement par CELEBREX 200 mg est nécessaire chez une femme enceinte entre 20 et 30 semaines de gestation environ, l'informer qu'elle devra peut-être être surveillée pour un oligohydramnios si le traitement dure plus de 48 heures [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Éviter l'utilisation concomitante d'AINS
Informer les patients que l'utilisation concomitante de CELEBREX avec d'autres AINS ou salicylates (p. ex. diflunisal, salsalate) n'est pas recommandée en raison du risque accru de toxicité gastro-intestinale et de l'augmentation faible ou nulle de l'efficacité [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ]. Alerter les patients que des AINS peuvent être présents dans des médicaments « en vente libre » pour le traitement du rhume, de la fièvre ou de l'insomnie.
Utilisation d'AINS et d'aspirine à faible dose
Informez les patients de ne pas utiliser d'aspirine à faible dose en même temps que CELEBREX 200 mg jusqu'à ce qu'ils en parlent à leur professionnel de la santé [voir INTERACTIONS MÉDICAMENTEUSES ].
L'étiquetage de ce produit a peut-être été mis à jour. Pour les informations de prescription les plus récentes, veuillez visiter www.pfizer.com.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Le célécoxib n'était pas cancérigène chez les rats Sprague-Dawley ayant reçu des doses orales allant jusqu'à 200 mg/kg pour les mâles et 10 mg/kg pour les femelles (environ 2 à 4 fois l'exposition humaine telle que mesurée par l'ASC0-24 à 200 mg deux fois par jour ) ou chez des souris ayant reçu des doses orales allant jusqu'à 25 mg/kg pour les mâles et 50 mg/kg pour les femelles (approximativement égales à l'exposition humaine mesurée par l'ASC0-24 à 200 mg deux fois par jour) pendant deux ans.
Mutagenèse
Le célécoxib n'était pas mutagène dans un test d'Ames et un test de mutation sur des cellules ovariennes de hamster chinois (CHO), ni clastogène dans un test d'aberration chromosomique sur des cellules CHO et un test du micronoyau in vivo sur de la moelle osseuse de rat.
Altération de la fertilité
Le célécoxib n'a eu aucun effet sur la fertilité mâle ou femelle ou sur la fonction reproductrice mâle chez le rat à des doses orales allant jusqu'à 600 mg/kg/jour (environ 11 fois l'exposition humaine à 200 mg deux fois par jour sur la base de l'ASC0-24). À ≥ 50 mg/kg/jour (environ 6 fois l'exposition humaine sur la base de l'ASC0-24 à 200 mg deux fois par jour), la perte préimplantatoire a augmenté.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
L'utilisation d'AINS, y compris CELEBREX 200 mg, peut entraîner une fermeture prématurée du canal artériel fœtal et un dysfonctionnement rénal fœtal entraînant un oligohydramnios et, dans certains cas, une insuffisance rénale néonatale. En raison de ces risques, limiter la dose et la durée d'utilisation de CELEBREX 200 mg entre environ 20 et 30 semaines de gestation et éviter l'utilisation de CELEBREX à environ 30 semaines de gestation et plus tard au cours de la grossesse (voir Considérations cliniques, données ).
Fermeture prématurée du canal artériel fœtal
L'utilisation d'AINS, y compris CELEBREX, à environ 30 semaines de gestation ou plus tard au cours de la grossesse augmente le risque de fermeture prématurée du canal artériel fœtal.
Oligohydramnios/Insuffisance rénale néonatale
L'utilisation d'AINS à environ 20 semaines de gestation ou plus tard pendant la grossesse a été associée à des cas de dysfonctionnement rénal fœtal entraînant un oligohydramnios et, dans certains cas, une insuffisance rénale néonatale.
Les données d'études observationnelles concernant d'autres risques potentiels pour l'embryon et le fœtus de l'utilisation d'AINS chez les femmes au cours du premier ou du deuxième trimestre de la grossesse ne sont pas concluantes. Dans les études de reproduction chez l'animal, des décès embryo-fœtaux et une augmentation des hernies diaphragmatiques ont été observés chez des rats ayant reçu quotidiennement du célécoxib pendant la période d'organogenèse à des doses orales d'environ 6 fois la dose humaine maximale recommandée (MRHD) de 200 mg deux fois par jour. De plus, des anomalies structurelles (p. ex., défauts septaux, côtes fusionnées, sternèbres fusionnées et sternèbres déformées) ont été observées chez des lapins ayant reçu des doses orales quotidiennes de célécoxib pendant la période d'organogenèse à environ 2 fois la MRHD (voir Données ). Sur la base de données animales, il a été démontré que les prostaglandines jouent un rôle important dans la perméabilité vasculaire de l'endomètre, l'implantation de blastocystes et la décidualisation. Dans les études animales, l'administration d'inhibiteurs de la synthèse des prostaglandines, tels que le célécoxib, a entraîné une augmentation des pertes avant et après l'implantation. Il a également été démontré que les prostaglandines jouent un rôle important dans le développement du rein fœtal. Dans des études animales publiées, il a été rapporté que les inhibiteurs de la synthèse des prostaglandines altèrent le développement des reins lorsqu'ils sont administrés à des doses cliniquement pertinentes.
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Considérations cliniques
Effets indésirables fœtaux/néonatals
Fermeture prématurée du canal artériel fœtal
Éviter l'utilisation d'AINS chez les femmes à environ 30 semaines de gestation et plus tard au cours de la grossesse, car les AINS, y compris CELEBREX 200 mg, peuvent provoquer une fermeture prématurée du canal artériel fœtal (voir Données ).
Oligohydramnios/Insuffisance rénale néonatale :
Si un AINS est nécessaire à environ 20 semaines de gestation ou plus tard au cours de la grossesse, limitez l'utilisation à la dose efficace la plus faible et à la durée la plus courte possible. Si le traitement par CELEBREX se prolonge au-delà de 48 heures, envisager une surveillance par échographie pour un oligohydramnios. En cas d'oligohydramnios, interrompre CELEBREX et assurer le suivi conformément à la pratique clinique (voir Données ).
Travail ou accouchement
Il n'y a pas d'études sur les effets de CELEBREX pendant le travail ou l'accouchement. Dans les études animales, les AINS, y compris le célécoxib, inhibent la synthèse des prostaglandines, retardent la parturition et augmentent l'incidence des mortinaissances.
Données
Données humaines
Les données disponibles n'établissent pas la présence ou l'absence de toxicité pour le développement liée à l'utilisation de CELEBREX.
Fermeture prématurée du canal artériel fœtal
La littérature publiée rapporte que l'utilisation d'AINS à environ 30 semaines de gestation et plus tard au cours de la grossesse peut entraîner une fermeture prématurée du canal artériel fœtal.
Oligohydramnios/Insuffisance rénale néonatale
Des études publiées et des rapports post-commercialisation décrivent l'utilisation maternelle d'AINS à environ 20 semaines de gestation ou plus tard pendant la grossesse associée à un dysfonctionnement rénal fœtal entraînant un oligohydramnios et, dans certains cas, une insuffisance rénale néonatale. Ces résultats indésirables sont observés, en moyenne, après des jours à des semaines de traitement, bien que l'oligohydramnios ait été rarement signalé dès 48 heures après le début des AINS. Dans de nombreux cas, mais pas tous, la diminution du liquide amniotique était transitoire et réversible avec l'arrêt du médicament. Il y a eu un nombre limité de rapports de cas d'utilisation maternelle d'AINS et de dysfonctionnement rénal néonatal sans oligohydramnios, dont certains étaient irréversibles. Certains cas de dysfonctionnement rénal néonatal ont nécessité un traitement par des procédures invasives, telles que l'exsanguinotransfusion ou la dialyse.
Les limites méthodologiques de ces études et rapports post-commercialisation incluent l'absence d'un groupe témoin ; informations limitées concernant la dose, la durée et le moment de l'exposition au médicament ; et l'utilisation concomitante d'autres médicaments. Ces limitations empêchent d'établir une estimation fiable du risque d'issues fœtales et néonatales indésirables avec l'utilisation maternelle d'AINS. Étant donné que les données publiées sur l'innocuité des issues néonatales impliquaient principalement des prématurés, la généralisation de certains risques signalés au nourrisson né à terme exposé aux AINS par l'utilisation maternelle est incertaine.
Données animales
Le célécoxib à des doses orales ≥ 150 mg/kg/jour (environ 2 fois l'exposition humaine à 200 mg deux fois par jour, mesurée par ASC0-24), a entraîné une incidence accrue de malformations septales ventriculaires, un événement rare, et des altérations fœtales, telles que les côtes fusionnaient, les sternèbres fusionnaient et les sternèbres étaient déformées lorsque les lapins étaient traités tout au long de l'organogenèse. Une augmentation dose-dépendante des hernies diaphragmatiques a été observée lorsque des rats ont reçu du célécoxib à des doses orales ≥ 30 mg/kg/jour (environ 6 fois l'exposition humaine sur la base de l'ASC 0–24 à 200 mg deux fois par jour pour la PR) tout au long de l'organogenèse. Chez le rat, l'exposition au célécoxib au début du développement embryonnaire a entraîné des pertes pré-implantation et post-implantation à des doses orales ≥ 50 mg/kg/jour (environ 6 fois l'exposition humaine sur la base de l'ASC 0-24 à 200 mg deux fois par jour pour RA).
Le célécoxib n'a produit aucun signe de retard de travail ou de parturition à des doses orales allant jusqu'à 100 mg/kg chez le rat (environ 7 fois l'exposition humaine telle que mesurée par l'ASC 0-24 à 200 mg deux fois par jour). Les effets de CELEBREX sur le travail et l'accouchement chez les femmes enceintes sont inconnus.
Lactation
Résumé des risques
Des données limitées provenant de 3 rapports publiés portant sur un total de 12 femmes allaitantes ont montré de faibles niveaux de CELEBREX dans le lait maternel. La dose quotidienne moyenne calculée pour le nourrisson était de 10 à 40 mcg/kg/jour, soit moins de 1 % de la dose thérapeutique basée sur le poids pour un enfant de deux ans. Un rapport portant sur deux nourrissons allaités âgés de 17 et 22 mois n'a révélé aucun événement indésirable. La prudence s'impose lorsque CELEBREX 100 mg est administré à une femme qui allaite. Les bénéfices de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de CELEBREX pour la mère et tout effet indésirable potentiel sur le nourrisson allaité à cause de CELEBREX 200 mg ou de l'affection maternelle sous-jacente.
Femelles et mâles de potentiel reproducteur
Infertilité
Femelles
D'après leur mécanisme d'action, l'utilisation d'AINS médiés par les prostaglandines, y compris CELEBREX, peut retarder ou prévenir la rupture des follicules ovariens, qui a été associée à une infertilité réversible chez certaines femmes. Des études animales publiées ont montré que l'administration d'inhibiteurs de la synthèse des prostaglandines a le potentiel de perturber la rupture folliculaire médiée par les prostaglandines nécessaire à l'ovulation. De petites études chez des femmes traitées avec des AINS ont également montré un retard réversible de l'ovulation. Envisager l'arrêt des AINS, y compris CELEBREX 200 mg, chez les femmes qui ont des difficultés à concevoir ou qui font l'objet d'un examen d'infertilité.
Utilisation pédiatrique
CELEBREX 200 mg est approuvé pour le soulagement des signes et des symptômes de la polyarthrite rhumatoïde juvénile chez les patients de 2 ans et plus. L'innocuité et l'efficacité n'ont pas été étudiées au-delà de six mois chez les enfants. La toxicité cardiovasculaire à long terme chez les enfants exposés à CELEBREX 100 mg n'a pas été évaluée et on ne sait pas si les risques à long terme peuvent être similaires à ceux observés chez les adultes exposés à CELEBREX ou à d'autres AINS sélectifs et non sélectifs de la COX-2 [voir AVERTISSEMENT ENCADRÉ , AVERTISSEMENTS ET PRECAUTIONS , et Etudes cliniques ].
L'utilisation du célécoxib chez les patients âgés de 2 à 17 ans atteints d'ARJ pauciarticulaire à évolution polyarticulaire ou chez les patients atteints d'ARJ d'apparition systémique a été étudiée dans une étude pharmacocinétique, d'innocuité et d'efficacité, en double aveugle, contrôlée par comparateur actif, d'une durée de 12 semaines, avec un Extension de 12 semaines en ouvert. Le célécoxib n'a pas été étudié chez les patients de moins de 2 ans, chez les patients pesant moins de 10 kg (22 lb) et chez les patients présentant des caractéristiques systémiques actives. Les patients atteints d'ARJ d'apparition systémique (sans caractéristiques systémiques actives) semblent être à risque de développer des tests de laboratoire de coagulation anormaux. Chez certains patients atteints d'ARJ d'apparition systémique, le célécoxib et le naproxène ont été associés à un léger allongement du temps de thromboplastine partielle activée (APTT) mais pas du temps de prothrombine (PT). Lorsque des AINS, y compris le célécoxib, sont utilisés chez des patients atteints d'ARJ d'apparition systémique, surveiller les signes et symptômes de coagulation ou de saignement anormaux, en raison du risque de coagulation intravasculaire disséminée. Les patients atteints d'ARJ d'apparition systémique doivent être surveillés pour le développement de tests de coagulation anormaux [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS , EFFETS INDÉSIRABLES , Toxicologie animale , Etudes cliniques ].
Des thérapies alternatives pour le traitement de l'ARJ doivent être envisagées chez les patients pédiatriques identifiés comme métaboliseurs lents du CYP2C9 [voir Métaboliseurs lents des substrats du CYP2C9 ].
Utilisation gériatrique
Les patients âgés, comparés aux patients plus jeunes, sont plus à risque d'effets indésirables cardiovasculaires, gastro-intestinaux et/ou rénaux graves associés aux AINS. Si le bénéfice attendu pour le patient âgé l'emporte sur ces risques potentiels, commencez le dosage à l'extrémité inférieure de la plage de dosage et surveillez les patients pour détecter tout effet indésirable [voir AVERTISSEMENTS ET PRECAUTIONS ].
Sur le nombre total de patients ayant reçu CELEBREX 100 mg dans les essais cliniques de pré-approbation, plus de 3 300 étaient âgés de 65 à 74 ans, tandis qu'environ 1 300 patients supplémentaires avaient 75 ans et plus. Aucune différence substantielle d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes. Dans les études cliniques comparant la fonction rénale mesurée par le DFG, l'azote uréique sanguin et la créatinine, et la fonction plaquettaire mesurée par le temps de saignement et l'agrégation plaquettaire, les résultats n'étaient pas différents entre les volontaires âgés et jeunes. Cependant, comme pour les autres AINS, y compris ceux qui inhibent sélectivement la COX-2, il y a eu plus de rapports post-commercialisation spontanés d'événements gastro-intestinaux mortels et d'insuffisance rénale aiguë chez les personnes âgées que chez les patients plus jeunes [voir AVERTISSEMENTS ET PRECAUTIONS ].
Insuffisance hépatique
La dose quotidienne recommandée de capsules CELEBREX chez les patients présentant une insuffisance hépatique modérée (Child-Pugh Classe B) doit être réduite de 50 %. L'utilisation de CELEBREX chez les patients présentant une insuffisance hépatique sévère n'est pas recommandée [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
Insuffisance rénale
CELEBREX n'est pas recommandé chez les patients présentant une insuffisance rénale sévère [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Métaboliseurs lents des substrats du CYP2C9
Chez les patients connus ou suspectés d'être des métaboliseurs lents du CYP2C9 (c.-à-d. CYP2C9*3/*3), en fonction du génotype ou des antécédents/expériences antérieures avec d'autres substrats du CYP2C9 (tels que la warfarine, la phénytoïne), administrer CELEBREX 200 mg en commençant par la moitié de la dose la plus faible posologie recommandée. Une prise en charge alternative doit être envisagée chez les patients atteints d'ARJ identifiés comme métaboliseurs lents du CYP2C9 [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Les symptômes consécutifs à des surdosages aigus d'AINS se sont généralement limités à une léthargie, une somnolence, des nausées, des vomissements et des douleurs épigastriques, qui ont généralement été réversibles avec des soins de soutien. Des saignements gastro-intestinaux se sont produits. Une hypertension, une insuffisance rénale aiguë, une dépression respiratoire et un coma sont survenus, mais étaient rares [voir AVERTISSEMENTS ET PRECAUTIONS ].
Aucun surdosage de CELEBREX 200 mg n'a été rapporté au cours des essais cliniques. Des doses allant jusqu'à 2400 mg/jour pendant 10 jours chez 12 patients n'ont pas entraîné de toxicité grave. Aucune information n'est disponible concernant l'élimination du célécoxib par hémodialyse, mais compte tenu de son degré élevé de liaison aux protéines plasmatiques (> 97 %), il est peu probable que la dialyse soit utile en cas de surdosage.
Gérer les patients avec des soins symptomatiques et de soutien suite à un surdosage d'AINS. Il n'y a pas d'antidote spécifique. Envisager des vomissements et/ou du charbon actif (60 à 100 grammes chez les adultes, 1 à 2 grammes par kg de poids corporel chez les patients pédiatriques) et/ou cathartique osmotique chez les patients symptomatiques vus dans les quatre heures suivant l'ingestion ou chez les patients présentant un surdosage important ( 5 à 10 fois la dose recommandée). La diurèse forcée, l'alcalinisation de l'urine, l'hémodialyse ou l'hémoperfusion peuvent ne pas être utiles en raison d'une forte liaison aux protéines.
Pour plus d'informations sur le traitement du surdosage, contactez un centre antipoison (1-800-222-1222).
CONTRE-INDICATIONS
CELEBREX est contre-indiqué chez les patients suivants :
- Hypersensibilité connue (p. ex., réactions anaphylactiques et réactions cutanées graves) au célécoxib, à l'un des composants du produit médicamenteux [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Antécédents d'asthme, d'urticaire ou d'autres réactions de type allergique après la prise d'aspirine ou d'autres AINS. Des réactions anaphylactiques sévères, parfois mortelles, aux AINS ont été rapportées chez ces patients [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Dans le cadre d'un pontage coronarien [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Chez les patients ayant présenté des réactions de type allergique aux sulfamides [voir AVERTISSEMENTS ET PRECAUTIONS ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le célécoxib a des propriétés analgésiques, anti-inflammatoires et antipyrétiques.
On pense que le mécanisme d'action de CELEBREX 100 mg est dû à l'inhibition de la synthèse des prostaglandines, principalement via l'inhibition de la COX-2.
Le célécoxib est un puissant inhibiteur de la synthèse des prostaglandines in vitro. Les concentrations de célécoxib atteintes pendant le traitement ont produit des effets in vivo. Les prostaglandines sensibilisent les nerfs afférents et potentialisent l'action de la bradykinine dans l'induction de la douleur chez les modèles animaux. Les prostaglandines sont des médiateurs de l'inflammation. Le célécoxib étant un inhibiteur de la synthèse des prostaglandines, son mode d'action peut être dû à une diminution des prostaglandines dans les tissus périphériques.
Pharmacodynamie
Plaquettes
Dans les essais cliniques menés chez des volontaires sains, CELEBREX à des doses uniques allant jusqu'à 800 mg et à des doses multiples de 600 mg deux fois par jour pendant une durée allant jusqu'à 7 jours (doses thérapeutiques supérieures aux doses thérapeutiques recommandées) n'a eu aucun effet sur la réduction de l'agrégation plaquettaire ni sur l'augmentation du temps de saignement. Du fait de son absence d'effet plaquettaire, CELEBREX 100mg ne se substitue pas à l'aspirine en prophylaxie cardiovasculaire. On ne sait pas s'il existe des effets de CELEBREX sur les plaquettes susceptibles de contribuer au risque accru d'événements indésirables thrombotiques cardiovasculaires graves associés à l'utilisation de CELEBREX.
Rétention d'eau
L'inhibition de la synthèse de PGE2 peut entraîner une rétention de sodium et d'eau par une réabsorption accrue dans la boucle ascendante épaisse médullaire rénale de Henle et peut-être d'autres segments du néphron distal. Dans les canaux collecteurs, la PGE2 semble inhiber la réabsorption d'eau en contrecarrant l'action de l'hormone antidiurétique.
Pharmacocinétique
Le célécoxib présente une augmentation proportionnelle à la dose de l'exposition après administration orale jusqu'à 200 mg deux fois par jour et une augmentation moins que proportionnelle à des doses plus élevées. Il a une distribution étendue et une forte liaison aux protéines. Il est principalement métabolisé par le CYP2C9 avec une demi-vie d'environ 11 heures.
Absorption
Les concentrations plasmatiques maximales de célécoxib surviennent environ 3 heures après une dose orale. Dans des conditions de jeûne, les concentrations plasmatiques maximales (Cmax) et l'aire sous la courbe (ASC) sont à peu près proportionnelles à la dose jusqu'à 200 mg deux fois par jour ; à des doses plus élevées, il y a des augmentations moins que proportionnelles de la Cmax et de l'ASC (voir Effets alimentaires ). Aucune étude de biodisponibilité absolue n'a été menée. Avec des doses multiples, l'état d'équilibre est atteint au jour 5 ou avant. Les paramètres pharmacocinétiques du célécoxib dans un groupe de sujets sains sont présentés dans le tableau 4.
Effets alimentaires
Lorsque les gélules de CELEBREX 200 mg étaient prises avec un repas riche en graisses, les concentrations plasmatiques maximales étaient retardées d'environ 1 à 2 heures avec une augmentation de l'absorption totale (ASC) de 10 % à 20 %. Dans des conditions de jeûne, à des doses supérieures à 200 mg, il y a une augmentation moins que proportionnelle de la Cmax et de l'ASC, ce que l'on pense être dû à la faible solubilité du médicament dans les milieux aqueux.
La co-administration de CELEBREX avec un antiacide contenant de l'aluminium et du magnésium a entraîné une réduction des concentrations plasmatiques de célécoxib avec une diminution de 37 % de la Cmax et de 10 % de l'ASC. CELEBREX, à des doses allant jusqu'à 200 mg deux fois par jour, peut être administré sans tenir compte de l'heure des repas. Des doses plus élevées (400 mg deux fois par jour) doivent être administrées avec de la nourriture pour améliorer l'absorption.
Chez des volontaires adultes en bonne santé, l'exposition systémique globale (ASC) au célécoxib était équivalente lorsque le célécoxib était administré sous forme de gélule intacte ou de contenu de gélule saupoudré sur de la compote de pommes. Il n'y a pas eu de modifications significatives de Cmax, Tmax ou t½ après l'administration du contenu de la capsule sur la compote de pommes [voir DOSAGE ET ADMINISTRATION ].
Distribution
Chez les sujets sains, le célécoxib est fortement lié aux protéines (~ 97 %) dans la plage de doses cliniques. Des études in vitro indiquent que le célécoxib se lie principalement à l'albumine et, dans une moindre mesure, à la glycoprotéine α-acide. Le volume de distribution apparent à l'état d'équilibre (V/F) est d'environ 400 L, suggérant une distribution étendue dans les tissus. Le célécoxib n'est pas préférentiellement lié aux globules rouges.
Élimination
Métabolisme
Le métabolisme du célécoxib est principalement médié par le CYP2C9. Trois métabolites, un alcool primaire, l'acide carboxylique correspondant et son conjugué glucuronide, ont été identifiés dans le plasma humain. Ces métabolites sont inactifs en tant qu'inhibiteurs de la COX-1 ou de la COX-2.
Excrétion
Le célécoxib est principalement éliminé par métabolisme hépatique avec peu (
Populations spécifiques
Gériatrique
l'état d'équilibre, les sujets âgés (plus de 65 ans) avaient une Cmax 40% plus élevée et une ASC 50% plus élevée par rapport aux sujets jeunes. Chez les femmes âgées, la Cmax et l'ASC du célécoxib sont supérieures à celles des hommes âgés, mais ces augmentations sont principalement dues à un poids corporel plus faible chez les femmes âgées. L'adaptation de la dose chez les personnes âgées n'est généralement pas nécessaire. Cependant, pour les patients pesant moins de 50 kg, initier le traitement à la dose la plus faible recommandée [voir Utilisation dans des populations spécifiques ].
Pédiatrique
La pharmacocinétique à l'état d'équilibre du célécoxib administré sous forme de suspension buvable expérimentale a été évaluée chez 152 patients atteints d'ARJ âgés de 2 à 17 ans et pesant ≥ 10 kg atteints d'AJR d'évolution pauciarticulaire ou polyarticulaire et chez des patients atteints d'AJR d'apparition systémique. L'analyse pharmacocinétique de population a indiqué que la clairance orale (non ajustée en fonction du poids corporel) du célécoxib augmente moins que proportionnellement à l'augmentation du poids, les patients de 10 kg et 25 kg devant avoir une clairance inférieure de 40 % et 24 %, respectivement, par rapport à un adulte atteint de PR de 70 kg. patient.
L'administration biquotidienne de gélules de 50 mg à des patients atteints d'ARJ pesant ≥ 12 à ≤ 25 kg et de gélules de 100 mg à des patients atteints d'ARJ pesant > 25 kg devrait permettre d'obtenir des concentrations plasmatiques similaires à celles observées dans un essai clinique qui a démontré la non-infériorité du célécoxib par rapport à naproxène 7,5 mg/kg deux fois par jour [voir DOSAGE ET ADMINISTRATION ]. Le célécoxib n'a pas été étudié chez les patients atteints d'ARJ de moins de 2 ans, chez les patients pesant moins de 10 kg (22 lb) ou au-delà de 24 semaines.
Course
Une méta-analyse d'études pharmacocinétiques a suggéré une ASC du célécoxib environ 40 % plus élevée chez les Noirs par rapport aux Caucasiens. La cause et la signification clinique de cette découverte sont inconnues.
Insuffisance hépatique
Une étude pharmacocinétique chez des sujets atteints d'insuffisance hépatique légère (Child-Pugh Classe A) et modérée (Child-Pugh Classe B) a montré que l'ASC du célécoxib à l'état d'équilibre est augmentée d'environ 40 % et 180 %, respectivement, par rapport à celle observée chez les témoins sains. sujets. Par conséquent, la dose quotidienne recommandée de capsules CELEBREX doit être réduite d'environ 50 % chez les patients présentant une insuffisance hépatique modérée (Child-Pugh classe B). Les patients atteints d'insuffisance hépatique sévère (classe C de Child-Pugh) n'ont pas été étudiés. L'utilisation de CELEBREX chez les patients présentant une insuffisance hépatique sévère n'est pas recommandée [voir DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ].
Insuffisance rénale
Dans une comparaison d'études croisées, l'ASC du célécoxib était environ 40 % plus faible chez les patients atteints d'insuffisance rénale chronique (GFR35-60 mL/min) que celle observée chez les sujets ayant une fonction rénale normale. Aucune relation significative n'a été trouvée entre le DFG et la clairance du célécoxib. Les patients atteints d'insuffisance rénale sévère n'ont pas été étudiés. Comme les autres AINS, CELEBREX 200 mg n'est pas recommandé chez les patients présentant une insuffisance rénale sévère [voir AVERTISSEMENTS ET PRECAUTIONS ].
Études sur les interactions médicamenteuses
Des études in vitro indiquent que le célécoxib n'est pas un inhibiteur du cytochrome P450 2C9, 2C19 ou 3A4.
Des études in vivo ont montré ce qui suit :
Aspirine
Lorsque les AINS ont été administrés avec de l'aspirine, la liaison aux protéines des AINS a été réduite, bien que la clairance des AINS libres n'ait pas été modifiée. La signification clinique de cette interaction n'est pas connue. Voir le tableau 3 pour les interactions médicamenteuses cliniquement significatives des AINS avec l'aspirine [ voir INTERACTIONS MÉDICAMENTEUSES ].
Lithium
Dans une étude menée chez des sujets sains, les taux plasmatiques moyens de lithium à l'état d'équilibre ont augmenté d'environ 17 % chez les sujets recevant du lithium 450 mg deux fois par jour avec CELEBREX 200 mg deux fois par jour par rapport aux sujets recevant du lithium seul [voir INTERACTIONS MÉDICAMENTEUSES ].
Fluconazole
L'administration concomitante de fluconazole à raison de 200 mg une fois par jour a entraîné une multiplication par deux de la concentration plasmatique de célécoxib. Cette augmentation est due à l'inhibition du métabolisme du célécoxib via P450 2C9 par le fluconazole [ voir INTERACTIONS MÉDICAMENTEUSES ].
Autres drogues
Les effets du célécoxib sur la pharmacocinétique et/ou la pharmacodynamique du glyburide, du kétoconazole, [voir INTERACTIONS MÉDICAMENTEUSES ], la phénytoïne et le tolbutamide ont été étudiés in vivo et aucune interaction cliniquement importante n'a été trouvée.
Pharmacogénomique
L'activité du CYP2C9 est réduite chez les individus présentant des polymorphismes génétiques qui conduisent à une activité enzymatique réduite, tels que ceux homozygotes pour les polymorphismes CYP2C9*2 et CYP2C9*3. Des données limitées provenant de 4 rapports publiés qui incluaient un total de 8 sujets avec le génotype homozygote CYP2C9*3/*3 ont montré des niveaux systémiques de célécoxib qui étaient 3 à 7 fois plus élevés chez ces sujets par rapport aux sujets avec CYP2C9*1/*1 ou * I/*3 génotypes. La pharmacocinétique du célécoxib n'a pas été évaluée chez les sujets présentant d'autres polymorphismes du CYP2C9, tels que *2, *5, *6, *9 et *11. On estime que la fréquence du génotype homozygote *3/*3 est de 0,3 % à 1,0 % dans divers groupes ethniques [ voir DOSAGE ET ADMINISTRATION , Utilisation dans des populations spécifiques ].
Toxicologie animale
Une augmentation de l'incidence des découvertes de fond de spermatocèle avec ou sans modifications secondaires telles que la pospermie épididymaire ainsi qu'une dilatation minime à légère des tubules séminifères a été observée chez le rat juvénile. Ces signes de reproduction, bien qu'apparemment liés au traitement, n'ont pas augmenté d'incidence ou de sévérité avec la dose et peuvent indiquer une exacerbation d'une affection spontanée. Des résultats reproducteurs similaires n'ont pas été observés dans les études sur des chiens juvéniles ou adultes ou chez des rats adultes traités par le célécoxib. La signification clinique de cette observation est inconnue.
Etudes cliniques
Arthrose
CELEBREX 200 mg a démontré une réduction significative des douleurs articulaires par rapport au placebo. CELEBREX a été évalué pour le traitement des signes et des symptômes de l'arthrose du genou et de la hanche dans des essais cliniques contrôlés contre placebo et contre comparateur actif d'une durée allant jusqu'à 12 semaines. Chez les patients atteints d'arthrose, le traitement par CELEBREX 100 mg deux fois par jour ou 200 mg une fois par jour a entraîné une amélioration de l'indice d'arthrose WOMAC (Universités Western Ontario et McMaster), un composite de la douleur, de la raideur et des mesures fonctionnelles dans l'arthrose. Dans trois études de 12 semaines sur la douleur accompagnant une poussée d'arthrose, CELEBREX 100 mg à des doses de 100 mg deux fois par jour et de 200 mg deux fois par jour a entraîné une réduction significative de la douleur dans les 24 à 48 heures suivant le début du traitement. Aux doses de 100 mg deux fois par jour ou de 200 mg deux fois par jour, l'efficacité de CELEBREX 200 mg s'est avérée similaire à celle du naproxène 500 mg deux fois par jour. Les doses de 200 mg deux fois par jour n'ont fourni aucun avantage supplémentaire au-delà de celui observé avec 100 mg deux fois par jour. Une dose quotidienne totale de 200 mg s'est avérée aussi efficace qu'elle soit administrée à raison de 100 mg deux fois par jour ou de 200 mg une fois par jour.
La polyarthrite rhumatoïde
CELEBREX a démontré une réduction significative de la sensibilité/douleur articulaire et de l'enflure articulaire par rapport au placebo. CELEBREX 100 mg a été évalué pour le traitement des signes et symptômes de la PR dans des essais cliniques contrôlés contre placebo et contre comparateur actif d'une durée allant jusqu'à 24 semaines. CELEBREX s'est avéré supérieur au placebo dans ces études, en utilisant l'indice de réponse ACR20, un composite de mesures cliniques, de laboratoire et fonctionnelles dans la PR. Les doses de CELEBREX de 100 mg deux fois par jour et de 200 mg deux fois par jour avaient une efficacité similaire et les deux étaient comparables au naproxène 500 mg deux fois par jour.
Bien que CELEBREX 100 mg deux fois par jour et 200 mg deux fois par jour aient fourni une efficacité globale similaire, certains patients ont tiré un bénéfice supplémentaire de la dose de 200 mg deux fois par jour. Des doses de 400 mg deux fois par jour n'ont fourni aucun avantage supplémentaire au-delà de celui observé avec 100 mg à 200 mg deux fois par jour.
Polyarthrite rhumatoïde juvénile (NCT00652925)
Dans une étude de non-infériorité randomisée, en double aveugle, contrôlée par comparateur actif, en groupes parallèles, multicentrique, de 12 semaines, des patients âgés de 2 à 17 ans atteints d'ARJ pauciarticulaire, polyarticulaire ou d'apparition systémique (avec des caractéristiques systémiques actuellement inactives) ), a reçu l'un des traitements suivants : célécoxib 3 mg/kg (jusqu'à un maximum de 150 mg) deux fois par jour ; célécoxib 6 mg/kg (jusqu'à un maximum de 300 mg) deux fois par jour ; ou naproxène 7,5 mg/kg (jusqu'à un maximum de 500 mg) deux fois par jour. Les taux de réponse étaient basés sur le critère JRA Definition of Improvement supérieur ou égal à 30 % (JRA DOI 30), qui est un composite de mesures cliniques, de laboratoire et fonctionnelles de la JRA. Les taux de réponse JRA DOI 30 à la semaine 12 étaient de 69 %, 80 % et 67 % dans les groupes de traitement célécoxib 3 mg/kg deux fois par jour, célécoxib 6 mg/kg deux fois par jour et naproxène 7,5 mg/kg deux fois par jour, respectivement.
L'efficacité et la sécurité de CELEBREX 100 mg pour l'ARJ n'ont pas été étudiées au-delà de six mois. La toxicité cardiovasculaire à long terme chez les enfants exposés à CELEBREX 200 mg n'a pas été évaluée et on ne sait pas si le risque à long terme peut être similaire à celui observé chez les adultes exposés à CELEBREX 100 mg ou à d'autres AINS sélectifs et non sélectifs de la COX-2 [ voir AVERTISSEMENT ENCADRÉ , AVERTISSEMENTS ET PRECAUTIONS ].
Spondylarthrite ankylosante
CELEBREX a été évalué chez des patients atteints de SA dans deux essais cliniques contrôlés contre placebo et contre comparateur actif d'une durée de 6 et 12 semaines. CELEBREX à des doses de 100 mg deux fois par jour, 200 mg une fois par jour et 400 mg une fois par jour s'est avéré statistiquement supérieur au placebo dans ces études pour les trois mesures d'efficacité co-primaires évaluant l'intensité globale de la douleur (échelle visuelle analogique) et l'activité globale de la maladie (Échelle Visuelle Analogique) et atteinte fonctionnelle (Bath Ankylosing Spondylitis Functional Index). Dans l'étude de 12 semaines, il n'y avait aucune différence dans l'ampleur de l'amélioration entre les doses de 200 mg et 400 mg de CELEBREX 200 mg dans une comparaison de la variation moyenne par rapport à la valeur initiale, mais il y avait un plus grand pourcentage de patients qui ont répondu à CELEBREX 400 mg, 53 %, qu'à CELEBREX 200 mg, 44 %, en utilisant les critères de réponse de l'évaluation de la spondylarthrite ankylosante (ASAS20). L'ASAS 20 définit un répondeur comme une amélioration par rapport au départ d'au moins 20 % et une amélioration absolue d'au moins 10 mm, sur une échelle de 0 mm à 100 mm, dans au moins trois des quatre domaines suivants : douleur globale du patient, spondylarthrite ankylosante de Bath Indice fonctionnel et inflammation. L'analyse des répondeurs n'a également démontré aucun changement dans les taux de répondeurs au-delà de 6 semaines.
Analgésie, y compris dysménorrhée primaire
Dans les modèles analgésiques aigus de douleur post-chirurgie buccale, de douleur post-chirurgie orthopédique et de dysménorrhée primaire, CELEBREX 100 mg a soulagé la douleur jugée modérée à sévère par les patientes. Doses uniques [voir DOSAGE ET ADMINISTRATION ] de CELEBREX 200 mg a soulagé la douleur en 60 minutes.
Essai sur les résultats cardiovasculaires : évaluation prospective randomisée de l'innocuité intégrée du célécoxib par rapport à l'ibuprofène ou au naproxène (PRECISION ; NCT00346216)
Concevoir
L'essai PRECISION était un essai contrôlé randomisé en double aveugle sur la sécurité cardiovasculaire chez des patients atteints d'arthrose et de polyarthrite rhumatoïde avec ou à haut risque de maladie cardiovasculaire comparant le célécoxib au naproxène et à l'ibuprofène. Les patients ont été randomisés pour recevoir une dose initiale de 100 mg deux fois par jour de célécoxib, 600 mg trois fois par jour d'ibuprofène ou 375 mg deux fois par jour de naproxène, avec la possibilité d'augmenter la dose selon les besoins pour la gestion de la douleur. Sur la base des doses indiquées, les patients arthrosiques randomisés pour le célécoxib ne pouvaient pas augmenter la dose.
Le critère d'évaluation principal, les Antiplatelet Trialists & # 39; Collaboration (APTC) était un composite de décès cardiovasculaires (y compris les décès hémorragiques), d'infarctus du myocarde non mortel et d'AVC non mortel, évalué de manière indépendante, avec une puissance de 80 % pour évaluer la non-infériorité. Tous les patients se sont vu prescrire de l'ésoméprazole en ouvert (20 à 40 mg) pour la protection gastro-intestinale. La randomisation du traitement a été stratifiée en fonction de l'utilisation initiale d'aspirine à faible dose.
De plus, il y avait une sous-étude de 4 mois évaluant les effets des trois médicaments sur la tension artérielle telle que mesurée par la surveillance ambulatoire.
Résultats
Parmi les sujets atteints d'arthrose, seuls 0,2 % (17/7259) ont augmenté la dose de célécoxib à 200 mg deux fois par jour, tandis que 54,7 % (3 946/7 208) ont augmenté la dose d'ibuprofène à 800 mg trois fois par jour et 54,8 % (3 937/7 178) ont augmenté la dose de naproxène. à la dose de 500 mg deux fois par jour. Parmi les sujets atteints de PR, 55,7 % (453/813) ont augmenté la dose de célécoxib à 200 mg deux fois par jour, 56,5 % (470/832) ont augmenté la dose d'ibuprofène à 800 mg trois fois par jour et 54,6 % (432/791) ont augmenté la dose de naproxène à la dose de 200 mg deux fois par jour. dose de 500 mg deux fois par jour ; cependant, la population PR ne représentait que 10 % de la population de l'essai.
Comme relativement peu de patients atteints de célécoxib dans l'ensemble (5,8 % [470/8072]) ont augmenté la dose à 200 mg deux fois par jour, les résultats de l'essai PRECISION ne permettent pas de déterminer la sécurité CV relative du célécoxib à 200 mg deux fois par jour par rapport à l'ibuprofène et naproxène aux doses prises.
Critère principal
L'essai comportait deux populations d'analyse prédéfinies :
- Population en intention de traiter (ITT) : composée de tous les sujets randomisés suivis pendant un maximum de 30 mois
- Population en intention de traiter modifiée (mITT) : composée de tous les sujets randomisés qui ont reçu au moins une dose de médicament à l'étude et qui ont eu au moins une visite post-inclusion suivie jusqu'à l'arrêt du traitement plus 30 jours ou 43 mois.
Le célécoxib, à la dose de 100 mg deux fois par jour, par rapport au naproxène ou à l'ibuprofène aux doses prises, a satisfait aux quatre critères de non-infériorité prédéfinis (p
Les résultats de l'analyse primaire pour ITT et mITT sont décrits dans le tableau 5.
Dans la population d'analyse ITT sur 30 mois, la mortalité toutes causes confondues était de 1,6 % dans le groupe célécoxib, de 1,8 % dans le groupe ibuprofène et de 2,0 % dans le groupe naproxène.
Sous-étude sur la surveillance ambulatoire de la pression artérielle (MPAA)
Dans la sous-étude PRECISION-ABPM, parmi un total de 444 patients analysables au mois 4, le célécoxib dosé à 100 mg deux fois par jour a diminué la pression artérielle systolique (PAS) moyenne sur 24 heures de 0,3 mmHg, tandis que l'ibuprofène et le naproxène aux doses prises ont augmenté PAS moyenne sur 24 heures de 3,7 et 1,6 mmHg, respectivement. Ces changements ont entraîné une différence statistiquement significative et cliniquement significative de 3,9 mmHg (p = 0,0009) entre le célécoxib et l'ibuprofène et une différence non statistiquement significative de 1,8 (p = 0,119) mmHg entre le célécoxib et le naproxène.
Etudes Spéciales
Études sur la prévention des polypes adénomateux (NCT00005094 et NCT00141193)
La sécurité cardiovasculaire a été évaluée dans deux études randomisées, en double aveugle, contrôlées par placebo, d'une durée de trois ans, portant sur des patients atteints de polypes adénomateux sporadiques traités par CELEBREX : l'essai APC (Adenoma Prevention with Celecoxib) et l'essai PreSAP (Prevention of Spontaneous Adenomatous Polyps) . Dans l'essai APC, il y a eu une augmentation liée à la dose du critère d'évaluation composite (évalué) de décès cardiovasculaire, d'infarctus du myocarde ou d'accident vasculaire cérébral avec le célécoxib par rapport au placebo sur 3 ans de traitement. L'essai PreSAP n'a pas démontré de risque accru statistiquement significatif pour le même critère d'évaluation composite (jugé) :
- Dans l'essai APC, les risques relatifs par rapport au placebo pour un critère composite (évalué) de décès cardiovasculaire, d'infarctus du myocarde ou d'accident vasculaire cérébral étaient de 3,4 (IC à 95 % 1,4 - 8,5) avec le célécoxib 400 mg deux fois par jour et de 2,8 (95 % IC 1,1 - 7,2) avec célécoxib 200 mg deux fois par jour. Les taux cumulés pour ce critère d'évaluation composite sur 3 ans étaient de 3,0 % (20/671 sujets) et de 2,5 % (17/685 sujets), respectivement, contre 0,9 % (6/679 sujets) avec le traitement par placebo. Les augmentations dans les deux groupes de doses de célécoxib par rapport aux patients traités par placebo étaient principalement dues à une incidence accrue d'infarctus du myocarde.
- Dans l'essai PreSAP, le rapport de risque pour ce même critère d'évaluation composite (évalué) était de 1,2 (IC à 95 % 0,6 - 2,4) avec le célécoxib 400 mg une fois par jour par rapport au placebo. Les taux cumulés pour ce paramètre composite sur 3 ans étaient de 2,3 % (21/933 sujets) et de 1,9 % (12/628 sujets), respectivement.
Des essais cliniques d'autres AINS sélectifs et non sélectifs de la COX-2 d'une durée allant jusqu'à trois ans ont montré un risque accru d'événements thrombotiques cardiovasculaires graves, d'infarctus du myocarde et d'accident vasculaire cérébral, qui peuvent être mortels. Par conséquent, tous les AINS sont considérés comme potentiellement associés à ce risque.
Étude sur la sécurité à long terme du célécoxib dans l'arthrite (CLASS)
Il s'agissait d'une étude prospective à long terme sur les résultats de l'innocuité menée après la commercialisation chez environ 5 800 patients atteints d'arthrose et 2 200 patients atteints de polyarthrite rhumatoïde. Les patients ont reçu CELEBREX 400 mg deux fois par jour (4 fois et 2 fois les doses recommandées pour l'OA et la PR, respectivement), de l'ibuprofène 800 mg trois fois par jour ou du diclofénac 75 mg deux fois par jour (doses thérapeutiques courantes). Les expositions médianes pour CELEBREX (n = 3 987) et le diclofénac (n = 1 996) étaient de 9 mois tandis que l'ibuprofène (n = 1 985) était de 6 mois. Le critère d'évaluation principal de cette étude de résultats était l'incidence des ulcères compliqués (saignements gastro-intestinaux, perforation ou obstruction). Les patients étaient autorisés à prendre de l'aspirine (AAS) à faible dose (≤ 325 mg/jour) en prophylaxie cardiovasculaire (sous-groupes d'AAS : CELEBREX, n = 882 ; diclofénac, n = 445 ; ibuprofène, n = 412). Les différences d'incidence d'ulcères compliqués entre CELEBREX 200 mg et le groupe combiné ibuprofène et diclofénac n'étaient pas statistiquement significatives.
Les patients recevant CELEBREX et de l'AAS à faible dose concomitante (N = 882) ont présenté des taux 4 fois plus élevés d'ulcères compliqués par rapport à ceux qui ne prenaient pas d'AAS (N = 3105). Le taux de Kaplan-Meier pour les ulcères compliqués à 9 mois était de 1,12 % contre 0,32 % pour ceux qui prenaient de l'AAS à faible dose et ceux qui n'en prenaient pas, respectivement [voir AVERTISSEMENTS ET PRECAUTIONS ].
Les taux cumulés estimés à 9 mois d'ulcères compliqués et symptomatiques pour les patients traités par CELEBREX 400 mg deux fois par jour sont décrits dans le tableau 7. Le tableau 7 présente également les résultats pour les patients âgés de moins ou de plus de 65 ans. La différence de taux entre les groupes CELEBREX 200 mg seul et CELEBREX 100 mg avec AAS peut être due au risque plus élevé d'événements gastro-intestinaux chez les utilisateurs d'AAS.
Chez un petit nombre de patients ayant des antécédents d'ulcère, les taux d'ulcères compliqués et symptomatiques chez les patients prenant CELEBREX 100 mg seul ou CELEBREX 100 mg avec AAS étaient, respectivement, de 2,56 % (n = 243) et de 6,85 % (n = 91) à 48 semaines. Ces résultats sont attendus chez les patients ayant des antécédents d'ulcère [voir AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ].
Les résultats de sécurité cardiovasculaire ont également été évalués dans l'essai CLASS. Les taux cumulés de Kaplan-Meier pour les événements indésirables thromboemboliques cardiovasculaires graves signalés par l'investigateur (y compris IDM, embolie pulmonaire, thrombose veineuse profonde, angor instable, accidents ischémiques transitoires et accidents vasculaires cérébraux ischémiques) n'ont démontré aucune différence entre le traitement par CELEBREX 200 mg, le diclofénac ou l'ibuprofène groupes. Les taux cumulés chez tous les patients à neuf mois pour CELEBREX, le diclofénac et l'ibuprofène étaient de 1,2 %, 1,4 % et 1,1 %, respectivement. Les taux cumulés chez les non-utilisateurs d'AAS à neuf mois dans chacun des trois groupes de traitement étaient inférieurs à 1 %. Les taux cumulés d'infarctus du myocarde chez les non-utilisateurs d'AAS à neuf mois dans chacun des trois groupes de traitement étaient inférieurs à 0,2 %. Il n'y avait pas de groupe placebo dans l'essai CLASS, ce qui limite la capacité de déterminer si les trois médicaments testés n'ont pas augmenté le risque d'événements CV ou s'ils ont tous augmenté le risque à un degré similaire. Dans l'étude CLASS, les taux cumulés de Kaplan-Meier à 9 mois d'œdème périphérique chez les patients sous CELEBREX 400 mg deux fois par jour (respectivement 4 fois et 2 fois les doses recommandées pour l'OA et la PR), l'ibuprofène 800 mg trois fois par jour et diclofénac 75 mg deux fois par jour étaient de 4,5 %, 6,9 % et 4,7 %, respectivement. Les taux d'hypertension de l'essai CLASS chez les patients traités par CELEBREX, ibuprofène et diclofénac étaient de 2,4 %, 4,2 % et 2,5 %, respectivement.
Études endoscopiques
La corrélation entre les résultats des études endoscopiques à court terme avec CELEBREX et l'incidence relative d'événements gastro-intestinaux graves cliniquement significatifs avec une utilisation à long terme n'a pas été établie. Des saignements gastro-intestinaux supérieurs graves et cliniquement significatifs ont été observés chez des patients recevant CELEBREX 100 mg dans des essais contrôlés et en ouvert [voir AVERTISSEMENTS ET PRECAUTIONS et Etudes cliniques ].
Une étude randomisée en double aveugle chez 430 patients atteints de PR a été menée dans laquelle un examen endoscopique a été réalisé à 6 mois. L'incidence des ulcères endoscopiques chez les patients prenant CELEBREX 200 mg deux fois par jour était de 4 % contre 15 % pour les patients prenant du diclofénac LP 75 mg deux fois par jour. Cependant, CELEBREX n'était pas statistiquement différent du diclofénac pour les résultats GI cliniquement pertinents dans l'essai CLASS [voir Etudes cliniques ].
L'incidence des ulcères endoscopiques a été étudiée dans deux études contrôlées par placebo de 12 semaines chez 2 157 patients atteints d'arthrose et de polyarthrite rhumatoïde chez lesquels les endoscopies initiales n'ont révélé aucun ulcère. Il n'y avait pas de relation dose entre l'incidence des ulcères gastro-duodénaux et la dose de CELEBREX (50 mg à 400 mg deux fois par jour). L'incidence pour le naproxène 500 mg deux fois par jour était de 16,2 % et 17,6 % dans les deux études, pour le placebo était de 2,0 % et 2,3 %, et pour toutes les doses de CELEBREX, l'incidence variait entre 2,7 % et 5,9 %. Il n'y a pas eu d'études cliniques de grande envergure pour comparer les résultats GI cliniquement pertinents avec CELEBREX et le naproxène.
Dans les études endoscopiques, environ 11 % des patients prenaient de l'aspirine (≤ 325 mg/jour). Dans les groupes CELEBREX, le taux d'ulcères endoscopiques est apparu plus élevé chez les utilisateurs d'aspirine que chez les non-utilisateurs. Cependant, le taux accru d'ulcères chez ces utilisateurs d'aspirine était inférieur aux taux d'ulcères endoscopiques observés dans les groupes comparateurs actifs, avec ou sans aspirine.
INFORMATIONS PATIENTS
Guide des médicaments pour les anti-inflammatoires non stéroïdiens (AINS)
Quelles sont les informations les plus importantes que je devrais connaître sur les médicaments appelés anti-inflammatoires non stéroïdiens (AINS) ?
Les AINS peuvent provoquer des effets secondaires graves, notamment :
- Risque accru de crise cardiaque ou d'accident vasculaire cérébral pouvant entraîner la mort. Ce risque peut survenir au début du traitement et peut augmenter :
- avec des doses croissantes d'AINS
- avec une utilisation plus longue des AINS
Ne prenez pas d'AINS juste avant ou après une chirurgie cardiaque appelée « greffe de pontage coronarien (PAC) ». Évitez de prendre des AINS après une crise cardiaque récente, à moins que votre fournisseur de soins de santé ne vous le dise. Vous pouvez avoir un risque accru d'avoir une autre crise cardiaque si vous prenez des AINS après une récente crise cardiaque.
- Risque accru de saignement, d'ulcères et de déchirures (perforation) de l'œsophage (tube menant de la bouche à l'estomac), de l'estomac et des intestins :
- à tout moment pendant l'utilisation
- sans symptômes précurseurs
- qui peut causer la mort
- Le risque de développer un ulcère ou des saignements augmente avec :
- antécédents d'ulcères de l'estomac ou de saignements de l'estomac ou de l'intestin avec l'utilisation d'AINS
- prendre des médicaments appelés « corticoïdes », « médicaments antiplaquettaires », « anticoagulants », « ISRS » ou « IRSN »
- augmentation des doses d'AINS
- utilisation plus longue des AINS
- fumeur
- buvant de l'alcool
- âge avancé
- mauvaise santé
- maladie hépatique avancée
- problèmes de saignement
- Les AINS ne doivent être utilisés que :
- exactement comme prescrit
- à la dose la plus faible possible pour votre traitement
- pour le temps le plus court nécessaire
Que sont les AINS ?
Les AINS sont utilisés pour traiter la douleur et les rougeurs, l'enflure et la chaleur (inflammation) causées par des conditions médicales telles que différents types d'arthrite, les crampes menstruelles et d'autres types de douleur à court terme.
Qui ne devrait pas prendre d'AINS ?
Ne prenez pas d'AINS :
- si vous avez eu une crise d'asthme, de l'urticaire ou une autre réaction allergique à l'aspirine ou à tout autre AINS.
- juste avant ou après un pontage coronarien.
Avant de prendre des AINS, informez votre fournisseur de soins de santé de toutes vos conditions médicales, y compris si vous :
- avez des problèmes de foie ou de rein
- avoir une pression artérielle élevée
- avoir de l'asthme
- êtes enceinte ou envisagez de devenir enceinte. La prise d'AINS à environ 20 semaines de grossesse ou plus tard peut nuire à votre bébé à naître. Si vous devez prendre des AINS pendant plus de 2 jours lorsque vous êtes entre 20 et 30 semaines de grossesse, votre fournisseur de soins de santé devra peut-être surveiller la quantité de liquide dans votre utérus autour de votre bébé. Vous ne devez pas prendre d'AINS après environ 30 semaines de grossesse
- allaitez ou envisagez d'allaiter.
Informez votre fournisseur de soins de santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance ou en vente libre, les vitamines ou les suppléments à base de plantes. Les AINS et certains autres médicaments peuvent interagir entre eux et provoquer des effets secondaires graves. Ne commencez pas à prendre un nouveau médicament sans en parler d'abord à votre fournisseur de soins de santé.
Quels sont les effets secondaires possibles des AINS ?
Les AINS peuvent provoquer des effets secondaires graves, notamment :
Voir « Quelles sont les informations les plus importantes que je devrais connaître sur les médicaments appelés anti-inflammatoires non stéroïdiens (AINS) ?
- hypertension artérielle nouvelle ou aggravée
- insuffisance cardiaque
- problèmes de foie, y compris insuffisance hépatique
- problèmes rénaux, y compris insuffisance rénale
- faible taux de globules rouges (anémie)
- réactions cutanées potentiellement mortelles
- réactions allergiques potentiellement mortelles
Les autres effets secondaires des AINS comprennent : douleurs à l'estomac, constipation, diarrhée, gaz, brûlures d'estomac, nausées, vomissements et étourdissements.
Obtenez immédiatement de l'aide d'urgence si vous présentez l'un des symptômes suivants :
- essoufflement ou difficulté à respirer
- douleur thoracique
- faiblesse dans une partie ou un côté de votre corps
- troubles de l'élocution
- gonflement du visage ou de la gorge
Arrêtez de prendre votre AINS et appelez immédiatement votre fournisseur de soins de santé si vous présentez l'un des symptômes suivants :
- nausée
- plus fatigué ou plus faible que d'habitude
- diarrhée
- démangeaison
- votre peau ou vos yeux sont jaunes
- indigestion ou douleur à l'estomac
- symptômes pseudo-grippaux
- Vomir du sang
- il y a du sang dans vos selles ou elles sont noires et collantes comme du goudron
- prise de poids inhabituelle
- éruption cutanée ou cloques avec fièvre
- gonflement des bras, des jambes, des mains et des pieds
Si vous prenez trop de votre AINS, appelez votre fournisseur de soins de santé ou obtenez une aide médicale immédiatement.
Ce ne sont pas tous les effets secondaires possibles des AINS. Pour plus d'informations, renseignez-vous auprès de votre professionnel de la santé ou de votre pharmacien sur les AINS.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Autres informations sur les AINS
- L'aspirine est un AINS, mais il n'augmente pas le risque de crise cardiaque. L'aspirine peut provoquer des saignements dans le cerveau, l'estomac et les intestins. L'aspirine peut également provoquer des ulcères dans l'estomac et les intestins.
- Certains AINS sont vendus à des doses plus faibles sans ordonnance (en vente libre). Parlez à votre fournisseur de soins de santé avant d'utiliser des AINS en vente libre pendant plus de 10 jours.
Informations générales sur l'utilisation sûre et efficace des AINS
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. N'utilisez pas d'AINS pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas d'AINS à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Si vous souhaitez plus d'informations sur les AINS, parlez-en à votre fournisseur de soins de santé. Vous pouvez demander à votre pharmacien ou à votre professionnel de la santé des informations sur les AINS destinées aux professionnels de la santé.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
