Imuran 50mg, 25mg Azathioprine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Imuran et comment est-il utilisé ?
Imuran 25 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de la polyarthrite rhumatoïde et pour prévenir le rejet de greffe. Imuran peut être utilisé seul ou avec d'autres médicaments.
Imuran 25 mg appartient à une classe de médicaments appelés DMARD, immunomodulateurs ; Immunosuppresseurs.
Quels sont les effets secondaires possibles d'Imuran ?
Imuran 25 mg peut provoquer des effets secondaires graves, notamment :
- fièvre,
- glandes enflées,
- courbatures,
- sueurs nocturnes,
- Ne pas se sentir bien,
- peau pâle,
- éruption,
- ecchymoses ou saignements faciles,
- mains et pieds froids,
- étourdissement,
- essoufflement,
- douleur dans le haut de l'estomac pouvant s'étendre à l'épaule,
- se sentir rassasié après avoir mangé seulement une petite quantité,
- perte de poids,
- des signes d'infection (fièvre, frissons, faiblesse, symptômes grippaux, mal de gorge, toux, douleur ou sensation de brûlure lorsque vous urinez),
- nausées sévères,
- vomissement,
- diarrhée,
- battements de coeur rapides,
- urine foncée et
- jaunissement de la peau ou des yeux (jaunisse)
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Imuran 50 mg incluent :
- nausée,
- diarrhée,
- Douleur d'estomac,
- perte de cheveux, et
- démangeaison de la peau
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Imuran. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
MALIGNITÉ
L'immunosuppression chronique avec IMURAN, un antimétabolite purique, augmente le risque de malignité chez l'homme. Les rapports de malignité comprennent le lymphome post-transplantation et le lymphome hépatosplénique à cellules T (HSTCL) chez les patients atteints d'une maladie inflammatoire de l'intestin. Les médecins utilisant ce médicament doivent être très familiers avec ce risque ainsi qu'avec le potentiel mutagène pour les hommes et les femmes et avec les toxicités hématologiques possibles. Les médecins doivent informer les patients du risque de malignité avec IMURAN. Voir AVERTISSEMENTS .
LA DESCRIPTION
IMURAN (azathioprine), un antimétabolite immunosuppresseur, est disponible sous forme de comprimés pour administration orale. Chaque comprimé sécable contient 50 mg d'azathioprine et les ingrédients inactifs lactose, stéarate de magnésium, fécule de pomme de terre, povidone et acide stéarique.
L'azathioprine est chimiquement la 6-[(1-méthyl-4-nitro-1H-imidazol-5-yl)thio]-1H-purine. La formule développée de l'azathioprine est :
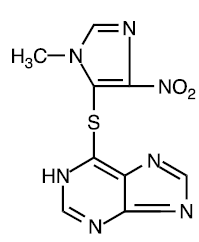
C'est un dérivé imidazolyle de la 6-mercaptopurine et nombre de ses effets biologiques sont similaires à ceux du composé parent.
L'azathioprine est insoluble dans l'eau, mais peut être dissoute en ajoutant un équivalent molaire d'alcali. L'azathioprine est stable en solution à pH neutre ou acide, mais l'hydrolyse en mercaptopurine se produit dans un excès d'hydroxyde de sodium (0,1 N), en particulier lors du réchauffement. La conversion en mercaptopurine se produit également en présence de composés sulfhydryle tels que la cystéine, le glutathion et le sulfure d'hydrogène.
LES INDICATIONS
IMURAN est indiqué comme traitement d'appoint pour la prévention du rejet en homotransplantation rénale. Il est également indiqué pour la prise en charge de la polyarthrite rhumatoïde active afin de réduire les signes et les symptômes.
Homotransplantation rénale
IMURAN est indiqué comme traitement d'appoint pour la prévention du rejet en homotransplantation rénale. L'expérience avec plus de 16 000 greffes montre une survie des patients à 5 ans de 35% à 55%, mais cela dépend du donneur, de la correspondance pour les antigènes HLA, de l'anticorps alloantigène anti-donneur ou anti-cellules B et d'autres variables. L'effet d'IMURAN sur ces variables n'a pas été testé dans des essais contrôlés.
La polyarthrite rhumatoïde
IMURAN est indiqué pour le traitement de la polyarthrite rhumatoïde (PR) active afin de réduire les signes et les symptômes. L'aspirine, les anti-inflammatoires non stéroïdiens et/ou les glucocorticoïdes à faible dose peuvent être poursuivis pendant le traitement par IMURAN. L'utilisation combinée d'IMURAN 25 mg avec des médicaments anti-rhumatismaux modificateurs de la maladie (DMARD) n'a pas été étudiée pour un bénéfice supplémentaire ou des effets indésirables inattendus. L'utilisation d'IMURAN avec ces agents ne peut être recommandée.
DOSAGE ET ADMINISTRATION
LE TEST TPMT NE PEUT PAS REMPLACER LA SURVEILLANCE COMPLÈTE DE LA SANTÉ CHEZ LES PATIENTS RECEVANT IMURAN. Le génotypage ou le phénotypage TPMT peut être utilisé pour identifier les patients dont l'activité TPMT est absente ou réduite. Les patients dont l'activité TPMT est faible ou absente présentent un risque accru de développer une myélotoxicité grave et potentiellement mortelle due à IMURAN si des doses conventionnelles sont administrées. Les médecins peuvent envisager des thérapies alternatives pour les patients qui ont une activité TPMT faible ou absente (homozygote pour les allèles non fonctionnels). IMURAN 25 mg doit être administré avec prudence aux patients ayant un allèle non fonctionnel (hétérozygote) qui présentent un risque de réduction de l'activité de la TPMT pouvant entraîner une toxicité si des doses conventionnelles sont administrées. Une réduction de la posologie est recommandée chez les patients présentant une activité réduite de la TPMT. L'arrêt précoce du médicament peut être envisagé chez les patients présentant des résultats sanguins anormaux qui ne répondent pas à la réduction de la dose.
Homotransplantation rénale
La dose d'IMURAN 50 mg nécessaire pour prévenir le rejet et minimiser la toxicité variera selon les patients ; cela nécessite une gestion prudente. La dose initiale est généralement de 3 à 5 mg/kg par jour, en commençant au moment de la greffe. IMURAN est généralement administré en une dose quotidienne unique le jour de la transplantation et, dans une minorité de cas, 1 à 3 jours avant celle-ci. Une réduction de la dose à des niveaux d'entretien de 1 à 3 mg/kg par jour est généralement possible. La dose d'IMURAN 50 mg ne doit pas être augmentée à des niveaux toxiques en raison d'une menace de rejet. L'arrêt peut être nécessaire en cas de toxicité hématologique sévère ou autre, même si le rejet de l'homogreffe peut être une conséquence du retrait du médicament.
La polyarthrite rhumatoïde
IMURAN 50 mg est généralement administré quotidiennement. La dose initiale doit être d'environ 1,0 mg/kg (50 à 100 mg) administrée en une dose unique ou en deux prises par jour. La dose peut être augmentée, en commençant à 6 à 8 semaines et ensuite par paliers à 4 semaines d'intervalle, s'il n'y a pas de toxicité grave et si la réponse initiale n'est pas satisfaisante. Les augmentations de dose doivent être de 0,5 mg/kg par jour, jusqu'à une dose maximale de 2,5 mg/kg par jour. La réponse thérapeutique survient après plusieurs semaines de traitement, généralement 6 à 8 ; un essai adéquat devrait durer au moins 12 semaines. Les patients non améliorés après 12 semaines peuvent être considérés comme réfractaires. IMURAN 50 mg peut être poursuivi à long terme chez les patients présentant une réponse clinique, mais les patients doivent être surveillés attentivement et une réduction progressive de la posologie doit être tentée pour réduire le risque de toxicité.
Le traitement d'entretien doit être à la dose efficace la plus faible, et la dose administrée peut être diminuée progressivement avec des changements de 0,5 mg/kg ou environ 25 mg par jour toutes les 4 semaines tandis que les autres traitements sont maintenus constants. La durée optimale d'entretien d'IMURAN 50mg n'a pas été déterminée. IMURAN peut être interrompu brutalement, mais des effets différés sont possibles.
Utilisation en cas de dysfonctionnement rénal
Les patients relativement oliguriques, en particulier ceux présentant une nécrose tubulaire dans la période post-transplantation cadavérique immédiate, peuvent avoir une clairance retardée d'IMURAN ou de ses métabolites, peuvent être particulièrement sensibles à ce médicament et reçoivent généralement des doses plus faibles.
Les procédures de manipulation et d'élimination appropriées de cet antimétabolite immunosuppresseur doivent être envisagées. Plusieurs lignes directrices à ce sujet ont été publiées.25-31 Il n'y a pas d'accord général sur le fait que toutes les procédures recommandées dans les lignes directrices sont nécessaires ou appropriées.
COMMENT FOURNIE
50mg comprimés sécables en forme de cercle, jaunes à blanc cassé, portant les inscriptions « IMURAN » et « 50 » sur chaque comprimé ; bouteille de 100 ( CDN 65483-590-10).
Conserver à 15° à 25°C (59° à 77°F) dans un endroit sec et à l'abri de la lumière.
RÉFÉRENCES
25. Recommandations pour la manipulation sécuritaire des médicaments antinéoplasiques parentéraux. Washington, DC : Division de la sécurité ; Département de pharmacie du centre clinique et services de soins infirmiers en oncologie, Institut national de la santé ; 1992. Département américain de la santé et des services sociaux. Publication du service de santé publique NIH 92-2621.
26. Conseil des affaires scientifiques de l'AMA. Lignes directrices pour la manipulation des antinéoplasiques parentéraux. JAMA. 1985; 253:15901592.
27. Commission nationale d'étude sur l'exposition cytotoxique. Recommandations pour la manipulation des agents cytotoxiques. 1987. Disponible auprès de Louis P. Jeffrey, président, National Study Commission on Cytotoxic Exposure. Massachusetts College of Pharmacy and Allied Health Sciences, 179 Longwood Avenue, Boston, MA 02115.
28. Société d'oncologie clinique d'Australie. Lignes directrices et recommandations pour une manipulation sécuritaire des agents antinéoplasiques. Med J Aust. 1983; 1:426-428.
29. Jones RB, Frank R, Mass T. Manipulation sûre des agents chimiothérapeutiques : un rapport du Mount Sinai Medical Center. CA Cancer J pour les cliniciens. 1983; 33:258-263.
30. Société américaine des pharmaciens hospitaliers. Bulletin d'assistance technique de l'ASHP sur la manipulation des médicaments cytotoxiques et dangereux. Suis J Hosp Pharm. 1990 ; 47:1033-1049.
31. Yodaiken RE, Bennett D. Directives sur les pratiques de travail de l'OSHA pour le personnel traitant des médicaments cytotoxiques (antinéoplasiques). Am J Hosp Pharm, 1996; 43:1193-1204.
Fabriqué par Pharmaceutics International, Inc. Hunt Valley, MD 21031 pour Prometheus Laboratories Inc. San Diego, CA 92121. Révisé : février 2014
EFFETS SECONDAIRES
Les effets toxiques principaux et potentiellement graves d'IMURAN sont hématologiques et gastro-intestinaux. Les risques d'infection secondaire et de malignité sont également importants (voir AVERTISSEMENTS ). La fréquence et la sévérité des effets indésirables dépendent de la dose et de la durée d'IMURAN ainsi que de la maladie sous-jacente du patient ou des traitements concomitants. L'incidence des toxicités hématologiques et des néoplasies rencontrées dans les groupes de receveurs d'homogreffes rénales est significativement plus élevée que celle des études utilisant IMURAN 25 mg pour la polyarthrite rhumatoïde. Les incidences relatives dans les études cliniques sont résumées ci-dessous :
Hématologique
La leucopénie et/ou la thrombocytopénie sont dose-dépendantes et peuvent survenir tardivement au cours du traitement par IMURAN. Une réduction de la dose ou un retrait temporaire peut entraîner l'inversion de ces toxicités. L'infection peut survenir en tant que manifestation secondaire de la suppression de la moelle osseuse ou de la leucopénie, mais l'incidence de l'infection dans l'homotransplantation rénale est de 30 à 60 fois supérieure à celle de la polyarthrite rhumatoïde. Des anémies, y compris une anémie macrocytaire et/ou des saignements ont été signalés.
Le génotypage ou le phénotypage TPMT peut aider à identifier les patients présentant une activité TPMT faible ou absente (homozygote pour les allèles non fonctionnels) qui présentent un risque accru de myélosuppression sévère et potentiellement mortelle due à IMURAN. Voir PHARMACOLOGIE CLINIQUE , AVERTISSEMENTS et PRÉCAUTIONS : Tests de laboratoire . Des décès associés à une pancytopénie ont été signalés chez des patients sans activité TPMT recevant de l'azathioprine.6,20
Gastro-intestinal
Des nausées et des vomissements peuvent survenir au cours des premiers mois de traitement par IMURAN 50 mg et sont survenus chez environ 12 % des 676 patients atteints de polyarthrite rhumatoïde. La fréquence des troubles gastriques peut souvent être réduite par l'administration du médicament en doses fractionnées et/ou après les repas. Cependant, chez certains patients, les nausées et les vomissements peuvent être sévères et peuvent être accompagnés de symptômes tels que diarrhée, fièvre, malaise et myalgies (voir PRÉCAUTIONS ). Des vomissements accompagnés de douleurs abdominales peuvent survenir rarement avec une pancréatite d'hypersensibilité. Une hépatotoxicité se manifestant par une élévation de la phosphatase alcaline sérique, de la bilirubine et/ou des transaminases sériques est connue après l'utilisation d'azathioprine, principalement chez les receveurs d'allogreffe. L'hépatotoxicité a été peu fréquente (moins de 1 %) chez les patients atteints de polyarthrite rhumatoïde. L'hépatotoxicité consécutive à la transplantation survient le plus souvent dans les 6 mois suivant la transplantation et est généralement réversible après l'interruption d'IMURAN. Une maladie veino-occlusive hépatique rare mais potentiellement mortelle associée à l'administration chronique d'azathioprine a été décrite chez des patients transplantés et chez un patient recevant IMURAN pour une panuvéite.21,22,23 La mesure périodique des transaminases sériques, de la phosphatase alcaline et de la bilirubine est indiqué pour la détection précoce de l'hépatotoxicité. Si une maladie veino-occlusive hépatique est cliniquement suspectée, IMURAN doit être arrêté définitivement.
Les autres
Des effets secondaires supplémentaires de faible fréquence ont été rapportés. Il s'agit notamment d'éruptions cutanées, d'alopécie, de fièvre, d'arthralgies, de diarrhée, de stéatorrhée, d'un bilan azoté négatif, d'une pneumopathie interstitielle réversible, d'un lymphome T hépatosplénique (voir AVERTISSEMENTS – Malignité ) et le syndrome de Sweet (dermatose aiguë fébrile à neutrophiles).
INTERACTIONS MÉDICAMENTEUSES
Utiliser avec Allopurinol
L'une des voies d'inactivation de l'azathioprine est inhibée par l'allopurinol. Les patients recevant simultanément IMURAN 50 mg et allopurinol doivent bénéficier d'une réduction de la dose d'IMURAN 50 mg, à environ 1/3 à 1/4 de la dose habituelle. Il est recommandé d'envisager une réduction supplémentaire de la dose ou des thérapies alternatives pour les patients présentant une activité TPMT faible ou absente recevant IMURAN 50 mg et de l'allopurinol, car les voies d'inactivation de la TPMT et de XO sont affectées. Voir PHARMACOLOGIE CLINIQUE , AVERTISSEMENTS , PRÉCAUTIONS : Tests de laboratoire et EFFETS INDÉSIRABLES sections.
Utiliser avec des aminosalicylates
Il existe des preuves in vitro que les dérivés d'aminosalicylate (p. ex., la sulphasalazine, la mésalazine ou l'olsalazine) inhibent l'enzyme TPMT. L'utilisation concomitante de ces agents avec IMURAN 50 mg doit être faite avec prudence.
Utilisation avec d'autres agents affectant la myélopoïèse
Les médicaments susceptibles d'affecter la production de leucocytes, y compris le cotrimoxazole, peuvent entraîner une leucopénie exagérée, en particulier chez les receveurs de greffe rénale.
Utilisation avec les inhibiteurs de l'enzyme de conversion de l'angiotensine
Il a été rapporté que l'utilisation d'inhibiteurs de l'enzyme de conversion de l'angiotensine pour contrôler l'hypertension chez les patients sous azathioprine induisait une anémie et une leucopénie sévère.
Utiliser avec la warfarine
IMURAN peut inhiber l'effet anticoagulant de la warfarine.
Utiliser avec la ribavirine
Il a été rapporté que l'utilisation de la ribavirine pour l'hépatite C chez les patients recevant de l'azathioprine induisait une pancytopénie sévère et pouvait augmenter le risque de myélotoxicité liée à l'azathioprine. L'inosine monophosphate déshydrogénase (IMDH) est nécessaire pour l'une des voies métaboliques de l'azathioprine. La ribavirine est connue pour inhiber l'IMDH, entraînant ainsi l'accumulation d'un métabolite de l'azathioprine, le 6-méthylthioionosine monophosphate (6MTITP), qui est associé à une myélotoxicité (neutropénie, thrombocytopénie et anémie). Les patients recevant de l'azathioprine avec de la ribavirine doivent subir une numération globulaire complète, y compris une numération plaquettaire, surveillée chaque semaine pendant le premier mois, deux fois par mois pendant les deuxième et troisième mois de traitement, puis une fois par mois ou plus fréquemment si la posologie ou d'autres changements de traitement sont nécessaires.
RÉFÉRENCES
6. Données internes, Prometheus Laboratories Inc.
20. Schutz E, Gummert J, Mohr F, Oellerich M. Myélosuppression induite par l'azathioprine chez les patients transplantés cardiaques déficients en thiopurine méthyltransférase. Lancette. 1993 ; 341:436.
21. Lire AE, Wiesner RH, LaBrecque DR, et al. Maladie veino-occlusive hépatique associée à une transplantation rénale et à un traitement par azathioprine. Ann Stagiaire Med. 1986; 104:651-655.
22. Katzka DA, Saul SH, Jorkasky D, et al. Azathioprine et maladie veino-occlusive hépatique chez les patients transplantés rénaux. Gastroentérologie. 1986; 90:446-454.
23. Weitz H, Gokel JM, Loeshke K, et al. Maladie veino-occlusive du foie chez les patients recevant un traitement immunosuppresseur. Virchows Arch Un Pathol Anat Histol. 1982 ; 395:245-256.
AVERTISSEMENTS
Malignité
Les patients recevant des immunosuppresseurs, y compris IMURAN 50 mg, présentent un risque accru de développer un lymphome et d'autres tumeurs malignes, en particulier de la peau. Les médecins doivent informer les patients du risque de malignité avec IMURAN. Comme d'habitude pour les patients présentant un risque accru de cancer de la peau, l'exposition au soleil et aux rayons ultraviolets doit être limitée par le port de vêtements de protection et l'utilisation d'un écran solaire à indice de protection élevé.
Post-transplantation
Les patients transplantés rénaux sont connus pour avoir un risque accru de malignité, principalement le cancer de la peau et les cellules du réticulum ou les tumeurs lymphomateuses. Le risque de lymphomes post-transplantation peut être augmenté chez les patients qui reçoivent un traitement agressif avec des médicaments immunosuppresseurs, y compris IMURAN. Par conséquent, le traitement médicamenteux immunosuppresseur doit être maintenu aux niveaux efficaces les plus bas.
La polyarthrite rhumatoïde
Des informations sont disponibles sur le risque de malignité avec l'utilisation d'IMURAN 50 mg dans la polyarthrite rhumatoïde (voir EFFETS INDÉSIRABLES ). Il n'a pas été possible de définir le risque précis de malignité dû à IMURAN. Les données suggèrent que le risque peut être élevé chez les patients atteints de polyarthrite rhumatoïde, bien qu'inférieur à celui des patients transplantés rénaux. Cependant, des leucémies myéloïdes aiguës ainsi que des tumeurs solides ont été rapportées chez des patients atteints de polyarthrite rhumatoïde ayant reçu IMURAN.
Maladie inflammatoire de l'intestin
Des cas post-commercialisation de lymphome T hépatosplénique (HSTCL), un type rare de lymphome T, ont été rapportés chez des patients traités par IMURAN. Ces cas ont eu une évolution très agressive de la maladie et ont été mortels. La majorité des cas signalés sont survenus chez des patients atteints de la maladie de Crohn ou de colite ulcéreuse et la majorité concernaient des adolescents et de jeunes adultes de sexe masculin. Certains des patients étaient traités par IMURAN en monothérapie et certains avaient reçu un traitement concomitant par un anti-TNFα au moment ou avant le diagnostic. La sécurité et l'efficacité d'IMURAN 25 mg pour le traitement de la maladie de Crohn et de la rectocolite hémorragique n'ont pas été établies.
Cytopénies
Une leucopénie sévère, une thrombocytopénie, des anémies, y compris une anémie macrocytaire, et/ou une pancytopénie peuvent survenir chez les patients traités par IMURAN. Une suppression sévère de la moelle osseuse peut également survenir. Les patients présentant une activité intermédiaire de la thiopurine S-méthyl transférase (TPMT) peuvent être exposés à un risque accru de myélotoxicité s'ils reçoivent des doses conventionnelles d'IMURAN. Les patients dont l'activité TPMT est faible ou absente présentent un risque accru de développer une myélotoxicité grave, potentiellement mortelle, s'ils reçoivent des doses conventionnelles d'IMURAN. Le génotypage ou le phénotypage TPMT peut aider à identifier les patients qui présentent un risque accru de développer une toxicité IMURAN 50 mg.2-9 (Voir PRÉCAUTIONS : Tests de laboratoire ). Les toxicités hématologiques sont liées à la dose et peuvent être plus sévères chez les patients transplantés rénaux dont l'homogreffe est en cours de rejet. Il est suggéré que les patients sous IMURAN aient une numération globulaire complète, y compris une numération plaquettaire, une fois par semaine pendant le premier mois, deux fois par mois pendant les deuxième et troisième mois de traitement, puis une fois par mois ou plus fréquemment si des modifications de la posologie ou d'autres changements de traitement sont nécessaires. Une suppression hématologique retardée peut survenir. Une réduction rapide de la posologie ou un arrêt temporaire du médicament peuvent être nécessaires en cas de chute rapide ou de diminution persistante du nombre de leucocytes, ou d'autres signes d'aplasie médullaire. La leucopénie n'est pas corrélée à l'effet thérapeutique ; par conséquent, la dose ne doit pas être augmentée intentionnellement pour réduire le nombre de globules blancs.
Infections graves
Les patients recevant des immunosuppresseurs, y compris Imuran 25 mg, présentent un risque accru d'infections bactériennes, virales, fongiques, protozoaires et opportunistes, y compris la réactivation d'infections latentes. Ces infections peuvent avoir des conséquences graves, voire mortelles.

Leucoencéphalopathie multifocale progressive
Des cas d'infection associée au virus JC entraînant une leucoencéphalopathie multifocale progressive (LEMP), parfois mortelle, ont été rapportés chez des patients traités par des immunosuppresseurs, dont Imuran. Les facteurs de risque de LEMP comprennent le traitement par des thérapies immunosuppressives et une altération de la fonction immunitaire. Envisagez le diagnostic de LEMP chez tout patient présentant des manifestations neurologiques d'apparition récente et envisagez de consulter un neurologue selon les indications cliniques. Envisagez de réduire le degré d'immunosuppression chez les patients qui développent une LEMP. Chez les patients transplantés, considérez le risque que l'immunosuppression réduite représente pour le greffon.
Effet sur le sperme chez les animaux
Il a été rapporté qu'IMURAN provoque une dépression temporaire de la spermatogenèse et une réduction de la viabilité et du nombre de spermatozoïdes chez la souris à des doses 10 fois supérieures à la dose thérapeutique humaine ;10 un pourcentage réduit d'accouplements fertiles s'est produit lorsque les animaux ont reçu 5 mg/kg.11
Grossesse
Catégorie de grossesse D
IMURAN peut être nocif pour le fœtus lorsqu'il est administré à une femme enceinte. IMURAN 50 mg ne doit pas être administré pendant la grossesse sans une évaluation soigneuse du rapport bénéfice/risque. Dans la mesure du possible, l'utilisation d'IMURAN chez les patientes enceintes doit être évitée. Ce médicament ne doit pas être utilisé pour traiter la polyarthrite rhumatoïde chez les femmes enceintes.12
IMURAN est tératogène chez le lapin et la souris lorsqu'il est administré à des doses équivalentes à la dose humaine (5 mg/kg par jour). Les anomalies comprenaient des malformations squelettiques et des anomalies viscérales.11
Des anomalies immunologiques limitées et d'autres anomalies sont survenues chez quelques nourrissons nés de receveurs d'allogreffe rénale sous IMURAN. Dans un rapport de cas détaillé13, une lymphopénie documentée, une diminution des taux d'IgG et d'IgM, une infection à CMV et une diminution de l'ombre thymique ont été notées chez un nourrisson né d'une mère recevant 150 mg d'azathioprine et 30 mg de prednisone par jour tout au long de la grossesse. À 10 semaines, la plupart des caractéristiques étaient normalisées. DeWitte et al ont rapporté une pancytopénie et une déficience immunitaire sévère chez un nourrisson prématuré dont la mère a reçu 125 mg d'azathioprine et 12,5 mg de prednisone par jour.14 Il y a eu deux rapports publiés faisant état de résultats physiques anormaux. Williamson et Karp ont décrit un nourrisson né avec une polydactylie préaxiale dont la mère a reçu de l'azathioprine 200 mg par jour et de la prednisone 20 mg tous les deux jours pendant la grossesse.15 Tallent et al ont décrit un nourrisson avec un grand myéloméningocèle dans la région lombaire supérieure, des hanches luxées bilatérales et pied bot varus équin. Le père suivait un traitement à long terme à l'azathioprine.16
Le rapport bénéfice/risque doit être soigneusement pesé avant l'utilisation d'IMURAN chez des patientes en âge de procréer. Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Si ce médicament est utilisé pendant la grossesse ou si la patiente tombe enceinte pendant qu'elle prend ce médicament, la patiente doit être informée du risque potentiel pour le fœtus. Il faut conseiller aux femmes en âge de procréer d'éviter de devenir enceintes.
PRÉCAUTIONS
Général
Une réaction d'hypersensibilité gastro-intestinale caractérisée par des nausées et des vomissements sévères a été rapportée. Ces symptômes peuvent également s'accompagner de diarrhée, d'éruptions cutanées, de fièvre, de malaises, de myalgies, d'élévations des enzymes hépatiques et parfois d'hypotension. Les symptômes de toxicité gastro-intestinale se développent le plus souvent au cours des premières semaines de traitement par IMURAN 25 mg et sont réversibles à l'arrêt du médicament. La réaction peut réapparaître quelques heures après une nouvelle provocation avec une dose unique d'IMURAN.
Tests de laboratoire
Surveillance complète de la numération globulaire (CBC)
Les patients sous IMURAN 25 mg doivent subir une numération globulaire complète, y compris une numération plaquettaire, une fois par semaine pendant le premier mois, deux fois par mois pendant les deuxième et troisième mois de traitement, puis une fois par mois ou plus fréquemment si des modifications de la posologie ou d'autres modifications du traitement sont nécessaires.
Test TPMT
Il est recommandé de tenir compte du génotype ou du phénotype des patients pour la TPMT. Des méthodes de phénotypage et de génotypage sont disponibles dans le commerce. Les allèles non fonctionnels les plus courants associés à des niveaux réduits d'activité TPMT sont TPMT*2, TPMT*3A et TPMT*3C. Les patients avec deux allèles non fonctionnels (homozygotes) ont une activité TPMT faible ou absente et ceux avec un allèle non fonctionnel (hétérozygotes) ont une activité intermédiaire. Des résultats précis de phénotypage (activité TPMT des globules rouges) ne sont pas possibles chez les patients qui ont reçu des transfusions sanguines récentes. Le test TPMT peut également être envisagé chez les patients présentant des résultats CBC anormaux qui ne répondent pas à la réduction de la dose. L'arrêt précoce du médicament chez ces patients est conseillé. LE TEST TPMT NE PEUT PAS REMPLACER LA SURVEILLANCE COMPLÈTE DE LA SANTÉ CHEZ LES PATIENTS RECEVANT IMURAN. Voir PHARMACOLOGIE CLINIQUE , AVERTISSEMENTS , EFFETS INDÉSIRABLES et DOSAGE ET ADMINISTRATION sections.
Carcinogenèse, mutagenèse, altération de la fertilité
Voir AVERTISSEMENTS section.
Grossesse
Effets tératogènes
Catégorie de grossesse D. Voir AVERTISSEMENTS section.
Mères allaitantes
L'utilisation d'IMURAN 25 mg chez les femmes qui allaitent n'est pas recommandée. L'azathioprine ou ses métabolites sont transférés à de faibles niveaux, à la fois par voie transplacentaire et dans le lait maternel.17,18,19 En raison du potentiel de tumorigénicité démontré pour l'azathioprine, une décision doit être prise d'arrêter l'allaitement ou d'arrêter le médicament, en tenant compte de la importance du médicament pour la mère.
Utilisation pédiatrique
L'innocuité et l'efficacité de l'azathioprine chez les patients pédiatriques n'ont pas été établies.
RÉFÉRENCES
2. Weinshilboum R. Pharmacogénétique de la thiopurine : études cliniques et moléculaires de la thiopurine méthyltransférase. Médicament Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Le locus du gène de la thiopurine S-méthyltransférase -- implications pour la pharmacogénomique clinique. Pharmacogénomique. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et al. Pancytopénie liée à l'azathioprine - une déficience enzymatique causée par un polymorphisme génétique courant : une revue. JR Soc Méd. 1992 ; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Réduction de l'activité de la thiopurine méthyltransférase et développement d'effets secondaires du traitement par l'azathioprine chez les patients atteints de polyarthrite rhumatoïde. Arthrite Rheum. 1998 ; 41:18581866.
6. Données internes, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Diagnostic moléculaire du déficit en thiopurine S-méthyltransférase : bases génétiques de l'intolérance à l'azathioprine et à la mercaptopurine. Ann Stagiaire Med. 1997 ; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. Le génotype de la thiopurine méthyltransférase prédit une toxicité sévère limitant le traitement de l'azathioprine. Ann Stagiaire Med. 1998 ; 129:716-718.
9. Clunie GP, Lennard L. Pertinence du statut de la thiopurine méthyltransférase chez les patients en rhumatologie recevant de l'azathioprine. Rhumatologie. 2004 ; 43:13-18.
10. Clark JM. La mutagénicité de l'azathioprine chez la souris, Drosophila melanogaster et Neurospora crassa. Mutat Res. 1975; 28:87-99.
11. Données internes, Prometheus Laboratories Inc.
12. Tagatz GE, Simmons RL. Grossesse après transplantation rénale. Ann Stagiaire Med. 1975; 82:113-114. Notes éditoriales.
13. Cote' CJ, Meuwissen HJ, Pickering RJ. Effets sur le nouveau-né de la prednisone et de l'azathioprine administrées à la mère pendant la grossesse. J Pédiatre. 1974 ; 85:324-328.
14. DeWitte DB, Buick MK, Cyran SE, et al. Pancytopénie néonatale et déficit immunitaire combiné sévère associés à l'administration prénatale d'azathioprine et de prednisone. J Pédiatre. 1984; 105:625-628.
15. Williamson RA, Karp LE. Tératogénicité de l'azathioprine : revue de la littérature et rapport de cas. Obstet Gynécol. 1981; 58:247-250.
16. Tallent MB, Simmons RL, Najarian JS. Malformations congénitales chez l'enfant d'un homme receveur d'une greffe de rein. JAMA. 1970 ; 211 : 1854-1855.
17. Données internes, Prometheus Laboratories Inc.
18. Saarikoski S, Seppälä M. Immunosuppression pendant la grossesse : transmission de l'azathioprine et de ses métabolites de la mère au fœtus. Suis J Obstet Gynecol. 1973 ; 115:1100-1106.
19. Coulam CB, Moyer TP, Jiang NS, et al. Allaitement après transplantation rénale. procédure de greffe 1982 ; 14 : 605-609.
SURDOSAGE
Les DL50 orales pour des doses uniques d'IMURAN 50 mg chez la souris et le rat sont respectivement de 2 500 mg/kg et 400 mg/kg. De très fortes doses de cet antimétabolite peuvent entraîner une hypoplasie médullaire, des saignements, une infection et la mort. Environ 30 % d'IMURAN est lié aux protéines sériques, mais environ 45 % sont éliminés au cours d'une hémodialyse de 8 heures.24 Un seul cas a été signalé chez un patient transplanté rénal qui a ingéré une dose unique de 7 500 mg d'IMURAN. Les réactions toxiques immédiates étaient des nausées, des vomissements et de la diarrhée, suivis d'une légère leucopénie et de légères anomalies de la fonction hépatique. Le nombre de globules blancs, le SGOT et la bilirubine sont revenus à la normale 6 jours après le surdosage.
CONTRE-INDICATIONS
IMURAN 25 mg ne doit pas être administré aux patients qui ont montré une hypersensibilité au médicament. IMURAN ne doit pas être utilisé pour traiter la polyarthrite rhumatoïde chez la femme enceinte. Les patients atteints de polyarthrite rhumatoïde précédemment traités avec des agents alkylants (cyclophosphamide, chlorambucil, melphalan ou autres) peuvent présenter un risque prohibitif de malignité s'ils sont traités par IMURAN.
RÉFÉRENCES
24. Schusziarra V, Ziekursch V, Schlamp R, et al. Pharmacocinétique de l'azathioprine sous hémodialyse. Int J Clin Pharmacol Biopharm. 1976; 14:298-302.
PHARMACOLOGIE CLINIQUE
L'azathioprine est bien absorbée après administration orale. La radioactivité sérique maximale se produit 1 à 2 heures après la prise orale de 35S-azathioprine et décroît avec une demi-vie de 5 heures. Il ne s'agit pas d'une estimation de la demi-vie de l'azathioprine elle-même, mais du taux de décomposition de tous les métabolites contenant du 35S du médicament. En raison d'un métabolisme important, seule une fraction de la radioactivité est présente sous forme d'azathioprine. Les doses habituelles produisent des taux sanguins d'azathioprine et de mercaptopurine dérivée de celle-ci qui sont faibles ( SURDOSAGE .
L'azathioprine est métabolisée en 6-mercaptopurine (6-MP). Les deux composés sont rapidement éliminés du sang et sont oxydés ou méthylés dans les érythrocytes et le foie ; aucune azathioprine ou mercaptopurine n'est détectable dans les urines après 8 heures. L'activation de la 6-mercaptopurine se produit via l'hypoxanthine-guanine phosphoribosyltransférase (HGPRT) et une série de processus multi-enzymatiques impliquant des kinases pour former des nucléotides de 6-thioguanine (6-TGN) comme principaux métabolites (voir Schéma de métabolisme dans la figure 1 ). La cytotoxicité de l'azathioprine est due, en partie, à l'incorporation de 6-TGN dans l'ADN.
La 6-MP subit deux voies d'inactivation majeures (Figure 1). L'un est la méthylation du thiol, qui est catalysée par l'enzyme thiopurine S-méthyltransférase (TPMT), pour former le métabolite inactif méthyl-6-MP (6-MeMP). L'activité TPMT est contrôlée par un polymorphisme génétique.1,2,3 Chez les Caucasiens et les Afro-Américains, environ 10 % de la population héritent d'un allèle TPMT non fonctionnel (hétérozygote) conférant une activité TPMT intermédiaire, et 0,3 % héritent de deux allèles TPMT non fonctionnels. allèles (homozygotes) pour une activité TPMT faible ou absente. Les allèles non fonctionnels sont moins courants chez les Asiatiques. L'activité de la TPMT est inversement corrélée aux niveaux de 6-TGN dans les érythrocytes et vraisemblablement dans d'autres tissus hématopoïétiques, puisque ces cellules ont des activités négligeables de xanthine oxydase (impliquée dans l'autre voie d'inactivation), laissant la méthylation de la TPMT comme seule voie d'inactivation. Les patients présentant une activité TPMT intermédiaire peuvent présenter un risque accru de myélotoxicité s'ils reçoivent des doses conventionnelles d'IMURAN. Les patients dont l'activité TPMT est faible ou absente présentent un risque accru de développer une myélotoxicité grave et potentiellement mortelle s'ils reçoivent des doses conventionnelles d'IMURAN.4-9 Le génotypage ou le phénotypage TPMT (activité TPMT des globules rouges) peut aider à identifier les patients qui risque de développer une toxicité d'IMURAN 25 mg.2,3,7,8,9 Des résultats précis de phénotypage (activité TPMT des globules rouges) ne sont pas possibles chez les patients qui ont reçu des transfusions sanguines récentes. Voir AVERTISSEMENTS , PRÉCAUTIONS : INTERACTIONS MÉDICAMENTEUSES , PRÉCAUTIONS : Tests de laboratoire et EFFETS INDÉSIRABLES sections.
Figure 1 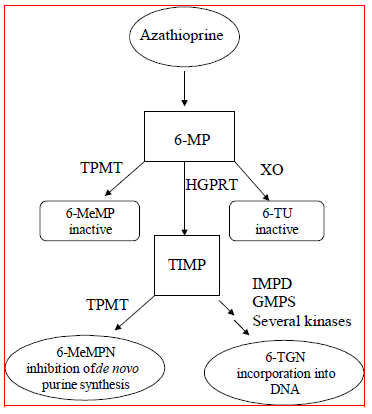 Figure 1. Voie métabolique de l'azathioprine : les voies concurrentes entraînent l'inactivation par TPMT ou XO, ou l'incorporation de nucléotides cytotoxiques dans l'ADN.
Figure 1. Voie métabolique de l'azathioprine : les voies concurrentes entraînent l'inactivation par TPMT ou XO, ou l'incorporation de nucléotides cytotoxiques dans l'ADN.
GMPS : guanosine monophosphate synthétase ; HGPRT : Hypoxanthine-guanine-phosphoribosyl-transférase ; IMPD : Inosine monophosphate déshydrogénase ; MeMP : méthylmercaptopurine ; MeMPN : nucléotide de méthylmercaptopurine ; TGN : nucléotides de thioguanine ; TIMP : Thioinosine monophosphate ; TPMT : Thiopurine S-méthyltransférase ; TU Acide thiourique ; XO : xanthine oxydase (adapté de Pharmacogenomics 2002 ; 3:89-98 ; et Cancer Res 2001 ; 61:5810-5816.)
Une autre voie d'inactivation est l'oxydation, qui est catalysée par la xanthine oxydase (XO) pour former de l'acide 6-thiourique. L'inhibition de la xanthine oxydase chez les patients recevant de l'allopurinol (ZYLOPRIM®) est à la base de la réduction de la posologie de l'azathioprine nécessaire chez ces patients (voir PRÉCAUTIONS : INTERACTIONS MÉDICAMENTEUSES ). Les proportions de métabolites sont différentes chez les patients individuels, ce qui explique vraisemblablement l'ampleur et la durée variables des effets des médicaments. La clairance rénale n'est probablement pas importante pour prédire l'efficacité biologique ou les toxicités, bien qu'une réduction de la dose soit pratiquée chez les patients dont la fonction rénale est altérée.
Survie de l'homogreffe
L'utilisation de l'azathioprine pour l'inhibition du rejet d'homogreffe rénale est bien établie, le ou les mécanismes de cette action sont quelque peu obscurs. Le médicament supprime les hypersensibilités de type à médiation cellulaire et provoque des altérations variables de la production d'anticorps. La suppression des effets des lymphocytes T, y compris l'ablation de la suppression des lymphocytes T, dépend de la relation temporelle avec le stimulus antigénique ou la prise de greffe. Cet agent a peu d'effet sur les rejets de greffe établis ou les réponses secondaires.
Les altérations des réponses immunitaires spécifiques ou des fonctions immunologiques chez les receveurs de greffe sont difficiles à relier spécifiquement à l'immunosuppression par l'azathioprine. Ces patients ont des réponses sous-normales aux vaccins, un faible nombre de lymphocytes T et une phagocytose anormale par les cellules sanguines périphériques, mais leurs réponses mitogènes, leurs immunoglobulines sériques et leurs réponses anticorps secondaires sont généralement normales.
Réponse immuno-inflammatoire
L'azathioprine supprime les manifestations de la maladie ainsi que la pathologie sous-jacente dans les modèles animaux de maladie auto-immune. Par exemple, la sévérité de l'arthrite adjuvante est réduite par l'azathioprine.
Les mécanismes par lesquels l'azathioprine affecte les maladies auto-immunes ne sont pas connus. L'azathioprine est immunosuppresseur, les tests d'hypersensibilité retardée et de cytotoxicité cellulaire sont supprimés à un degré plus élevé que les réponses anticorps. Dans le modèle d'arthrite adjuvante chez le rat, il a été démontré que l'azathioprine inhibe l'hyperplasie des ganglions lymphatiques, qui précède l'apparition des signes de la maladie. Les effets immunosuppresseurs et thérapeutiques chez les modèles animaux sont liés à la dose. L'azathioprine est considérée comme un médicament à action lente et les effets peuvent persister après l'arrêt du médicament.
RÉFÉRENCES
1. Lennard L. La pharmacologie clinique de la 6-mercaptopurine. Eur J Clin Pharmacol. 1992;43:329-339.
2. Weinshilboum R. Pharmacogénétique de la thiopurine : études cliniques et moléculaires de la thiopurine méthyltransférase. Médicament Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Le locus du gène de la thiopurine S-méthyltransférase -- implications pour la pharmacogénomique clinique. Pharmacogénomique. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et al. Pancytopénie liée à l'azathioprine - une déficience enzymatique causée par un polymorphisme génétique courant : une revue. JR Soc Méd. 1992 ; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Réduction de l'activité de la thiopurine méthyltransférase et développement d'effets secondaires du traitement par l'azathioprine chez les patients atteints de polyarthrite rhumatoïde. Arthrite Rheum. 1998 ; 41:18581866.
6. Données internes, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Diagnostic moléculaire du déficit en thiopurine S-méthyltransférase : bases génétiques de l'intolérance à l'azathioprine et à la mercaptopurine. Ann Stagiaire Med. 1997 ; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. Le génotype de la thiopurine méthyltransférase prédit une toxicité sévère limitant le traitement de l'azathioprine. Ann Stagiaire Med. 1998 ; 129:716-718.
9. Clunie GP, Lennard L. Pertinence du statut de la thiopurine méthyltransférase chez les patients en rhumatologie recevant de l'azathioprine. Rhumatologie. 2004 ; 43:13-18.
INFORMATIONS PATIENTS
Les patients qui commencent un traitement par IMURAN doivent être informés de la nécessité de numérations globulaires périodiques pendant qu'ils reçoivent le médicament et doivent être encouragés à signaler tout saignement ou ecchymose inhabituel à leur médecin. Ils doivent être informés du danger d'infection pendant qu'ils reçoivent IMURAN et doivent signaler les signes et symptômes d'infection à leur médecin. Des instructions posologiques précises doivent être données au patient, en particulier lorsqu'IMURAN est administré en présence d'insuffisance rénale ou en concomitance avec l'allopurinol (voir INTERACTIONS MÉDICAMENTEUSES sous-section et DOSAGE ET ADMINISTRATION ). Les patientes doivent être informées des risques potentiels de l'utilisation d'IMURAN 50 mg pendant la grossesse et pendant la période d'allaitement. Le risque accru de malignité après un traitement par IMURAN doit être expliqué au patient.
