Traitement de la douleur: Lioresal 10mg, 25mg Baclofen Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Lioresal 10 mg intrathécal et comment est-il utilisé ?
Lioresal Intrathecal est un médicament d'ordonnance utilisé pour traiter les symptômes de la spasticité. Lioresal Intrathecal peut être utilisé seul ou avec d'autres médicaments.
Lioresal Intrathecal appartient à une classe de médicaments appelés relaxants musculaires squelettiques.
On ne sait pas si Lioresal Intrathecal est sûr et efficace chez les enfants de moins de 12 ans.
Quels sont les effets secondaires possibles de Lioresal 25mg Intrathecal ?
Lioresal 10 mg intrathécal peut provoquer des effets indésirables graves, notamment :
- urticaire,
- difficulté à respirer,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- somnolence intense,
- respiration faible ou superficielle,
- confusion,
- hallucinations,
- démangeaisons, picotements ou contractions dans les mains, les bras, les pieds ou les jambes,
- fièvre, et
- saisie
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets indésirables les plus courants de Lioresal 25 mg intrathécal incluent :
- somnolence,
- vertiges,
- la faiblesse,
- fatigue,
- mal de tête,
- troubles du sommeil (insomnie),
- nausée,
- la constipation et
- uriner plus souvent que d'habitude
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Lioresal Intrathecal. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
L'arrêt brutal du baclofène intrathécal, quelle qu'en soit la cause, a entraîné des séquelles telles qu'une forte fièvre, une altération de l'état mental, une spasticité de rebond exagérée et une rigidité musculaire, qui dans de rares cas ont évolué vers la rhabdomyolyse, la défaillance de plusieurs organes et la mort.
La prévention de l'arrêt brutal du baclofène intrathécal nécessite une attention particulière à la programmation et à la surveillance du système de perfusion, à la planification et aux procédures de remplissage et aux alarmes de la pompe. Les patients et les soignants doivent être informés de l'importance de respecter les visites de renouvellement programmées et doivent être informés des premiers symptômes du sevrage du baclofène. Une attention particulière doit être accordée aux patients à risque apparent (par exemple, lésions de la moelle épinière à T-6 ou plus, difficultés de communication, antécédents de symptômes de sevrage du baclofène oral ou intrathécal). Consultez le manuel technique du système de perfusion implantable pour obtenir des informations supplémentaires sur le clinicien et le patient après l'implantation (voir AVERTISSEMENTS ).
LA DESCRIPTION
LIORESAL INTRATHECAL (baclofène injectable) est un myorelaxant et un antispasmodique. Son nom chimique est l'acide 4-amino-3-(4-chlorophényl) butanoïque et sa formule structurale est :
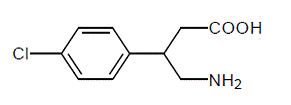
Le baclofène est une poudre cristalline blanche à blanc cassé, inodore ou pratiquement inodore, d'un poids moléculaire de 213,66. Il est légèrement soluble dans l'eau, très légèrement soluble dans le méthanol et insoluble dans le chloroforme.
LIORESAL INTRATHECAL est une solution stérile, apyrogène, isotonique, sans antioxydants, conservateurs ou autres additifs potentiellement neurotoxiques, indiquée uniquement pour une administration intrathécale. Le médicament est stable en solution à 37°C et compatible avec le LCR. Chaque millilitre de LIORESAL INTRATHECAL contient du baclofène USP 50 mcg, 500 mcg ou 2000 mcg et du chlorure de sodium 9 mg dans de l'eau pour injection; La plage de pH est de 5,0 à 7,0. Chaque ampoule est destinée à UN USAGE UNIQUE UNIQUEMENT. Jeter toute portion inutilisée. NE PAS AUTOCLAVER.
LES INDICATIONS
LIORESAL 10 mg INTRATHECAL (baclofène injectable) est indiqué dans la prise en charge de la spasticité sévère. Les patients doivent d'abord répondre à une dose de dépistage de baclofène intrathécal avant d'envisager une perfusion à long terme via une pompe implantable. Pour la spasticité d'origine médullaire, la perfusion chronique de LIORESAL INTRATHECAL via une pompe implantable doit être réservée aux patients qui ne répondent pas au traitement oral par le baclofène ou à ceux qui présentent des effets secondaires intolérables sur le SNC à des doses efficaces. Les patients présentant une spasticité due à une lésion cérébrale traumatique doivent attendre au moins un an après la lésion avant d'envisager un traitement à long terme par le baclofène intrathécal. LIORESAL INTRATHECAL est destiné à être utilisé par voie intrathécale en doses tests en bolus unique (par cathéter rachidien ou ponction lombaire) et, pour un usage chronique, uniquement dans des pompes implantables approuvées par la FDA spécifiquement pour l'administration de LIORESAL INTRATHECAL dans l'espace intrathécal.
Spasticité d'origine médullaire
Des preuves à l'appui de l'efficacité de LIORESAL INTRATHECAL ont été obtenues au cours d'études randomisées et contrôlées comparant les effets d'une dose intrathécale unique ou d'une perfusion intrathécale de trois jours de LIORESAL INTRATHECAL à un placebo chez des patients souffrant de spasticité sévère et de spasmes dus à un traumatisme de la moelle épinière ou à de multiples sclérose. LIORESAL 10 mg INTRATHECAL s'est avéré supérieur au placebo sur les deux principaux critères de jugement employés : modification par rapport à la valeur initiale de l'évaluation d'Ashworth de la spasticité et de la fréquence des spasmes.
Spasticité d'origine cérébrale
L'efficacité de LIORESAL INTRATHECAL a été étudiée dans trois essais cliniques contrôlés ; deux patients inscrits atteints de paralysie cérébrale et un patient inscrit souffrant de spasticité due à une lésion cérébrale antérieure. La première étude, un essai croisé contrôlé randomisé de 51 patients atteints de paralysie cérébrale, a fourni des résultats solides et statistiquement significatifs ; LIORESAL INTRATHECAL s'est avéré supérieur au placebo pour réduire la spasticité mesurée par l'échelle d'Ashworth. Une deuxième étude croisée a été menée chez 11 patients souffrant de spasticité résultant d'une lésion cérébrale. Malgré la petite taille de l'échantillon, l'étude a donné une statistique de test presque significative (p = 0,066) et a fourni des résultats directionnellement favorables. La dernière étude, cependant, n'a pas fourni de données pouvant être analysées de manière fiable.
Le traitement par LIORESAL 10mg INTRATHECAL peut être considéré comme une alternative aux procédures neurochirurgicales destructrices. Avant l'implantation d'un dispositif pour perfusion intrathécale chronique de LIORESAL 10mg INTRATHECAL, les patients doivent montrer une réponse à LIORESAL 10mg INTRATHECAL dans un essai de dépistage (voir DOSAGE ET ADMINISTRATION ).
DOSAGE ET ADMINISTRATION
Reportez-vous au manuel du fabricant de la pompe implantable approuvée pour la perfusion intrathécale pour obtenir des instructions et des précautions spécifiques pour la programmation de la pompe et/ou le remplissage du réservoir. Il existe différentes pompes avec différents volumes de réservoir et différents kits de recharge sont disponibles. Il est important de se familiariser avec tous ces produits afin de sélectionner le kit de recharge approprié pour la pompe particulière utilisée.
Phase de sélection
Avant l'implantation de la pompe et le début de la perfusion chronique de LIORESAL INTRATHECAL (baclofène injectable), les patients doivent démontrer une réponse clinique positive à une dose bolus de LIORESAL INTRATHECAL administrée par voie intrathécale lors d'un essai de dépistage. L'essai de dépistage utilise LIORESAL INTRATHECAL à une concentration de 50 mcg/mL. Une ampoule de 1 mL (50 mcg/mL) est disponible pour l'essai de dépistage. La procédure de dépistage est la suivante. Un bolus initial contenant 50 microgrammes dans un volume de 1 millilitre est administré dans l'espace intrathécal par barbotage sur une période d'au moins une minute. Le patient est observé pendant les 4 à 8 heures qui suivent. Une réponse positive consiste en une diminution significative du tonus musculaire et/ou de la fréquence et/ou de la sévérité des spasmes. Si la réponse initiale est inférieure à celle souhaitée, une seconde injection bolus peut être administrée 24 heures après la première. Le deuxième bolus de dépistage consiste en 75 microgrammes dans 1,5 millilitre. Encore une fois, le patient doit être observé pendant un intervalle de 4 à 8 heures. Si la réponse est toujours insuffisante, une dose finale de dépistage en bolus de 100 microgrammes dans 2 millilitres peut être administrée 24 heures plus tard.
Patients pédiatriques
La dose initiale de dépistage pour les patients pédiatriques est la même que pour les patients adultes, c'est-à-dire 50 mcg. Cependant, pour les très petits patients, une dose de dépistage de 25 mcg peut être essayée en premier. Les patients qui ne répondent pas à un bolus intrathécal de 100 mcg ne doivent pas être considérés comme des candidats à une pompe implantée pour une perfusion chronique.
Période de titration de la dose post-implantation
Pour déterminer la dose quotidienne totale initiale de LIORESAL INTRATHECAL après implantation, la dose de dépistage ayant donné un effet positif doit être doublée et administrée sur une période de 24 heures, sauf si l'efficacité de la dose bolus a été maintenue pendant plus de 8 heures, au cours desquelles Dans ce cas, la dose quotidienne initiale doit être la dose de dépistage administrée sur une période de 24 heures. Aucune augmentation de dose ne doit être administrée au cours des 24 premières heures (c'est-à-dire jusqu'à ce que l'état d'équilibre soit atteint).
Patients adultes atteints de spasticité d'origine médullaire
Après les premières 24 heures, pour les patients adultes, la dose quotidienne doit être augmentée lentement par incréments de 10 à 30 % et seulement une fois toutes les 24 heures, jusqu'à ce que l'effet clinique souhaité soit atteint.
Patients adultes atteints de spasticité d'origine cérébrale
Après les premières 24 heures, la dose quotidienne doit être augmentée lentement de 5 à 15 % une seule fois toutes les 24 heures, jusqu'à ce que l'effet clinique souhaité soit atteint.
Patients pédiatriques
Après les premières 24 heures, la dose quotidienne doit être augmentée lentement de 5 à 15 % une seule fois toutes les 24 heures, jusqu'à ce que l'effet clinique souhaité soit atteint. S'il n'y a pas de réponse clinique substantielle aux augmentations de la dose quotidienne, vérifier le bon fonctionnement de la pompe et la perméabilité du cathéter. Les patients doivent être étroitement surveillés dans un environnement entièrement équipé et doté de personnel pendant la phase de dépistage et la période de titration de la dose immédiatement après l'implantation. L'équipement de réanimation doit être immédiatement disponible pour être utilisé en cas d'effets secondaires potentiellement mortels ou intolérables.
Thérapie d'entretien
Spasticité des patients d'origine médullaire
L'objectif clinique est de maintenir le tonus musculaire aussi proche que possible de la normale et de minimiser la fréquence et la gravité des spasmes dans la mesure du possible, sans induire d'effets secondaires intolérables. Très souvent, la dose d'entretien doit être ajustée au cours des premiers mois de traitement pendant que les patients s'adaptent aux changements de style de vie dus à l'atténuation de la spasticité. Lors des remplissages périodiques de la pompe, la dose quotidienne peut être augmentée de 10 à 40 %, mais pas plus de 40 %, pour maintenir un contrôle adéquat des symptômes. La dose quotidienne peut être réduite de 10 à 20 % si les patients ressentent des effets secondaires. La plupart des patients ont besoin d'augmentations progressives de la dose au fil du temps pour maintenir une réponse optimale pendant le traitement chronique. Un besoin important et soudain d'augmenter la dose suggère une complication du cathéter (c'est-à-dire, un pli ou un délogement du cathéter).
La posologie d'entretien pour une perfusion continue à long terme de LIORESAL 10 mg INTRATHECAL (baclofène injectable) a varié de 12 mcg/jour à 2003 mcg/jour, la plupart des patients étant maintenus de manière adéquate sur 300 microgrammes à 800 microgrammes par jour. L'expérience avec des doses quotidiennes supérieures à 1000 mcg/jour est limitée. La détermination de la dose optimale de LIORESAL INTRATHECAL nécessite une titration individuelle. La dose la plus faible avec une réponse optimale doit être utilisée.
Spasticité des patients d'origine cérébrale
L'objectif clinique est de maintenir le tonus musculaire aussi proche que possible de la normale et de minimiser autant que possible la fréquence et la sévérité des spasmes, sans induire d'effets secondaires intolérables, ou d'ajuster la dose au degré de tonus musculaire souhaité pour des fonctions optimales. Très souvent, la dose d'entretien doit être ajustée au cours des premiers mois de traitement pendant que les patients s'adaptent aux changements de style de vie dus à l'atténuation de la spasticité. Lors des remplissages périodiques de la pompe, la dose quotidienne peut être augmentée de 5 à 20 %, mais pas plus de 20 %, pour maintenir un contrôle adéquat des symptômes. La dose quotidienne peut être réduite de 10 à 20 % si les patients ressentent des effets indésirables. De nombreux patients ont besoin d'augmentations progressives de la dose au fil du temps pour maintenir une réponse optimale pendant le traitement chronique. Un besoin important et soudain d'augmenter la dose suggère une complication du cathéter (c'est-à-dire, un pli ou un délogement du cathéter).
La posologie d'entretien pour une perfusion continue à long terme de LIORESAL 25 mg INTRATHECAL (baclofène injectable) a varié de 22 mcg/jour à 1400 mcg/jour, la plupart des patients étant maintenus de manière adéquate sur 90 microgrammes à 703 microgrammes par jour. Dans les essais cliniques, seuls 3 patients sur 150 ont eu besoin de doses quotidiennes supérieures à 1 000 mcg/jour.
Patients pédiatriques
Utiliser les mêmes recommandations posologiques pour les patients atteints de spasticité d'origine cérébrale. Les patients pédiatriques de moins de 12 ans semblaient nécessiter une dose quotidienne plus faible dans les essais cliniques. La dose quotidienne moyenne pour les patients de moins de 12 ans était de 274 mcg/jour, avec une fourchette de 24 à 1199 mcg/jour. La posologie requise pour les patients pédiatriques de plus de 12 ans ne semble pas être différente de celle des patients adultes. La détermination de la dose optimale de LIORESAL INTRATHECAL nécessite une titration individuelle. La dose la plus faible avec une réponse optimale doit être utilisée.
Besoin potentiel d'ajustements posologiques en cas d'utilisation chronique
Au cours d'un traitement à long terme, environ 5 % (28/627) des patients deviennent réfractaires à des doses croissantes. Il n'y a pas suffisamment d'expérience pour faire des recommandations fermes pour le traitement de la tolérance ; cependant, cette « tolérance » a été parfois traitée, à l'hôpital, par un « congé médicamenteux » consistant en la diminution progressive de LIORESAL 25 mg INTRATHECAL sur une période de 2 à 4 semaines et le passage à des méthodes alternatives de prise en charge de la spasticité. Après la « pause médicamenteuse », LIORESAL INTRATHECAL peut être redémarré à la dose initiale de perfusion continue.
La stabilité
Les produits médicamenteux parentéraux doivent être inspectés pour déceler les particules et la décoloration avant l'administration, chaque fois que la solution et le contenant le permettent.
Spécifications de livraison
La concentration spécifique à utiliser dépend de la dose quotidienne totale requise ainsi que du débit de la pompe. LIORESAL 10 mg INTRATHECAL peut nécessiter une dilution lorsqu'il est utilisé avec certaines pompes implantables. Veuillez consulter le manuel du fabricant pour des recommandations spécifiques.
Instructions de préparation
Dépistage
Utilisez uniquement l'ampoule de dépistage de 1 mL (50 mcg/mL) pour l'injection en bolus dans l'espace sous-arachnoïdien. Pour une dose bolus de 50 mcg, utilisez 1 mL de l'ampoule de dépistage. Utilisez 1,5 mL d'injection de baclofène à 50 mcg/mL pour une dose bolus de 75 mcg. Pour la dose de dépistage maximale de 100 mcg, utilisez 2 mL d'injection de baclofène à 50 mcg/mL (2 ampoules de dépistage).
Entretien
Pour les patients nécessitant des concentrations autres que 500 mcg/mL ou 2000 mcg/mL, LIORESAL INTRATHECAL doit être dilué .
LIORESAL 10mg INTRATHECAL doit être dilué avec chlorure de sodium stérile sans agent de conservation pour injection, USP
Régime de livraison
LIORESAL 10mg INTRATHECAL est le plus souvent administré en mode perfusion continue immédiatement après l'implantation. Pour les patients implantés avec des pompes programmables qui ont obtenu un contrôle relativement satisfaisant de la perfusion continue, des avantages supplémentaires peuvent être obtenus en utilisant des schémas plus complexes d'administration de LIORESAL INTRATHECAL. Par exemple, les patients qui ont des spasmes accrus la nuit peuvent nécessiter une augmentation de 20 % de leur débit de perfusion horaire. Les changements de débit doivent être programmés pour commencer deux heures avant l'heure de l'effet clinique souhaité.
COMMENT FOURNIE
LIORESAL INTRATHECAL (baclofène injectable) est conditionné en ampoules à usage unique contenant 0,05 mg/1 mL (50 mcg/mL), 10 mg/20 mL (500 mcg/mL), 10 mg/5 mL (2000 mcg/mL) ou 40 mg/20 mL ( 2000 mcg/mL) fourni comme suit :
Dose de dépistage (modèle 8563s) : cinq ampoules contenant chacune 0,05 mg/1 mL (50 mcg/mL) ( CDN 70257-562-55).
Kits de recharge LIORESAL INTRATHECAL (baclofène injectable) Chaque kit de recharge comprend la quantité indiquée de LIORESAL INTRATHECAL, un kit de préparation de médicament, un kit de recharge de pompe avec des accessoires compatibles avec les systèmes de perfusion Medtronic SynchroMed® et les instructions associées.
Modèle 8561 : une ampoule contenant 10 mg/20 mL (500 mcg/mL) ( CDN 70257-560-01).
Modèle 8562 : deux ampoules contenant chacune 10 mg/5 mL (2000 mcg/mL) ( CDN 70257-561-02).
Modèle 8564 : une ampoule contenant 40 mg/20 mL (2000 mcg/mL) ( CDN 70257-563-01).
Modèle 8565 : deux ampoules contenant chacune 10 mg/20 mL (500 mcg/mL) ( CDN 70257-560-02).
Modèle 8566 : deux ampoules contenant chacune 40 mg/20 mL (2000 mcg/mL) ( CDN 70257-563-02).
Stockage
Ne nécessite pas de réfrigération.
Ne pas entreposer au-dessus de 86 °F (30 °C).
Ne pas congeler.
Ne pas stériliser à la chaleur.
Distribué par : Saol Therapeutics Inc. Saol Therapeutics Inc., Roswell, GA 30076. Révisé : janvier 2019
EFFETS SECONDAIRES
Spasticité d'origine médullaire - Études cliniques
Couramment observé chez les patients atteints de spasticité d'origine rachidienne
Dans les essais cliniques pré- et post-commercialisation, les effets indésirables les plus fréquemment observés associés à l'utilisation de LIORESAL 25 mg INTRATHECAL (baclofène injectable) qui n'ont pas été observés à une incidence équivalente chez les patients traités par placebo ont été : somnolence, étourdissements, nausées, hypotension, céphalées, convulsions et hypotonie.
Associé à l'arrêt du traitement
8/474 patients atteints de spasticité d'origine médullaire recevant une perfusion à long terme de LIORESAL 25 mg INTRATHECAL dans des études cliniques pré- et post-commercialisation aux États-Unis ont arrêté le traitement en raison d'événements indésirables. Celles-ci comprennent : les infections de la poche de la pompe (3), la méningite (2), la déhiscence de la plaie (1), les fibromes gynécologiques (1) et la surpression de la pompe (1) avec des séquelles inconnues, le cas échéant. Onze patients ayant développé un coma secondaire à un surdosage ont vu leur traitement temporairement suspendu, mais tous ont été repris par la suite et n'ont donc pas été considérés comme de véritables arrêts.
Décès
Voir AVERTISSEMENTS .
Incidence dans les essais contrôlés
L'expérience avec LIORESAL INTRATHECAL (baclofène injectable) obtenue dans des études randomisées contrôlées contre placebo en parallèle ne fournit qu'une base limitée pour estimer l'incidence des événements indésirables car les études ont été de très courte durée (jusqu'à trois jours de perfusion) et n'ont impliqué qu'un total de 63 patients. Les événements suivants sont survenus chez les 31 patients recevant LIORESAL INTRATHECAL (baclofène injectable) dans deux essais randomisés contrôlés par placebo : hypotension (2), étourdissements (2), céphalées (2), dyspnée (1). Aucun événement indésirable n'a été rapporté parmi les 32 patients recevant le placebo dans ces études.
Événements observés lors de l'évaluation pré et post-commercialisation de LIORESAL INTRATHECAL
Les événements indésirables associés à l'utilisation de LIORESAL 25mg INTRATHECAL reflètent l'expérience acquise auprès de 576 patients suivis prospectivement aux Etats-Unis. Ils ont reçu LIORESAL INTRATHECAL pendant des périodes allant d'un jour (dépistage) (N = 576) à plus de huit ans (entretien) (N = 10). La dose de bolus de dépistage habituelle administrée avant l'implantation de la pompe dans ces études était généralement de 50 mcg. La dose d'entretien variait de 12 mcg à 2003 mcg par jour. En raison de la nature ouverte et non contrôlée de l'expérience, un lien de causalité entre les événements observés et l'administration de LIORESAL INTRATHECAL ne peut pas être évalué de manière fiable dans de nombreux cas et de nombreux événements indésirables signalés sont connus pour se produire en association avec les affections sous-jacentes traitées. Néanmoins, bon nombre des réactions les plus fréquemment signalées - hypotonie, somnolence, étourdissements, paresthésie, nausées/vomissements et céphalées - semblent clairement liées au médicament.
Les effets indésirables signalés au cours de toutes les études américaines (tant contrôlées que non contrôlées) sont présentés dans le tableau suivant. Huit des 474 patients qui ont reçu une perfusion chronique via des pompes implantées ont eu des effets indésirables qui ont conduit à l'arrêt du traitement à long terme dans les études pré- et post-commercialisation.
INCIDENCE DES ÉVÉNEMENTS INDÉSIRABLES LES PLUS FRÉQUENTS (≥ 1 %) CHEZ LES PATIENTS AVEC SPASTICITÉ D'ORIGINE VERTÉBRALE DANS DES ESSAIS CLINIQUES SUIVI PROSPECTIVEMENT
En plus des événements indésirables les plus fréquents (1 % ou plus) signalés chez les 576 patients nationaux suivis de manière prospective dans les études pré- et post-commercialisation, l'expérience de 194 patients supplémentaires exposés à LIORESAL 25 mg INTRATHECAL (baclofène injectable) dans le cadre d'études étrangères a été signalé. Les événements indésirables suivants, non décrits dans le tableau, classés par ordre décroissant de fréquence et classés par système corporel, ont été rapportés :
Système nerveux: Démarche anormale, pensées anormales, tremblements, amnésie, contractions musculaires, vasodilitation, accident vasculaire cérébral, nystagmus, trouble de la personnalité, dépression psychotique, ischémie cérébrale, labilité émotionnelle, euphorie, hypertonie, iléus, toxicomanie, incoordination, réaction paranoïaque et ptose.
Système digestif: Flatulence, dysphagie, dyspepsie et gastro-entérite.
Cardiovasculaire: Hypotension orthostatique, bradycardie, palpitations, syncope, arythmie ventriculaire, thrombophlébite profonde, pâleur et tachycardie.
Respiratoire: Trouble respiratoire, pneumonie par aspiration, hyperventilation, embolie pulmonaire et rhinite.
Urogénital: Hématurie et insuffisance rénale.
Peau et appendices : Alopécie et transpiration.
Troubles métaboliques et nutritionnels : Perte de poids, albuminurie, déshydratation et hyperglycémie.
Sens spéciaux : Vision anormale, anomalie de l'accommodation, photophobie, perte du goût et acouphènes.
Corps dans son ensemble : Suicide, absence d'effet médicamenteux, douleurs abdominales, hypothermie, rigidité de la nuque, douleurs thoraciques, frissons, œdème facial, syndrome grippal et surdosage.
Système sanguin et lymphatique : Anémie.
Spasticité d'origine cérébrale - Etudes cliniques
Couramment observé
Dans les essais cliniques de pré-commercialisation, les événements indésirables les plus fréquemment observés associés à l'utilisation de LIORESAL 25 mg INTRATHECAL (baclofène injectable) qui n'ont pas été observés à une incidence équivalente chez les patients traités par placebo comprenaient : agitation, constipation, somnolence, hyperleucocytose, frissons, troubles urinaires. rétention et hypotonie.
Associé à l'arrêt du traitement
Neuf des 211 patients recevant LIORESAL INTRATHECAL dans les études cliniques de pré-commercialisation aux États-Unis ont interrompu la perfusion à long terme en raison d'événements indésirables associés au traitement intrathécal.
Les neuf événements indésirables ayant conduit à l'arrêt étaient : infection (3), fuites de LCR (2), méningite (2), drainage (1) et contrôle ingérable du tronc (1).
Décès
Trois décès, dont aucun n'a été attribué à LIORESAL 10mg INTRATHECAL, ont été rapportés chez des patients dans des essais cliniques impliquant des patients atteints de spasticité d'origine cérébrale. Voir Mises en garde sur d'autres décès signalés chez des patients atteints de spasticité vertébrale .
Incidence dans les essais contrôlés
L'expérience avec LIORESAL INTRATHECAL (baclofène injectable) obtenue dans des études randomisées contrôlées contre placebo en parallèle ne fournit qu'une base limitée pour estimer l'incidence des événements indésirables, car les études ont porté sur un total de 62 patients exposés à un seul bolus intrathécal de 50 mcg. Les événements suivants sont survenus chez les 62 patients recevant LIORESAL 10 mg INTRATHECAL dans deux essais randomisés contrôlés par placebo portant respectivement sur des patients atteints de paralysie cérébrale et de traumatismes crâniens : agitation, constipation, somnolence, hyperleucocytose, nausées, vomissements, nystagmus, frissons, rétention urinaire et hypotonie.
Événements observés lors de l'évaluation pré-commercialisation de LIORESAL 25 mg INTRATHECAL
Les événements indésirables associés à l'utilisation de LIORESAL INTRATHECAL reflètent l'expérience acquise avec un total de 211 patients américains atteints de spasticité d'origine cérébrale, dont 112 étaient des patients pédiatriques (moins de 16 ans à l'inclusion). Ils ont reçu LIORESAL INTRATHECAL pendant des périodes allant d'un jour (dépistage) (N= 211) à 84 mois (entretien) (N= 1). La dose de bolus de dépistage habituelle administrée avant l'implantation de la pompe dans ces études était de 50 à 75 mcg. La dose d'entretien variait de 22 mcg à 1400 mcg par jour. Les doses utilisées dans cette population de patients pour une perfusion à long terme sont généralement inférieures à celles requises pour les patients atteints de spasticité d'origine médullaire.
En raison de la nature ouverte et incontrôlée de l'expérience, un lien de causalité entre les événements observés et l'administration de LIORESAL INTRATHECAL ne peut être évalué de manière fiable dans de nombreux cas. Néanmoins, bon nombre des réactions les plus fréquemment signalées - somnolence, étourdissements, céphalées, nausées, hypotension, hypotonie et coma - semblent clairement liées au médicament.
Les événements indésirables les plus fréquents (≥ 1 %) rapportés au cours de tous les essais cliniques sont présentés dans le tableau suivant. Neuf patients ont arrêté le traitement à long terme en raison d'événements indésirables.
INCIDENCE DES ÉVÉNEMENTS INDÉSIRABLES LES PLUS FRÉQUENTS (≥ 1 %) CHEZ LES PATIENTS ATTEINTS DE SPASTICITÉ D'ORIGINE CÉRÉBRALE DANS DES ESSAIS CLINIQUES SUIVI PROSPECTIVEMENT
Les événements indésirables les plus fréquents (1 % ou plus) signalés chez les 211 patients suivis de manière prospective et exposés à LIORESAL 25 mg INTRATHECAL (baclofène injectable) ont été rapportés. Dans la cohorte totale, les événements indésirables suivants, non décrits dans le tableau, classés par ordre décroissant de fréquence et classés par système corporel, ont été rapportés :
Système nerveux: Acathisie, ataxie, confusion, dépression, opisthotonos, amnésie, anxiété, hallucinations, hystérie, insomnie, nystagmus, trouble de la personnalité, diminution des réflexes et vasodilitation.
Système digestif: Dysphagie, incontinence fécale, hémorragie gastro-intestinale et trouble de la langue.
Cardiovasculaire: Bradycardie.
Respiratoire: Apnée, dyspnée et hyperventilation.
Urogénital: Éjaculation anormale, calculs rénaux, oligurie et vaginite.
Peau et appendices : Éruption cutanée, transpiration, alopécie, dermatite de contact et ulcère cutané.
Sens spéciaux : Anomalie du logement.
Corps dans son ensemble : Mort, fièvre, douleurs abdominales, carcinome, malaise et hypothermie.
Système sanguin et lymphatique : Leucocytose et éruption pétéchiale.
Expérience post-commercialisation
Les événements indésirables suivants ont été signalés au cours de l'utilisation post-approbation de LIORESAL INTRATHECAL. Étant donné que ces événements sont signalés volontairement par une population de taille incertaine, il n'est pas possible d'estimer de manière fiable leur fréquence.
Musculo-squelettique
L'apparition d'une scoliose ou l'aggravation d'une scoliose préexistante a été rapportée.
Urogénital
Des dysfonctionnements sexuels chez les hommes et les femmes, y compris une diminution de la libido et un dysfonctionnement de l'orgasme, ont été rapportés. La dysfonction érectile chez les hommes a également été rapportée. Des cas de priapisme ont été signalés après l'arrêt du baclofène.
INTERACTIONS MÉDICAMENTEUSES
L'expérience systématique de l'utilisation de LIORESAL INTRATHECAL en association avec d'autres médicaments est insuffisante pour prédire des interactions médicamenteuses spécifiques. Les interactions attribuées à l'utilisation combinée de LIORESAL INTRATHECAL et de la morphine péridurale comprennent l'hypotension et la dyspnée.
AVERTISSEMENTS
LIORESAL INTRATHECAL est destiné à être utilisé en injections intrathécales en bolus unique (via un cathéter placé dans l'espace intrathécal lombaire ou injection par ponction lombaire) et dans des pompes implantables approuvées par la FDA spécifiquement pour l'administration intrathécale de baclofène. En raison de la possibilité d'une dépression du système nerveux central potentiellement mortelle, d'un collapsus cardiovasculaire et/ou d'une insuffisance respiratoire, les médecins doivent être correctement formés et éduqués sur le traitement par perfusion intrathécale chronique.
Le système de pompe ne doit pas être implanté tant que la réponse du patient au bolus LIORESAL 10mg injection INTRATHECAL n'a pas été correctement évaluée. Évaluation (consistant en une procédure de dépistage : voir DOSAGE ET ADMINISTRATION nécessite que LIORESAL 25mg INTRATHECAL soit administré dans l'espace intrathécal via un cathéter ou une ponction lombaire. En raison des risques associés à la procédure de dépistage et à l'ajustement de la posologie après l'implantation de la pompe, ces phases doivent être réalisées dans un environnement médicalement supervisé et adéquatement équipé en suivant les instructions décrites dans la section Posologie et administration.
Un équipement de réanimation doit être disponible.
Après l'implantation chirurgicale de la pompe, en particulier pendant les phases initiales d'utilisation de la pompe, le patient doit être étroitement surveillé jusqu'à ce qu'il soit certain que la réponse du patient à la perfusion est acceptable et raisonnablement stable.
A chaque fois que le débit de dosage de la pompe et/ou la concentration de LIORESAL INTRATHECAL (baclofène injectable) dans le réservoir est ajusté, une surveillance médicale étroite est nécessaire jusqu'à ce qu'il soit certain que la réponse du patient à la perfusion est acceptable et raisonnablement stable.
Il est obligatoire que le patient, tous les soignants du patient et les médecins responsables du patient reçoivent une information adéquate concernant les risques de ce mode de traitement. Tout le personnel médical et les soignants doivent être informés 1) des signes et symptômes de surdosage, 2) des procédures à suivre en cas de surdosage et 3) des soins à domicile appropriés de la pompe et du site d'insertion.
Surdosage
Des signes de surdosage peuvent apparaître brutalement ou insidieusement. Un surdosage aigu et massif peut se présenter sous la forme d'un coma. Des formes de surdosage moins soudaines et/ou moins sévères peuvent se manifester par des signes de somnolence, des étourdissements, des étourdissements, de la somnolence, une dépression respiratoire, des convulsions, une progression rostrale de l'hypotonie et une perte de conscience évoluant vers le coma. Si un surdosage semble probable, le patient doit être transporté immédiatement à l'hôpital pour évaluation et vidange du réservoir de la pompe. Dans les cas signalés à ce jour, le surdosage a généralement été lié à un dysfonctionnement de la pompe, à une injection sous-cutanée accidentelle ou à une erreur de dosage. (Voir Symptômes et traitement de la surdose de drogue .)
Une extrême prudence doit être utilisée lors du remplissage d'une pompe implantable approuvée par la FDA. Ces pompes ne doivent être remplies qu'à travers le septum de remplissage du réservoir. Une injection accidentelle dans le tissu sous-cutané peut se produire si le septum de remplissage du réservoir n'est pas correctement accessible. Certaines pompes sont également équipées d'un orifice d'accès au cathéter qui permet un accès direct au cathéter intrathécal. L'injection directe dans ce port d'accès au cathéter ou l'injection par inadvertance dans le tissu sous-cutané peut provoquer un surdosage potentiellement mortel.
Retrait
L'arrêt brutal du baclofène intrathécal, quelle qu'en soit la cause, a entraîné des séquelles telles qu'une forte fièvre, une altération de l'état mental, une spasticité de rebond exagérée et une rigidité musculaire qui, dans de rares cas, ont évolué vers une rhabdomyolyse, une défaillance de plusieurs organes et la mort. Au cours des 9 premières années d'expérience post-commercialisation, 27 cas de sevrage temporellement liés à l'arrêt du traitement par le baclofène ont été rapportés ; six patients sont décédés. Dans la plupart des cas, les symptômes de sevrage sont apparus quelques heures à quelques jours après l'interruption du traitement par le baclofène. Les raisons courantes de l'interruption brutale du traitement par baclofène intrathécal comprenaient un dysfonctionnement du cathéter (en particulier la déconnexion), un faible volume dans le réservoir de la pompe et la fin de la durée de vie de la batterie de la pompe ; l'erreur humaine peut avoir joué un rôle causal ou contributif dans certains cas. Des cas de masse intrathécale à l'extrémité du cathéter implanté entraînant des symptômes de sevrage ont également été signalés, la plupart d'entre eux impliquant des mélanges analgésiques préparés en pharmacie (voir PRÉCAUTIONS ).
La prévention de l'arrêt brutal du baclofène intrathécal nécessite une attention particulière à la programmation et à la surveillance du système de perfusion, à la planification et aux procédures de remplissage et aux alarmes de la pompe. Les patients et les soignants doivent être informés de l'importance de respecter les visites de renouvellement programmées et doivent être informés des premiers symptômes du sevrage du baclofène.
Tous les patients recevant un traitement par baclofène intrathécal sont potentiellement à risque de sevrage. Les premiers symptômes du sevrage du baclofène peuvent inclure le retour de la spasticité initiale, du prurit, de l'hypotension et des paresthésies. Un priapisme peut se développer ou réapparaître si le traitement par baclofène intrathécal est interrompu. Certaines caractéristiques cliniques du syndrome de sevrage avancé du baclofène intrathécal peuvent ressembler à une dysréflexie autonome, une infection (septicémie), une hyperthermie maligne, un syndrome neuroleptique-malin ou d'autres affections associées à un état hypermétabolique ou à une rhabdomyolyse généralisée.
Un diagnostic et un traitement rapides et précis dans une salle d'urgence ou un établissement de soins intensifs sont importants pour prévenir les effets potentiellement mortels sur le système nerveux central et les effets systémiques du sevrage intrathécal du baclofène. Le traitement suggéré pour le sevrage du baclofène intrathécal est la restauration du baclofène intrathécal à ou près de la même dose qu'avant l'interruption du traitement. Cependant, si la restauration de l'administration intrathécale est retardée, un traitement avec des médicaments agonistes GABA-ergiques tels que le baclofène oral ou entéral, ou des benzodiazépines orales, entérales ou intraveineuses peut prévenir des séquelles potentiellement mortelles. Le baclofène oral ou entéral seul ne doit pas être utilisé pour arrêter la progression du sevrage du baclofène intrathécal.
Des crises d'épilepsie ont été rapportées lors de surdosage et à l'arrêt de LIORESAL 25 mg INTRATHECAL ainsi que chez des patients maintenus aux doses thérapeutiques de LIORESAL INTRATHECAL.
Décès
Spasticité d'origine médullaire
Il y a eu 16 décès rapportés parmi les 576 patients américains traités par LIORESAL 10mg INTRATHECAL (baclofène injectable) dans les études pré- et post-commercialisation évaluées en décembre 1992. Comme ces patients ont été traités dans des conditions cliniques non contrôlées, il est impossible de déterminer avec certitude rôle, s'il en est, joué par LIORESAL INTRATHECAL dans leur mort.
En tant que groupe, les patients décédés étaient relativement jeunes (l'âge moyen était de 47 ans avec une fourchette de 25 à 63 ans), mais la majorité souffrait de spasticité sévère d'une durée de plusieurs années, étaient non ambulatoires, avaient diverses complications médicales telles que la pneumonie, les voies urinaires infections et décubitus, et/ou avait reçu plusieurs médicaments concomitants. Un examen au cas par cas de l'évolution clinique des 16 patients décédés n'a révélé aucun signe, symptôme ou résultat de laboratoire unique suggérant que le traitement par LIORESAL INTRATHECAL a causé leur décès. Deux patients, cependant, ont subi une mort subite et inattendue dans les 2 semaines suivant l'implantation de la pompe et un patient est décédé de manière inattendue après le dépistage.
Un patient, un homme de 44 ans atteint de SEP, est décédé à l'hôpital le deuxième jour suivant l'implantation de la pompe. Une autopsie a démontré une fibrose sévère du système de conduction coronaire. Une deuxième patiente, une femme de 52 ans atteinte de SEP et ayant des antécédents d'infarctus du myocarde de la paroi inférieure, a été retrouvée morte au lit 12 jours après l'implantation de la pompe, 2 heures après avoir documenté des signes vitaux normaux. Une autopsie a révélé une congestion pulmonaire et des épanchements pleuraux bilatéraux. Il est impossible de déterminer si LIORESAL INTRATHECAL a contribué à ces décès. Le troisième patient a subi trois essais de dépistage du baclofène. Ses antécédents médicaux comprenaient une lésion médullaire, une pneumonie par aspiration, un choc septique, une coagulopathie intravasculaire disséminée, une acidose métabolique grave, une toxicité hépatique et un état de mal épileptique. Douze jours après le dépistage (il n'a pas été implanté), il a de nouveau connu un état de mal épileptique suivi d'une détérioration neurologique significative. Sur la base d'instructions préalables, des mesures de réanimation extraordinaires n'ont pas été prises et le patient est décédé.
Spasticité d'origine cérébrale
Trois décès sont survenus parmi les 211 patients traités par LIORESAL INTRATHECAL dans les études de précommercialisation en mars 1996. Ces décès n'ont pas été attribués au traitement.
Surperfusion
L'administration d'un volume de médicament supérieur au débit programmé (surperfusion) peut entraîner un surdosage inattendu ou un retrait provoqué par une vidange prématurée du réservoir de la pompe. Reportez-vous au manuel de la pompe du fabricant et aux instructions pour remplir le réservoir.
PRÉCAUTIONS
Les enfants doivent avoir une masse corporelle suffisante pour accueillir la pompe implantable pour une perfusion chronique. Veuillez consulter le manuel du fabricant de la pompe pour des recommandations spécifiques.
La sécurité et l'efficacité chez les patients pédiatriques de moins de 4 ans n'ont pas été établies.
Dépistage
Les patients doivent être exempts d'infection avant l'essai de dépistage avec LIORESAL INTRATHECAL (baclofène injectable) car la présence d'une infection systémique peut interférer avec l'évaluation de la réponse du patient au bolus de LIORESAL 10 mg INTRATHECAL.
Implantation de la pompe
Les patients doivent être exempts d'infection avant l'implantation de la pompe car la présence d'une infection peut augmenter le risque de complications chirurgicales. De plus, une infection systémique peut compliquer le dosage.
Ajustement de la dose de la pompe et titrage
Chez la plupart des patients, il sera nécessaire d'augmenter progressivement la dose au fil du temps pour maintenir l'efficacité ; une exigence soudaine d'augmentation substantielle de la dose indique généralement une complication du cathéter (c'est-à-dire, un pli ou un délogement du cathéter).
Le remplissage du réservoir doit être effectué par du personnel parfaitement formé et qualifié, conformément aux instructions fournies par le fabricant de la pompe. Une injection accidentelle dans le tissu sous-cutané peut se produire si le septum de remplissage du réservoir n'est pas correctement accessible. L'injection sous-cutanée peut entraîner des symptômes de surdosage systémique ou une déplétion précoce du réservoir. Les intervalles de remplissage doivent être soigneusement calculés pour éviter l'épuisement du réservoir, car cela entraînerait le retour d'une spasticité sévère et éventuellement des symptômes de sevrage.
Une technique aseptique stricte lors du remplissage est nécessaire pour éviter une contamination bactérienne et une infection grave. Une période d'observation adaptée à la situation clinique doit suivre chaque remplissage ou manipulation du réservoir de médicament.
Une extrême prudence doit être utilisée lors du remplissage d'une pompe implantable approuvée par la FDA équipée d'un orifice d'injection qui permet un accès direct au cathéter intrathécal. L'injection directe dans le cathéter par le port d'accès au cathéter peut provoquer un surdosage potentiellement mortel.
Considérations supplémentaires relatives à l'ajustement posologique
Il peut être important de titrer la dose pour maintenir un certain degré de tonus musculaire et permettre des spasmes occasionnels pour : 1) aider à soutenir la fonction circulatoire, 2) éventuellement prévenir la formation d'une thrombose veineuse profonde, 3) optimiser les activités de la vie quotidienne et la facilité des soins .
Sauf en cas d'urgence liée à un surdosage, la dose de LIORESAL 25 mg INTRATHECAL doit normalement être réduite lentement si le médicament est arrêté pour une raison quelconque.
Une tentative doit être faite pour interrompre les médicaments antispasmodiques oraux concomitants afin d'éviter un éventuel surdosage ou des interactions médicamenteuses indésirables, soit avant le dépistage, soit après l'implantation et le début de la perfusion chronique de LIORESAL INTRATHECAL. La réduction et l'arrêt des antispasmotiques oraux doivent se faire lentement et sous la surveillance attentive du médecin. La réduction brutale ou l'arrêt des antispastiques concomitants doit être évité.
Somnolence
Une somnolence a été rapportée chez des patients sous LIORESAL INTRATHECAL. Les patients doivent être avertis de la conduite d'automobiles ou d'autres machines dangereuses, ainsi que des activités rendues dangereuses par une diminution de la vigilance. Les patients doivent également être avertis que les effets dépresseurs du système nerveux central de LIORESAL INTRATHECAL (baclofène injectable) peuvent s'ajouter à ceux de l'alcool et d'autres dépresseurs du SNC.
Masse intrathécale
Des cas de masse intrathécale à l'extrémité du cathéter implanté ont été signalés, la plupart d'entre eux impliquant des mélanges analgésiques préparés en pharmacie. Les symptômes les plus fréquents associés à la masse intrathécale sont : 1) diminution de la réponse thérapeutique (aggravation de la spasticité, retour de la spasticité alors qu'elle était auparavant bien contrôlée, symptômes de sevrage, mauvaise réponse à des doses croissantes ou augmentations fréquentes ou importantes de la posologie), 2) douleur, 3) déficit/dysfonctionnement neurologique. Les cliniciens doivent surveiller attentivement les patients sous thérapie intrarachidienne pour tout nouveau signe ou symptôme neurologique. Chez les patients présentant de nouveaux signes ou symptômes neurologiques évoquant une masse intrathécale, envisagez une consultation neurochirurgicale, car de nombreux symptômes de masse inflammatoire ne sont pas différents des symptômes ressentis par les patients souffrant de spasticité sévère due à leur maladie. Dans certains cas, la réalisation d'une procédure d'imagerie peut être appropriée pour confirmer ou infirmer le diagnostic d'une masse intrathécale.
Précautions dans les populations particulières de patients
Une titration prudente de la dose de LIORESAL 10 mg INTRATHECAL est nécessaire lorsque la spasticité est nécessaire pour maintenir la posture droite et l'équilibre dans la locomotion ou chaque fois que la spasticité est utilisée pour obtenir une fonction et des soins optimaux.
Les patients souffrant de troubles psychotiques, de schizophrénie ou d'états confusionnels doivent être traités avec prudence par LIORESAL INTRATHECAL et maintenus sous étroite surveillance, car des exacerbations de ces troubles ont été observées lors d'une administration orale.
LIORESAL INTRATHECAL doit être utilisé avec prudence chez les patients ayant des antécédents de dysréflexie autonome. La présence de stimuli nociceptifs ou l'arrêt brutal de LIORESAL 10mg INTRATHECAL (baclofène injectable) peut provoquer un épisode dysréflexique autonome.
Étant donné que LIORESAL est principalement excrété sous forme inchangée par les reins, il doit être administré avec prudence chez les patients présentant une insuffisance rénale et il peut être nécessaire de réduire la posologie.
Tests de laboratoire
Aucun test de laboratoire spécifique n'est jugé indispensable pour la prise en charge des patients sous LIORESAL INTRATHECAL.
Carcinogenèse, mutagenèse et altération de la fertilité
Aucune augmentation des tumeurs n'a été observée chez les rats recevant du baclofène par voie orale pendant deux ans. Des tests de génotoxicité adéquats du baclofène n'ont pas été effectués.
Grossesse
Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Dans les études animales, le baclofène a eu des effets indésirables sur le développement embryofœtal lorsqu'il a été administré par voie orale à des rates gravides. LIORESAL 25mg INTRATHECAL ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Le baclofène administré par voie orale a augmenté l'incidence des anomalies structurelles fœtales (omphalocèles) chez les rats. Des réductions de l'apport alimentaire et du gain de poids corporel ont été observées chez les mères. Des anomalies structurelles fœtales n'ont pas été observées chez les souris ou les lapins
Mères allaitantes
Chez les mères traitées par LIORESAL oral (baclofène USP) à doses thérapeutiques, la substance active passe dans le lait. On ne sait pas si des niveaux détectables de médicament sont présents dans le lait des mères allaitantes recevant LIORESAL 25 mg INTRATHECAL. En règle générale, l'allaitement ne doit être entrepris pendant qu'un patient reçoit LIORESAL 25mg INTRATHECAL que si le bénéfice potentiel justifie les risques potentiels pour le nourrisson.
Utilisation pédiatrique
Les enfants doivent avoir une masse corporelle suffisante pour accueillir la pompe implantable pour une perfusion chronique. Veuillez consulter le manuel du fabricant de la pompe pour des recommandations spécifiques.
La sécurité et l'efficacité chez les patients pédiatriques de moins de 4 ans n'ont pas été établies.
Considérations basées sur l'expérience avec LIORESAL oral (baclofène USP)
Une augmentation liée à la dose de l'incidence des kystes ovariens a été observée chez les rats femelles traités de manière chronique par LIORESAL par voie orale. Des kystes ovariens ont été découverts à la palpation chez environ 4 % des patientes atteintes de sclérose en plaques qui ont été traitées par LIORESAL 25 mg par voie orale pendant un an maximum. Dans la plupart des cas, ces kystes ont disparu spontanément alors que les patients continuaient à recevoir le médicament. On estime que les kystes ovariens surviennent spontanément chez environ 1 % à 5 % de la population féminine normale.
SURDOSAGE
Une attention particulière doit être accordée à la reconnaissance des signes et symptômes de surdosage, en particulier lors de la phase initiale de dépistage et de titration de dose du traitement, mais également lors de la réintroduction de LIORESAL INTRATHECAL après une période d'interruption du traitement.
Symptômes d'un surdosage de LIORESAL INTRATHECAL
Somnolence, étourdissements, étourdissements, somnolence, dépression respiratoire, hypothermie, convulsions, progression rostrale de l'hypotonie et perte de conscience évoluant jusqu'au coma jusqu'à 72 heures. durée. Dans la plupart des cas rapportés, le coma était réversible sans séquelles après l'arrêt du médicament. Des symptômes de surdosage de LIORESAL 25mg INTRATHECAL ont été rapportés chez un patient adulte sensible après avoir reçu un bolus intrathécal de 25 mcg.
Suggestions de traitement pour le surdosage
Il n'existe pas d'antidote spécifique pour traiter les surdosages de LIORESAL INTRATHECAL (baclofène injectable) ; cependant, les étapes suivantes doivent normalement être entreprises :
Si la ponction lombaire n'est pas contre-indiquée, il faut envisager de prélever 30 à 40 ml de LCR pour réduire la concentration de baclofène dans le LCR.
CONTRE-INDICATIONS
Hypersensibilité au baclofène. LIORESAL INTRATHECAL n'est pas recommandé pour une administration intraveineuse, intramusculaire, sous-cutanée ou péridurale.
PHARMACOLOGIE CLINIQUE
Le mécanisme d'action précis du baclofène en tant que relaxant musculaire et agent antispasmodique n'est pas entièrement compris. Le baclofène inhibe à la fois les réflexes monosynaptiques et polysynaptiques au niveau de la colonne vertébrale, éventuellement en diminuant la libération de neurotransmetteurs excitateurs par les terminaux afférents primaires, bien que des actions au niveau des sites supraspinaux puissent également se produire et contribuer à son effet clinique. Le baclofène est un analogue structurel du neurotransmetteur inhibiteur acide gamma-aminobutyrique (GABA) et peut exercer ses effets par stimulation du sous-type de récepteur GABAB.
LIORESAL INTRATHECAL, lorsqu'il est introduit directement dans l'espace intrathécal, permet d'obtenir des concentrations efficaces dans le LCR avec des concentrations plasmatiques résultantes 100 fois inférieures à celles obtenues avec une administration orale.
Chez les humains, ainsi que chez les animaux, il a été démontré que le baclofène a des propriétés dépressives générales sur le SNC, comme l'indique la production de sédation avec tolérance, somnolence, ataxie et dépression respiratoire et cardiovasculaire.
Pharmacodynamie de LIORESAL INTRATHECAL
Bolus intrathécal
Patients adultes
Le début d'action est généralement d'une demi-heure à une heure après un bolus intrathécal. L'effet spasmolytique maximal est observé environ quatre heures après l'administration et les effets peuvent durer de quatre à huit heures. L'apparition, la réponse maximale et la durée d'action peuvent varier d'un patient à l'autre en fonction de la dose et de la gravité des symptômes.
Patients pédiatriques
Le début, la réponse maximale et la durée d'action sont similaires à ceux observés chez les patients adultes.
Perfusion continue
L'action antispasmodique de LIORESAL 25mg INTRATHECAL se manifeste pour la première fois 6 à 8 heures après le début de la perfusion continue. L'activité maximale est observée en 24 à 48 heures.
Perfusion continue
Aucune information supplémentaire n'est disponible pour les patients pédiatriques.
Pharmacocinétique de LIORESAL 25mg INTRATHECAL
La pharmacocinétique de la clairance dans le LCR de LIORESAL 25 mg INTRATHECAL, calculée à partir d'études en bolus intrathécal ou en perfusion continue, se rapproche du renouvellement du LCR, ce qui suggère que l'élimination se fait par l'élimination du LCR en vrac.
Bolus intrathécal
Après une injection bolus lombaire de 50 ou 100 µg de LIORESAL 10 mg INTRATHECAL chez sept patients, la demi-vie d'élimination moyenne dans le LCR était de 1,51 heure sur les quatre premières heures et la clairance moyenne du LCR était d'environ 30 mL/heure.
Perfusion continue
La clairance moyenne dans le LCR de LIORESAL 10 mg INTRATHECAL (baclofène injectable) était d'environ 30 ml/heure dans une étude portant sur dix patients sous perfusion intrathécale continue. Les concentrations plasmatiques concomitantes de baclofène pendant l'administration intrathécale devraient être faibles (0-5 ng/mL).
Des données pharmacocinétiques limitées suggèrent qu'un gradient de concentration lombaire-cisternale d'environ 4:1 s'établit le long de l'axe neurologique pendant la perfusion de baclofène. Ceci est basé sur un prélèvement simultané de LCR par ponction cisternale et lombaire chez 5 patients recevant une perfusion continue de baclofène au niveau lombaire à des doses associées à une efficacité thérapeutique ; la variabilité inter-patients était grande. Le gradient n'a pas été modifié par la position.
Six patients pédiatriques (âgés de 8 à 18 ans) recevant une perfusion intrathécale continue de baclofène à des doses de 77 à 400 mcg/jour présentaient des taux plasmatiques de baclofène proches ou inférieurs à 10 ng/mL.
INFORMATIONS PATIENTS
PrLIORESAL Intrathécal (baclofène) Injection 0,05 mg/mL, 0,5 mg/mL et 2 mg/mL
Pour injection intrathécale et perfusion uniquement
Ce dépliant est la partie III d'une « monographie de produit » en trois parties publiée lorsque LIORESAL IT a été approuvé pour la vente au Canada et est conçu spécifiquement pour les consommateurs. Cette notice est un résumé et ne vous dira pas tout sur LIORESAL 10mg IT. Contactez votre médecin ou votre pharmacien si vous avez des questions sur le médicament.
À PROPOS DE CE MÉDICAMENT
À quoi sert le médicament :
LIORESAL 25 mg intrathécal appartient à un groupe de médicaments appelés myorelaxants. Il est utilisé pour réduire et soulager les raideurs excessives et/ou les spasmes survenant dans diverses maladies telles que, par exemple, la sclérose en plaques, les maladies ou lésions de la moelle épinière et certains troubles cérébraux.
Ce qu'il fait:
La solution est injectée ou perfusée dans l'espace liquide autour de la moelle épinière à l'aide d'une pompe spéciale qui est implantée sous la peau de votre abdomen. De la pompe, une quantité constante de la solution est délivrée dans l'espace liquide autour de la moelle épinière à travers un petit tube.
En raison de son effet bénéfique sur les contractions musculaires et du soulagement de la douleur qui en résulte, LIORESAL intrathécal améliore votre mobilité et votre capacité à gérer vos activités quotidiennes sans aide. LIORESAL 25mg vous aide également à mieux profiter de la kinésithérapie.
Quand ne pas l'utiliser :
Vous ne devez pas être traité par LIORESALIT si vous :
- êtes allergique (hypersensibilité) à LIORESAL 25mg Intrathecal ou à l'un des autres composants contenus dans LIORESAL 10mg Intrathecal listés ci-dessous.
Quel est l'ingrédient médicinal :
baclofène.
Quels sont les ingrédients non médicinaux :
LIORESAL 25mg IT contient : du chlorure de sodium et de l'eau pour injection
Sous quelles formes posologiques il se présente :
LIORESAL 25 mg intrathécal (baclofène injectable) 0,05 mg/mL : Chaque ampoule de 1 mL contient 0,05 mg de baclofène pour administration intrathécale.
LIORESAL Intrathecal (baclofène injectable) 0,5 mg/mL : Chaque ampoule de 20 mL contient 10 mg de baclofène pour administration intrathécale.
LIORESAL 25mg Intrathecal (baclofène injectable) 2 mg/mL : Chaque ampoule de 5 mL contient 10 mg de baclofène pour administration intrathécale.
AVERTISSEMENTS ET PRECAUTIONS
LIORESAL 10 mg intrathécal convient à de nombreux patients souffrant de spasmes musculaires, mais pas à tous.
Consultez votre médecin ou votre pharmacien AVANT d'utiliser LIORESAL 25mgIT si vous :
- avoir n'importe quel type d'infection
- avez la maladie de Parkinson ou certaines maladies mentales accompagnées de confusion
- souffrez d'épilepsie (convulsions)
- avoir le diabète
- a déjà eu des problèmes cardiaques
- a déjà eu des problèmes rénaux
- avoir des problèmes respiratoires
- avez des douleurs aiguës à l'estomac ou à l'intestin
- avez perturbé la circulation sanguine dans votre cerveau
- avez déjà connu des épisodes soudains d'hypertension artérielle, d'anxiété, de transpiration excessive, de « chair de poule », de maux de tête intenses et de battements cardiaques anormalement lents en raison d'une réaction excessive de votre système nerveux à des stimuli tels que la distension de la vessie et de l'intestin, une irritation et des douleurs cutanées
Si l'un de ces cas s'applique à vous, il se peut que votre médecin ne veuille pas vous donner ce médicament ou veuille prendre des précautions particulières. Si vous n'avez rien dit à votre médecin, informez-le avant de commencer le traitement par LIORESAL 25 mg intrathécal.
Si vous pensez être allergique, demandez conseil à votre médecin.
Conduite et utilisation de machines : LIORESAL intrathécal peut provoquer une somnolence ou des étourdissements. Soyez prudent lorsque vous conduisez une voiture ou utilisez une machine ou faites des choses qui nécessitent une attention particulière jusqu'à ce que vous vous sentiez à nouveau normal.
INTERACTIONS AVEC CE MÉDICAMENT
Informez votre médecin ou votre pharmacien si vous prenez ou avez récemment pris tout autre médicament, y compris des médicaments à base de plantes et sans ordonnance (en vente libre). Certains autres médicaments peuvent interagir avec LIORESAL 10mgIT. Votre médecin peut modifier la posologie ou parfois arrêter l'un des médicaments. Ceci est particulièrement important pour les médicaments suivants :
- d'autres médicaments pour votre état spasmodique
- médicaments pour la maladie de Parkinson
- médicaments contre l'épilepsie
- les médicaments utilisés pour traiter les troubles de l'humeur tels que les antidépresseurs et le lithium
- médicaments contre l'hypertension
- autres médicaments qui affectent les reins, par exemple l'ibuprofène
- opiacés pour soulager la douleur
- les médicaments utilisés pour vous aider à dormir ou à vous calmer
- les médicaments qui ralentissent le système nerveux central, par exemple les antihistaminiques et les sédatifs (certains d'entre eux peuvent être achetés sans ordonnance)
Informez toujours votre médecin ou infirmier/ère de tous les médicaments que vous prenez. Il s'agit des médicaments que vous avez achetés vous-même ainsi que des médicaments prescrits par votre médecin.
Soyez prudent si vous buvez des boissons alcoolisées pendant le traitement par LIORESAL 25 mg intrathécal car vous pourriez vous sentir plus somnolent ou étourdi que d'habitude.
UTILISATION APPROPRIÉE DE CE MÉDICAMENT
Dose habituelle
LIORESAL Intrathecal ne peut être administré que par des médecins expérimentés utilisant un équipement médical spécial. Vous devrez rester à l'hôpital, au moins au début du traitement.
Votre médecin injectera une petite quantité de LIORESAL intrathécal dans votre moelle épinière pour voir si cela améliore vos spasmes musculaires. Si c'est le cas, une pompe spéciale sera implantée sous votre peau. La pompe vous donnera une petite quantité de médicament tout le temps.
Cela peut prendre plusieurs jours pour trouver la dose de médicament qui vous convient le mieux, votre médecin vous surveillera de près pendant cette période.
Après cela, votre médecin voudra toujours vous voir régulièrement pour vérifier vos progrès et s'assurer que votre pompe fonctionne bien.
IL EST DE LA PLUS GRANDE IMPORTANCE QUE LES RENDEZ-VOUS POUR REMPLIR LA POMPE SOIENT TENUS, SINON LES SPASMES PEUVENT SE REPRODUIRE PARCE QUE VOUS N'OBTENEZ PAS UNE DOSE ASSEZ ÉLEVÉE DE LIORESAL INTRATHÉCAL. LA SPASTICITÉ MUSCULAIRE PEUT NE PAS S'AMÉLIORER OU PEUT S'AGGRAVER EN CONSÉQUENCE.
Si la spasticité musculaire ne s'améliore pas ou si vous recommencez à avoir des spasmes, progressivement ou soudainement, contactez immédiatement votre médecin.
Veuillez consulter la documentation du fabricant de la pompe pour obtenir des informations sur l'entretien à domicile de la pompe et du site d'insertion.
Surveillance pendant le traitement par LIORESAL 10mg Intrathécal
Vous serez surveillé de près dans un environnement entièrement équipé et doté de personnel pendant la phase de dépistage et la période de titration de la dose immédiatement après l'implantation de la pompe. Vous serez régulièrement évalué pour vos besoins en matière de dosage, pour les effets secondaires possibles ou les signes d'infection. Le fonctionnement du système de livraison sera également vérifié.
La grossesse et l'allaitement
Vous devez informer votre médecin si vous êtes enceinte ou envisagez de le devenir, car LIORESAL 25 mg intrathécal ne doit pas être utilisé pendant la grossesse ou si vous allaitez. Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Votre médecin discutera avec vous du risque potentiel lié à la prise de LIORESAL 25 mg intrathécal pendant la grossesse.
Le médecin décidera si vous pouvez recevoir LIORESAL 10 mg intrathécal dans ces situations particulières. Seules de très petites quantités de LIORESAL 10mg passent dans le lait maternel. Demandez à votre médecin si vous souhaitez allaiter.
Surdosage
En cas de surdosage, communiquez immédiatement avec un professionnel de la santé, le service d'urgence d'un hôpital ou le centre antipoison régional, même s'il n'y a aucun symptôme.
Des signes de surdosage peuvent apparaître brutalement ou insidieusement par exemple par un dysfonctionnement de la pompe. Il est très important que vous et vos proches reconnaissiez les signes de surdosage. Si vous présentez l'un ou l'autre des symptômes suivants ou une combinaison des symptômes suivants, informez-en votre médecin sans tarder car la quantité de médicament que vous recevez peut être trop élevée :
- faiblesse musculaire inhabituelle (trop peu de tonus musculaire)
- envie de dormir
- étourdissements ou étourdissements
- salivation excessive
- nausées ou vomissements
- difficultés respiratoires, convulsions ou perte de conscience
- température corporelle anormalement basse
Dose oubliée
L'arrêt brutal de LIORESAL 10 mg intrathécal peut entraîner des problèmes médicaux graves et, dans de rares cas, être fatal.
Les signes indiquant que votre pompe ne fonctionne pas correctement ou qu'elle ne délivre pas la bonne quantité de médicament comprennent une augmentation ou un retour de la spasticité, des démangeaisons, une pression artérielle basse, des étourdissements, une sensation de picotement, une forte fièvre, une altération de l'état mental et une rigidité musculaire ou une nouvelle faiblesse musculaire ou paralysie. Il est important d'informer immédiatement votre médecin si vous ressentez l'un des symptômes ci-dessus.
EFFETS SECONDAIRES ET MESURES À PRENDRE
Comme avec tous les médicaments, les patients traités par LIORESAL 25 mg intrathécal peuvent présenter certains effets indésirables, bien que tout le monde n'y soit pas sujet. Ceux-ci surviennent plus souvent au début du traitement pendant votre séjour à l'hôpital, mais ils peuvent également survenir plus tard et doivent être vérifiés auprès de votre médecin.
Très commun: Somnolence, faiblesse musculaire
Commun: Sensation d'anxiété, de sédation et de lassitude (épuisement), faiblesse dans les jambes, raideur dans les muscles, étourdissements/étourdissements, maux de tête, somnolence, nausées et/ou vomissements, picotements dans les mains et les pieds, insomnie, troubles de l'élocution, pneumonie , faiblesse, frissons, fatigue, douleur, sécheresse de la bouche, éruption cutanée et/ou démangeaisons, gonflement des chevilles, des pieds ou du bas des jambes, visage gonflé, nervosité ou agitation inhabituelle, confusion/désorientation, constipation, diarrhée, perte d'appétit, excès salivation, fièvre/frissons, problèmes urinaires, difficultés sexuelles.
Rare: Changements d'humeur ou mentaux, paranoïa, sensation de bonheur extrême (euphorie), perte de coordination musculaire (ataxie), température corporelle anormalement basse, perte de mémoire, mouvements oculaires continus et incontrôlables, diminution du goût, difficulté à avaler, douleurs abdominales, perte de cheveux, transpiration excessive.
Rare: Agitation, rythme respiratoire anormalement lent.
Informez votre médecin si vous remarquez un autre effet. Certains effets secondaires pourraient être associés au système de livraison.
EFFETS SECONDAIRES GRAVES, FRÉQUENCE ET MESURES À PRENDRE
Ce n'est pas une liste complète des effets secondaires. Pour tout effet inattendu ressenti lors de la prise de LIORESAL IT, contactez votre médecin ou votre pharmacien.
COMMENT LE CONSERVER
Conserver les ampoules LIORESAL 10mg IT entre 15 et 30°C (protéger de la chaleur). Ne pas congeler. Ne pas stériliser à la chaleur.
Gardez tous les médicaments hors de la portée et de la vue des enfants.
Ce médicament est prescrit pour votre problème médical spécifique et pour votre propre usage uniquement. Ne pas donner à d'autres personnes.
N'utilisez pas de médicaments périmés. Jetez-les en toute sécurité hors de la portée des enfants ou apportez-les à votre pharmacien qui les éliminera pour vous.
SIGNALEMENT DES EFFETS SECONDAIRES SOUPÇONNÉS
Vous pouvez déclarer tout effet indésirable soupçonné associé à l'utilisation de produits de santé au Programme Canada Vigilance de l'une des 3 façons suivantes :
- Signalez en ligne à www.santecanada.gc.ca/medeffet
- Appelez sans frais au 1-866-234-2345
- Remplissez un formulaire de déclaration de Canada Vigilance et :
- Télécopiez sans frais au 1-866-678-6789, ou
- Envoyer à : Programme Canada Vigilance, Santé Canada, indice postal 0701E, Ottawa, Ontario, K1A 0K9
Les étiquettes préaffranchies, le formulaire de déclaration de Canada Vigilance et les lignes directrices sur la déclaration des effets indésirables sont disponibles sur le site Web de MedEffetMC Canada à www.santecanada.gc.ca/medeffet.
REMARQUE: Si vous avez besoin d'informations relatives à la gestion des effets secondaires, contactez votre professionnel de la santé. Le Programme Canada Vigilance ne fournit pas de conseils médicaux.
PLUS D'INFORMATION
Ce document ainsi que la monographie complète du produit, préparée pour les professionnels de la santé, peuvent être consultés à l'adresse : http://www.novartis.ca ou en communiquant avec le commanditaire, Novartis Pharmaceuticals Canada Inc, au : 1-800-363-8883
