Provera 5mg, 10mg Medroxyprogesterone Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Provera et comment est-il utilisé ?
Provera 10 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes des saignements menstruels abondants, des saignements menstruels absents ou irréguliers et comme moyen de contraception. Provera 10 mg peut être utilisé seul ou avec d'autres médicaments.
Provera 5 mg appartient à une classe de médicaments appelés Antinéoplasiques, Hormones, Progestatifs.
On ne sait pas si Provera est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Provera 10mg ?
Provera 5 mg peut provoquer des effets secondaires graves, notamment :
- des saignements vaginaux (si vous êtes déjà ménopausée),
- étourdissement,
- masse mammaire,
- la dépression,
- troubles du sommeil (insomnie),
- vertiges,
- des changements d'humeur,
- mal de tête,
- fièvre,
- jaunissement de la peau ou des yeux (jaunisse),
- gonflement des mains, des chevilles ou des pieds,
- douleur ou pression thoracique,
- douleur se propageant à la mâchoire ou à l'épaule,
- nausée,
- transpiration,
- engourdissement ou faiblesse soudaine,
- maux de tête intenses et soudains,
- troubles de l'élocution,
- problèmes de vue,
- des problèmes d'équilibre,
- toux soudaine,
- respiration sifflante,
- Respiration rapide,
- cracher du sang, et
- douleur dans la jambe (ou les deux) avec gonflement, chaleur et rougeur
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Provera 10 mg incluent :
- spotting ou saignement intermenstruel,
- changements dans vos menstruations,
- démangeaisons ou pertes vaginales,
- sensibilité ou écoulement des seins,
- mal de tête,
- vertiges,
- se sentir nerveux ou déprimé,
- ecchymose ou gonflement de vos veines,
- ballonnements,
- rétention d'eau,
- des changements d'humeur,
- troubles du sommeil (insomnie),
- démangeaison,
- éruption,
- acné,
- la pousse des cheveux,
- perte de cheveux du cuir chevelu,
- maux d'estomac,
- ballonnements,
- nausée,
- gain de poids, et
- changements de vision ou difficulté à porter des lentilles de contact
ATTENTION
TROUBLES CARDIO-VASCULAIRES, CANCER DU SEIN ET PROBABLE DÉMENCE POUR LA THÉRAPIE ŒSTROGÈNE PLUS PROGESTINE
Troubles cardiovasculaires et démence probable
Le traitement par œstrogène plus progestatif ne doit pas être utilisé pour la prévention des maladies cardiovasculaires ou de la démence. (Voir Etudes cliniques et AVERTISSEMENTS , Troubles cardiovasculaires et démence probable .)
La sous-étude sur les œstrogènes et les progestatifs de la Women's Health Initiative (WHI) a signalé un risque accru de thrombose veineuse profonde (TVP), d'embolie pulmonaire (EP), d'accident vasculaire cérébral et d'infarctus du myocarde (IM) chez les femmes ménopausées (âgées de 50 à 79 ans). ) pendant 5,6 ans de traitement avec des œstrogènes conjugués (CE) quotidiens par voie orale [0,625 mg] associés à l'acétate de médroxyprogestérone (MPA) [2,5 mg], par rapport au placebo. (Voir Etudes cliniques et AVERTISSEMENTS , Troubles cardiovasculaires .)
L'étude auxiliaire WHI Memory Study (WHIMS) sur les œstrogènes et le progestatif a rapporté un risque accru de développer une démence probable chez les femmes ménopausées âgées de 65 ans ou plus pendant 4 ans de traitement par EC quotidien (0,625 mg) associé à MPA (2,5 mg), relatif au placebo. On ne sait pas si cette constatation s'applique aux femmes ménopausées plus jeunes. (Voir Etudes cliniques et AVERTISSEMENTS , Démence probable et PRÉCAUTIONS , Utilisation gériatrique .)
Cancer du sein
La sous-étude WHI sur les œstrogènes et les progestatifs a démontré un risque accru de cancer du sein invasif. (Voir Etudes cliniques et AVERTISSEMENTS , Tumeur maligne , Cancer du sein .)
En l'absence de données comparables, ces risques doivent être supposés similaires pour d'autres doses d'EC et de MPA, et d'autres combinaisons et formes posologiques d'œstrogènes et de progestatifs.
Les progestatifs avec des œstrogènes doivent être prescrits aux doses efficaces les plus faibles et pour la durée la plus courte compatible avec les objectifs de traitement et les risques pour la femme individuelle.
LA DESCRIPTION
Les comprimés PROVERA® contiennent de l'acétate de médroxyprogestérone, qui est un dérivé de la progestérone. C'est une poudre cristalline blanche à blanchâtre, inodore, stable à l'air, fondant entre 200 et 210°C. Il est librement soluble dans le chloroforme, soluble dans l'acétone et dans le dioxane, peu soluble dans l'alcool et dans le méthanol, légèrement soluble dans l'éther et insoluble dans l'eau.
Le nom chimique de l'acétate de médroxyprogestérone est prégn-4-ène-3, 20-dione, 17-(acétyloxy)-6- méthyl-, (6α)-. La formule structurale est :
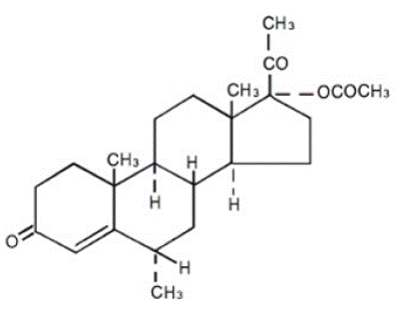
Chaque comprimé PROVERA 5 mg pour administration orale contient 2,5 mg, 5 mg ou 10 mg d'acétate de médroxyprogestérone et les ingrédients inactifs suivants : stéarate de calcium, amidon de maïs, lactose, huile minérale, acide sorbique, saccharose et talc. Le comprimé de 2,5 mg contient FD&C jaune n° 6.
LES INDICATIONS
Les comprimés de PROVERA 5 mg sont indiqués dans le traitement de l'aménorrhée secondaire et des saignements utérins anormaux dus à un déséquilibre hormonal en l'absence de pathologie organique, comme les fibromes ou le cancer de l'utérus. Ils sont également indiqués pour une utilisation dans la prévention de l'hyperplasie de l'endomètre chez les femmes ménopausées non hystérectomisées qui reçoivent quotidiennement des comprimés oraux d'œstrogènes conjugués à 0,625 mg.
DOSAGE ET ADMINISTRATION
Aménorrhée secondaire
Les comprimés de PROVERA 10 mg peuvent être administrés à des doses de 5 ou 10 mg par jour pendant 5 à 10 jours. Une dose pour induire une transformation sécrétoire optimale d'un endomètre qui a été suffisamment amorcé avec des œstrogènes endogènes ou exogènes est de 10 mg de PROVERA 10 mg par jour pendant 10 jours. En cas d'aménorrhée secondaire, le traitement peut être débuté à tout moment. Les saignements de privation de progestatif surviennent généralement dans les trois à sept jours suivant l'arrêt du traitement par PROVERA 10 mg.
Saignements utérins anormaux dus à un déséquilibre hormonal en l'absence de pathologie organique
À partir du 16e ou 21e jour calculé du cycle menstruel, 5 ou 10 mg de PROVERA 10 mg peuvent être administrés quotidiennement pendant 5 à 10 jours. Pour produire une transformation sécrétoire optimale d'un endomètre qui a été correctement amorcé avec des œstrogènes endogènes ou exogènes, 10 mg de PROVERA 10 mg par jour pendant 10 jours à partir du 16e jour du cycle sont suggérés. Les hémorragies de privation de progestatif surviennent généralement dans les trois à sept jours suivant l'arrêt du traitement par PROVERA. Les patientes ayant des antécédents d'épisodes récurrents de saignements utérins anormaux peuvent bénéficier d'un cycle menstruel planifié avec PROVERA.
Réduction de l'hyperplasie endométriale chez les femmes ménopausées recevant quotidiennement 0,625 mg d'œstrogènes conjugués
Lorsqu'un œstrogène est prescrit à une femme ménopausée avec un utérus, un progestatif doit également être instauré pour réduire le risque de cancer de l'endomètre. Une femme sans utérus n'a pas besoin de progestatif. L'utilisation d'œstrogène, seul ou en association avec un progestatif, doit se faire avec la dose efficace la plus faible et pour la durée la plus courte compatible avec les objectifs du traitement et les risques pour la femme individuelle. Les patients doivent être réévalués périodiquement selon les besoins cliniques (par exemple, tous les 3 à 6 mois) pour déterminer si le traitement est toujours nécessaire (voir AVERTISSEMENTS ). Pour les femmes qui ont un utérus, des mesures diagnostiques adéquates, telles que le prélèvement de l'endomètre, lorsqu'elles sont indiquées, doivent être prises pour exclure une malignité en cas de saignements vaginaux anormaux persistants ou récurrents non diagnostiqués.
Les comprimés de PROVERA peuvent être administrés à des doses de 5 ou 10 mg par jour pendant 12 à 14 jours consécutifs par mois, chez les femmes ménopausées recevant quotidiennement 0,625 mg d'œstrogènes conjugués, soit en commençant le 1er jour du cycle, soit le 16e jour du cycle.
Les patients doivent commencer à la dose la plus faible.
La dose efficace la plus faible de PROVERA n'a pas été déterminée.
COMMENT FOURNIE
PROVERA 10mg Comprimés sont disponibles dans les concentrations et tailles d'emballage suivantes :
2,5 mg (sécable, rond, orange)
Bouteilles de 30 CDN 0009-0064-06 Flacons de 100 CDN 0009-0064-04
5mg (sécable, hexagonal, blanc)
Bouteilles de 100 CDN 0009-0286-03
10 mg (rayé, rond, blanc)
Bouteilles de 100 CDN 0009-0050-02 Flacons de 500 CDN 0009-0050-11
Conserver à température ambiante contrôlée entre 20 et 25 °C (68 et 77 °F) [voir USP ].
"Tenir hors de portée des enfants"
Distribué par : Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. Révisé : août 2015
EFFETS SECONDAIRES
Voir AVERTISSEMENTS ENCADRÉS , AVERTISSEMENTS , et PRÉCAUTIONS .
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Les effets indésirables suivants ont été rapportés chez des femmes prenant des comprimés de PROVERA 10 mg, sans traitement concomitant par œstrogènes :
Système génito-urinaire
Saignements utérins anormaux (irréguliers, augmentation, diminution), modification du flux menstruel, saignements intermenstruels, saignotements, aménorrhée, modifications de l'érosion cervicale et des sécrétions cervicales.
Seins
Une sensibilité mammaire, une mastodynie ou une galactorrhée ont été rapportées.
Cardiovasculaire
Des troubles thromboemboliques incluant thrombophlébite et embolie pulmonaire ont été rapportés.
Gastro-intestinal
Nausées, ictère cholestatique.
Peau
Des réactions de sensibilité consistant en urticaire, prurit, œdème et rash généralisé se sont produites. Acné, réactions de sensibilité consistant en urticaire, prurit, œdème et éruption cutanée généralisée se sont produites. L'acné, l'alopécie et l'hirsutisme ont été rapportés.
Yeux
Lésions neuro-oculaires, par exemple, thrombose rétinienne et névrite optique.
Système nerveux central
Dépression mentale, insomnie, somnolence, étourdissements, maux de tête, nervosité.
Divers
Réactions d'hypersensibilité (par exemple, réactions anaphylactiques et anaphylactoïdes, œdème de Quincke), éruption cutanée (allergique) avec et sans prurit, changement de poids (augmentation ou diminution), pyrexie, œdème/rétention hydrique, fatigue, diminution de la tolérance au glucose.
Les effets indésirables suivants ont été rapportés avec un traitement par œstrogène plus progestatif.
Système génito-urinaire
Saignements utérins/spottings anormaux ou écoulement ; saignement intermenstruel ; repérage; dysménorrhée/douleur pelvienne ; augmentation de la taille des léiomyomes utérins ; vaginite, y compris candidose vaginale ; modification de la quantité de sécrétion cervicale ; changements dans l'ectropion cervical; cancer des ovaires; hyperplasie de l'endomètre; cancer de l'endomètre.
Seins
Tendresse, hypertrophie, douleur, écoulement du mamelon, galactorrhée ; changements mammaires fibrokystiques; cancer du sein.
Cardiovasculaire
Thrombose veineuse profonde et superficielle ; embolie pulmonaire; thrombophlébite; infarctus du myocarde; accident vasculaire cérébral; augmentation de la tension artérielle.
Gastro-intestinal
Nausées Vomissements; crampes abdominales, ballonnements; ictère cholestatique; augmentation de l'incidence des maladies de la vésicule biliaire ; pancréatite; hypertrophie des hémangiomes hépatiques.
Peau
Chloasma ou mélasma pouvant persister après l'arrêt du médicament ; érythème polymorphe ; érythème noueux; éruption hémorragique; perte de cheveux du cuir chevelu; hirsutisme; prurit, éruption cutanée.
Yeux
Thrombose vasculaire rétinienne, intolérance aux lentilles de contact.
Système nerveux central
Mal de tête; migraine; vertiges; dépression mentale; chorée; nervosité; troubles de l'humeur; irritabilité; exacerbation de l'épilepsie, démence.
Divers
Augmentation ou diminution du poids ; tolérance réduite aux glucides; aggravation de la porphyrie; œdème; arthralgies; crampes dans les jambes; changements de libido; urticaire, œdème de Quincke, réactions anaphylactoïdes/anaphylactiques ; hypocalcémie; exacerbation de l'asthme; augmentation des triglycérides.
INTERACTIONS MÉDICAMENTEUSES
Interactions médicament-test de laboratoire
Les résultats de laboratoire suivants peuvent être modifiés par l'utilisation d'un traitement à base d'œstrogène et de progestatif :
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
Voir AVERTISSEMENTS ENCADRÉS .
Troubles cardiovasculaires
Un risque accru d'EP, de TVP, d'accident vasculaire cérébral et d'IM a été rapporté avec le traitement par œstrogène et progestatif. Si l'un de ces événements survient ou est suspecté, le traitement par œstrogène plus progestatif doit être interrompu immédiatement.
Facteurs de risque de maladie vasculaire artérielle (par exemple, hypertension, diabète sucré, tabagisme, hypercholestérolémie et obésité) et/ou de thromboembolie veineuse (TEV) (par exemple, antécédents personnels ou familiaux de TEV, obésité et lupus érythémateux disséminé) doit être géré de manière appropriée.
Accident vasculaire cérébral
Dans la sous-étude WHI œstrogène plus progestatif, une augmentation statistiquement significative du risque d'accident vasculaire cérébral a été signalée chez les femmes âgées de 50 à 79 ans recevant de l'EC (0,625 mg) plus MPA (2,5 mg) par rapport aux femmes du même groupe d'âge recevant un placebo (33 contre 25 pour 10 000 femmes-années). (Voir Etudes cliniques .) L'augmentation du risque a été démontrée après la première année et a persisté. Si un accident vasculaire cérébral survient ou est suspecté, le traitement par œstrogène plus progestatif doit être interrompu immédiatement.
Maladie coronarienne
Dans la sous-étude WHI œstrogène plus progestatif, il y avait un risque accru statistiquement non significatif d'événements coronariens signalés chez les femmes recevant quotidiennement CE (0,625 mg) plus MPA (2,5 mg) par rapport aux femmes recevant un placebo (41 contre 34 pour 10 000 femmes-années ). Une augmentation du risque relatif a été démontrée au cours de l'année 1, et une tendance à la diminution du risque relatif a été signalée au cours des années 2 à 5.
Chez les femmes ménopausées atteintes d'une cardiopathie documentée (n = 2 763, âge moyen 66,7 ans), dans un essai clinique contrôlé de prévention secondaire des maladies cardiovasculaires (Heart and Estrogen/Progestin Replacement Study [HERS]), un traitement par EC quotidien (0,625 mg ) plus MPA (2,5 mg) n'ont démontré aucun avantage cardiovasculaire. Au cours d'un suivi moyen de 4,1 ans, le traitement par CE plus MPA n'a pas réduit le taux global d'événements coronariens chez les femmes ménopausées atteintes d'une maladie coronarienne établie. Il y a eu plus d'événements coronariens dans le groupe traité par CE plus MPA que dans le groupe placebo au cours de la première année, mais pas au cours des années suivantes. Deux mille trois cent vingt et une (2 321) femmes de l'essai HERS initial ont accepté de participer à une extension en ouvert de HERS, HERS II. Le suivi moyen dans HERS II était de 2,7 ans supplémentaires, pour un total de 6,8 ans au total. Les taux d'événements coronariens étaient comparables chez les femmes du groupe CE plus MPA et du groupe placebo dans le SHER, le SHER II et l'ensemble.
Thromboembolie veineuse
Dans la sous-étude WHI œstrogène plus progestatif, un taux statistiquement significatif de 2 fois plus de TEV (TVP et EP) a été rapporté chez les femmes recevant quotidiennement EC (0,625 mg) plus MPA (2,5 mg) par rapport aux femmes recevant un placebo (35 contre 17 par 10 000 femmes-années). Des augmentations statistiquement significatives du risque de TVP (26 contre 13 pour 10 000 années-femmes) et d'EP (18 contre 8 pour 10 000 années-femmes) ont également été démontrées. L'augmentation du risque de TEV a été démontrée au cours de la première année et a persisté. (Voir Etudes cliniques .) Si une TEV survient ou est suspectée, le traitement par œstrogène plus progestatif doit être interrompu immédiatement.
Si possible, les œstrogènes plus les progestatifs doivent être interrompus au moins 4 à 6 semaines avant une intervention chirurgicale du type associé à un risque accru de thromboembolie, ou pendant les périodes d'immobilisation prolongée.
Néoplasmes malins
Cancer du sein
L'essai clinique randomisé le plus important fournissant des informations sur le cancer du sein chez les utilisatrices d'œstrogène plus progestatif est la sous-étude WHI sur l'EC quotidien (0,625 mg) plus MPA (2,5 mg). Après un suivi moyen de 5,6 ans, la sous-étude sur les œstrogènes et le progestatif a fait état d'un risque accru de cancer du sein invasif chez les femmes qui prenaient quotidiennement de l'EC plus de l'AMP.
Dans cette sous-étude, l'utilisation antérieure d'œstrogène seul ou d'œstrogène plus progestatif a été signalée par 26 % des femmes. Le risque relatif de cancer du sein invasif était de 1,24 et le risque absolu était de 41 contre 33 cas pour 10 000 femmes-années, pour l'EC plus MPA par rapport au placebo. Parmi les femmes qui ont déclaré avoir déjà utilisé une hormonothérapie, le risque relatif de cancer du sein invasif était de 1,86 et le risque absolu était de 46 contre 25 cas pour 10 000 femmes-années, pour l'EC plus MPA par rapport au placebo. Parmi les femmes qui n'ont déclaré aucune utilisation antérieure d'hormonothérapie, le risque relatif de cancer du sein invasif était de 1,09 et le risque absolu était de 40 contre 36 cas pour 10 000 femmes-années, pour l'EC plus MPA par rapport au placebo. Dans la même sous-étude, les cancers du sein invasifs étaient plus gros, étaient plus susceptibles d'avoir des ganglions positifs et ont été diagnostiqués à un stade plus avancé dans le groupe CE (0,625 mg) plus MPA (2,5 mg) par rapport au groupe placebo. La maladie métastatique était rare sans différence apparente entre les deux groupes. D'autres facteurs pronostiques tels que le sous-type histologique, le grade et le statut des récepteurs hormonaux ne différaient pas entre les groupes. (Voir Etudes cliniques .)
Conformément à l'essai clinique WHI, des études observationnelles ont également signalé un risque accru de cancer du sein pour le traitement par œstrogène plus progestatif, et un risque moindre pour le traitement par œstrogène seul, après plusieurs années d'utilisation. Le risque augmentait avec la durée d'utilisation et semblait revenir à la valeur initiale environ 5 ans après l'arrêt du traitement (seules les études observationnelles disposent de données substantielles sur le risque après l'arrêt). Des études observationnelles suggèrent également que le risque de cancer du sein était plus élevé et est apparu plus tôt avec un traitement par œstrogène plus progestatif par rapport à un traitement par œstrogène seul. Cependant, ces études n'ont pas trouvé de variation significative du risque de cancer du sein entre les différentes combinaisons d'œstrogène et de progestatif ou les voies d'administration.
Il a été rapporté que l'utilisation d'œstrogène plus progestatif entraîne une augmentation des mammographies anormales nécessitant une évaluation plus approfondie. Toutes les femmes devraient subir des examens annuels des seins par un fournisseur de soins de santé et effectuer des auto-examens mensuels des seins. De plus, les examens de mammographie doivent être programmés en fonction de l'âge de la patiente, des facteurs de risque et des résultats de mammographie antérieurs.
Cancer de l'endomètre
Un risque accru de cancer de l'endomètre a été rapporté avec l'utilisation d'un traitement œstrogénique sans opposition chez les femmes ayant un utérus. Le risque de cancer de l'endomètre signalé chez les utilisatrices d'œstrogènes sans opposition est environ 2 à 12 fois plus élevé que chez les non-utilisatrices et semble dépendre de la durée du traitement et de la dose d'œstrogène. La plupart des études ne montrent aucune augmentation significative du risque associé à l'utilisation d'œstrogènes pendant moins d'un an. Le plus grand risque semble associé à une utilisation prolongée, avec des risques accrus de 15 à 24 fois pendant 5 à 10 ans ou plus. Il a été démontré que ce risque persiste pendant au moins 8 à 15 ans après l'arrêt de l'œstrogénothérapie.
La surveillance clinique de toutes les femmes utilisant un traitement œstroprogestatif est importante. Des mesures diagnostiques adéquates, y compris un prélèvement de l'endomètre lorsqu'il est indiqué, doivent être prises pour exclure une malignité dans tous les cas de saignements génitaux anormaux persistants ou récurrents non diagnostiqués. Il n'y a aucune preuve que l'utilisation d'œstrogènes naturels entraîne un profil de risque endométrial différent de celui des œstrogènes synthétiques à dose équivalente d'œstrogène. Il a été démontré que l'ajout d'un progestatif à l'oestrogénothérapie réduit le risque d'hyperplasie de l'endomètre, qui peut être un précurseur du cancer de l'endomètre.
Cancer des ovaires
La sous-étude WHI sur les œstrogènes et les progestatifs a fait état d'un risque accru statistiquement non significatif de cancer de l'ovaire. Après un suivi moyen de 5,6 ans, le risque relatif de cancer de l'ovaire pour l'EC plus MPA par rapport au placebo était de 1,58 (IC à 95 %, 0,77 à 3,24). Le risque absolu de CE plus MPA était de 4 contre 3 cas pour 10 000 années-femmes. Dans certaines études épidémiologiques, l'utilisation d'œstrogène plus progestatif et de produits contenant uniquement de l'œstrogène, en particulier pendant 5 ans ou plus, a été associée à un risque accru de cancer de l'ovaire. Cependant, la durée d'exposition associée à un risque accru n'est pas cohérente dans toutes les études épidémiologiques et certaines ne rapportent aucune association.
Démence probable
Dans l'étude auxiliaire WHIMS œstrogène plus progestatif de WHI, une population de 4 532 femmes ménopausées âgées de 65 à 79 ans a été randomisée pour recevoir quotidiennement EC (0,625 mg) plus MPA (2,5 mg) ou un placebo. Après un suivi moyen de 4 ans, 40 femmes du groupe CE plus MPA et 21 femmes du groupe placebo ont reçu un diagnostic de démence probable. Le risque relatif de démence probable pour CE plus MPA par rapport au placebo était de 2,05 (IC à 95 %, 1,21 à 3,48). Le risque absolu de démence probable pour CE plus MPA par rapport au placebo était de 45 contre 22 cas pour 10 000 années-femmes. On ne sait pas si ces résultats s'appliquent aux jeunes femmes ménopausées. (Voir Etudes cliniques et PRÉCAUTIONS , Utilisation gériatrique .)
Anomalies visuelles
Interrompre le traitement par œstrogène plus progestatif en attendant l'examen en cas de perte soudaine partielle ou complète de la vision ou d'apparition soudaine d'exophtalmie, de diplopie ou de migraine. Si l'examen révèle un œdème papillaire ou des lésions vasculaires rétiniennes, le traitement œstroprogestatif doit être arrêté définitivement.
PRÉCAUTIONS
Général
Ajout d'un progestatif lorsqu'une femme n'a pas subi d'hystérectomie
Des études sur l'ajout d'un progestatif pendant 10 jours ou plus d'un cycle d'administration d'œstrogènes, ou quotidiennement avec des œstrogènes dans un régime continu, ont rapporté une incidence réduite d'hyperplasie de l'endomètre par rapport à celle induite par un traitement aux œstrogènes seuls. L'hyperplasie de l'endomètre peut être un précurseur du cancer de l'endomètre.
Il existe cependant des risques possibles qui peuvent être associés à l'utilisation de progestatifs avec des œstrogènes par rapport aux schémas thérapeutiques à base d'œstrogènes seuls. Ceux-ci incluent un risque accru de cancer du sein.
Saignements vaginaux anormaux inattendus
En cas de saignements vaginaux anormaux inattendus, des mesures diagnostiques adéquates sont indiquées.
Tension artérielle élevée
La pression artérielle doit être surveillée à intervalles réguliers avec un traitement par œstrogène et progestatif.
Hypertriglycéridémie
Chez les femmes présentant une hypertriglycéridémie préexistante, le traitement par œstrogène plus progestatif peut être associé à des élévations des triglycérides plasmatiques conduisant à une pancréatite. Envisager l'arrêt du traitement en cas de pancréatite.
Insuffisance hépatique et/ou antécédents d'ictère cholestatique
Les œstrogènes associés aux progestatifs peuvent être mal métabolisés chez les femmes dont la fonction hépatique est altérée. Pour les femmes ayant des antécédents d'ictère cholestatique associé à une utilisation antérieure d'œstrogènes ou à une grossesse, la prudence s'impose et, en cas de récidive, le traitement doit être interrompu.
Rétention d'eau
Les progestatifs peuvent provoquer un certain degré de rétention d'eau. Les femmes qui ont des conditions qui pourraient être influencées par ce facteur, comme une insuffisance cardiaque ou rénale, justifient une surveillance attentive lorsque des œstrogènes plus un progestatif sont prescrits.
Hypocalcémie
Le traitement par œstrogène plus progestatif doit être utilisé avec prudence chez les femmes atteintes d'hypoparathyroïdie, car une hypocalcémie induite par les œstrogènes peut survenir.
Exacerbation d'autres conditions
Le traitement par œstrogène plus progestatif peut provoquer une exacerbation de l'asthme, du diabète sucré, de l'épilepsie, de la migraine, de la porphyrie, du lupus érythémateux disséminé et des hémangiomes hépatiques et doit être utilisé avec prudence chez les femmes atteintes de ces affections.
Informations sur les patients
Les médecins sont invités à discuter de la INFORMATIONS PATIENTS dépliant avec les femmes à qui ils prescrivent PROVERA.
Il peut y avoir un risque accru de malformations congénitales mineures chez les enfants dont les mères sont exposées à des progestatifs au cours du premier trimestre de la grossesse. Le risque possible pour le bébé de sexe masculin est l'hypospadias, une condition dans laquelle l'ouverture du pénis se trouve sur le dessous plutôt que sur le bout du pénis. Cette condition survient naturellement chez environ 5 à 8 pour 1000 naissances masculines. Le risque peut être augmenté avec l'exposition à PROVERA. L'élargissement du clitoris et la fusion des lèvres peuvent survenir chez les bébés de sexe féminin. Cependant, une association claire entre l'hypospadias, l'élargissement du clitoris et la fusion labiale avec l'utilisation de PROVERA n'a pas été établie.
Informer la patiente de l'importance de déclarer l'exposition à PROVERA 5mg en début de grossesse.
Carcinogenèse, mutagenèse, altération de la fertilité
Cancérogénicité
Il a été démontré que l'administration intramusculaire à long terme d'acétate de médroxyprogestérone produit des tumeurs mammaires chez les chiens beagle. Il n'y avait aucune preuve d'un effet cancérigène associé à l'administration orale d'acétate de médroxyprogestérone à des rats et des souris.
L'administration continue à long terme d'œstrogène plus progestatif a montré un risque accru de cancer du sein et de cancer de l'ovaire. (Voir AVERTISSEMENTS et PRÉCAUTIONS .)
Génotoxicité
L'acétate de médroxyprogestérone n'a pas été mutagène dans une batterie d'essais de toxicité génétique in vitro ou in vivo.
La fertilité
L'acétate de médroxyprogestérone à fortes doses est un médicament anti-fertilité et des doses élevées devraient altérer la fertilité jusqu'à l'arrêt du traitement.
Grossesse
Catégorie de grossesse X
PROVERA ne doit pas être utilisé pendant la grossesse. (Voir CONTRE-INDICATIONS .)
Il peut y avoir des risques accrus d'hypospadias, d'hypertrophie clitoridienne et de fusion labiale chez les enfants dont les mères sont exposées à PROVERA 10 mg au cours du premier trimestre de la grossesse. Cependant, une association claire entre ces conditions avec l'utilisation de PROVERA n'a pas été établie.
Mères allaitantes
PROVERA ne doit pas être utilisé pendant l'allaitement. Des quantités détectables de progestatif ont été identifiées dans le lait maternel de mères allaitantes recevant des progestatifs.
Utilisation pédiatrique
Les comprimés de PROVERA 10 mg ne sont pas indiqués chez l'enfant. Aucune étude clinique n'a été menée dans la population pédiatrique.
Utilisation gériatrique
Il n'y a pas eu un nombre suffisant de femmes gériatriques impliquées dans des études cliniques utilisant PROVERA seul pour déterminer si les personnes de plus de 65 ans diffèrent des sujets plus jeunes dans leur réponse à PROVERA seul.
Les études de l'Initiative sur la santé des femmes
Dans la sous-étude WHI sur les œstrogènes plus progestatifs (CE quotidienne [0,625 mg] plus MPA [2,5 mg] versus placebo), il y avait un risque relatif plus élevé d'AVC non mortel et de cancer du sein invasif chez les femmes de plus de 65 ans. (Voir Etudes cliniques .)
L'étude sur la mémoire de l'Initiative pour la santé des femmes
Dans les études auxiliaires WHIMS portant sur des femmes ménopausées âgées de 65 à 79 ans, il y avait un risque accru de développer une démence probable chez les femmes recevant des œstrogènes seuls ou des œstrogènes plus progestatifs par rapport au placebo. (Voir AVERTISSEMENTS , Démence probable .)
Étant donné que les deux études auxiliaires ont été menées chez des femmes âgées de 65 à 79 ans, on ne sait pas si ces résultats s'appliquent aux femmes ménopausées plus jeunes. (Voir AVERTISSEMENTS , Démence probable .)
SURDOSAGE
Un surdosage d'œstrogène plus progestatif peut provoquer des nausées et des vomissements, une sensibilité des seins, des étourdissements, des douleurs abdominales, une somnolence/fatigue et des saignements de privation peuvent survenir chez les femmes. Le traitement du surdosage consiste en l'arrêt de l'EC plus MPA ainsi qu'en l'institution de soins symptomatiques appropriés.
CONTRE-INDICATIONS
PROVERA 10 mg est contre-indiqué chez les femmes présentant l'une des conditions suivantes :
PHARMACOLOGIE CLINIQUE
L'acétate de médroxyprogestérone (MPA) administré par voie orale ou parentérale aux doses recommandées chez les femmes ayant des œstrogènes endogènes adéquats, transforme l'endomètre prolifératif en sécréteur. Des effets androgéniques et anabolisants ont été notés, mais le médicament est apparemment dépourvu d'activité œstrogénique significative. Bien que le MPA administré par voie parentérale inhibe la production de gonadotrophines, qui à son tour empêche la maturation folliculaire et l'ovulation, les données disponibles indiquent que cela ne se produit pas lorsque la dose orale habituellement recommandée est administrée en doses quotidiennes uniques.
Pharmacocinétique
La pharmacocinétique du MPA a été déterminée chez 20 femmes ménopausées après administration d'une dose unique de huit comprimés de PROVERA à 2,5 mg ou d'une administration unique de deux comprimés de PROVERA à 10 mg à jeun. Dans une autre étude, la pharmacocinétique à l'état d'équilibre du MPA a été déterminée à jeun chez 30 femmes ménopausées après administration quotidienne d'un comprimé de PROVERA à 10 mg pendant 7 jours. Dans les deux études, le MPA a été quantifié dans le sérum à l'aide d'une méthode validée de chromatographie en phase gazeuse-spectrométrie de masse (GC-MS). Les estimations des paramètres pharmacocinétiques du MPA après des doses uniques et multiples de comprimés PROVERA étaient très variables et sont résumées dans le tableau 1.
Absorption
Aucune étude spécifique sur la biodisponibilité absolue du MPA chez l'homme n'a été menée. Le MPA est rapidement absorbé par le tractus gastro-intestinal et les concentrations maximales de MPA sont obtenues entre 2 et 4 heures après l'administration orale.
L'administration de PROVERA avec de la nourriture augmente la biodisponibilité du MPA. Une dose de 10 mg de PROVERA 10 mg, prise immédiatement avant ou après un repas, a augmenté la Cmax du MPA (50 à 70 %) et l'ASC (18 à 33 %). La demi-vie du MPA n'a pas été modifiée avec la nourriture.
Distribution
Le MPA est lié à environ 90 % aux protéines, principalement à l'albumine ; aucune liaison au MPA ne se produit avec la globuline liant les hormones sexuelles.
Métabolisme
Après administration orale, le MPA est largement métabolisé dans le foie par hydroxylation, suivi d'une conjugaison et d'une élimination dans les urines.
Excrétion
La plupart des métabolites du MPA sont excrétés dans l'urine sous forme de conjugués glucuronide avec seulement des quantités mineures excrétées sous forme de sulfates.
Populations spécifiques
Insuffisance hépatique
Le MPA est presque exclusivement éliminé par métabolisme hépatique. Chez 14 patients atteints d'une maladie hépatique avancée, la disposition du MPA était significativement altérée (élimination réduite). Chez les patients atteints de stéatose hépatique, la dose moyenne en pourcentage excrétée dans les urines de 24 heures sous forme de MPA intact après une dose de 10 mg ou 100 mg était de 7,3 % et 6,4 %, respectivement.
Insuffisance rénale
L'effet de l'insuffisance rénale sur la pharmacocinétique de PROVERA 5 mg n'a pas été étudié.
Interactions médicamenteuses
L'acétate de médroxyprogestérone (MPA) est métabolisé in vitro principalement par hydroxylation via le CYP3A4. Aucune étude spécifique sur les interactions médicamenteuses évaluant les effets cliniques des inducteurs ou des inhibiteurs du CYP3A4 sur le MPA n'a été menée. Les inducteurs et/ou inhibiteurs du CYP3A4 peuvent affecter le métabolisme du MPA.
Etudes cliniques
Effets sur l'endomètre
Dans une étude de 3 ans, en double aveugle, contrôlée par placebo, portant sur 356 femmes ménopausées non hystérectomisées âgées de 45 à 64 ans, randomisées pour recevoir un placebo (n = 119), 0,625 mg d'œstrogènes conjugués uniquement (n = 119) ou 0,625 mg d'œstrogènes conjugués plus PROVERA cyclique (n = 118), les résultats ont montré un risque réduit d'hyperplasie de l'endomètre dans le groupe de traitement recevant 10 mg de PROVERA 5 mg plus 0,625 mg d'œstrogènes conjugués par rapport au groupe recevant 0,625 mg d'œstrogènes conjugués uniquement. Voir le tableau 2.
Dans une deuxième étude d'un an, 832 femmes ménopausées âgées de 45 à 65 ans ont été traitées avec 0,625 mg d'œstrogènes conjugués par jour (jours 1 à 28), plus soit 5 mg de PROVERA cyclique, soit 10 mg de PROVERA cyclique (jours 15 à 28), ou 0,625 mg d'œstrogènes conjugués par jour uniquement. Les groupes de traitement recevant 5 ou 10 mg de PROVERA cyclique (jours 15 à 28) plus des œstrogènes conjugués quotidiens ont montré un taux d'hyperplasie significativement plus faible par rapport au groupe des œstrogènes conjugués seuls. Voir le tableau 3.
Études de l'Initiative sur la santé des femmes
Le WHI a recruté environ 27 000 femmes ménopausées en bonne santé dans deux sous-études pour évaluer les risques et les avantages de l'EC oral quotidien (0,625 mg) - seul ou en association avec le MPA (2,5 mg) par rapport à un placebo dans la prévention de certaines maladies chroniques. Le critère d'évaluation principal était l'incidence des maladies coronariennes (MC) (définies comme un IM non mortel, un IM silencieux et un décès par maladie coronarienne), le cancer du sein invasif étant le principal résultat indésirable. Un « indice global » comprenait la survenue la plus précoce de coronaropathie, de cancer du sein invasif, d'accident vasculaire cérébral, d'EP, de cancer de l'endomètre (uniquement dans la sous-étude CE plus MPA), de cancer colorectal, de fracture de la hanche ou de décès dû à une autre cause. Ces sous-études n'ont pas évalué les effets de l'EC seul ou de l'EC plus MPA sur les symptômes de la ménopause.
Sous-étude WHI sur les œstrogènes et les progestatifs
La sous-étude WHI sur les œstrogènes et le progestatif a été arrêtée prématurément. Selon la règle d'arrêt prédéfinie, après un suivi moyen de 5,6 ans de traitement, le risque accru de cancer du sein invasif et d'événements cardiovasculaires dépassait les bénéfices spécifiés inclus dans «l'indice global». L'excès de risque absolu d'événements inclus dans « l'indice global » était de 19 pour 10 000 femmes-années.
Pour les résultats inclus dans « l'indice global » WHI qui ont atteint une signification statistique après 5,6 ans de suivi, les risques excédentaires absolus pour 10 000 femmes-années dans le groupe traité avec EC plus MPA étaient de 7 événements coronariens supplémentaires, 8 AVC supplémentaires, 10 EP de plus et 8 cancers du sein invasifs de plus, tandis que la réduction absolue du risque pour 10 000 années-femmes était de 6 cancers colorectaux de moins et de 5 fractures de la hanche de moins.
Les résultats de la sous-étude CE plus MPA, qui comprenait 16 608 femmes (moyenne d'âge de 63 ans, tranche de 50 à 79 ans ; 83,9 % de Blanches, 6,8 % de Noires, 5,4 % d'Hispaniques, 3,9 % d'Autres) sont présentés dans le tableau 4. Ces résultats reflètent de manière centralisée données arbitrées après un suivi moyen de 5,6 ans.
Le moment de l'initiation du traitement par œstrogène plus progestatif par rapport au début de la ménopause peut affecter le profil risque/bénéfice global. La sous-étude WHI œstrogène plus progestatif stratifiée selon l'âge a montré chez les femmes de 50 à 59 ans une tendance non significative vers une réduction du risque de mortalité globale [rapport de risque (RR) 0,69 (IC à 95 %, 0,44–1,07)].
Étude sur la mémoire de l'Initiative pour la santé des femmes
L'étude complémentaire WHIMS sur les œstrogènes et les progestatifs de la WHI a recruté 4 532 femmes ménopausées, pour la plupart en bonne santé, âgées de 65 ans et plus (47 % étaient âgées de 65 à 69 ans, 35 % avaient entre 70 et 74 ans et 18 % avaient 75 ans). âge et plus) pour évaluer les effets de l'EC quotidien (0,625 mg) plus MPA (2,5 mg) sur l'incidence de la démence probable (résultat principal) par rapport au placebo.
Après un suivi moyen de 4 ans, le risque relatif de démence probable pour l'EC plus MPA par rapport au placebo était de 2,05 (IC à 95 %, 1,21 à 3,48). Le risque absolu de démence probable pour CE plus MPA par rapport au placebo était de 45 contre 33 pour 10 000 femmes-années. La démence probable telle que définie dans cette étude comprenait la maladie d'Alzheimer (MA), la démence vasculaire (VaD) et le type mixte (présentant à la fois des caractéristiques de MA et de VAD). La classification la plus courante de démence probable dans le groupe de traitement et le groupe placebo était la MA. Étant donné que l'étude auxiliaire a été menée auprès de femmes âgées de 65 à 79 ans, on ne sait pas si ces résultats s'appliquent aux femmes ménopausées plus jeunes. (Voir AVERTISSEMENTS , Démence probable et PRÉCAUTIONS , Utilisation gériatrique ).
INFORMATIONS PATIENTS
PROVERA (pro-VE-rah) (acétate de médroxyprogestérone) comprimés, USP
Lisez ces informations patient avant de commencer à prendre PROVERA et lisez ce que vous obtenez chaque fois que vous renouvelez votre prescription de PROVERA. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre fournisseur de soins de santé au sujet de votre état de santé ou de votre traitement.
Quelle est l'information la plus importante que je devrais connaître sur PROVERA (une hormone progestative) ?
- N'utilisez pas d'œstrogènes avec des progestatifs pour prévenir les maladies cardiaques, les crises cardiaques, les accidents vasculaires cérébraux ou la démence (dégradation des fonctions cérébrales).
- L'utilisation d'œstrogènes avec des progestatifs peut augmenter vos risques de crise cardiaque, d'accident vasculaire cérébral, de cancer du sein et de caillots sanguins.
- L'utilisation d'œstrogènes avec des progestatifs peut augmenter vos risques de développer une démence, selon une étude menée auprès de femmes de 65 ans ou plus.
- Vous et votre fournisseur de soins de santé devriez discuter régulièrement de la nécessité de poursuivre un traitement par PROVERA.
Qu'est-ce que PROVERA 10 mg ?
PROVERA est un médicament qui contient de l'acétate de médroxyprogestérone, une hormone progestative.
A quoi sert PROVERA 5mg ?
PROVERA est utilisé pour :
- Traiter les menstruations qui se sont arrêtées ou pour traiter les saignements utérins anormaux. Les femmes avec un utérus qui ne sont pas enceintes, qui cessent d'avoir des menstruations régulières ou qui commencent à avoir des menstruations irrégulières peuvent avoir une baisse de leur taux de progestérone. Discutez avec votre fournisseur de soins de santé pour savoir si PROVERA 10 mg vous convient.
- Réduisez vos chances d'avoir un cancer de l'utérus (utérus). Chez les femmes ménopausées dont l'utérus utilise des œstrogènes, la prise d'un progestatif en association avec des œstrogènes réduira le risque de cancer de l'utérus (utérus).
Qui ne devrait pas prendre PROVERA ?
Ne commencez pas à prendre PROVERA si vous :
- avoir des saignements vaginaux inhabituels
- avez actuellement ou avez eu certains cancers L'association d'œstrogène et de progestatif peut augmenter vos risques de contracter certains types de cancer, y compris le cancer du sein. Si vous avez ou avez eu un cancer, discutez avec votre fournisseur de soins de santé pour savoir si vous devez utiliser PROVERA.
- a eu un accident vasculaire cérébral ou une crise cardiaque
- avez actuellement ou avez eu des caillots sanguins
- avez actuellement ou avez eu des problèmes de foie
- êtes allergique à PROVERA 10 mg ou à l'un de ses ingrédients Voir la liste des ingrédients de PROVERA à la fin de cette notice.
- pensez que vous pourriez être enceinte PROVERA n'est pas destiné aux femmes enceintes. Si vous pensez être enceinte, vous devriez faire un test de grossesse et connaître les résultats. N'utilisez pas PROVERA si le test est positif et parlez-en à votre fournisseur de soins de santé. Il peut y avoir un risque accru de malformations congénitales mineures chez les enfants dont les mères prennent PROVERA pendant les 4 premiers mois de la grossesse. PROVERA ne doit pas être utilisé comme test de grossesse.
Que dois-je dire à mon professionnel de la santé avant de prendre PROVERA 10 mg ? Avant de prendre PROVERA 5 mg, informez votre professionnel de la santé si vous :
- avez d'autres problèmes médicaux Votre fournisseur de soins de santé devra peut-être vous examiner plus attentivement si vous souffrez de certaines affections telles que l'asthme (respiration sifflante), l'épilepsie (convulsions), le diabète, la migraine, l'endométriose (douleur pelvienne intense), le lupus ou des problèmes cardiaques, hépatiques, thyroïdiens, reins ou si vous avez un taux élevé de calcium dans le sang.
- vont subir une intervention chirurgicale ou seront alités Votre fournisseur de soins de santé vous indiquera si vous devez arrêter de prendre PROVERA.
- allaitent L'hormone contenue dans PROVERA peut passer dans votre lait maternel.
Informez votre fournisseur de soins de santé de tous les médicaments que vous prenez y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Certains médicaments peuvent affecter le fonctionnement de PROVERA. PROVERA peut également modifier l'action d'autres médicaments.
Comment dois-je prendre PROVERA 10 mg ?
Commencez par la dose la plus faible et discutez avec votre fournisseur de soins de santé de l'efficacité de cette dose pour vous. La dose efficace la plus faible de PROVERA n'a pas été déterminée. Vous et votre fournisseur de soins de santé devriez parler régulièrement (tous les 3 à 6 mois) de la dose que vous prenez et si vous avez encore besoin d'un traitement par PROVERA.
Quels sont les effets secondaires possibles de PROVERA ?
Les effets indésirables suivants ont été rapportés avec l'utilisation de PROVERA 10 mg seul :
- sensibilité des seins
- sécrétion de lait maternel
- saignement intermenstruel
- spotting (saignements vaginaux mineurs)
- menstruations irrégulières
- aménorrhée (absence de menstruations)
- sécrétions vaginales
- maux de tête
- nervosité
- vertiges
- la dépression
- insomnie, somnolence, fatigue
- symptômes de type syndrome prémenstruel
- thrombophlébite (veines enflammées)
- caillot de sang
- démangeaisons, urticaire, éruption cutanée
- acné
- perte de cheveux, pousse des cheveux
- douleur abdominale
- nausée
- ballonnement
- fièvre
- augmentation de poids
- gonflement
- changements dans la vision et la sensibilité aux lentilles de contact
Appelez immédiatement votre fournisseur de soins de santé si vous avez de l'urticaire, des problèmes respiratoires, un gonflement du visage, de la bouche, de la langue ou du cou
Les effets indésirables suivants ont été rapportés avec l'utilisation de PROVERA 5 mg avec un œstrogène.
Les effets secondaires sont regroupés en fonction de leur gravité et de la fréquence à laquelle ils se produisent lorsque vous êtes traité.
Les effets secondaires graves, mais moins courants, comprennent :
- crise cardiaque
- accident vasculaire cérébral
- caillots sanguins
- démence
- cancer du sein
- cancer de l'utérus
- cancer de l'ovaire
- hypertension artérielle
- glycémie élevée
- maladie de la vésicule biliaire
- problèmes de foie
- changements dans vos niveaux d'hormones thyroïdiennes
- élargissements de tumeurs bénignes ("fibromes")
Appelez immédiatement votre fournisseur de soins de santé si vous présentez l'un des signes avant-coureurs suivants ou tout autre symptôme inhabituel qui vous préoccupe :
- nouvelles masses mammaires
- saignement vaginal inhabituel
- changements dans la vision et la parole
- nouveaux maux de tête sévères et soudains
- douleurs intenses dans la poitrine ou les jambes avec ou sans essoufflement, faiblesse et fatigue
- perte de mémoire ou confusion
Les effets secondaires moins graves mais courants incluent :
- mal de tête
- douleur mammaire
- saignement vaginal irrégulier ou spotting
- crampes d'estomac ou abdominales, ballonnements
- nausée et vomissements
- chute de cheveux
- rétention d'eau
- infection vaginale par des levures
Ce ne sont pas tous les effets secondaires possibles de PROVERA avec ou sans œstrogènes. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou à votre pharmacien des conseils sur les effets secondaires. Dites à votre fournisseur de soins de santé si vous avez des effets secondaires qui vous dérangent ou qui ne disparaissent pas. Vous pouvez signaler les effets secondaires à Pfizer au 1-800-438-1985 ou à la FDA au 1-800-FDA-1088.
Que puis-je faire pour réduire mes risques d'effet secondaire grave avec PROVERA 10 mg ?
- Discutez régulièrement avec votre fournisseur de soins de santé pour savoir si vous devez continuer à prendre PROVERA. L'ajout d'un progestatif est généralement recommandé pour les femmes ayant un utérus afin de réduire le risque de cancer de l'utérus (utérus).
- Consultez immédiatement votre fournisseur de soins de santé si vous avez des saignements vaginaux pendant que vous prenez PROVERA.
- Passez un examen pelvien, un examen des seins et une mammographie (radiographie des seins) chaque année, à moins que votre fournisseur de soins de santé ne vous dise autre chose. Si des membres de votre famille ont eu un cancer du sein ou si vous avez déjà eu des masses mammaires ou une mammographie anormale, vous devrez peut-être passer des examens des seins plus souvent.
- Si vous souffrez d'hypertension artérielle, d'un taux de cholestérol élevé (graisses dans le sang), de diabète, d'embonpoint ou si vous consommez du tabac, vous risquez davantage de développer une maladie cardiaque. Demandez à votre professionnel de la santé des moyens de réduire vos risques de maladie cardiaque.
Informations générales sur l'utilisation sûre et efficace de PROVERA
- Des médicaments sont parfois prescrits pour des affections qui ne sont pas mentionnées dans les notices d'information destinées aux patients.
- Ne prenez pas PROVERA pour des conditions pour lesquelles il n'a pas été prescrit.
- Ne donnez pas PROVERA à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Gardez PROVERA 10 mg hors de la portée des enfants.
Cette notice fournit un résumé des informations les plus importantes sur PROVERA. Si vous souhaitez plus d'informations, parlez-en à votre fournisseur de soins de santé ou à votre pharmacien. Vous pouvez demander des informations sur PROVERA 10mg qui sont écrites pour les professionnels de la santé. Vous pouvez obtenir plus d'informations en appelant le numéro sans frais, 1-800-438-1985.
Quels sont les ingrédients de PROVERA ?
Chaque comprimé PROVERA 5 mg pour administration orale contient 2,5 mg, 5 mg ou 10 mg d'acétate de médroxyprogestérone.
Ingrédients inactifs : stéarate de calcium, amidon de maïs, lactose, huile minérale, acide sorbique, saccharose, talc. Le comprimé de 2,5 mg contient FD&C jaune n° 6.
L'étiquette de ce produit a peut-être été mise à jour. Pour des informations de prescription complètes et à jour, veuillez visiter www.pfizer.com
