Diflucan 50mg, 100mg, 150mg, 200mg Fluconazole Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Diflucan et comment est-il utilisé ?
Diflucan est un médicament délivré sur ordonnance utilisé pour traiter les symptômes des infections fongiques. Diflucan 50 mg peut être utilisé seul ou avec d'autres médicaments.
Diflucan 100 mg appartient à une classe de médicaments appelés antifongiques.
Quels sont les effets secondaires de Diflucan 150 mg ?
Diflucan 100 mg peut provoquer des effets indésirables graves, notamment :
- rythme cardiaque rapide ou battant,
- flotter dans ta poitrine,
- essoufflement,
- vertiges soudains,
- fièvre,
- des frissons,
- courbatures,
- symptômes de la grippe,
- ecchymoses ou saignements faciles,
- faiblesse inhabituelle,
- saisie (convulsions),
- éruption cutanée ou lésions,
- perte d'appétit,
- douleur dans le haut du ventre,
- urine foncée,
- selles de couleur argile, et
- jaunissement des yeux ou de la peau (jaunisse)
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Diflucan incluent :
- nausée,
- Douleur d'estomac,
- diarrhée,
- maux d'estomac,
- mal de tête,
- des étourdissements et
- changements dans votre sens du goût
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Diflucan. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
DIFLUCAN® (fluconazole), le premier d'une nouvelle sous-classe d'agents antifongiques triazolés synthétiques, est disponible sous forme de comprimés pour administration orale, sous forme de poudre pour suspension buvable.
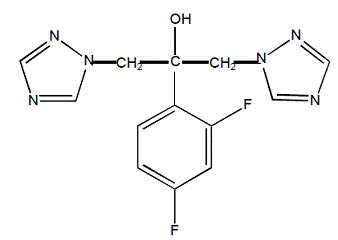
Le fluconazole est désigné chimiquement sous le nom d'alcool benzylique 2,4-difluoro-α,α1-bis(1H-1,2,4-triazol-1-ylméthyl) avec une formule empirique de C13H12F2N6O et un poids moléculaire de 306,3. La formule structurale est :
Le fluconazole est un solide cristallin blanc légèrement soluble dans l'eau et le sérum physiologique.
Les comprimés DIFLUCAN contiennent 50, 100, 150 ou 200 mg de fluconazole et les ingrédients inactifs suivants : cellulose microcristalline, phosphate de calcium dibasique anhydre, povidone, croscarmellose sodique, colorant de laque d'aluminium FD&C rouge n° 40 et stéarate de magnésium.
DIFLUCAN pour suspension orale contient 350 mg ou 1400 mg de fluconazole et les ingrédients inactifs suivants : saccharose, citrate de sodium dihydraté, acide citrique anhydre, benzoate de sodium, dioxyde de titane, dioxyde de silice colloïdale, gomme de xanthane et arôme naturel d'orange. Après reconstitution avec 24 mL d'eau distillée ou d'eau purifiée (USP), chaque mL de suspension reconstituée contient 10 mg ou 40 mg de fluconazole.
LES INDICATIONS
DIFLUCAN (fluconazole) est indiqué pour le traitement de :
- Candidose vaginale (infections vaginales à levures dues à Candida).
- Candidose oropharyngée et oesophagienne. Dans des études ouvertes non comparatives portant sur un nombre relativement restreint de patients, DIFLUCAN s'est également avéré efficace pour le traitement des infections des voies urinaires à Candida, des péritonites et des infections systémiques à Candida, y compris la candidémie, la candidose disséminée et la pneumonie.
- Méningite cryptococcique. Avant de prescrire DIFLUCAN (fluconazole) à des patients atteints du SIDA atteints de méningite cryptococcique, veuillez consulter Etudes cliniques section. Aucune étude comparant DIFLUCAN 150 mg à l'amphotéricine B chez des patients non infectés par le VIH n'a été menée.
Prophylaxie
DIFLUCAN est également indiqué pour diminuer l'incidence de la candidose chez les patients subissant une greffe de moelle osseuse qui reçoivent une chimiothérapie cytotoxique et/ou une radiothérapie.
Des échantillons pour la culture fongique et d'autres études de laboratoire pertinentes (sérologie, histopathologie) doivent être obtenus avant le traitement afin d'isoler et d'identifier les organismes responsables. La thérapie peut être instituée avant que les résultats des cultures et autres études de laboratoire ne soient connus; cependant, une fois ces résultats disponibles, le traitement anti-infectieux doit être adapté en conséquence.
DOSAGE ET ADMINISTRATION
Posologie et administration chez les adultes
Une seule dose
Candidose vaginale
La posologie recommandée de DIFLUCAN pour la candidose vaginale est de 150 mg en une seule prise orale.
Doses multiples
ÉTANT DONNÉ QUE L'ABSORPTION ORALE EST RAPIDE ET PRESQUE COMPLÈTE, LA DOSE QUOTIDIENNE DE DIFLUCAN (FLUCONAZOLE) EST LA MÊME POUR L'ADMINISTRATION ORALE (COMPRIMÉS ET SUSPENSION) ET INTRAVEINEUSE. En général, une dose de charge de deux fois la dose quotidienne est recommandée le premier jour de traitement pour entraîner des concentrations plasmatiques proches de l'état d'équilibre le deuxième jour de traitement.
La dose quotidienne de DIFLUCAN 100 mg pour le traitement des infections autres que la candidose vaginale doit être basée sur l'organisme infectant et la réponse du patient au traitement. Le traitement doit être poursuivi jusqu'à ce que les paramètres cliniques ou les tests de laboratoire indiquent que l'infection fongique active a diminué. Une période de traitement inadéquate peut entraîner une récidive de l'infection active. Les patients atteints de SIDA et de méningite cryptococcique ou de candidose oropharyngée récurrente nécessitent généralement un traitement d'entretien pour prévenir les rechutes.
Candidose oropharyngée
La posologie recommandée de DIFLUCAN pour la candidose oropharyngée est de 200 mg le premier jour, suivie de 100 mg une fois par jour. Les signes cliniques de candidose oropharyngée disparaissent généralement en quelques jours, mais le traitement doit être poursuivi pendant au moins 2 semaines pour réduire le risque de rechute.
Candidose oesophagienne
La posologie recommandée de DIFLUCAN 200 mg pour la candidose œsophagienne est de 200 mg le premier jour, suivi de 100 mg une fois par jour. Des doses allant jusqu'à 400 mg/jour peuvent être utilisées, en fonction du jugement médical de la réponse du patient au traitement. Les patients atteints de candidose œsophagienne doivent être traités pendant au moins trois semaines et pendant au moins deux semaines après la résolution des symptômes.
Infections systémiques à Candida
Pour les infections systémiques à Candida, y compris la candidémie, la candidose disséminée et la pneumonie, la posologie thérapeutique optimale et la durée du traitement n'ont pas été établies. Dans des études ouvertes non comparatives portant sur un petit nombre de patients, des doses allant jusqu'à 400 mg par jour ont été utilisées.
Infections urinaires et péritonites
Pour le traitement des infections des voies urinaires à Candida et de la péritonite, des doses quotidiennes de 50 à 200 mg ont été utilisées dans des études ouvertes non comparatives portant sur un petit nombre de patients.
Méningite cryptococcique
La posologie recommandée pour le traitement de la méningite cryptococcique aiguë est de 400 mg le premier jour, suivie de 200 mg une fois par jour. Une posologie de 400 mg une fois par jour peut être utilisée, en fonction du jugement médical de la réponse du patient au traitement. La durée recommandée du traitement pour le traitement initial de la méningite cryptococcique est de 10 à 12 semaines après que le liquide céphalo-rachidien devient négatif à la culture. La posologie recommandée de DIFLUCAN 150 mg pour la suppression des rechutes de méningite cryptococcique chez les patients atteints du SIDA est de 200 mg une fois par jour.
Prophylaxie chez les patients subissant une greffe de moelle osseuse
La posologie quotidienne recommandée de DIFLUCAN pour la prévention de la candidose chez les patients subissant une greffe de moelle osseuse est de 400 mg, une fois par jour. Les patients chez qui une granulocytopénie sévère est anticipée (moins de 500 cellules neutrophiles/mm³) doivent commencer la prophylaxie par DIFLUCAN plusieurs jours avant le début prévu de la neutropénie et la poursuivre pendant 7 jours après que le nombre de neutrophiles dépasse 1000 cellules/mm³.
Posologie et administration chez les enfants
Le schéma d'équivalence de dose suivant doit généralement fournir une exposition équivalente chez les patients pédiatriques et adultes :
L'expérience avec DIFLUCAN chez les nouveau-nés est limitée aux études pharmacocinétiques chez les nouveau-nés prématurés. (Voir PHARMACOLOGIE CLINIQUE .) Sur la base de la demi-vie prolongée observée chez les nouveau-nés prématurés (âge gestationnel de 26 à 29 semaines), ces enfants, au cours des deux premières semaines de vie, devraient recevoir la même dose (mg/kg) que chez les enfants plus âgés, mais administrés toutes les 72 heures. Après les deux premières semaines, ces enfants doivent recevoir une dose une fois par jour. Aucune information concernant la pharmacocinétique de DIFLUCAN chez les nouveau-nés nés à terme n'est disponible.
Candidose oropharyngée
La posologie recommandée de DIFLUCAN 150 mg dans la candidose oropharyngée chez l'enfant est de 6 mg/kg le premier jour, suivi de 3 mg/kg une fois par jour. Le traitement doit être administré pendant au moins 2 semaines pour diminuer le risque de rechute.
Candidose oesophagienne
Pour le traitement de la candidose œsophagienne, la posologie recommandée de DIFLUCAN chez l'enfant est de 6 mg/kg le premier jour, suivie de 3 mg/kg une fois par jour. Des doses allant jusqu'à 12 mg/kg/jour peuvent être utilisées, en fonction du jugement médical de la réponse du patient au traitement. Les patients atteints de candidose œsophagienne doivent être traités pendant au moins trois semaines et pendant au moins 2 semaines après la résolution des symptômes.
Infections systémiques à Candida
Pour le traitement de la candidémie et des infections disséminées à Candida, des doses quotidiennes de 6 à 12 mg/kg/jour ont été utilisées dans une étude ouverte non comparative portant sur un petit nombre d'enfants.
Méningite cryptococcique
Pour le traitement de la méningite cryptococcique aiguë, la posologie recommandée est de 12 mg/kg le premier jour, suivie de 6 mg/kg une fois par jour. Une posologie de 12 mg/kg une fois par jour peut être utilisée, en fonction du jugement médical de la réponse du patient au traitement. La durée recommandée du traitement pour le traitement initial de la méningite cryptococcique est de 10 à 12 semaines après que le liquide céphalo-rachidien devient négatif à la culture. Pour la suppression des rechutes de méningite cryptococcique chez les enfants atteints du SIDA, la dose recommandée de DIFLUCAN est de 6 mg/kg une fois par jour.
Posologie chez les patients présentant une fonction rénale altérée
Le fluconazole est éliminé principalement par excrétion rénale sous forme inchangée. Il n'est pas nécessaire d'ajuster le traitement à dose unique pour la candidose vaginale en raison d'une fonction rénale altérée. Chez les patients insuffisants rénaux qui recevront plusieurs doses de DIFLUCAN, une dose de charge initiale de 50 mg à 400 mg doit être administrée. Après la dose de charge, la dose quotidienne (selon l'indication) doit être basée sur le tableau suivant :
Les patients sous hémodialyse doivent recevoir 100 % de la dose recommandée après chaque hémodialyse ; les jours sans dialyse, les patients doivent recevoir une dose réduite en fonction de leur clairance de la créatinine.
Il s'agit d'ajustements posologiques suggérés basés sur la pharmacocinétique suite à l'administration de doses multiples. Un ajustement supplémentaire peut être nécessaire en fonction de l'état clinique.
Lorsque la créatinine sérique est la seule mesure disponible de la fonction rénale, la formule suivante (basée sur le sexe, le poids et l'âge du patient) doit être utilisée pour estimer la clairance de la créatinine chez l'adulte :
Mâles: Poids (kg) × (140 – âge)/ 72 × créatinine sérique (mg/100 mL)
Femelles : 0,85 × au-dessus de la valeur
Bien que la pharmacocinétique du fluconazole n'ait pas été étudiée chez les enfants insuffisants rénaux, la réduction de la posologie chez les enfants insuffisants rénaux doit être parallèle à celle recommandée pour les adultes. La formule suivante peut être utilisée pour estimer la clairance de la créatinine chez les enfants :
× longueur ou hauteur linéaire (cm)/créatinine sérique (mg/100 mL)
(Où K = 0,55 pour les enfants de plus d'un an et 0,45 pour les nourrissons.)
Administration
DIFLUCAN 100 mg est administré par voie orale. DIFLUCAN peut être pris avec ou sans nourriture.
Instructions pour mélanger la suspension orale
Préparez une suspension au moment de la distribution comme suit : tapotez le flacon jusqu'à ce que toute la poudre s'écoule librement. Pour reconstituer, ajouter 24 ml d'eau distillée ou d'eau purifiée (USP) à la bouteille de fluconazole et agiter vigoureusement pour suspendre la poudre. Chaque bouteille délivrera 35 mL de suspension. Les concentrations des suspensions reconstituées sont les suivantes :
Remarque : bien agiter la suspension buvable avant utilisation. Conservez la suspension reconstituée entre 86°F (30°C) et 41°F (5°C) et jetez la portion inutilisée après 2 semaines. Protéger du gel.
COMMENT FOURNIE
DIFLUCAN 100mg Comprimés Les comprimés trapézoïdaux roses contenant 50, 100 ou 200 mg de fluconazole sont conditionnés en flacons ou en plaquettes thermoformées. Les comprimés de fluconazole à 150 mg sont roses et de forme ovale, conditionnés dans une plaquette unitaire à dose unique.
Les comprimés DIFLUCAN sont fournis comme suit :
DIFLUCAN 50 mg Comprimés : Gravé « DIFLUCAN » et « 50 » au recto et « ROERIG » au verso.
CDN 0049-3410-30 Bouteilles de 30
DIFLUCAN 100 mg Comprimés : Gravé « DIFLUCAN » et « 100 » au recto et « ROERIG » au verso.
CDN 0049-3420-30 Bouteilles de 30 CDN 0049-3420-41 Paquet de dose unitaire de 100
DIFLUCAN 150 mg Comprimés : Gravé « DIFLUCAN » et « 150 » au recto et « ROERIG » au verso.
CDN 0049-3500-79 Paquet de dose unitaire de 1
DIFLUCAN 200 mg Comprimés : Gravé « DIFLUCAN » et « 200 » au recto et « ROERIG » au verso.
CDN 0049-3430-30 Bouteilles de 30 CDN 0049-3430-41 Paquet de dose unitaire de 100
Stockage
Conservez les comprimés à une température inférieure à 86 °F (30 °C).
DIFLUCAN 100mg pour Suspension Buvable : DIFLUCAN pour suspension buvable est fourni sous forme de poudre à saveur d'orange pour fournir 35 mL par bouteille comme suit :
CDN 0049-3440-19 Fluconazole 350 mg par bouteille CDN 0049-3450-19 Fluconazole 1400 mg par bouteille
Stockage
Stocker la poudre sèche en dessous de 86°F (30°C). Conservez la suspension reconstituée entre 86°F (30°C) et 41°F (5°C) et jetez la portion inutilisée après 2 semaines. Protéger du gel.
Distribué par : Roerig Division of Pfizer Inc., NY, NY 10017. Révisé : octobre 2021
EFFETS SECONDAIRES
DIFLUCAN est généralement bien toléré.
Chez certains patients, en particulier ceux atteints de maladies sous-jacentes graves telles que le SIDA et le cancer, des modifications des résultats des tests de la fonction rénale et hématologique et des anomalies hépatiques ont été observées pendant le traitement par le fluconazole et les agents comparatifs, mais la signification clinique et la relation avec le traitement sont incertaines.
Chez les patients recevant une dose unique pour une candidose vaginale
Au cours des études cliniques comparatives menées aux Etats-Unis, 448 patientes atteintes de candidose vaginale ont été traitées par DIFLUCAN, 150 mg dose unique. L'incidence globale des effets secondaires possiblement liés à DIFLUCAN a été de 26 %. Chez 422 patients recevant des agents comparatifs actifs, l'incidence était de 16 %. Les effets indésirables liés au traitement les plus fréquemment signalés chez les patientes ayant reçu une dose unique de 150 mg de fluconazole pour une vaginite étaient les maux de tête (13 %), les nausées (7 %) et les douleurs abdominales (6 %). D'autres effets secondaires signalés avec une incidence égale ou supérieure à 1 % comprenaient la diarrhée (3 %), la dyspepsie (1 %), les étourdissements (1 %) et la perversion du goût (1 %). La plupart des effets indésirables signalés étaient d'intensité légère à modérée. De rares cas d'œdème de Quincke et de réaction anaphylactique ont été signalés dans l'expérience de commercialisation.
Chez les patients recevant des doses multiples pour d'autres infections
Seize pour cent des plus de 4 000 patients traités par DIFLUCAN (fluconazole) dans des essais cliniques de 7 jours ou plus ont présenté des événements indésirables. Le traitement a été interrompu chez 1,5 % des patients en raison d'événements cliniques indésirables et chez 1,3 % des patients en raison d'anomalies des tests de laboratoire.
Les événements indésirables cliniques ont été signalés plus fréquemment chez les patients infectés par le VIH (21 %) que chez les patients non infectés par le VIH (13 %) ; cependant, les schémas chez les patients infectés par le VIH et non infectés par le VIH étaient similaires. Les proportions de patients arrêtant le traitement en raison d'événements indésirables cliniques étaient similaires dans les deux groupes (1,5 %).
Les événements indésirables cliniques suivants liés au traitement sont survenus à une incidence de 1 % ou plus chez 4 048 patients recevant DIFLUCAN à 50 mg pendant 7 jours ou plus au cours des essais cliniques : nausées 3,7 %, maux de tête 1,9 %, éruption cutanée 1,8 %, vomissements 1,7 %, douleur 1,7 % et diarrhée 1,5 %.
Hépato-biliaire
Dans les essais cliniques combinés et l'expérience de commercialisation, de rares cas de réactions hépatiques graves ont été observés pendant le traitement par DIFLUCAN. (Voir AVERTISSEMENTS .) Le spectre de ces réactions hépatiques va de légères élévations transitoires des transaminases à l'hépatite clinique, la cholestase et l'insuffisance hépatique fulminante, y compris les décès. Des cas de réactions hépatiques mortelles ont été observés principalement chez des patients souffrant de troubles médicaux sous-jacents graves (principalement le SIDA ou une tumeur maligne) et souvent lors de la prise de plusieurs médicaments concomitants. Des réactions hépatiques transitoires, y compris l'hépatite et la jaunisse, sont survenues chez des patients sans autres facteurs de risque identifiables. Dans chacun de ces cas, la fonction hépatique est revenue à ses valeurs initiales à l'arrêt de DIFLUCAN.
Dans deux essais comparatifs évaluant l'efficacité de DIFLUCAN pour la suppression des rechutes de méningite cryptococcique, une augmentation statistiquement significative a été observée dans les taux médians d'AST (SGOT) d'une valeur initiale de 30 UI/L à 41 UI/L dans un essai et 34 UI/L à 66 UI/L dans l'autre. Le taux global d'élévations des transaminases sériques supérieures à 8 fois la limite supérieure de la normale était d'environ 1 % chez les patients traités au fluconazole dans les essais cliniques. Ces élévations sont survenues chez des patients atteints d'une maladie sous-jacente grave, principalement le SIDA ou des tumeurs malignes, dont la plupart recevaient plusieurs médicaments concomitants, dont beaucoup étaient connus pour être hépatotoxiques. L'incidence des transaminases sériques anormalement élevées était plus élevée chez les patients prenant DIFLUCAN en concomitance avec un ou plusieurs des médicaments suivants : rifampicine, phénytoïne, isoniazide, acide valproïque ou agents hypoglycémiants sulfonylurées oraux.
Expérience post-commercialisation
De plus, les événements indésirables suivants sont survenus au cours de l'expérience post-commercialisation.
Immunologique : Dans de rares cas, une anaphylaxie (incluant œdème de Quincke, œdème facial et prurit) a été rapportée.
Corps dans son ensemble : Asthénie, fatigue, fièvre, malaise.
Cardiovasculaire: Allongement QT, torsades de pointes. (Voir PRÉCAUTIONS .)
Système nerveux central: Convulsions, vertiges.
Hématopoïétique et lymphatique : Leucopénie, y compris neutropénie et agranulocytose, thrombocytopénie.
Métabolique: Hypercholestérolémie, hypertriglycéridémie, hypokaliémie.
Gastro-intestinal : Cholestase, bouche sèche, atteinte hépatocellulaire, dyspepsie, vomissements.
Autres sens : Perversion du goût.
Système musculo-squelettique: myalgie.
Système nerveux: Insomnie, paresthésie, somnolence, tremblements, vertiges.
Peau et appendices : Pustulose exanthématique aiguë généralisée, éruption médicamenteuse, y compris éruption médicamenteuse fixe, augmentation de la transpiration, troubles cutanés exfoliatifs, y compris syndrome de Stevens-Johnson et nécrolyse épidermique toxique, réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) (voir AVERTISSEMENTS ), alopécie.
Effets indésirables chez les enfants
Le schéma et l'incidence des événements indésirables et des anomalies de laboratoire enregistrés au cours des essais cliniques pédiatriques sont comparables à ceux observés chez les adultes.
Lors d'essais cliniques de phase II/III menés aux États-Unis et en Europe, 577 patients pédiatriques âgés de 1 jour à 17 ans ont été traités par DIFLUCAN à des doses allant jusqu'à 15 mg/kg/jour pendant 1 616 jours. Treize pour cent des enfants ont présenté des événements indésirables liés au traitement. Les événements les plus fréquemment signalés étaient les vomissements (5 %), les douleurs abdominales (3 %), les nausées (2 %) et la diarrhée (2 %). Le traitement a été interrompu chez 2,3 % des patients en raison d'événements cliniques indésirables et chez 1,4 % des patients en raison d'anomalies des tests de laboratoire. La majorité des anomalies de laboratoire liées au traitement étaient des élévations des transaminases ou de la phosphatase alcaline.
Pourcentage de patients présentant des effets secondaires liés au traitement
INTERACTIONS MÉDICAMENTEUSES
(Voir CONTRE-INDICATIONS .) Le fluconazole est un inhibiteur modéré du CYP2C9 et du CYP3A4. Le fluconazole est également un puissant inhibiteur du CYP2C19. Les patients traités par DIFLUCAN, qui sont également traités de façon concomitante par des médicaments à marge thérapeutique étroite métabolisés par le CYP2C9 et le CYP3A4, doivent être surveillés afin de détecter tout effet indésirable associé aux médicaments administrés en concomitance. En plus des interactions observées/documentées mentionnées ci-dessous, il existe un risque d'augmentation de la concentration plasmatique d'autres composés métabolisés par le CYP2C9, le CYP2C19 et le CYP3A4 co-administrés avec le fluconazole. Par conséquent, la prudence s'impose lors de l'utilisation de ces associations et les patients doivent être étroitement surveillés. L'effet inhibiteur enzymatique du fluconazole persiste 4 à 5 jours après l'arrêt du traitement au fluconazole en raison de la longue demi-vie du fluconazole. Des interactions médicamenteuses cliniquement ou potentiellement significatives entre DIFLUCAN 200 mg et les agents/classes suivants ont été observées et sont décrites plus en détail ci-dessous :
Alfentanil
Une étude a observé une réduction de la clairance et du volume de distribution ainsi qu'un allongement de la t½ de l'alfentanil après un traitement concomitant avec le fluconazole. Un mécanisme d'action possible est l'inhibition du CYP3A4 par le fluconazole. Un ajustement posologique de l'alfentanil peut être nécessaire.
Amiodarone
L'administration concomitante de fluconazole et d'amiodarone peut augmenter l'allongement de l'intervalle QT. La prudence s'impose si l'utilisation concomitante de fluconazole et d'amiodarone est nécessaire, notamment avec du fluconazole à forte dose (800 mg).
Amitriptyline, Nortriptyline
Le fluconazole augmente l'effet de l'amitriptyline et de la nortriptyline. La 5-nortriptyline et/ou la S-amitriptyline peuvent être dosées au début du traitement combiné et après 1 semaine. La posologie d'amitriptyline/nortriptyline doit être ajustée si nécessaire.
Amphotéricine B
L'administration concomitante de fluconazole et d'amphotéricine B chez des souris infectées normales et immunodéprimées a montré les résultats suivants : un petit effet antifongique additif dans l'infection systémique à Candida albicans, aucune interaction dans l'infection intracrânienne à Cryptococcus neoformans et antagonisme des deux médicaments dans l'infection systémique à A fumigatus. La signification clinique des résultats obtenus dans ces études est inconnue.
Azithromycine
Une étude ouverte, randomisée, croisée à trois voies chez 18 sujets sains a évalué l'effet d'une dose orale unique de 1200 mg d'azithromycine sur la pharmacocinétique d'une dose orale unique de 800 mg de fluconazole ainsi que les effets du fluconazole sur la pharmacocinétique d'azithromycine. Il n'y a pas eu d'interaction pharmacocinétique significative entre le fluconazole et l'azithromycine.
Bloqueurs de canaux calciques
Certains antagonistes des canaux calciques (nifédipine, isradipine, amlodipine, vérapamil et félodipine) sont métabolisés par le CYP3A4. Le fluconazole a le potentiel d'augmenter l'exposition systémique des antagonistes des canaux calciques. Une surveillance fréquente des événements indésirables est recommandée.
Carbamazépine
Le fluconazole inhibe le métabolisme de la carbamazépine et une augmentation de 30 % de la carbamazépine sérique a été observée. Il existe un risque de développer une toxicité à la carbamazépine. Un ajustement posologique de la carbamazépine peut être nécessaire en fonction des mesures de concentration/de l'effet.
Célécoxib
Lors d'un traitement concomitant par le fluconazole (200 mg par jour) et le célécoxib (200 mg), la Cmax et l'ASC du célécoxib ont augmenté de 68 % et 134 %, respectivement. La moitié de la dose de célécoxib peut être nécessaire en cas d'association avec le fluconazole.
Anticoagulants de type coumarine
Le temps de prothrombine peut être augmenté chez les patients recevant simultanément DIFLUCAN 150 mg et des anticoagulants de type coumarine. Dans l'expérience post-commercialisation, comme avec d'autres antifongiques azolés, des événements hémorragiques (ecchymoses, épistaxis, saignements gastro-intestinaux, hématurie et méléna) ont été rapportés en association avec des augmentations du temps de prothrombine chez des patients recevant du fluconazole en même temps que de la warfarine. Une surveillance attentive du temps de prothrombine chez les patients recevant DIFLUCAN 50 mg et des anticoagulants de type coumarine est recommandée. Un ajustement de la dose de warfarine peut être nécessaire. (Voir PHARMACOLOGIE CLINIQUE : Études sur les interactions médicamenteuses .)
Cyclophosphamide
Le traitement combiné avec le cyclophosphamide et le fluconazole entraîne une augmentation de la bilirubine sérique et de la créatinine sérique. L'association peut être utilisée tout en tenant davantage compte du risque d'augmentation de la bilirubine sérique et de la créatinine sérique.
Ciclosporine
DIFLUCAN 100 mg augmente significativement les taux de ciclosporine chez les patients transplantés rénaux avec ou sans insuffisance rénale. Une surveillance attentive des concentrations de cyclosporine et de la créatinine sérique est recommandée chez les patients recevant DIFLUCAN et de la cyclosporine. (Voir PHARMACOLOGIE CLINIQUE : Études sur les interactions médicamenteuses .) Cette combinaison peut être utilisée en réduisant la dose de cyclosporine en fonction de la concentration de cyclosporine.
Fentanyl
Un cas mortel d'interaction possible entre le fentanyl et le fluconazole a été signalé. L'auteur a estimé que le patient était décédé d'une intoxication au fentanyl. De plus, dans une étude croisée randomisée avec 12 volontaires sains, il a été montré que le fluconazole retardait significativement l'élimination du fentanyl. Une concentration élevée de fentanyl peut entraîner une dépression respiratoire.
Inhibiteurs de l'HMG-CoA réductase
Le risque de myopathie et de rhabdomyolyse augmente lorsque le fluconazole est co-administré avec des inhibiteurs de l'HMG-CoA réductase métabolisés par le CYP3A4, comme l'atorvastatine et la simvastatine, ou par le CYP2C9, comme la fluvastatine. Si un traitement concomitant est nécessaire, le patient doit être surveillé pour des symptômes de myopathie et de rhabdomyolyse et la créatinine kinase doit être surveillée. Les inhibiteurs de l'HMG-CoA réductase doivent être arrêtés si une augmentation marquée de la créatinine kinase est observée ou si une myopathie/rhabdomyolyse est diagnostiquée ou suspectée.
Hydrochlorothiazide
Dans une étude d'interaction pharmacocinétique, l'administration concomitante de doses multiples d'hydrochlorothiazide à des volontaires sains recevant du fluconazole a augmenté les concentrations plasmatiques de fluconazole de 40 %. Un effet de cette ampleur ne devrait pas nécessiter de modification du schéma posologique du fluconazole chez les sujets recevant des diurétiques concomitants.
Ibrutinib
Les inhibiteurs modérés du CYP3A4 tels que le fluconazole peuvent augmenter les concentrations plasmatiques d'ibrutinib et augmenter le risque d'effets indésirables associés à l'ibrutinib. Si l'ibrutinib et le fluconazole sont administrés simultanément, réduisez la dose d'ibrutinib comme indiqué dans les informations de prescription de l'ibrutinib et le patient doit être fréquemment surveillé pour tout effet indésirable associé à l'ibrutinib.
Lemborexant
L'administration concomitante de fluconazole a augmenté la Cmax et l'ASC du lemborexant d'environ 1,6 et 4,2 fois, respectivement, ce qui devrait augmenter le risque d'effets indésirables, tels que la somnolence. Eviter l'utilisation concomitante de DIFLUCAN avec le lemborexant.
Losartan
Le fluconazole inhibe le métabolisme du losartan en son métabolite actif (E-31 74) qui est responsable de la majeure partie de l'antagonisme des récepteurs de l'angiotensine II qui se produit pendant le traitement par le losartan. Les patients doivent faire surveiller leur tension artérielle en permanence.
Méthadone
Le fluconazole peut augmenter la concentration sérique de méthadone. Un ajustement posologique de la méthadone peut être nécessaire.
Médicaments anti-inflammatoires non stéroïdiens
La Cmax et l'ASC du flurbiprofène ont été augmentées de 23 % et 81 %, respectivement, lors de l'administration concomitante de fluconazole par rapport à l'administration de flurbiprofène seul. De même, la Cmax et l'ASC de l'isomère pharmacologiquement actif [S-(+)-ibuprofène] ont augmenté de 15 % et 82 %, respectivement, lorsque le fluconazole a été co-administré avec de l'ibuprofène racémique (400 mg) par rapport à l'administration d'ibuprofène racémique seul.
Bien qu'il n'ait pas été spécifiquement étudié, le fluconazole a le potentiel d'augmenter l'exposition systémique à d'autres anti-inflammatoires non stéroïdiens (AINS) qui sont métabolisés par le CYP2C9 (p. ex., naproxène, lornoxicam, méloxicam, diclofénac). Une surveillance fréquente des événements indésirables et de la toxicité liés aux AINS est recommandée. Un ajustement de la posologie des AINS peut être nécessaire.
Olaparib
Les inhibiteurs modérés du CYP3A4 tels que le fluconazole augmentent les concentrations plasmatiques d'olaparib ; l'utilisation concomitante n'est pas recommandée. Si l'association ne peut être évitée, réduire la dose d'olaparib comme indiqué dans les renseignements thérapeutiques de LYNPARZA® (olaparib).
Contraceptifs oraux
Deux études pharmacocinétiques avec un contraceptif oral combiné ont été réalisées en utilisant des doses multiples de fluconazole. Il n'y a pas eu d'effets pertinents sur le niveau hormonal dans l'étude sur le fluconazole à 50 mg, tandis qu'à 200 mg par jour, les ASC de l'éthinylestradiol et du lévonorgestrel ont augmenté de 40 % et 24 %, respectivement. Ainsi, il est peu probable que l'utilisation de doses multiples de fluconazole à ces doses ait un effet sur l'efficacité du contraceptif oral combiné.
Hypoglycémiants oraux
Une hypoglycémie cliniquement significative peut être précipitée par l'utilisation de DIFLUCAN avec des agents hypoglycémiants oraux; un décès a été rapporté par hypoglycémie en association avec l'utilisation combinée de DIFLUCAN 150 mg et de glyburide. DIFLUCAN réduit le métabolisme du tolbutamide, du glyburide et du glipizide et augmente la concentration plasmatique de ces agents. Lorsque DIFLUCAN 100 mg est utilisé en concomitance avec ces hypoglycémiants oraux ou d'autres sulfonylurées, les concentrations de glucose dans le sang doivent être étroitement surveillées et la dose de sulfonylurée doit être ajustée si nécessaire. (Voir PHARMACOLOGIE CLINIQUE : Études sur les interactions médicamenteuses .)
Phénytoïne
DIFLUCAN augmente les concentrations plasmatiques de la phénytoïne. Une surveillance attentive des concentrations de phénytoïne chez les patients recevant DIFLUCAN 50 mg et de la phénytoïne est recommandée. (Voir PHARMACOLOGIE CLINIQUE : Études sur les interactions médicamenteuses .)
Pimozide
Bien qu'elle n'ait pas été étudiée in vitro ou in vivo, l'administration concomitante de fluconazole et de pimozide peut entraîner une inhibition du métabolisme du pimozide. L'augmentation des concentrations plasmatiques de pimozide peut entraîner un allongement de l'intervalle QT et de rares occurrences de torsades de pointes. L'administration concomitante de fluconazole et de pimozide est contre-indiquée.
Prednisone
Il y a eu un rapport de cas selon lequel un patient transplanté hépatique traité avec de la prednisone a développé une insuffisance aiguë du cortex surrénalien lorsqu'un traitement de 3 mois avec du fluconazole a été interrompu. L'arrêt du fluconazole a probablement provoqué une activité accrue du CYP3A4 qui a entraîné une augmentation du métabolisme de la prednisone. Les patients sous traitement à long terme par fluconazole et prednisone doivent être étroitement surveillés pour une insuffisance corticosurrénalienne lors de l'arrêt du fluconazole.
Quinidine
Bien qu'elle n'ait pas été étudiée in vitro ou in vivo, l'administration concomitante de fluconazole et de quinidine peut entraîner une inhibition du métabolisme de la quinidine. L'utilisation de la quinidine a été associée à un allongement de l'intervalle QT et à de rares cas de torsades de pointes. L'administration concomitante de fluconazole et de quinidine est contre-indiquée. (Voir CONTRE-INDICATIONS .)
Rifabutine
Il a été rapporté qu'une interaction existe lorsque le fluconazole est administré en même temps que la rifabutine, entraînant une augmentation des taux sériques de rifabutine jusqu'à 80 %. Des cas d'uvéite ont été rapportés chez des patients auxquels du fluconazole et de la rifabutine ont été co-administrés. Les patients recevant simultanément de la rifabutine et du fluconazole doivent être étroitement surveillés. (Voir PHARMACOLOGIE CLINIQUE : Études sur les interactions médicamenteuses .)
Rifampine
La rifampicine améliore le métabolisme de DIFLUCAN administré simultanément. En fonction des circonstances cliniques, il convient d'envisager d'augmenter la dose de DIFLUCAN 200 mg lorsqu'il est administré avec la rifampicine. (Voir PHARMACOLOGIE CLINIQUE : Études sur les interactions médicamenteuses .)
Saquinavir
Le fluconazole augmente l'ASC du saquinavir d'environ 50 %, la Cmax d'environ 55 % et diminue la clairance du saquinavir d'environ 50 % en raison de l'inhibition du métabolisme hépatique du saquinavir par le CYP3A4 et de l'inhibition de la glycoprotéine P. Un ajustement posologique du saquinavir peut être nécessaire.
Benzodiazépines à courte durée d'action
Après administration orale de midazolam, le fluconazole a entraîné des augmentations substantielles des concentrations de midazolam et des effets psychomoteurs. Cet effet sur le midazolam semble être plus prononcé après administration orale de fluconazole qu'avec le fluconazole administré par voie intraveineuse. Si des benzodiazépines à courte durée d'action, qui sont métabolisées par le système du cytochrome P450, sont administrées de manière concomitante avec du fluconazole, il faut envisager de diminuer la posologie des benzodiazépines et les patients doivent être surveillés de manière appropriée. (Voir PHARMACOLOGIE CLINIQUE : Études sur les interactions médicamenteuses .)
sirolimus
Le fluconazole augmente les concentrations plasmatiques de sirolimus vraisemblablement en inhibant le métabolisme du sirolimus via le CYP3A4 et la glycoprotéine P. Cette association peut être utilisée avec un ajustement posologique du sirolimus en fonction des mesures effet/concentration.
Tacrolimus
Le fluconazole peut augmenter jusqu'à 5 fois les concentrations sériques du tacrolimus administré par voie orale en raison de l'inhibition du métabolisme du tacrolimus par le CYP3A4 dans les intestins. Aucun changement pharmacocinétique significatif n'a été observé lorsque le tacrolimus est administré par voie intraveineuse. Des taux accrus de tacrolimus ont été associés à une néphrotoxicité. La posologie du tacrolimus administré par voie orale doit être diminuée en fonction de la concentration de tacrolimus. (Voir PHARMACOLOGIE CLINIQUE : Études sur les interactions médicamenteuses .)
Théophylline
DIFLUCAN 50mg augmente les concentrations sériques de théophylline. Une surveillance attentive des concentrations sériques de théophylline chez les patients recevant DIFLUCAN 100 mg et théophylline est recommandée. (Voir PHARMACOLOGIE CLINIQUE : Études sur les interactions médicamenteuses .)
Tofacitinib
L'exposition systémique au tofacitinib est augmentée lorsque le tofacitinib est co-administré avec le fluconazole. Réduire la dose de tofacitinib lorsqu'il est administré en concomitance avec du fluconazole (c'est-à-dire de 5 mg deux fois par jour à 5 mg une fois par jour, comme indiqué sur l'étiquette de XELJANZ [tofacitinib]). (Voir PHARMACOLOGIE CLINIQUE : Études sur les interactions médicamenteuses .)
Tolvaptan
L'exposition plasmatique au tolvaptan est significativement augmentée (200 % de l'ASC ; 80 % de la Cmax) lorsque le tolvaptan, un substrat du CYP3A4, est co-administré avec le fluconazole, un inhibiteur modéré du CYP3A4. Cette interaction peut entraîner le risque d'une augmentation significative des effets indésirables associés au tolvaptan, notamment une diurèse importante, une déshydratation et une insuffisance rénale aiguë. Si le tolvaptan et le fluconazole sont administrés de manière concomitante, la dose de tolvaptan doit être réduite comme indiqué dans les informations de prescription du tolvaptan et le patient doit être fréquemment surveillé pour tout effet indésirable associé au tolvaptan.
Triazolam
Le fluconazole augmente l'ASC du triazolam (dose unique) d'environ 50 %, la Cmax de 20 % à 32 % et la t½ de 25 % à 50 % en raison de l'inhibition du métabolisme du triazolam. Des ajustements posologiques du triazolam peuvent être nécessaires.
Vinca Alcaloïdes
Bien qu'il n'ait pas été étudié, le fluconazole peut augmenter les concentrations plasmatiques des alcaloïdes de la pervenche (p. ex., vincristine et vinblastine) et entraîner une neurotoxicité, probablement due à un effet inhibiteur sur le CYP3A4.
Vitamine A
Sur la base d'un rapport de cas chez un patient recevant une thérapie combinée avec de l'acide tout-trans-rétinoïde (une forme acide de la vitamine A) et du fluconazole, des effets indésirables liés au système nerveux central (SNC) se sont développés sous la forme d'une pseudo-tumeur cérébrale, qui a disparu après arrêt du traitement par fluconazole. Cette association peut être utilisée mais l'incidence des effets indésirables liés au SNC doit être prise en compte.
Voriconazole
Éviter l'administration concomitante de voriconazole et de fluconazole. La surveillance des effets indésirables et de la toxicité liés au voriconazole est recommandée ; en particulier si le voriconazole est débuté dans les 24 h suivant la dernière dose de fluconazole. (Voir PHARMACOLOGIE CLINIQUE : Études sur les interactions médicamenteuses .)
Zidovudine
Le fluconazole augmente la Cmax et l'ASC de la zidovudine de 84 % et 74 %, respectivement, en raison d'une diminution d'environ 45 % de la clairance de la zidovudine par voie orale. La demi-vie de la zidovudine a également été prolongée d'environ 128 % après un traitement combiné avec le fluconazole. Les patients recevant cette association doivent être surveillés pour le développement d'effets indésirables liés à la zidovudine. Une réduction de la posologie de la zidovudine peut être envisagée.

Les médecins doivent savoir qu'aucune étude d'interaction avec des médicaments autres que ceux énumérés dans la section PHARMACOLOGIE CLINIQUE n'a été menée, mais de telles interactions peuvent se produire.
AVERTISSEMENTS
PRÉCAUTIONS
Général
Certains azolés, dont le fluconazole, ont été associés à un allongement de l'intervalle QT sur l'électrocardiogramme. Le fluconazole provoque un allongement de l'intervalle QT via l'inhibition du courant du canal rectificateur potassique (Ikr). L'allongement de l'intervalle QT provoqué par d'autres médicaments (tels que l'amiodarone) peut être amplifié via l'inhibition du cytochrome P450 (CYP) 3A4. (Voir PRÉCAUTIONS : Interactions médicamenteuses .) Au cours de la surveillance post-commercialisation, de rares cas d'allongement de l'intervalle QT et de torsades de pointes ont été signalés chez des patients prenant du fluconazole. La plupart de ces rapports concernaient des patients gravement malades présentant de multiples facteurs de risque confondants, tels qu'une cardiopathie structurelle, des anomalies électrolytiques et des médicaments concomitants pouvant y avoir contribué. Les patients souffrant d'hypokaliémie et d'insuffisance cardiaque avancée présentent un risque accru de survenue d'arythmies ventriculaires potentiellement mortelles et de torsades de pointes.
Le fluconazole doit être administré avec prudence aux patients présentant ces affections potentiellement proarythmiques.
L'utilisation concomitante de fluconazole et d'érythromycine peut augmenter le risque de cardiotoxicité (allongement de l'intervalle QT, torsades de pointes) et par conséquent de mort cardiaque subite. Cette combinaison doit être évitée.
Le fluconazole doit être administré avec prudence chez les patients présentant un dysfonctionnement rénal.
Une insuffisance surrénalienne a été rapportée chez des patients recevant des azoles, dont le fluconazole. Des cas réversibles d'insuffisance surrénalienne ont été rapportés chez des patients recevant du fluconazole.
DIFLUCAN 100 mg poudre pour suspension buvable contient du saccharose et ne doit pas être utilisé chez les patients présentant un déficit en fructose héréditaire, une malabsorption du glucose/galactose et un déficit en sucrase-isomaltase.
Lors de la conduite de véhicules ou de l'utilisation de machines, il convient de tenir compte du fait que des étourdissements ou des convulsions peuvent parfois survenir.
Une seule dose
La commodité et l'efficacité du schéma posologique de comprimés oraux à dose unique de fluconazole pour le traitement des infections vaginales à levures doivent être mises en balance avec l'acceptabilité d'une incidence plus élevée d'événements indésirables liés au médicament avec DIFLUCAN (26 %) par rapport aux agents intravaginaux (16 %) aux États-Unis. études cliniques comparatives. (Voir EFFETS INDÉSIRABLES et Etudes cliniques .)
Toxicologie non clinique
Carcinogenèse, mutagenèse et altération de la fertilité
Le fluconazole n'a montré aucun signe de potentiel carcinogène chez les souris et les rats traités par voie orale pendant 24 mois à des doses de 2,5 mg/kg/jour, 5 mg/kg/jour ou 10 mg/kg/jour (environ 2 à 7 fois la dose humaine recommandée). ). Les rats mâles traités avec 5 mg/kg/jour et 10 mg/kg/jour ont présenté une incidence accrue d'adénomes hépatocellulaires.
Le fluconazole, avec ou sans activation métabolique, s'est révélé négatif dans les tests de mutagénicité sur quatre souches de S. typhimurium et sur le système de lymphome de souris L5178Y. Des études cytogénétiques in vivo (cellules de moelle osseuse murine, après administration orale de fluconazole) et in vitro (lymphocytes humains exposés au fluconazole à 1000 mcg/mL) n'ont montré aucun signe de mutations chromosomiques.
Le fluconazole n'a pas affecté la fertilité des rats mâles ou femelles traités par voie orale avec des doses quotidiennes de 5 mg/kg, 10 mg/kg ou 20 mg/kg ou avec des doses parentérales de 5 mg/kg, 25 mg/kg ou 75 mg /kg, bien que le début de la parturition ait été légèrement retardé à 20 mg/kg PO. Dans une étude périnatale intraveineuse chez le rat à 5 mg/kg, 20 mg/kg et 40 mg/kg, une dystocie et un allongement de la parturition ont été observés chez quelques mères à 20 mg/kg (environ 5 à 15 fois la dose humaine recommandée ) et 40 mg/kg, mais pas à 5 mg/kg. Les perturbations de la parturition se sont traduites par une légère augmentation du nombre de petits mort-nés et une diminution de la survie néonatale à ces niveaux de dose. Les effets sur la parturition chez les rats sont cohérents avec la propriété de réduction des œstrogènes spécifique à l'espèce produite par de fortes doses de fluconazole. Un tel changement hormonal n'a pas été observé chez les femmes traitées par le fluconazole. (Voir PHARMACOLOGIE CLINIQUE .)
Grossesse
Effets tératogènes
Potentiel de préjudice fœtal
L'utilisation pendant la grossesse doit être évitée, sauf chez les patientes atteintes d'infections fongiques graves ou potentiellement mortelles chez qui le fluconazole peut être utilisé si le bénéfice attendu l'emporte sur le risque possible pour le fœtus. Quelques rapports de cas publiés décrivent un schéma d'anomalies congénitales distinctes chez les nourrissons exposés in utero à de fortes doses de fluconazole maternel (400 à 800 mg/jour) pendant la majeure partie ou la totalité du premier trimestre. Ces anomalies rapportées sont similaires à celles observées dans les études animales. Des mesures contraceptives efficaces doivent être envisagées chez les femmes en âge de procréer traitées par DIFLUCAN 400 à 800 mg/jour et doivent être poursuivies pendant toute la durée du traitement et pendant environ 1 semaine (5 à 6 demi-vies) après la dernière dose. Si DIFLUCAN est utilisé pendant la grossesse, ou si la patiente tombe enceinte pendant qu'elle prend le médicament, la patiente doit être informée du risque potentiel pour le fœtus. Des avortements spontanés et des anomalies congénitales ont été suggérés comme risques potentiels associés à 150 mg de fluconazole en dose unique ou répétée au cours du premier trimestre de la grossesse sur la base d'études épidémiologiques rétrospectives. Il n'y a pas d'études adéquates et bien contrôlées de DIFLUCAN 150 mg chez la femme enceinte. (Voir AVERTISSEMENTS : Potentiel de préjudice fœtal .)
Données humaines
Les rapports de cas décrivent un schéma distinctif et rare de malformations congénitales chez les nourrissons dont les mères ont reçu du fluconazole à forte dose (400 à 800 mg/jour) pendant la majeure partie ou la totalité du premier trimestre de la grossesse. Les caractéristiques observées chez ces nourrissons comprennent une brachycéphalie, un faciès anormal, un développement anormal du crâne, une fente palatine, une courbure fémorale, des côtes fines et des os longs, une arthrogrypose et une cardiopathie congénitale. Ces effets sont similaires à ceux observés dans les études animales.
Des études épidémiologiques suggèrent un risque potentiel d'avortement spontané et d'anomalies congénitales chez les nourrissons dont les mères ont été traitées avec 150 mg de fluconazole en dose unique ou répétée au cours du premier trimestre, mais ces études épidémiologiques ont des limites et ces résultats n'ont pas été confirmés dans des études cliniques contrôlées. essais.
Données animales
Le fluconazole a été administré par voie orale à des lapines gravides pendant l'organogenèse dans deux études à des doses de 5 mg/kg, 10 mg/kg et 20 mg/kg et à 5 mg/kg, 25 mg/kg et 75 mg/kg, respectivement. Le gain de poids maternel était altéré à toutes les doses (environ 0,25 à 4 fois la dose clinique de 400 mg sur la base de la comparaison de la surface corporelle [BSA]), et des avortements se sont produits à 75 mg/kg (environ 4 fois la dose clinique de 400 mg sur la base de BSA); aucun effet fœtal indésirable n'a été observé.
Dans plusieurs études au cours desquelles des rates gravides ont reçu du fluconazole par voie orale pendant l'organogenèse, le gain de poids maternel a été altéré et le poids placentaire a augmenté à 25 mg/kg. Il n'y a eu aucun effet sur le fœtus à 5 mg/kg ou 10 mg/kg; des augmentations des variantes anatomiques fœtales (côtes surnuméraires, dilatation du bassinet du rein) et des retards d'ossification ont été observés à 25 mg/kg et 50 mg/kg et à des doses supérieures. À des doses allant de 80 à 320 mg/kg (environ 2 à 8 fois la dose clinique de 400 mg basée sur la surface corporelle), la mortalité embryonnaire chez le rat a été augmentée et les anomalies fœtales comprenaient des côtes ondulées, une fente palatine et une ossification craniofaciale anormale. Ces effets sont cohérents avec l'inhibition de la synthèse des œstrogènes chez les rats et peuvent être le résultat d'effets connus de la baisse des œstrogènes sur la grossesse, l'organogenèse et la parturition.
Mères allaitantes
Le fluconazole était présent à de faibles niveaux dans le lait maternel après l'administration d'une dose unique de 150 mg, d'après les données d'une étude menée chez 10 femmes allaitantes qui ont interrompu temporairement ou définitivement l'allaitement de 5 jours à 19 mois après l'accouchement. La dose quotidienne estimée de fluconazole pour le nourrisson provenant du lait maternel (en supposant une consommation moyenne de lait de 150 ml/kg/jour) basée sur la concentration maximale moyenne dans le lait (2,61 mcg/mL [intervalle : 1,57 à 3,65 mcg/mL] à 5,2 heures après dose) était de 0,39 mg/kg/jour, soit environ 13 % de la dose pédiatrique recommandée pour la candidose oropharyngée. (La dose pédiatrique indiquée est de 6 mg/kg/jour le premier jour, suivie de 3 mg/kg/jour ; la dose infantile estimée est de 13 % de la dose d'entretien de 3 mg/kg/jour). Il n'y a pas de données sur les taux de fluconazole dans le lait après une utilisation répétée ou après une dose élevée de fluconazole. Une enquête publiée portant sur 96 femmes allaitantes traitées avec du fluconazole 150 mg un jour sur deux (moyenne de 7,3 gélules [fourchette de 1 à 29 gélules]) pour une candidose mammaire associée à l'allaitement n'a rapporté aucun effet indésirable grave chez les nourrissons. La prudence s'impose lorsque DIFLUCAN est administré à une femme qui allaite.
Utilisation pédiatrique
Une étude ouverte, randomisée et contrôlée a montré que DIFLUCAN 100 mg était efficace dans le traitement de la candidose oropharyngée chez les enfants de 6 mois à 13 ans. (Voir Etudes cliniques .)
L'utilisation de DIFLUCAN 200 mg chez l'enfant atteint de méningite cryptococcique, d'œsophagite à Candida ou d'infections systémiques à Candida est étayée par l'efficacité démontrée pour ces indications chez l'adulte et par les résultats de plusieurs petites études cliniques pédiatriques non comparatives. De plus, des études pharmacocinétiques chez l'enfant (voir PHARMACOLOGIE CLINIQUE ) ont établi une proportionnalité de dose entre les enfants et les adultes. (Voir DOSAGE ET ADMINISTRATION .)
Dans une étude non comparative portant sur des enfants atteints d'infections fongiques systémiques graves, dont la plupart étaient des candidémies, l'efficacité de DIFLUCAN a été similaire à celle rapportée pour le traitement des candidémies chez l'adulte. Sur 17 sujets avec une candidémie confirmée par culture, 11 sur 14 (79 %) avec des symptômes de base (3 étaient asymptomatiques) ont eu une guérison clinique ; 13/15 (87 %) des patients évaluables ont eu une guérison mycologique à la fin du traitement, mais deux de ces patients ont rechuté à 10 et 18 jours, respectivement, après l'arrêt du traitement.
L'efficacité de DIFLUCAN pour la suppression de la méningite cryptococcique a été couronnée de succès chez 4 des 5 enfants traités dans une étude d'utilisation compassionnelle du fluconazole pour le traitement de mycoses potentiellement mortelles ou graves. Il n'existe aucune information concernant l'efficacité du fluconazole pour le traitement primaire de la méningite cryptococcique chez l'enfant.
Le profil de tolérance de DIFLUCAN 200 mg chez l'enfant a été étudié chez 577 enfants âgés de 1 jour à 17 ans ayant reçu des doses allant de 1 à 15 mg/kg/jour pendant 1 à 1 616 jours. (Voir EFFETS INDÉSIRABLES .)
L'efficacité de DIFLUCAN n'a pas été établie chez les nourrissons de moins de 6 mois. (Voir PHARMACOLOGIE CLINIQUE .) Un petit nombre de patients (29) âgés de 1 jour à 6 mois ont été traités en toute sécurité par DIFLUCAN.
Utilisation gériatrique
Chez les patients non atteints du SIDA, les effets secondaires possiblement liés au traitement par le fluconazole ont été signalés chez moins de patients âgés de 65 ans et plus (9 %, n = 339) que chez les patients plus jeunes (14 %, n = 2 240). Cependant, il n'y avait pas de différence constante entre les patients plus âgés et plus jeunes en ce qui concerne les effets secondaires individuels. Parmi les effets secondaires les plus fréquemment signalés (> 1 %), les éruptions cutanées, les vomissements et la diarrhée sont survenus chez de plus grandes proportions de patients âgés. Des proportions similaires de patients âgés (2,4 %) et de patients plus jeunes (1,5 %) ont interrompu le traitement par le fluconazole en raison d'effets secondaires. Dans l'expérience post-commercialisation, les rapports spontanés d'anémie et d'insuffisance rénale aiguë étaient plus fréquents chez les patients âgés de 65 ans ou plus que chez ceux âgés de 12 à 65 ans. En raison du caractère volontaire des déclarations et de l'augmentation naturelle de l'incidence de l'anémie et de l'insuffisance rénale chez les personnes âgées, il n'est cependant pas possible d'établir une relation causale avec l'exposition au médicament.
Les essais cliniques contrôlés du fluconazole n'ont pas inclus un nombre suffisant de patients âgés de 65 ans et plus pour évaluer s'ils répondent différemment des patients plus jeunes dans chaque indication. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes.
Le fluconazole est principalement éliminé par excrétion rénale sous forme inchangée. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises pour ajuster la dose en fonction de la clairance de la créatinine. Il peut être utile de surveiller la fonction rénale. (Voir PHARMACOLOGIE CLINIQUE et DOSAGE ET ADMINISTRATION .)
SURDOSAGE
Des cas de surdosage de fluconazole accompagnés d'hallucinations et de comportements paranoïaques ont été rapportés.
En cas de surdosage, un traitement symptomatique (avec mesures de soutien et lavage gastrique si cliniquement indiqué) doit être institué.
Le fluconazole est en grande partie excrété dans l'urine. Une séance d'hémodialyse de 3 heures diminue les taux plasmatiques d'environ 50 %.
Chez les souris et les rats recevant de très fortes doses de fluconazole, les effets cliniques chez les deux espèces comprenaient une diminution de la motilité et de la respiration, un ptosis, un larmoiement, une salivation, une incontinence urinaire, une perte du réflexe de redressement et une cyanose ; la mort était parfois précédée de convulsions cloniques.
CONTRE-INDICATIONS
DIFLUCAN (fluconazole) est contre-indiqué chez les patients qui ont manifesté une hypersensibilité au fluconazole ou à l'un de ses excipients. Il n'y a aucune information concernant l'hypersensibilité croisée entre le fluconazole et d'autres agents antifongiques azolés. La prudence s'impose lors de la prescription de DIFLUCAN aux patients présentant une hypersensibilité aux autres azolés. L'administration concomitante d'autres médicaments connus pour allonger l'intervalle QT et métabolisés par l'enzyme CYP3A4 tels que l'érythromycine, le pimozide et la quinidine est contre-indiquée chez les patients recevant du fluconazole. (Voir PHARMACOLOGIE CLINIQUE : Études sur les interactions médicamenteuses et PRÉCAUTIONS .)
PHARMACOLOGIE CLINIQUE
Pharmacocinétique et métabolisme
Les propriétés pharmacocinétiques du fluconazole sont similaires après administration par voie intraveineuse ou orale. Chez des volontaires sains, la biodisponibilité du fluconazole administré par voie orale est supérieure à 90 % par rapport à l'administration intraveineuse. La bioéquivalence a été établie entre le comprimé de 100 mg et les deux dosages de suspension lorsqu'ils sont administrés en une seule dose de 200 mg.
Les concentrations plasmatiques maximales (Cmax) chez les volontaires sains à jeun surviennent entre 1 et 2 heures avec une demi-vie d'élimination plasmatique terminale d'environ 30 heures (intervalle : 20 à 50 heures) après administration orale.
Chez des volontaires sains à jeun, l'administration d'une dose orale unique de 400 mg de DIFLUCAN (fluconazole) conduit à une Cmax moyenne de 6,72 mcg/mL (intervalle : 4,12 à 8,08 mcg/mL) et après des doses orales uniques de 50 à 400 mg, le fluconazole les concentrations plasmatiques et l'aire sous la courbe concentration plasmatique-temps (ASC) sont proportionnelles à la dose.
Les données sur la Cmax et l'ASC d'une étude sur les effets des aliments impliquant l'administration de comprimés DIFLUCAN (fluconazole) à des volontaires sains à jeun et avec un repas riche en graisses ont indiqué que l'exposition au médicament n'est pas affectée par les aliments. Par conséquent, DIFLUCAN peut être pris sans tenir compte des repas. (Voir DOSAGE ET ADMINISTRATION .)
Les concentrations à l'état d'équilibre sont atteintes dans les 5 à 10 jours suivant des doses orales de 50 à 400 mg administrées une fois par jour. L'administration d'une dose de charge (le jour 1) de deux fois la dose quotidienne habituelle entraîne des concentrations plasmatiques proches de l'état d'équilibre le deuxième jour. Le volume apparent de distribution du fluconazole se rapproche de celui de l'eau corporelle totale. La liaison aux protéines plasmatiques est faible (11 à 12 %). Après des doses orales uniques ou multiples pendant 14 jours maximum, le fluconazole pénètre dans tous les liquides organiques étudiés (voir tableau ci-dessous ). Chez des volontaires sains, les concentrations salivaires de fluconazole étaient égales ou légèrement supérieures aux concentrations plasmatiques, quelle que soit la dose, la voie ou la durée de l'administration. Chez les patients atteints de bronchectasie, les concentrations de fluconazole dans les expectorations après une dose orale unique de 150 mg étaient égales aux concentrations plasmatiques à la fois 4 et 24 heures après l'administration. Chez les patients atteints de méningite fongique, les concentrations de fluconazole dans le liquide céphalo-rachidien (LCR) représentent environ 80 % des concentrations plasmatiques correspondantes.
Une dose orale unique de 150 mg de fluconazole administrée à 27 patientes a pénétré dans le tissu vaginal, entraînant des rapports tissu/plasma allant de 0,94 à 1,14 au cours des 48 premières heures suivant l'administration.
Une dose orale unique de 150 mg de fluconazole administrée à 14 patientes a pénétré dans les sécrétions vaginales, entraînant des rapports liquide/plasma allant de 0,36 à 0,71 au cours des 72 premières heures suivant l'administration.
Chez les volontaires sains, le fluconazole est éliminé principalement par excrétion rénale, environ 80 % de la dose administrée apparaissant dans l'urine sous forme inchangée. Environ 11 % de la dose est excrétée dans l'urine sous forme de métabolites.
La pharmacocinétique du fluconazole est nettement affectée par la réduction de la fonction rénale. Il existe une relation inverse entre la demi-vie d'élimination et la clairance de la créatinine. La dose de DIFLUCAN peut devoir être réduite chez les patients présentant une fonction rénale altérée. (Voir DOSAGE ET ADMINISTRATION .) Une séance d'hémodialyse de 3 heures diminue les concentrations plasmatiques d'environ 50 %.
Chez des volontaires sains, l'administration de DIFLUCAN (doses allant de 200 mg à 400 mg une fois par jour pendant 14 jours maximum) a été associée à des effets faibles et irréguliers sur les concentrations de testostérone, les concentrations de corticostéroïdes endogènes et la réponse du cortisol stimulée par l'hormone adrénocorticotrope (ACTH).
Pharmacocinétique chez les enfants
Chez les enfants, les données pharmacocinétiques suivantes {Moyenne (%cv)} ont été rapportées :
La clairance corrigée en fonction du poids corporel n'a pas été affectée par l'âge dans ces études. La clairance corporelle moyenne chez les adultes est de 0,23 (17 %) mL/min/kg.
Chez les nouveau-nés prématurés (âge gestationnel de 26 à 29 semaines), la clairance moyenne (% cv) dans les 36 heures suivant la naissance était de 0,180 (35 %, N = 7) ml/min/kg, ce qui augmentait avec le temps jusqu'à une moyenne de 0,218 ( 31 %, N = 9) mL/min/kg six jours plus tard et 0,333 (56 %, N = 4) mL/min/kg 12 jours plus tard. De même, la demi-vie était de 73,6 heures, diminuant avec le temps pour atteindre une moyenne de 53,2 heures six jours plus tard et de 46,6 heures 12 jours plus tard.
Pharmacocinétique chez les personnes âgées
Une étude pharmacocinétique a été menée chez 22 sujets âgés de 65 ans ou plus recevant une dose orale unique de 50 mg de fluconazole. Dix de ces patients recevaient en concomitance des diurétiques. La Cmax était de 1,54 mcg/mL et s'est produite 1,3 heure après l'administration de la dose. L'ASC moyenne était de 76,4 ± 20,3 mcg•h/mL et la demi-vie terminale moyenne était de 46,2 heures. Ces valeurs de paramètres pharmacocinétiques sont supérieures aux valeurs analogues rapportées pour de jeunes volontaires masculins normaux. L'administration concomitante de diurétiques n'a pas modifié significativement l'ASC ou la Cmax. De plus, la clairance de la créatinine (74 ml/min), le pourcentage de médicament retrouvé inchangé dans l'urine (0 à 24 heures, 22 %) et les estimations de la clairance rénale du fluconazole (0,124 ml/min/kg) chez les personnes âgées étaient généralement plus faibles que celles des bénévoles plus jeunes. Ainsi, l'altération de la disposition du fluconazole chez les personnes âgées semble être liée à la fonction rénale réduite caractéristique de ce groupe. Un tracé de la demi-vie d'élimination terminale de chaque sujet par rapport à la clairance de la créatinine par rapport à la demi-vie prédite - la courbe de clairance de la créatinine dérivée de sujets normaux et de sujets présentant divers degrés d'insuffisance rénale a indiqué que 21 des 22 sujets tombaient dans la limite de confiance de 95 % des courbes de demi-vie prédites de la clairance de la créatinine. Ces résultats sont cohérents avec l'hypothèse selon laquelle les valeurs plus élevées des paramètres pharmacocinétiques observées chez les sujets âgés par rapport aux jeunes volontaires masculins normaux sont dues à la diminution de la fonction rénale attendue chez les personnes âgées.
Études sur les interactions médicamenteuses
(Voir INTERACTIONS MÉDICAMENTEUSES )
Contraceptifs oraux
Des contraceptifs oraux ont été administrés en une dose unique avant et après l'administration orale de DIFLUCAN 50 mg une fois par jour pendant 10 jours chez 10 femmes en bonne santé. Il n'y avait pas de différence significative dans l'ASC de l'éthinylestradiol ou du lévonorgestrel après l'administration de 50 mg de DIFLUCAN. L'augmentation moyenne de l'ASC de l'éthinylestradiol était de 6 % (intervalle : - 47 à 108 %) et l'ASC du lévonorgestrel a augmenté de 17 % (intervalle : - 33 à 141 %).
Dans une deuxième étude, vingt-cinq femmes normales ont reçu des doses quotidiennes de comprimés de 200 mg de DIFLUCAN à 150 mg ou de placebo pendant deux périodes de dix jours. Les cycles de traitement étaient espacés d'un mois, tous les sujets recevant DIFLUCAN pendant un cycle et un placebo pendant l'autre. L'ordre de traitement de l'étude était aléatoire. Des doses uniques d'un comprimé contraceptif oral contenant du lévonorgestrel et de l'éthinylestradiol ont été administrées le dernier jour de traitement (jour 10) des deux cycles. Suite à l'administration de 200 mg de DIFLUCAN, l'augmentation moyenne en pourcentage de l'ASC du lévonorgestrel par rapport au placebo était de 25 % (intervalle : - 12 à 82 %) et l'augmentation moyenne en pourcentage de l'éthinylestradiol par rapport au placebo était de 38 % (intervalle : -11 à 101%). Ces deux augmentations étaient statistiquement significativement différentes du placebo.
Une troisième étude a évalué l'interaction potentielle d'une dose hebdomadaire de 300 mg de fluconazole chez 21 femmes normales prenant un contraceptif oral contenant de l'éthinylestradiol et de la noréthindrone. Dans cette étude croisée, randomisée, en double aveugle, contrôlée par placebo, menée sur trois cycles de traitement contraceptif oral, l'administration de fluconazole a entraîné de légères augmentations des ASC moyennes de l'éthinylestradiol et de la noréthindrone par rapport à l'administration d'un placebo similaire. Les ASC moyennes de l'éthinylestradiol et de la noréthindrone ont augmenté de 24 % (intervalle d'IC à 95 % : 18 à 31 %) et de 13 % (intervalle d'IC à 95 % : 8 à 18 %), respectivement, par rapport au placebo. Le traitement au fluconazole n'a entraîné aucune diminution de l'ASC de l'éthinylestradiol chez aucun sujet individuel de cette étude par rapport à l'administration d'un placebo. Les valeurs individuelles de l'ASC de la noréthindrone ont diminué très légèrement (
Cimétidine
DIFLUCAN 100 mg a été administré en une seule dose orale et deux heures après une dose unique de cimétidine 400 mg à six volontaires sains de sexe masculin. Après l'administration de cimétidine, il y a eu une diminution significative de l'ASC et de la Cmax du fluconazole. Il y avait une diminution moyenne ± ET de l'ASC du fluconazole de 13 % ± 11 % (intervalle : - 3,4 à - 31 %) et la Cmax a diminué de 19 % ± 14 % (intervalle : - 5 à - 40 %). Cependant, l'administration de cimétidine 600 mg à 900 mg par voie intraveineuse sur une période de quatre heures (d'une heure avant à 3 heures après une dose orale unique de DIFLUCAN 200 mg) n'a pas affecté la biodisponibilité ou la pharmacocinétique du fluconazole chez 24 volontaires sains de sexe masculin. .
Antiacide
L'administration de Maalox® (20 mL) à 14 hommes volontaires sains immédiatement avant une dose unique de DIFLUCAN 100 mg n'a eu aucun effet sur l'absorption ou l'élimination du fluconazole.
Hydrochlorothiazide
L'administration orale concomitante de 100 mg de DIFLUCAN et de 50 mg d'hydrochlorothiazide pendant 10 jours chez 13 volontaires normaux a entraîné une augmentation significative de l'ASC et de la Cmax du fluconazole par rapport à DIFLUCAN administré seul. Il y avait une augmentation moyenne ± ET de l'ASC et de la Cmax du fluconazole de 45 % ± 31 % (intervalle : 19 à 114 %) et 43 % ± 31 % (intervalle : 19 à 122 %), respectivement. Ces changements sont attribués à une réduction moyenne ± écart-type de la clairance rénale de 30 % ± 12 % (intervalle : - 10 à - 50 %).
Rifampine
L'administration d'une dose orale unique de 200 mg de DIFLUCAN 200 mg après 15 jours de rifampicine administrée à raison de 600 mg par jour chez huit volontaires sains de sexe masculin a entraîné une diminution significative de l'ASC du fluconazole et une augmentation significative de la clairance orale apparente du fluconazole. Il y avait une réduction moyenne ± ET de l'ASC du fluconazole de 23 % ± 9 % (intervalle : -13 à -42 %). La clairance orale apparente du fluconazole a augmenté de 32 % ± 17 % (intervalle : 16 à 72 %). La demi-vie du fluconazole a diminué de 33,4 ± 4,4 heures à 26,8 ± 3,9 heures. (Voir PRÉCAUTIONS .)
Warfarine
Il y a eu une augmentation significative de la réponse du temps de prothrombine (aire sous la courbe temps de prothrombine) après une dose unique de warfarine (15 mg) administrée à 13 volontaires masculins normaux après DIFLUCAN oral 200 mg administré quotidiennement pendant 14 jours par rapport à l'administration de warfarine seule. Il y avait une augmentation moyenne ± ET de la réponse du temps de prothrombine (aire sous la courbe temps de prothrombine) de 7 % ± 4 % (intervalle : - 2 à 13 %). (Voir PRÉCAUTIONS .) La moyenne est basée sur les données de 12 sujets, car l'un des 13 sujets a connu une augmentation de 2 fois de sa réponse au temps de prothrombine.
Phénytoïne
L'ASC de la phénytoïne a été déterminée après 4 jours d'administration de phénytoïne (200 mg par jour, par voie orale pendant 3 jours suivis de 250 mg par voie intraveineuse pour une dose) avec et sans administration de fluconazole (DIFLUCAN par voie orale 200 mg par jour pendant 16 jours) chez 10 hommes normaux bénévoles. Il y avait une augmentation significative de l'ASC de la phénytoïne. L'augmentation moyenne ± ET de l'ASC de la phénytoïne était de 88 % ± 68 % (intervalle : 16 à 247 %). L'ampleur absolue de cette interaction est inconnue en raison de la disposition intrinsèquement non linéaire de la phénytoïne. (Voir PRÉCAUTIONS .)
Ciclosporine
L'ASC et la Cmax de la cyclosporine ont été déterminées avant et après l'administration de 200 mg de fluconazole par jour pendant 14 jours chez huit patients transplantés rénaux sous traitement par cyclosporine depuis au moins 6 mois et sous dose stable de cyclosporine depuis au moins 6 semaines. Il y a eu une augmentation significative de l'ASC, de la Cmax et de la Cmin de la cyclosporine (concentration sur 24 heures) et une réduction significative de la clairance orale apparente après l'administration de fluconazole. L'augmentation moyenne ± ET de l'ASC était de 92 % ± 43 % (intervalle : 18 à 147 %). La Cmax a augmenté de 60 % ± 48 % (intervalle : - 5 à 133 %). Le C a augmenté de 157 % ± 96 % (intervalle : 33 à 360 %). La clairance orale apparente a diminué de 45 % ± 15 % (intervalle : – 15 à - 60 %). (Voir PRÉCAUTIONS .)
Zidovudine
Les concentrations plasmatiques de zidovudine ont été déterminées à deux reprises (avant et après fluconazole 200 mg par jour pendant 15 jours) chez 13 volontaires atteints du SIDA ou d'ARC qui recevaient une dose stable de zidovudine pendant au moins deux semaines. Il y a eu une augmentation significative de l'ASC de la zidovudine après l'administration de fluconazole. L'augmentation moyenne ± ET de l'ASC était de 20 % ± 32 % (intervalle : - 27 à 104 %). Le rapport métabolite, GZDV, à la molécule mère a significativement diminué après l'administration de fluconazole, passant de 7,6 ± 3,6 à 5,7 ± 2,2.
Théophylline
La pharmacocinétique de la théophylline a été déterminée à partir d'une dose intraveineuse unique d'aminophylline (6 mg/kg) avant et après l'administration orale de fluconazole 200 mg par jour pendant 14 jours chez 16 volontaires mâles normaux. Il y avait des augmentations significatives dans theophylline AUC, Cmax et demi-vie avec une diminution correspondante dans l'autorisation. L'ASC moyenne de la théophylline ± SD a augmenté de 21 % ± 16 % (intervalle : - 5 à 48 %). La Cmax a augmenté de 13 % ± 17 % (intervalle : – 13 à 40 %). La clairance de la théophylline a diminué de 16 % ± 11 % (intervalle : - 32 à 5 %). La demi-vie de la théophylline est passée de 6,6 ± 1,7 heures à 7,9 ± 1,5 heures. (Voir PRÉCAUTIONS .)
Quinidine
Bien qu'elle n'ait pas été étudiée in vitro ou in vivo, l'administration concomitante de fluconazole et de quinidine peut entraîner une inhibition du métabolisme de la quinidine. L'utilisation de la quinidine a été associée à un allongement de l'intervalle QT et à de rares cas de torsades de pointes. L'administration concomitante de fluconazole et de quinidine est contre-indiquée. (Voir CONTRE-INDICATIONS et PRÉCAUTIONS .)
Hypoglycémiants oraux
Les effets du fluconazole sur la pharmacocinétique des hypoglycémiants oraux sulfonylurées tolbutamide, glipizide et glyburide ont été évalués dans trois études contrôlées par placebo chez des volontaires sains. Tous les sujets ont reçu la sulfonylurée seule en une dose unique et à nouveau en une seule dose après l'administration de DIFLUCAN 100 mg par jour pendant 7 jours. Dans ces trois études, 22/46 (47,8 %) des patients traités par DIFLUCAN et 9/22 (40,1 %) des patients sous placebo ont présenté des symptômes compatibles avec une hypoglycémie. (Voir PRÉCAUTIONS .)
Tolbutamide
Chez 13 hommes volontaires sains, il y a eu une augmentation significative de l'ASC et de la Cmax du tolbutamide (dose unique de 500 mg) après l'administration de fluconazole. Il y avait une augmentation moyenne ± ET de l'ASC du tolbutamide de 26 % ± 9 % (intervalle : 12 à 39 %). La Cmax du tolbutamide a augmenté de 11 % ± 9 % (intervalle : 6 à 27 %). (Voir PRÉCAUTIONS .)
Glipizide
L'ASC et la Cmax du glipizide (dose unique de 2,5 mg) ont été significativement augmentées après l'administration de fluconazole chez 13 hommes volontaires sains. Il y avait une augmentation moyenne ± ET de l'ASC de 49 % ± 13 % (intervalle : 27 à 73 %) et une augmentation de la Cmax de 19 % ± 23 % (intervalle : - 11 à 79 %). (Voir PRÉCAUTIONS .)
Glyburide
L'ASC et la Cmax du glyburide (dose unique de 5 mg) ont été significativement augmentées après l'administration de fluconazole chez 20 hommes volontaires sains. Il y avait une augmentation moyenne ± ET de l'ASC de 44 % ± 29 % (intervalle : - 13 à 115 %) et la Cmax a augmenté de 19 % ± 19 % (intervalle : - 23 à 62 %). Cinq sujets ont eu besoin de glucose par voie orale suite à l'ingestion de glyburide après 7 jours d'administration de fluconazole. (Voir PRÉCAUTIONS .)
Rifabutine
Des rapports publiés indiquent qu'une interaction existe lorsque le fluconazole est administré en même temps que la rifabutine, entraînant une augmentation des taux sériques de rifabutine. (Voir PRÉCAUTIONS .)
Tacrolimus
Des rapports publiés indiquent qu'une interaction existe lorsque le fluconazole est administré en même temps que le tacrolimus, entraînant une augmentation des taux sériques de tacrolimus. (Voir PRÉCAUTIONS .)
Midazolam
L'effet du fluconazole sur la pharmacocinétique et la pharmacodynamique du midazolam a été examiné dans une étude croisée randomisée chez 12 volontaires. Dans l'étude, les sujets ont ingéré un placebo ou 400 mg de fluconazole le jour 1, suivis de 200 mg par jour du jour 2 au jour 6. De plus, une dose de 7,5 mg de midazolam a été ingérée par voie orale le premier jour, 0,05 mg/kg a été administré par voie intraveineuse le quatrième jour et 7,5 mg par voie orale le sixième jour. Le fluconazole a réduit la clairance du midazolam IV de 51 %. Le premier jour d'administration, le fluconazole a augmenté l'ASC et la Cmax du midazolam de 259 % et 150 %, respectivement. Le sixième jour d'administration, le fluconazole a augmenté l'ASC et la Cmax du midazolam de 259 % et 74 %, respectivement. Les effets psychomoteurs du midazolam ont été significativement augmentés après l'administration orale de midazolam, mais pas significativement affectés après l'administration intraveineuse de midazolam.
Une deuxième étude randomisée, à double placebo, contrôlée par placebo, croisée en trois phases a été réalisée pour déterminer l'effet de la voie d'administration du fluconazole sur l'interaction entre le fluconazole et le midazolam. Dans chaque phase, les sujets ont reçu 400 mg de fluconazole par voie orale et une solution saline intraveineuse ; placebo oral et fluconazole intraveineux 400 mg ; et placebo oral et solution saline IV. Une dose orale de 7,5 mg de midazolam a été ingérée après fluconazole/placebo. L'ASC et la Cmax du midazolam étaient significativement plus élevées après administration orale qu'IV de fluconazole. Le fluconazole oral a augmenté l'ASC et la Cmax du midazolam de 272 % et 129 %, respectivement. Le fluconazole IV a augmenté l'ASC et la Cmax du midazolam de 244 % et 79 %, respectivement. Le fluconazole oral et IV a augmenté les effets pharmacodynamiques du midazolam. (Voir PRÉCAUTIONS .)
Azithromycine
Une étude ouverte, randomisée, croisée à trois voies chez 18 sujets sains a évalué l'effet d'une dose orale unique de 800 mg de fluconazole sur la pharmacocinétique d'une dose orale unique de 1200 mg d'azithromycine ainsi que les effets de l'azithromycine sur la pharmacocinétique du fluconazole. Il n'y a pas eu d'interaction pharmacocinétique significative entre le fluconazole et l'azithromycine.
Voriconazole
Le voriconazole est un substrat des isoenzymes CYP2C9 et CYP3A4. L'administration concomitante de voriconazole oral (400 mg Q12h pendant 1 jour, puis 200 mg Q12h pendant 2,5 jours) et de fluconazole oral (400 mg le jour 1, puis 200 mg Q24h pendant 4 jours) à 6 sujets sains de sexe masculin a entraîné une augmentation de la Cmax et l'ASCτ du voriconazole en moyenne de 57 % (IC à 90 % : 20 % à 107 %) et 79 % (IC à 90 % : 40 % à 128 %), respectivement. Dans une étude clinique de suivi portant sur 8 sujets sains de sexe masculin, la réduction de la posologie et/ou de la fréquence du voriconazole et du fluconazole n'a pas éliminé ni diminué cet effet. L'administration concomitante de voriconazole et de fluconazole à n'importe quelle dose n'est pas recommandée. Une surveillance étroite des événements indésirables liés au voriconazole est recommandée si le voriconazole est utilisé de manière séquentielle après le fluconazole, en particulier dans les 24 h suivant la dernière dose de fluconazole. (Voir PRÉCAUTIONS .)
Tofacitinib
L'administration concomitante de fluconazole (400 mg le jour 1 et 200 mg une fois par jour pendant 6 jours [jours 2 à 7]) et de tofacitinib (30 mg en dose unique le jour 5) chez des sujets sains a entraîné une augmentation des valeurs moyennes de l'ASC et de la Cmax du tofacitinib d'environ 79 % (IC à 90 % : 64 % à 96 %) et 27 % (IC à 90 % : 12 % à 44 %), respectivement, par rapport à l'administration de tofacitinib seul. (Voir PRÉCAUTIONS .)
Microbiologie
Mécanisme d'action
Le fluconazole est un inhibiteur hautement sélectif de l'enzyme lanostérol 14-α-déméthylase dépendante du cytochrome P450 fongique. Cette enzyme fonctionne pour convertir le lanostérol en ergostérol. La perte subséquente de stérols normaux est corrélée à l'accumulation de 14-α-méthyl stérols dans les champignons et peut être responsable de l'activité fongistatique du fluconazole. La déméthylation des cellules de mammifères est beaucoup moins sensible à l'inhibition du fluconazole.
La résistance
Un potentiel de développement de résistance au fluconazole est bien connu. Les isolats fongiques présentant une sensibilité réduite aux autres azoles peuvent également présenter une sensibilité réduite au fluconazole. La fréquence de développement d'une résistance aux médicaments pour les différents champignons pour lesquels ce médicament est indiqué n'est pas connue.
La résistance au fluconazole peut résulter d'une modification de la qualité ou de la quantité de l'enzyme cible (lanosterol 14-α-déméthylase), d'un accès réduit à la cible médicamenteuse ou d'une combinaison de ces mécanismes.
Des mutations ponctuelles dans le gène (ERG11) codant pour l'enzyme cible conduisent à une cible altérée avec une affinité réduite pour les azoles. La surexpression d'ERG11 entraîne la production de concentrations élevées de l'enzyme cible, créant le besoin de concentrations intracellulaires plus élevées de médicament pour inhiber toutes les molécules d'enzyme dans la cellule.
Le deuxième mécanisme majeur de résistance aux médicaments implique l'efflux actif de fluconazole hors de la cellule par l'activation de deux types de transporteurs d'efflux multidrogues ; les principaux facilitateurs (codés par les gènes MDR) et ceux de la superfamille des cassettes de liaison à l'ATP (codés par les gènes CDR). La régulation à la hausse du gène MDR entraîne une résistance au fluconazole, tandis que la régulation à la hausse des gènes CDR peut entraîner une résistance à plusieurs azoles.
La résistance chez Candida glabrata comprend généralement une régulation à la hausse des gènes CDR entraînant une résistance à plusieurs azoles. Pour un isolat où la concentration minimale inhibitrice (CMI) est classée comme intermédiaire (16 à 32 mcg/mL), la dose de fluconazole la plus élevée est recommandée.
Candida krusei doit être considéré comme résistant au fluconazole. La résistance chez C. krusei semble être médiée par une sensibilité réduite de l'enzyme cible à l'inhibition par l'agent.
Des cas de surinfection par des espèces de Candida autres que C. albicans, qui sont souvent intrinsèquement non sensibles à DIFLUCAN (par exemple, Candida krusei), ont été rapportés. De tels cas peuvent nécessiter un traitement antifongique alternatif.
Activité anti-microbienne
Le fluconazole s'est avéré actif contre la plupart des isolats des micro-organismes suivants à la fois in vitro et dans les infections cliniques.
Candida albicans Candida glabrata (De nombreux isolats sont moyennement sensibles) Candida parapsilosis Candida tropicalis Cryptococcus neoformans
Les données in vitro suivantes sont disponibles, mais leur signification clinique est inconnue. Au moins 90 % des champignons suivants présentent une CMI in vitro inférieure ou égale au seuil de sensibilité du fluconazole (https://www.fda.gov/STIC) contre des isolats d'un genre ou d'un groupe d'organismes similaires. Cependant, l'efficacité du fluconazole dans le traitement des infections cliniques dues à ces champignons n'a pas été établie dans des essais cliniques adéquats et bien contrôlés.
Candida dubliniensis Candida guilliermondii Candida kefyr Candida lusitaniae
Candida krusei doit être considéré comme résistant au fluconazole. La résistance chez C. krusei semble être médiée par une sensibilité réduite de l'enzyme cible à l'inhibition par l'agent.
Des cas de surinfection par des espèces de Candida autres que C. albicans, qui sont souvent intrinsèquement non sensibles à DIFLUCAN (par exemple, Candida krusei), ont été rapportés. De tels cas peuvent nécessiter un traitement antifongique alternatif.
Test de sensibilité
Pour des informations spécifiques concernant les critères d'interprétation des tests de sensibilité et les méthodes de test associées et les normes de contrôle qualité reconnues par la FDA pour ce médicament, veuillez consulter : https://www.fda.gov/STIC.
Etudes cliniques
Méningite cryptococcique
Dans une étude multicentrique comparant DIFLUCAN (200 mg/jour) à l'amphotéricine B (0,3 mg/kg/jour) pour le traitement de la méningite cryptococcique chez les patients atteints du SIDA, une analyse multivariée a révélé trois facteurs préthérapeutiques prédictifs de décès au cours du traitement : état mental, titre d'antigène cryptococcique dans le liquide céphalo-rachidien supérieur à 1:1024 et nombre de globules blancs dans le liquide céphalo-rachidien inférieur à 20 cellules/mm³. La mortalité chez les patients à haut risque était de 33 % et 40 % pour les patients amphotéricine B et DIFLUCAN, respectivement (p = 0,58), avec des décès globaux de 14 % (9 sujets sur 63) et 18 % (24 sujets sur 131) pour les 2 bras de l'étude (p=0,48). Les doses et schémas thérapeutiques optimaux pour les patients atteints de méningite cryptococcique aiguë et à haut risque d'échec thérapeutique restent à déterminer. (Saag, et al. N Engl J Med 1992; 326:83-9.)
Candidose vaginale
Deux études adéquates et bien contrôlées ont été menées aux États-Unis en utilisant le comprimé de 150 mg. Dans les deux cas, les résultats du traitement au fluconazole étaient comparables au traitement de contrôle (clotrimazole ou miconazole par voie intravaginale pendant 7 jours) à la fois cliniquement et statistiquement lors de l'évaluation post-traitement un mois.
Le taux de guérison thérapeutique, défini comme une résolution complète des signes et symptômes de la candidose vaginale (guérison clinique), ainsi qu'un examen KOH négatif et une culture négative pour Candida (éradication microbiologique), était de 55 % dans le groupe fluconazole et les produits vaginaux groupe.
Environ les trois quarts des patientes inscrites avaient une vaginite aiguë (
Beaucoup plus d'événements gastro-intestinaux ont été signalés dans le groupe fluconazole par rapport au groupe produit vaginal. La plupart des événements étaient légers à modérés. Étant donné que le fluconazole a été administré en une seule dose, aucune interruption n'a eu lieu.
Études pédiatriques
Candidose oropharyngée
Une étude comparative en ouvert de l'efficacité et de la tolérance de DIFLUCAN (2 à 3 mg/kg/jour) et de la nystatine orale (400 000 UI 4 fois par jour) chez des enfants immunodéprimés atteints de candidose oropharyngée a été menée. Les taux de réponse clinique et mycologique étaient plus élevés chez les enfants traités par le fluconazole.
La guérison clinique à la fin du traitement a été rapportée chez 86 % des patients traités par le fluconazole contre 46 % des patients traités par la nystatine. Mycologiquement, 76 % des patients traités par fluconazole avaient l'organisme infectieux éradiqué comparativement à 11 % pour les patients traités par nystatine.
La proportion de patients en rechute clinique 2 semaines après la fin du traitement était de 14% pour les sujets recevant DIFLUCAN et de 16% pour les sujets recevant la nystatine. A 4 semaines après la fin du traitement, les pourcentages de patients en rechute clinique étaient de 22% pour DIFLUCAN 150mg et de 23% pour la nystatine.
INFORMATIONS PATIENTS
DIFLUCAN® (colorant-FLEW-kan) (fluconazole) Comprimés
Cette notice contient des informations importantes sur DIFLUCAN. Il n'est pas destiné à remplacer les instructions de votre fournisseur de soins de santé. Lisez attentivement ces informations avant de prendre DIFLUCAN. Demandez à votre fournisseur de soins de santé si vous ne comprenez pas l'une de ces informations ou si vous voulez en savoir plus sur DIFLUCAN.
Qu'est-ce que DIFLUCAN 100 mg ?
DIFLUCAN est un médicament délivré sur ordonnance utilisé pour traiter les infections vaginales à levures causées par une levure appelée Candida. DIFLUCAN 150 mg aide à empêcher la croissance d'une trop grande quantité de levures dans le vagin afin que l'infection à levures disparaisse.
DIFLUCAN 150mg est différent des autres traitements des mycoses vaginales car il s'agit d'un comprimé pris par voie orale. DIFLUCAN est également utilisé pour d'autres affections. Cependant, cette notice ne concerne que l'utilisation de DIFLUCAN 50 mg pour les mycoses vaginales. Pour plus d'informations sur l'utilisation de DIFLUCAN 200 mg pour d'autres raisons, demandez à votre fournisseur de soins de santé. Voir la section de cette notice pour plus d'informations sur les infections vaginales à levures.
Qu'est-ce qu'une infection vaginale à levures?
Il est normal qu'une certaine quantité de levure se retrouve dans le vagin. Parfois, trop de levure commence à se développer dans le vagin, ce qui peut provoquer une infection à levures. Les mycoses vaginales sont courantes. Environ trois femmes adultes sur quatre auront au moins une infection vaginale à levures au cours de leur vie.
Certains médicaments et conditions médicales peuvent augmenter vos risques de contracter une infection à levures. Si vous êtes enceinte, souffrez de diabète, utilisez des contraceptifs oraux ou prenez des antibiotiques, vous pourriez avoir des infections à levures plus souvent que les autres femmes. L'hygiène personnelle et certains types de vêtements peuvent augmenter vos risques de contracter une infection à levures. Demandez à votre fournisseur de soins de santé des conseils sur ce que vous pouvez faire pour aider à prévenir les infections vaginales à levures. Si vous contractez une infection vaginale à levures, vous pouvez présenter l'un des symptômes suivants :
- démangeaison
- une sensation de brûlure lorsque vous urinez
- rougeur
- douleur
- un écoulement vaginal blanc épais qui ressemble à du fromage cottage
Ne prenez pas DIFLUCAN si vous.
- prendre les médicaments suivants :
- quinidine
- érythromycine
- pimozide
- êtes allergique au fluconazole, à l'ingrédient actif de DIFLUCAN 50 mg, ou à l'un des ingrédients de DIFLUCAN. Voir la fin de cette notice d'information destinée aux patients pour une liste complète des ingrédients de DIFLUCAN.
Avant de prendre DIFLUCAN, informez votre fournisseur de soins de santé de toutes vos conditions médicales, si vous :
- avoir des problèmes de foie
- avoir des problèmes rénaux
- avez des problèmes cardiaques, y compris des arythmies cardiaques
- avez une hypokaliémie (faible taux de potassium)
- êtes enceinte ou envisagez de devenir enceinte. Informez immédiatement votre fournisseur de soins de santé si vous tombez enceinte pendant que vous prenez DIFLUCAN. Vous et votre professionnel de la santé déciderez si DIFLUCAN 100 mg vous convient. Si vous êtes susceptible de tomber enceinte, vous devez utiliser une méthode contraceptive (contraceptive) pendant que vous prenez DIFLUCAN et pendant 1 semaine après votre dernière dose.
- allaitez ou envisagez d'allaiter. DIFLUCAN peut passer dans votre lait maternel. Discutez avec votre fournisseur de soins de santé de la meilleure façon de nourrir votre bébé pendant que vous prenez DIFLUCAN.
Avant de commencer à prendre DIFLUCAN, informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Informez particulièrement votre fournisseur de soins de santé si vous prenez :
- médicaments contre le diabète tels que le glyburide, le tolbutamide, le glipizide
- médicaments contre l'hypertension comme l'hydrochlorothiazide, le losartan, l'amlodipine, le vérapamil, la nifédipine ou la félodipine
- des anticoagulants tels que la warfarine
- cyclosporine, tacrolimus ou sirolimus (utilisés pour prévenir le rejet des greffes d'organes)
- rifampicine ou rifabutine pour la tuberculose
- phénytoïne ou carbamazépine pour contrôler les crises
- théophylline pour contrôler l'asthme
- quinidine (utilisée pour corriger les troubles du rythme cardiaque)
- amiodarone (utilisé pour traiter les battements cardiaques irréguliers "arythmies")
- amitriptyline ou nortriptyline pour la dépression
- pimozide pour les maladies psychiatriques
- amphotéricine B ou voriconazole pour les infections fongiques
- érythromycine pour les infections bactériennes
- olaparib, cyclophosphamide ou alcaloïdes de la pervenche tels que la vincristine ou la vinblastine pour le traitement du cancer
- fentanyl, alfentanil ou méthadone pour la douleur chronique
- ibrutinib utilisé pour traiter le cancer du sang
- lemborexant, utilisé pour le traitement de l'insomnie
- médicaments hypolipidémiants tels que l'atorvastatine, la simvastatine et la fluvastatine
- anti-inflammatoires non stéroïdiens, y compris le célécoxib, l'ibuprofène et le naproxène
- la prednisone, un stéroïde utilisé pour traiter les troubles cutanés, gastro-intestinaux, hématologiques ou respiratoires
- médicaments antiviraux utilisés pour traiter le VIH comme le saquinavir ou la zidovudine
- tofacitinib pour la polyarthrite rhumatoïde
- complément alimentaire en vitamine A
- tolvaptan utilisé pour traiter l'hyponatrémie (faible taux de sodium dans le sang) ou pour ralentir le déclin de la fonction rénale
Étant donné qu'il existe de nombreux noms de marque pour ces médicaments, consultez votre fournisseur de soins de santé ou votre pharmacien si vous avez des questions.
Comment dois-je prendre DIFLUCAN ?
- Prenez DIFLUCAN exactement comme votre professionnel de la santé vous l'a indiqué.
- Prenez DIFLUCAN 100 mg par voie orale avec ou sans nourriture.
- Si vous avez pris trop de DIFLUCAN 50 mg, appelez votre professionnel de la santé ou rendez-vous immédiatement aux urgences les plus proches.
Que dois-je éviter lors de la prise de DIFLUCAN 150mg ?
DIFLUCAN peut provoquer des étourdissements et des convulsions. Ne conduisez pas et n'utilisez pas de machines tant que vous ne savez pas comment DIFLUCAN vous affecte.
Quels sont les effets secondaires possibles de DIFLUCAN 150mg ?
DIFLUCAN 50mg peut provoquer des effets indésirables graves dont :
- graves problèmes de foie. Certaines personnes souffrant de problèmes médicaux graves ont développé de graves problèmes de foie qui ont mis leur vie en danger ou ont causé la mort pendant qu'elles prenaient DIFLUCAN. Parfois, ces problèmes hépatiques peuvent être résolus lorsque vous arrêtez de prendre DIFLUCAN. Informez immédiatement votre fournisseur de soins de santé si vous présentez des symptômes de problèmes hépatiques graves, notamment :
- urine de couleur foncée
- démangeaisons cutanées sévères
- jaunissement de la peau et des yeux (jaunisse)
- selles claires
- fatigue
- vomissement
- perte d'appétit
- réactions allergiques graves : Dans de rares cas, des réactions allergiques graves (anaphylaxie) sont survenues lors de la prise de DIFLUCAN. Arrêtez de prendre DIFLUCAN 50 mg, appelez votre professionnel de la santé ou rendez-vous immédiatement aux urgences de l'hôpital le plus proche si vous présentez des signes ou des symptômes de réaction allergique, notamment :
- essoufflement
- fièvre
- gonflement des paupières
- tousser
- éruption cutanée, urticaire, cloques ou desquamation de la peau
- visage, bouche, cou ou toute autre partie du corps
- respiration sifflante
- battement de cœur ou d'oreilles
- des frissons
- graves problèmes de peau. Certaines personnes souffrant de problèmes médicaux graves ont développé des problèmes cutanés graves qui ont entraîné la mort lors de la prise de DIFLUCAN. Informez immédiatement votre fournisseur de soins de santé si vous développez une éruption cutanée pendant que vous prenez DIFLUCAN.
Les effets indésirables les plus courants de DIFLUCAN 200 mg incluent :
- mal de tête
- vertiges
- diarrhée
- Douleur d'estomac
- nausées ou maux d'estomac
- changements dans le goût des aliments
D'autres effets secondaires incluent:
- insuffisance surrénalienne : Certaines personnes ayant pris DIFLUCAN ont développé une insuffisance surrénalienne réversible. Informez immédiatement votre fournisseur de soins de santé si vous présentez des symptômes d'insuffisance surrénalienne, notamment :
- fatigue de longue durée
- faiblesse musculaire
- perte d'appétit
- perte de poids
- Douleur d'estomac
- vertiges
- nausée
- vomissement
- étourdissements ou convulsions.
Ce ne sont pas tous les effets indésirables possibles de DIFLUCAN.
Appelez votre fournisseur de soins de santé pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment conserver DIFLUCAN ?
Conservez les comprimés DIFLUCAN à une température inférieure à 30 °C (86 °F).
Conservez DIFLUCAN 50 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de DIFLUCAN.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans une notice d'information destinée aux patients. Ne pas utiliser DIFLUCAN 50mg pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas DIFLUCAN à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire. Vous pouvez demander à votre professionnel de la santé des informations sur DIFLUCAN 200 mg destinées aux professionnels de la santé.
Quels sont les ingrédients de DIFLUCAN 150mg ?
Ingrédient actif: fluconazole
Ingrédients inactifs: cellulose microcristalline, phosphate de calcium dibasique anhydre, povidone, croscarmellose sodique, colorant de laque d'aluminium FD&C rouge n° 40 et stéarate de magnésium.
Ces informations patient ont été approuvées par la Food and Drug Administration des États-Unis
