Parlodel 2.5mg Bromocriptine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Parlodel et comment est-il utilisé ?
Parlodel 2,5 mg est un médicament sur ordonnance utilisé pour traiter les symptômes des dysfonctionnements associés à l'hyperprolactinémie, de la maladie de Parkinson et de l'acromégalie. Parlodel 2,5 mg peut être utilisé seul ou avec d'autres médicaments.
Parlodel 2,5 mg appartient à une classe de médicaments appelés agents antiparkinsoniens, agonistes de la dopamine ; Hyperprolactinémie ; Métabolique et endocrinien, autre.
On ne sait pas si Parlodel 2,5 mg est sûr et efficace chez les enfants de moins de 10 ans.
Quels sont les effets secondaires possibles de Parlodel ?
Parlodel peut provoquer des effets secondaires graves, notamment :
- urticaire,
- difficulté à respirer,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- problèmes de vue,
- nez qui coule constamment,
- douleur thoracique,
- douleur quand tu respires,
- rythme cardiaque rapide,
- Respiration rapide,
- essoufflement,
- mal au dos,
- gonflement des chevilles ou des pieds,
- uriner moins ou pas du tout,
- confusion,
- hallucinations,
- étourdissement,
- mal de tête,
- faim,
- la faiblesse,
- transpiration,
- tremblements,
- irritabilité,
- difficulté à se concentrer,
- mouvements musculaires involontaires,
- perte d'équilibre ou de coordination,
- selles sanglantes ou goudronneuses,
- tousser du sang,
- vomi qui ressemble à du marc de café,
- Maux de tête sévères,
- Vision floue,
- bourdonne dans tes oreilles,
- anxiété,
- confusion,
- douleur thoracique,
- essoufflement,
- battements de coeur irréguliers et
- convulsions
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Parlodel 2,5 mg incluent :
- vertiges,
- sensation de rotation,
- légère somnolence,
- fatigue,
- léger mal de tête,
- humeur dépressive,
- troubles du sommeil (insomnie),
- bouche sèche,
- nez encombré,
- maux d'estomac,
- nausée,
- vomissement,
- Douleur d'estomac,
- perte d'appétit,
- diarrhée,
- la constipation et
- sensation de froid ou engourdissement dans les doigts
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Parlodel. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
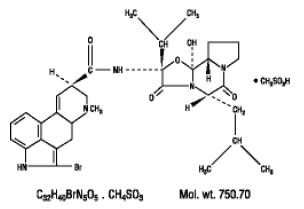
Parlodel® (mésylate de bromocriptine) est un dérivé de l'ergot de seigle doté d'une puissante activité agoniste des récepteurs de la dopamine. Chaque comprimé Parlodel® (mésylate de bromocriptine) SnapTabs® pour administration orale contient 2½ mg et chaque capsule contient 5 mg de bromocriptine (sous forme de mésylate). Le mésylate de bromocriptine est chimiquement désigné comme Ergotaman-3',6',18-trione, 2-bromo-12'-hydroxy-2'-(1-méthyléthyl)-5'-( 2-méthylpropyl)-, (5'α)-monométhanesulfonate (sel).
La formule structurale est :
2½ mg de SnapTabs®
Ingrédient actif: mésylate de bromocriptine, USP
Ingrédients inactifs: dioxyde de silicium colloïdal, lactose, stéarate de magnésium, povidone, amidon et un autre ingrédient
Gélules de 5 mg
Ingrédient actif: mésylate de bromocriptine, USP
Ingrédients inactifs: dioxyde de silicium colloïdal, gélatine, lactose, stéarate de magnésium, oxyde de fer rouge, dioxyde de silicium, laurylsulfate de sodium, amidon, dioxyde de titane, oxyde de fer jaune et un autre ingrédient
LES INDICATIONS
Dysfonctions associées à l'hyperprolactinémie
Parlodel (mésylate de bromocriptine) est indiqué pour le traitement des dysfonctionnements associés à hyperprolactinémie y compris aménorrhée avec ou sans galactorrhée, infertilité ou hypogonadisme . Le traitement par Parlodel 2,5 mg est indiqué chez les patients adénomes sécrétant de la prolactine , qui peut être l'endocrinopathie sous-jacente de base contribuant aux présentations cliniques ci-dessus. Réduction dans taille de la tumeur été démontré chez des patients masculins et féminins atteints de macroadénomes. Dans les cas où une adénectomie est choisie, un traitement par Parlodel 2,5 mg peut être utilisé pour réduire la masse tumorale avant la chirurgie.
Acromégalie
La thérapie Parlodel 2,5 mg est indiquée dans le traitement de l'acromégalie. La thérapie parlodel, seule ou en association avec une irradiation hypophysaire ou une intervention chirurgicale, réduit l'hormone de croissance sérique de 50 % ou plus chez environ la moitié des patients traités, bien que généralement pas à des niveaux normaux.
Étant donné que les effets de l'irradiation hypophysaire externe peuvent ne pas devenir maximaux avant plusieurs années, un traitement adjuvant avec Parlodel 2,5 mg offre un bénéfice potentiel avant que les effets de l'irradiation ne se manifestent.
La maladie de Parkinson
Parlodel 2,5mg SnapTabs ou gélules sont indiqués dans le traitement des signes et symptômes de la maladie de Parkinson idiopathique ou postencéphalitique. En tant que traitement d'appoint à la lévodopa (seule ou avec un inhibiteur de la décarboxylase périphérique), le traitement par Parlodel peut apporter des bénéfices thérapeutiques supplémentaires chez les patients qui sont actuellement maintenus à des doses optimales de lévodopa, ceux qui commencent à se détériorer (développer une tolérance) au traitement par la lévodopa, et ceux qui connaissent un « échec de fin de dose » sous traitement à la lévodopa. Le traitement par Parlodel 2,5 mg peut permettre une réduction de la dose d'entretien de la lévodopa et, par conséquent, peut améliorer la survenue et/ou la gravité des effets indésirables associés au traitement à long terme par la lévodopa, tels que les mouvements involontaires anormaux (par exemple, les dyskinésies) et les fluctuations marquées de fonction motrice (phénomène « on-off »). L'efficacité continue du traitement par Parlodel 2,5 mg pendant un traitement de plus de 2 ans n'a pas été établie.
Les données sont insuffisantes pour évaluer le bénéfice potentiel du traitement de la maladie de Parkinson nouvellement diagnostiquée avec Parlodel. Des études ont cependant montré un nombre significativement plus élevé d'effets indésirables (notamment nausées, hallucinations, confusion et hypotension) chez les patients traités par Parlodel que chez les patients traités par la lévodopa/carbidopa. Les patients qui ne répondent pas à la lévodopa sont de mauvais candidats pour le traitement par Parlodel.
DOSAGE ET ADMINISTRATION
Général
Il est recommandé de prendre Parlodel (mésylate de bromocriptine) avec de la nourriture. Les patients doivent être évalués fréquemment pendant l'augmentation de la dose afin de déterminer la dose la plus faible qui produit une réponse thérapeutique.
Indications hyperprolactinémiques
La posologie initiale de Parlodel SnapTabs chez l'adulte est d'un ½ à un comprimé sécable de 2½ mg par jour. Un comprimé supplémentaire de 2½ mg peut être ajouté au schéma thérapeutique selon la tolérance tous les 2 à 7 jours jusqu'à l'obtention d'une réponse thérapeutique optimale. La posologie thérapeutique variait de 2,5 à 15 mg par jour chez les adultes étudiés cliniquement.
Sur la base de données limitées chez les enfants de 11 à 15 ans (voir Utilisation pédiatrique ) la dose initiale est d'un ½ à un comprimé sécable de 2½ mg par jour. Il peut être nécessaire d'augmenter la posologie selon la tolérance jusqu'à l'obtention d'une réponse thérapeutique. La posologie thérapeutique variait de 2,5 à 10 mg par jour chez les enfants atteints d'adénomes hypophysaires sécrétant de la prolactine.
Afin de réduire la probabilité d'une exposition prolongée à Parlodel en cas de grossesse insoupçonnée, un contraceptif mécanique doit être utilisé en association avec le traitement par Parlodel 2,5 mg jusqu'à ce que les cycles menstruels ovulatoires normaux soient rétablis. La contraception peut alors être interrompue chez les patientes souhaitant une grossesse.
Par la suite, si les règles ne surviennent pas dans les 3 jours suivant la date prévue, le traitement par Parlodel 2,5 mg doit être interrompu et un test de grossesse doit être effectué.
Acromégalie
Pratiquement tous les patients acromégales recevant un bénéfice thérapeutique de Parlodel 2,5 mg présentent également des réductions des taux circulants d'hormone de croissance. Par conséquent, une évaluation périodique des taux circulants d'hormone de croissance servira, dans la plupart des cas, de guide pour déterminer le potentiel thérapeutique de Parlodel. Si, après un bref essai avec le traitement par Parlodel, aucune réduction significative des taux d'hormone de croissance n'a eu lieu, une évaluation minutieuse des caractéristiques cliniques de la maladie doit être effectuée et, si aucun changement n'est survenu, un ajustement posologique ou l'arrêt du traitement doit être envisagé. .
La posologie initiale recommandée est de 1 ½ à 1 comprimé Parlodel SnapTabs de 2½ mg au coucher (avec de la nourriture) pendant 3 jours. Un ½ à 1 comprimé supplémentaire de SnapTabs doit être ajouté au régime de traitement selon la tolérance tous les 3 à 7 jours jusqu'à ce que le patient obtienne un bénéfice thérapeutique optimal. Les patients doivent être réévalués tous les mois et la posologie ajustée en fonction des réductions de l'hormone de croissance ou de la réponse clinique. La gamme posologique thérapeutique optimale habituelle de Parlodel varie de 20 à 30 mg/jour chez la plupart des patients. La posologie maximale ne doit pas dépasser 100 mg/jour.
Les patients traités par irradiation hypophysaire doivent être retirés du traitement par Parlodel 2,5 mg sur une base annuelle pour évaluer à la fois les effets cliniques des rayonnements sur le processus de la maladie ainsi que les effets du traitement par Parlodel. Habituellement, une période de retrait de 4 à 8 semaines est suffisante à cette fin. La récurrence des signes/symptômes ou l'augmentation de l'hormone de croissance indiquent que le processus pathologique est toujours actif et que d'autres cures de Parlodel doivent être envisagées.
La maladie de Parkinson
Le principe de base de la thérapie Parlodel 2,5 mg est d'initier le traitement à faible dose et, sur une base individuelle, d'augmenter lentement la dose quotidienne jusqu'à l'obtention d'une réponse thérapeutique maximale. La posologie de la lévodopa pendant cette période d'introduction doit être maintenue, si possible. La dose initiale de Parlodel 2,5 mg est d'un ½ d'un comprimé SnapTabs de 2½ mg deux fois par jour avec les repas. Des évaluations sont conseillées à des intervalles de 2 semaines pendant l'ajustement posologique afin de s'assurer que la dose la plus faible produisant une réponse thérapeutique optimale n'est pas dépassée. Si nécessaire, la posologie peut être augmentée tous les 14 à 28 jours de 2½ mg/jour aux repas. S'il est conseillé de réduire la dose de lévodopa en raison d'effets indésirables, la dose quotidienne de Parlodel, si elle est augmentée, doit être réalisée progressivement par petites augmentations (2,5 mg).
La sécurité de Parlodel n'a pas été démontrée à des doses supérieures à 100 mg/jour.
COMMENT FOURNIE
Parlodel (mésylate de bromocriptine) SnapTabs
2½ mg
Parlodel est disponible en flacon contenant 30 et 100 comprimés de 2 ½ mg, chaque flacon contient un déshydratant.
SnapTabs ronds, blanc cassé, à bords biseautés, contenant chacun 2½ mg de bromocriptine (sous forme de mésylate). Gravé « PARLODEL 2½ » sur une face et « 017 » sur la face rainurée. Conforme au test de dissolution USP 1.
Paquets de 30 - CDN 30698-202-30 Paquets de 100 - CDN 30698-202-01
Capsules de Parlodel (mésylate de bromocriptine)
5mg
Capsules caramel et blanches, contenant chacune 5 mg de bromocriptine (sous forme de mésylate). Imprimé à l'encre rouge « PARLODEL 5 mg » sur une moitié et « 102 » sur l'autre moitié.
Paquets de 30 - CDN 30698-201-30 Paquets de 100 - CDN 30698-201-01
Stocker et distribuer
Conserver à 68° à 77°F (20° à 25°C); les excursions permises à 59° à 86°F (15° à 30°C) [Voir USP la Température de Pièce Contrôlée].
Distribuer dans un récipient étanche et résistant à la lumière.
Fabriqué pour et distribué par : Validus Pharmaceuticals LLC Parsippany, NJ 07054. Révisé : juillet 2021
EFFETS SECONDAIRES
Effets indésirables des essais cliniques
Indications hyperprolactinémiques
L'incidence des effets indésirables est assez élevée (69 %) mais ceux-ci sont généralement d'intensité légère à modérée. Le traitement a été interrompu chez environ 5 % des patients en raison d'effets indésirables. Ceux-ci par ordre décroissant de fréquence sont : nausées (49 %), maux de tête (19 %), étourdissements (17 %), fatigue (7 %), étourdissements (5 %), vomissements (5 %), crampes abdominales (4 %) , congestion nasale (3%), constipation (3%), diarrhée (3%) et somnolence (3%).
Un léger effet hypotenseur peut accompagner le traitement par Parlodel (mésylate de bromocriptine). La survenue d'effets indésirables peut être atténuée en réduisant temporairement la dose à ½ comprimé SnapTabs 2 ou 3 fois par jour. Quelques cas de rhinorrhée du liquide céphalo-rachidien ont été rapportés chez des patients recevant Parlodel 2,5 mg pour le traitement de prolactinomes volumineux. Cela s'est produit rarement, généralement uniquement chez des patients ayant déjà subi une chirurgie transsphénoïdale, une radiothérapie hypophysaire ou les deux, et qui recevaient Parlodel 2,5 mg pour une récidive tumorale. Il peut également survenir chez des patients non traités auparavant dont la tumeur s'étend dans le sinus sphénoïdal.
Acromégalie
Les effets indésirables les plus fréquemment rencontrés chez les patients acromégales traités par Parlodel 2,5 mg étaient : %), indigestion/dyspepsie (4 %), vasospasme digital (3 %), somnolence/fatigue (3 %) et vomissements (2 %).
Les effets indésirables moins fréquents (moins de 2 %) étaient : saignements gastro-intestinaux, étourdissements, exacerbation du syndrome de Raynaud, céphalées et syncope. Rarement (moins de 1 %) perte de cheveux, potentialisation de l'alcool, évanouissement, étourdissements, arythmie, tachycardie ventriculaire, diminution du besoin de sommeil, hallucinations visuelles, lassitude, essoufflement, bradycardie, vertige, paresthésie, apathie, crise vaso-vagale, psychose délirante, paranoïa , insomnie, sensation de tête lourde, diminution de la tolérance au froid, picotements des oreilles, pâleur faciale et crampes musculaires ont été rapportés.
La maladie de Parkinson
Dans les essais cliniques au cours desquels Parlodel 2,5 mg a été administré avec une réduction concomitante de la dose de lévodopa/carbidopa, les nouveaux effets indésirables les plus fréquents ont été : nausées, mouvements involontaires anormaux, hallucinations, confusion, phénomène "on-off", étourdissements, somnolence, évanouissement/évanouissement, vomissements, asthénie, gêne abdominale, troubles visuels, ataxie, insomnie, dépression, hypotension, essoufflement, constipation et vertiges.
Les effets indésirables moins fréquents qui peuvent être rencontrés incluent : anorexie, anxiété, blépharospasme, bouche sèche, dysphagie, œdème des pieds et des chevilles, érythromélalgie, crise épileptiforme, fatigue, maux de tête, léthargie, marbrures de la peau, congestion nasale, nervosité, cauchemars, paresthésie, éruption cutanée, pollakiurie, incontinence urinaire, rétention urinaire et, rarement, signes et symptômes d'ergotisme tels que picotements des doigts, pieds froids, engourdissements, crampes musculaires des pieds et des jambes ou exacerbation du syndrome de Raynaud.
Les anomalies des tests de laboratoire peuvent inclure des élévations de l'azote uréique sanguin, du SGOT, du SGPT, du GGPT, du CPK, de la phosphatase alcaline et de l'acide urique, qui sont généralement transitoires et sans signification clinique.
Effets indésirables de l'expérience post-commercialisation
Les effets indésirables suivants ont été signalés lors de l'utilisation post-approbation de Parlodel (toutes indications combinées). Étant donné que les effets indésirables signalés spontanément sont signalés volontairement par une population de taille incertaine, il n'est généralement pas possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Troubles psychiatriques: Confusion, agitation/excitation psychomotrice, hallucinations, troubles psychotiques, insomnie, augmentation de la libido, hypersexualité et contrôle des impulsions/comportements compulsifs (y compris jeu, dépenses et autres pulsions intenses).
Troubles du système nerveux : Céphalées, somnolence, étourdissements, dyskinésie, somnolence, paresthésie, somnolence diurne excessive, endormissement soudain.
Troubles oculaires : Troubles visuels, vision floue.
Troubles de l'oreille et du labyrinthe : Acouphène.
Troubles cardiaques : Épanchement péricardique, péricardite constrictive, tachycardie, bradycardie, arythmie, fibrose valvulaire cardiaque.
Affections vasculaires : Hypotension, hypotension orthostatique (conduisant très rarement à une syncope), pâleur réversible des doigts et des orteils induite par le froid (en particulier chez les patients ayant des antécédents de phénomène de Raynaud).
Troubles respiratoires, thoraciques et médiastinaux : Congestion nasale, épanchement pleural, fibrose pleurale, pleurésie, fibrose pulmonaire, dyspnée.
Problèmes gastro-intestinaux: Nausées, constipation, vomissements, bouche sèche, diarrhée, douleurs abdominales, fibrose rétropéritonéale, ulcère gastro-intestinal, hémorragie gastro-intestinale.
Affections de la peau et du tissu sous-cutané : Réactions cutanées allergiques, perte de cheveux.
Troubles musculo-squelettiques et du tissu conjonctif : Crampes dans les jambes.
Troubles généraux et anomalies au site d'administration : Fatigue, œdème périphérique, un syndrome ressemblant au syndrome malin des neuroleptiques lors de l'arrêt brutal de Parlodel, symptômes de sevrage (y compris apathie, anxiété, dépression, fatigue, insomnie, transpiration et douleur) avec réduction progressive ou après l'arrêt (voir PRÉCAUTIONS ).
Événements indésirables observés dans d'autres conditions
Patientes en post-partum (voir ci-dessus AVERTISSEMENTS )
Dans les études post-partum avec Parlodel 2,5 mg, 23% des patientes post-partum traitées ont eu au moins 1 effet secondaire, mais ils étaient généralement d'intensité légère à modérée. Le traitement a été interrompu chez environ 3 % des patients. Les effets indésirables les plus fréquents étaient : céphalées (10 %), étourdissements (8 %), nausées (7 %), vomissements (3 %), fatigue (1,0 %), syncope (0,7 %), diarrhée (0,4 %) et crampes (0,4 %). Des diminutions de la pression artérielle (≥ 20 mm Hg systolique et ≥ 10 mm Hg diastolique) sont survenues chez 28 % des patientes au moins une fois au cours des 3 premiers jours post-partum ; ceux-ci étaient généralement de nature transitoire. Les rapports d'évanouissement dans la puerpéralité peuvent éventuellement être liés à cet effet. Dans l'expérience post-commercialisation aux États-Unis, les effets indésirables graves signalés comprennent 72 cas de convulsions (dont 4 cas d'état de mal épileptique), 30 cas d'accident vasculaire cérébral et 9 cas d'infarctus du myocarde chez les patientes en post-partum. Les cas de convulsions n'étaient pas nécessairement accompagnés du développement de l'hypertension. Un mal de tête ininterrompu et souvent progressivement sévère, parfois accompagné de troubles visuels, souvent précédé de plusieurs heures à plusieurs jours de cas de convulsions et/ou d'accidents vasculaires cérébraux. La plupart des patientes n'avaient montré aucun signe d'un des troubles hypertensifs de la grossesse, y compris l'éclampsie, la prééclampsie ou l'hypertension induite par la grossesse. Un cas d'AVC était associé à une thrombose du sinus sagittal et un autre à une vascularite cérébrale et cérébelleuse. Un cas d'infarctus du myocarde a été associé à une coagulation intravasculaire disséminée inexpliquée et un second s'est produit en conjonction avec l'utilisation d'un autre alcaloïde de l'ergot. La relation entre ces effets indésirables et l'administration de Parlodel n'a pas été établie.
Dans de rares cas, des événements indésirables graves, notamment hypertension, infarctus du myocarde, convulsions, accident vasculaire cérébral ou troubles psychiques, ont été signalés chez des femmes en post-partum traitées par Parlodel. Chez certains patients, le développement de convulsions ou d'accidents vasculaires cérébraux a été précédé de céphalées sévères et/ou de troubles visuels transitoires. Bien que la relation causale entre ces événements et le médicament soit incertaine, une surveillance périodique de la pression artérielle est recommandée chez les femmes post-partum recevant Parlodel. Si une hypertension, des céphalées sévères, progressives ou incessantes (avec ou sans troubles visuels) ou des signes de toxicité du SNC se développent, l'administration de Parlodel 2,5 mg doit être interrompue et le patient doit être évalué rapidement.
Une prudence particulière est requise chez les patients qui ont été récemment traités ou qui reçoivent un traitement concomitant avec des médicaments pouvant modifier la pression artérielle, par exemple des vasoconstricteurs tels que des sympathomimétiques ou des alcaloïdes de l'ergot de seigle, y compris l'ergométrine ou la méthylergométrine et leur utilisation concomitante pendant la puerpéralité n'est pas recommandée.
Pour signaler des RÉACTIONS INDÉSIRABLES SUSPECTÉES, contactez Validus Pharmaceuticals LLC au 1-866-982-5438 ou la FDA au 1-800-FDA-1088 ou www.fda.gov/medwatch.
INTERACTIONS MÉDICAMENTEUSES
Le risque d'utiliser Parlodel en association avec d'autres médicaments n'a pas été systématiquement évalué, mais l'alcool peut potentialiser les effets secondaires de Parlodel. Parlodel 2,5 mg peut interagir avec les antagonistes de la dopamine, les butyrophénones et certains autres agents. Les composés de ces catégories entraînent une diminution de l'efficacité de Parlodel : phénothiazines, halopéridol, métoclopramide et pimozide. La bromocriptine est un substrat du CYP3A4. Il convient donc d'être prudent lors de la co-administration de médicaments qui sont de puissants inhibiteurs de cette enzyme (tels que les antimycosiques azolés, les inhibiteurs de la protéase du VIH). Il a été démontré que l'utilisation concomitante d'antibiotiques macrolides tels que l'érythromycine augmentait les taux plasmatiques de bromocriptine (les valeurs moyennes de l'ASC et de la Cmax étaient respectivement multipliées par 3,7 et 4,6).1 Le traitement concomitant de patients acromégales par la bromocriptine et l'octréotide a entraîné une augmentation niveaux de bromocriptine (l'ASC de la bromocriptine a augmenté d'environ 38 %).4 L'utilisation concomitante de Parlodel avec d'autres alcaloïdes de l'ergot de seigle n'est pas recommandée. Un ajustement de la dose peut être nécessaire dans les cas où des doses élevées de bromocriptine sont utilisées (comme l'indication de la maladie de Parkinson).
AVERTISSEMENTS
Étant donné qu'une hyperprolactinémie avec aménorrhée/galactorrhée et infertilité a été observée chez des patients atteints de tumeurs hypophysaires, une évaluation complète de l'hypophyse est indiquée avant le traitement par Parlodel (mésylate de bromocriptine).
Si une grossesse survient pendant l'administration de Parlodel, une observation attentive de ces patientes est obligatoire. Les adénomes sécrétant de la prolactine peuvent se dilater et une compression des nerfs optiques ou crâniens peut survenir, nécessitant une chirurgie hypophysaire d'urgence. Dans la plupart des cas, la compression se résout après l'accouchement. Il a été rapporté que la réinitiation du traitement par Parlodel 2,5 mg produit une amélioration des champs visuels des patientes chez qui une compression nerveuse s'est produite pendant la grossesse. La sécurité du traitement par Parlodel 2,5 mg pendant la grossesse pour la mère et le fœtus n'a pas été établie.
Parlodel 2,5 mg a été associé à de la somnolence et à des épisodes d'endormissement soudain, en particulier chez les patients atteints de la maladie de Parkinson. Des endormissements soudains pendant les activités quotidiennes, dans certains cas sans prise de conscience ni signes avant-coureurs, ont été rapportés. Les patients doivent en être informés et déconseillés de conduire ou d'utiliser des machines pendant le traitement par la bromocriptine. Les patients qui ont, ont éprouvé de la somnolence et/ou un épisode d'endormissement soudain ne doivent pas conduire ou utiliser des machines. De plus, une réduction de la posologie ou l'arrêt du traitement peuvent être envisagés.
Une hypotension symptomatique peut survenir chez les patients traités par Parlodel pour n'importe quelle indication. Dans les études post-partum avec Parlodel, des diminutions des pressions systolique et diastolique en décubitus supérieur à 20 mm et 10 mm Hg, respectivement, ont été observées chez près de 30 % des patientes recevant Parlodel. À l'occasion, la chute de la pression systolique en décubitus atteignait 50 à 59 mm de Hg.
Étant donné que des réactions hypotensives peuvent survenir occasionnellement, en particulier au cours des premiers jours de traitement, et entraîner une diminution de la vigilance, une prudence particulière s'impose lors de la conduite d'un véhicule ou de l'utilisation de machines.
Bien qu'une hypotension au début du traitement par Parlodel 2,5 mg survienne chez certains patients, dans de rares cas, des événements indésirables graves, notamment hypertension, infarctus du myocarde, convulsions, accident vasculaire cérébral, ont été rapportés chez des femmes post-partum traitées par Parlodel 2,5 mg pour l'inhibition de la lactation. Des cas d'hypertension ont été signalés, parfois au début du traitement, mais se développant souvent au cours de la deuxième semaine de traitement; des convulsions ont également été signalées avec et sans développement antérieur d'hypertension; des accidents vasculaires cérébraux ont été signalés principalement chez des patientes en post-partum dont l'évolution prénatale et obstétricale n'avait pas été compliquée. Beaucoup de ces patients souffrant de convulsions (y compris des cas d'état de mal épileptique) et/ou d'accidents vasculaires cérébraux ont déclaré avoir développé un mal de tête constant et souvent progressivement sévère quelques heures à quelques jours avant l'événement aigu. Certains cas d'AVC et de convulsions ont également été précédés de troubles visuels (vision floue et cécité corticale transitoire). Des cas d'infarctus aigu du myocarde ont également été rapportés.
Bien qu'une relation causale entre l'administration de Parlodel et l'hypertension, les convulsions, les accidents vasculaires cérébraux et l'infarctus du myocarde chez les femmes en post-partum n'ait pas été établie, l'utilisation du médicament pour la prévention de la lactation physiologique ou chez les patients présentant une hypertension non contrôlée n'est pas recommandée. Chez les patientes traitées pour une hyperprolactinémie, Parlodel 2,5 mg doit être arrêté dès le diagnostic de grossesse (voir PRÉCAUTIONS , États hyperprolactinémiques ). Dans le cas où Parlodel 2,5 mg est réinstitué pour contrôler un macroadénome à expansion rapide (voir PRÉCAUTIONS , États hyperprolactinémiques et qu'une patiente présente un trouble hypertensif de la grossesse, le bénéfice de la poursuite de Parlodel doit être mis en balance avec le risque éventuel de son utilisation au cours d'un trouble hypertensif de la grossesse. Lorsque Parlodel est utilisé pour traiter l'acromégalie ou la maladie de Parkinson chez des patientes qui deviennent enceintes par la suite, une décision doit être prise quant à savoir si le traitement continue d'être médicalement nécessaire ou peut être arrêté. S'il est poursuivi, le médicament doit être arrêté chez les femmes susceptibles de présenter des troubles hypertensifs de la grossesse (y compris l'éclampsie, la prééclampsie ou l'hypertension induite par la grossesse) à moins que l'arrêt de Parlodel ne soit considéré comme médicalement contre-indiqué. En raison de la possibilité d'une interaction entre Parlodel et d'autres alcaloïdes de l'ergot, l'utilisation concomitante de ces médicaments n'est pas recommandée. Une surveillance périodique de la pression artérielle, en particulier pendant les premières semaines de traitement, est prudente. En cas d'hypertension, de céphalées sévères, progressives ou incessantes (avec ou sans troubles visuels) ou de signes de toxicité sur le SNC, le traitement médicamenteux doit être interrompu et le patient doit être évalué rapidement. Une attention particulière doit être portée aux patients qui ont été récemment traités ou qui reçoivent un traitement concomitant avec des médicaments susceptibles de modifier la tension artérielle. Leur utilisation concomitante dans la puerpéralité n'est pas recommandée.
Parmi les patients sous Parlodel, en particulier sous traitement à long terme et à forte dose, des épanchements pleuraux et péricardiques, ainsi qu'une fibrose pleurale et pulmonaire et une péricardite constrictive ont été rapportés. Les patients présentant des troubles pleuro-pulmonaires inexpliqués doivent être examinés minutieusement et l'arrêt du traitement par Parlodel 2,5 mg doit être envisagé. Dans les cas où le traitement par Parlodel 2,5 mg a été interrompu, les changements sont lentement revenus à la normale.
Chez quelques patients sous Parlodel, en particulier sous traitement à long terme et à forte dose, une fibrose rétropéritonéale a été rapportée. Pour assurer la reconnaissance de la fibrose rétropéritonéale à un stade précoce et réversible, il est recommandé de surveiller ses manifestations (p. ex., dorsalgie, œdème des membres inférieurs, altération de la fonction rénale) dans cette catégorie de patients. Le médicament Parlodel doit être arrêté si des modifications fibrotiques du rétropéritoine sont diagnostiquées ou suspectées.
PRÉCAUTIONS
Général
Il y a eu des rapports de patients éprouvant des envies intenses de jouer, des envies sexuelles accrues, des envies intenses de dépenser de l'argent de manière incontrôlable et/ou d'autres envies intenses, et l'incapacité de contrôler ces envies tout en prenant un ou plusieurs des médicaments, y compris Parlodel 2,5 mg. , qui augmentent le tonus dopaminergique central. Dans certains cas, mais pas tous, ces envies ont cessé lorsque la dose a été réduite ou que le médicament a été arrêté. Étant donné que les patients peuvent ne pas reconnaître ces comportements comme anormaux, il est important que les prescripteurs interrogent spécifiquement les patients ou leurs soignants sur le développement d'envies de jeu nouvelles ou accrues, d'envies sexuelles, de dépenses incontrôlées ou d'autres envies pendant le traitement par Parlodel 2,5 mg pour la maladie de Parkinson. ou des dysfonctionnements associés à l'hyperprolactinémie. Les médecins doivent envisager de réduire la dose ou d'arrêter le médicament si un patient développe de telles envies pendant la prise de Parlodel.
L'innocuité et l'efficacité de Parlodel (mésylate de bromocriptine) n'ont pas été établies chez les patients atteints de maladie rénale ou hépatique. Des précautions doivent être prises lors de l'administration concomitante d'un traitement par Parlodel avec d'autres médicaments connus pour abaisser la tension artérielle.
Le médicament doit être utilisé avec prudence chez les patients ayant des antécédents de psychose ou de maladie cardiovasculaire. Si des patientes acromégales ou des patientes atteintes de prolactinome ou de la maladie de Parkinson sont traitées par Parlodel 2,5 mg pendant la grossesse, elles doivent être surveillées avec prudence, en particulier pendant la période post-partum si elles ont des antécédents de maladie cardiovasculaire.
Les patients présentant des problèmes héréditaires rares d'intolérance au galactose, un déficit sévère en lactase ou une malabsorption du glucose et du galactose ne doivent pas prendre ce médicament.
États hyperprolactinémiques
La déficience du champ visuel est une complication connue du macroprolactinome. Un traitement efficace avec Parlodel 2,5 mg conduit à une réduction de l'hyperprolactinémie et souvent à une résolution de la déficience visuelle. Chez certains patients, cependant, une détérioration secondaire des champs visuels peut se développer par la suite malgré des taux de prolactine normalisés et un rétrécissement tumoral, ce qui peut résulter d'une traction sur le chiasma optique qui est tiré vers le bas dans la selle maintenant partiellement vide. Dans ces cas, le défaut du champ visuel peut s'améliorer lors de la réduction de la dose de bromocriptine alors qu'il y a une certaine élévation de la prolactine et une certaine réexpansion de la tumeur. La surveillance des champs visuels chez les patients atteints de macroprolactinome est donc recommandée pour une reconnaissance précoce de la perte de champ secondaire due à une hernie chiasmale et une adaptation de la posologie du médicament.
L'efficacité relative de Parlodel par rapport à la chirurgie pour préserver les champs visuels n'est pas connue. Les patients présentant une perte de champ visuel rapidement progressive doivent être évalués par un neurochirurgien pour aider à décider du traitement le plus approprié.
Étant donné que la grossesse est souvent l'objectif thérapeutique chez de nombreuses patientes hyperprolactinémiques présentant une aménorrhée/galactorrhée et un hypogonadisme (stérilité), une évaluation attentive de l'hypophyse est essentielle pour détecter la présence d'un adénome sécrétant de la prolactine. Il doit être conseillé aux patientes ne cherchant pas à être enceintes ou à celles présentant de gros adénomes d'utiliser des mesures contraceptives autres que les contraceptifs oraux pendant le traitement par Parlodel. Étant donné qu'une grossesse peut survenir avant le retour des règles, un test de grossesse est recommandé au moins toutes les 4 semaines pendant la période d'aménorrhée et, une fois les règles rétablies, chaque fois qu'une patiente manque une période menstruelle. Le traitement par Parlodel SnapTabs ou gélules doit être interrompu dès que la grossesse est établie. Les patientes doivent être étroitement surveillées tout au long de la grossesse afin de détecter tout signe ou symptôme susceptible de signaler l'hypertrophie d'une tumeur sécrétant de la prolactine non détectée auparavant ou existante. L'arrêt du traitement par Parlodel chez les patients présentant des macroadénomes connus a été associé à une recroissance rapide de la tumeur et à une augmentation de la prolactine sérique dans la plupart des cas.
Une rhinorrhée du liquide céphalo-rachidien a été observée chez certains patients atteints d'adénomes sécrétant de la prolactine traités par Parlodel.
Acromégalie
Un vasospasme digital sensible au froid a été observé chez certains patients acromégales traités par Parlodel. La réponse, si elle se produit, peut être inversée en réduisant la dose de Parlodel 2,5 mg et peut être prévenue en gardant les doigts au chaud. Des cas d'hémorragies gastro-intestinales graves dues à des ulcères peptiques ont été signalés, certains mortels. Bien qu'il n'y ait aucune preuve que Parlodel 2,5 mg augmente l'incidence des ulcères gastro-duodénaux chez les patients acromégales, les symptômes évoquant un ulcère gastro-duodénal doivent être étudiés de manière approfondie et traités de manière appropriée. Les patients ayant des antécédents d'ulcère peptique ou d'hémorragie gastro-intestinale doivent être surveillés attentivement pendant le traitement par Parlodel.
Une expansion tumorale possible lors du traitement par Parlodel a été rapportée chez quelques patients. Étant donné que l'histoire naturelle des tumeurs sécrétant de l'hormone de croissance est inconnue, tous les patients doivent être étroitement surveillés et, si des signes d'expansion tumorale se développent, l'arrêt du traitement et d'autres procédures doivent être envisagés.
La maladie de Parkinson
La sécurité lors d'une utilisation à long terme pendant plus de 2 ans aux doses requises pour le parkinsonisme n'a pas été établie.
Comme pour tout traitement chronique, une évaluation périodique des fonctions hépatique, hématopoïétique, cardiovasculaire et rénale est recommandée. Une hypotension symptomatique peut survenir et, par conséquent, la prudence s'impose lors du traitement de patients recevant des médicaments antihypertenseurs.
Des doses élevées de Parlodel 2,5 mg peuvent être associées à une confusion et à des troubles mentaux. Étant donné que les patients parkinsoniens peuvent manifester des degrés légers de démence, la prudence s'impose lors du traitement de ces patients.
Parlodel administré seul ou en association avec la lévodopa peut provoquer des hallucinations (visuelles ou auditives). Les hallucinations disparaissent généralement avec une réduction de la posologie ; occasionnellement, l'arrêt de Parlodel 2,5 mg est nécessaire. Rarement, après des doses élevées, les hallucinations ont persisté pendant plusieurs semaines après l'arrêt de Parlodel.
Comme avec la lévodopa, la prudence s'impose lors de l'administration de Parlodel à des patients ayant des antécédents d'infarctus du myocarde qui présentent une arythmie résiduelle auriculaire, nodale ou ventriculaire.
Une fibrose rétropéritonéale a été rapportée chez quelques patients recevant un traitement à long terme (2 à 10 ans) avec Parlodel 2,5 mg à des doses allant de 30 à 140 mg par jour.
Des études épidémiologiques ont montré que les patients atteints de la maladie de Parkinson ont un risque plus élevé (2 environ 6 fois plus élevé) de développer un mélanome que la population générale. On ne sait pas si le risque accru observé était dû à la maladie de Parkinson ou à d'autres facteurs, tels que les médicaments utilisés pour traiter la maladie de Parkinson. Pour les raisons indiquées ci-dessus, il est conseillé aux patients et aux prestataires de surveiller fréquemment et régulièrement les mélanomes lors de l'utilisation de Parlodel pour toute indication. Idéalement, des examens périodiques de la peau devraient être effectués par des personnes dûment qualifiées (par exemple, des dermatologues).
L'arrêt de Parlodel doit être entrepris progressivement chaque fois que possible, même si le patient doit rester sous lévodopa. Un complexe de symptômes ressemblant au syndrome malin des neuroleptiques (caractérisé par une température élevée, une rigidité musculaire, une altération de la conscience et une instabilité autonome), sans autre étiologie évidente, a été rapporté en association avec une réduction rapide de la dose, l'arrêt ou des modifications du traitement antiparkinsonien.
Des symptômes tels que l'apathie, l'anxiété, la dépression, la fatigue, l'insomnie, la transpiration et la douleur ont été rapportés pendant la réduction progressive ou après l'arrêt des agonistes dopaminergiques, y compris Parlodel. Ces symptômes ne répondent généralement pas à la lévodopa. Avant l'arrêt de Parlodel, les patients doivent être informés des symptômes de sevrage potentiels et étroitement surveillés pendant et après l'arrêt de Parlodel. En cas de symptômes de sevrage sévères, la ré-administration d'un agoniste dopaminergique à la dose efficace la plus faible peut être envisagée.
Carcinogenèse, mutagenèse, altération de la fertilité
Une étude de 74 semaines a été menée chez des souris en utilisant des niveaux alimentaires de mésylate de bromocriptine équivalents à des doses orales de 10 et 50 mg/kg/jour. Une étude de 100 semaines chez le rat a été menée en utilisant des niveaux alimentaires équivalents à des doses orales de 1,7, 9,8 et 44 mg/kg/jour. Les doses les plus élevées testées chez les souris et les rats étaient respectivement d'environ 2,5 et 4,4 fois la dose humaine maximale administrée dans les essais cliniques contrôlés (100 mg/jour) en fonction de la surface corporelle. Des tumeurs utérines malignes, de l'endomètre et du myomètre, ont été trouvées chez les rats comme suit : 0/50 femelles témoins, 2/50 femelles ayant reçu 1,7 mg/kg par jour, 7/49 femelles ayant reçu 9,8 mg/kg par jour et 9/50 femelles ayant reçu 44 mg/kg par jour. L'apparition de ces néoplasmes est probablement attribuable au rapport œstrogène/progestérone élevé qui se produit chez les rats en raison de l'action inhibitrice de la prolactine du mésylate de bromocriptine. Les mécanismes endocriniens supposés être impliqués chez le rat ne sont pas présents chez l'homme. Il n'existe aucune corrélation connue entre les tumeurs malignes utérines survenant chez les rats traités à la bromocriptine et le risque humain. Contrairement aux résultats chez les rats, les utérus de souris tuées après 74 semaines de traitement n'ont pas montré de signes de changements liés au médicament.
Le potentiel mutagène du mésylate de bromocriptine a été évalué dans le cadre d'une batterie de tests comprenant le test de mutation bactérienne d'Ames, l'activité mutagène in vitro sur des fibroblastes de hamster chinois V79, l'analyse cytogénétique de cellules de moelle osseuse de hamster chinois après un traitement in vivo et un test du micronoyau in vivo pour le test mutagène. potentiel chez la souris.
Aucun effet mutagène n'a été obtenu dans aucun de ces tests.
La fertilité et les performances de reproduction chez les rats femelles n'ont pas été influencées négativement par le traitement par la bromocriptine au-delà de la diminution prévue du poids des ratons due à la suppression de la lactation. Chez les mâles traités avec 50 mg/kg de ce médicament, l'accouplement et la fertilité se situaient dans les limites de la normale. Une perte périnatale accrue a été produite dans les sous-groupes de mères, sacrifiées au jour 21 post-partum (pp) après s'être accouplées avec des mâles traités avec la dose la plus élevée (50 mg/kg).
Grossesse
Catégorie B
L'administration de 10 à 30 mg/kg de bromocriptine à 2 souches de rats les jours 6 à 15 post-coïtum (pc) ainsi qu'une dose unique de 10 mg/kg le jour 5 pc a interféré avec la nidation. Trois mg/kg administrés les jours 6 à 15 n'ont eu aucun effet sur la nidation et n'ont produit aucune anomalie. Chez les animaux traités du jour 8 au jour 15 pc, c'est-à-dire après l'implantation, 30 mg/kg ont produit une augmentation de la mortalité prénatale sous la forme d'une augmentation de l'incidence de la résorption embryonnaire. Une anomalie, une aplasie des vertèbres vertébrales et des côtes, a été trouvée dans le groupe de 262 fœtus issus des mères traitées avec 30 mg/kg de bromocriptine. Aucun effet fœtotoxique n'a été observé chez les descendants de mères traitées pendant la période péri- ou postnatale.
Deux études ont été menées sur des lapins (2 souches) pour déterminer le potentiel d'interférence avec la nidation. Des niveaux de dose de 100 ou 300 mg/kg/jour du jour 1 au jour 6 pc n'ont pas affecté négativement la nidation. La dose élevée était environ 63 fois la dose humaine maximale administrée dans les essais cliniques contrôlés (100 mg/jour), en fonction de la surface corporelle. Chez les lapins blancs de Nouvelle-Zélande, une certaine mortalité embryonnaire est survenue à 300 mg/kg, ce qui était le reflet d'une toxicité maternelle manifeste. Trois études ont été menées sur 2 souches de lapins pour déterminer le potentiel tératologique de la bromocriptine à des doses de 3, 10, 30, 100 et 300 mg/kg administrées du jour 6 au jour 18 pc Dans 2 études avec la souche Yellow-silver , une fente palatine a été observée chez 3 et 2 fœtus à des doses maternellement toxiques de 100 et 300 mg/kg, respectivement. Un fœtus témoin présentait également cette anomalie. Dans la troisième étude menée avec des lapins blancs de Nouvelle-Zélande selon un protocole identique, aucune fente palatine n'a été produite.
Aucun effet tératologique ou embryotoxique de la bromocriptine n'a été produit chez les 6 descendants de 6 singes à une dose de 2 mg/kg.
Des informations concernant 1276 grossesses chez des femmes prenant Parlodel ont été recueillies. Dans la majorité des cas, Parlodel a été arrêté dans les 8 semaines de grossesse (moyenne de 28,7 jours), cependant, 8 patientes ont reçu le médicament en continu tout au long de la grossesse. La dose quotidienne moyenne pour tous les patients était de 5,8 mg (intervalle de 1 à 40 mg).
Sur ces 1276 grossesses, il y a eu 1088 accouchements à terme (4 mort-nés), 145 avortements spontanés (11,4%) et 28 avortements provoqués (2,2%). De plus, 12 gravidités extra-utérines et 3 grains de beauté hydatiformes (2 fois chez la même patiente) ont provoqué une interruption précoce de grossesse. Ces données se comparent favorablement au taux d'avortement (11 % -25 %) cité pour les grossesses induites par le citrate de clomifène, la gonadotrophine ménopausique et la gonadotrophine chorionique.
Bien que les avortements spontanés ne soient souvent pas signalés, surtout avant 20 semaines de gestation, leur fréquence a été estimée à 15 %.
L'incidence des malformations congénitales dans la population en général varie de 2 % à 4,5 %. L'incidence sur 1109 naissances vivantes de patients recevant de la bromocriptine est de 3,3 %.
Il n'y a aucune suggestion que Parlodel 2,5 mg ait contribué au type ou à l'incidence des malformations congénitales dans ce groupe de nourrissons.
Mères allaitantes
Parlodel 2,5 mg ne doit pas être utilisé pendant l'allaitement chez les femmes en post-partum.
Utilisation pédiatrique
L'innocuité et l'efficacité de la bromocriptine pour le traitement des adénomes hypophysaires sécrétant de la prolactine ont été établies chez les patients âgés de 16 à l'âge adulte. Aucune donnée n'est disponible sur l'utilisation de la bromocriptine chez les patients pédiatriques de moins de 8 ans. Un seul patient de 8 ans traité par bromocriptine pour un macroadénome hypophysaire sécrétant de la prolactine a été rapporté sans réponse thérapeutique.
L'utilisation de la bromocriptine pour le traitement des adénomes sécrétant de la prolactine chez les patients pédiatriques âgés de 11 à moins de 16 ans est étayée par des preuves issues d'essais bien contrôlés chez l'adulte, avec des données supplémentaires chez un nombre limité (n = 14) d'enfants. et les adolescents de 11 à 15 ans atteints de macro et de microadénomes hypophysaires sécrétant de la prolactine qui ont été traités par la bromocriptine. Sur les 14 patients signalés, 9 ont eu des résultats positifs, 3 des réponses partielles et 2 n'ont pas répondu au traitement à la bromocriptine. L'hypopituitarisme chronique a compliqué le traitement du macroadénome chez 5 des répondeurs, à la fois chez les patients recevant de la bromocriptine seule et chez ceux qui ont reçu de la bromocriptine en association avec un traitement chirurgical et/ou une irradiation hypophysaire.
La sécurité et l'efficacité de bromocriptine dans les patients de pédiatrie n'ont été établies pour aucune autre indication énumérée dans la section d'INDICATIONS ET D'UTILISATION.
Utilisation gériatrique
Les études cliniques sur Parlodel 2,5 mg n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer si les personnes âgées réagissent différemment des sujets plus jeunes. Cependant, d'autres expériences cliniques rapportées, y compris la notification post-commercialisation d'événements indésirables, n'ont pas identifié de différences de réponse ou de tolérabilité entre les patients âgés et les patients plus jeunes. Même si aucune variation de l'efficacité ou du profil des effets indésirables chez les patients gériatriques prenant Parlodel 2,5 mg n'a été observée, une plus grande sensibilité de certaines personnes âgées ne peut être catégoriquement exclue. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant par l'extrémité inférieure de la plage de doses, reflétant la fréquence plus élevée de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux dans cette population.
SURDOSAGE
Les signes et symptômes les plus fréquemment signalés associés à un surdosage aigu de Parlodel (mésylate de bromocriptine) sont : nausées, vomissements, constipation, diaphorèse, étourdissements, pâleur, hypotension grave, malaise, confusion, léthargie, somnolence, délires, hallucinations et bâillements répétés. La dose létale n'a pas été établie et le médicament a une marge de sécurité très large. Cependant, un décès est survenu chez un patient qui s'est suicidé avec une quantité inconnue de Parlodel 2,5 mg et de la chloroquine.
Le traitement du surdosage consiste en l'élimination du médicament par des vomissements (si conscient), un lavage gastrique, du charbon actif ou une catharsis saline. Une surveillance attentive et un enregistrement de l'apport et de la sortie de liquide sont essentiels. L'hypotension doit être traitée en plaçant le patient en position de Trendelenburg et en lui administrant des liquides IV. Si un soulagement satisfaisant de l'hypotension ne peut être obtenu en utilisant les mesures ci-dessus dans toute leur étendue, les vasopresseurs doivent être envisagés.
Il y a eu des rapports isolés d'enfants qui ont accidentellement ingéré Parlodel. Les vomissements, la somnolence et la fièvre ont été signalés comme événements indésirables. Les patients ont récupéré soit spontanément en quelques heures, soit après une prise en charge adaptée.
CONTRE-INDICATIONS
Hypersensibilité à la bromocriptine ou à l'un des excipients de Parlodel (mésylate de bromocriptine), hypertension non contrôlée et sensibilité à tout alcaloïde de l'ergot. Chez les patientes traitées pour une hyperprolactinémie, Parlodel 2,5 mg doit être arrêté dès le diagnostic de grossesse (voir PRÉCAUTIONS , États hyperprolactinémiques ). Dans le cas où Parlodel 2,5 mg est réinstitué pour contrôler un macroadénome à expansion rapide (voir PRÉCAUTIONS , États hyperprolactinémiques et qu'une patiente présente un trouble hypertensif de la grossesse, le bénéfice de la poursuite de Parlodel doit être mis en balance avec le risque éventuel de son utilisation au cours d'un trouble hypertensif de la grossesse. Lorsque Parlodel est utilisé pour traiter l'acromégalie, le prolactinome ou la maladie de Parkinson chez les patientes qui deviennent enceintes par la suite, une décision doit être prise pour déterminer si le traitement continue d'être médicalement nécessaire ou peut être arrêté. S'il est poursuivi, le médicament doit être arrêté chez les femmes susceptibles de présenter des troubles hypertensifs de la grossesse (y compris l'éclampsie, la prééclampsie ou l'hypertension induite par la grossesse) à moins que l'arrêt de Parlodel ne soit considéré comme médicalement contre-indiqué.
Le médicament ne doit pas être utilisé pendant la période post-partum chez les femmes ayant des antécédents de maladie coronarienne et d'autres affections cardiovasculaires graves, sauf si le retrait est considéré comme médicalement contre-indiqué. Si le médicament est utilisé pendant la période post-partum, le patient doit être observé avec prudence.
PHARMACOLOGIE CLINIQUE
Parlodel (mésylate de bromocriptine) est un agoniste des récepteurs de la dopamine, qui active les récepteurs de la dopamine post-synaptiques. Les neurones dopaminergiques du processus tubéro-infundibulaire modulent la sécrétion de prolactine par l'hypophyse antérieure en sécrétant un facteur inhibiteur de la prolactine (que l'on pense être la dopamine); dans le corps strié, les neurones dopaminergiques sont impliqués dans le contrôle de la fonction motrice. Cliniquement, Parlodel 2,5 mg réduit significativement les taux plasmatiques de prolactine chez les patients présentant une prolactine physiologiquement élevée ainsi que chez les patients présentant une hyperprolactinémie. L'inhibition de la lactation physiologique ainsi que de la galactorrhée dans les états pathologiques d'hyperprolactinémie est obtenue à des doses qui n'affectent pas la sécrétion d'autres hormones tropiques par l'antéhypophyse. Des expériences ont démontré que la bromocriptine induit un comportement stéréotypé durable chez les rongeurs et un comportement de retournement chez les rats présentant des lésions unilatérales de la substantia nigra. Ces actions, caractéristiques de celles produites par la dopamine, sont inhibées par les antagonistes dopaminergiques et suggèrent une action directe de la bromocriptine sur les récepteurs dopaminergiques striataux.
Le mésylate de bromocriptine est un agent non hormonal et non œstrogénique qui inhibe la sécrétion de prolactine chez l'homme, avec peu ou pas d'effet sur les autres hormones hypophysaires, sauf chez les patients atteints d'acromégalie, où il abaisse les taux sanguins élevés d'hormone de croissance chez la majorité des patients.
Le mésylate de bromocriptine produit son effet thérapeutique dans le traitement de la maladie de Parkinson, une affection clinique caractérisée par un déficit progressif de la synthèse de la dopamine dans la substantia nigra, en stimulant directement les récepteurs de la dopamine dans le corps strié. En revanche, la lévodopa n'exerce son effet thérapeutique qu'après conversion en dopamine par les neurones de la substantia nigra, dont on sait qu'ils sont numériquement diminués dans cette population de patients.
Pharmacocinétique
Absorption
Après l'administration d'une dose unique de comprimés de Parlodel 2,5 mg, 2 x 2,5 mg à 5 volontaires sains à jeun, les concentrations plasmatiques maximales moyennes de bromocriptine, le temps nécessaire pour atteindre les concentrations plasmatiques maximales et la demi-vie d'élimination étaient de 465 pg/mL ± 226, 2,5 h ± 2 et 4,85 h, respectivement.1 Une relation linéaire a été trouvée entre des doses uniques de Parlodel 2,5 mg et la Cmax et l'ASC dans la plage de doses de 1 à 7,5 mg.2 La pharmacocinétique des métabolites de la bromocriptine n'a pas été rapportée.
La nourriture n'a pas affecté de manière significative l'exposition systémique à la bromocriptine après l'administration de comprimés de Parlodel, 2,5 mg.3 Il est recommandé de prendre Parlodel 2,5 mg avec de la nourriture en raison du pourcentage élevé de sujets qui vomissent après avoir reçu de la bromocriptine à jeun.
Après l'administration de Parlodel 5 mg deux fois par jour pendant 14 jours, la Cmax et l'ASC de la bromocriptine à l'état d'équilibre étaient respectivement de 628 ± 375 pg/mL et de 2 377 ± 1 186 pg*h/mL.4
Distribution
Des expériences in vitro ont montré que la bromocriptine était liée à 90% -96% à l'albumine sérique.
Métabolisme
La bromocriptine subit une importante biotransformation de premier passage, reflétée par des profils complexes de métabolites et par une absence presque complète de médicament parent dans l'urine et les fèces.
Des études in vitro utilisant des microsomes hépatiques humains ont montré que la bromocriptine a une forte affinité pour le CYP3A et que les hydroxylations au niveau du cycle proline du fragment cyclopeptide constituaient une voie métabolique principale.5 Les inhibiteurs et/ou les substrats puissants du CYP3A4 pourraient donc inhiber la clairance de la bromocriptine et du plomb. à des niveaux accrus. (voir PRÉCAUTIONS , INTERACTIONS MÉDICAMENTEUSES section). La participation d'autres enzymes CYP majeures telles que 2D6, 2C8 et 2C19 sur le métabolisme de la bromocriptine n'a pas été évaluée. La bromocriptine est également un inhibiteur du CYP3A4 avec une valeur IC50 calculée de 1,69 μM.6 Compte tenu des faibles concentrations thérapeutiques de bromocriptine chez les patients (Cmax = 0,82 nM), une altération significative du métabolisme d'un second médicament dont la clairance est médiée par le CYP3A4 ne devrait pas être attendu. L'effet potentiel de la bromocriptine et de ses métabolites comme inducteurs des enzymes CYP n'a pas été rapporté.
Excrétion
Environ 82 % et 5,6 % de la dose radioactive administrée par voie orale ont été récupérés respectivement dans les fèces et l'urine. L'acide bromolysergique et l'acide bromisolysergique représentaient la moitié de la radioactivité dans l'urine.5
Populations spécifiques
Effet de l'insuffisance rénale
L'effet de la fonction rénale sur la pharmacocinétique de la bromocriptine n'a pas été évalué.
Étant donné que la molécule mère et ses métabolites sont presque entièrement excrétés via le métabolisme et que seulement 6 % sont éliminés par voie rénale, l'insuffisance rénale peut ne pas avoir d'impact significatif sur la pharmacocinétique de la bromocriptine et de ses métabolites (voir PRÉCAUTIONS , Général ).
Effet de l'insuffisance hépatique
L'effet de l'insuffisance hépatique sur la pharmacocinétique de Parlodel et de ses métabolites n'a pas été évalué. Étant donné que Parlodel est principalement éliminé par métabolisme, une insuffisance hépatique peut augmenter les taux plasmatiques de bromocriptine, par conséquent, la prudence peut être nécessaire (voir PRÉCAUTIONS , Général ).
L'effet de l'âge, de la race et du sexe sur la pharmacocinétique de la bromocriptine et de ses métabolites n'a pas été évalué.
Etudes cliniques
Dans environ 75 % des cas d'aménorrhée et de galactorrhée, le traitement par Parlodel 2,5 mg supprime complètement ou presque complètement la galactorrhée et rétablit les cycles menstruels ovulatoires normaux.
Les règles sont généralement rétablies avant la suppression complète de la galactorrhée ; le délai pour cela est en moyenne de 6 à 8 semaines. Cependant, certains patients répondent en quelques jours, et d'autres peuvent prendre jusqu'à 8 mois.
La galactorrhée peut prendre plus de temps à contrôler selon le degré de stimulation du tissu mammaire avant le traitement. Au moins une réduction de 75% de la sécrétion est généralement observée après 8 à 12 semaines. Certains patients peuvent ne pas répondre même après 12 mois de traitement.
Chez de nombreux patients acromégales, Parlodel 2,5 mg produit une réduction rapide et durable des taux circulants d'hormone de croissance sérique.
1 Nelson, M. et. Al. (1990). Évaluation pharmacocinétique de l'érythromycine et de la caféine administrées avec de la bromocriptine. Clin Pharmacol Ther; 47(6):694-7.
Schran, HF, Bhuta, SI, Schwartz et al. (1980). La pharmacocinétique de la bromocriptine chez l'homme. Dans : Golstein, M. Calne, DB, et. Al (éds). Composé de l'ergot et fonction cérébrale : aspects neuroendocriniens et neuropsychiatriques, pp. 125-139, New York, Rave Press.
3 Kopitar, Z., Vrhovac, B., Povsic, L., Plavsic, F., Francetic, I., Urbancic, J. (1991). L'effet de la nourriture et du métoclopramide sur la pharmacocinétique et les effets secondaires de la bromocriptine. Eur J Drug Metab Pharmacokinet ; 16(3):177-81
4 Flogstad, AK, Halse, J., Grass, P., Abisch, E., Djoseland, O., Kutz, K., Bodd, E. et Jervell, J., (1994). Une comparaison de l'octréotide, de la bromocriptine ou d'une combinaison des deux médicaments dans l'acromégalie. Journal d'endocrinologie clinique et métabolisme ; Vol 79, 461-465
5 Peyronneau MA, Delaforge M, Rivière R et al. 1994. Haute affinité des ergopeptides pour le CYP P450 3A. Importance de leur fraction peptidique pour la reconnaissance de P450 et l'hydroxylation de la bromocriptine. Eur J Biochem 223:947-56.
Wynalda, MA, Wienkers, LC (1997). Évaluation des interactions potentielles entre les agonistes des récepteurs de la dopamine et diverses enzymes du cytochrome P450 humain à l'aide d'un simple crible d'inhibition in vitro. Médicament Metab Dispos ; 25:1211-14.
INFORMATIONS PATIENTS
Au cours des essais cliniques, des étourdissements, de la somnolence, des évanouissements, des évanouissements et des syncopes ont été signalés au début du traitement par Parlodel 2,5 mg. Dans les rapports post-commercialisation, Parlodel a été associé à de la somnolence et à des épisodes d'endormissement soudain, en particulier chez les patients atteints de la maladie de Parkinson. L'endormissement soudain au cours des activités quotidiennes, dans certains cas sans prise de conscience ou signes avant-coureurs, a été très rarement signalé. Tous les patients recevant Parlodel doivent être avertis de ne pas participer à des activités nécessitant des réponses rapides et précises, telles que la conduite d'une automobile ou l'utilisation de machines. Les patients traités par Parlodel 2,5 mg et présentant une somnolence et/ou des épisodes de sommeil soudains doivent être avertis de ne pas conduire ou de ne pas se livrer à des activités où la vigilance réduite peut les exposer ou exposer d'autres personnes à un risque de blessure grave ou de mort (par exemple, faire fonctionner des machines).
Les patients recevant Parlodel 2,5 mg pour des états hyperprolactinémiques associés à un macroadénome ou ceux qui ont déjà subi une chirurgie transsphénoïdale doivent être informés de signaler tout écoulement nasal aqueux persistant à leur médecin. Les patients recevant Parlodel 2,5 mg pour le traitement d'un macroadénome doivent être informés que l'arrêt du traitement peut être associé à une repousse rapide de la tumeur et à la récurrence de leurs symptômes initiaux.
Les patients et leurs soignants doivent être avertis de la possibilité que les patients puissent ressentir des envies intenses de dépenser de l'argent de manière incontrôlable, des envies intenses de jouer, des envies sexuelles accrues et d'autres envies intenses et l'incapacité de contrôler ces envies tout en prenant Parlodel. Conseillez aux patients et à leurs soignants d'informer leur fournisseur de soins de santé s'ils développent des dépenses incontrôlées nouvelles ou accrues, des envies de jeu, des envies sexuelles ou d'autres envies pendant leur traitement par Parlodel [voir PRÉCAUTIONS ].
Particulièrement pendant les premiers jours de traitement, des réactions hypotensives peuvent survenir occasionnellement et entraîner une diminution de la vigilance, une attention particulière doit être portée lors de la conduite d'un véhicule ou de l'utilisation de machines.
Conseillez aux patients de contacter leur fournisseur de soins de santé s'ils souhaitent arrêter Parlodel ou diminuer la dose de Parlodel. Conseillez aux patients à qui on a prescrit une dose plus faible ou à qui on a arrêté de prendre le médicament d'informer leur professionnel de la santé s'ils présentent des symptômes de sevrage tels que fièvre, rigidité musculaire, altération de la conscience, apathie, anxiété, dépression, fatigue, insomnie, transpiration ou douleur (voir PRÉCAUTIONS ).
