Estrace 1mg, 2mg Estradiol Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Estrace et comment est-il utilisé ?
Estrace est un médicament sur ordonnance utilisé pour traiter les symptômes du cancer du sein métastatique, de l'ostéoporose, du faible taux d'œstrogènes (hypoestrogénisme), de l'atrophie vulvaire et vaginale à la ménopause. Estrace 1 mg peut être utilisé seul ou avec d'autres médicaments.
Estrace 1 mg appartient à une classe de médicaments appelés dérivés d'œstrogène.
On ne sait pas si Estrace 1 mg est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles d'Estrace 1mg ?
Estrace peut provoquer des effets secondaires graves, notamment :
- douleur ou pression thoracique,
- douleur se propageant à la mâchoire ou à l'épaule,
- nausée,
- transpiration,
- engourdissement ou faiblesse soudaine (surtout d'un côté du corps),
- maux de tête intenses et soudains,
- troubles de l'élocution,
- des problèmes de vision ou d'équilibre,
- perte de vision soudaine,
- douleur thoracique lancinante,
- se sentir essoufflé,
- tousser du sang,
- douleur ou chaleur dans une ou les deux jambes,
- gonflement ou sensibilité de l'estomac,
- jaunissement de la peau ou des yeux (jaunisse),
- problèmes de mémoire,
- confusion,
- comportement inhabituel,
- saignements vaginaux inhabituels,
- douleur pelvienne,
- boule dans ton sein,
- vomissement,
- constipation,
- augmentation de la soif ou de la miction,
- faiblesse musculaire,
- douleurs osseuses, une
- ré
- manque d'énergie
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Estrace incluent :
- nausée,
- vomissement,
- diarrhée,
- des crampes d'estomac,
- des changements d'humeur,
- troubles du sommeil (insomnie),
- mal de tête,
- mal au dos,
- douleur mammaire,
- symptômes du rhume (nez bouché, douleurs sinusales, mal de gorge),
- gain de poids,
- amincissement des cheveux du cuir chevelu,
- démangeaisons ou pertes vaginales,
- changements dans vos menstruations, et
- saignement intermenstruel
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Estrace. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LES ŒSTROGÈNES AUGMENTENT LE RISQUE DE CANCER DE L'ENDOMÈTRE
Une surveillance clinique étroite de toutes les femmes prenant des œstrogènes est importante. Des mesures diagnostiques adéquates, y compris un prélèvement de l'endomètre lorsqu'il est indiqué, doivent être prises pour exclure une malignité dans tous les cas de saignements vaginaux anormaux persistants ou récurrents non diagnostiqués. Il n'y a aucune preuve que l'utilisation d'œstrogènes « naturels » entraîne un profil de risque endométrial différent de celui des œstrogènes « synthétiques » à des doses d'œstrogènes équivalentes. (Voir AVERTISSEMENTS , Néoplasmes malins , Cancer de l'endomètre .)
RISQUES CARDIOVASCULAIRES ET AUTRES
Les œstrogènes avec ou sans progestatif ne doivent pas être utilisés pour la prévention des maladies cardiovasculaires. (Voir AVERTISSEMENTS , Troubles cardiovasculaires .)
L'étude Women's Health Initiative (WHI) a rapporté des risques accrus d'infarctus du myocarde, d'accident vasculaire cérébral, de cancer du sein invasif, d'embolie pulmonaire et de thrombose veineuse profonde chez les femmes ménopausées (âgées de 50 à 79 ans) pendant 5 ans de traitement par voie orale. oestrogènes conjugués (CE 0,625 mg) associés à l'acétate de médroxyprogestérone (MPA 2,5 mg) par rapport au placebo. (Voir PHARMACOLOGIE CLINIQUE , Etudes cliniques .)
La Women's Health Initiative Memory Study (WHIMS), une sous-étude de la WHI, a rapporté un risque accru de développer une démence probable chez les femmes ménopausées âgées de 65 ans ou plus pendant 4 ans de traitement par œstrogènes conjugués oraux plus acétate de médroxyprogestérone par rapport au placebo . On ne sait pas si cette constatation s'applique aux femmes ménopausées plus jeunes ou aux femmes prenant un traitement à base d'œstrogènes seuls. (Voir PHARMACOLOGIE CLINIQUE , Etudes cliniques .)
D'autres doses d'œstrogènes conjugués oraux avec de l'acétate de médroxyprogestérone et d'autres combinaisons et formes posologiques d'œstrogènes et de progestatifs n'ont pas été étudiées dans les essais cliniques WHI et, en l'absence de données comparables, ces risques doivent être supposés similaires. En raison de ces risques, les œstrogènes avec ou sans progestatif doivent être prescrits aux doses efficaces les plus faibles et pour la durée la plus courte compatible avec les objectifs du traitement et les risques pour la femme individuelle.
LA DESCRIPTION
ESTRACE ® (comprimés d'estradiol, USP) pour administration orale contient 0,5, 1 ou 2 mg d'estradiol micronisé par comprimé. L'estradiol (17ß-estradiol) est un solide cristallin blanc, chimiquement décrit comme estra-1,3,5,(10)-triène-3, 17ß-diol. La formule structurale est :
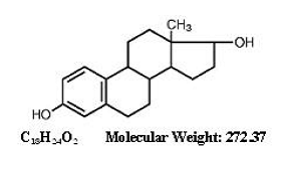
Ingrédients inactifs : Dioxyde de silicium colloïdal, amidon de maïs, phosphate de calcium dibasique, lactose monohydraté, stéarate de magnésium et glycolate d'amidon sodique. De plus, le 1 mg contient également du bleu FD&C no. 1 laque d'aluminium et D&C rouge no. 27 lac d'aluminium. Le 2 mg contient également du bleu FD&C no. 1 laque d'aluminium et FD&C jaune no. 5 (tartrazine) laque aluminique.
LES INDICATIONS
ESTRACE (comprimés d'estradiol, USP) est indiqué dans :
DOSAGE ET ADMINISTRATION
Lorsqu'un œstrogène est prescrit à une femme ménopausée avec un utérus, un progestatif doit également être instauré pour réduire le risque de cancer de l'endomètre. Une femme sans utérus n'a pas besoin de progestatif. L'utilisation d'œstrogène, seul ou en association avec un progestatif, doit se faire avec la dose efficace la plus faible et pour la durée la plus courte compatible avec les objectifs du traitement et les risques pour la femme individuelle. Les patients doivent être réévalués périodiquement selon les besoins cliniques (p. ex., tous les 3 à 6 mois) pour déterminer si le traitement est toujours nécessaire (voir AVERTISSEMENTS ENCADRÉS et AVERTISSEMENTS ). Pour les femmes qui ont un utérus, des mesures diagnostiques adéquates, telles que le prélèvement de l'endomètre, lorsqu'elles sont indiquées, doivent être prises pour exclure une malignité en cas de saignements vaginaux anormaux persistants ou récurrents non diagnostiqués.
Les patients doivent être initiés à la dose la plus faible pour l'indication.
1. Pour le traitement des symptômes vasomoteurs modérés à sévères, de l'atrophie vulvaire et vaginale associée à la ménopause, la dose et le schéma thérapeutique les plus faibles qui contrôleront les symptômes doivent être choisis et le médicament doit être interrompu le plus rapidement possible.
Les tentatives d'interruption ou de diminution de la médication doivent être effectuées à des intervalles de 3 à 6 mois. La plage posologique initiale habituelle est de 1 à 2 mg par jour d'estradiol ajustée si nécessaire pour contrôler les symptômes présentés. La dose minimale efficace pour le traitement d'entretien doit être déterminée par titration. L'administration doit être cyclique (par exemple, 3 semaines et 1 semaine de repos).
2. Pour le traitement de l'hypoestrogénie féminine due à l'hypogonadisme, à la castration ou à une insuffisance ovarienne primaire.
Le traitement est généralement initié avec une dose de 1 à 2 mg par jour d'estradiol, ajustée si nécessaire pour contrôler les symptômes présentés; la dose minimale efficace pour le traitement d'entretien doit être déterminée par titration.
3. Pour le traitement du cancer du sein, à titre palliatif uniquement, chez des femmes et des hommes dûment sélectionnés atteints d'une maladie métastatique.
La posologie suggérée est de 10 mg trois fois par jour pendant une période d'au moins trois mois.
4. Pour le traitement du carcinome avancé androgéno-dépendant de la prostate, à titre palliatif uniquement.
La posologie suggérée est de 1 à 2 mg trois fois par jour. L'efficacité de la thérapie peut être jugée par des déterminations de phosphatase ainsi que par une amélioration symptomatique du patient.
5. Pour la prévention de l'ostéoporose.
Lors de la prescription uniquement pour la prévention de l'ostéoporose post-ménopausique, le traitement ne doit être envisagé que pour les femmes présentant un risque important d'ostéoporose et pour lesquelles les médicaments non œstrogéniques ne sont pas considérés comme appropriés.
La dose efficace la plus faible d'ESTRACE 2 mg n'a pas été déterminée.
COMMENT FOURNIE
ESTRACE® (comprimés d'estradiol, USP) sont disponibles en :
0,5 mg Comprimé blanc à blanc cassé, ovale, plat, biseauté, sécable. Gravé avec 720 / ½ sur le côté marqué et toilettes d'un autre côté. Disponible en bouteilles de :
100 comprimés CDN 0430-0720-24
1mg : Comprimé violet clair, ovale, plat, biseauté, sécable. Gravé avec 721/1 sur le côté marqué et toilettes d'un autre côté. Disponible en bouteilles de :
100 comprimés CDN 0430-0721-24
2mg : Comprimé vert, ovale, plat, biseauté, sécable. Gravé avec 722/2 sur le côté marqué et toilettes d'un autre côté. Disponible en bouteilles de :
100 comprimés CDN 0430-0722-24
Conserver à 20° à 25° C (68° à 77°F) [Voir Température ambiante contrôlée USP ].
Dispenser dans un récipient étanche et résistant à la lumière tel que défini dans l'USP, avec une fermeture à l'épreuve des enfants (au besoin).
GARDEZ CECI ET TOUS LES MÉDICAMENTS HORS DE LA PORTÉE DES ENFANTS.
Fabriqué par : TEVA PHARMACEUTICALS USA Sellersville, PA 18960. Commercialisé par : Warner Chilcott (US), LLC, Rockaway, NJ 07866, 1-800-521-8813. Révisé : septembre 2013
EFFETS SECONDAIRES
Voir AVERTISSEMENTS ENCADRÉS , AVERTISSEMENTS et PRÉCAUTIONS .
Les effets indésirables supplémentaires suivants ont été rapportés avec un traitement par œstrogène et/ou progestatif.
Système génito-urinaire
Changements dans le profil des saignements vaginaux et saignements ou flux de retrait anormaux ; saignements intermenstruels, spotting, dysménorrhée Augmentation de la taille des léiomyomes utérins Vaginite, y compris candidose vaginale Modification de la quantité de sécrétions cervicales Modifications de l'ectropion cervical Cancer de l'ovaire ; hyperplasie de l'endomètre; cancer de l'endomètre
Seins
Tendresse, hypertrophie, douleur, écoulement du mamelon, galactorrhée ; changements mammaires fibrokystiques; cancer du sein
Cardiovasculaire
Thrombose veineuse profonde et superficielle ; embolie pulmonaire; thrombophlébite; infarctus du myocarde; accident vasculaire cérébral; augmentation de la pression artérielle
Gastro-intestinal
Nausées, vomissements Crampes abdominales, ballonnements Ictère cholestatique Augmentation de l'incidence des maladies de la vésicule biliaire Pancréatite Agrandissement des hémangiomes hépatiques
Peau
Chloasma ou mélasma pouvant persister après l'arrêt du médicament Érythème polymorphe Érythème noueux Éruption hémorragique Perte de cheveux Hirsutisme Prurit, éruption cutanée
Yeux
Thrombose vasculaire rétinienne Accroissement de la courbure cornéenne Intolérance aux lentilles de contact
Système nerveux central
Maux de tête, migraine, étourdissements Dépression mentale Chorée Nervosité, troubles de l'humeur, irritabilité Exacerbation de l'épilepsie Démence
Divers
Augmentation ou diminution du poids Réduction de la tolérance aux glucides Aggravation de la porphyrie Œdème Arthralgies; crampes dans les jambes Modifications de la libido Urticaire Œdème de Quincke Réactions anaphylactoïdes/anaphylactiques Hypocalcémie Exacerbation de l'asthme Augmentation des triglycérides
INTERACTIONS MÉDICAMENTEUSES
Interactions médicament/test de laboratoire
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
Voir AVERTISSEMENTS ENCADRÉS .
Troubles cardiovasculaires
Le traitement par œstrogène et œstrogène/progestatif a été associé à un risque accru d'événements cardiovasculaires tels qu'infarctus du myocarde et accident vasculaire cérébral, ainsi que de thrombose veineuse et d'embolie pulmonaire (thromboembolie veineuse ou TEV). Si l'un de ces effets survient ou est suspecté, les œstrogènes doivent être arrêtés immédiatement.
Les facteurs de risque de maladie vasculaire artérielle (p. ex., hypertension, diabète sucré, tabagisme, hypercholestérolémie et obésité) et/ou de thromboembolie veineuse (p. ex., antécédents personnels ou familiaux de TEV, obésité et lupus érythémateux disséminé) doivent être gérés de manière appropriée.
Maladie coronarienne et accident vasculaire cérébral
Dans l'étude Women's Health Initiative (WHI), une augmentation du nombre d'infarctus du myocarde et d'accidents vasculaires cérébraux a été observée chez les femmes recevant l'EC par rapport au placebo. Ces observations sont préliminaires et l'étude se poursuit. (Voir PHARMACOLOGIE CLINIQUE , Etudes cliniques .)
Dans la sous-étude CE/MPA de WHI, un risque accru d'événements de maladie coronarienne (CHD) (définis comme un infarctus du myocarde non mortel et un décès par coronaropathie) a été observé chez les femmes recevant CE/MPA par rapport aux femmes recevant un placebo (37 contre 30 pour 10 000 personnes années). L'augmentation du risque a été observée la première année et a persisté.
Dans la même sous-étude de WHI, un risque accru d'accident vasculaire cérébral a été observé chez les femmes recevant CE/MPA par rapport aux femmes recevant un placebo (29 contre 21 pour 10 000 années-femmes). L'augmentation du risque a été observée après la première année et a persisté.
Chez les femmes ménopausées atteintes d'une maladie cardiaque documentée (n = 2 763, âge moyen 66,7 ans), un essai clinique contrôlé de prévention secondaire des maladies cardiovasculaires (Heart and Estrogen/Progestin Replacement Study ; HERS) traitement par CE/MPA (0,625 mg/2,5 mg par jour) n'ont démontré aucun bénéfice cardiovasculaire. Au cours d'un suivi moyen de 4,1 ans, le traitement par CE/MPA n'a pas réduit le taux global d'événements coronariens chez les femmes ménopausées atteintes d'une maladie coronarienne établie. Il y a eu plus d'événements coronariens dans le groupe traité par CE/MPA que dans le groupe placebo au cours de la première année, mais pas au cours des années suivantes. Deux mille trois cent vingt et une femmes de l'essai original HERS ont accepté de participer à une extension en ouvert de HERS, HERS II. Le suivi moyen dans HERS II était de 2,7 ans supplémentaires, pour un total de 6,8 ans au total. Les taux d'événements coronariens étaient comparables chez les femmes du groupe EC/MPA et du groupe placebo dans le SHER, le SHER II et dans l'ensemble.
De fortes doses d'œstrogènes (5 mg d'œstrogènes conjugués par jour), comparables à celles utilisées pour traiter le cancer de la prostate et du sein, ont montré dans un vaste essai clinique prospectif chez l'homme qu'elles augmentaient les risques d'infarctus du myocarde non mortel, d'embolie pulmonaire et de thrombophlébite.
Thromboembolie veineuse (TEV).
Dans l'étude Women's Health Initiative (WHI), une augmentation de la TEV a été observée chez les femmes recevant l'EC par rapport au placebo. Ces observations sont préliminaires et l'étude se poursuit. (Voir PHARMACOLOGIE CLINIQUE , Etudes cliniques .)
Dans la sous-étude CE/MPA de WHI, un taux deux fois plus élevé de TEV, y compris de thrombose veineuse profonde et d'embolie pulmonaire, a été observé chez les femmes recevant CE/MPA par rapport aux femmes recevant un placebo. Le taux de TEV était de 34 pour 10 000 années-femmes dans le groupe EC/MPA contre 16 pour 10 000 années-femmes dans le groupe placebo. L'augmentation du risque de TEV a été observée au cours de la première année et a persisté.
Si possible, les œstrogènes doivent être interrompus au moins 4 à 6 semaines avant une intervention chirurgicale du type associé à un risque accru de thromboembolie, ou pendant les périodes d'immobilisation prolongée.
Néoplasmes malins
Cancer de l'endomètre
L'utilisation d'œstrogènes sans opposition chez les femmes dont l'utérus est intact a été associée à un risque accru de cancer de l'endomètre. Le risque de cancer de l'endomètre signalé chez les utilisatrices d'œstrogènes sans opposition est environ 2 à 12 fois plus élevé que chez les non-utilisatrices et semble dépendre de la durée du traitement et de la dose d'œstrogène. La plupart des études ne montrent aucun risque accru significatif associé à l'utilisation d'œstrogènes pendant moins d'un an. Le plus grand risque semble associé à une utilisation prolongée - avec des risques accrus de 15 à 24 fois pendant cinq à dix ans ou plus - et ce risque persiste pendant 8 à plus de 15 ans après l'arrêt de l'œstrogénothérapie.
La surveillance clinique de toutes les femmes prenant des associations œstroprogestatives est importante (voir PRÉCAUTIONS ). Des mesures diagnostiques adéquates, y compris un prélèvement de l'endomètre lorsqu'il est indiqué, doivent être prises pour exclure une malignité dans tous les cas de saignements vaginaux anormaux persistants ou récurrents non diagnostiqués. Il n'y a aucune preuve que l'utilisation d'œstrogènes naturels entraîne un profil de risque endométrial différent de celui des œstrogènes synthétiques à dose équivalente d'œstrogène. Il a été démontré que l'ajout d'un progestatif à l'oestrogénothérapie réduit le risque d'hyperplasie de l'endomètre, qui peut être un précurseur du cancer de l'endomètre.
Cancer du sein
Il a été rapporté que l'utilisation d'œstrogènes et de progestatifs par les femmes ménopausées augmente le risque de cancer du sein. L'essai clinique randomisé le plus important fournissant des informations sur ce problème est la sous-étude de la Women's Health Initiative (WHI) sur la CE/MPA (voir PHARMACOLOGIE CLINIQUE , Etudes cliniques ). Les résultats des études observationnelles sont généralement cohérents avec ceux de l'essai clinique WHI et ne signalent aucune variation significative du risque de cancer du sein entre les différents œstrogènes ou progestatifs, les doses ou les voies d'administration.
La sous-étude CE/MPA de WHI a rapporté un risque accru de cancer du sein chez les femmes qui ont pris CE/MPA pendant un suivi moyen de 5,6 ans. Des études observationnelles ont également rapporté un risque accru pour la thérapie combinée œstrogène/progestatif, et un risque accru plus faible pour la thérapie à base d'œstrogène seul, après plusieurs années d'utilisation. Dans l'essai WHI et dans des études observationnelles, l'excès de risque augmentait avec la durée d'utilisation. D'après les études observationnelles, le risque semblait revenir à la ligne de base environ cinq ans après l'arrêt du traitement. De plus, des études observationnelles suggèrent que le risque de cancer du sein était plus élevé et est apparu plus tôt avec la thérapie combinée œstrogène/progestatif par rapport à la thérapie à base d'œstrogène seul.
Dans la sous-étude CE/MPA, 26 % des femmes ont déclaré avoir déjà utilisé des œstrogènes seuls et/ou une hormonothérapie combinée œstrogène/progestatif. Après un suivi moyen de 5,6 ans au cours de l'essai clinique, le risque relatif global de cancer du sein invasif était de 1,24 (intervalle de confiance à 95 % 1,01-1,54) et le risque absolu global était de 41 contre 33 cas pour 10 000 femmes-années, pour CE/MPA par rapport au placebo. Parmi les femmes qui ont déclaré avoir déjà utilisé une hormonothérapie, le risque relatif de cancer du sein invasif était de 1,86 et le risque absolu était de 46 contre 25 cas pour 10 000 femmes-années, pour l'EC/MPA par rapport au placebo. Parmi les femmes qui n'ont déclaré aucune utilisation antérieure d'hormonothérapie, le risque relatif de cancer du sein invasif était de 1,09 et le risque absolu était de 40 contre 36 cas pour 10 000 femmes-années pour l'EC/MPA par rapport au placebo. Dans la même sous-étude, les cancers du sein invasifs étaient plus importants et diagnostiqués à un stade plus avancé dans le groupe EC/MPA par rapport au groupe placebo. La maladie métastatique était rare sans différence apparente entre les deux groupes. Les autres facteurs pronostiques tels que le sous-type histologique, le grade et le statut des récepteurs hormonaux ne différaient pas entre les groupes.
Il a été rapporté que l'utilisation d'œstrogène plus progestatif entraîne une augmentation des mammographies anormales nécessitant une évaluation plus approfondie. Toutes les femmes devraient subir des examens annuels des seins par un fournisseur de soins de santé et effectuer des auto-examens mensuels des seins. De plus, les examens de mammographie doivent être programmés en fonction de l'âge de la patiente, des facteurs de risque et des résultats de mammographie antérieurs.
Démence
Dans la Women's Health Initiative Memory Study (WHIMS), 4 532 femmes ménopausées généralement en bonne santé âgées de 65 ans et plus ont été étudiées, dont 35 % avaient entre 70 et 74 ans et 18 % avaient 75 ans ou plus. Après un suivi moyen de 4 ans, 40 femmes traitées par EC/MPA (1,8 %, n = 2 229) et 21 femmes du groupe placebo (0,9 %, n = 2 303) ont reçu un diagnostic de démence probable. Le risque relatif d'EC/MPA par rapport au placebo était de 2,05 (intervalle de confiance à 95 % de 1,21 à 3,48) et était similaire pour les femmes avec et sans antécédents d'utilisation d'hormones ménopausiques avant le SIMDUT. Le risque absolu de démence probable pour CE/MPA par rapport au placebo était de 45 contre 22 cas pour 10 000 années-femmes, et le risque excédentaire absolu pour CE/MPA était de 23 cas pour 10 000 années-femmes. On ne sait pas si ces résultats s'appliquent aux jeunes femmes ménopausées. (Voir PHARMACOLOGIE CLINIQUE , Etudes cliniques et PRÉCAUTIONS , Utilisation gériatrique .)
On ne sait pas si ces résultats s'appliquent à la thérapie par les œstrogènes seuls.
Maladie de la vésicule biliaire
Une augmentation de 2 à 4 fois du risque de maladie de la vésicule biliaire nécessitant une intervention chirurgicale chez les femmes ménopausées recevant des œstrogènes a été rapportée.
Hypercalcémie
L'administration d'œstrogènes peut entraîner une hypercalcémie sévère chez les patientes atteintes d'un cancer du sein et de métastases osseuses. En cas d'hypercalcémie, l'utilisation du médicament doit être arrêtée et des mesures appropriées doivent être prises pour réduire le taux de calcium sérique.
Anomalies visuelles
Une thrombose vasculaire rétinienne a été rapportée chez des patientes recevant des œstrogènes. Arrêtez le médicament en attendant l'examen s'il y a une perte soudaine partielle ou complète de la vision, ou une apparition soudaine d'exophtalmie, de diplopie ou de migraine. Si l'examen révèle un œdème papillaire ou des lésions vasculaires rétiniennes, les œstrogènes doivent être arrêtés définitivement.
PRÉCAUTIONS
Général
Ajout d'un progestatif lorsqu'une femme n'a pas subi d'hystérectomie
Des études sur l'ajout d'un progestatif pendant 10 jours ou plus d'un cycle d'administration d'œstrogènes, ou quotidiennement avec des œstrogènes dans un régime continu, ont rapporté une incidence réduite d'hyperplasie de l'endomètre par rapport à celle induite par un traitement aux œstrogènes seuls. L'hyperplasie de l'endomètre peut être un précurseur du cancer de l'endomètre.
Il existe cependant des risques possibles qui peuvent être associés à l'utilisation de progestatifs avec des œstrogènes par rapport aux schémas thérapeutiques à base d'œstrogènes seuls. Ceux-ci incluent un risque accru possible de cancer du sein.
Tension artérielle élevée
Dans un petit nombre de rapports de cas, des augmentations substantielles de la pression artérielle ont été attribuées à des réactions idiosyncratiques aux œstrogènes. Dans un vaste essai clinique randomisé et contrôlé par placebo, aucun effet généralisé des œstrogènes sur la tension artérielle n'a été observé. La pression artérielle doit être surveillée à intervalles réguliers avec l'utilisation d'œstrogènes.
Hypertriglycéridémie
Chez les patientes présentant une hypertriglycéridémie préexistante, l'œstrogénothérapie peut être associée à des élévations des triglycérides plasmatiques entraînant une pancréatite et d'autres complications.
Fonction hépatique altérée et antécédents d'ictère cholestatique
Les œstrogènes peuvent être mal métabolisés chez les patients présentant une fonction hépatique altérée. Pour les patientes ayant des antécédents d'ictère cholestatique associé à une utilisation antérieure d'œstrogène ou à une grossesse, la prudence s'impose et en cas de récidive, le traitement doit être interrompu.
Hypothyroïdie
L'administration d'œstrogènes entraîne une augmentation des taux de globuline liant la thyroïde (TBG). Les patients ayant une fonction thyroïdienne normale peuvent compenser l'augmentation de la TBG en produisant plus d'hormones thyroïdiennes, maintenant ainsi les concentrations sériques libres de T4 et de T3 dans la plage normale. Les patientes dépendantes d'un traitement hormonal substitutif thyroïdien qui reçoivent également des œstrogènes peuvent nécessiter des doses plus élevées de leur traitement substitutif thyroïdien. Ces patients doivent faire surveiller leur fonction thyroïdienne afin de maintenir leur taux d'hormones thyroïdiennes libres dans une plage acceptable.
Rétention d'eau
Étant donné que les œstrogènes peuvent provoquer un certain degré de rétention d'eau, les patients souffrant d'affections pouvant être influencées par ce facteur, telles que l'asthme, l'épilepsie, la migraine et un dysfonctionnement cardiaque ou rénal, nécessitent une surveillance attentive lorsque des œstrogènes sont prescrits.
Hypocalcémie
Les œstrogènes doivent être utilisés avec prudence chez les personnes souffrant d'hypocalcémie grave.
Cancer des ovaires
La sous-étude CE/MPA de WHI a rapporté que l'œstrogène plus progestatif augmentait le risque de cancer de l'ovaire. Après un suivi moyen de 5,6 ans, le risque relatif de cancer de l'ovaire pour l'EC/MPA par rapport au placebo était de 1,58 (intervalle de confiance à 95 % 0,77 - 3,24) mais n'était pas statistiquement significatif. Le risque absolu de CE/MPA par rapport au placebo était de 4,2 contre 2,7 cas pour 10 000 femmes-années. Dans certaines études épidémiologiques, l'utilisation d'œstrogènes seuls, en particulier pendant dix ans ou plus, a été associée à un risque accru de cancer de l'ovaire. D'autres études épidémiologiques n'ont pas trouvé ces associations.
Exacerbation de l'endométriose
L'endométriose peut être exacerbée par l'administration d'œstrogènes. Quelques cas de transformation maligne d'implants endométriaux résiduels ont été signalés chez des femmes traitées après une hystérectomie avec un traitement aux œstrogènes seuls. Pour les patientes connues pour avoir une endométriose résiduelle post-hystérectomie, l'ajout d'un progestatif doit être envisagé.
Exacerbation d'autres conditions
Les œstrogènes peuvent provoquer une exacerbation de l'asthme, du diabète sucré, de l'épilepsie, de la migraine ou de la porphyrie, du lupus érythémateux disséminé et des hémangiomes hépatiques et doivent être utilisés avec prudence chez les femmes atteintes de ces affections.
ESTRACE (comprimés d'estradiol, USP), 2 mg, contient FD&C jaune n° 5 (tartrazine) qui peut provoquer des réactions de type allergique (y compris l'asthme bronchique) chez certaines personnes sensibles. Bien que l'incidence globale de la sensibilité au FD&C jaune n° 5 (tartrazine) dans la population générale soit faible, elle est fréquemment observée chez les patients qui présentent également une hypersensibilité à l'aspirine.
Informations sur les patients
Les médecins sont invités à discuter de la INFORMATIONS PATIENTS dépliant avec les patients pour lesquels ils prescrivent ESTRACE.
Tests de laboratoire
L'administration d'œstrogènes doit être initiée à la dose la plus faible approuvée pour l'indication, puis guidée par la réponse clinique plutôt que par les taux sériques d'hormones (p. ex., œstradiol, FSH). (Voir DOSAGE ET ADMINISTRATION section.)
Carcinogenèse, mutagenèse, altération de la fertilité
L'administration continue à long terme d'œstrogène, avec ou sans progestatif, chez les femmes avec et sans utérus, a montré un risque accru de cancer de l'endomètre, de cancer du sein et de cancer de l'ovaire. (Voir AVERTISSEMENTS ENCADRÉS , AVERTISSEMENTS et PRÉCAUTIONS .)
L'administration continue à long terme d'œstrogènes naturels et synthétiques chez certaines espèces animales augmente la fréquence des carcinomes du sein, de l'utérus, du col de l'utérus, du vagin, des testicules et du foie.
Catégorie de grossesse X
Estrace 2 mg ne doit pas être utilisé pendant la grossesse. (Voir CONTRE-INDICATIONS .)
Mères allaitantes
Il a été démontré que l'administration d'œstrogènes aux mères allaitantes diminue la quantité et la qualité du lait. Des quantités détectables d'oestrogènes ont été identifiées dans le lait des mères recevant ce médicament. La prudence s'impose lorsqu'ESTRACE 1 mg est administré à une femme qui allaite.
Utilisation pédiatrique
L'innocuité et l'efficacité chez les patients pédiatriques n'ont pas été établies. Il a été démontré que des doses importantes et répétées d'œstrogène sur une période de temps prolongée accélèrent la fermeture épiphysaire, entraînant une petite taille adulte si le traitement est initié avant la fin de la puberté physiologique chez les enfants en développement normal. Chez les patients chez qui la croissance osseuse n'est pas complète, une surveillance périodique de la maturation osseuse et des effets sur les centres épiphysaires est recommandée.
Le traitement aux œstrogènes des enfants prépubères induit également un développement prématuré des seins et une cornification vaginale, et peut potentiellement induire des saignements vaginaux chez les filles. Chez les garçons, le traitement aux œstrogènes peut modifier le processus pubertaire normal. Toutes les autres réactions physiologiques et indésirables associées au traitement œstrogénique chez l'adulte pourraient potentiellement survenir dans la population pédiatrique, y compris les troubles thromboemboliques et la stimulation de la croissance de certaines tumeurs. Par conséquent, les œstrogènes ne doivent être administrés aux patients pédiatriques que lorsque cela est clairement indiqué et la dose efficace la plus faible doit toujours être utilisée.
Utilisation gériatrique
L'innocuité et l'efficacité des comprimés ESTRACE chez les patients gériatriques n'ont pas été établies. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
Dans la Women's Health Initiative Memory Study, incluant 4 532 femmes âgées de 65 ans et plus, suivies pendant une moyenne de 4 ans, 82 % (n = 3 729) avaient entre 65 et 74 ans tandis que 18 % (n = 803) avaient 75 ans et plus. La plupart des femmes (80 %) n'avaient jamais utilisé d'hormonothérapie. Les femmes traitées avec des œstrogènes conjugués plus de l'acétate de médroxyprogestérone auraient un risque deux fois plus élevé de développer une démence probable. La maladie d'Alzheimer était la classification la plus courante de démence probable à la fois dans le groupe œstrogènes conjugués plus acétate de médroxyprogestérone et dans le groupe placebo. Quatre-vingt-dix pour cent des cas de démence probable sont survenus chez les 54 % de femmes âgées de plus de 70 ans. (Voir AVERTISSEMENTS , Démence .)
On ne sait pas si ces résultats s'appliquent à la thérapie par les œstrogènes seuls.
SURDOSAGE
Aucun effet nocif grave n'a été signalé après l'ingestion aiguë de fortes doses de contraceptifs oraux contenant des œstrogènes par de jeunes enfants. Un surdosage d'œstrogènes peut provoquer des nausées et des vomissements, et des saignements de privation peuvent survenir chez les femmes.
CONTRE-INDICATIONS
Les œstrogènes ne doivent pas être utilisés chez les personnes présentant l'une des conditions suivantes :
PHARMACOLOGIE CLINIQUE
Les œstrogènes endogènes sont largement responsables du développement et du maintien du système reproducteur féminin et des caractéristiques sexuelles secondaires. Bien que les œstrogènes circulants existent dans un équilibre dynamique d'interconversions métaboliques, l'œstradiol est le principal œstrogène humain intracellulaire et est sensiblement plus puissant que ses métabolites, l'œstrone et l'œstriol au niveau des récepteurs.
La principale source d'œstrogène chez les femmes adultes ayant un cycle normal est le follicule ovarien, qui sécrète 70 à 500 mcg d'œstradiol par jour, selon la phase du cycle menstruel. Après la ménopause, la plupart des œstrogènes endogènes sont produits par la conversion de l'androstènedione, sécrétée par le cortex surrénalien, en œstrone par les tissus périphériques. Ainsi, l'œstrone et la forme conjuguée au sulfate, le sulfate d'œstrone, sont les œstrogènes circulants les plus abondants chez les femmes ménopausées.
Les œstrogènes agissent en se liant aux récepteurs nucléaires dans les tissus sensibles aux œstrogènes. À ce jour, deux récepteurs aux œstrogènes ont été identifiés. Celles-ci varient en proportion d'un tissu à l'autre.
Les œstrogènes circulants modulent la sécrétion hypophysaire des gonadotrophines, de l'hormone lutéinisante (LH) et de l'hormone folliculo-stimulante (FSH), par un mécanisme de rétroaction négative. Les œstrogènes agissent pour réduire les niveaux élevés de ces hormones observés chez les femmes ménopausées.
Pharmacocinétique
Distribution
La distribution des œstrogènes exogènes est similaire à celle des œstrogènes endogènes. Les œstrogènes sont largement distribués dans le corps et se trouvent généralement à des concentrations plus élevées dans les organes cibles des hormones sexuelles. Les œstrogènes circulent dans le sang en grande partie liés à la globuline liant les hormones sexuelles (SHBG) et à l'albumine.
Métabolisme
Les œstrogènes exogènes sont métabolisés de la même manière que les œstrogènes endogènes. Les œstrogènes circulants existent dans un équilibre dynamique d'interconversions métaboliques. Ces transformations ont lieu principalement dans le foie. L'estradiol est converti de manière réversible en estrone, et les deux peuvent être convertis en estriol, qui est le principal métabolite urinaire. Les œstrogènes subissent également une recirculation entérohépatique via une conjugaison de sulfate et de glucuronide dans le foie, une sécrétion biliaire de conjugués dans l'intestin et une hydrolyse dans l'intestin suivie d'une réabsorption. Chez les femmes ménopausées, une proportion importante des œstrogènes circulants existe sous forme de sulfates conjugués, en particulier le sulfate d'œstrone, qui sert de réservoir circulant pour la formation d'œstrogènes plus actifs.
Excrétion
L'estradiol, l'estrone et l'estriol sont excrétés dans l'urine avec les conjugués glucuronide et sulfate.
Populations particulières
Aucune étude pharmacocinétique n'a été menée dans des populations particulières, y compris les patients atteints d'insuffisance rénale ou hépatique.
Interactions médicamenteuses
Des études in vitro et in vivo ont montré que les œstrogènes sont partiellement métabolisés par le cytochrome P450 3A4 (CYP3A4). Par conséquent, les inducteurs ou les inhibiteurs du CYP3A4 peuvent affecter le métabolisme des œstrogènes. Les inducteurs du CYP3A4 tels que les préparations de millepertuis (Hypericum perforatum), le phénobarbital, la carbamazépine et la rifampicine peuvent réduire les concentrations plasmatiques d'œstrogènes, entraînant éventuellement une diminution des effets thérapeutiques et/ou des modifications du profil des saignements utérins. Les inhibiteurs du CYP3A4 tels que l'érythromycine, la clarithromycine, le kétoconazole, l'itraconazole, le ritonavir et le jus de pamplemousse peuvent augmenter les concentrations plasmatiques d'œstrogènes et entraîner des effets secondaires.
Etudes cliniques
Ostéoporose
La plupart des études prospectives d'efficacité pour cette indication ont été réalisées chez des femmes blanches ménopausées, sans stratification par d'autres facteurs de risque, et tendent à montrer un effet universellement salutaire sur l'os.
Les résultats d'une étude de deux ans, randomisée, contrôlée par placebo, en double aveugle et à dose variable ont montré qu'un traitement avec 0,5 mg d'estradiol par jour pendant 23 jours (sur un cycle de 28 jours) prévient la perte de masse osseuse vertébrale chez les femmes ménopausées. Lorsque l'œstrogénothérapie est interrompue, la masse osseuse diminue à un rythme comparable à la période postménopausique immédiate. Il n'y a aucune preuve que la thérapie de remplacement des œstrogènes restaure la masse osseuse aux niveaux préménopausiques.
Études de l'Initiative sur la santé des femmes
La Women's Health Initiative (WHI) a recruté un total de 27 000 femmes ménopausées en bonne santé pour évaluer les risques et les avantages de l'utilisation d'œstrogènes conjugués (EC) à 0,625 mg par voie orale par jour ou de l'utilisation d'œstrogènes conjugués à 0,625 mg par voie orale. oestrogènes plus 2,5 mg d'acétate de médroxyprogestérone (MPA) par jour par rapport à un placebo dans la prévention de certaines maladies chroniques. Le critère d'évaluation principal était l'incidence des maladies coronariennes (MC) (infarctus du myocarde non mortel et décès par maladie coronarienne), le cancer du sein invasif étant le principal effet indésirable étudié. Un « indice global » comprenait la survenue la plus précoce de coronaropathie, de cancer du sein invasif, d'accident vasculaire cérébral, d'embolie pulmonaire (EP), de cancer de l'endomètre, de cancer colorectal, de fracture de la hanche ou de décès dû à une autre cause. L'étude n'a pas évalué les effets de la CE ou de la CE/MPA sur les symptômes de la ménopause.
La sous-étude CE/MPA a été arrêtée prématurément car, selon la règle d'arrêt prédéfinie, le risque accru de cancer du sein et d'événements cardiovasculaires dépassait les bénéfices spécifiés inclus dans l'« indice global ». Les résultats de la sous-étude CE/MPA, qui comprenait 16 608 femmes (âge moyen de 63 ans, allant de 50 à 79 ans ; 83,9 % de Blanches, 6,5 % de Noires, 5,5 % d'Hispaniques), après un suivi moyen de 5,2 ans, sont présentés dans le tableau 1 ci-dessous :
Pour les résultats inclus dans « l'indice global », les risques excédentaires absolus pour 10 000 femmes-années dans le groupe traité par EC/MPA étaient de 7 événements coronariens supplémentaires, 8 AVC supplémentaires, 8 EP supplémentaires et 8 cancers du sein invasifs supplémentaires, tandis que les réductions absolues du risque pour 10 000 femmes-années étaient de 6 cancers colorectaux de moins et de 5 fractures de la hanche de moins. L'excès de risque absolu d'événements inclus dans « l'indice global » était de 19 pour 10 000 femmes-années. Il n'y avait pas de différence entre les groupes en termes de mortalité toutes causes confondues. (Voir AVERTISSEMENTS ENCADRÉS , AVERTISSEMENTS , et PRÉCAUTIONS .)
Étude sur la mémoire de l'Initiative pour la santé des femmes
La Women's Health Initiative Memory Study (WHIMS), une sous-étude de la WHI, a recruté 4 532 femmes ménopausées en bonne santé âgées de 65 ans et plus (47 % avaient entre 65 et 69 ans, 35 % avaient entre 70 et 74 ans et 18 % avaient 75 ans et plus) pour évaluer les effets de l'EC/MPA (0,625 mg d'œstrogènes conjugués plus 2,5 mg d'acétate de médroxyprogestérone) sur l'incidence de la démence probable (résultat principal) par rapport au placebo.
Après un suivi moyen de 4 ans, 40 femmes du groupe œstrogène/progestatif (45 pour 10 000 femmes-années) et 21 du groupe placebo (22 pour 10 000 femmes-années) ont reçu un diagnostic de démence probable. Le risque relatif de démence probable dans le groupe sous hormonothérapie était de 2,05 (IC à 95 %, 1,21 à 3,48) par rapport au placebo. Les différences entre les groupes sont apparues dès la première année de traitement. On ne sait pas si ces résultats s'appliquent aux jeunes femmes ménopausées. (Voir AVERTISSEMENT ENCADRÉ et AVERTISSEMENTS , Démence .)
INFORMATIONS PATIENTS
INTRODUCTION
Lisez ces informations patient avant de commencer à prendre ESTRACE 2 mg et lisez ce que vous obtenez chaque fois que vous rechargez ESTRACE. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre fournisseur de soins de santé au sujet de votre état de santé ou de votre traitement.
QUELLES SONT LES INFORMATIONS LES PLUS IMPORTANTES QUE JE DEVRAIS CONNAÎTRE SUR ESTRACE (UNE HORMONE ŒSTROGÈNE) ?
- Les œstrogènes augmentent les risques de cancer de l'utérus.
Signalez immédiatement tout saignement vaginal inhabituel pendant que vous prenez des œstrogènes. Les saignements vaginaux après la ménopause peuvent être un signe avant-coureur d'un cancer de l'utérus (utérus). Votre fournisseur de soins de santé devrait vérifier tout saignement vaginal inhabituel pour en déterminer la cause.
- N'utilisez pas d'œstrogènes avec ou sans progestatifs pour prévenir les maladies cardiaques, les crises cardiaques ou les accidents vasculaires cérébraux.
L'utilisation d'œstrogènes avec ou sans progestatif peut augmenter vos risques de crise cardiaque, d'accident vasculaire cérébral, de cancer du sein et de caillots sanguins. L'utilisation d'œstrogènes avec des progestatifs peut augmenter votre risque de démence. Vous et votre fournisseur de soins de santé devriez discuter régulièrement de la nécessité de poursuivre votre traitement par ESTRACE.
QU'EST-CE QUE L'ESTRACE ?
ESTRACE est un médicament qui contient des hormones œstrogènes.
À QUOI EST UTILISÉ ESTRACE ?
ESTRACE 1mg est utilisé pour :
- réduire les bouffées de chaleur modérées à sévères
Les œstrogènes sont des hormones fabriquées par les ovaires de la femme. Entre 45 et 55 ans, les ovaires cessent normalement de fabriquer des œstrogènes. Cela conduit à une baisse des niveaux d'œstrogène dans le corps qui provoque le "changement de vie" ou la ménopause (la fin des menstruations mensuelles). Parfois, les deux ovaires sont retirés lors d'une opération avant la ménopause naturelle. La chute soudaine des niveaux d'oestrogènes provoque une « ménopause chirurgicale ».
Lorsque les niveaux d'œstrogène commencent à baisser, certaines femmes développent des symptômes très inconfortables, tels que des sensations de chaleur au niveau du visage, du cou et de la poitrine, ou de fortes sensations soudaines de chaleur et de transpiration («bouffées de chaleur» ou «bouffées de chaleur»). Chez certaines femmes, les symptômes sont légers et elles n'auront pas besoin d'œstrogènes. Chez d'autres femmes, les symptômes peuvent être plus graves. Vous et votre fournisseur de soins de santé devriez discuter régulièrement de la nécessité de poursuivre votre traitement par ESTRACE.
Les exercices avec mise en charge, comme la marche ou la course, et la prise de calcium avec des suppléments de vitamine D peuvent également réduire vos risques de contracter l'ostéoporose postménopausique. Il est important de parler d'exercice et de suppléments avec votre fournisseur de soins de santé avant de les commencer.
traiter la sécheresse, les démangeaisons et les brûlures dans ou autour du vagin, les difficultés ou les brûlures à la miction associées à la ménopause
Vous et votre fournisseur de soins de santé devriez discuter régulièrement de la nécessité de poursuivre un traitement par ESTRACE pour contrôler ces problèmes. Si vous utilisez ESTRACE uniquement pour traiter votre sécheresse, vos démangeaisons et vos brûlures dans et autour de votre vagin, discutez avec votre professionnel de la santé pour savoir si un produit vaginal topique serait mieux pour vous.
- traiter certaines conditions dans lesquelles les ovaires d'une jeune femme ne produisent pas suffisamment d'œstrogène naturellement
- traiter certains types de saignements vaginaux anormaux dus à un déséquilibre hormonal lorsque votre médecin n'a trouvé aucune cause grave du saignement
- traiter certains cancers dans des situations particulières, chez l'homme et la femme
- prévenir l'amincissement des os
L'ostéoporose de la ménopause est un amincissement des os qui les rend plus faibles et plus faciles à casser. Si vous utilisez ESTRACE 1 mg uniquement pour prévenir l'ostéoporose de la ménopause, discutez avec votre professionnel de la santé pour savoir si un traitement ou un médicament différent sans œstrogènes pourrait être meilleur pour vous. Vous et votre fournisseur de soins de santé devriez discuter régulièrement de la nécessité de poursuivre ESTRACE.
QUI NE DEVRAIT PAS UTILISER ESTRACE 2mg ?
Ne commencez pas à prendre ESTRACE 2 mg si vous :
- avez des saignements vaginaux inhabituels qui n'ont pas été évalués par votre médecin (voir MISES EN GARDE BOXÉES)
Des saignements vaginaux inhabituels peuvent être un signe avant-coureur d'un cancer de l'utérus, surtout s'ils surviennent après la ménopause. Votre médecin doit déterminer la cause du saignement afin qu'il puisse recommander le traitement approprié. Prendre des œstrogènes sans consulter votre médecin peut vous causer de graves dommages si vos saignements vaginaux sont causés par un cancer de l'utérus.
- avez actuellement ou avez eu certains cancers
Les œstrogènes peuvent augmenter le risque de certains types de cancer, notamment le cancer du sein ou de l'utérus. Si vous avez ou avez eu un cancer, demandez à votre professionnel de la santé si vous devez prendre ESTRACE.
(Pour certains patients atteints d'un cancer du sein ou de la prostate, les œstrogènes peuvent aider.)
- a eu un accident vasculaire cérébral ou une crise cardiaque au cours de la dernière année
- avez actuellement ou avez eu des caillots sanguins
- avez ou avez eu des problèmes de foie
- êtes allergique à ESTRACE ou à l'un de ses ingrédients
Voir la fin de cette notice pour la liste des ingrédients d'ESTRACE.
ESTRACE 2 mg comprimés contient de la tartrazine qui peut provoquer des réactions de type allergique (dont asthme bronchique) chez certaines personnes sensibles. Bien que l'incidence globale de la sensibilité au FD&C jaune n° 5 (tartrazine) dans la population générale soit faible, elle est fréquemment observée chez les patients qui présentent également une hypersensibilité à l'aspirine.
- pensez que vous pourriez être enceinte
Dites à votre fournisseur de soins de santé :
- si vous allaitez
L'hormone contenue dans ESTRACE 1mg peut passer dans votre lait
- sur tous vos problèmes médicaux
Votre fournisseur de soins de santé devra peut-être vous examiner plus attentivement si vous souffrez de certaines conditions, telles que l'asthme (respiration sifflante), l'épilepsie (convulsions), la migraine, l'endométriose, le lupus, des problèmes cardiaques, hépatiques, thyroïdiens, rénaux ou si vous avez des taux élevés de calcium. dans ton sang.
- sur tous les médicaments que vous prenez
Cela comprend les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Certains médicaments peuvent affecter le fonctionnement d'ESTRACE 1 mg. ESTRACE 1 mg peut également modifier l'action de vos autres médicaments.
- si vous allez subir une intervention chirurgicale ou si vous serez au repos
Vous devrez peut-être arrêter de prendre des œstrogènes.
COMMENT DOIS-JE PRENDRE ESTRACE ?
1. Commencez par la dose la plus faible et discutez avec votre fournisseur de soins de santé de l'efficacité de cette dose pour vous.
2. Les œstrogènes doivent être utilisés à la dose la plus faible possible pour votre traitement uniquement aussi longtemps que nécessaire. Vous et votre fournisseur de soins de santé devriez parler régulièrement (par exemple, tous les 3 à 6 mois) de la dose que vous prenez et si vous avez encore besoin d'un traitement par ESTRACE.
QUELS SONT LES EFFETS SECONDAIRES POSSIBLES DES ŒSTROGÈNES ?
Les effets secondaires moins courants mais graves comprennent :
- Cancer du sein
- Cancer de l'utérus
- Accident vasculaire cérébral
- Crise cardiaque
- Caillots sanguins
- Démence
- Maladie de la vésicule biliaire
- Cancer des ovaires
Voici quelques-uns des signes avant-coureurs des effets secondaires graves :
- Masses mammaires
- Saignements vaginaux inhabituels
- Vertiges et malaise
- Changements dans le discours
- Maux de tête sévères
- Douleur thoracique
- Essoufflement
- Douleurs dans les jambes
- Changements de vision
- Vomissement
Appelez immédiatement votre fournisseur de soins de santé si vous présentez l'un de ces signes avant-coureurs ou tout autre symptôme inhabituel qui vous préoccupe.
Les effets secondaires courants incluent :
- Mal de tête
- Douleur mammaire
- Saignements vaginaux irréguliers ou spotting
- Crampes d'estomac/abdominales, ballonnements
- Nausée et vomissements
- Chute de cheveux
D'autres effets secondaires incluent:
- Hypertension artérielle
- Problèmes de foie
- Glycémie élevée
- Rétention d'eau
- Agrandissement des tumeurs bénignes ("fibromes") de l'utérus
- Un assombrissement inégal de la peau, en particulier sur le visage
- Infection vaginale par des levures
Ce ne sont pas tous les effets secondaires possibles d'ESTRACE. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou votre pharmacien.
QUE PUIS-JE FAIRE POUR RÉDUIRE MES CHANCES D'UN EFFET SECONDAIRE GRAVE AVEC ESTRACE ?
Si vous utilisez des œstrogènes, vous pouvez réduire vos risques en faisant ces choses :
- Discutez avec votre fournisseur de soins de santé :
- Soyez attentif aux signes de problèmes
Si l'un de ces signaux d'avertissement (ou tout autre symptôme inhabituel) survient pendant que vous utilisez des œstrogènes, appelez immédiatement votre médecin :
Saignement anormal du vagin (cancer de l'utérus possible)
Douleurs dans les mollets ou la poitrine, essoufflement soudain ou toux sanglante (caillot possible dans les jambes ou les poumons)
Maux de tête ou vomissements sévères, étourdissements, évanouissements, modifications de la vision ou de la parole, faiblesse ou engourdissement d'un bras ou d'une jambe (possible caillot dans le cerveau ou l'œil)
Masses mammaires (cancer du sein possible ; demandez à votre médecin ou professionnel de la santé de vous montrer comment examiner vos seins tous les mois)
Jaunissement de la peau ou des yeux (problème de foie possible)
Douleur, gonflement ou sensibilité dans l'abdomen (problème possible de la vésicule biliaire)
INFORMATIONS GÉNÉRALES SUR L'UTILISATION SÉCURITAIRE ET EFFICACE D'ESTRACE
Des médicaments sont parfois prescrits pour des affections qui ne sont pas mentionnées dans les notices d'information destinées aux patients. Ne prenez pas ESTRACE 2mg pour des conditions pour lesquelles il n'a pas été prescrit. Ne donnez pas ESTRACE 1 mg à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
GARDER ESTRACE HORS DE LA PORTÉE DES ENFANTS
Cette notice fournit un résumé des informations les plus importantes sur ESTRACE. Si vous souhaitez plus d'informations, parlez-en à votre fournisseur de soins de santé ou à votre pharmacien. Vous pouvez demander des informations sur ESTRACE qui sont écrites pour les professionnels de la santé. Vous pouvez obtenir plus d'informations en appelant le numéro sans frais 1-800-521-8813.
QUELS SONT LES INGRÉDIENTS D'ESTRACE ?
Ingrédients inactifs : Dioxyde de silicium colloïdal, amidon de maïs, phosphate de calcium dibasique, lactose monohydraté, stéarate de magnésium et glycolate d'amidon sodique. De plus, le 1 mg contient également du bleu FD&C no. 1 laque d'aluminium et D&C rouge no. 27 lac d'aluminium. Le 2 mg contient également du bleu FD&C no. 1 laque d'aluminium et FD&C jaune no. 5 (tartrazine) laque aluminique.
