Fosamax 35mg, 70mg Alendronate Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Fosamax 70 mg et comment est-il utilisé ?
Fosamax 35 mg est un médicament délivré sur ordonnance utilisé pour prévenir et traiter certains types de perte osseuse (ostéoporose) chez les adultes. Fosamax 70 mg peut être utilisé seul ou avec d'autres médicaments.
Fosamax est un modificateur du métabolisme du calcium, un dérivé bisphosphonate.
On ne sait pas si Fosamax est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Fosamax ?
Fosamax peut provoquer des effets secondaires graves, notamment :
- douleur thoracique
- brûlures d'estomac nouvelles ou qui s'aggravent
- douleur ou brûlure sous les côtes ou dans le dos
- brûlures d'estomac sévères
- douleur brûlante dans le haut de l'estomac ou crachats de sang
- douleur nouvelle ou inhabituelle dans la cuisse ou la hanche
- douleur à la mâchoire
- engourdissement
- gonflement
- douleurs articulaires, osseuses ou musculaires intenses
- spasmes ou crampes musculaires
- engourdissement ou sensation de picotement autour de la bouche ou dans les doigts ou les orteils
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Fosamax incluent :
- brûlures d'estomac
- maux d'estomac
- Douleur d'estomac
- nausée
- diarrhée
- constipation
- douleur osseuse
- douleur musculaire
- douleur articulaire
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Fosamax. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
FOSAMAX (alendronate sodique) est un bisphosphonate qui agit comme un inhibiteur spécifique de la résorption osseuse médiée par les ostéoclastes. Les bisphosphonates sont des analogues synthétiques du pyrophosphate qui se lient à l'hydroxyapatite présente dans les os.
L'alendronate sodique est chimiquement décrit comme le sel monosodique de l'acide (4-amino-1-hydroxybutylidène) bisphosphonique trihydraté.
La formule empirique de l'alendronate sodique est C4H12NNaO7P2 •3H2O et son poids de formule est 325,12. La formule structurale est :
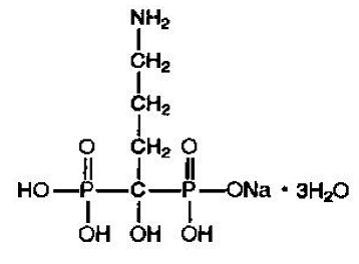
L'alendronate sodique est une poudre blanche, cristalline et non hygroscopique. Il est soluble dans l'eau, très légèrement soluble dans l'alcool et pratiquement insoluble dans le chloroforme.
Les comprimés FOSAMAX 70 mg pour administration orale contiennent 91,37 mg de sel monosodique d'alendronate trihydraté, soit l'équivalent molaire de 70 mg d'acide libre, et les ingrédients inactifs suivants : cellulose microcristalline, lactose anhydre, croscarmellose sodique et stéarate de magnésium.
LES INDICATIONS
Treatment® de l'ostéoporose chez les femmes ménopausées
FOSAMAX est indiqué pour le traitement de l'ostéoporose chez les femmes ménopausées. Chez les femmes ménopausées, FOSAMAX 70 mg augmente la masse osseuse et réduit l'incidence des fractures, notamment celles de la hanche et du rachis (fractures vertébrales par tassement). [Voir Etudes cliniques ]
Prévention de l'ostéoporose chez les femmes ménopausées
FOSAMAX 70 mg est indiqué dans la prévention de l'ostéoporose post-ménopausique [voir Etudes cliniques ].
Traitement pour augmenter la masse osseuse chez les hommes atteints d'ostéoporose
FOSAMAX est indiqué comme traitement pour augmenter la masse osseuse chez les hommes atteints d'ostéoporose [voir Etudes cliniques ].
Traitement de l'ostéoporose induite par les glucocorticoïdes
FOSAMAX est indiqué pour le traitement de l'ostéoporose induite par les glucocorticoïdes chez les hommes et les femmes recevant des glucocorticoïdes à une dose quotidienne équivalente à 7,5 mg ou plus de prednisone et qui ont une faible densité minérale osseuse [voir Etudes cliniques ].
Traitement de la maladie osseuse de Paget
FOSAMAX 35mg est indiqué pour le traitement de la maladie osseuse de Paget chez l'homme et la femme. Le traitement est indiqué chez les patients atteints de la maladie osseuse de Paget qui ont une phosphatase alcaline au moins deux fois supérieure à la limite supérieure de la normale, ou ceux qui sont symptomatiques ou ceux qui risquent de développer de futures complications de leur maladie. [Voir Etudes cliniques ]
Limites d'utilisation importantes
La durée d'utilisation optimale n'a pas été déterminée. La sécurité et l'efficacité de FOSAMAX pour le traitement de l'ostéoporose sont basées sur des données cliniques d'une durée de quatre ans. Tous les patients sous traitement par bisphosphonates doivent faire réévaluer périodiquement la nécessité de poursuivre le traitement. Les patients à faible risque de fracture doivent être considérés pour l'arrêt du médicament après 3 à 5 ans d'utilisation. Les patients qui arrêtent le traitement doivent faire réévaluer périodiquement leur risque de fracture.
DOSAGE ET ADMINISTRATION
Bien que les comprimés d'alendronate 5 mg, 10 mg, 35 mg et 40 mg soient disponibles sur le marché, FOSAMAX 35 mg n'est plus commercialisé dans les dosages 5 mg, 10 mg, 35 mg et 40 mg.
Bien qu'une solution buvable d'alendronate puisse être disponible sur le marché, la solution buvable FOSAMAX 35 mg n'est plus commercialisée.
Traitement de l'ostéoporose chez les femmes ménopausées
La posologie recommandée est de :
- un comprimé de 70 mg une fois par semaine ou
- un flacon de solution buvable à 70 mg une fois par semaine ou
- un comprimé de 10 mg une fois par jour
Prévention de l'ostéoporose chez les femmes ménopausées
La posologie recommandée est de :
- un comprimé de 35 mg une fois par semaine ou
- un comprimé de 5 mg une fois par jour
Traitement pour augmenter la masse osseuse chez les hommes atteints d'ostéoporose
La posologie recommandée est de :
- un comprimé de 70 mg une fois par semaine ou
- un flacon de solution buvable à 70 mg une fois par semaine ou
- un comprimé de 10 mg une fois par jour
Traitement de l'ostéoporose induite par les glucocorticoïdes
La posologie recommandée est d'un comprimé à 5 mg une fois par jour, sauf pour les femmes ménopausées ne recevant pas d'œstrogène, pour lesquelles la posologie recommandée est d'un comprimé à 10 mg une fois par jour.
Traitement de la maladie osseuse de Paget
Le schéma thérapeutique recommandé est de 40 mg une fois par jour pendant six mois.
Re-traitement de la maladie de Paget
Un retraitement par FOSAMAX 35 mg peut être envisagé, après une période d'évaluation post-traitement de six mois chez les patients qui ont rechuté, sur la base des augmentations de la phosphatase alcaline sérique, qui doivent être mesurées périodiquement. Un retraitement peut également être envisagé chez ceux qui n'ont pas réussi à normaliser leur phosphatase alcaline sérique.
Instructions d'administration importantes
Demandez aux patients de faire ce qui suit :
- Prenez FOSAMAX au moins une demi-heure avant le premier aliment, boisson ou médicament de la journée avec de l'eau ordinaire uniquement [voir Informations sur les conseils aux patients ]. D'autres boissons (y compris l'eau minérale), la nourriture et certains médicaments sont susceptibles de réduire l'absorption de FOSAMAX [voir INTERACTIONS MÉDICAMENTEUSES ]. Attendre moins de 30 minutes ou prendre FOSAMAX 70 mg avec de la nourriture, des boissons (autres que de l'eau plate) ou d'autres médicaments diminuera l'effet de FOSAMAX 70 mg en diminuant son absorption dans le corps.
- Prenez FOSAMAX au lever pour la journée. Pour faciliter l'administration dans l'estomac et réduire ainsi le risque d'irritation de l'œsophage, un comprimé de FOSAMAX 35 mg doit être avalé avec un grand verre d'eau (6 à 8 onces). Pour faciliter la vidange gastrique, FOSAMAX 70 mg solution buvable doit être suivi d'au moins 2 onces (un quart de tasse) d'eau. Les patients ne doivent pas s'allonger pendant au moins 30 minutes et jusqu'après leur premier repas de la journée. FOSAMAX ne doit pas être pris au coucher ou avant de se lever pour la journée. Le non-respect de ces instructions peut augmenter le risque d'effets indésirables œsophagiens [voir AVERTISSEMENTS ET PRECAUTIONS et Informations sur les conseils aux patients ].
Recommandations pour la supplémentation en calcium et en vitamine D
Demandez aux patients de prendre des suppléments de calcium si l'apport alimentaire est insuffisant [voir AVERTISSEMENTS ET PRECAUTIONS ]. Les patients présentant un risque accru d'insuffisance en vitamine D (p. ex., âgés de plus de 70 ans, confinés en maison de retraite ou souffrant d'une maladie chronique) peuvent avoir besoin d'une supplémentation en vitamine D. Les patients atteints de syndromes de malabsorption gastro-intestinale peuvent nécessiter des doses plus élevées de supplémentation en vitamine D et la mesure de la 25-hydroxyvitamine D doit être envisagée.
Les patients traités avec des glucocorticoïdes doivent recevoir des quantités adéquates de calcium et de vitamine D.
Instructions d'administration pour les doses oubliées
Si une dose hebdomadaire de FOSAMAX est oubliée, demandez aux patients de prendre une dose le matin après s'en être souvenu. Ils ne doivent pas prendre deux doses le même jour mais doivent recommencer à prendre une dose une fois par semaine, comme initialement prévu le jour choisi.
COMMENT FOURNIE
Formes posologiques et points forts
- Les comprimés à 70 mg sont des comprimés blancs, ovales, non enrobés portant le code 31 sur une face et le contour d'un os sur l'autre.
Stockage et manutention
N° 3814 - Les comprimés FOSAMAX, 70 mg, sont des comprimés blancs, ovales et non enrobés portant le code 31 d'un côté et le contour d'une image d'os de l'autre :
CDN 0006-0031-44 blister d'unité d'utilisation de 4.
Stockage
Comprimés FOSAMAX
Conserver dans un récipient bien fermé à température ambiante, 15-30°C (59-86°F).
Distribué par : Merck Sharp & Dohme Corp., une filiale de MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Révisé : août 2019
EFFETS SECONDAIRES
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
Traitement de l'ostéoporose chez les femmes ménopausées
Dosage quotidien
La sécurité de FOSAMAX 35 mg dans le traitement de l'ostéoporose post-ménopausique a été évaluée dans quatre essais cliniques qui ont inclus 7453 femmes âgées de 44 à 84 ans. L'étude 1 et l'étude 2 étaient des études multicentriques à double insu, contrôlées par placebo, de conception identique, d'une durée de trois ans (États-Unis et multinationale n = 994) ; L'étude 3 était la cohorte de fractures vertébrales de trois ans du Fracture Intervention Trial [FIT] (n = 2027) et l'étude 4 était la cohorte de fractures cliniques de quatre ans du FIT (n = 4432). Au total, 3620 patients ont été exposés au placebo et 3432 patients ont été exposés au FOSAMAX. Des patients ayant une maladie gastro-intestinale préexistante et l'utilisation concomitante d'anti-inflammatoires non stéroïdiens ont été inclus dans ces essais cliniques. Dans les études 1 et 2, toutes les femmes ont reçu 500 mg de calcium élémentaire sous forme de carbonate. Dans les études 3 et 4, toutes les femmes dont l'apport alimentaire en calcium était inférieur à 1 000 mg par jour ont reçu 500 mg de calcium et 250 unités internationales de vitamine D par jour.
Parmi les patients traités par l'alendronate 10 mg ou le placebo dans les études 1 et 2, et tous les patients dans les études 3 et 4, l'incidence de la mortalité toutes causes confondues était de 1,8 % dans le groupe placebo et de 1,8 % dans le groupe FOSAMAX 35 mg. L'incidence des événements indésirables graves a été de 30,7 % dans le groupe placebo et de 30,9 % dans le groupe FOSAMAX. Le pourcentage de patients qui ont arrêté l'étude en raison d'un événement indésirable clinique était de 9,5 % dans le groupe placebo et de 8,9 % dans le groupe FOSAMAX 70 mg. Les effets indésirables de ces études considérés par les investigateurs comme possiblement, probablement ou définitivement liés au médicament chez plus de ou égal à 1 % des patients traités soit par FOSAMAX 35 mg soit par placebo sont présentés dans le tableau 1.
Une éruption cutanée et un érythème se sont produits.
Effets indésirables gastro-intestinaux
Un patient traité par FOSAMAX (10 mg/jour), qui avait des antécédents d'ulcère peptique et de gastrectomie et qui prenait de l'aspirine en concomitance, a développé un ulcère anastomotique avec une légère hémorragie, qui a été considéré comme lié au médicament. L'aspirine et le FOSAMAX ont été arrêtés et le patient s'est rétabli. Dans les populations des études 1 et 2, 49 à 54 % avaient des antécédents de troubles gastro-intestinaux au départ et 54 à 89 % avaient utilisé des anti-inflammatoires non stéroïdiens ou de l'aspirine à un moment donné au cours des études. [Voir AVERTISSEMENTS ET PRECAUTIONS ]
Résultats des tests de laboratoire
Dans des études multicentriques contrôlées en double aveugle, des diminutions asymptomatiques, légères et transitoires du calcium et du phosphate sériques ont été observées chez environ 18 % et 10 %, respectivement, des patients prenant FOSAMAX contre environ 12 % et 3 % de ceux prenant un placebo. Cependant, les incidences des diminutions du calcium sérique à moins de 8,0 mg/dL (2,0 mM) et du phosphate sérique à moins de ou égal à 2,0 mg/dL (0,65 mM) étaient similaires dans les deux groupes de traitement.
Dosage hebdomadaire
La sécurité de FOSAMAX 70 mg une fois par semaine pour le traitement de l'ostéoporose post-ménopausique a été évaluée dans une étude multicentrique en double aveugle d'un an comparant FOSAMAX 70 mg une fois par semaine et FOSAMAX 10 mg par jour. Les profils globaux d'innocuité et de tolérabilité de FOSAMAX 70 mg une fois par semaine et de FOSAMAX 10 mg par jour étaient similaires. Les effets indésirables considérés par les investigateurs comme possiblement, probablement ou définitivement liés au médicament chez 1 % ou plus des patients dans l'un ou l'autre des groupes de traitement sont présentés dans le tableau 2.
Prévention de l'ostéoporose chez les femmes ménopausées
Dosage quotidien
L'innocuité de FOSAMAX 5 mg/jour chez les femmes ménopausées âgées de 40 à 60 ans a été évaluée dans trois études en double aveugle contrôlées par placebo impliquant plus de 1 400 patientes randomisées pour recevoir FOSAMAX pendant deux ou trois ans. Dans ces études, les profils de sécurité globaux de FOSAMAX 5 mg/jour et du placebo étaient similaires. L'arrêt du traitement en raison d'un événement indésirable clinique est survenu chez 7,5 % des 642 patients traités par FOSAMAX 5 mg/jour et 5,7 % des 648 patients traités par placebo.
Dosage hebdomadaire
La sécurité de FOSAMAX 35 mg une fois par semaine par rapport à FOSAMAX 5 mg par jour a été évaluée dans une étude multicentrique en double aveugle d'un an portant sur 723 patients. Les profils globaux d'innocuité et de tolérabilité de FOSAMAX 35 mg une fois par semaine et de FOSAMAX 5 mg par jour étaient similaires.
Les effets indésirables de ces études considérés par les investigateurs comme possiblement, probablement ou définitivement liés au médicament chez plus de ou égal à 1 % des patients traités par FOSAMAX 35 mg, FOSAMAX 5 mg/jour ou un placebo une fois par semaine sont présentés dans le tableau 3. .
Utilisation concomitante avec la thérapie de remplacement des œstrogènes/hormones
Dans deux études (d'une durée de un et deux ans) portant sur des femmes ménopausées ostéoporotiques (total : n = 853), le profil d'innocuité et de tolérabilité du traitement combiné par FOSAMAX 10 mg une fois par jour et œstrogène ± progestatif (n = 354) était compatibles avec ceux des traitements individuels.
L'ostéoporose chez les hommes
Dans deux études multicentriques, en double aveugle, contrôlées contre placebo chez des hommes (une étude de deux ans sur FOSAMAX 10 mg/jour et une étude d'un an sur FOSAMAX 70 mg une fois par semaine), les taux d'arrêt du traitement en raison de tout effet indésirable clinique étaient de 2,7 % pour FOSAMAX 10 mg/jour contre 10,5 % pour le placebo, et de 6,4 % pour FOSAMAX 70 mg une fois par semaine contre 8,6 % pour le placebo. Les effets indésirables considérés par les investigateurs comme possiblement, probablement ou définitivement liés au médicament chez au moins 2 % des patients traités soit par FOSAMAX 70 mg soit par placebo sont présentés dans le tableau 4.
Ostéoporose induite par les glucocorticoïdes
Dans deux études multicentriques, en double aveugle, contrôlées contre placebo, d'une durée d'un an chez des patients recevant un traitement par glucocorticoïdes, les profils globaux de sécurité et de tolérance de FOSAMAX 5 et 10 mg/jour étaient généralement similaires à ceux du placebo. Les effets indésirables considérés par les investigateurs comme possiblement, probablement ou définitivement liés au médicament chez 1 % ou plus des patients traités soit par FOSAMAX 5 ou 10 mg/jour soit par placebo sont présentés dans le Tableau 5.
Le profil global d'innocuité et de tolérabilité dans la population d'ostéoporose induite par les glucocorticoïdes qui a poursuivi le traitement pendant la deuxième année des études (FOSAMAX : n = 147) était cohérent avec celui observé pendant la première année.
Maladie osseuse de Paget
Dans les études cliniques (ostéoporose et maladie de Paget), les événements indésirables rapportés chez 175 patientes prenant FOSAMAX 40 mg/jour pendant 3 à 12 mois étaient similaires à ceux des femmes ménopausées traitées par FOSAMAX 10 mg/jour. Cependant, il y avait une augmentation apparente de l'incidence des effets indésirables gastro-intestinaux supérieurs chez les patients prenant FOSAMAX 40 mg/jour (17,7 % FOSAMAX contre 10,2 % placebo). Un cas d'œsophagite et deux cas de gastrite ont entraîné l'arrêt du traitement.
De plus, les douleurs musculo-squelettiques (osseuses, musculaires ou articulaires), qui ont été décrites chez des patients atteints de la maladie de Paget traités avec d'autres bisphosphonates, ont été considérées par les investigateurs comme possiblement, probablement ou définitivement liées au médicament chez environ 6 % des patients. traités par FOSAMAX 40 mg/jour versus environ 1 % des patients traités par placebo, mais ont rarement entraîné l'arrêt du traitement. L'arrêt du traitement en raison d'événements indésirables cliniques est survenu chez 6,4 % des patients atteints de la maladie de Paget traités par FOSAMAX 40 mg/jour et 2,4 % des patients traités par placebo.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de FOSAMAX. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Corps dans son ensemble : réactions d'hypersensibilité incluant urticaire et œdème de Quincke. Des symptômes transitoires de myalgie, de malaise, d'asthénie et de fièvre ont été rapportés avec FOSAMAX, généralement en association avec l'initiation du traitement. Une hypocalcémie symptomatique est survenue, généralement en association avec des conditions prédisposantes. Œdème périphérique.
Gastro-intestinal : oesophagite, érosions oesophagiennes, ulcères oesophagiens, rétrécissement ou perforation oesophagienne et ulcération oropharyngée. Des ulcères gastriques ou duodénaux, certains sévères et avec complications, ont également été rapportés [voir DOSAGE ET ADMINISTRATION ; AVERTISSEMENTS ET PRECAUTIONS ].
Une ostéonécrose localisée de la mâchoire, généralement associée à une extraction dentaire et/ou une infection locale avec retard de cicatrisation, a été rapportée [voir AVERTISSEMENTS ET PRECAUTIONS ].
Musculo-squelettique : douleurs osseuses, articulaires et/ou musculaires, parfois intenses et invalidantes [voir AVERTISSEMENTS ET PRECAUTIONS ] ; gonflement des articulations; la diaphyse fémorale à basse énergie et les fractures sous-trochantériennes [voir AVERTISSEMENTS ET PRECAUTIONS ].
Système nerveux: étourdissements et vertiges.
Pulmonaire: exacerbations aiguës de l'asthme.
Peau: éruption cutanée (parfois avec photosensibilité), prurit, alopécie, réactions cutanées sévères, y compris syndrome de Stevens-Johnson et nécrolyse épidermique toxique.
Sens spéciaux : uvéite, sclérite ou épisclérite. Cholestéatome du conduit auditif externe (ostéonécrose focale).
INTERACTIONS MÉDICAMENTEUSES
Suppléments de calcium/antiacides
La co-administration de FOSAMAX et de calcium, d'antiacides ou de médicaments oraux contenant des cations multivalents interférera avec l'absorption de FOSAMAX. Par conséquent, demandez aux patients d'attendre au moins une demi-heure après la prise de FOSAMAX 35 mg avant de prendre tout autre médicament par voie orale.
Aspirine
Dans les études cliniques, l'incidence des événements indésirables gastro-intestinaux supérieurs a été augmentée chez les patients recevant un traitement concomitant avec des doses quotidiennes de FOSAMAX 35 mg supérieures à 10 mg et des produits contenant de l'aspirine.
Médicaments anti-inflammatoires non stéroïdiens
FOSAMAX 35 mg peut être administré aux patients prenant des anti-inflammatoires non stéroïdiens (AINS). Dans une étude clinique contrôlée de 3 ans (n = 2027) au cours de laquelle une majorité de patients ont reçu des AINS concomitants, l'incidence des événements indésirables gastro-intestinaux supérieurs était similaire chez les patients prenant FOSAMAX 5 ou 10 mg/jour par rapport à ceux prenant un placebo. Cependant, étant donné que l'utilisation d'AINS est associée à une irritation gastro-intestinale, la prudence s'impose lors de l'utilisation concomitante de FOSAMAX.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Effets indésirables gastro-intestinaux supérieurs
FOSAMAX 35 mg, comme les autres bisphosphonates administrés par voie orale, peut provoquer une irritation locale de la muqueuse digestive haute. En raison de ces effets irritants possibles et d'un potentiel d'aggravation de la maladie sous-jacente, la prudence s'impose lorsque FOSAMAX est administré à des patients présentant des problèmes gastro-intestinaux supérieurs actifs (tels que l'œsophage connu de Barrett, la dysphagie, d'autres maladies de l'œsophage, la gastrite, duodénite ou ulcères).
Des effets indésirables œsophagiens, tels qu'œsophagite, ulcères œsophagiens et érosions œsophagiennes, parfois accompagnés de saignements et rarement suivis d'une sténose ou d'une perforation œsophagienne, ont été signalés chez des patients recevant un traitement par bisphosphonates oraux, y compris FOSAMAX. Dans certains cas, ceux-ci ont été graves et ont nécessité une hospitalisation. Les médecins doivent donc être attentifs à tout signe ou symptôme signalant une éventuelle réaction œsophagienne et les patients doivent être informés d'arrêter FOSAMAX 70 mg et de consulter un médecin s'ils développent une dysphagie, une odynophagie, une douleur rétrosternale ou des brûlures d'estomac nouvelles ou aggravées.
Le risque d'effets indésirables œsophagiens sévères semble être plus élevé chez les patients qui s'allongent après avoir pris des bisphosphonates oraux, y compris FOSAMAX 70 mg, et/ou qui n'arrivent pas à avaler des bisphosphonates oraux, y compris FOSAMAX 35 mg avec le grand verre d'eau recommandé (6 à 8 onces) et /ou qui continuent à prendre des bisphosphonates oraux dont FOSAMAX 70mg après avoir développé des symptômes évocateurs d'une irritation de l'œsophage. Par conséquent, il est très important que les instructions de dosage complètes soient fournies et comprises par le patient [voir DOSAGE ET ADMINISTRATION ]. Chez les patients qui ne peuvent pas se conformer aux instructions de dosage en raison d'un handicap mental, le traitement par FOSAMAX doit être utilisé sous une surveillance appropriée.
Il y a eu des rapports post-commercialisation d'ulcères gastriques et duodénaux avec l'utilisation de bisphosphonates oraux, certains graves et avec complications, bien qu'aucun risque accru n'ait été observé dans les essais cliniques contrôlés [voir EFFETS INDÉSIRABLES ].
Métabolisme minéral
L'hypocalcémie doit être corrigée avant d'initier le traitement par FOSAMAX [voir CONTRE-INDICATIONS ]. D'autres troubles affectant le métabolisme minéral (comme la carence en vitamine D) doivent également être traités efficacement. Chez les patients atteints de ces affections, la calcémie et les symptômes d'hypocalcémie doivent être surveillés pendant le traitement par FOSAMAX.
Vraisemblablement en raison des effets de FOSAMAX sur l'augmentation de la minéralisation osseuse, de petites diminutions asymptomatiques du calcium et du phosphate sériques peuvent survenir, en particulier chez les patients atteints de la maladie de Paget, chez qui le taux de renouvellement osseux avant le traitement peut être considérablement élevé, et chez les les patients recevant des glucocorticoïdes, chez qui l'absorption du calcium peut être diminuée.
Assurer un apport adéquat en calcium et en vitamine D est particulièrement important chez les patients atteints de la maladie osseuse de Paget et chez les patients recevant des glucocorticoïdes.
Douleur musculo-squelettique
Dans l'expérience post-commercialisation, des douleurs osseuses, articulaires et/ou musculaires sévères et parfois invalidantes ont été rapportées chez des patients prenant des bisphosphonates approuvés pour la prévention et le traitement de l'ostéoporose [voir EFFETS INDÉSIRABLES ]. Cette catégorie de médicaments comprend FOSAMAX (alendronate). La plupart des patients étaient des femmes ménopausées. Le délai d'apparition des symptômes variait d'un jour à plusieurs mois après le début du traitement. Cesser l'utilisation si des symptômes graves se développent. La plupart des patients ont eu un soulagement des symptômes après l'arrêt. Un sous-ensemble a présenté une récurrence des symptômes lors d'une nouvelle provocation avec le même médicament ou un autre bisphosphonate.
Dans les études cliniques contrôlées par placebo sur FOSAMAX, les pourcentages de patients présentant ces symptômes étaient similaires dans les groupes FOSAMAX 35 mg et placebo.
Ostéonécrose de la mâchoire
L'ostéonécrose de la mâchoire (ONM), qui peut survenir spontanément, est généralement associée à une extraction dentaire et/ou à une infection locale avec retard de cicatrisation et a été rapportée chez des patients prenant des bisphosphonates, y compris FOSAMAX. Les facteurs de risque connus d'ostéonécrose de la mâchoire comprennent les procédures dentaires invasives (p. ex., extraction dentaire, implants dentaires, chirurgie osseuse), le diagnostic de cancer, les traitements concomitants (p. ex., chimiothérapie, corticostéroïdes, inhibiteurs de l'angiogenèse), une mauvaise hygiène buccale et les comorbidités troubles (p. ex., maladie parodontale et/ou autre maladie dentaire préexistante, anémie, coagulopathie, infection, prothèses dentaires mal ajustées). Le risque d'ONM peut augmenter avec la durée d'exposition aux bisphosphonates.
Pour les patients nécessitant des procédures dentaires invasives, l'arrêt du traitement aux bisphosphonates peut réduire le risque d'ONM. Le jugement clinique du médecin traitant et/ou du chirurgien buccal doit guider le plan de prise en charge de chaque patient sur la base d'une évaluation individuelle du rapport bénéfice/risque.
Les patients qui développent une ostéonécrose de la mâchoire pendant un traitement par bisphosphonates doivent être pris en charge par un chirurgien buccal. Chez ces patients, une chirurgie dentaire extensive pour traiter l'ONM peut aggraver la condition. L'arrêt du traitement par bisphosphonates doit être envisagé en fonction de l'évaluation individuelle du rapport bénéfice/risque.
Fractures fémorales sous-trochantériennes et diaphysaires atypiques
Des fractures atypiques, à faible énergie ou à faible traumatisme de la diaphyse fémorale ont été rapportées chez des patients traités par bisphosphonates. Ces fractures peuvent se produire n'importe où dans la diaphyse fémorale, juste en dessous du petit trochanter jusqu'au-dessus de l'évasement supracondylien et sont d'orientation transversale ou oblique courte sans signe de comminution. La causalité n'a pas été établie car ces fractures surviennent également chez des patients ostéoporotiques qui n'ont pas été traités par des bisphosphonates.
Les fractures atypiques du fémur surviennent le plus souvent avec peu ou pas de traumatisme dans la zone touchée. Ils peuvent être bilatéraux et de nombreux patients signalent une douleur prodromique dans la zone touchée, se présentant généralement comme une douleur sourde et douloureuse à la cuisse, des semaines à des mois avant qu'une fracture complète ne se produise. Un certain nombre de rapports notent que les patients recevaient également un traitement avec des glucocorticoïdes (par exemple, la prednisone) au moment de la fracture.
Tout patient ayant des antécédents d'exposition aux bisphosphonates qui se présente avec des douleurs à la cuisse ou à l'aine doit être suspecté d'avoir une fracture atypique et doit être évalué pour exclure une fracture incomplète du fémur. Les patients présentant une fracture atypique doivent également être évalués pour les symptômes et les signes de fracture du membre controlatéral. L'interruption du traitement par bisphosphonates doit être envisagée, dans l'attente d'une évaluation du rapport bénéfice/risque, sur une base individuelle.
Insuffisance rénale
FOSAMAX 35 mg n'est pas recommandé chez les patients dont la clairance de la créatinine est inférieure à 35 mL/min.
Ostéoporose induite par les glucocorticoïdes
Le rapport bénéfice/risque de FOSAMAX pour le traitement à des doses quotidiennes de glucocorticoïdes inférieures à 7,5 mg de prednisone ou équivalent n'a pas été établi [voir INDICATIONS ET USAGE ]. Avant de commencer le traitement, le statut hormonal gonadique des hommes et des femmes doit être vérifié et un remplacement approprié doit être envisagé.
Une mesure de la densité minérale osseuse doit être effectuée au début du traitement et répétée après 6 à 12 mois de traitement combiné FOSAMAX et glucocorticoïdes.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments ).
Donnez l'ordre aux patients de lire le Guide de Médication avant de commencer la thérapie avec FOSAMAX et de le relire chaque fois que la prescription est renouvelée.
Recommandations pour l'ostéoporose, y compris la supplémentation en calcium et en vitamine D
Demandez aux patients de prendre des suppléments de calcium et de vitamine D si l'apport alimentaire quotidien est insuffisant. Les exercices avec mise en charge doivent être envisagés ainsi que la modification de certains facteurs comportementaux, tels que le tabagisme et/ou la consommation excessive d'alcool, si ces facteurs existent.
Instructions de dosage
Informez les patients que les avantages attendus de FOSAMAX 70 mg ne peuvent être obtenus que s'il est pris avec de l'eau ordinaire la première chose à se lever pour la journée au moins 30 minutes avant le premier aliment, boisson ou médicament de la journée. Il a été démontré que même l'administration de jus d'orange ou de café réduit considérablement l'absorption de FOSAMAX [voir PHARMACOLOGIE CLINIQUE ].
Demandez aux patients de ne pas mâcher ou sucer le comprimé en raison d'un potentiel d'ulcération oropharyngée.
Demandez aux patients d'avaler chaque comprimé de FOSAMAX avec un grand verre d'eau (6 à 8 onces) pour faciliter l'administration dans l'estomac et réduire ainsi le risque d'irritation de l'œsophage. Demandez aux patients de boire au moins 2 onces (un quart de tasse) d'eau après avoir pris FOSAMAX 70 mg solution buvable, pour faciliter la vidange gastrique.
Demandez aux patients de ne pas s'allonger pendant au moins 30 minutes et jusqu'après leur premier repas de la journée.
Demandez aux patients de ne pas prendre FOSAMAX au coucher ou avant de se lever pour la journée. Les patients doivent être informés que le non-respect de ces instructions peut augmenter leur risque de problèmes œsophagiens.
Informez les patients que s'ils développent des symptômes de maladie œsophagienne (tels qu'une difficulté ou une douleur à la déglutition, une douleur rétrosternale ou des brûlures d'estomac nouvelles ou qui s'aggravent), ils doivent arrêter de prendre FOSAMAX et consulter leur médecin.
Si les patients manquent une dose de FOSAMAX 70 mg une fois par semaine, demandez aux patients de prendre une dose le matin après s'être souvenu. Ils ne doivent pas prendre deux doses le même jour mais doivent recommencer à prendre une dose une fois par semaine, comme initialement prévu le jour choisi.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Les adénomes de la glande de Harder (une glande rétro-orbitaire non présente chez l'homme) ont augmenté chez les souris femelles à forte dose (p = 0,003) dans une étude de cancérogénicité orale de 92 semaines à des doses d'alendronate de 1, 3 et 10 mg/kg/ jour (mâles) ou 1, 2 et 5 mg/kg/jour (femelles). Ces doses sont équivalentes à environ 0,1 à 1 fois la dose quotidienne clinique recommandée la plus élevée de 40 mg basée sur la surface, mg/m². La pertinence de cette découverte pour les humains est inconnue.
Les adénomes des cellules parafolliculaires (thyroïde) ont augmenté chez les rats mâles ayant reçu une dose élevée (p = 0,003) dans une étude de cancérogénicité orale de 2 ans à des doses de 1 et 3,75 mg/kg de poids corporel. Ces doses sont équivalentes à environ 0,3 et 1 fois la dose quotidienne clinique de 40 mg basée sur la surface, en mg/m². La pertinence de ce résultat pour l'homme n'est pas connue.
L'alendronate n'a pas été génotoxique dans le test de mutagenèse microbienne in vitro avec et sans activation métabolique, dans un test de mutagenèse in vitro sur des cellules de mammifères, dans un test d'élution alcaline in vitro sur des hépatocytes de rat et dans un test d'aberration chromosomique in vivo chez la souris. Cependant, dans un test d'aberration chromosomique in vitro sur des cellules ovariennes de hamster chinois, l'alendronate a donné des résultats équivoques.
L'alendronate n'a eu aucun effet sur la fertilité (mâle ou femelle) chez le rat à des doses orales allant jusqu'à 5 mg/kg/jour (environ 1 fois la dose quotidienne clinique de 40 mg basée sur la surface, mg/m²).
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Les données disponibles sur l'utilisation de FOSAMAX chez les femmes enceintes sont insuffisantes pour informer un risque associé au médicament d'issues maternelles ou fœtales indésirables. Arrêtez FOSAMAX 35 mg lorsque la grossesse est reconnue.
Dans les études de reproduction chez l'animal, l'administration orale quotidienne d'alendronate à des rats d'avant l'accouplement jusqu'à la fin de la gestation ou de la lactation a montré une diminution de la survie postimplantation et une diminution du gain de poids corporel des ratons à partir de doses équivalentes à moins de la moitié de la dose quotidienne clinique la plus élevée recommandée de 40 mg ( basé sur la surface corporelle, mg/m²). L'administration orale d'alendronate à des rats au cours de l'organogenèse a entraîné une réduction de l'ossification fœtale à partir de doses 3 fois supérieures à la dose quotidienne clinique de 40 mg. Aucun effet fœtal similaire n'a été observé chez les lapines gravides recevant des doses orales pendant l'organogenèse à des doses équivalentes à environ 10 fois la dose clinique quotidienne de 40 mg.
Un accouchement retardé ou un échec de la progéniture, une parturition prolongée et des décès maternels et fœtaux en fin de grossesse dus à une hypocalcémie maternelle sont survenus chez des rats à des doses orales aussi faibles qu'un dixième de la dose clinique quotidienne de 40 mg (voir Données ).
Les bisphosphonates sont incorporés dans la matrice osseuse, à partir de laquelle ils sont progressivement libérés sur une période de plusieurs années. La quantité de bisphosphonate incorporée dans l'os adulte et disponible pour être libérée dans la circulation systémique est directement liée à la dose et à la durée d'utilisation du bisphosphonate. Par conséquent, sur la base du mécanisme d'action des bisphosphonates, il existe un risque potentiel de lésions fœtales, principalement squelettiques, si une femme tombe enceinte après avoir terminé un traitement par bisphosphonates. L'impact de variables telles que le délai entre l'arrêt du traitement par bisphosphonates et la conception, le bisphosphonate particulier utilisé et la voie d'administration (intraveineuse versus orale) sur le risque n'a pas été étudié.
Le risque de fond estimé de malformations congénitales majeures et de fausses couches pour la ou les populations indiquées est inconnu. Toutes les grossesses présentent un risque de fond de malformations congénitales, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, les risques de fond estimés de malformations congénitales majeures et de fausses couches dans les grossesses cliniquement reconnues sont respectivement de 2 à 4 % et de 15 à 20 %.
Données
Données animales
Des études de reproduction chez des rats ayant reçu des doses orales d'avant l'accouplement jusqu'à la fin de la gestation ou de la lactation ont montré une diminution de la survie postimplantation à partir de 2 mg/kg/jour et une diminution du gain de poids corporel à partir de 1 mg/kg/jour, doses équivalentes à moins de la moitié des 40 mg dose quotidienne clinique basée sur la surface corporelle, mg/m². L'incidence d'ossification fœtale incomplète dans les os vertébraux, crâniens et sternébraux a augmenté chez les rats recevant une dose orale pendant l'organogenèse à partir de 10 mg/kg/jour (environ 3 fois la dose quotidienne clinique de 40 mg). Aucun effet fœtal similaire n'a été observé chez les lapines gravides ayant reçu par voie orale pendant l'organogenèse jusqu'à 35 mg/kg/jour (équivalent à environ 10 fois la dose quotidienne clinique de 40 mg).
Le calcium total et le calcium ionisé ont diminué chez les rates gravides recevant par voie orale 15 mg/kg/jour d'alendronate (environ 4 fois la dose quotidienne clinique de 40 mg), entraînant des retards et des échecs d'accouchement. Une parturition prolongée due à une hypocalcémie maternelle a été observée lorsque les rats ont été traités avant l'accouplement jusqu'à la gestation à partir de 0,5 mg/kg/jour (environ un dixième de la dose quotidienne clinique de 40 mg). Une maternotoxicité (décès en fin de grossesse) est également survenue chez des rats femelles traités par voie orale avec 15 mg/kg/jour (environ 4 fois la dose quotidienne clinique de 40 mg) pendant diverses périodes de gestation. Ces décès maternels ont été atténués mais pas éliminés par l'arrêt du traitement. La supplémentation en calcium dans l'eau de boisson ou par minipompe sous-cutanée à des rats dosés par voie orale avec 15 mg/kg/jour d'alendronate n'a pas pu améliorer l'hypocalcémie ni prévenir les décès maternels et néonatals liés à la dystocie. Cependant, la supplémentation en calcium par voie intraveineuse a empêché les décès maternels, mais pas néonatals.
Lactation
Résumé des risques
On ne sait pas si l'alendronate est présent dans le lait maternel humain, s'il affecte la production de lait maternel ou s'il a des effets sur le nourrisson allaité. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que les besoins cliniques de la mère en FOSAMAX 70 mg et tout effet indésirable potentiel de FOSAMAX ou de l'affection maternelle sous-jacente sur l'enfant allaité.
Utilisation pédiatrique
FOSAMAX 70 mg n'est pas indiqué chez les patients pédiatriques.
L'innocuité et l'efficacité de FOSAMAX ont été examinées dans une étude randomisée, en double aveugle et contrôlée par placebo d'une durée de deux ans portant sur 139 patients pédiatriques, âgés de 4 à 18 ans, atteints d'ostéogenèse imparfaite (OI) sévère. Cent neuf patients ont été randomisés pour recevoir 5 mg de FOSAMAX 35 mg par jour (poids inférieur à 40 kg) ou 10 mg de FOSAMAX 70 mg par jour (poids supérieur ou égal à 40 kg) et 30 patients au placebo. Le Z-score moyen de base de la DMO du rachis lombaire des patients était de -4,5. La variation moyenne du score Z de la DMO de la colonne lombaire entre le début et le 24e mois était de 1,3 chez les patients traités par FOSAMAX à 35 mg et de 0,1 chez les patients sous placebo. Le traitement par FOSAMAX 35 mg n'a pas réduit le risque de fracture. Seize pour cent des patients FOSAMAX qui ont subi une fracture radiologiquement confirmée au mois 12 de l'étude ont présenté un retard de cicatrisation de la fracture (remodelage du cal) ou une pseudarthrose de la fracture lors de l'évaluation radiographique au mois 24, contre 9 % des patients traités par placebo. Chez les patients traités par FOSAMAX, les données d'histomorphométrie osseuse obtenues au mois 24 ont démontré une diminution du remodelage osseux et un retard du temps de minéralisation ; cependant, il n'y avait aucun défaut de minéralisation. Il n'y avait pas de différences statistiquement significatives entre les groupes FOSAMAX 35 mg et placebo dans la réduction de la douleur osseuse. La biodisponibilité orale chez les enfants était similaire à celle observée chez les adultes.
Le profil d'innocuité global de FOSAMAX chez les patients atteints d'ostéogenèse imparfaite traités jusqu'à 24 mois était généralement similaire à celui des adultes atteints d'ostéoporose traités par FOSAMAX. Cependant, il y a eu une augmentation de la fréquence des vomissements chez les patients atteints d'ostéogenèse imparfaite traités par FOSAMAX par rapport au placebo. Au cours de la période de traitement de 24 mois, des vomissements ont été observés chez 32 des 109 (29,4 %) patients traités par FOSAMAX 70 mg et 3 des 30 (10 %) patients traités par placebo.
Dans une étude pharmacocinétique, 6 des 24 patients pédiatriques atteints d'ostéogenèse imparfaite ayant reçu une dose orale unique de FOSAMAX 35 ou 70 mg ont développé de la fièvre, des symptômes pseudo-grippaux et/ou une légère lymphocytopénie dans les 24 à 48 heures suivant l'administration. Ces événements, ne durant pas plus de 2 à 3 jours et répondant à l'acétaminophène, sont cohérents avec une réponse de phase aiguë qui a été rapportée chez des patients recevant des bisphosphonates, y compris FOSAMAX. [Voir EFFETS INDÉSIRABLES ]
Utilisation gériatrique
Parmi les patients recevant FOSAMAX dans le cadre de l'essai d'intervention sur fracture (FIT), 71 % (n = 2 302) avaient plus ou moins 65 ans et 17 % (n = 550) avaient plus ou moins 75 ans. Parmi les patients recevant FOSAMAX 70 mg aux États-Unis et dans les études multinationales sur le traitement de l'ostéoporose chez les femmes, les études sur l'ostéoporose chez les hommes, les études sur l'ostéoporose induite par les glucocorticoïdes et les études sur la maladie de Paget [voir Etudes cliniques ], 45 %, 54 %, 37 % et 70 %, respectivement, étaient âgés de 65 ans ou plus. Aucune différence globale d'efficacité ou de sécurité n'a été observée entre ces patients et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue.
Insuffisance rénale
FOSAMAX 70 mg n'est pas recommandé chez les patients dont la clairance de la créatinine est inférieure à 35 mL/min. Aucun ajustement posologique n'est nécessaire chez les patients dont la clairance de la créatinine est comprise entre 35 et 60 ml/min [voir PHARMACOLOGIE CLINIQUE ].
Insuffisance hépatique
Comme il existe des preuves que l'alendronate n'est pas métabolisé ou excrété dans la bile, aucune étude n'a été menée chez des patients atteints d'insuffisance hépatique. Aucun ajustement posologique n'est nécessaire [voir PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Une létalité significative après des doses orales uniques a été observée chez les rats femelles et les souris à 552 mg/kg (3256 mg/m²) et 966 mg/kg (2898 mg/m²), respectivement. Chez les mâles, ces valeurs étaient légèrement plus élevées, 626 et 1280 mg/kg, respectivement. Il n'y a pas eu de létalité chez le chien à des doses orales allant jusqu'à 200 mg/kg (4000 mg/m²).
Aucune information spécifique n'est disponible sur le traitement du surdosage avec FOSAMAX. Une hypocalcémie, une hypophosphatémie et des événements indésirables gastro-intestinaux supérieurs, tels que des maux d'estomac, des brûlures d'estomac, une œsophagite, une gastrite ou un ulcère, peuvent résulter d'un surdosage oral. Du lait ou des antiacides doivent être administrés pour lier l'alendronate. En raison du risque d'irritation de l'œsophage, il ne faut pas provoquer de vomissements et le patient doit rester parfaitement droit.
La dialyse ne serait pas bénéfique.
CONTRE-INDICATIONS
FOSAMAX 35 mg est contre-indiqué chez les patients présentant les conditions suivantes :
- Anomalies de l'œsophage qui retardent la vidange de l'œsophage telles que sténose ou achalasie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Incapacité à se tenir debout ou à s'asseoir pendant au moins 30 minutes [voir DOSAGE ET ADMINISTRATION ; AVERTISSEMENTS ET PRECAUTIONS ]
- Ne pas administrer FOSAMAX 35 mg solution buvable aux patients à risque accru d'aspiration.
- Hypocalcémie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypersensibilité à tout composant de ce produit. Des réactions d'hypersensibilité incluant urticaire et œdème de Quincke ont été rapportées [voir EFFETS INDÉSIRABLES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Les études animales ont indiqué le mode d'action suivant. Au niveau cellulaire, l'alendronate montre une localisation préférentielle aux sites de résorption osseuse, spécifiquement sous les ostéoclastes. Les ostéoclastes adhèrent normalement à la surface de l'os mais n'ont pas la bordure ébouriffée qui indique une résorption active. L'alendronate n'interfère pas avec le recrutement ou l'attachement des ostéoclastes, mais il inhibe l'activité des ostéoclastes. Des études chez la souris sur la localisation du [ 3 H]alendronate radioactif dans l'os ont montré une absorption environ 10 fois plus élevée sur les surfaces des ostéoclastes que sur les surfaces des ostéoblastes. Les os examinés 6 et 49 jours après l'administration de [ 3 H]alendronate chez les rats et les souris, respectivement, ont montré que de l'os normal s'était formé au-dessus de l'alendronate, qui était incorporé à l'intérieur de la matrice. Bien qu'il soit incorporé dans la matrice osseuse, l'alendronate n'est pas pharmacologiquement actif. Ainsi, l'alendronate doit être administré en continu pour supprimer les ostéoclastes sur les surfaces de résorption nouvellement formées. L'histomorphométrie chez les babouins et les rats a montré que le traitement à l'alendronate réduit le remodelage osseux (c'est-à-dire le nombre de sites au niveau desquels l'os est remodelé). De plus, la formation osseuse dépasse la résorption osseuse au niveau de ces sites de remodelage, entraînant des gains progressifs de masse osseuse.

Pharmacodynamie
L'alendronate est un bisphosphonate qui se lie à l'hydroxyapatite osseuse et inhibe spécifiquement l'activité des ostéoclastes, les cellules résorbant l'os. L'alendronate réduit la résorption osseuse sans effet direct sur la formation osseuse, bien que ce dernier processus soit finalement réduit car la résorption et la formation osseuses sont couplées au cours du remodelage osseux.
Ostéoporose chez les femmes ménopausées
L'ostéoporose se caractérise par une faible masse osseuse qui entraîne un risque accru de fracture. Le diagnostic peut être confirmé par la découverte d'une faible masse osseuse, des signes de fracture à la radiographie, des antécédents de fracture ostéoporotique, ou une perte de taille ou une cyphose, indiquant une fracture vertébrale (rachidienne). L'ostéoporose survient chez les hommes et les femmes, mais elle est plus fréquente chez les femmes après la ménopause, lorsque le renouvellement osseux augmente et que le taux de résorption osseuse dépasse celui de la formation osseuse. Ces changements entraînent une perte osseuse progressive et conduisent à l'ostéoporose chez une proportion importante de femmes de plus de 50 ans. Les fractures, généralement de la colonne vertébrale, de la hanche et du poignet, en sont les conséquences courantes. De 50 à 90 ans, le risque de fracture de la hanche chez les femmes blanches augmente de 50 fois et le risque de fracture vertébrale de 15 à 30 fois. On estime qu'environ 40 % des femmes de 50 ans subiront une ou plusieurs fractures liées à l'ostéoporose de la colonne vertébrale, de la hanche ou du poignet au cours de leur vie restante. Les fractures de la hanche, en particulier, sont associées à une morbidité, une incapacité et une mortalité substantielles.
Des doses orales quotidiennes d'alendronate (5, 20 et 40 mg pendant six semaines) chez des femmes ménopausées ont produit des modifications biochimiques indiquant une inhibition dose-dépendante de la résorption osseuse, notamment une diminution du calcium urinaire et des marqueurs urinaires de la dégradation du collagène osseux (tels que la désoxypyridinoline et la N-télopeptides liés du collagène de type I). Ces modifications biochimiques avaient tendance à revenir vers les valeurs initiales dès 3 semaines après l'arrêt du traitement par l'alendronate et ne différaient pas du placebo après 7 mois.
Le traitement à long terme de l'ostéoporose avec FOSAMAX 10 mg/jour (jusqu'à cinq ans) a réduit l'excrétion urinaire des marqueurs de la résorption osseuse, la déoxypyridinoline et les N-télopeptides réticulés du collagène de type l, d'environ 50 % et 70 %, respectivement , pour atteindre des niveaux similaires à ceux observés chez les femmes préménopausées en bonne santé. Des diminutions similaires ont été observées chez les patients dans les études de prévention de l'ostéoporose qui ont reçu FOSAMAX 5 mg/jour. La diminution du taux de résorption osseuse indiquée par ces marqueurs était évidente dès un mois et à trois à six mois a atteint un plateau qui a été maintenu pendant toute la durée du traitement avec FOSAMAX. Dans les études sur le traitement de l'ostéoporose, FOSAMAX 10 mg/jour a diminué les marqueurs de la formation osseuse, l'ostéocalcine et la phosphatase alcaline spécifique osseuse d'environ 50 %, et la phosphatase alcaline sérique totale d'environ 25 à 30 % pour atteindre un plateau après 6 à 12 mois. Dans les études de prévention de l'ostéoporose, FOSAMAX 5 mg/jour a diminué l'ostéocalcine et la phosphatase alcaline sérique totale d'environ 40 % et 15 %, respectivement. Des réductions similaires du taux de remodelage osseux ont été observées chez les femmes ménopausées au cours d'études d'un an avec FOSAMAX 70 mg une fois par semaine pour le traitement de l'ostéoporose et FOSAMAX 35 mg une fois par semaine pour la prévention de l'ostéoporose. Ces données indiquent que le taux de renouvellement osseux a atteint un nouvel état d'équilibre, malgré l'augmentation progressive de la quantité totale d'alendronate déposée dans l'os.
En raison de l'inhibition de la résorption osseuse, des réductions asymptomatiques des concentrations sériques de calcium et de phosphate ont également été observées après le traitement par FOSAMAX. Dans les études à long terme, des réductions par rapport aux valeurs initiales du calcium sérique (environ 2 %) et du phosphate (environ 4 à 6 %) étaient évidentes le premier mois après le début de FOSAMAX 10 mg. Aucune autre diminution de la calcémie n'a été observée pendant la durée de traitement de cinq ans ; cependant, le phosphate sérique est revenu vers les niveaux pré-étude au cours des années trois à cinq. Des réductions similaires ont été observées avec FOSAMAX 5 mg/jour. Dans des études d'un an avec FOSAMAX 35 et 70 mg une fois par semaine, des réductions similaires ont été observées à 6 et 12 mois. La réduction du phosphate sérique peut refléter non seulement le bilan minéral osseux positif dû à FOSAMAX 70 mg, mais également une diminution de la réabsorption rénale du phosphate.
L'ostéoporose chez les hommes
Le traitement des hommes atteints d'ostéoporose avec FOSAMAX 10 mg/jour pendant deux ans a réduit l'excrétion urinaire des N-télopeptides réticulés du collagène de type I d'environ 60 % et de la phosphatase alcaline spécifique des os d'environ 40 %. Des réductions similaires ont été observées dans une étude d'un an chez des hommes atteints d'ostéoporose recevant une fois par semaine FOSAMAX 70 mg.
Ostéoporose induite par les glucocorticoïdes
L'utilisation soutenue de glucocorticoïdes est souvent associée au développement de l'ostéoporose et des fractures qui en résultent (en particulier des vertèbres, de la hanche et des côtes). Il survient à la fois chez les hommes et les femmes de tous âges. L'ostéoporose survient à la suite d'une formation osseuse inhibée et d'une résorption osseuse accrue entraînant une perte osseuse nette. L'alendronate diminue la résorption osseuse sans inhiber directement la formation osseuse.
Dans des études cliniques allant jusqu'à deux ans & # 39; durée, FOSAMAX 5 et 10 mg/jour ont réduit les N-télopeptides réticulés du collagène de type I (un marqueur de la résorption osseuse) d'environ 60 % et ont réduit la phosphatase alcaline osseuse spécifique et la phosphatase alcaline sérique totale (marqueurs de la formation osseuse) de environ 15 à 30 % et 8 à 18 %, respectivement. Du fait de l'inhibition de la résorption osseuse, FOSAMAX 5 et 10 mg/jour ont induit des diminutions asymptomatiques de la calcémie (environ 1 à 2 %) et du phosphate sérique (environ 1 à 8 %).
La maladie osseuse de Paget
La maladie osseuse de Paget est un trouble squelettique chronique et focal caractérisé par un remodelage osseux fortement accru et désordonné. Une résorption osseuse ostéoclastique excessive est suivie d'une nouvelle formation osseuse ostéoblastique, conduisant au remplacement de l'architecture osseuse normale par une structure osseuse désorganisée, agrandie et affaiblie.
Les manifestations cliniques de la maladie de Paget vont de l'absence de symptômes à une morbidité sévère due à des douleurs osseuses, des déformations osseuses, des fractures pathologiques et des complications neurologiques et autres. La phosphatase alcaline sérique, l'indice biochimique de l'activité de la maladie le plus fréquemment utilisé, fournit une mesure objective de la gravité de la maladie et de la réponse au traitement.
FOSAMAX 70 mg diminue directement le taux de résorption osseuse, ce qui entraîne une diminution indirecte de la formation osseuse. Dans les essais cliniques, FOSAMAX 40 mg une fois par jour pendant six mois a produit des diminutions significatives de la phosphatase alcaline sérique ainsi que des marqueurs urinaires de la dégradation du collagène osseux. En raison de l'inhibition de la résorption osseuse, FOSAMAX a induit des diminutions généralement légères, transitoires et asymptomatiques du calcium et du phosphate sériques.
Pharmacocinétique
Absorption
Par rapport à une dose intraveineuse de référence, la biodisponibilité orale moyenne de l'alendronate chez la femme était de 0,64 % pour des doses allant de 5 à 70 mg lorsqu'il était administré après une nuit à jeun et deux heures avant un petit déjeuner standardisé. La biodisponibilité orale du comprimé de 10 mg chez les hommes (0,59 %) était similaire à celle des femmes lorsqu'il était administré après une nuit à jeun et 2 heures avant le petit-déjeuner.
FOSAMAX 70 mg solution buvable et FOSAMAX 70 mg comprimé sont également biodisponibles.
Une étude examinant l'effet du moment d'un repas sur la biodisponibilité de l'alendronate a été réalisée chez 49 femmes ménopausées. La biodisponibilité a diminué (d'environ 40 %) lorsque 10 mg d'alendronate ont été administrés 0,5 ou 1 heure avant un petit-déjeuner standardisé, par rapport à une administration 2 heures avant de manger. Dans les études de traitement et de prévention de l'ostéoporose, l'alendronate était efficace lorsqu'il était administré au moins 30 minutes avant le petit-déjeuner.
La biodisponibilité était négligeable, que l'alendronate ait été administré avec ou jusqu'à deux heures après un petit-déjeuner standardisé. L'administration concomitante d'alendronate avec du café ou du jus d'orange a réduit la biodisponibilité d'environ 60 %.
Distribution
Des études précliniques (chez des rats mâles) montrent que l'alendronate se distribue de manière transitoire aux tissus mous après administration intraveineuse de 1 mg/kg, mais est ensuite rapidement redistribué dans les os ou excrété dans les urines. Le volume de distribution moyen à l'état d'équilibre, à l'exclusion de l'os, est d'au moins 28 L chez l'homme. Les concentrations de médicament dans le plasma suite à des doses orales thérapeutiques sont trop faibles (moins de 5 ng/mL) pour une détection analytique. La liaison aux protéines dans le plasma humain est d'environ 78 %.
Métabolisme
Il n'y a aucune preuve que l'alendronate soit métabolisé chez les animaux ou les humains.
Excrétion
Après une dose intraveineuse unique de [14C]alendronate, environ 50 % de la radioactivité a été excrétée dans l'urine dans les 72 heures et peu ou pas de radioactivité a été récupérée dans les fèces. Après une dose intraveineuse unique de 10 mg, la clairance rénale de l'alendronate était de 71 mL/min (64, 78 ; intervalle de confiance [IC] à 90 %) et la clairance systémique n'a pas dépassé 200 mL/min. Les concentrations plasmatiques ont chuté de plus de 95 % dans les 6 heures suivant l'administration intraveineuse. La demi-vie terminale chez l'homme est estimée à plus de 10 ans, reflétant probablement la libération d'alendronate par le squelette. Sur la base de ce qui précède, on estime qu'après 10 ans de traitement oral par FOSAMAX (10 mg par jour), la quantité d'alendronate libérée quotidiennement par le squelette est d'environ 25 % de celle absorbée par le tractus gastro-intestinal.
Populations spécifiques
Le genre
La biodisponibilité et la fraction d'une dose intraveineuse excrétée dans l'urine étaient similaires chez les hommes et les femmes.
Gériatrique
La biodisponibilité et la disposition (excrétion urinaire) étaient similaires chez les patients âgés et plus jeunes. Aucun ajustement posologique n'est nécessaire chez les patients âgés.
Course
Les différences pharmacocinétiques dues à la race n'ont pas été étudiées.
Insuffisance rénale
Des études précliniques montrent que, chez les rats souffrant d'insuffisance rénale, des quantités croissantes de médicament sont présentes dans le plasma, les reins, la rate et le tibia. Chez les témoins sains, le médicament qui ne se dépose pas dans les os est rapidement excrété dans l'urine. Aucun signe de saturation de l'absorption osseuse n'a été trouvé après 3 semaines d'administration avec des doses intraveineuses cumulatives de 35 mg/kg chez de jeunes rats mâles. Bien qu'aucune étude pharmacocinétique formelle sur l'insuffisance rénale n'ait été menée chez des patients, il est probable que, comme chez l'animal, l'élimination de l'alendronate par voie rénale soit réduite chez les patients insuffisants rénaux. Par conséquent, une accumulation un peu plus importante d'alendronate dans les os peut être attendue chez les patients présentant une insuffisance rénale.
Aucun ajustement posologique n'est nécessaire chez les patients dont la clairance de la créatinine est comprise entre 35 et 60 ml/min. FOSAMAX 35 mg n'est pas recommandé chez les patients dont la clairance de la créatinine est inférieure à 35 ml/min en raison du manque d'expérience avec l'alendronate dans l'insuffisance rénale.
Insuffisance hépatique
Comme il existe des preuves que l'alendronate n'est pas métabolisé ou excrété dans la bile, aucune étude n'a été menée chez des patients atteints d'insuffisance hépatique. Aucun ajustement posologique n'est nécessaire.
Interactions médicamenteuses
Il a été démontré que la ranitidine intraveineuse double la biodisponibilité de l'alendronate oral. La signification clinique de cette biodisponibilité accrue et si des augmentations similaires se produiront chez les patients recevant des antagonistes H2 par voie orale sont inconnues.
Chez des sujets sains, la prednisone orale (20 mg trois fois par jour pendant cinq jours) n'a pas produit de changement cliniquement significatif de la biodisponibilité orale de l'alendronate (une augmentation moyenne allant de 20 à 44 %).
Les produits contenant du calcium et d'autres cations multivalents sont susceptibles d'interférer avec l'absorption de l'alendronate.
Toxicologie animale et/ou pharmacologie
Les activités inhibitrices relatives sur la résorption osseuse et la minéralisation de l'alendronate et de l'étidronate ont été comparées dans le test de Schenk, qui est basé sur l'examen histologique des épiphyses de rats en croissance. Dans ce test, la dose la plus faible d'alendronate qui a interféré avec la minéralisation osseuse (conduisant à l'ostéomalacie) était 6000 fois supérieure à la dose antirésorptive. Le rapport correspondant pour l'étidronate était de un pour un. Ces données suggèrent que l'alendronate administré à des doses thérapeutiques est très peu susceptible d'induire une ostéomalacie.
Etudes cliniques
Traitement de l'ostéoporose chez les femmes ménopausées
Dosage quotidien
L'efficacité de FOSAMAX 10 mg par jour a été évaluée dans quatre essais cliniques. L'étude 1, une étude clinique américaine de trois ans, multicentrique, en double aveugle, contrôlée par placebo, a recruté 478 patients avec un T-score de DMO égal ou inférieur à moins 2,5 avec ou sans fracture vertébrale antérieure ; L'étude 2, une étude clinique multinationale de trois ans, multicentrique, en double aveugle, contrôlée par placebo, a recruté 516 patients avec un T-score de DMO égal ou inférieur à moins 2,5 avec ou sans fracture vertébrale antérieure ; l'étude 3, l'étude de trois ans de l'essai d'intervention sur les fractures (FIT), une étude qui a recruté 2027 patientes ménopausées avec au moins une fracture vertébrale de base ; et l'étude 4, l'étude de quatre ans sur le FIT : une étude qui a recruté 4 432 patientes ménopausées présentant une faible masse osseuse mais sans fracture vertébrale initiale.
Effet sur l'incidence des fractures
Pour évaluer les effets de FOSAMAX sur l'incidence des fractures vertébrales (détectées par radiographie numérisée ; environ un tiers de celles-ci étaient cliniquement symptomatiques), les études américaines et multinationales ont été combinées dans une analyse comparant un placebo aux groupes de dosage combinés de FOSAMAX (5 ou 10 mg pendant trois ans ou 20 mg pendant deux ans suivis de 5 mg pendant un an). Il y a eu une réduction statistiquement significative de la proportion de patients traités par FOSAMAX 70 mg présentant une ou plusieurs nouvelles fractures vertébrales par rapport à ceux traités par placebo (3,2 % contre 6,2 % ; une réduction du risque relatif de 48 %). Une réduction du nombre total de nouvelles fractures vertébrales (4,2 vs 11,3 pour 100 patients) a également été observée. Dans l'analyse groupée, les patients qui ont reçu FOSAMAX ont présenté une perte de stature statistiquement significativement inférieure à celle observée chez ceux qui ont reçu le placebo (-3,0 mm contre -4,6 mm).
Le Fracture Intervention Trial (FIT) consistait en deux études menées chez des femmes ménopausées : l'étude de trois ans portant sur des patientes ayant subi au moins une fracture vertébrale radiographique initiale et l'étude de quatre ans portant sur des patientes présentant une faible masse osseuse mais sans fracture vertébrale initiale. Dans les deux études sur le FIT, 96 % des patients randomisés ont terminé les études (c'est-à-dire ont eu une visite de clôture à la fin prévue de l'étude) ; environ 80 % des patients prenaient encore les médicaments à l'étude à la fin de l'étude.
Essai d'intervention sur les fractures : étude de trois ans (patients avec au moins une fracture vertébrale radiographique initiale)
Cette étude randomisée, en double aveugle, contrôlée par placebo, portant sur 2027 patients (FOSAMAX 70 mg, n = 1022 ; placebo, n = 1005) a démontré que le traitement par FOSAMAX entraînait des réductions statistiquement significatives de l'incidence des fractures à trois ans, comme indiqué dans le tableau 6. .
De plus, dans cette population de patients présentant une fracture vertébrale à l'inclusion, le traitement par FOSAMAX a significativement réduit l'incidence des hospitalisations (25,0 % contre 30,7 %).
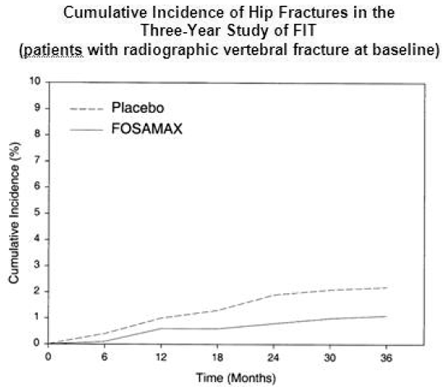
Dans l'étude de trois ans sur le FIT, des fractures de la hanche sont survenues chez 22 (2,2 %) des 1005 patients sous placebo et 11 (1,1 %) des 1022 patients sous FOSAMAX, p = 0,047. La figure 1 montre l'incidence cumulée des fractures de la hanche dans cette étude.
Figure 1 : Incidence cumulée des fractures de la hanche dans l'étude de trois ans sur le FIT (patients présentant une fracture vertébrale radiographique au départ)
Essai d'intervention sur les fractures : étude de quatre ans (patients avec une faible masse osseuse mais sans fracture vertébrale radiographique de base)
Cette étude randomisée, en double aveugle, contrôlée par placebo, portant sur 4 432 patients (FOSAMAX 70 mg, n = 2 214 ; placebo, n = 2 218) a étudié plus en détail la réduction de l'incidence des fractures due à FOSAMAX. Le but de l'étude était de recruter des femmes atteintes d'ostéoporose, définie comme une DMO au col du fémur de base d'au moins deux écarts-types en dessous de la moyenne des jeunes femmes adultes. Cependant, en raison de révisions ultérieures des valeurs normatives de la DMO du col fémoral, 31 % des patients ne répondaient pas à ce critère d'entrée et cette étude incluait donc à la fois des femmes ostéoporotiques et non ostéoporotiques. Les résultats sont présentés dans le tableau 7 pour les patients atteints d'ostéoporose.
Résultats des fractures dans les études
Dans l'étude de trois ans sur le FIT, FOSAMAX 35 mg a réduit le pourcentage de femmes ayant subi au moins une nouvelle fracture vertébrale radiographique de 15,0 % à 7,9 % (réduction du risque relatif de 47 %, p
FOSAMAX a réduit le pourcentage de femmes subissant plusieurs (deux ou plus) nouvelles fractures vertébrales de 4,2 % à 0,6 % (réduction du risque relatif de 87 %, p
Ainsi, FOSAMAX 35 mg a réduit l'incidence des fractures vertébrales radiographiques chez les femmes ostéoporotiques, qu'elles aient ou non déjà eu une fracture vertébrale radiographique.
Effet sur la densité minérale osseuse
L'efficacité de la densité minérale osseuse de FOSAMAX 10 mg une fois par jour chez les femmes ménopausées, âgées de 44 à 84 ans, atteintes d'ostéoporose (densité minérale osseuse [DMO] du rachis lombaire d'au moins 2 écarts-types en dessous de la moyenne préménopausique) a été démontrée dans quatre études cliniques en aveugle contrôlées par placebo de deux ou trois ans & # 39; durée.
La figure 2 montre les augmentations moyennes de la DMO du rachis lombaire, du col fémoral et du trochanter chez les patients recevant FOSAMAX 10 mg/jour par rapport aux patients traités par placebo à trois ans pour chacune de ces études.
Figure 2 : Études sur le traitement de l'ostéoporose chez les femmes ménopausées Augmentation de la DMO FOSAMAX 10 mg/jour à trois ans
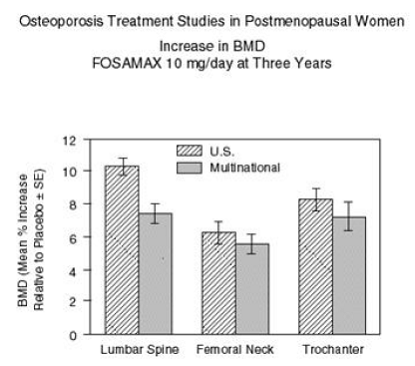
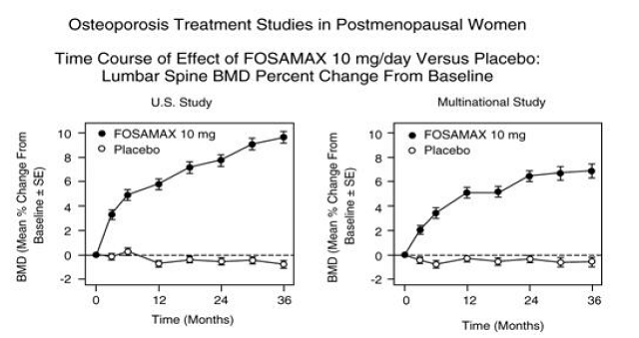
À trois ans, des augmentations significatives de la DMO, par rapport à la valeur initiale et au placebo, ont été observées à chaque site de mesure dans chaque étude chez les patients ayant reçu FOSAMAX 10 mg/jour. La DMO corporelle totale a également augmenté de manière significative dans chaque étude, ce qui suggère que les augmentations de la masse osseuse de la colonne vertébrale et de la hanche ne se sont pas produites au détriment d'autres sites squelettiques. Les augmentations de la DMO étaient évidentes dès trois mois et se sont poursuivies tout au long des trois années de traitement. (Voir la figure 3 pour les résultats de la colonne lombaire.) Dans la prolongation de deux ans de ces études, le traitement de 147 patients avec FOSAMAX 10 mg/jour a entraîné des augmentations continues de la DMO au niveau de la colonne lombaire et du trochanter (augmentations supplémentaires absolues entre les années 3 et 3). 5 : rachis lombaire, 0,94 % ; trochanter, 0,88 %). La DMO au niveau du col fémoral, de l'avant-bras et du corps entier a été maintenue. FOSAMAX a été efficace de la même manière quel que soit l'âge, la race, le taux initial de renouvellement osseux et la DMO initiale dans la plage étudiée (au moins 2 écarts-types en dessous de la moyenne préménopausique).
Figure 3 : Études sur le traitement de l'ostéoporose chez les femmes ménopausées Évolution temporelle de l'effet de FOSAMAX 10 mg/jour par rapport au placebo : Pourcentage de variation de la DMO de la colonne lombaire par rapport au départ
Chez les patientes atteintes d'ostéoporose post-ménopausique traitées par FOSAMAX 10 mg/jour pendant un ou deux ans, les effets de l'arrêt du traitement ont été évalués. Après l'arrêt du traitement, il n'y a plus eu d'augmentation de la masse osseuse et les taux de perte osseuse étaient similaires à ceux des groupes placebo.
Histologie osseuse
L'histologie osseuse chez 270 patientes ménopausées atteintes d'ostéoporose traitées par FOSAMAX à des doses allant de 1 à 20 mg/jour pendant un, deux ou trois ans a révélé une minéralisation et une structure normales, ainsi que la diminution attendue du remodelage osseux par rapport au placebo. Ces données, associées à l'histologie osseuse normale et à l'augmentation de la résistance osseuse observées chez les rats et les babouins exposés à un traitement à long terme par l'alendronate, permettent de conclure que l'os formé pendant le traitement par FOSAMAX 35 mg est de qualité normale.
Effet sur la hauteur
FOSAMAX, sur une période de trois ou quatre ans, a été associé à des réductions statistiquement significatives de la perte de taille par rapport au placebo chez les patients avec et sans fractures vertébrales radiographiques initiales. À la fin des études FIT, les différences entre les groupes de traitement étaient de 3,2 mm dans l'étude de trois ans et de 1,3 mm dans l'étude de quatre ans.
Dosage hebdomadaire
L'équivalence thérapeutique de FOSAMAX 70 mg une fois par semaine (n = 519) et FOSAMAX 10 mg par jour (n = 370) a été démontrée dans une étude multicentrique en double aveugle d'un an chez des femmes ménopausées atteintes d'ostéoporose. Dans l'analyse principale des finissants, les augmentations moyennes par rapport au départ de la DMO du rachis lombaire à un an étaient de 5,1 % (4,8 ; 5,4 % ; IC à 95 %) dans le groupe recevant 70 mg une fois par semaine (n = 440) et de 5,4 % ( 5,0, 5,8 % ; IC à 95 %) dans le groupe de 10 mg par jour (n = 330). Les deux groupes de traitement étaient également similaires en ce qui concerne les augmentations de la DMO aux autres sites squelettiques. Les résultats de l'analyse en intention de traiter étaient cohérents avec l'analyse primaire des finissants.
Utilisation concomitante avec la thérapie de remplacement des œstrogènes/hormones (THS)
Les effets sur la DMO du traitement par FOSAMAX 10 mg une fois par jour et les œstrogènes conjugués (0,625 mg/jour) seuls ou en association ont été évalués dans une étude de deux ans, en double aveugle, contrôlée par placebo chez des femmes ménopausées ostéoporotiques hystérectomisées (n= 425). À deux ans, les augmentations de la DMO de la colonne lombaire par rapport au départ étaient significativement plus importantes avec l'association (8,3 %) qu'avec l'œstrogène ou le FOSAMAX seul (6,0 % chacun).
Les effets sur la DMO lorsque FOSAMAX 35 mg a été ajouté à des doses stables (pendant au moins un an) de THS (œstrogène ± progestatif) ont été évalués dans une étude d'un an, en double aveugle, contrôlée par placebo chez des femmes ménopausées ostéoporotiques (n = 428). L'ajout de FOSAMAX 10 mg une fois par jour au THS a produit, à un an, des augmentations significativement plus importantes de la DMO lombaire (3,7 %) par rapport au THS seul (1,1 %).
Dans ces études, des augmentations significatives ou des tendances favorables de la DMO pour le traitement combiné par rapport au THS seul ont été observées au niveau de la hanche totale, du col fémoral et du trochanter. Aucun effet significatif n'a été observé pour la DMO corporelle totale.
Des études histomorphométriques de biopsies transiliaques chez 92 sujets ont montré une architecture osseuse normale. Par rapport au placebo, il y a eu une suppression de 98 % du remodelage osseux (évaluée par la surface de minéralisation) après 18 mois de traitement combiné avec FOSAMAX 35 mg et HRT, 94 % sous FOSAMAX 35 mg seul et 78 % sous HRT seul. Les effets à long terme de l'association FOSAMAX 35 mg et HRT sur la survenue et la cicatrisation des fractures n'ont pas été étudiés.
Prévention de l'ostéoporose chez les femmes ménopausées
Dosage quotidien
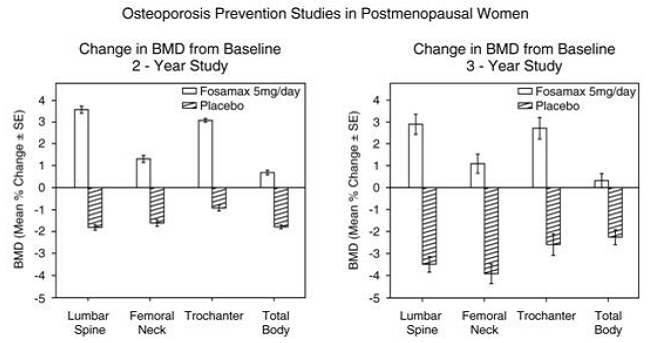
La prévention de la perte osseuse a été démontrée dans deux études en double aveugle contrôlées par placebo chez des femmes ménopausées âgées de 40 à 60 ans. Mille six cent neuf patientes (FOSAMAX 5 mg/jour ; n = 498) ménopausées depuis au moins six mois ont été incluses dans une étude de deux ans sans tenir compte de leur DMO initiale. Dans l'autre étude, 447 patientes (FOSAMAX 5 mg/jour ; n = 88), ménopausées entre six mois et trois ans, ont été traitées pendant une durée allant jusqu'à trois ans. Chez les patients traités par placebo, des pertes de DMO d'environ 1 % par an ont été observées au niveau de la colonne vertébrale, de la hanche (col fémoral et trochanter) et de l'ensemble du corps. En revanche, FOSAMAX 5 mg/jour a prévenu la perte osseuse chez la majorité des patients et induit des augmentations significatives de la masse osseuse moyenne à chacun de ces sites (voir Figure 4). De plus, FOSAMAX 5 mg/jour a réduit le taux de perte osseuse au niveau de l'avant-bras d'environ la moitié par rapport au placebo. FOSAMAX 5 mg/jour a été efficace de manière similaire dans cette population, quels que soient l'âge, le temps écoulé depuis la ménopause, la race et le taux initial de remodelage osseux.
Figure 4 : Études sur la prévention de l'ostéoporose chez les femmes ménopausées
Histologie osseuse
L'histologie osseuse était normale chez les 28 patients biopsiés au bout de trois ans ayant reçu FOSAMAX à des doses allant jusqu'à 10 mg/jour.
Dosage hebdomadaire
L'équivalence thérapeutique de FOSAMAX 35 mg une fois par semaine (n = 362) et FOSAMAX 5 mg par jour (n = 361) a été démontrée dans une étude multicentrique en double aveugle d'un an chez des femmes ménopausées sans ostéoporose. Dans l'analyse principale des finissants, les augmentations moyennes par rapport au départ de la DMO du rachis lombaire à un an étaient de 2,9 % (2,6, 3,2 % ; IC à 95 %) dans le groupe recevant 35 mg une fois par semaine (n = 307) et de 3,2 % ( 2,9 ; 3,5 % ; IC à 95 %) dans le groupe de 5 mg par jour (n = 298). Les deux groupes de traitement étaient également similaires en ce qui concerne les augmentations de la DMO aux autres sites squelettiques. Les résultats de l'analyse en intention de traiter étaient cohérents avec l'analyse primaire des finissants.
Traitement pour augmenter la masse osseuse chez les hommes atteints d'ostéoporose
L'efficacité de FOSAMAX 35 mg chez les hommes atteints d'ostéoporose hypogonadique ou idiopathique a été démontrée dans deux études cliniques.
Dosage quotidien
Une étude multicentrique de deux ans, en double aveugle, contrôlée par placebo, portant sur FOSAMAX 10 mg une fois par jour, a recruté un total de 241 hommes âgés de 31 à 87 ans (moyenne, 63). Tous les patients de l'essai avaient soit un T-score de DMO inférieur ou égal à -2 au col fémoral et inférieur ou égal à -1 au rachis lombaire, soit une fracture ostéoporotique initiale et un T-score de DMO inférieur ou égal à égal à -1 au col fémoral. À deux ans, les augmentations moyennes par rapport au placebo de la DMO chez les hommes recevant FOSAMAX 10 mg/jour étaient significatives aux sites suivants : rachis lombaire, 5,3 % ; col fémoral, 2,6 % ; trochanter, 3,1 % ; et corps total, 1,6 %. Le traitement par FOSAMAX 70 mg a également réduit la perte de taille (FOSAMAX, -0,6 mm vs placebo, -2,4 mm).
Dosage hebdomadaire
Une étude multicentrique d'un an, en double aveugle, contrôlée par placebo, portant sur FOSAMAX 70 mg une fois par semaine, a recruté un total de 167 hommes âgés de 38 à 91 ans (moyenne, 66). Les patients de l'étude avaient soit un T-score de DMO inférieur ou égal à -2 au col fémoral et inférieur ou égal à -1 au rachis lombaire, soit un T-score de DMO inférieur ou égal à -2 au niveau du rachis lombaire. rachis lombaire et inférieur ou égal à -1 au col fémoral, ou une fracture ostéoporotique initiale et un T-score de DMO inférieur ou égal à -1 au col fémoral. À un an, les augmentations moyennes par rapport au placebo de la DMO chez les hommes recevant FOSAMAX 70 mg une fois par semaine étaient significatives aux sites suivants : rachis lombaire, 2,8 % ; col fémoral, 1,9 % ; trochanter, 2,0 % ; et corps entier, 1,2 %. Ces augmentations de la DMO étaient similaires à celles observées à un an dans l'étude à 10 mg une fois par jour.
Dans les deux études, les réponses de la DMO étaient similaires quel que soit l'âge (supérieur ou égal à 65 ans contre moins de 65 ans), la fonction gonadique (testostérone de base inférieure à 9 ng/dL contre supérieure ou égale à 9 ng/dL) , ou DMO de base (score T du col du fémur et du rachis lombaire inférieur ou égal à -2,5 vs supérieur à -2,5).
Traitement de l'ostéoporose induite par les glucocorticoïdes
L'efficacité de FOSAMAX 5 et 10 mg une fois par jour chez les hommes et les femmes recevant des glucocorticoïdes (au moins 7,5 mg/jour de prednisone ou équivalent) a été démontrée dans deux études multicentriques d'un an, en double aveugle, randomisées, contrôlées contre placebo portant sur conception pratiquement identique, l'une réalisée aux États-Unis et l'autre dans 15 pays différents (Multinationale [qui comprenait également FOSAMAX 2,5 mg/jour]). Ces études ont recruté respectivement 232 et 328 patients âgés de 17 à 83 ans atteints de diverses maladies nécessitant des glucocorticoïdes. Les patients ont reçu un supplément de calcium et de vitamine D. La figure 5 montre les augmentations moyennes par rapport au placebo de la DMO du rachis lombaire, du col fémoral et du trochanter chez les patients recevant FOSAMAX 5 mg/jour pour chaque étude.
Figure 5 : Études chez des patients traités aux glucocorticoïdes Augmentation de la DMO FOSAMAX 5 mg/jour à un an
Après un an, des augmentations significatives par rapport au placebo de la DMO ont été observées dans les études combinées sur chacun de ces sites chez les patients ayant reçu FOSAMAX 5 mg/jour. Chez les patients traités par placebo, une diminution significative de la DMO s'est produite au niveau du col fémoral (-1,2 %), et des diminutions plus faibles ont été observées au niveau du rachis lombaire et du trochanter. La DMO corporelle totale a été maintenue avec FOSAMAX 5 mg/jour. Les augmentations de la DMO avec FOSAMAX 10 mg/jour étaient similaires à celles avec FOSAMAX 5 mg/jour chez toutes les patientes, à l'exception des femmes ménopausées ne recevant pas d'œstrogénothérapie. Chez ces femmes, les augmentations (par rapport au placebo) avec FOSAMAX 10 mg/j étaient plus importantes que celles avec FOSAMAX 5 mg/j au niveau du rachis lombaire (4,1 % vs 1,6 %) et du trochanter (2,8 % vs 1,7 %), mais pas sur d'autres sites. FOSAMAX 35 mg a été efficace quelle que soit la dose ou la durée d'utilisation des glucocorticoïdes. De plus, FOSAMAX était également efficace quel que soit l'âge (moins de 65 ans contre supérieur ou égal à 65 ans), la race (caucasien contre les autres races), le sexe, la maladie sous-jacente, la DMO de base, le remodelage osseux de base et l'utilisation avec un variété de médicaments courants.
L'histologie osseuse était normale chez les 49 patients biopsiés au bout d'un an ayant reçu FOSAMAX à des doses allant jusqu'à 10 mg/jour.
Sur les 560 patients initiaux de ces études, 208 patients qui sont restés sous au moins 7,5 mg/jour de prednisone ou équivalent ont continué dans une prolongation d'un an en double aveugle. Après deux ans de traitement, la DMO de la colonne vertébrale a augmenté de 3,7 % et 5,0 % par rapport au placebo avec FOSAMAX 5 et 10 mg/jour, respectivement. Des augmentations significatives de la DMO (par rapport au placebo) ont également été observées au niveau du col fémoral, du trochanter et de l'ensemble du corps.
Après un an, 2,3% des patients traités par FOSAMAX 5 ou 10 mg/jour (poolés) vs 3,7% de ceux traités par placebo ont présenté une nouvelle fracture vertébrale (non significatif). Cependant, dans la population étudiée pendant deux ans, le traitement par FOSAMAX (groupes posologiques combinés : 5 ou 10 mg pendant deux ans ou 2,5 mg pendant un an suivis de 10 mg pendant un an) a réduit de manière significative l'incidence des patients présentant une nouvelle fracture vertébrale. (FOSAMAX 0,7 % contre placebo 6,8 %).
Traitement de la maladie osseuse de Paget
L'efficacité de FOSAMAX 40 mg une fois par jour pendant six mois a été démontrée dans deux études cliniques en double aveugle chez des patients masculins et féminins atteints de la maladie de Paget modérée à sévère (phosphatase alcaline au moins deux fois la limite supérieure de la normale) : un placebo une étude multinationale contrôlée et une étude comparative américaine avec l'étidronate disodique 400 mg/jour. La figure 6 montre les changements moyens en pourcentage par rapport à la ligne de base de la phosphatase alcaline sérique jusqu'à six mois de traitement randomisé.
Figure 6 : Études sur l'effet osseux de la maladie de Paget sur la phosphatase alcaline sérique de FOSAMAX 40 mg/jour par rapport à un placebo ou à l'étidronate 400 mg/jour
À six mois, la suppression de la phosphatase alcaline chez les patients traités par FOSAMAX était significativement supérieure à celle obtenue avec l'étidronate et contrastait avec l'absence totale de réponse chez les patients traités par placebo. La réponse (définie comme une normalisation de la phosphatase alcaline sérique ou une diminution par rapport au départ supérieure ou égale à 60 %) s'est produite chez environ 85 % des patients traités par FOSAMAX dans les études combinées contre 30 % dans le groupe étidronate et 0 % dans le groupe placebo groupe. FOSAMAX 70 mg a été efficace de la même manière, quel que soit l'âge, le sexe, la race, l'utilisation antérieure d'autres bisphosphonates ou la phosphatase alcaline de base dans la plage étudiée (au moins deux fois la limite supérieure de la normale).
L'histologie osseuse a été évaluée chez 33 patients atteints de la maladie de Paget traités par FOSAMAX 40 mg/jour pendant 6 mois. Comme chez les patients traités pour l'ostéoporose [voir Etudes cliniques ], FOSAMAX n'a pas altéré la minéralisation et la diminution attendue du taux de renouvellement osseux a été observée. De l'os lamellaire normal a été produit pendant le traitement avec FOSAMAX, même là où l'os préexistant était tissé et désorganisé. Dans l'ensemble, les données d'histologie osseuse permettent de conclure que l'os formé pendant le traitement par FOSAMAX 35 mg est de qualité normale.
INFORMATIONS PATIENTS
FOSAMAX® (FOSS-ah-max)(alendronate sodique) Comprimés
Lisez le Guide des médicaments fourni avec FOSAMAX 70 mg avant de commencer à le prendre et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ce Guide de Médication ne prend pas l'endroit de parler avec votre docteur de votre condition médicale ou traitement. Discutez avec votre médecin si vous avez des questions sur FOSAMAX.
Quelle est l'information la plus importante que je devrais connaître sur FOSAMAX 70 mg ?
FOSAMAX 70 mg peut provoquer des effets indésirables graves, notamment :
1. Problèmes d'oesophage.
Certaines personnes qui prennent FOSAMAX 35 mg peuvent développer des problèmes au niveau de l'œsophage (le tube qui relie la bouche et l'estomac).
Ces problèmes comprennent une irritation, une inflammation ou des ulcères de l'œsophage qui peuvent parfois saigner.
- Il est important que vous preniez FOSAMAX 70 mg exactement comme prescrit pour aider à réduire vos risques de développer des problèmes d'œsophage. (Voir la rubrique « Comment dois-je prendre FOSAMAX ? »)
- Arrêtez de prendre FOSAMAX et appelez immédiatement votre médecin si vous ressentez des douleurs thoraciques, des brûlures d'estomac nouvelles ou qui s'aggravent, ou si vous avez des difficultés ou des douleurs lorsque vous avalez.
2. Faible taux de calcium dans le sang (hypocalcémie).
FOSAMAX peut réduire les taux de calcium dans votre sang. Si vous avez un faible taux de calcium dans le sang avant de commencer à prendre FOSAMAX, il peut s'aggraver pendant le traitement. Votre hypocalcémie doit être traitée avant de prendre FOSAMAX. La plupart des personnes ayant un faible taux de calcium dans le sang ne présentent aucun symptôme, mais certaines personnes peuvent présenter des symptômes. Appelez immédiatement votre médecin si vous présentez des symptômes d'hypocalcémie tels que :
- Spasmes, secousses ou crampes dans vos muscles
- Engourdissement ou picotements dans les doigts, les orteils ou autour de la bouche
Votre médecin peut vous prescrire du calcium et de la vitamine D pour aider à prévenir un faible taux de calcium dans votre sang, pendant que vous prenez FOSAMAX. Prenez du calcium et de la vitamine D comme votre médecin vous l'a indiqué.
3. Douleurs osseuses, articulaires ou musculaires.
Certaines personnes qui prennent FOSAMAX développent de graves douleurs osseuses, articulaires ou musculaires.
4. Problèmes graves de l'os de la mâchoire (ostéonécrose).
Des problèmes graves d'os de la mâchoire peuvent survenir lorsque vous prenez FOSAMAX. Votre médecin doit examiner votre bouche avant de commencer FOSAMAX. Votre médecin peut vous demander de consulter votre dentiste avant de commencer FOSAMAX. Il est important que vous preniez soin de votre bouche pendant le traitement par FOSAMAX.
5. Fractures inhabituelles des os de la cuisse.
Certaines personnes ont développé des fractures inhabituelles de l'os de la cuisse. Les symptômes d'une fracture peuvent inclure une douleur nouvelle ou inhabituelle à la hanche, à l'aine ou à la cuisse.
Appelez immédiatement votre médecin si vous ressentez l'un de ces effets secondaires.
Qu'est-ce que FOSAMAX 70mg ?
- FOSAMAX 70 mg est un médicament délivré sur ordonnance utilisé pour :
- Traiter ou prévenir l'ostéoporose chez les femmes après la ménopause. Il aide à réduire le risque de fracture de la hanche ou de la colonne vertébrale (pause).
- Augmenter la masse osseuse chez les hommes atteints d'ostéoporose.
- Traiter l'ostéoporose chez les hommes ou les femmes qui prennent des corticostéroïdes.
Traiter certains hommes et femmes atteints de la maladie osseuse de Paget.
On ne sait pas combien de temps FOSAMAX 70 mg agit pour le traitement et la prévention de l'ostéoporose. Vous devriez consulter votre médecin régulièrement pour déterminer si FOSAMAX 70 mg vous convient toujours.
FOSAMAX ne doit pas être utilisé chez les enfants.
Qui ne devrait pas prendre FOSAMAX 70mg ?
Ne prenez pas FOSAMAX si vous :
- Vous avez certains problèmes avec votre œsophage, le tube qui relie votre bouche à votre estomac
- Ne peut pas se tenir debout ou s'asseoir droit pendant au moins 30 minutes
- Avoir de faibles niveaux de calcium dans le sang
- êtes allergique à FOSAMAX 70 mg ou à l'un de ses ingrédients. La liste des ingrédients se trouve à la fin de cette notice.
Que dois-je dire à mon médecin avant de prendre FOSAMAX 35 mg ?
Avant de commencer FOSAMAX, assurez-vous de parler à votre médecin si vous :
- Avoir des problèmes de déglutition
- Avoir des problèmes d'estomac ou de digestion
- Avoir un faible taux de calcium dans le sang
- Prévoyez une chirurgie dentaire ou une extraction de dents
- Avoir des problèmes rénaux
- On vous a dit que vous avez du mal à absorber les minéraux dans votre estomac ou vos intestins (syndrome de malabsorption)
- êtes enceinte, essayez de devenir enceinte ou pensez que vous êtes enceinte. Si vous tombez enceinte pendant que vous prenez FOSAMAX, arrêtez de le prendre et contactez votre médecin. On ne sait pas si FOSAMAX peut nuire à votre bébé à naître.
- Allaitez ou envisagez d'allaiter. On ne sait pas si FOSAMAX passe dans votre lait et peut nuire à votre bébé.
Prévenez surtout votre médecin si vous prenez :
- antiacides
- aspirine
- Médicaments anti-inflammatoires non stéroïdiens (AINS)
Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Certains médicaments peuvent affecter le fonctionnement de FOSAMAX 70 mg.
Connaissez les médicaments que vous prenez. Conservez-en une liste et montrez-la à votre médecin et à votre pharmacien chaque fois que vous recevez un nouveau médicament.
Comment dois-je prendre FOSAMAX 35mg ?
- Prenez FOSAMAX 35 mg exactement comme votre médecin vous l'a indiqué.
- FOSAMAX n'agit que s'il est pris à jeun.
- Prenez FOSAMAX 35 mg, après vous être levé pour la journée et avant de prendre votre premier aliment, boisson ou autre médicament.
- Prenez FOSAMAX en position assise ou debout.
- Ne pas mâcher ou sucer un comprimé de FOSAMAX.
- Avalez le comprimé FOSAMAX avec un grand verre (6-8 oz) d'eau ordinaire uniquement.
- Ne pas prenez FOSAMAX avec de l'eau minérale, du café, du thé, du soda ou du jus.
- Si vous prenez Alendronate Quotidien :
- Prenez 1 comprimé d'alendronate une fois par jour, tous les jours après vous être levé pour la journée et avant de prendre votre premier aliment, boisson ou autre médicament.
- Si vous prenez FOSAMAX une fois par semaine :
- Choisissez le jour de la semaine qui correspond le mieux à votre emploi du temps.
- Prenez 1 dose de FOSAMAX chaque semaine le jour de votre choix après vous être levé pour la journée et avant de prendre votre premier aliment, boisson ou autre médicament.
- Si vous prenez Alendronate Quotidien :
Après avoir avalé FOSAMAX 35mg comprimé, attendre au moins 30 minutes :
- Avant de vous allonger. Vous pouvez vous asseoir, vous tenir debout ou marcher et faire des activités normales comme la lecture.
- Avant de prendre votre premier aliment ou boisson, à l'exception de l'eau plate.
- Avant de prendre d'autres médicaments, y compris des antiacides, du calcium et d'autres suppléments et vitamines.
Ne vous allongez pas pendant au moins 30 minutes après avoir pris FOSAMAX et après avoir mangé votre premier aliment de la journée.
Si vous oubliez une dose de FOSAMAX 70 mg, ne la prenez pas plus tard dans la journée. Prenez la dose oubliée le lendemain matin après vous en être souvenu, puis reprenez votre horaire normal. Ne pas prendre 2 doses le même jour.
Si vous avez pris trop de FOSAMAX 70 mg, appelez votre médecin. N'essayez pas de vomir. Ne vous allongez pas.
Quels sont les effets secondaires possibles de FOSAMAX 70mg ?
FOSAMAX peut provoquer des effets secondaires graves.
- Voir "Quelles sont les informations les plus importantes que je devrais connaître sur FOSAMAX ?"
Les effets indésirables les plus courants de FOSAMAX 70mg sont :
- Douleur dans la région de l'estomac (abdominale)
- Brûlures d'estomac
- Constipation
- Diarrhée
- Maux d'estomac
- Douleur dans les os, les articulations ou les muscles
- Nausée
Vous pouvez avoir des réactions allergiques, telles que de l'urticaire ou un gonflement du visage, des lèvres, de la langue ou de la gorge.
Une aggravation de l'asthme a été rapportée.
Dites à votre médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de FOSAMAX. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment conserver FOSAMAX ?
- Conservez FOSAMAX 35 mg à température ambiante, entre 59 °F et 86 °F (15 °C et 30 °C).
- Conservez FOSAMAX dans un récipient hermétiquement fermé.
Gardez FOSAMAX et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de FOSAMAX.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. N'utilisez pas FOSAMAX 35 mg pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas FOSAMAX 35 mg à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Ce guide de médication résume les informations les plus importantes sur FOSAMAX. Si vous souhaitez plus d'informations, parlez-en à votre médecin. Vous pouvez demander à votre médecin ou à votre pharmacien des informations sur FOSAMAX rédigées pour les professionnels de la santé. Pour plus d'informations, rendez-vous sur : www.FOSAMAX.com ou appelez le 1-800-622-4477 (sans frais).
Quels sont les ingrédients de FOSAMAX ?
Ingrédient actif : alendronate sodique
Ingrédients inactifs : cellulose microcristalline, lactose anhydre, croscarmellose sodique, stéarate de magnésium.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
