Traitement des femmes: Clomid 100mg, 25mg, 50mg Clomiphene Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Clomid 50 mg et comment est-il utilisé ?
Clomid 100mg est un médicament sur ordonnance utilisé pour traiter les symptômes de l'infertilité chez les femmes qui ont une insuffisance ovulatoire. Clomid peut être utilisé seul ou avec d'autres médicaments.
Clomid appartient à une classe de médicaments appelés modulateurs sélectifs des récepteurs aux œstrogènes.
On ne sait pas si Clomid est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles du Clomid ?
Clomid peut provoquer des effets secondaires graves, notamment :
- Douleur d'estomac,
- ballonnements,
- nausée,
- vomissement,
- diarrhée,
- prise de poids rapide (surtout au niveau du visage et du ventre),
- peu ou pas de miction,
- douleur quand tu respires,
- fréquence cardiaque rapide, et
- essoufflement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Clomid incluent :
- bouffées vasomotrices (chaleur, rougeur ou sensation de picotement),
- nausée,
- vomissement,
- ballonnements,
- douleur ou sensibilité mammaire,
- maux de tête, et
- saignements intermenstruels ou spotting
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Clomid. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
CLOMID (comprimés de citrate de clomifène USP) est un stimulant ovulatoire non stéroïdien administré par voie orale, désigné chimiquement par le citrate de 2-[p-(2-chloro-1,2-diphénylvinyl)phénoxy] triéthylamine (1:1). Il a la formule moléculaire de C26H28ClNO • C6H8O7 et un poids moléculaire de 598,09. Il est représenté structurellement par :
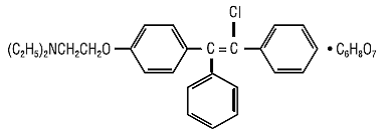
Le citrate de clomifène est une poudre cristalline blanche à jaune pâle, essentiellement inodore. Il est librement soluble dans le méthanol ; soluble dans l'éthanol; légèrement soluble dans l'acétone, l'eau et le chloroforme; et insoluble dans l'éther.
CLOMID 50mg est un mélange de deux isomères géométriques [cis (zuclomifène) et trans (enclomifène)] contenant entre 30% et 50% de l'isomère cis.
Chaque comprimé blanc sécable contient 50 mg de citrate de clomifène USP. Le comprimé contient également les ingrédients inactifs suivants : amidon de maïs, lactose, stéarate de magnésium, amidon de maïs prégélatinisé et saccharose.
LES INDICATIONS
CLOMID 100mg est indiqué pour le traitement du dysfonctionnement ovulatoire chez les femmes souhaitant une grossesse. Les obstacles à l'obtention d'une grossesse doivent être exclus ou traités de manière adéquate avant de commencer le traitement par CLOMID 50 mg. Les patientes les plus susceptibles de réussir le traitement par clomifène sont les patientes atteintes du syndrome des ovaires polykystiques (voir AVERTISSEMENTS : Syndrome d'hyperstimulation ovarienne ), le syndrome d'aménorrhée-galactorrhée, l'aménorrhée psychogène, l'aménorrhée post-contraceptive orale et certains cas d'aménorrhée secondaire d'étiologie indéterminée.
Le coït correctement chronométré par rapport à l'ovulation est important. Un graphique de la température basale du corps ou d'autres tests appropriés peuvent aider la patiente et son médecin à déterminer si l'ovulation s'est produite. Une fois l'ovulation établie, chaque cycle de CLOMID 100 mg doit être commencé le ou vers le 5ème jour du cycle. La thérapie cyclique à long terme n'est pas recommandée au-delà d'un total d'environ six cycles (dont trois cycles ovulatoires). (Voir DOSAGE ET ADMINISTRATION et PRÉCAUTIONS .)
CLOMID est indiqué uniquement chez les patientes présentant un dysfonctionnement ovulatoire avéré et remplissant les conditions décrites ci-dessous :
De plus, les patients sélectionnés pour le traitement CLOMID doivent être évalués en ce qui concerne les éléments suivants :
Il n'existe pas d'études adéquates ou bien contrôlées démontrant l'efficacité de CLOMID 100 mg dans le traitement de l'infertilité masculine. De plus, des tumeurs testiculaires et une gynécomastie ont été signalées chez des hommes utilisant du clomiphène. La relation de cause à effet entre les déclarations de tumeurs testiculaires et l'administration de CLOMID 25 mg n'est pas connue.
Bien que la littérature médicale suggère diverses méthodes, il n'existe pas de schéma thérapeutique standard universellement accepté pour la thérapie combinée (c'est-à-dire, CLOMID en conjonction avec d'autres médicaments induisant l'ovulation). De même, il n'y a pas de schéma CLOMID standard pour l'induction de l'ovulation dans les programmes de fécondation in vitro afin de produire des ovules pour la fécondation et la réintroduction. Par conséquent, CLOMID 50 mg n'est pas recommandé pour ces utilisations.
DOSAGE ET ADMINISTRATION
considérations générales
Le bilan et le traitement des candidats au traitement par CLOMID 100 mg doivent être supervisés par des médecins expérimentés dans la prise en charge des troubles gynécologiques ou endocriniens. Les patients ne doivent être choisis pour un traitement par CLOMID 50 mg qu'après une évaluation diagnostique minutieuse (voir LES INDICATIONS ). Le plan de traitement doit être défini à l'avance. Les obstacles à la réalisation de l'objectif du traitement doivent être exclus ou traités de manière adéquate avant de commencer CLOMID. L'objectif thérapeutique doit être mis en balance avec les risques potentiels et discuté avec la patiente et les autres personnes impliquées dans la réalisation d'une grossesse.
L'ovulation survient le plus souvent 5 à 10 jours après une cure de CLOMID. Le coït doit être programmé pour coïncider avec le moment prévu de l'ovulation. Des tests appropriés pour déterminer l'ovulation peuvent être utiles pendant cette période.
Dosage recommandé
Le traitement du patient sélectionné doit commencer par une faible dose, 50 mg par jour (1 comprimé) pendant 5 jours. La dose ne doit être augmentée que chez les patientes qui n'ovulent pas en réponse à 50 mg de CLOMID cyclique. Une faible dose ou une faible durée de traitement est particulièrement recommandée si une sensibilité inhabituelle à la gonadotrophine hypophysaire est suspectée, comme chez les patientes atteintes du syndrome des ovaires polykystiques (voir AVERTISSEMENTS ; Syndrome d'hyperstimulation ovarienne ).
La patiente doit être soigneusement évaluée pour exclure une grossesse, une hypertrophie ovarienne ou la formation de kystes ovariens entre chaque cycle de traitement.
Si un saignement provoqué par un progestatif est prévu ou si un saignement utérin spontané survient avant le traitement, le schéma posologique de 50 mg par jour pendant 5 jours doit être débuté le ou vers le 5e jour du cycle. Le traitement peut être débuté à tout moment chez la patiente qui n'a pas eu de saignement utérin récent. Lorsque l'ovulation se produit à ce dosage, il n'y a aucun avantage à augmenter la dose dans les cycles de traitement suivants.
Si l'ovulation ne semble pas se produire après le premier cycle de traitement, un deuxième cycle de 100 mg par jour (deux comprimés de 50 mg administrés en une seule dose quotidienne) pendant 5 jours doit être administré. Ce cours peut être commencé dès 30 jours après le précédent après que des précautions ont été prises pour exclure la présence d'une grossesse. L'augmentation de la posologie ou de la durée du traitement au-delà de 100 mg/jour pendant 5 jours n'est pas recommandée.
La majorité des patientes qui vont ovuler le feront après le premier traitement. Si l'ovulation ne se produit pas après trois cycles de traitement, la poursuite du traitement par CLOMID 50 mg n'est pas recommandée et la patiente doit être réévaluée. Si trois réponses ovulatoires se produisent, mais que la grossesse n'a pas été atteinte, un traitement supplémentaire n'est pas recommandé. Si les règles ne surviennent pas après une réponse ovulatoire, la patiente doit être réévaluée. Un traitement cyclique à long terme n'est pas recommandé au-delà d'un total d'environ six cycles (voir PRÉCAUTIONS ).
COMMENT FOURNIE
CDN 0068-0226-30 : Les comprimés de 50 mg dans des boîtes de 30 comprimés sont ronds, blancs, sécables et gravés CLOMID 50. Conservez les comprimés à température ambiante contrôlée entre 59 et 86 °F (15 et 30 °C). Protéger de la chaleur, de la lumière et de l'humidité excessive et conserver dans des récipients fermés.
Fabriqué par : UNE ENTREPRISE SANOFI, sanofi-aventis US LLC, Bridgewater, NJ 08807. Révision : juillet 2017
EFFETS SECONDAIRES
Événements indésirables des essais cliniques.
CLOMID, aux posologies recommandées, est généralement bien toléré. Les effets indésirables ont généralement été légers et transitoires et la plupart ont disparu rapidement après l'arrêt du traitement. Les effets indésirables signalés chez les patients traités par le citrate de clomifène au cours des études cliniques sont présentés dans le tableau 2.
Les événements indésirables suivants ont été rapportés chez moins de 1 % des patients dans les essais cliniques : abdomen aigu, augmentation de l'appétit, constipation, dermatite ou éruption cutanée, dépression, diarrhée, étourdissements, fatigue, perte de cheveux/cheveux secs, augmentation de la fréquence/du volume urinaire, insomnie, étourdissements, tension nerveuse, sécheresse vaginale, vertiges, prise/perte de poids.
Les patients sous traitement prolongé par CLOMID 25 mg peuvent présenter des taux sériques élevés de desmostérol. Cela est probablement dû à une interférence directe avec la synthèse du cholestérol. Cependant, les stérols sériques chez les patients recevant la dose recommandée de CLOMID 50 mg ne sont pas significativement modifiés. Le cancer de l'ovaire a été rarement signalé chez des patientes ayant reçu des médicaments contre la fertilité. L'infertilité est un facteur de risque principal du cancer de l'ovaire; cependant, les données épidémiologiques suggèrent que l'utilisation prolongée de clomifène peut augmenter le risque de tumeur ovarienne borderline ou invasive.
Événements indésirables post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de Clomid. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Corps dans son ensemble : Fièvre, acouphènes, faiblesse
Cardiovasculaire: Arythmie, douleur thoracique, œdème, hypertension, palpitations, phlébite, embolie pulmonaire, essoufflement, tachycardie, thrombophlébite
Système nerveux central: Migraine, céphalée, paresthésie, convulsion, accident vasculaire cérébral, syncope
Dermatologique : Acné, réaction allergique, érythème, érythème polymorphe, érythème noueux, hypertrichose, prurit, urticaire
Anomalies fœtales/néonatales :
- Développement osseux anormal : malformations squelettiques du crâne, du visage, des voies nasales, de la mâchoire, de la main, des membres (ectromélie, y compris l'amélie, l'hémimélie et la phocomélie), du pied (pied bot), de la colonne vertébrale et des articulations
- Anomalies cardiaques : malformations cardiaques septales, communication interventriculaire musculaire, persistance du canal artériel, tétralogie de Fallot et coarctation de l'aorte
- Troubles chromosomiques : syndrome de Down
- Anomalies de l'oreille et surdité
- Anomalies du tractus gastro-intestinal : fente labiale et palatine, anus imperforé, fistule trachéo-œsophagienne, hernie diaphragmatique, omphalocèle
- Anomalies génitales : hypospadias, exstrophie cloacale
- Malformations du tissu pulmonaire
- Malformations de l'œil et du cristallin (cataracte)
- Tumeurs : tumeur neuroectodermique, tumeur thyroïdienne, hépatoblastome, leucémie lymphocytaire
- Anomalies du système nerveux : anomalies du tube neural (anencéphalie, méningomyélocèle), microcéphalie et hydrocéphalie
- Anomalies rénales : agénésie rénale et dysgénésie rénale
- Autres : nanisme, retard mental
Gastro-intestinal : Pancréatite
Génito-urinaire : Endométriose, kyste ovarien (l'hypertrophie ovarienne ou les kystes peuvent, en tant que tels, être compliqués par une torsion annexielle), hémorragie ovarienne, grossesse tubaire, hémorragie utérine, réduction de l'épaisseur de l'endomètre
Hépatique: Augmentation des transaminases, hépatite
Troubles du métabolisme : Hypertriglycéridémie, dans certains cas avec pancréatite
Musculo-squelettique : Arthralgie, mal de dos, myalgie
Tumeurs : Foie (hémangiosarcome hépatique, adénome des cellules hépatiques, carcinome hépatocellulaire); sein (maladie fibrokystique, carcinome du sein); endomètre (carcinome de l'endomètre); système nerveux (astrocytome, tumeur hypophysaire, prolactinome, neurofibromatose, glioblastome multiforme, abcès cérébral); ovaire (lutéome de grossesse, kyste dermoïde de l'ovaire, carcinome ovarien) ; trophoblastique (môle hydatiforme, choriocarcinome); divers (mélanome, myélome, kystes périanaux, carcinome à cellules rénales, lymphome de Hodgkin, carcinome de la langue, carcinome de la vessie)
Psychiatrique: Anxiété, irritabilité, changements d'humeur, psychose
Troubles visuels : Hébergement anormal, cataracte, douleur oculaire, œdème maculaire, névrite optique, photopsie, décollement du vitré postérieur, hémorragie rétinienne, thrombose rétinienne, spasme vasculaire rétinien, perte de vision temporaire ou prolongée, éventuellement irréversible.
Autre: Leucocytose, trouble thyroïdien
INTERACTIONS MÉDICAMENTEUSES
Les interactions médicamenteuses avec CLOMID n'ont pas été documentées.
Toxicomanie et dépendance
La tolérance, l'abus ou la dépendance à CLOMID n'ont pas été signalés.
AVERTISSEMENTS
Symptômes visuels
Les patients doivent être informés que des troubles visuels ou d'autres symptômes visuels tels que des taches ou des éclairs (scotomes scintillants) peuvent parfois survenir pendant le traitement par CLOMID. L'incidence de ces symptômes visuels augmente avec l'augmentation de la dose totale ou de la durée du traitement. Ces troubles visuels sont généralement réversibles ; cependant, des cas de troubles visuels prolongés ont été rapportés, certains survenant après l'arrêt de CLOMID 50 mg. Les troubles visuels peuvent être irréversibles, en particulier avec l'augmentation de la posologie ou de la durée du traitement. Les patients doivent être avertis que ces symptômes visuels peuvent rendre des activités telles que la conduite d'une voiture ou l'utilisation de machines plus dangereuses que d'habitude, en particulier dans des conditions d'éclairage variable.
Ces symptômes visuels semblent être dus à l'intensification et à la prolongation des images rémanentes. Les symptômes apparaissent souvent pour la première fois ou sont accentués par l'exposition à un environnement très éclairé. Bien que l'acuité visuelle mesurée n'ait généralement pas été affectée, un patient de l'étude prenant 200 mg de CLOMID par jour a développé un flou visuel le 7ème jour de traitement, qui a évolué vers une diminution sévère de l'acuité visuelle au 10ème jour. Aucune autre anomalie n'a été retrouvée et l'acuité visuelle est redevenue normale au 3e jour après l'arrêt du traitement.
Des scotomes ophtalmologiquement définissables et des modifications de la fonction cellulaire rétinienne (électrorétinographique) ont également été signalés. Un patient traité au cours des études cliniques a développé des phosphènes et des scotomes lors de l'administration prolongée de CLOMID 50 mg, qui ont disparu au 32e jour après l'arrêt du traitement.
La surveillance post-commercialisation des événements indésirables a également révélé d'autres signes et symptômes visuels au cours du traitement par CLOMID (voir EFFETS INDÉSIRABLES ).
Bien que l'étiologie de ces symptômes visuels ne soit pas encore comprise, les patients présentant des symptômes visuels doivent interrompre le traitement et subir rapidement une évaluation ophtalmologique complète.
Syndrome d'hyperstimulation ovarienne
Le syndrome d'hyperstimulation ovarienne (SHO) a été signalé chez des patientes recevant un traitement au citrate de clomifène pour l'induction de l'ovulation. Le SHO peut progresser rapidement (en 24 heures à plusieurs jours) et devenir un trouble médical grave. Dans certains cas, le SHO est survenu après l'utilisation cyclique d'un traitement au citrate de clomifène ou lorsque le citrate de clomifène a été utilisé en association avec des gonadotrophines. Des anomalies transitoires des tests de la fonction hépatique suggérant un dysfonctionnement hépatique, qui peuvent s'accompagner de changements morphologiques à la biopsie du foie, ont été rapportées en association avec le SHO.
Le SHO est un événement médical distinct de l'hypertrophie ovarienne non compliquée. Les signes cliniques de ce syndrome dans les cas graves peuvent inclure une hypertrophie ovarienne importante, des symptômes gastro-intestinaux, une ascite, une dyspnée, une oligurie et un épanchement pleural. De plus, les symptômes suivants ont été rapportés en association avec ce syndrome : épanchement péricardique, anasarque, hydrothorax, abdomen aigu, hypotension, insuffisance rénale, œdème pulmonaire, hémorragie intrapéritonéale et ovarienne, thrombose veineuse profonde, torsion de l'ovaire et troubles respiratoires aigus. détresse. Les signes avant-coureurs du SHO sont les douleurs et distensions abdominales, les nausées, les vomissements, la diarrhée et la prise de poids. Des niveaux élevés de stéroïdes urinaires, divers degrés de déséquilibre électrolytique, une hypovolémie, une hémoconcentration et une hypoprotéinémie peuvent survenir. Un décès dû à un choc hypovolémique, à une hémoconcentration ou à une thromboembolie est survenu. En raison de la fragilité des ovaires hypertrophiés dans les cas graves, l'examen abdominal et pelvien doit être effectué avec beaucoup de prudence. En cas de conception, une progression rapide vers la forme sévère du syndrome peut survenir.
Afin de minimiser le risque associé à une hypertrophie ovarienne anormale occasionnelle associée au traitement par CLOMID 100 mg, la dose la plus faible compatible avec les résultats cliniques attendus doit être utilisée. L'élargissement maximal de l'ovaire, qu'il soit physiologique ou anormal, peut ne se produire que plusieurs jours après l'arrêt de la dose recommandée de CLOMID. Certains patients atteints du syndrome des ovaires polykystiques qui sont inhabituellement sensibles à la gonadotrophine peuvent avoir une réponse exagérée aux doses habituelles de CLOMID. Par conséquent, les patientes atteintes du syndrome des ovaires polykystiques doivent être initiées à la dose recommandée la plus faible et à la durée de traitement la plus courte pour le premier cycle de traitement (voir DOSAGE ET ADMINISTRATION ).
En cas d'élargissement de l'ovaire, un traitement CLOMID supplémentaire ne doit pas être administré tant que les ovaires n'ont pas retrouvé leur taille d'avant le traitement, et la posologie ou la durée du traitement suivant doit être réduite. L'hypertrophie ovarienne et la formation de kystes associées au traitement par CLOMID 50 mg régressent généralement spontanément en quelques jours ou quelques semaines après l'arrêt du traitement. Le bénéfice potentiel d'un traitement ultérieur par CLOMID 25 mg dans ces cas devrait dépasser le risque. Sauf indication chirurgicale pour la laparotomie, un tel élargissement kystique doit toujours être géré de manière conservatrice.
Une relation causale entre l'hyperstimulation ovarienne et le cancer de l'ovaire n'a pas été déterminée. Cependant, comme une corrélation entre le cancer de l'ovaire et la nulliparité, l'infertilité et l'âge a été suggérée, si les kystes ovariens ne régressent pas spontanément, une évaluation approfondie doit être effectuée pour exclure la présence d'une néoplasie ovarienne.
PRÉCAUTIONS
Général
Une attention particulière doit être accordée à la sélection des candidats à la thérapie CLOMID. Un examen pelvien est nécessaire avant le traitement par CLOMID et avant chaque traitement ultérieur (voir CONTRE-INDICATIONS et AVERTISSEMENTS ).
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune étude de toxicité à long terme chez l'animal n'a été réalisée pour évaluer le potentiel carcinogène ou mutagène du citrate de clomifène.
L'administration orale de CLOMID 25 mg à des rats mâles à des doses de 0,3 ou 1 mg/kg/jour a entraîné une diminution de la fertilité, tandis que des doses plus élevées ont entraîné une infertilité temporaire. Des doses orales de 0,1 mg/kg/jour chez des rats femelles ont temporairement interrompu le schéma normal des frottis vaginaux cycliques et empêché la conception. Des doses de 0,3 mg/kg/jour ont légèrement réduit le nombre d'ovules et de corps jaunes ovulés, tandis que 3 mg/kg/jour ont inhibé l'ovulation.
Grossesse
Résumé des risques fœtaux
L'utilisation de CLOMID 100 mg chez la femme enceinte est contre-indiquée, car le traitement par CLOMID 25 mg n'apporte aucun bénéfice dans cette population.
Les données humaines disponibles ne suggèrent pas un risque accru d'anomalies congénitales au-dessus du risque de base de la population. Cependant, des études de toxicologie de la reproduction animale ont montré une augmentation des pertes embryo-fœtales et des malformations structurelles chez la progéniture. Si ce médicament est utilisé pendant la grossesse, ou si la patiente tombe enceinte pendant qu'elle prend ce médicament, la patiente doit être informée des risques potentiels pour le fœtus.
Considérations cliniques
Pour éviter l'administration accidentelle de CLOMID 25 mg au début de la grossesse, des tests appropriés doivent être utilisés au cours de chaque cycle de traitement pour déterminer si l'ovulation et/ou la grossesse se produisent. Les patientes doivent être soigneusement évaluées pour exclure une hypertrophie ovarienne ou la formation de kystes ovariens entre chaque cycle de traitement. Le prochain cycle de traitement par CLOMID doit être retardé jusqu'à ce que ces conditions aient été exclues.
Données humaines
Les données humaines disponibles provenant d'études épidémiologiques ne montrent aucune relation de cause à effet apparente entre l'exposition périconceptuelle au citrate de clomifène et un risque accru de malformations congénitales globales, ou toute anomalie spécifique. Cependant, en raison du petit nombre de cas d'anomalies congénitales survenant chez les femmes traitées au citrate de clomifène, ces études épidémiologiques n'ont pu exclure que de grandes différences de risque. Les études n'ont pas pris en compte les facteurs associés à l'hypofertilité féminine et n'ont pas été en mesure de tenir compte d'autres facteurs de confusion importants. De plus, les données disponibles ne soutiennent pas une augmentation du taux d'avortement spontané chez les femmes hypofertiles traitées avec du citrate de clomifène pour l'induction de l'ovulation.
Données animales
L'administration orale de citrate de clomifène à des rates gravides pendant l'organogenèse à des doses de 1 à 2 mg/kg/jour a entraîné un hydramnios et des fœtus faibles et œdémateux avec des côtes ondulées et d'autres modifications osseuses temporaires. Des doses de 8 mg/kg/jour ou plus ont également provoqué une augmentation des résorptions et des morts fœtales, une dystocie et un retard de parturition, et 40 mg/kg/jour ont entraîné une augmentation de la mortalité maternelle. Des doses uniques de 50 mg/kg ont provoqué des cataractes fœtales, tandis que 200 mg/kg ont provoqué une fente palatine. Suite à l'injection de citrate de clomifène 2 mg/kg à des souris et des rats pendant la gestation, la progéniture a présenté des modifications métaplasiques de l'appareil reproducteur. Les souris et les rats nouveau-nés injectés au cours des premiers jours de leur vie ont également développé des modifications métaplasiques de la muqueuse utérine et vaginale, ainsi qu'une ouverture vaginale prématurée et des ovaires anovulatoires. Ces résultats sont similaires au comportement reproducteur anormal et à la stérilité décrits avec d'autres œstrogènes et anti-œstrogènes.
Chez les lapins, certaines altérations osseuses temporaires ont été observées chez les fœtus de mères ayant reçu des doses orales de 20 ou 40 mg/kg/jour pendant la grossesse, mais pas après 8 mg/kg/jour. Aucune malformation permanente n'a été observée dans ces études. De plus, des singes rhésus ayant reçu des doses orales de 1,5 à 4,5 mg/kg/jour pendant diverses périodes de la grossesse n'ont eu aucune progéniture anormale.
Mères allaitantes
On ne sait pas si CLOMID est excrété dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, la prudence s'impose si CLOMID est administré à une femme qui allaite. Chez certains patients, CLOMID peut réduire la lactation.
Cancer des ovaires
L'utilisation prolongée de comprimés de citrate de clomifène USP peut augmenter le risque de tumeur ovarienne limite ou invasive (voir EFFETS INDÉSIRABLES ).
SURDOSAGE
Signes et symptômes
Aucun effet toxique accompagnant un surdosage aigu de CLOMID 50 mg n'a été rapporté. Les signes et symptômes de surdosage résultant de l'utilisation d'une dose supérieure à la dose recommandée pendant le traitement par CLOMID 100 mg comprennent des nausées, des vomissements, des bouffées vasomotrices, une vision floue, des taches ou des éclairs, des scotomes, une hypertrophie ovarienne avec des douleurs pelviennes ou abdominales. (Voir CONTRE-INDICATIONS : Kyste de l'ovaire .)
DL50 orale
La DL50 orale aiguë de CLOMID 25 mg est de 1700 mg/kg chez la souris et de 5750 mg/kg chez le rat. La dose toxique chez l'homme n'est pas connue.
Dialyse
On ne sait pas si CLOMID est dialysable.
Traitement
En cas de surdosage, des mesures de soutien appropriées doivent être utilisées en plus de la décontamination gastro-intestinale.
CONTRE-INDICATIONS
Hypersensibilité
CLOMID 100 mg est contre-indiqué chez les patients présentant une hypersensibilité ou une allergie connue au citrate de clomifène ou à l'un de ses composants.
Grossesse
L'utilisation de CLOMID chez la femme enceinte est contre-indiquée, car CLOMID n'offre aucun bénéfice dans cette population.
Les données humaines disponibles ne suggèrent pas un risque accru d'anomalies congénitales au-dessus du risque de base de la population lorsqu'elles sont utilisées comme indiqué. Cependant, des études de toxicologie de la reproduction animale ont montré une augmentation des pertes embryo-fœtales et des malformations structurelles chez la progéniture. Si ce médicament est utilisé pendant la grossesse, ou si la patiente tombe enceinte pendant qu'elle prend ce médicament, la patiente doit être informée des risques potentiels pour le fœtus. (Voir PRÉCAUTIONS : Grossesse .)
Maladie du foie
Le traitement par CLOMID 25 mg est contre-indiqué chez les patients présentant une maladie hépatique ou des antécédents de dysfonctionnement hépatique (voir également LES INDICATIONS et EFFETS INDÉSIRABLES ).
Saignements utérins anormaux
CLOMID 25 mg est contre-indiqué chez les patientes présentant des saignements utérins anormaux d'origine indéterminée (voir LES INDICATIONS ).
Kystes de l'ovaire
CLOMID est contre-indiqué chez les patientes présentant des kystes ovariens ou une hypertrophie non due au syndrome des ovaires polykystiques (voir LES INDICATIONS et AVERTISSEMENTS ).
Autre
CLOMID est contre-indiqué chez les patients présentant un dysfonctionnement thyroïdien ou surrénalien non contrôlé ou en présence d'une lésion intracrânienne organique telle qu'une tumeur hypophysaire (voir LES INDICATIONS ).
PHARMACOLOGIE CLINIQUE
Action
CLOMID 25 mg est un médicament d'une puissance pharmacologique considérable. Avec une sélection rigoureuse et une gestion appropriée de la patiente, CLOMID 100 mg s'est avéré être une thérapie utile pour la patiente anovulatoire désirant une grossesse.
Le citrate de clomifène est capable d'interagir avec les tissus contenant des récepteurs aux œstrogènes, notamment l'hypothalamus, l'hypophyse, les ovaires, l'endomètre, le vagin et le col de l'utérus. Il peut entrer en compétition avec les œstrogènes pour les sites de liaison aux récepteurs des œstrogènes et peut retarder la reconstitution des récepteurs intracellulaires des œstrogènes. Le citrate de clomifène initie une série d'événements endocriniens aboutissant à une poussée préovulatoire de gonadotrophine et à une rupture folliculaire subséquente. Le premier événement endocrinien en réponse à une cure de clomifène est une augmentation de la libération de gonadotrophines hypophysaires. Cela initie la stéroïdogenèse et la folliculogenèse, entraînant la croissance du follicule ovarien et une augmentation du taux circulant d'estradiol. Après l'ovulation, la progestérone plasmatique et l'estradiol augmentent et diminuent comme ils le feraient dans un cycle ovulatoire normal.
Les données disponibles suggèrent que les propriétés œstrogéniques et anti-œstrogéniques du clomiphène peuvent participer à l'initiation de l'ovulation. Les deux isomères du clomifène se sont révélés avoir des effets mixtes œstrogéniques et anti-œstrogéniques, qui peuvent varier d'une espèce à l'autre. Certaines données suggèrent que le zuclomifène a une plus grande activité œstrogénique que l'enclomifène.
Le citrate de clomifène n'a aucun effet progestatif, androgénique ou antiandrogénique apparent et ne semble pas interférer avec la fonction hypophyso-surrénalienne ou hypophyso-thyroïdienne. Bien qu'il n'y ait aucune preuve d'un « effet de report » de CLOMID, des règles ovulatoires spontanées ont été observées chez certaines patientes après un traitement par CLOMID à 100 mg.
Pharmacocinétique
D'après les premières études sur le citrate de clomifène marqué au 14C, il a été démontré que le médicament était facilement absorbé par voie orale chez l'homme et excrété principalement dans les fèces. L'excrétion urinaire et fécale cumulative du 14C était en moyenne d'environ 50 % de la dose orale et de 37 % d'une dose intraveineuse après 5 jours. L'excrétion urinaire moyenne était d'environ 8 % avec une excrétion fécale d'environ 42 %.
Une certaine trace de 14C était encore présente dans les matières fécales 6 semaines après l'administration. Des études ultérieures à dose unique chez des volontaires sains ont montré que le zuclomifène (cis) a une demi-vie plus longue que l'enclomifène (trans). Des niveaux détectables de zuclomifène ont persisté pendant plus d'un mois chez ces sujets. Cela peut être évocateur d'un recyclage entérohépatique stéréospécifique ou d'une séquestration du zuclomifène. Ainsi, il est possible que certains médicaments actifs restent dans l'organisme au début de la grossesse chez les femmes qui conçoivent pendant le cycle menstruel pendant le traitement par CLOMID.
Etudes cliniques
Au cours des investigations cliniques, 7578 patientes ont reçu CLOMID, dont certaines présentaient des obstacles à l'ovulation autres qu'un dysfonctionnement ovulatoire (voir LES INDICATIONS ). Dans ces essais cliniques, un traitement réussi caractérisé par une grossesse s'est produit chez environ 30 % de ces patientes.
Au total, 2 635 grossesses ont été signalées au cours de la période d'essai clinique. Parmi ces grossesses, les informations sur les résultats n'étaient disponibles que pour 2369 des cas. Le tableau 1 résume l'issue de ces cas.
Parmi les grossesses signalées, l'incidence des grossesses multiples était de 7,98 % : 6,9 % de jumeaux, 0,5 % de triplés, 0,3 % de quadruplés et 0,1 % de quintuplés. Sur les 165 grossesses gémellaires pour lesquelles des informations suffisantes étaient disponibles, le rapport entre jumeaux monozygotes et dizygotes était d'environ 1:5. Le tableau 1 rapporte le taux de survie des naissances multiples vivantes.
Une naissance sextuplée a été signalée après la fin des études cliniques originales; aucun des sextuplés n'a survécu (chacun pesait moins de 400 g), bien que chacun ait semblé grossièrement normal.
La survie globale des nourrissons issus de grossesses multiples, y compris les avortements spontanés, les mortinaissances et les décès néonatals, est de 73 %.
Anomalies fœtales/néonatales et mortalité
Les anomalies fœtales suivantes ont été signalées à la suite de grossesses consécutives à un traitement d'induction de l'ovulation par CLOMID au cours d'essais cliniques. Chacune des anomalies fœtales suivantes a été signalée à un taux de
De plus, des cas d'anomalies congénitales ont été signalés au cours de la surveillance post-commercialisation de CLOMID (voir EFFETS INDÉSIRABLES ).
INFORMATIONS PATIENTS
Le but et les risques du traitement par CLOMID doivent être présentés au patient avant de commencer le traitement. Il convient de souligner que l'objectif de la thérapie CLOMID est l'ovulation pour la grossesse suivante. Le médecin doit conseiller le patient en tenant particulièrement compte des risques potentiels suivants :
Symptômes visuels
Avertir que des troubles visuels ou d'autres symptômes visuels peuvent survenir occasionnellement pendant ou peu de temps après le traitement par CLOMID. Il doit être clairement indiqué au patient que, dans certains cas, les troubles visuels peuvent être prolongés et éventuellement irréversibles, en particulier avec une posologie ou une durée de traitement accrues. Avertir que les symptômes visuels peuvent rendre des activités telles que la conduite d'une voiture ou l'utilisation de machines plus dangereuses que d'habitude, en particulier dans des conditions d'éclairage variable (voir AVERTISSEMENTS ).
Le patient doit être avisé d'informer le médecin de tout symptôme visuel inhabituel. Si le patient présente des symptômes visuels, le traitement doit être interrompu et une évaluation ophtalmologique complète doit être effectuée.
Douleur ou distension abdominale/pelvienne
Une hypertrophie ovarienne peut survenir pendant ou peu de temps après le traitement par CLOMID. Afin de minimiser les risques associés à l'hypertrophie ovarienne, la patiente doit être informée d'informer le médecin de toute douleur abdominale ou pelvienne, prise de poids, inconfort ou distension après la prise de CLOMID (voir AVERTISSEMENTS ).
Grossesse multiple
Informez la patiente qu'il existe un risque accru de grossesse multiple, y compris de grossesse tubaire bilatérale et de grossesse tubaire et intra-utérine concomitante, lorsque la conception survient en relation avec le traitement par CLOMID. Les complications et les risques potentiels d'une grossesse multiple doivent être expliqués.
Avortement spontané et anomalies congénitales
Informez la patiente que les données disponibles ne suggèrent aucune augmentation des taux d'avortement spontané (fausse couche) ou d'anomalies congénitales avec l'utilisation maternelle de CLOMID 50 mg par rapport aux taux de la population générale.
Au cours de l'investigation clinique, l'expérience des patientes dont l'issue de la grossesse est connue (tableau 1) montre un taux d'avortement spontané de 20,4 % et un taux de mortinaissance de 1,0 %. (Voir Etudes cliniques ). Parmi les anomalies congénitales signalées spontanément en tant que cas individuels depuis la commercialisation de Clomid, la proportion d'anomalies du tube neural a été élevée parmi les grossesses associées à l'ovulation induite par Clomid, mais cela n'a pas été étayé par des données provenant d'études basées sur la population.
