Sustiva 200mg, 600mg Efavirenz Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Sustiva 600 mg et comment est-il utilisé ?
Sustiva est un médicament d'ordonnance utilisé pour traiter les symptômes de l'infection par le VIH. Sustiva peut être utilisé seul ou avec d'autres médicaments.
Sustiva appartient à une classe de médicaments appelés VIH, INNTI.
On ne sait pas si Sustiva est sûr et efficace chez les enfants de moins de 3 mois.
Quels sont les effets secondaires possibles de Sustiva ?
Sustiva peut provoquer des effets secondaires graves, notamment :
- urticaire,
- difficulté à respirer,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- fièvre,
- mal de gorge,
- Yeux brûlants,
- douleurs cutanées,
- éruption cutanée rouge ou violette avec cloques et desquamation,
- saisie,
- hallucinations,
- difficulté à se concentrer,
- difficulté à parler ou à bouger (peut survenir des mois ou des années après le début du traitement),
- vertiges,
- somnolence,
- confusion,
- difficulté à se concentrer,
- rêves étranges,
- insomnie,
- problèmes d'élocution,
- des difficultés d'équilibre ou de mouvement musculaire,
- anxiété,
- paranoïa,
- comportement inhabituel,
- sentiment de tristesse ou de désespoir,
- pensées suicidaires,
- nausée,
- Douleur d'estomac,
- perte d'appétit,
- urine foncée,
- selles de couleur argile,
- jaunissement de la peau ou des yeux (jaunisse),
- sueurs nocturnes,
- glandes enflées,
- boutons de fièvre,
- toux,
- respiration sifflante,
- diarrhée,
- perte de poids,
- difficulté à avaler,
- problèmes d'équilibre ou de mouvement des yeux,
- la faiblesse,
- sensation de picotement,
- gonflement du cou ou de la gorge (hypertrophie de la thyroïde),
- changements menstruels, et
- impuissance
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Sustiva comprennent :
- nausée,
- vomissement,
- vertiges,
- somnolence,
- difficulté à se concentrer,
- éruption,
- mal de tête,
- fatigue,
- troubles du sommeil (insomnie),
- rêves étranges et
- changements dans la forme ou l'emplacement de la graisse corporelle (en particulier dans les bras, les jambes, le visage, le cou, les seins et la taille)
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Sustiva. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
SUSTIVA® (éfavirenz) est un inhibiteur non nucléosidique de la transcriptase inverse (INNTI) spécifique au VIH-1. L'éfavirenz est chimiquement décrit comme (S)-6-chloro-4-(cyclopropyléthynyl)-1,4-dihydro4-(trifluorométhyl)-2H-3,1-benzoxazine-2-one. Sa formule empirique est C14H9ClF3NO2 et sa formule structurale est :
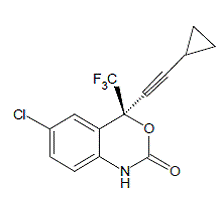
L'éfavirenz est une poudre cristalline blanche à légèrement rose avec une masse moléculaire de 315,68. Il est pratiquement insoluble dans l'eau (
Gélules
SUSTIVA est disponible sous forme de gélules pour administration orale contenant 50 mg ou 200 mg d'éfavirenz et les ingrédients inactifs suivants : lactose monohydraté, stéarate de magnésium, laurylsulfate de sodium et glycolate d'amidon sodique. L'enveloppe de la gélule contient les ingrédients inactifs et les colorants suivants : gélatine, laurylsulfate de sodium, dioxyde de titane et/ou oxyde de fer jaune. Les enveloppes des gélules peuvent également contenir du dioxyde de silicium. Les gélules sont imprimées avec de l'encre contenant du bleu carmin 40, du bleu FD&C n° 2 et du dioxyde de titane.
Comprimés
SUSTIVA 600 mg est disponible sous forme de comprimés pelliculés pour administration orale contenant 600 mg d'éfavirenz et les ingrédients inactifs suivants : croscarmellose sodique, hydroxypropylcellulose, lactose monohydraté, stéarate de magnésium, cellulose microcristalline et laurylsulfate de sodium. Le pelliculage contient Opadry Yellow et Opadry Clear. Les comprimés sont polis à la cire de carnauba et imprimés à l'encre violette, Opacode WB.
LES INDICATIONS
SUSTIVA® (éfavirenz) en association avec d'autres agents antirétroviraux est indiqué pour le traitement de l'infection par le virus de l'immunodéficience humaine de type 1 (VIH-1) chez les adultes et les enfants âgés d'au moins 3 mois et pesant au moins 3,5 kg.
DOSAGE ET ADMINISTRATION
Fonction hépatique
Surveiller la fonction hépatique avant et pendant le traitement par SUSTIVA [voir AVERTISSEMENTS ET PRECAUTIONS ]. SUSTIVA 600 mg n'est pas recommandé chez les patients présentant une insuffisance hépatique modérée ou sévère (Child Pugh B ou C) [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Adultes
La posologie recommandée de SUSTIVA (éfavirenz) est de 600 mg par voie orale, une fois par jour, en association avec un inhibiteur de la protéase et/ou des inhibiteurs nucléosidiques de la transcriptase inverse (INTI). Il est recommandé de prendre SUSTIVA à jeun, de préférence au coucher. L'augmentation des concentrations d'éfavirenz observée après l'administration de SUSTIVA 600 mg avec de la nourriture peut entraîner une augmentation de la fréquence des effets indésirables [voir PHARMACOLOGIE CLINIQUE ]. L'administration au coucher peut améliorer la tolérance des symptômes du système nerveux [voir AVERTISSEMENTS ET PRECAUTIONS , EFFETS INDÉSIRABLES , et INFORMATIONS PATIENTS ]. Les gélules ou les comprimés de SUSTIVA doivent être avalés intacts avec du liquide. Pour les patients qui ne peuvent pas avaler de gélules ou de comprimés, la méthode d'administration par saupoudrage de gélules est recommandée [voir Mode d'administration par saupoudrage de capsule ].
Thérapie antirétrovirale concomitante
SUSTIVA doit être administré en association avec d'autres médicaments antirétroviraux [voir LES INDICATIONS , AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES , et PHARMACOLOGIE CLINIQUE ].
Ajustement posologique
Si SUSTIVA 200 mg est co-administré avec le voriconazole, la dose d'entretien du voriconazole doit être augmentée à 400 mg toutes les 12 heures et la dose de SUSTIVA 200 mg doit être diminuée à 300 mg une fois par jour en utilisant la forme gélule (une gélule de 200 mg et deux gélules de 50 mg ou six gélules de 50 mg). gélules mg). Les comprimés de SUSTIVA 600 mg ne doivent pas être cassés. [voir INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE .]
Si SUSTIVA est co-administré avec la rifampicine chez des patients pesant 50 kg ou plus, une augmentation de la dose de SUSTIVA 200 mg à 800 mg une fois par jour est recommandée [voir INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
Patients pédiatriques
Il est recommandé de prendre SUSTIVA 600 mg à jeun, de préférence au coucher. Le tableau 1 décrit la dose recommandée de SUSTIVA pour les patients pédiatriques âgés de 3 mois ou plus et pesant entre 3,5 kg et 40 kg [voir PHARMACOLOGIE CLINIQUE ]. La posologie recommandée de SUSTIVA pour les patients pédiatriques pesant 40 kg ou plus est de 600 mg une fois par jour. Pour les patients pédiatriques qui ne peuvent pas avaler de gélules, le contenu de la gélule peut être administré avec une petite quantité de nourriture ou de préparation pour nourrissons en utilisant la méthode d'administration par saupoudrage de gélules [voir Mode d'administration par saupoudrage de capsule ].
Mode d'administration par saupoudrage de capsule
Pour les patients pédiatriques âgés d'au moins 3 mois et pesant au moins 3,5 kg et les adultes qui ne peuvent pas avaler de gélules ou de comprimés, le contenu de la gélule peut être administré avec une petite quantité (1 à 2 cuillères à café) de nourriture. L'utilisation de préparations pour nourrissons pour le mélange ne doit être envisagée que pour les jeunes nourrissons qui ne peuvent pas consommer de manière fiable des aliments solides. Les patients et les soignants doivent être informés qu'ils doivent ouvrir la gélule avec précaution pour éviter tout renversement ou dispersion du contenu de la gélule dans l'air. La gélule doit être maintenue horizontalement au-dessus d'un petit récipient et soigneusement tordue pour l'ouvrir. Pour les patients capables de tolérer les aliments solides, le contenu entier de la gélule doit être mélangé délicatement avec un aliment mou adapté à l'âge, tel que la compote de pommes, la gelée de raisin ou le yaourt, dans le petit récipient. Pour les jeunes nourrissons recevant le mélange gélule-préparation pour nourrissons, tout le contenu de la gélule doit être délicatement mélangé à 2 cuillerées à thé de préparation pour nourrissons reconstituée à température ambiante dans un petit récipient en remuant soigneusement avec une petite cuillère, puis en aspirant le mélange dans un récipient de 10 mL seringue doseuse orale pour l'administration. Après l'administration du mélange SUSTIVA-aliment ou préparation, une petite quantité supplémentaire (environ 2 cuillères à café) d'aliment ou de préparation doit être ajoutée au récipient de mélange vide, agitée pour disperser tout résidu SUSTIVA restant et administrée au patient. Le mélange SUSTIVA-aliment ou préparation doit être administré dans les 30 minutes suivant le mélange. Aucun aliment supplémentaire ne doit être consommé pendant 2 heures après l'administration de SUSTIVA.
D'autres instructions destinées aux patients concernant la méthode d'administration par saupoudrage de capsule sont fournies dans l'étiquetage patient approuvé par la FDA (voir INFORMATIONS PATIENTS et MODE D'EMPLOI ).
COMMENT FOURNIE
Formes posologiques et points forts
Gélules
Les gélules de 200 mg sont de couleur or, imprimées au verso avec « SUSTIVA » sur le corps et « 200 mg » sur le capuchon.
Les gélules de 50 mg sont de couleur or et blanc, portant l'inscription « SUSTIVA » sur le capuchon de couleur or et « 50 mg » imprimé au verso sur le corps blanc.
Comprimés
Les comprimés à 600 mg sont des comprimés pelliculés jaunes, en forme de capsule, portant l'inscription « SUSTIVA » imprimée sur les deux faces.
Stockage et manutention
Gélules
Les capsules SUSTIVA® (efavirenz) sont disponibles comme suit :
Les gélules de 200 mg sont de couleur or, imprimées au verso avec « SUSTIVA » sur le corps et « 200 mg » sur le capuchon.
Bouteilles de 90 - CDN 0056-0474-92
Les gélules de 50 mg sont de couleur or et blanc, portant l'inscription « SUSTIVA » sur le capuchon de couleur or et « 50 mg » imprimé au verso sur le corps blanc.
Bouteilles de 30 - CDN 0056-0470-30
Comprimés
Les comprimés SUSTIVA® (efavirenz) sont disponibles comme suit :
Les comprimés à 600 mg sont des comprimés pelliculés jaunes, en forme de capsule, portant l'inscription « SUSTIVA » imprimée sur les deux faces.
Bouteilles de 30 - CDN 0056-0510-30
Stockage
Les capsules SUSTIVA 600mg et les comprimés SUSTIVA doivent être conservés à 25°C (77°F); les excursions permises à 15°C-30°C (59°F-86°F) [voient USP la Température de Pièce Contrôlée].
Distribué par : Bristol-Myers Squibb Company Princeton, NJ 08543 USA. Révisé : octobre 2020
EFFETS SECONDAIRES
Les effets indésirables les plus importants observés chez les patients traités par SUSTIVA sont :
- symptômes psychiatriques [voir AVERTISSEMENTS ET PRECAUTIONS ],
- symptômes du système nerveux [voir AVERTISSEMENTS ET PRECAUTIONS ],
- éruption [voir AVERTISSEMENTS ET PRECAUTIONS ].
- hépatotoxicité [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les études cliniques sont menées dans des conditions très variables, les taux d'effets indésirables rapportés ne peuvent pas être directement comparés aux taux d'autres études cliniques et peuvent ne pas refléter les taux observés dans la pratique clinique.
Effets indésirables chez les adultes
Les effets indésirables les plus fréquents (> 5 % dans l'un ou l'autre des groupes de traitement par l'éfavirenz) de gravité au moins modérée chez les patients de l'étude 006 traités par SUSTIVA 200 mg en association avec la zidovudine/lamivudine ou l'indinavir étaient les suivants : éruption cutanée, étourdissements, nausées, céphalées, fatigue, insomnie, et des vomissements.
Les effets indésirables cliniques sélectionnés d'intensité modérée ou sévère observés chez ≥ 2 % des patients traités par SUSTIVA dans deux essais cliniques contrôlés sont présentés dans le tableau 2.
Des cas de pancréatite ont été rapportés, bien qu'une relation causale avec l'éfavirenz n'ait pas été établie. Des augmentations asymptomatiques des taux sériques d'amylase ont été observées chez un nombre significativement plus élevé de patients traités par l'éfavirenz 600 mg que chez les patients témoins (voir Anomalies de laboratoire ).
Symptômes du système nerveux
Pour 1 008 patients traités par des schémas contenant SUSTIVA et 635 patients traités par un schéma témoin dans des essais contrôlés, le tableau 3 répertorie la fréquence des symptômes de différents degrés de gravité et indique les taux d'abandon pour un ou plusieurs des symptômes du système nerveux suivants : étourdissements, insomnie, troubles de la concentration, somnolence, rêves anormaux, euphorie, confusion, agitation, amnésie, hallucinations, stupeur, pensées anormales et dépersonnalisation [voir AVERTISSEMENTS ET PRECAUTIONS ]. Les fréquences des symptômes spécifiques du système nerveux central et périphérique sont fournies dans le tableau 2.
Symptômes psychiatriques
Des effets indésirables psychiatriques graves ont été signalés chez des patients traités par SUSTIVA. Dans les essais contrôlés, les symptômes psychiatriques observés à une fréquence supérieure à 2 % chez les patients traités par SUSTIVA 600 mg ou les régimes témoins, respectivement, étaient la dépression (19 %, 16 %), l'anxiété (13 %, 9 %) et la nervosité (7 % , 2%).
Éruption
Dans les essais cliniques contrôlés, la fréquence des éruptions cutanées (tous grades confondus, quelle qu'en soit la cause) était de 26 % pour 1 008 adultes traités par des régimes contenant 200 mg de SUSTIVA et de 17 % pour 635 adultes traités par un régime témoin. La plupart des rapports d'éruptions cutanées étaient d'intensité légère ou modérée. La fréquence des éruptions cutanées de grade 3 était de 0,8 % pour les patients traités par SUSTIVA et de 0,3 % pour les groupes témoins, et la fréquence des éruptions cutanées de grade 4 était de 0,1 % pour SUSTIVA et de 0 pour les groupes témoins. Les taux d'abandon à la suite d'une éruption cutanée étaient de 1,7 % pour les patients traités par SUSTIVA et de 0,3 % pour les groupes témoins [voir AVERTISSEMENTS ET PRECAUTIONS ].
L'expérience avec SUSTIVA chez les patients qui ont arrêté d'autres agents antirétroviraux de la classe des INNTI est limitée. Dix-neuf patients qui ont arrêté la névirapine en raison d'une éruption cutanée ont été traités par SUSTIVA. Neuf de ces patients ont développé une éruption cutanée légère à modérée pendant le traitement par SUSTIVA, et deux de ces patients ont arrêté le traitement en raison d'une éruption cutanée.
Anomalies de laboratoire
Les anomalies de laboratoire de grade 3-4 sélectionnées signalées chez ≥ 2 % des patients traités par SUSTIVA dans deux essais cliniques sont présentées dans le tableau 4.
Patients co-infectés par l'hépatite B ou C
Les tests de la fonction hépatique doivent être surveillés chez les patients ayant des antécédents d'hépatite B et/ou C. Dans l'ensemble de données à long terme de l'étude 006, 137 patients traités avec des régimes contenant SUSTIVA (durée médiane du traitement, 68 semaines) et 84 patients traités avec un régime témoin (durée médiane, 56 semaines) étaient séropositifs lors du dépistage de l'hépatite B (antigène de surface positif) et/ou C (anticorps de l'hépatite C positif). Parmi ces patients co-infectés, des élévations de l'AST à plus de cinq fois la LSN se sont développées chez 13 % des patients des bras SUSTIVA et 7 % de ceux du bras témoin, et des élévations de l'ALT à plus de cinq fois la LSN se sont développées chez 20 % des patients dans les bras SUSTIVA et 7 % des patients dans le bras contrôle. Parmi les patients co-infectés, 3 % de ceux traités par des schémas thérapeutiques contenant SUSTIVA et 2 % du groupe témoin ont abandonné l'étude en raison de troubles du foie ou du système biliaire [voir AVERTISSEMENTS ET PRECAUTIONS ].
Lipides
Des augmentations par rapport au départ du cholestérol total de 10 à 20 % ont été observées chez certains volontaires non infectés recevant SUSTIVA. Chez les patients traités par SUSTIVA + zidovudine + lamivudine, des augmentations par rapport aux valeurs initiales du cholestérol total non à jeun et des HDL d'environ 20 % et 25 %, respectivement, ont été observées. Chez les patients traités par SUSTIVA + indinavir, des augmentations par rapport aux valeurs initiales du cholestérol et des HDL non à jeun d'environ 40 % et 35 %, respectivement, ont été observées. Des taux de cholestérol total non à jeun ≥ 240 mg/dL et ≥ 300 mg/dL ont été rapportés chez 34 % et 9 %, respectivement, des patients traités par SUSTIVA + zidovudine + lamivudine ; 54 % et 20 %, respectivement, des patients traités par SUSTIVA + indinavir ; et 28 % et 4 %, respectivement, des patients traités par indinavir + zidovudine + lamivudine. Les effets de SUSTIVA 600 mg sur les triglycérides et les LDL dans cette étude n'ont pas été bien caractérisés puisque des échantillons ont été prélevés sur des patients non à jeun. La signification clinique de ces résultats est inconnue [voir AVERTISSEMENTS ET PRECAUTIONS ].
Effets indésirables chez les patients pédiatriques
Étant donné que les études cliniques sont menées dans des conditions très variables, les taux d'effets indésirables rapportés ne peuvent pas être directement comparés aux taux d'autres études cliniques et peuvent ne pas refléter les taux observés dans la pratique clinique.
L'évaluation des effets indésirables est basée sur trois essais cliniques chez 182 patients pédiatriques infectés par le VIH-1 (âgés de 3 mois à 21 ans) qui ont reçu SUSTIVA 200 mg en association avec d'autres agents antirétroviraux pendant une durée médiane de 123 semaines. Les effets indésirables observés dans les trois essais étaient similaires à ceux observés dans les essais cliniques chez l'adulte, sauf que les éruptions cutanées étaient plus fréquentes chez les patients pédiatriques (32 % pour tous les grades, quelle que soit la causalité) et plus souvent de grade supérieur (c'est-à-dire plus graves). Deux (1,1 %) patients pédiatriques ont présenté une éruption cutanée de grade 3 (éruption confluente avec fièvre, éruption cutanée généralisée) et quatre (2,2 %) patients pédiatriques ont présenté une éruption cutanée de grade 4 (tous des érythèmes polymorphes). Cinq patients pédiatriques (2,7 %) ont abandonné l'étude en raison d'une éruption cutanée [voir AVERTISSEMENTS ET PRECAUTIONS ].
Expérience post-commercialisation
Les réactions défavorables suivantes ont été identifiées pendant l'utilisation de postapprobation de SUSTIVA. Étant donné que ces réactions sont signalées volontairement par une population de taille inconnue, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Corps dans son ensemble : réactions allergiques, asthénie, redistribution/accumulation de graisse corporelle [voir AVERTISSEMENTS ET PRECAUTIONS ]
Système nerveux central et périphérique : troubles de la coordination, ataxie, encéphalopathie, troubles de la coordination et de l'équilibre cérébelleux, convulsions, hypoesthésie, paresthésie, neuropathie, tremblements, vertiges
Endocrine: gynécomastie
Gastro-intestinal : constipation, malabsorption
Cardiovasculaire: bouffées vasomotrices, palpitations
Système hépatique et biliaire : augmentation des enzymes hépatiques, insuffisance hépatique, hépatite.
Métabolique et Nutritionnel : hypercholestérolémie, hypertriglycéridémie
Musculo-squelettique : arthralgie, myalgie, myopathie
Psychiatrique: réactions agressives, agitation, délire, labilité émotionnelle, manie, névrose, paranoïa, psychose, suicide, catatonie
Respiratoire: dyspnée
Peau et appendices : érythème polymorphe, dermatite photoallergique, syndrome de Stevens-Johnson
Sens spéciaux : vision anormale, acouphènes
INTERACTIONS MÉDICAMENTEUSES
Potentiel pour SUSTIVA d'affecter d'autres médicaments
Il a été démontré in vivo que l'éfavirenz induisait le CYP3A et le CYP2B6. D'autres composés qui sont des substrats du CYP3A ou du CYP2B6 peuvent avoir des concentrations plasmatiques diminuées lorsqu'ils sont co-administrés avec SUSTIVA.
Possibilité que d'autres médicaments affectent SUSTIVA
Les médicaments qui induisent l'activité du CYP3A (par exemple, le phénobarbital, la rifampicine, la rifabutine) devraient augmenter la clairance de l'éfavirenz, entraînant une diminution des concentrations plasmatiques [voir DOSAGE ET ADMINISTRATION ].
Médicaments prolongeant l'intervalle QT
Les informations disponibles sur le potentiel d'interaction pharmacodynamique entre SUSTIVA 600 mg et les médicaments qui allongent l'intervalle QTc sont limitées. Un allongement de l'intervalle QTc a été observé avec l'utilisation d'éfavirenz [voir PHARMACOLOGIE CLINIQUE ]. Envisager des alternatives à SUSTIVA 600 mg lorsqu'il est co-administré avec un médicament présentant un risque connu de Torsade de Pointes.
Interactions médicamenteuses établies et autres interactions médicamenteuses potentiellement importantes
Les interactions médicamenteuses avec SUSTIVA sont résumées dans le tableau 5. Pour les données pharmacocinétiques, [voir PHARMACOLOGIE CLINIQUE ] Tableaux 7 et 8. Ce tableau inclut les interactions potentiellement significatives, mais n'est pas exhaustif.
Médicaments sans interactions cliniquement significatives avec SUSTIVA
Aucun ajustement posologique n'est recommandé lorsque SUSTIVA 600 mg est administré avec les éléments suivants : antiacides à base d'hydroxyde d'aluminium/magnésium, azithromycine, cétirizine, famotidine, fluconazole, lorazépam, nelfinavir, inhibiteurs nucléosidiques de la transcriptase inverse (abacavir, emtricitabine, lamivudine, stavudine, fumarate de ténofovir disoproxil, zidovudine ), la paroxétine et le raltégravir.
Interaction avec les tests de cannabinoïdes
L'éfavirenz ne se lie pas aux récepteurs cannabinoïdes. Des résultats de tests de cannabinoïdes urinaires faussement positifs ont été rapportés avec certains tests de dépistage chez des sujets non infectés et infectés par le VIH recevant de l'éfavirenz. La confirmation des tests de dépistage positifs aux cannabinoïdes par une méthode plus spécifique est recommandée.
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Interactions médicamenteuses
Les concentrations plasmatiques d'éfavirenz peuvent être modifiées par des substrats, des inhibiteurs ou des inducteurs du CYP3A. De même, l'éfavirenz peut modifier les concentrations plasmatiques des médicaments métabolisés par le CYP3A ou le CYP2B6. L'effet le plus important de l'éfavirenz à l'état d'équilibre est l'induction du CYP3A et du CYP2B6 [voir DOSAGE ET ADMINISTRATION et INTERACTIONS MÉDICAMENTEUSES ].
Allongement de l'intervalle QTc
Un allongement de l'intervalle QTc a été observé avec l'utilisation d'éfavirenz [voir INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ]. Envisager des alternatives à SUSTIVA 600 mg lorsqu'il est co-administré avec un médicament présentant un risque connu de torsade de pointes ou lorsqu'il est administré à des patients présentant un risque plus élevé de torsade de pointes.
La résistance
SUSTIVA 200 mg ne doit pas être utilisé comme agent unique pour traiter l'infection par le VIH-1 ou ajouté comme agent unique à un traitement défaillant. Le virus résistant émerge rapidement lorsque l'éfavirenz est administré en monothérapie. Le choix de nouveaux agents antirétroviraux à utiliser en association avec l'éfavirenz doit tenir compte du potentiel de résistance croisée virale.
Coadministration avec des produits connexes
L'administration concomitante de SUSTIVA avec ATRIPLA (éfavirenz 600 mg/emtricitabine 200 mg/fumarate de ténofovir disoproxil 300 mg) n'est pas recommandée sauf si nécessaire pour un ajustement posologique (par exemple, avec la rifampicine), car l'éfavirenz est l'un de ses principes actifs.
Symptômes psychiatriques
Des effets indésirables psychiatriques graves ont été signalés chez des patients traités par SUSTIVA. Dans des essais contrôlés portant sur 1 008 patients traités avec des schémas thérapeutiques contenant 600 mg de SUSTIVA pendant une moyenne de 2,1 ans et 635 patients traités avec des schémas thérapeutiques témoins pendant une moyenne de 1,5 an, la fréquence (indépendamment de la causalité) d'événements psychiatriques graves spécifiques chez les patients ayant reçu SUSTIVA ou les régimes de contrôle, respectivement, étaient la dépression sévère (2,4 %, 0,9 %), les idées suicidaires (0,7 %, 0,3 %), les tentatives de suicide non mortelles (0,5 %, 0), le comportement agressif (0,4 %, 0,5 %), les réactions paranoïaques (0,4 %, 0,3 %) et réactions maniaques (0,2 %, 0,3 %). Lorsque des symptômes psychiatriques similaires à ceux notés ci-dessus ont été combinés et évalués en tant que groupe dans une analyse multifactorielle des données de l'étude 006, le traitement par l'éfavirenz a été associé à une augmentation de la survenue de ces symptômes psychiatriques sélectionnés. D'autres facteurs associés à une augmentation de la survenue de ces symptômes psychiatriques étaient les antécédents d'utilisation de drogues injectables, les antécédents psychiatriques et la prise de médicaments psychiatriques à l'entrée dans l'étude ; des associations similaires ont été observées dans les groupes de traitement SUSTIVA et témoin. Dans l'étude 006, l'apparition de nouveaux symptômes psychiatriques graves s'est produite tout au long de l'étude, tant chez les patients traités par SUSTIVA que chez les patients traités par le groupe témoin. Un pour cent des patients traités par SUSTIVA ont arrêté ou interrompu le traitement en raison d'un ou plusieurs de ces symptômes psychiatriques sélectionnés. Il y a également eu des rapports post-commercialisation occasionnels de décès par suicide, délires et comportement de type psychose, bien qu'une relation causale avec l'utilisation de SUSTIVA ne puisse être déterminée à partir de ces rapports. Des cas de catatonie post-commercialisation ont également été rapportés et peuvent être associés à une exposition accrue à l'éfavirenz. Les patients souffrant d'expériences indésirables psychiatriques graves doivent demander une évaluation médicale immédiate pour évaluer la possibilité que les symptômes puissent être liés à l'utilisation de SUSTIVA et, le cas échéant, pour déterminer si les risques de la poursuite du traitement l'emportent sur les avantages. [voir EFFETS INDÉSIRABLES .]
Symptômes du système nerveux
Cinquante-trois pour cent (531/1008) des patients recevant SUSTIVA 600 mg dans des essais contrôlés ont signalé des symptômes du système nerveux central (de tout grade, quelle qu'en soit la cause) par rapport à 25 % (156/635) des patients recevant des régimes témoins [voir EFFETS INDÉSIRABLES ]. Ces symptômes comprenaient, mais sans s'y limiter, des étourdissements (28,1 % des 1 008 patients), de l'insomnie (16,3 %), des troubles de la concentration (8,3 %), de la somnolence (7,0 %), des rêves anormaux (6,2 %) et des hallucinations (1,2 %). %). Ces symptômes étaient sévères chez 2,0 % des patients ; et 2,1 % des patients ont arrêté le traitement en conséquence. Ces symptômes commencent généralement au cours du premier ou du deuxième jour de traitement et disparaissent généralement après les 2 à 4 premières semaines de traitement. Après 4 semaines de traitement, la prévalence des symptômes du système nerveux d'une gravité au moins modérée variait de 5 % à 9 % chez les patients traités avec des régimes contenant SUSTIVA et de 3 % à 5 % chez les patients traités avec un régime témoin. Les patients doivent être informés que ces symptômes fréquents étaient susceptibles de s'améliorer avec la poursuite du traitement et qu'ils n'étaient pas prédictifs de l'apparition ultérieure des symptômes psychiatriques moins fréquents [voir Symptômes psychiatriques ]. L'administration au coucher peut améliorer la tolérance de ces symptômes du système nerveux [voir DOSAGE ET ADMINISTRATION ].
L'analyse des données à long terme de l'étude 006 (suivi médian de 180 semaines, 102 semaines et 76 semaines pour les patients traités par SUSTIVA + zidovudine + lamivudine, SUSTIVA + indinavir et indinavir + zidovudine + lamivudine, respectivement) a montré qu'au-delà Après 24 semaines de traitement, l'incidence de l'apparition de nouveaux symptômes du système nerveux chez les patients traités par SUSTIVA était généralement similaire à celle du groupe témoin contenant de l'indinavir.
Une neurotoxicité d'apparition tardive, y compris l'ataxie et l'encéphalopathie (troubles de la conscience, confusion, ralentissement psychomoteur, psychose, délire), peut survenir des mois à des années après le début du traitement par l'éfavirenz. Certains événements de neurotoxicité d'apparition tardive sont survenus chez des patients présentant des polymorphismes génétiques du CYP2B6 associés à une augmentation des taux d'éfavirenz malgré la posologie standard de SUSTIVA. Les patients présentant des signes et des symptômes d'effets indésirables neurologiques graves doivent être évalués rapidement afin d'évaluer la possibilité que ces événements puissent être liés à l'utilisation de l'éfavirenz et si l'arrêt de SUSTIVA 600 mg est justifié.
Les patients recevant SUSTIVA 600 mg doivent être avertis du potentiel d'effets additifs sur le système nerveux central lorsque SUSTIVA 200 mg est utilisé en concomitance avec de l'alcool ou des médicaments psychoactifs.
Les patients qui présentent des symptômes du système nerveux central tels que des étourdissements, des troubles de la concentration et/ou de la somnolence doivent éviter les tâches potentiellement dangereuses telles que conduire ou utiliser des machines.
Toxicité embryo-fœtale
L'éfavirenz peut être nocif pour le fœtus lorsqu'il est administré au cours du premier trimestre à une femme enceinte. Conseillez aux femmes en âge de procréer qui reçoivent SUSTIVA 600 mg d'éviter une grossesse. [voir Utilisation dans des populations spécifiques .]
Éruption
Dans des essais cliniques contrôlés, 26 % (266/1008) des patients adultes traités par 600 mg de SUSTIVA ont présenté une éruption cutanée d'apparition récente, contre 17 % (111/635) de ceux traités dans les groupes témoins [voir EFFETS INDÉSIRABLES ]. Une éruption cutanée associée à des cloques, une desquamation humide ou une ulcération est survenue chez 0,9 % (9/1008) des patients traités par SUSTIVA. L'incidence des éruptions cutanées de grade 4 (p. ex., érythème polymorphe, syndrome de Stevens-Johnson) chez les patients adultes traités par SUSTIVA dans toutes les études et l'accès élargi était de 0,1 %. Les éruptions cutanées sont généralement des éruptions cutanées maculopapuleuses légères à modérées qui surviennent dans les 2 premières semaines suivant le début du traitement par l'éfavirenz (le délai médian d'apparition de l'éruption cutanée chez l'adulte était de 11 jours) et, chez la plupart des patients poursuivant le traitement par l'éfavirenz, l'éruption cutanée disparaît en 1 mois (durée médiane, 16 jours). Le taux d'abandon pour éruption cutanée dans les essais cliniques chez l'adulte était de 1,7 % (17/1008).
Des éruptions cutanées ont été signalées chez 59 des 182 patients pédiatriques (32 %) traités par SUSTIVA [voir EFFETS INDÉSIRABLES ]. Deux patients pédiatriques ont présenté une éruption cutanée de grade 3 (éruption confluente avec fièvre, éruption cutanée généralisée) et quatre patients ont présenté une éruption cutanée de grade 4 (érythème polymorphe). Le délai médian d'apparition de l'éruption cutanée chez les patients pédiatriques était de 28 jours (intervalle de 3 à 1 642 jours). Une prophylaxie avec des antihistaminiques appropriés avant de commencer le traitement par SUSTIVA chez les patients pédiatriques doit être envisagée.
SUSTIVA 600 mg peut généralement être réinitialisé chez les patients interrompant le traitement en raison d'une éruption cutanée. SUSTIVA 200 mg doit être arrêté chez les patients développant une éruption cutanée sévère associée à des cloques, une desquamation, une atteinte des muqueuses ou de la fièvre. Des antihistaminiques et/ou des corticostéroïdes appropriés peuvent améliorer la tolérance et accélérer la résolution des éruptions cutanées. Pour les patients qui ont eu une réaction cutanée menaçant le pronostic vital (par exemple, le syndrome de Stevens-Johnson), un traitement alternatif doit être envisagé [voir CONTRE-INDICATIONS ].
Hépatotoxicité
Des cas d'hépatite post-commercialisation, y compris une hépatite fulminante évoluant vers une insuffisance hépatique nécessitant une transplantation ou entraînant la mort, ont été rapportés chez des patients traités par SUSTIVA. Les rapports ont inclus des patients atteints d'une maladie hépatique sous-jacente, y compris une co-infection par l'hépatite B ou C, et des patients sans maladie hépatique préexistante ou d'autres facteurs de risque identifiables.
SUSTIVA 600 mg n'est pas recommandé chez les patients présentant une insuffisance hépatique modérée ou sévère. Une surveillance attentive est recommandée chez les patients présentant une insuffisance hépatique légère recevant SUSTIVA. [voir EFFETS INDÉSIRABLES et Utilisation dans des populations spécifiques ].
La surveillance des enzymes hépatiques avant et pendant le traitement est recommandée pour tous les patients [voir DOSAGE ET ADMINISTRATION ].
Envisager d'arrêter SUSTIVA 600 mg chez les patients présentant des élévations persistantes des transaminases sériques supérieures à cinq fois la limite supérieure de la plage normale.Interrompre SUSTIVA 200 mg si l'élévation des transaminases sériques s'accompagne de signes cliniques ou de symptômes d'hépatite ou de décompensation hépatique.
Convulsions
Des convulsions ont été observées chez des patients adultes et pédiatriques recevant de l'éfavirenz, généralement en présence d'antécédents médicaux connus de convulsions [voir Toxicologie non clinique ]. Des précautions doivent être prises chez tout patient ayant des antécédents de convulsions. Les patients recevant simultanément des médicaments anticonvulsivants principalement métabolisés par le foie, tels que la phénytoïne et le phénobarbital, peuvent nécessiter une surveillance périodique des taux plasmatiques [voir INTERACTIONS MÉDICAMENTEUSES ].
Élévations lipidiques
Le traitement par SUSTIVA a entraîné une augmentation de la concentration de cholestérol total et de triglycérides [voir EFFETS INDÉSIRABLES ]. Des tests de cholestérol et de triglycérides doivent être effectués avant de commencer le traitement par SUSTIVA 200 mg et à intervalles réguliers pendant le traitement.
Syndrome de reconstitution immunitaire
Un syndrome de reconstitution immunitaire a été signalé chez des patients traités par une association d'antirétroviraux, y compris SUSTIVA. Au cours de la phase initiale du traitement antirétroviral combiné, les patients dont le système immunitaire répond peuvent développer une réponse inflammatoire aux infections opportunistes indolentes ou résiduelles (telles que l'infection à Mycobacterium avium, le cytomégalovirus, la pneumonie à Pneumocystis jiroveci [PCP] ou la tuberculose), ce qui peut nécessiter une évaluation plus approfondie et traitement.
Des troubles auto-immuns (tels que la maladie de Basedow, la polymyosite, le syndrome de Guillain-Barré et l'hépatite auto-immune) ont également été signalés dans le cadre d'une reconstitution immunitaire ; cependant, le délai d'apparition est plus variable et peut survenir plusieurs mois après le début du traitement.
Redistribution des graisses
Une redistribution/accumulation de graisse corporelle, y compris une obésité centrale, une hypertrophie de la graisse dorso-cervicale (bosse de bison), une fonte périphérique, une fonte faciale, une hypertrophie mammaire et une « apparence cushingoïde » ont été observées chez des patients recevant un traitement antirétroviral. Le mécanisme et les conséquences à long terme de ces événements sont actuellement inconnus. Une relation causale n'a pas été établie.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( INFORMATIONS PATIENTS et Mode d'emploi ).
Interactions médicamenteuses
Une déclaration destinée aux patients et aux prestataires de soins de santé figure sur les étiquettes des flacons du produit : ALERTE : Renseignez-vous sur les médicaments qui ne doivent PAS être pris avec SUSTIVA.
SUSTIVA peut interagir avec certains médicaments ; par conséquent, conseillez aux patients de signaler à leur médecin l'utilisation de tout autre médicament sur ordonnance ou en vente libre.
Informations générales pour les patients
Informez les patients que SUSTIVA 200 mg ne guérit pas l'infection par le VIH-1 et que les patients peuvent continuer à souffrir de maladies associées à l'infection par le VIH-1, y compris les infections opportunistes. Les patients doivent rester sous la surveillance d'un médecin pendant qu'ils prennent SUSTIVA.
Conseillez aux patients d'éviter de faire des choses qui peuvent propager l'infection par le VIH-1 à d'autres.
- Ne partagez pas et ne réutilisez pas les aiguilles ou tout autre matériel d'injection.
- Ne partagez pas d'objets personnels qui peuvent contenir du sang ou des liquides organiques, comme des brosses à dents et des lames de rasoir.
- N'ayez aucun type de rapport sexuel sans protection. Pratiquez toujours des rapports sexuels protégés en utilisant un préservatif en latex ou en polyuréthane pour réduire les risques de contact sexuel avec le sperme, les sécrétions vaginales ou le sang.
- Ne pas allaiter. Les mères infectées par le VIH-1 ne doivent pas allaiter car le VIH-1 peut être transmis au bébé par le lait maternel.
Instructions de dosage
Conseillez aux patients de prendre SUSTIVA tous les jours comme prescrit. Si un patient oublie de prendre SUSTIVA, dites-lui de prendre immédiatement la dose oubliée, à moins qu'il ne soit presque temps de prendre la dose suivante. Conseillez au patient de ne pas prendre 2 doses à la fois et de prendre la dose suivante à l'heure prévue. Conseillez au patient de demander à un fournisseur de soins de santé s'il a besoin d'aide pour planifier les meilleurs moments pour prendre ses médicaments.
SUSTIVA 200 mg doit toujours être utilisé en association avec d'autres médicaments antirétroviraux. Conseillez aux patients de prendre SUSTIVA 600 mg à jeun, de préférence au coucher. La prise de SUSTIVA avec de la nourriture augmente les concentrations d'éfavirenz et peut augmenter la fréquence des effets indésirables. L'administration au coucher peut améliorer la tolérance des symptômes du système nerveux [voir DOSAGE ET ADMINISTRATION et EFFETS INDÉSIRABLES ]. Les prestataires de soins de santé doivent aider les parents ou les soignants à déterminer le meilleur schéma posologique de SUSTIVA pour les nourrissons et les jeunes enfants.
Pour les patients adultes et pédiatriques qui ne peuvent pas avaler de gélules ou de comprimés, il faut conseiller aux patients ou à leurs soignants de lire et de suivre attentivement les instructions d'administration du contenu de la gélule dans une petite quantité d'aliment ou de préparation pour nourrissons [voir DOSAGE ET ADMINISTRATION et étiquetage patient approuvé par la FDA ( INFORMATIONS PATIENTS et MODE D'EMPLOI )]. Les patients doivent appeler leur fournisseur de soins de santé ou leur pharmacien s'ils ont des questions.
Symptômes du système nerveux
Informez les patients que les symptômes du système nerveux central (NSS), y compris les étourdissements, l'insomnie, les troubles de la concentration, la somnolence et les rêves anormaux, sont fréquemment signalés au cours des premières semaines de traitement par SUSTIVA [voir AVERTISSEMENTS ET PRECAUTIONS ]. L'administration au coucher peut améliorer la tolérance de ces symptômes, qui sont susceptibles de s'améliorer avec la poursuite du traitement. Alerter les patients du potentiel d'effets additifs lorsque SUSTIVA est utilisé en concomitance avec de l'alcool ou des médicaments psychoactifs. Informez les patients que s'ils ressentent un NSS, ils doivent éviter les tâches potentiellement dangereuses telles que conduire ou faire fonctionner des machines.
Informez les patients qu'il existe un risque de développer une neurotoxicité tardive, notamment une ataxie et une encéphalopathie, qui peuvent survenir des mois ou des années après le début du traitement par SUSTIVA [voir AVERTISSEMENTS ET PRECAUTIONS ].
Symptômes psychiatriques
Informez les patients que des symptômes psychiatriques graves, notamment une dépression grave, des tentatives de suicide, un comportement agressif, des idées délirantes, de la paranoïa, des symptômes de type psychose et de la catatonie, ont été signalés chez des patients recevant SUSTIVA [voir AVERTISSEMENTS ET PRECAUTIONS ]. S'ils vivent des expériences indésirables psychiatriques graves, ils doivent demander une évaluation médicale immédiate. Conseillez aux patients d'informer leur médecin de tout antécédent de maladie mentale ou de toxicomanie.
Éruption
Informez les patients qu'un effet indésirable courant est une éruption cutanée [voir AVERTISSEMENTS ET PRECAUTIONS ]. Les éruptions cutanées disparaissent généralement sans aucun changement de traitement. Cependant, étant donné que l'éruption cutanée peut être grave, conseillez aux patients de contacter rapidement leur médecin en cas d'éruption cutanée.
Hépatotoxicité
Informez les patients qu'ils doivent surveiller les signes précurseurs d'inflammation ou d'insuffisance hépatique, tels que la fatigue, la faiblesse, le manque d'appétit, les nausées et les vomissements, ainsi que les signes ultérieurs tels que la jaunisse, la confusion, l'enflure abdominale et la décoloration des selles, et de consulter leur professionnel de la santé sans délai si de tels symptômes surviennent [voir AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ].
Femelles de potentiel reproducteur
Conseiller aux femmes en âge de procréer d'utiliser une contraception efficace ainsi qu'une méthode de barrière pendant le traitement par SUSTIVA 600 mg et pendant 12 semaines après l'arrêt de SUSTIVA. Conseillez aux patientes de contacter leur fournisseur de soins de santé si elles envisagent de devenir enceintes, si elles deviennent enceintes ou si une grossesse est suspectée pendant le traitement par SUSTIVA [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Registre d'exposition pendant la grossesse
Informez les patients qu'il existe un registre d'exposition pendant la grossesse qui surveille les résultats de la grossesse chez les femmes exposées à SUSTIVA pendant la grossesse [voir Utilisation dans des populations spécifiques ].
Redistribution des graisses
Informez les patients qu'une redistribution ou une accumulation de graisse corporelle peut se produire chez les patients recevant un traitement antirétroviral et que la cause et les effets à long terme de ces affections sur la santé ne sont pas connus [voir AVERTISSEMENTS ET PRECAUTIONS ].
SUSTIVA est une marque déposée de Bristol-Myers Squibb Pharma Company. ATRIPLA est une marque déposée de Bristol-Myers Squibb & Gilead Sciences, LLC.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Des études de cancérogénicité à long terme chez la souris et le rat ont été réalisées avec l'éfavirenz. Des souris ont reçu des doses de 0, 25, 75, 150 ou 300 mg/kg/jour pendant 2 ans. Les incidences d'adénomes et de carcinomes hépatocellulaires et d'adénomes pulmonaires alvéolaires/bronchiolaires ont augmenté par rapport au bruit de fond chez les femelles. Aucune augmentation de l'incidence des tumeurs au-dessus du bruit de fond n'a été observée chez les hommes. Il n'y avait pas de DSENO chez les femelles établies pour cette étude parce que des découvertes de tumeurs se sont produites à toutes les doses. L'ASC à la NOAEL (150 mg/kg) chez les mâles était d'environ 0,9 fois celle observée chez l'homme à la dose clinique recommandée. Dans l'étude chez le rat, aucune augmentation de l'incidence des tumeurs n'a été observée à des doses allant jusqu'à 100 mg/kg/jour, pour lesquelles les ASC étaient de 0,1 (mâles) ou 0,2 (femelles) fois celles observées chez l'homme à la dose clinique recommandée.
Mutagenèse
L'éfavirenz a été testé négatif dans une batterie de tests de génotoxicité in vitro et in vivo. Celles-ci comprenaient des tests de mutation bactérienne dans S. typhimurium et E. coli, des tests de mutation de mammifères dans des cellules ovariennes de hamster chinois, des tests d'aberration chromosomique dans des lymphocytes du sang périphérique humain ou des cellules ovariennes de hamster chinois et un test in vivo du micronoyau de moelle osseuse de souris.
Altération de la fertilité
L'éfavirenz n'a pas altéré l'accouplement ou la fertilité des rats mâles ou femelles, et n'a pas affecté le sperme des rats mâles traités. Les performances de reproduction des descendants nés de rats femelles ayant reçu de l'éfavirenz n'ont pas été affectées. Les ASC aux valeurs NOAEL chez les rats mâles (200 mg/kg) et femelles (100 mg/kg) étaient environ ≤ 0,15 fois celles observées chez l'homme à la dose clinique recommandée.
Utilisation dans des populations spécifiques
Grossesse
Registre d'exposition pendant la grossesse
Il existe un registre d'exposition pendant la grossesse qui surveille les résultats de la grossesse chez les femmes exposées à SUSTIVA 600 mg pendant la grossesse. Les médecins sont encouragés à inscrire leurs patientes en appelant le Registre des grossesses antirétrovirales au 1-800-258-4263.
Résumé des risques
Il existe des rapports de cas rétrospectifs d'anomalies du tube neural chez les nourrissons dont les mères ont été exposées à des régimes contenant de l'éfavirenz au cours du premier trimestre de la grossesse. Les données prospectives sur les grossesses du Registre des grossesses sous antirétroviraux ne sont pas suffisantes pour évaluer adéquatement ce risque. Les données disponibles de l'Antiretroviral Pregnancy Registry ne montrent aucune différence dans le risque global de malformations congénitales majeures par rapport au taux de fond de malformations congénitales majeures de 2,7 % dans la population de référence américaine du Metropolitan Atlanta Congenital Defects Program (MACDP). Bien qu'aucune relation causale n'ait été établie entre l'exposition à l'éfavirenz au cours du premier trimestre et les anomalies du tube neural, des malformations similaires ont été observées dans des études menées chez le singe à des doses similaires à la dose humaine. De plus, des toxicités fœtales et embryonnaires sont survenues chez le rat, à une dose dix fois inférieure à l'exposition humaine à la dose clinique recommandée. En raison du risque potentiel d'anomalies du tube neural, l'éfavirenz ne doit pas être utilisé pendant le premier trimestre de la grossesse. Informez les femmes enceintes du risque potentiel pour le fœtus.
Données
Données humaines
Il existe des rapports post-commercialisation rétrospectifs de résultats compatibles avec des anomalies du tube neural, y compris la méningomyélocèle, tous chez des nourrissons de mères exposées à des schémas thérapeutiques contenant de l'éfavirenz au cours du premier trimestre.
D'après les rapports prospectifs du Registre des grossesses sous traitement antirétroviral (APR) d'environ 1 000 naissances vivantes suite à une exposition à des régimes contenant de l'éfavirenz (dont plus de 800 naissances vivantes exposées au cours du premier trimestre), il n'y avait aucune différence entre l'éfavirenz et les malformations congénitales globales par rapport au taux de malformations congénitales de base de 2,7 % dans la population de référence américaine du Metropolitan Atlanta Congenital Defects Program. Selon le rapport provisoire du RAP publié en décembre 2014, la prévalence des malformations congénitales à la suite d'une exposition au premier trimestre était de 2,3 % (IC à 95 % : 1,4 % à 3,6 %). L'une de ces malformations signalées de manière prospective lors d'une exposition au cours du premier trimestre était une malformation du tube neural. Un seul cas d'anophtalmie avec exposition à l'éfavirenz au cours du premier trimestre a également été signalé de manière prospective. Ce cas comprenait également de graves fentes faciales obliques et des bandes amniotiques, qui ont une association connue avec l'anophtalmie.
Données animales
Les effets de l'éfavirenz sur le développement embryo-fœtal ont été étudiés chez trois espèces non cliniques (singes cynomolgus, rats et lapins). Chez les singes, l'efavirenz 60 mg/kg/jour a été administré aux femelles gestantes tout au long de la grossesse (jours de gestation 20 à 150). L'exposition systémique maternelle au médicament (AUC) était de 1,3 fois l'exposition chez l'homme à la dose clinique recommandée (600 mg/jour), avec des concentrations de médicament dans la veine ombilicale fœtale d'environ 0,7 fois les valeurs maternelles. Trois des 20 fœtus/nourrissons avaient une ou plusieurs malformations ; il n'y avait pas de fœtus ou de nourrissons malformés issus de mères ayant reçu le placebo. Les malformations survenues chez ces trois fœtus de singe comprenaient une anencéphalie et une anophtalmie unilatérale chez un fœtus, une microphtalmie chez un deuxième et une fente palatine chez le troisième. Aucune NOAEL (dose sans effet indésirable observable) n'a été établie pour cette étude car une seule dose a été évaluée. Chez les rats, l'éfavirenz a été administré soit pendant l'organogenèse (jours de gestation 7 à 18) soit du jour de gestation 7 au jour de lactation 21 à 50, 100 ou 200 mg/kg/jour. L'administration de 200 mg/kg/jour chez le rat a été associée à une augmentation de l'incidence des résorptions précoces ; et des doses de 100 mg/kg/jour et plus étaient associées à une mortalité néonatale précoce. L'ASC à la NOAEL (50 mg/kg/jour) dans cette étude chez le rat était de 0,1 fois celle observée chez l'homme à la dose clinique recommandée. Les concentrations de médicament dans le lait au 10e jour de lactation étaient environ 8 fois plus élevées que celles dans le plasma maternel. Chez les lapines gestantes, l'éfavirenz n'a été ni létal sur le plan embryonnaire ni tératogène lorsqu'il a été administré à des doses de 25, 50 et 75 mg/kg/jour pendant la période d'organogenèse (jours de gestation 6 à 18). L'ASC à la NOAEL (75 mg/kg/jour) chez le lapin était de 0,4 fois celle observée chez l'homme à la dose clinique recommandée.
Lactation
Résumé des risques
Les Centers for Disease Control and Prevention recommandent aux mères infectées par le VIH de ne pas allaiter leurs bébés pour éviter le risque de transmission postnatale du VIH. En raison du risque de transmission du VIH chez les nourrissons allaités, conseillez aux femmes de ne pas allaiter.
Femelles et mâles de potentiel reproducteur
En raison des effets tératogènes potentiels, une grossesse doit être évitée chez les femmes recevant SUSTIVA. [voir Grossesse .]
Test de grossesse
Les femmes en âge de procréer doivent subir un test de grossesse avant le début de SUSTIVA.
La contraception
Les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement par SUSTIVA 200 mg et pendant 12 semaines après l'arrêt de SUSTIVA 200 mg en raison de la longue demi-vie de l'éfavirenz. La contraception barrière doit toujours être utilisée en association avec d'autres méthodes de contraception. Les méthodes hormonales qui contiennent de la progestérone peuvent avoir une efficacité réduite [voir INTERACTIONS MÉDICAMENTEUSES ].
Utilisation pédiatrique
L'innocuité, le profil pharmacocinétique et les réponses virologiques et immunologiques de SUSTIVA 600 mg ont été évalués chez des patients pédiatriques infectés par le VIH-1 naïfs de traitement antirétroviral et expérimentés âgés de 3 mois à 21 ans dans trois essais cliniques en ouvert [voir EFFETS INDÉSIRABLES , PHARMACOLOGIE CLINIQUE , et Etudes cliniques ]. Le type et la fréquence des effets indésirables dans ces essais étaient généralement similaires à ceux des patients adultes, à l'exception d'une fréquence plus élevée d'éruptions cutanées, y compris une fréquence plus élevée d'éruptions cutanées de grade 3 ou 4, chez les patients pédiatriques par rapport aux adultes [voir AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ].
L'utilisation de SUSTIVA chez les patients âgés de moins de 3 mois OU pesant moins de 3,5 kg n'est pas recommandée car la sécurité, la pharmacocinétique et l'activité antivirale de SUSTIVA 600 mg n'ont pas été évaluées dans ce groupe d'âge et il existe un risque de développer une résistance au VIH. si SUSTIVA est sous-dosé. voir DOSAGE ET ADMINISTRATION pour les recommandations posologiques pour les patients pédiatriques.
Utilisation gériatrique
Les études cliniques de SUSTIVA 200 mg n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment des sujets plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement.
Insuffisance hépatique
SUSTIVA n'est pas recommandé chez les patients présentant une insuffisance hépatique modérée ou sévère car les données sont insuffisantes pour déterminer si un ajustement posologique est nécessaire. Les patients présentant une insuffisance hépatique légère peuvent être traités par l'éfavirenz sans aucun ajustement posologique. En raison du métabolisme important de l'éfavirenz médié par le cytochrome P450 et de l'expérience clinique limitée chez les patients atteints d'insuffisance hépatique, il convient d'être prudent lors de l'administration de SUSTIVA à ces patients [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Certains patients prenant accidentellement 600 mg deux fois par jour ont signalé une augmentation des symptômes du système nerveux. Un patient a présenté des contractions musculaires involontaires.
Le traitement d'un surdosage avec SUSTIVA 200 mg doit consister en des mesures générales de soutien, y compris la surveillance des signes vitaux et l'observation de l'état clinique du patient. L'administration de charbon actif peut être utilisée pour faciliter l'élimination du médicament non absorbé. Il n'existe pas d'antidote spécifique en cas de surdosage avec SUSTIVA. Étant donné que l'éfavirenz est fortement lié aux protéines, il est peu probable que la dialyse élimine de manière significative le médicament du sang.
CONTRE-INDICATIONS
- SUSTIVA est contre-indiqué chez les patients présentant une hypersensibilité cliniquement significative (par exemple, syndrome de Stevens-Johnson, érythème polymorphe ou éruptions cutanées toxiques) à l'un des composants de ce produit.
- L'administration concomitante d'efavirenz avec l'elbasvir et le grazoprevir est contre-indiquée [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
L'éfavirenz est un médicament antiviral [voir Microbiologie ].
Pharmacodynamie
Électrophysiologie cardiaque
L'effet de SUSTIVA 600 mg sur l'intervalle QTc a été évalué dans une étude ouverte, positive et contrôlée par placebo, à séquence unique, à 3 périodes et 3 traitements croisés sur l'intervalle QT chez 58 sujets sains enrichis pour les polymorphismes CYP2B6. La Cmax moyenne de l'éfavirenz chez les sujets porteurs du génotype CYP2B6 *6/*6 suite à l'administration d'une dose quotidienne de 600 mg pendant 14 jours était 2,25 fois supérieure à la Cmax moyenne observée chez les sujets porteurs du génotype CYP2B6 *1/*1. Une relation positive entre la concentration d'éfavirenz et l'allongement de l'intervalle QTc a été observée. Sur la base de la relation concentration-QTc, l'allongement moyen de l'intervalle QTc et son intervalle de confiance à 90 % supérieur sont de 8,7 ms et 11,3 ms chez les sujets de génotype CYP2B6*6/*6 après l'administration d'une dose quotidienne de 600 mg pendant 14 jours [voir AVERTISSEMENTS ET PRECAUTIONS ].
Pharmacocinétique
Absorption
Des concentrations plasmatiques maximales d'éfavirenz de 1,6 à 9,1 μM ont été atteintes 5 heures après l'administration de doses orales uniques de 100 mg à 1 600 mg à des volontaires non infectés. Des augmentations liées à la dose de la Cmax et de l'ASC ont été observées pour des doses allant jusqu'à 1 600 mg ; les augmentations étaient moins que proportionnelles suggérant une diminution de l'absorption à des doses plus élevées.
Chez les patients infectés par le VIH-1 à l'état d'équilibre, la Cmax moyenne, la Cmin moyenne et l'ASC moyenne étaient proportionnelles à la dose après des doses quotidiennes de 200 mg, 400 mg et 600 mg. Le temps jusqu'au pic des concentrations plasmatiques était d'environ 3 à 5 heures et les concentrations plasmatiques à l'état d'équilibre étaient atteintes en 6 à 10 jours. Chez 35 patients recevant SUSTIVA 600 mg une fois par jour, la Cmax à l'état d'équilibre était de 12,9 ± 3,7 μM (moyenne ± ET), la Cmin à l'état d'équilibre était de 5,6 ± 3,2 μM et l'ASC était de 184 ± 73 μM•h.
Effet de la nourriture sur l'absorption orale :
Gélules
Administration d'une dose unique de 600 mg de gélules d'éfavirenz avec un repas riche en graisses/haute teneur en calories (894 kcal, 54 g de matières grasses, 54 % de calories provenant des graisses) ou un repas faible en graisses/normalement calorique (440 kcal, 2 g lipides, 4 % de calories provenant des lipides) était associée à une augmentation moyenne de 22 % et 17 % de l'ASC∞ de l'efavirenz et à une augmentation moyenne de 39 % et 51 % de la Cmax de l'efavirenz, respectivement, par rapport aux expositions obtenues lorsqu'il était administré à jeun . [voir DOSAGE ET ADMINISTRATION et INFORMATIONS PATIENTS .]
Comprimés
L'administration d'un seul comprimé d'éfavirenz à 600 mg avec un repas riche en graisses/riche en calories (environ 1000 kcal, 500-600 kcal provenant des graisses) a été associée à une augmentation de 28 % de l'ASC∞ moyenne de l'éfavirenz et à une augmentation de 79 % de la moyenne Cmax de l'éfavirenz par rapport aux expositions obtenues à jeun. [voir DOSAGE ET ADMINISTRATION et INFORMATIONS PATIENTS .]
Biodisponibilité du contenu de la gélule mélangé avec des véhicules alimentaires
Chez des sujets adultes en bonne santé, l'ASC de l'éfavirenz lorsqu'il est administré sous forme de contenu de trois gélules de 200 mg mélangées à 2 cuillères à café de certains véhicules alimentaires (compote de pommes, gelée de raisin ou yaourt, ou préparation pour nourrissons) a répondu aux critères de bioéquivalence pour l'ASC de la formulation de gélule intacte administrée dans des conditions de jeûne.
Distribution
L'éfavirenz est fortement lié (environ 99,5 à 99,75 %) aux protéines plasmatiques humaines, principalement l'albumine. Chez les patients infectés par le VIH-1 (n = 9) ayant reçu SUSTIVA 200 à 600 mg une fois par jour pendant au moins un mois, les concentrations dans le liquide céphalo-rachidien variaient de 0,26 à 1,19 % (moyenne 0,69 %) de la concentration plasmatique correspondante. Cette proportion est environ 3 fois plus élevée que la fraction non liée aux protéines (libre) de l'éfavirenz dans le plasma.
Métabolisme
Des études chez l'homme et des études in vitro utilisant des microsomes hépatiques humains ont démontré que l'éfavirenz est principalement métabolisé par le système du cytochrome P450 en métabolites hydroxylés avec une glucuronidation ultérieure de ces métabolites hydroxylés. Ces métabolites sont essentiellement inactifs contre le VIH-1. Les études in vitro suggèrent que le CYP3A et le CYP2B6 sont les principales isoenzymes responsables du métabolisme de l'éfavirenz.
Il a été démontré que l'éfavirenz induisait les enzymes CYP, entraînant l'induction de son propre métabolisme. Des doses multiples de 200 à 400 mg par jour pendant 10 jours ont entraîné une accumulation plus faible que prévu (22 à 42 % de moins) et une demi-vie terminale plus courte de 40 à 55 heures (demi-vie à dose unique de 52 à 76 heures ).
Élimination
L'éfavirenz a une demi-vie terminale de 52 à 76 heures après des doses uniques et de 40 à 55 heures après des doses multiples. Une étude d'un mois sur le bilan massique/l'excrétion a été menée à l'aide de 400 mg par jour avec une dose marquée au C administrée le jour 8. Environ 14 à 34 % du radiomarqueur ont été récupérés dans l'urine et 16 à 61 % ont été récupérés dans les fèces. . Presque toute l'excrétion urinaire du médicament radiomarqué était sous forme de métabolites. L'éfavirenz représentait la majorité de la radioactivité totale mesurée dans les matières fécales.
Populations particulières
Pédiatrique
Les paramètres pharmacocinétiques de l'éfavirenz à l'état d'équilibre chez les patients pédiatriques ont été prédits par un modèle pharmacocinétique de population et sont résumés dans le tableau 6 par tranches de poids correspondant aux doses recommandées.
Genre et race
La pharmacocinétique de l'éfavirenz chez les patients semble être similaire entre les hommes et les femmes et parmi les groupes raciaux étudiés.
Insuffisance rénale
La pharmacocinétique de l'éfavirenz n'a pas été étudiée chez les insuffisants rénaux ; cependant, moins de 1 % de l'éfavirenz est excrété sous forme inchangée dans l'urine, de sorte que l'impact de l'insuffisance rénale sur l'élimination de l'éfavirenz devrait être minime.
Insuffisance hépatique
Une étude à doses multiples n'a montré aucun effet significatif sur la pharmacocinétique de l'éfavirenz chez les patients atteints d'insuffisance hépatique légère (Child-Pugh Classe A) par rapport aux témoins. Il n'y avait pas suffisamment de données pour déterminer si une insuffisance hépatique modérée ou sévère (classe Child-Pugh B ou C) affecte la pharmacocinétique de l'éfavirenz.
Études sur les interactions médicamenteuses
Il a été démontré in vivo que l'éfavirenz provoque une induction enzymatique hépatique, augmentant ainsi la biotransformation de certains médicaments métabolisés par le CYP3A et le CYP2B6. Des études in vitro ont montré que l'éfavirenz inhibait les isoenzymes CYP 2C9 et 2C19 avec des valeurs de Ki (8,5-17 μM) dans la plage des concentrations plasmatiques d'éfavirenz observées. Dans les études in vitro, l'éfavirenz n'a pas inhibé le CYP2E1 et a inhibé le CYP2D6 et le CYP1A2 (valeurs Ki 82-160 μM) uniquement à des concentrations bien supérieures à celles obtenues cliniquement. L'administration concomitante d'éfavirenz avec des médicaments principalement métabolisés par les isoenzymes CYP2C9, CYP2C19, CYP3A ou CYP2B6 peut entraîner une modification des concentrations plasmatiques du médicament coadministré. On s'attendrait à ce que les médicaments qui induisent l'activité du CYP3A et du CYP2B6 augmentent la clairance de l'éfavirenz, entraînant une diminution des concentrations plasmatiques.
Des études d'interaction médicamenteuse ont été réalisées avec l'éfavirenz et d'autres médicaments susceptibles d'être co-administrés ou des médicaments couramment utilisés comme sondes pour l'interaction pharmacocinétique. Les effets de la co-administration d'éfavirenz sur la Cmax, l'ASC et la Cmin sont résumés dans le Tableau 7 (effet de l'éfavirenz sur d'autres médicaments) et le Tableau 8 (effet d'autres médicaments sur l'éfavirenz). Pour plus d'informations sur les recommandations cliniques, voir INTERACTIONS MÉDICAMENTEUSES .
Microbiologie
Mécanisme d'action
L'éfavirenz est un INNTI du VIH-1. L'activité de l'éfavirenz est médiée principalement par l'inhibition non compétitive de la transcriptase inverse du VIH-1. La transcriptase inverse du VIH-2 et les ADN polymérases cellulaires humaines α, β, γ et δ ne sont pas inhibées par l'éfavirenz.
Activité antivirale en culture cellulaire
La concentration d'éfavirenz inhibant la réplication des souches de type sauvage adaptées au laboratoire et des isolats cliniques en culture cellulaire de 90 à 95 % (EC90-95) variait de 1,7 à 25 nM dans les lignées cellulaires lymphoblastoïdes, les cellules mononucléaires du sang périphérique (PBMC) et les macrophages. /cultures de monocytes. L'éfavirenz a démontré une activité antivirale contre le clade B et la plupart des isolats non-clade B (sous-types A, AE, AG, C, D, F, G, J, N), mais avait une activité antivirale réduite contre les virus du groupe O. L'éfavirenz a démontré une activité antivirale additive sans cytotoxicité contre le VIH-1 en culture cellulaire lorsqu'il est associé aux INNTI delavirdine et névirapine, aux INTI (abacavir, didanosine, emtricitabine, lamivudine, stavudine, ténofovir, zalcitabine, zidovudine), aux IP (amprénavir, indinavir, lopinavir, nelfinavir, ritonavir, saquinavir) et l'enfuvirtide, un inhibiteur de fusion. L'éfavirenz a démontré une activité antivirale additive à antagoniste en culture cellulaire avec l'atazanavir. L'éfavirenz n'a pas été antagoniste avec l'adéfovir, utilisé pour le traitement de l'infection par le virus de l'hépatite B, ou la ribavirine, utilisée en association avec l'interféron pour le traitement de l'infection par le virus de l'hépatite C.
La résistance
En culture cellulaire
En culture cellulaire, des isolats de VIH-1 présentant une sensibilité réduite à l'éfavirenz (augmentation >380 fois de la valeur EC90) ont émergé rapidement en présence de médicament. La caractérisation génotypique de ces virus a identifié des substitutions d'acides aminés simples L100I ou V179D, des substitutions doubles L100I/V108I et des substitutions triples L100I/V179D/Y181C dans la transcriptase inverse.
Etudes cliniques
Des isolats cliniques présentant une sensibilité réduite en culture cellulaire à l'éfavirenz ont été obtenus. Une ou plusieurs substitutions aux positions d'acides aminés 98, 100, 101, 103, 106, 108, 188, 190, 225 et 227 dans la transcriptase inverse ont été observées chez des patients en échec du traitement par l'éfavirenz en association avec l'indinavir ou avec la zidovudine plus lamivudine. La substitution K103N a été la plus fréquemment observée. La surveillance de la résistance à long terme (moyenne de 52 semaines, plage de 4 à 106 semaines) a analysé 28 isolats de référence et d'échec virologique correspondants. Soixante et un pour cent (17/28) de ces isolats ayant échoué présentaient une diminution de la sensibilité à l'efavirenz en culture cellulaire avec une variation médiane de 88 fois la sensibilité à l'efavirenz (valeur CE50) par rapport à la référence. La substitution NNRTI la plus fréquente à se développer dans ces isolats de patients était K103N (54 %). Les autres substitutions INNTI qui se sont développées comprenaient L100I (7 %), K101E/Q/R (14 %), V108I (11 %), G190S/T/A (7 %), P225H (18 %), et M230I/L (11 %).
Résistance croisée
Une résistance croisée parmi les INNTI a été observée. Les isolats cliniques précédemment caractérisés comme résistants à l'éfavirenz étaient également phénotypiquement résistants en culture cellulaire à la delavirdine et à la névirapine par rapport au départ. Les isolats viraux cliniques résistants à la délavirdine et/ou à la névirapine avec des substitutions associées à la résistance aux INNTI (A98G, L100I, K101E/P, K103N/S, V106A, Y181X, Y188X, G190X, P225H, F227L ou M230L) ont montré une sensibilité réduite à l'éfavirenz en culture cellulaire. Plus de 90 % des isolats cliniques résistants aux INTI testés en culture cellulaire ont conservé leur sensibilité à l'éfavirenz.
Toxicologie animale
Des convulsions non soutenues ont été observées chez 6 des 20 singes recevant de l'éfavirenz à des doses produisant des valeurs plasmatiques d'ASC 4 à 13 fois supérieures à celles observées chez l'homme recevant la dose recommandée [voir AVERTISSEMENTS ET PRECAUTIONS ].
Etudes cliniques
Adultes
Étude 006 un essai randomisé ouvert comparant SUSTIVA (600 mg une fois par jour) + zidovudine (ZDV, 300 mg q12h) + lamivudine (LAM, 150 mg q12h) ou SUSTIVA (600 mg une fois par jour) + indinavir (IDV, 1000 mg q8h) avec indinavir (800 mg q8h) + zidovudine (300 mg q12h) + lamivudine (150 mg q12h). Douze cent soixante-six patients (âge moyen 36,5 ans [extrêmes 18-81], 60 % de race blanche, 83 % d'hommes) ont été recrutés. Tous les patients étaient naïfs d'éfavirenz, de lamivudine, d'INNTI et d'IP à l'entrée dans l'étude. Le nombre initial médian de cellules CD4+ était de 320 cellules/mm3 et le niveau médian initial d'ARN du VIH-1 était de 4,8 log copies/mL. Les résultats du traitement avec un dosage standard (limite de dosage 400 copies/mL) sur 48 et 168 semaines sont présentés dans le tableau 9. Les taux plasmatiques d'ARN du VIH ont été quantifiés avec un dosage standard (limite de dosage 400 copies/mL) et ultrasensible (limite de dosage 50 copies/mL) versions du test AMPLICOR HIV-1 MONITOR. Au cours de l'étude, la version 1.5 du test a été introduite en Europe pour améliorer la détection du virus non clade B.
Pour les patients traités par SUSTIVA + zidovudine + lamivudine, SUSTIVA + indinavir ou indinavir + zidovudine + lamivudine, le pourcentage de répondeurs avec un ARN du VIH-1
ACTG 364 est une étude randomisée, en double aveugle, contrôlée par placebo, d'une durée de 48 semaines chez des patients ayant déjà reçu des INTI qui avaient terminé deux études ACTG antérieures. Cent quatre-vingt-seize patients (âge moyen 41 ans [intervalle 18-76], 74 % de race blanche, 88 % d'hommes) ont reçu des INTI en association avec SUSTIVA (600 mg une fois par jour) ou du nelfinavir (NFV, 750 mg trois fois par jour). ), ou SUSTIVA (600 mg une fois par jour) + nelfinavir de manière randomisée en double aveugle. Le nombre initial moyen de cellules CD4+ était de 389 cellules/mm3 et le taux moyen initial d'ARN du VIH-1 était de 8 130 copies/mL. Lors de leur entrée dans l'étude, tous les patients ont reçu un nouveau schéma thérapeutique INTI ouvert, qui dépendait de leur expérience antérieure de traitement INTI. Il n'y avait aucune différence significative dans le nombre moyen de cellules CD4+ entre les groupes de traitement; l'augmentation moyenne globale était d'environ 100 cellules à 48 semaines chez les patients qui ont poursuivi les schémas thérapeutiques à l'étude. Les résultats du traitement sont présentés dans le tableau 10. Les taux plasmatiques d'ARN du VIH ont été quantifiés avec le test AMPLICOR HIV-1 MONITOR en utilisant une limite inférieure de quantification de 500 copies/mL.
Une analyse de Kaplan-Meier du temps jusqu'à l'échec du traitement sur 72 semaines démontre une durée plus longue de suppression virologique (ARN du VIH
Patients pédiatriques
L'étude AI266922 est une étude en ouvert visant à évaluer la pharmacocinétique, l'innocuité, la tolérabilité et l'activité antivirale de SUSTIVA 200 mg en association avec la didanosine et l'emtricitabine chez des patients pédiatriques naïfs et expérimentés aux antirétroviraux. Trente-sept patients âgés de 3 mois à 6 ans (médiane 0,7 an) ont été traités par SUSTIVA. Au départ, l'ARN plasmatique médian du VIH-1 était de 5,88 log copies/mL, le nombre médian de cellules CD4+ était de 1144 cellules/mm3 et le pourcentage médian de CD4+ était de 25 %. La durée médiane du traitement à l'étude était de 60 semaines ; 27 % des patients ont arrêté avant la semaine 48. En utilisant une analyse ITT, les proportions globales de patients avec un ARN VIH
L'étude PACTG 1021 était une étude en ouvert visant à évaluer la pharmacocinétique, l'innocuité, la tolérabilité et l'activité antivirale de SUSTIVA 200 mg en association avec la didanosine et l'emtricitabine chez des patients pédiatriques naïfs de traitement antirétroviral. Quarante-trois patients âgés de 3 mois à 21 ans (médiane 9,6 ans) ont reçu SUSTIVA. Au départ, l'ARN plasmatique médian du VIH-1 était de 4,8 log copies/mL, le nombre médian de cellules CD4+ était de 367 cellules/mm3 et le pourcentage médian de CD4+ était de 18 %. La durée médiane du traitement à l'étude était de 181 semaines ; 16 % des patients ont arrêté avant la semaine 48. En utilisant une analyse ITT, les proportions globales de patients avec un ARN du VIH
L'étude PACTG 382 était une étude ouverte visant à évaluer la pharmacocinétique, l'innocuité, la tolérabilité et l'activité antivirale de SUSTIVA en association avec le nelfinavir et un INTI chez des patients pédiatriques n'ayant jamais reçu d'antirétroviraux et ayant déjà reçu un INTI. Cent deux patients âgés de 3 mois à 16 ans (médiane 5,7 ans) ont été traités par SUSTIVA. Quatre-vingt-sept pour cent des patients avaient déjà reçu un traitement antirétroviral. Au départ, l'ARN plasmatique médian du VIH-1 était de 4,57 log copies/mL, le nombre médian de cellules CD4+ était de 755 cellules/mm3 et le pourcentage médian de CD4+ était de 30 %. La durée médiane du traitement à l'étude était de 118 semaines ; 25 % des patients ont arrêté avant la semaine 48. En utilisant une analyse ITT, la proportion globale de patients avec un ARN VIH
INFORMATIONS PATIENTS
SUSTIVA® (sus-TEE-vah) (éfavirenz) gélules
SUSTIVA® (sus-TEE-vah) (éfavirenz) comprimés
Important : Demandez à votre médecin ou à votre pharmacien quels médicaments ne doivent pas être pris avec SUSTIVA. Pour plus d'informations, consultez la rubrique « Que dois-je dire à mon médecin avant de prendre SUSTIVA ? »
Lisez ces informations patient avant de commencer à prendre SUSTIVA et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre médecin au sujet de votre état de santé ou de votre traitement.
Qu'est-ce que SUSTIVA ?
SUSTIVA 600 mg est un médicament sur ordonnance contre le VIH-1 (virus de l'immunodéficience humaine de type 1) utilisé avec d'autres médicaments antirétroviraux pour traiter l'infection par le VIH-1 chez les adultes et les enfants âgés d'au moins 3 mois et pesant au moins 7 livres 12 onces (3,5 kg). Le VIH est le virus qui cause le SIDA (syndrome d'immunodéficience acquise).
On ne sait pas si SUSTIVA est sûr et efficace chez les enfants de moins de 3 mois ou qui pèsent moins de 7 livres 12 onces (3,5 kg).
Lorsqu'il est utilisé avec d'autres médicaments antirétroviraux pour traiter l'infection par le VIH-1, SUSTIVA 600 mg peut aider à :
- réduire la quantité de VIH-1 dans votre sang. C'est ce qu'on appelle la charge virale.
- augmenter le nombre de cellules CD4+ (T) dans votre sang qui aident à combattre d'autres infections.
Réduire la quantité de VIH-1 et augmenter le nombre de cellules CD4+ (T) dans votre sang peut aider à améliorer votre système immunitaire. Cela peut réduire votre risque de décès ou de contracter des infections qui peuvent survenir lorsque votre système immunitaire est affaibli (infections opportunistes).
SUSTIVA 600 mg ne guérit pas l'infection par le VIH-1 ni le SIDA. Vous devez continuer à prendre des médicaments contre le VIH-1 pour contrôler l'infection par le VIH-1 et réduire les maladies liées au VIH.
Évitez de faire des choses qui peuvent transmettre l'infection par le VIH-1 à d'autres :
- Ne partagez pas et ne réutilisez pas les aiguilles ou tout autre matériel d'injection.
- Ne partagez pas d'objets personnels qui peuvent contenir du sang ou des liquides organiques, comme des brosses à dents et des lames de rasoir.
- N'ayez aucun type de rapport sexuel sans protection. Pratiquez toujours des rapports sexuels protégés en utilisant un préservatif en latex ou en polyuréthane pour réduire les risques de contact sexuel avec des fluides corporels tels que le sperme, les sécrétions vaginales ou le sang.
Demandez à votre médecin si vous avez des questions sur la façon de prévenir la transmission du VIH à d'autres personnes.
Qui ne devrait pas prendre SUSTIVA 600 mg ?
Ne prenez pas SUSTIVA si vous êtes allergique à l'éfavirenz ou à l'un des ingrédients de SUSTIVA. Voir la fin de cette notice pour une liste complète des ingrédients de SUSTIVA.
Ne prenez pas SUSTIVA si vous prenez actuellement de l'elbasvir et du grazoprevir (ZEPATIER®).
Que dois-je dire à mon médecin avant de prendre SUSTIVA 200 mg ?
Avant de prendre SUSTIVA, informez votre médecin si vous avez des conditions médicales et en particulier, si vous :
- avoir une maladie cardiaque
- avez déjà eu un problème de santé mentale
- avez déjà consommé des drogues illicites ou de grandes quantités d'alcool
- avez des problèmes de foie, y compris une infection par le virus de l'hépatite B ou C
- avoir des antécédents de convulsions
- êtes enceinte ou envisagez de devenir enceinte. SUSTIVA 600 mg peut nuire à votre bébé à naître. Si vous êtes en mesure de devenir enceinte, votre fournisseur de soins de santé doit faire un test de grossesse avant de commencer SUSTIVA. Vous ne devez pas devenir enceinte pendant que vous prenez SUSTIVA et pendant 12 semaines après l'arrêt du traitement par SUSTIVA. Les femmes capables de devenir enceintes doivent utiliser 2 formes efficaces de contraception pendant le traitement et pendant 12 semaines après l'arrêt du traitement par SUSTIVA. Une forme barrière de contrôle des naissances doit toujours être utilisée avec un autre type de contrôle des naissances.
- Les formes barrières de contrôle des naissances peuvent inclure un préservatif en latex ou en polyuréthane, une éponge contraceptive, un diaphragme avec spermicide et une cape cervicale.
- Les formes hormonales de contrôle des naissances, telles que les pilules contraceptives, les injections, les anneaux vaginaux ou les implants peuvent ne pas fonctionner pendant le traitement par SUSTIVA.
- Discutez avec votre médecin des formes de contraception pouvant être utilisées pendant le traitement par SUSTIVA.
- Registre des grossesses. Il existe un registre des grossesses pour les femmes qui prennent des médicaments antirétroviraux pendant la grossesse. Le but de ce registre est de recueillir des informations sur votre santé et celle de votre bébé. Discutez avec votre médecin de la façon dont vous pouvez participer à ce registre.
- N'allaitez pas si vous prenez SUSTIVA.
- Vous ne devez pas allaiter si vous avez le VIH en raison du risque de transmission du VIH à votre bébé.
Informez votre médecin et votre pharmacien de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
SUSTIVA 600 mg peut affecter le mode d'action d'autres médicaments, et d'autres médicaments peuvent affecter le mode d'action de SUSTIVA 600 mg, et peut provoquer des effets secondaires graves. Si vous prenez certains médicaments avec SUSTIVA, la quantité de SUSTIVA 600 mg dans votre corps peut être trop faible et cela peut ne pas vous aider à contrôler votre infection par le VIH. Le virus du VIH présent dans votre corps peut devenir résistant à SUSTIVA ou à d'autres médicaments anti-VIH similaires.
Vous ne devez pas prendre SUSTIVA 600 mg si vous prenez ATRIPLA (éfavirenz, emtricitabine, fumarate de ténofovir disoproxil) à moins que votre médecin ne vous le dise.
Informez votre médecin et votre pharmacien de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Certains médicaments interagissent avec SUSTIVA.
Conservez une liste de vos médicaments pour la montrer à votre médecin et à votre pharmacien.
- Vous pouvez demander à votre médecin ou à votre pharmacien une liste des médicaments qui interagissent avec SUSTIVA.
- Ne commencez pas à prendre un nouveau médicament sans en parler à votre médecin. Votre médecin peut vous dire s'il est sécuritaire de prendre SUSTIVA avec d'autres médicaments.
Comment dois-je prendre SUSTIVA ?
- Prenez SUSTIVA 600 mg exactement comme votre médecin vous l'a indiqué.
- Ne modifiez pas votre dose et n'arrêtez pas de prendre SUSTIVA à moins que votre médecin ne vous le dise.
- Restez sous la surveillance de votre médecin pendant le traitement par SUSTIVA.
- SUSTIVA doit être utilisé avec d'autres médicaments antirétroviraux.
- Prenez SUSTIVA 1 fois par jour.
- SUSTIVA se présente sous forme de comprimés ou de gélules.
- Les comprimés de SUSTIVA ne doivent pas être cassés.
- Avalez les comprimés ou les gélules de SUSTIVA entiers avec un liquide.
Comment et quand prendre SUSTIVA.
- Vous devez prendre SUSTIVA 600 mg à jeun au coucher. La prise de SUSTIVA 200 mg avec de la nourriture augmente la quantité de médicament dans votre corps. Certains effets indésirables peuvent moins vous gêner si vous prenez SUSTIVA 600 mg à jeun et au coucher.
- Le médecin de votre enfant prescrira la bonne dose de SUSTIVA 200 mg en fonction du poids de votre enfant.
- Si vous avez des difficultés à avaler des comprimés ou des gélules, parlez-en à votre médecin. Votre médecin peut vous recommander d'ouvrir la gélule de SUSTIVA et d'en mélanger le contenu avec des aliments ou des préparations pour nourrissons. Voir les "Instructions d'utilisation" détaillées à la fin de ces informations destinées aux patients pour savoir comment prendre correctement SUSTIVA 600 mg en utilisant la méthode de saupoudrage de capsules.
- Les adultes et les enfants qui prennent SUSTIVA 600 mg en utilisant la méthode de saupoudrage de capsule ne doivent pas manger pendant 2 heures après avoir pris une dose de SUSTIVA.
- Les bébés ne doivent pas recevoir de lait maternisé pendant 2 heures après avoir pris une dose de SUSTIVA en utilisant la méthode de saupoudrage de capsule.
- Ne manquez pas une dose de SUSTIVA. Si vous oubliez de prendre SUSTIVA, prenez immédiatement la dose oubliée, sauf s'il est presque l'heure de votre prochaine dose. Ne prenez pas 2 doses à la fois. Prenez simplement votre prochaine dose à l'heure prévue. Si vous avez besoin d'aide pour planifier les meilleurs moments pour prendre votre médicament, demandez à votre médecin ou à votre pharmacien.
- Si vous avez pris trop de SUSTIVA, appelez votre médecin ou rendez-vous immédiatement aux urgences de l'hôpital le plus proche.
- Lorsque votre réserve de SUSTIVA 600 mg commence à s'épuiser, demandez-en davantage à votre médecin ou à votre pharmacie. Il est important de ne pas manquer de SUSTIVA. La quantité de VIH-1 dans votre sang peut augmenter si le médicament est arrêté même pour une courte période. Le virus peut devenir résistant à SUSTIVA 600 mg et plus difficile à traiter.
Quels sont les effets secondaires possibles de SUSTIVA ?
SUSTIVA 600 mg peut provoquer des effets indésirables graves, notamment :
Si vous avez des étourdissements, des problèmes de concentration ou de la somnolence, ne conduisez pas de voiture, n'utilisez pas de machines ou ne faites rien qui nécessite que vous soyez alerte.
Certains symptômes du système nerveux (par exemple, confusion, pensées et mouvements physiques lents, délires [fausses croyances] ou hallucinations [voir ou entendre des choses que les autres ne voient pas ou n'entendent pas]) peuvent survenir des mois ou des années après le début du traitement par SUSTIVA 600 mg. Communiquez rapidement avec votre fournisseur de soins de santé si l'un de ces symptômes survient.
Informez immédiatement votre médecin si vous présentez l'un des symptômes suivants :
- Problèmes de santé mentale graves peut survenir chez les personnes qui prennent SUSTIVA. Informez immédiatement votre médecin si vous présentez l'un des symptômes suivants :
- se sentir triste ou désespéré ne pas faire confiance aux autres
- se sentir anxieux ou agité entendre ou voir des choses qui ne sont pas réelles
- avez des pensées de vous faire du mal (suicide) ou avez essayé de vous faire du mal ou de faire du mal à d'autres
- ne sont pas capables de bouger ou de parler normalement
- ne sont pas capables de faire la différence entre ce qui est vrai ou réel et ce qui est faux ou irréel
- Symptômes du système nerveux sont fréquents chez les personnes qui prennent SUSTIVA 200 mg et peuvent être graves. Ces symptômes commencent généralement au cours du premier ou du deuxième jour de traitement par SUSTIVA 200 mg et disparaissent généralement après 2 à 4 semaines de traitement. Certains symptômes peuvent survenir des mois ou des années après le début du traitement par SUSTIVA. Ces symptômes peuvent s'aggraver si vous buvez de l'alcool, prenez un médicament pour des problèmes de santé mentale ou utilisez certaines drogues illicites pendant le traitement par SUSTIVA. Les symptômes peuvent inclure :
- vertiges
- difficulté à se concentrer
- troubles du sommeil
- somnolence
- rêves inhabituels
- manque de coordination ou difficulté d'équilibre
- Démangeaison de la peau est fréquent avec SUSTIVA 600 mg mais peut parfois être sévère. Les éruptions cutanées disparaissent généralement sans aucun changement de traitement. Si vous développez une éruption cutanée avec l'un des symptômes suivants, informez-en immédiatement votre médecin :
- éruption cutanée, avec ou sans démangeaisons
- peau qui pèle
- fièvre
- plaies buccales
- gonflement de votre visage
- yeux rouges ou enflammés, comme "l'œil rose" (conjonctivite)
- cloques ou lésions cutanées
- Problèmes de foie, y compris insuffisance hépatique et décès peut survenir chez les personnes qui prennent SUSTIVA. Des problèmes de foie peuvent survenir chez des personnes sans antécédents de problèmes de foie. Votre médecin effectuera des tests sanguins pour vérifier votre foie avant de commencer SUSTIVA 200 mg et pendant le traitement.
- votre peau ou la partie blanche de vos yeux devient jaune (jaunisse)
- vous n'avez pas envie de manger pendant plusieurs jours ou plus
- ton urine devient foncée
- vous avez mal au ventre (nausées)
- vos selles (selles) deviennent claires
- vous avez des douleurs au bas de l'estomac (abdominales)
- Saisies peut survenir chez les personnes qui prennent SUSTIVA. Les crises sont plus susceptibles de se produire si vous avez eu des crises dans le passé. Dites à votre médecin si vous avez eu une crise ou si vous prenez un médicament pour aider à prévenir les crises.
- Modifications de votre système immunitaire (syndrome de reconstitution immunitaire) peut survenir lorsque vous commencez à prendre des médicaments contre le VIH-1. Votre système immunitaire peut se renforcer et commencer à combattre des infections cachées depuis longtemps dans votre corps. Dites à votre médecin si vous commencez à avoir de nouveaux symptômes après avoir commencé votre traitement contre le VIH-1.
- Changements dans la graisse corporelle peut survenir chez les personnes qui prennent des médicaments contre le VIH-1. Ces changements peuvent inclure une augmentation de la quantité de graisse dans le haut du dos et du cou ("bosse de bison"), dans la poitrine et autour de la partie principale de votre corps (tronc). Une perte de graisse des jambes, des bras et du visage peut également se produire. La cause et les effets à long terme de ces affections sur la santé ne sont pas connus.
Les effets secondaires les plus courants de SUSTIVA 600 mg incluent :
- éruption
- rêves anormaux
- vertiges
- fatigue
- nausée
- troubles du sommeil
- mal de tête
- vomissement
- difficulté de concentration
Certains patients prenant SUSTIVA ont présenté une augmentation des taux de lipides (cholestérol et triglycérides) dans le sang. Dites à votre médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de SUSTIVA. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver SUSTIVA ?
- Conservez les gélules et les comprimés SUSTIVA à température ambiante entre 68 °F et 77 °F (20 °C et 25 °C).
Gardez SUSTIVA et tous les médicaments hors de la portée des enfants.
Informations générales sur SUSTIVA
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans une notice d'information destinée aux patients. N'utilisez pas SUSTIVA 600 mg pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas SUSTIVA 600 mg à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Si vous souhaitez plus d'informations, parlez-en à votre médecin. Vous pouvez demander à votre pharmacien ou à votre médecin des informations sur SUSTIVA destinées aux professionnels de la santé. Pour plus d'informations, rendez-vous sur www.sustiva.com ou appelez le 1-800-321-1335.
Quels sont les ingrédients de SUSTIVA ?
Ingrédient actif: éfavirenz
Ingrédients inactifs:
Gélules SUSTIVA 600mg : lactose monohydraté, stéarate de magnésium, laurylsulfate de sodium et glycolate d'amidon sodique. L'enveloppe de la gélule contient de la gélatine, du laurylsulfate de sodium, du dioxyde de titane et/ou de l'oxyde de fer jaune. L'enveloppe de la capsule peut également contenir du dioxyde de silicium. Les gélules sont imprimées avec de l'encre contenant du bleu carmin 40, du bleu FD&C n° 2 et du dioxyde de titane.
Comprimés SUSTIVA : croscarmellose sodique, hydroxypropylcellulose, lactose monohydraté, stéarate de magnésium, cellulose microcristalline et laurylsulfate de sodium. Le pelliculage du comprimé contient Opadry Yellow et Opadry Clear. Les comprimés sont polis à la cire de carnauba et imprimés à l'encre violette, Opacode WB.
Ces informations destinées aux patients ont été approuvées par la Food and Drug Administration des États-Unis.
Mode d'emploi
SUSTIVA® (sus-TEE-vah) (éfavirenz) gélules
Préparation d'une dose de SUSTIVA 600mg en utilisant la méthode de saupoudrage de capsule
Lisez ce mode d'emploi avant de préparer votre première dose de SUSTIVA mélangé avec de la nourriture ou du lait maternisé en utilisant la méthode de saupoudrage de la capsule, chaque fois que vous recevez une recharge et au besoin. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre médecin au sujet de votre état de santé ou de votre traitement. Demandez à votre médecin ou à votre pharmacien si vous avez des questions sur la façon de mélanger ou d'administrer une dose de SUSTIVA 200 mg en utilisant la méthode de saupoudrage de capsule.
Une information important:
- Pour plus d'informations sur les gélules de SUSTIVA 600 mg, consultez la notice d'information destinée aux patients.
- La méthode de saupoudrage de gélules pour mélanger le contenu des gélules SUSTIVA avec des aliments mous ou des préparations pour nourrissons peut être utilisée pour les adultes ou les enfants qui ne peuvent pas avaler des gélules ou des comprimés.
- Vous devez prendre SUSTIVA 600 mg à jeun au coucher.
- Vous ne devez pas manger pendant 2 heures après avoir pris SUSTIVA mélangé avec de la nourriture.
- Les bébés qui sont assez âgés pour avaler de la nourriture doivent recevoir SUSTIVA en utilisant la méthode de saupoudrage de capsules mélangées avec de la nourriture plutôt qu'avec du lait maternisé.
- Discutez avec votre médecin pour vous aider à décider du meilleur calendrier pour donner à votre bébé SUSTIVA mélangé à une préparation pour nourrissons en utilisant la méthode de saupoudrage de capsules.
Préparation d'une dose de SUSTIVA 600 mg mélangée à de la nourriture en utilisant la méthode de saupoudrage de capsule.
Avant de préparer une dose de SUSTIVA 200 mg mélangée à de la nourriture en utilisant la méthode de saupoudrage en capsule, rassemblez les fournitures suivantes :
- serviettes en papier
- cuillère à café pour mesurer
- petite cuillère pour remuer et nourrir
- petit contenant propre (comme un petit tasse ou bol)
- aliments mous comme la compote de pommes, la gelée de raisin ou le yogourt
Étape 1. Choisissez une surface de travail propre et plane. Placez une serviette en papier propre sur la surface de travail. Ensuite, placez les autres fournitures sur la serviette en papier.
Étape 2. Bien se laver et se sécher les mains.
Étape 3. Placez 1 à 2 cuillères à café d'aliments mous comme de la compote de pommes, de la gelée de raisin ou du yaourt dans le petit récipient (voir Figure A ). La couleur et l'épaisseur des aliments peuvent changer lorsqu'ils sont mélangés avec le médicament.
Figure A
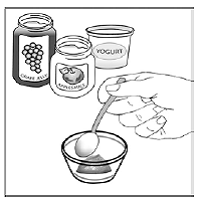
Étape 4. Il y a 2 parties de la capsule SUSTIVA 200mg. Regardez la capsule SUSTIVA pour voir quelle partie de la capsule chevauche l'autre partie (voir Figure B ).
Figure B
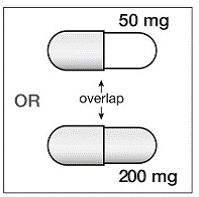
Étape 5. Tenez la capsule SUSTIVA dans une position latérale (horizontale) directement au-dessus du récipient de nourriture. Tenez chaque extrémité de la gélule SUSTIVA entre vos pouces et vos index (index) (voir Figure C ).
Figure C
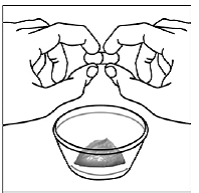
Étape 6. Utilisez votre pouce et votre index pour pincer près de l'extrémité de la partie qui se chevauche de la gélule de SUSTIVA 600 mg (voir Figure D ).
Figure D
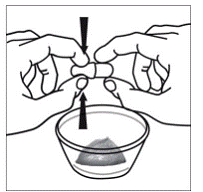
Ensuite, tournez soigneusement les deux extrémités de la gélule de SUSTIVA 600 mg dans des directions opposées pour l'ouvrir (voir Figure E ). Veillez à ne pas renverser le contenu de la gélule ou à le répandre dans l'air.
Figure E

Étape 7. Saupoudrer le contenu de la gélule SUSTIVA sur les aliments (voir Figure F ).
- Vérifiez les enveloppes des gélules pour vous assurer qu'elles sont vides.
- Jetez les enveloppes de gélules vides.
Figure F

Si la dose totale prescrite est supérieure à 1 capsule, suivez les étapes 4 à 7 pour chaque capsule. N'ajoutez pas plus de nourriture.
Les étapes 8 à 11 doivent être complétées dans les 30 minutes de mélanger le médicament (voir Chiffre G ).
Chiffre G

Étape 8. Utilisez la petite cuillère pour mélanger délicatement le contenu de la gélule et les aliments (voir Chiffre H ). Les vermicelles ne se dissolvent pas. Le mélange aura l'air granuleux mais ne devrait pas être grumeleux.
Chiffre H
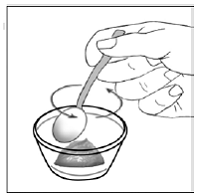
Étape 9. Utilisez la petite cuillère pour donner ou prendre le mélange de nourriture et de contenu de la gélule. Assurez-vous que tout le mélange est avalé.
Étape 10. Ajoutez environ 2 cuillères à café de plus de nourriture dans le récipient vide et remuez doucement avec la petite cuillère pour mélanger avec tout contenu de capsule qui peut encore être dans le récipient.
Étape 11. Utilisez la petite cuillère pour donner ou prendre le mélange de nourriture et de contenu de la gélule. Assurez-vous que tout le mélange est avalé.
Étape 12. Lavez le récipient et les cuillères. Jetez la serviette en papier et nettoyez la surface de travail. Lavez-vous les mains.
Préparation d'une dose de SUSTIVA 600 mg mélangée à une préparation pour nourrissons en utilisant la méthode de saupoudrage de capsules
Pour vous assurer que votre bébé reçoit tout le médicament, ne donnez pas le contenu de la capsule SUSTIVA à votre bébé dans un biberon.
Avant de préparer une dose de SUSTIVA mélangée à une préparation pour nourrissons en utilisant la méthode de saupoudrage de capsules, rassemblez les fournitures suivantes :
- serviettes en papier
- cuillère à café pour remuer et mesurer
- petit contenant propre (comme un petit tasse ou bol) (voir Je figure ).
- Seringue doseuse orale de 10 mL (demandez-la à votre pharmacien) (voir Je figure ).
- lait maternisé à température ambiante.
Je figure
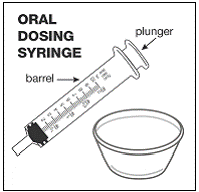
Étape 1. Préparez la préparation pour nourrissons selon les instructions sur l'emballage de la préparation pour nourrissons. Vous utiliserez environ 1 once de formule pour administrer le médicament. Toute formule restante ne doit pas être donnée à l'enfant pendant 2 heures.
Étape 2. Choisissez une surface de travail propre et plane. Placez une serviette en papier propre sur la surface de travail. Placez les fournitures dont vous aurez besoin sur la serviette en papier.
Étape 3. Bien se laver et se sécher les mains.
Étape 4. Versez 2 cuillères à café de lait maternisé à température ambiante dans le récipient (voir Figure J ).
Figure J
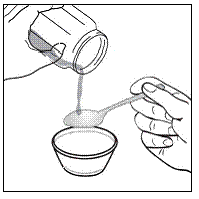
Étape 5. Il y a 2 parties de la capsule SUSTIVA. Regardez la capsule SUSTIVA pour voir quelle partie de la capsule chevauche l'autre partie (voir Figure K ).
Figure K
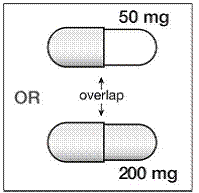
Étape 6. Tenez la capsule SUSTIVA dans une position latérale (horizontale) directement au-dessus du récipient avec la préparation pour nourrissons. Tenez chaque extrémité de la gélule de SUSTIVA 600 mg entre vos pouces et vos index (pointeurs) (voir Chiffre L ).
Chiffre L
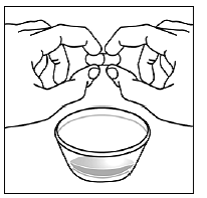
Étape 7. Utilisez votre pouce et votre index pour pincer près de l'extrémité de la partie qui se chevauche de la capsule SUSTIVA (voir Figure M ).
Figure M
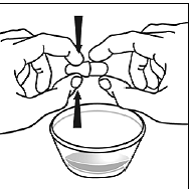
Ensuite, tournez soigneusement les deux extrémités de la capsule SUSTIVA dans des directions opposées pour l'ouvrir (voir Chiffre N ). Veillez à ne pas renverser le contenu de la gélule ou à le répandre dans l'air.
Chiffre N
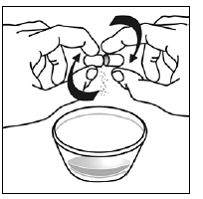
Étape 8. Saupoudrez le contenu de la gélule de SUSTIVA 600 mg sur le lait maternisé (voir Chiffre O ).
- Vérifiez les enveloppes des gélules pour vous assurer qu'elles sont vides.
- Jetez les enveloppes de gélules vides.
Chiffre O
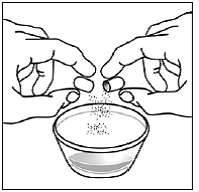
Si la dose totale prescrite est supérieure à 1 capsule, suivez les étapes 5 à 8 pour chaque capsule. N'ajoutez plus de lait maternisé.
Les étapes 9 à 12 doivent être complétées dans les 30 minutes de mélanger le médicament (voir Chiffre P ).
Chiffre P

Étape 9. Tenez le récipient d'une main. De l'autre main, utilisez la cuillère à café pour mélanger délicatement le contenu de la gélule et le lait maternisé (voir Chiffre Q ). Les vermicelles ne se dissolvent pas. Le mélange aura l'air granuleux mais ne devrait pas être grumeleux.
Chiffre Q
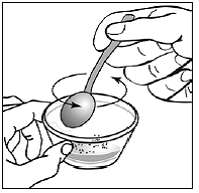
Étape 10. Pour aspirer tout le mélange dans la seringue doseuse orale :
Figure R
Les figures
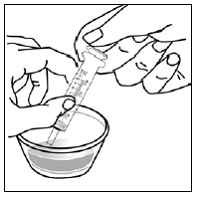
Figure T
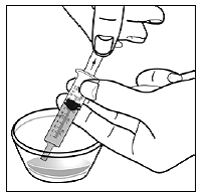
- Vérifiez que le piston est complètement enfoncé dans le corps de la seringue (voir Figure R ).
- Placer le bout de la seringue dans le mélange contenu dans le récipient (voir Les figures ).
- Tirez lentement sur le piston et aspirez tout le mélange (voir Figure T ).
Étape 11. Placez le bout de la seringue dans la bouche de votre bébé le long de l'intérieur de la joue (voir Figure U ). Poussez lentement sur le piston pour donner à votre bébé tout le mélange.
Figure U
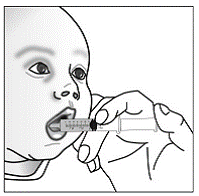
Étape 12. Pour vous assurer que tous les médicaments sont administrés à votre bébé :
- Répétez l'étape 4 ci-dessus.
- Remuer avec une cuillère à café.
- Ensuite, répétez Étapes 10 et 11 ci-dessus (voir Chiffre V ).
Chiffre V
Étape 13. Retirez le piston de la seringue doseuse orale. Lavez le récipient, la cuillère à thé et la seringue doseuse orale. Laissez sécher le piston et le corps de la seringue avant de les remonter.
Étape 14. Jetez la serviette en papier et nettoyez la surface de travail. Lavez-vous les mains.
Comment dois-je conserver les gélules de SUSTIVA 600 mg ?
- Conservez les gélules SUSTIVA à température ambiante entre 68 °F et 77 °F (20 °C et 25 °C).
Conservez les gélules de SUSTIVA 600 mg et tous les médicaments hors de la portée des enfants.
Ce mode d'emploi a été approuvé par la Food and Drug Administration des États-Unis.
