Acyclovir cream 5% 10g, 5g Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que la crème Zovirax et comment est-elle utilisée ?
La crème Zovirax est un médicament sur ordonnance utilisé pour traiter les symptômes des boutons de fièvre (herpès labial) et de l'herpès génital. La crème Zovirax peut être utilisée seule ou avec d'autres médicaments.
La crème Zovirax appartient à une classe de médicaments appelés antiviraux.
On ne sait pas si la crème Zovirax est sûre et efficace chez les enfants de moins de 12 ans.
Quels sont les effets secondaires possibles de la crème Zovirax?
La crème Zovirax peut provoquer des effets secondaires graves, notamment :
- ecchymoses ou saignements faciles,
- taches violettes ou rouges sous la peau,
- peu ou pas de miction,
- miction douloureuse ou difficile,
- gonflement des pieds ou des chevilles,
- se sentir fatigué, et
- essoufflement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de la crème Zovirax comprennent :
- nausée,
- vomissement,
- diarrhée,
- malaise général,
- maux de tête, et
- douleur buccale lors de l'utilisation d'un comprimé buccal d'acyclovir
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de la crème Zovirax. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
ZOVIRAX est le nom de marque de l'acyclovir, un analogue nucléosidique synthétique actif contre les virus de l'herpès. La crème ZOVIRAX à 5 % est une formulation pour administration topique.
Le nom chimique de l'acyclovir est 2-amino-1,9-dihydro-9-[(2-hydroxyéthoxy)méthyl]-6H-purin-6-one ; il a la formule structurale suivante :
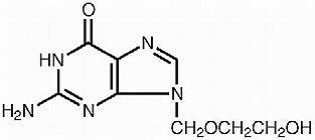
L'acyclovir est une poudre cristalline blanche de formule moléculaire C8H11N5O3 et d'un poids moléculaire de 225. La solubilité maximale dans l'eau à 37 °C est de 2,5 mg/mL. Les pKa de l'acyclovir sont de 2,27 et 9,25.
Chaque gramme de crème ZOVIRAX à 5 % contient 50 mg d'acyclovir et les ingrédients inactifs suivants : alcool cétostéarylique, huile minérale, poloxamer 407, propylèneglycol, laurylsulfate de sodium, eau et vaseline blanche.
LES INDICATIONS
La crème ZOVIRAX est un inhibiteur de l'ADN polymérase analogue désoxynucléoside du virus de l'herpès simplex (HSV) indiqué pour le traitement de l'herpès labial récurrent (herpès labial) chez les adultes et les adolescents immunocompétents de 12 ans et plus.
DOSAGE ET ADMINISTRATION
La crème ZOVIRAX doit être appliquée 5 fois par jour pendant 4 jours. Le traitement doit être initié le plus tôt possible après l'apparition des signes ou des symptômes de l'herpès labial, c'est-à-dire pendant le prodrome ou lors de l'apparition des lésions.
Pour les adolescents de 12 ans et plus, la posologie est la même que pour les adultes.
COMMENT FOURNIE
Formes posologiques et points forts
Chaque gramme de crème ZOVIRAX contient 50 mg (équivalent à 5 % p/p) d'acyclovir.
Stockage et manutention
Chaque gramme de crème ZOVIRAX contient 50 mg (équivalent à 5 % p/p) d'acyclovir dans une base de crème aqueuse. La crème ZOVIRAX est fournie comme suit :
CDN 0187-0994-45 : tubes de 5 g
Conserver à ou en dessous de 25°C (77°F); les excursions permises à 15° à 30°C (59° à 86°F) [voient USP la Température de Pièce Contrôlée].
Distribué par : Bausch Health US, LLC Bridgewater, NJ 08807 USA. Fabriqué par : Bausch Health Companies Inc. Laval, Québec H7L 4A8, Canada. Révisé : décembre 2020
EFFETS SECONDAIRES
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
Dans cinq essais à double insu contrôlés par placebo, 1124 patients ont été traités avec la crème ZOVIRAX et 1161 avec la crème placebo (véhicule). Des réactions locales au site d'application ont été signalées par 5 % des patients recevant la crème ZOVIRAX et 4 % des patients recevant le placebo. Les effets indésirables les plus courants au site d'application topique étaient les lèvres sèches, la desquamation, la sécheresse de la peau, les lèvres craquelées, la peau brûlante, le prurit, la desquamation de la peau et les picotements sur la peau; chaque effet indésirable est survenu chez moins de 1 % des patients recevant la crème ZOVIRAX et le placebo. Trois patients sous crème ZOVIRAX et un patient sous placebo ont arrêté le traitement en raison d'un événement indésirable.
Une étude supplémentaire, portant sur 22 adultes en bonne santé, a été menée pour évaluer la tolérance cutanée de la crème ZOVIRAX par rapport au véhicule en utilisant une méthodologie de test de patch occlus et semi-occlus. La crème ZOVIRAX et le placebo ont tous deux montré un potentiel d'irritation élevé et cumulatif. Une autre étude, portant sur 251 adultes en bonne santé, a été menée pour évaluer le potentiel de sensibilisation de contact de la crème ZOVIRAX en utilisant une méthodologie de test épicutané répété. Sur 202 sujets évaluables, d'éventuelles réactions de sensibilisation cutanée ont été observées chez les mêmes 4 sujets (2 %) avec à la fois la crème ZOVIRAX et le placebo, et ces réactions à la fois à la crème ZOVIRAX et au placebo ont été confirmées chez 3 sujets lors d'une nouvelle provocation. Le ou les ingrédients sensibilisants n'ont pas été identifiés.
Le profil de sécurité chez les patients âgés de 12 à 17 ans était similaire à celui observé chez les adultes.
Expérience post-commercialisation
En plus des événements défavorables annoncés des essais cliniques, les événements suivants ont été identifiés pendant l'utilisation de postapprobation de crème acyclovir. Parce qu'ils sont signalés volontairement à partir d'une population de taille inconnue, les estimations de fréquence ne peuvent pas être faites. Ces événements ont été choisis pour inclusion en raison d'une combinaison de leur gravité, de leur fréquence de signalement ou de leur lien causal potentiel avec la crème d'acyclovir.
Général: Angiœdème, anaphylaxie.
Peau: Dermatite de contact, eczéma.
INTERACTIONS MÉDICAMENTEUSES
L'expérience clinique n'a identifié aucune interaction résultant de l'administration topique ou systémique d'autres médicaments en concomitance avec la crème ZOVIRAX. En raison de l'absorption systémique minimale de la crème ZOVIRAX, les interactions médicamenteuses systémiques sont peu probables.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Général
La crème ZOVIRAX ne doit être appliquée que sur les aspects externes affectés des lèvres et du visage chez les patients atteints d'herpès labial. Aucune donnée n'étant disponible, l'application sur les muqueuses humaines n'est pas recommandée. La crème ZOVIRAX est destinée à un usage cutané uniquement et ne doit pas être utilisée dans les yeux ou à l'intérieur de la bouche ou du nez.
Sensibilisation des contacts
La crème ZOVIRAX a un potentiel d'irritation et de sensibilisation par contact [voir EFFETS INDÉSIRABLES ].
L'effet de la crème ZOVIRAX n'a pas été établi chez les patients immunodéprimés.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( INFORMATIONS PATIENTS ).
Général
Les patients doivent être informés que la crème ZOVIRAX est une crème topique délivrée sur ordonnance pour le traitement des boutons de fièvre (herpès labial récurrent) qui apparaissent sur le visage et les lèvres. La crème ZOVIRAX n'est pas un remède contre les boutons de fièvre. Les patients doivent être informés que la crème ZOVIRAX est destinée à un usage cutané uniquement pour l'herpès labial des lèvres et autour de la bouche. Les patients doivent être informés que la crème ZOVIRAX ne doit pas être utilisée dans les yeux, dans la bouche ou le nez, ou sur les organes génitaux. Les patients doivent être informés qu'ils doivent éviter d'appliquer d'autres produits topiques sur la zone affectée lors de l'utilisation de la crème ZOVIRAX.
Ne pas utiliser si vous êtes allergique à la crème ZOVIRAX ou à l'un des ingrédients de la crème ZOVIRAX. Avant d'utiliser la crème ZOVIRAX, informez votre médecin si vous êtes enceinte, planifiez une grossesse ou si vous allaitez.
Mode d'emploi
Le traitement doit être initié dès le premier signe ou symptôme de récidive. Demandez aux patients de se laver les mains avant l'application et de s'assurer que le visage et/ou les lèvres sont propres et secs. Conseillez aux patients d'appliquer la crème ZOVIRAX par voie topique 5 fois par jour pendant 4 jours. Demandez aux patients d'appliquer localement une quantité de crème ZOVIRAX suffisante pour couvrir la zone affectée, y compris la marge externe. Conseillez aux patients d'éviter de frotter inutilement la zone affectée pour éviter d'aggraver ou de transférer l'infection. Demandez aux patients de se laver les mains à l'eau et au savon après avoir utilisé la crème ZOVIRAX. Tenir hors de portée des enfants.
Les effets secondaires possibles
Les effets secondaires courants liés à la peau qui se sont produits lors de l'application de la crème ZOVIRAX comprennent des réactions au site d'application. La crème ZOVIRAX peut provoquer une irritation et une sensibilisation par contact.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
L'exposition systémique après l'administration topique d'acyclovir est minime. Aucune étude de cancérogénicité cutanée n'a été menée. Les résultats des études de carcinogenèse, de mutagenèse et de fertilité ne sont pas inclus dans les informations complètes de prescription de la crème ZOVIRAX en raison des expositions minimales à l'acyclovir résultant de l'application cutanée. Des renseignements sur ces études sont disponibles dans les renseignements thérapeutiques complets sur les gélules, les comprimés et la suspension de ZOVIRAX et sur ZOVIRAX pour injection.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
L'acyclovir est peu absorbé par voie systémique suivant la voie d'administration topique, et l'utilisation maternelle ne devrait pas entraîner d'exposition fœtale à la crème ZOVIRAX [voir PHARMACOLOGIE CLINIQUE ]. L'expérience de l'utilisation topique de l'acyclovir chez les femmes enceintes sur plusieurs décennies, basée sur la littérature publiée, y compris les études observationnelles, n'a pas identifié de risque associé au médicament d'anomalies congénitales majeures, de fausse couche ou d'issues maternelles ou fœtales indésirables. Des études de reproduction animale avec une exposition systémique à l'acyclovir ont été menées. Reportez-vous aux informations de prescription de l'acyclovir pour plus de détails.
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Lactation
Résumé des risques
L'acyclovir est peu absorbé par voie systémique après administration topique, et l'allaitement ne devrait pas entraîner l'exposition de l'enfant à la crème ZOVIRAX [voir PHARMACOLOGIE CLINIQUE ]. Il n'y a pas de données sur les effets de ZOVIRAX sur le nourrisson allaité ou sur la production de lait. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de la mère pour la crème ZOVIRAX et tout effet indésirable potentiel sur l'enfant allaité de la crème ZOVIRAX ou de l'affection maternelle sous-jacente.
Utilisation pédiatrique
Un essai ouvert et non contrôlé avec la crème ZOVIRAX a été mené chez 113 patients âgés de 12 à 17 ans atteints d'herpès labial récurrent. Dans cet essai, le traitement a été appliqué en utilisant le même schéma posologique que chez les adultes et les sujets ont été suivis pour les événements indésirables. Le profil de sécurité était similaire à celui observé chez l'adulte. L'innocuité et l'efficacité chez les patients pédiatriques de moins de 12 ans n'ont pas été établies.
Utilisation gériatrique
Les études cliniques sur la crème d'acyclovir n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils réagissent différemment des sujets plus jeunes. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes. L'absorption systémique de l'acyclovir après administration topique est minime [voir PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Un surdosage par application topique de la crème ZOVIRAX est peu probable en raison d'une exposition systémique minimale [voir PHARMACOLOGIE CLINIQUE ]. Il n'y a pas d'information disponible sur le surdosage.
CONTRE-INDICATIONS
La crème ZOVIRAX est contre-indiquée chez les patients présentant une hypersensibilité connue à l'acyclovir, au valacyclovir ou à tout composant de la formulation.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
L'acyclovir est un médicament antiviral actif contre les virus de l'herpès α [voir Microbiologie ].
Pharmacocinétique
Une étude de pharmacologie clinique a été réalisée avec la crème ZOVIRAX chez des volontaires adultes pour évaluer l'absorption percutanée de l'acyclovir. Dans cette étude, qui comprenait 6 volontaires masculins, la crème a été appliquée sur une surface de 710 cm² sur le dos des volontaires 5 fois par jour à des intervalles de 2 heures pendant un total de 4 jours. Le poids de la crème appliquée et l'excrétion urinaire d'acyclovir ont été mesurés quotidiennement. La concentration plasmatique d'acyclovir a été dosée 1 heure après l'application finale. L'excrétion urinaire quotidienne moyenne de l'acyclovir était d'environ 0,04 % de la dose quotidienne appliquée. Les concentrations plasmatiques d'acyclovir étaient inférieures à la limite de détection (0,01 μM) chez 5 sujets et à peine détectables (0,014 μM) chez 1 sujet. L'absorption systémique de l'acyclovir de la crème ZOVIRAX est minime chez les adultes.
L'absorption systémique de l'acyclovir après l'application topique de crème n'a pas été évaluée chez les patients de moins de 18 ans.
Microbiologie
Mécanisme d'action
L'acyclovir est un analogue synthétique de désoxynucléoside de purine avec une culture cellulaire et une activité inhibitrice in vivo contre les ADN polymérases du HSV de types 1 (HSV-1) et 2 (HSV-2). Il inhibe la réplication du HSV-1 et du HSV-2 en culture cellulaire et in vivo.
L'activité inhibitrice de l'acyclovir est sélective en raison de son affinité pour l'enzyme thymidine kinase (TK) codée par le HSV. Cette enzyme virale convertit l'acyclovir en monophosphate d'acyclovir, un analogue de désoxynucléotide. Le monophosphate est ensuite converti en diphosphate par la guanylate kinase cellulaire et en triphosphate par un certain nombre d'enzymes cellulaires. Dans les tests biochimiques, l'acyclovir triphosphate inhibe la réplication de l'ADN viral de l'herpès α. Cette inhibition est accomplie de 3 manières : 1) inhibition compétitive de l'ADNpolymérase virale, 2) incorporation dans et terminaison de la chaîne d'ADN viral en croissance, et 3) inactivation de l'ADN polymérase virale.
Activité antivirale
La relation quantitative entre la sensibilité des virus de l'herpès aux antiviraux en culture cellulaire et la réponse clinique au traitement n'a pas été établie chez l'homme, et les tests de sensibilité virale n'ont pas été normalisés. Les résultats des tests de sensibilité, exprimés comme la concentration de médicament requise pour inhiber de 50 % la croissance du virus dans la culture cellulaire (valeur CE50), varient considérablement en fonction d'un certain nombre de facteurs. En utilisant des tests de réduction de plaque sur des cellules Vero, les valeurs de CE50 de l'acyclovir contre les isolats du virus de l'herpès simplex vont de 0,09 à 59,9 μM (0,02 à 13,5 μg/mL) pour le HSV-1 et de 0,04 à 44,0 μM (0,01 à 9,9 μg/mL ) pour HSV-2.
La résistance
En culture cellulaire
Les souches HSV-1 et HSV-2 résistantes à l'acyclovir ont été isolées en culture cellulaire. Le HSV résistant à l'acyclovir résulte de mutations dans les gènes viraux de la thymidine kinase (TK; pUL23) et de l'ADN polymérase (POL; pUL30). Les décalages de cadre ont été couramment isolés et ont entraîné une troncature prématurée du produit HSV TK avec pour conséquence une diminution de la sensibilité à l'acyclovir. Des mutations du gène viral TK peuvent entraîner une perte complète de l'activité TK (TK négative), des niveaux réduits d'activité TK (TK partielle) ou une altération de la capacité de la TK virale à phosphoryler le médicament sans perte équivalente de la capacité à phosphoryler la thymidine (TK altérée). En culture cellulaire, les substitutions associées à la résistance suivantes dans TK de HSV-1 et HSV-2 ont été observées (tableau 1).
Chez les patients infectés par le VHS
Les isolats cliniques de HSV-1 et HSV-2 obtenus de patients en échec de traitement pour leurs infections à herpèsvirus α ont été évalués pour les modifications génotypiques des gènes TK et POL et pour la résistance phénotypique à l'acyclovir (tableau 2). Des isolats de HSV avec des mutations de décalage de cadre et des substitutions associées à la résistance dans TK et POL ont été identifiés. La liste des substitutions dans HSV TK et POL conduisant à une diminution de la sensibilité à l'acyclovir n'est pas exhaustive et des changements supplémentaires seront probablement identifiés dans les variants de HSV isolés chez des patients qui échouent aux régimes contenant de l'acyclovir. La possibilité d'une résistance virale à l'acyclovir doit être envisagée chez les patients qui ne répondent pas ou qui subissent une excrétion virale récurrente pendant le traitement.
Résistance croisée
Une résistance croisée a été observée parmi les isolats de HSV porteurs de mutations de décalage de cadre et de substitutions associées à la résistance, qui confèrent une sensibilité réduite au penciclovir (PCV), au famciclovir (FCV) et au foscarnet (FOS) [Tableau 3].
Etudes cliniques
Sujets adultes
La crème ZOVIRAX a été évaluée dans deux essais à double insu, randomisés et contrôlés par placebo (véhicule) pour le traitement de l'herpès labial récurrent. Le patient moyen a eu cinq épisodes d'herpès labial au cours des 12 mois précédents. Dans le premier essai, l'âge médian des sujets était de 37 ans (intervalle de 18 à 81 ans), 74 % étaient des femmes et 94 % étaient de race blanche. Dans le deuxième essai, l'âge médian des sujets était de 38 ans (intervalle de 18 à 87 ans), 73 % étaient des femmes et 94 % étaient de race blanche. Les sujets ont reçu pour instruction de commencer le traitement dans l'heure suivant la constatation des signes ou des symptômes et de poursuivre le traitement pendant 4 jours, avec l'application du médicament à l'étude 5 fois par jour. Dans les deux études, la durée moyenne de l'épisode d'herpès labial récurrent était d'environ une demi-journée plus courte chez les sujets traités par la crème ZOVIRAX (n = 682) par rapport aux sujets traités par placebo (n = 703) pendant environ 4,5 jours versus 5 jours. , respectivement. Aucune différence significative n'a été observée entre les sujets recevant la crème ZOVIRAX ou le placebo dans la prévention de la progression des lésions des feux sauvages.
Sujets pédiatriques
Un essai ouvert et non contrôlé avec la crème ZOVIRAX a été mené chez 113 patients âgés de 12 à 17 ans atteints d'herpès labial récurrent. Dans cet essai, le traitement a été appliqué en utilisant le même schéma posologique que chez les adultes et les sujets ont été suivis pour les événements indésirables. Le profil de sécurité était similaire à celui observé chez l'adulte.
INFORMATIONS PATIENTS
ZOVIRAX (zho-vahy-rex)(acyclovir) Crème
Informations importantes : La crème ZOVIRAX est à utiliser uniquement sur les boutons de fièvre sur les lèvres et autour de la bouche.
La crème ZOVIRAX ne doit pas être utilisée dans les yeux, la bouche, le nez ou sur les organes génitaux.
Qu'est-ce que la crème ZOVIRAX ?
- La crème ZOVIRAX est un médicament délivré sur ordonnance utilisé pour traiter les boutons de fièvre (herpès labial) récurrents chez les adultes et les enfants de 12 ans et plus et dont le système immunitaire est normal.
- La crème ZOVIRAX n'est pas un remède contre les boutons de fièvre.
On ne sait pas si la crème ZOVIRAX est sûre et efficace chez les enfants de moins de 12 ans.
N'utilisez pas la crème ZOVIRAX si vous êtes allergique à l'acyclovir, au valacyclovir ou à l'un des ingrédients de la crème ZOVIRAX. Voir la fin de cette notice pour la liste complète des ingrédients de la crème ZOVIRAX.
Que dois-je dire à mon fournisseur de soins de santé avant d'utiliser la crème ZOVIRAX ?
Avant d'utiliser la crème ZOVIRAX, informez votre fournisseur de soins de santé de toutes vos conditions médicales, y compris si vous :
- tomber malade très facilement (avoir un système immunitaire affaibli).
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si la crème ZOVIRAX nuira à votre bébé à naître.
- allaitez ou envisagez d'allaiter. On ne sait pas si la crème ZOVIRAX passe dans votre lait maternel. Discutez avec votre professionnel de la santé de la meilleure façon de nourrir votre bébé si vous utilisez la crème ZOVIRAX.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
Comment dois-je utiliser la crème ZOVIRAX ?
- Utilisez la crème ZOVIRAX exactement comme votre professionnel de la santé vous l'a indiqué.
- Utilisez ZOVIRAX Crème dès que vous avez les premiers symptômes d'un bouton de fièvre tels que démangeaisons, rougeurs, brûlures ou picotements, ou dès l'apparition du bouton de fièvre.
- Lavez-vous les mains à l'eau et au savon avant et après l'application de la crème ZOVIRAX.
- La zone affectée doit être propre et sèche avant d'appliquer la crème ZOVIRAX.
- Appliquez la crème ZOVIRAX sur la zone affectée 5 fois par jour pendant 4 jours, y compris le bord extérieur.
- Vous ne devez pas appliquer d'autres produits pour la peau sur la zone affectée pendant le traitement avec la crème ZOVIRAX.
- Évitez de frotter inutilement le bouton de fièvre, car cela peut entraîner la propagation du bouton de fièvre à d'autres zones autour de votre bouche ou aggraver votre bouton de fièvre.
Quels sont les effets secondaires possibles de la crème ZOVIRAX ?
Les effets secondaires les plus courants de la crème ZOVIRAX sont des réactions cutanées au site de traitement et peuvent inclure : lèvres sèches ou craquelées, desquamation, desquamation ou sécheresse de la peau, sensation de brûlure ou de picotement et démangeaisons.
Ce ne sont pas tous les effets secondaires possibles de la crème ZOVIRAX.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver la crème ZOVIRAX ?
- Conservez la crème ZOVIRAX à température ambiante entre 68 ° et 77 °F (20 ° et 25 °C).
Gardez la crème ZOVIRAX et tous les médicaments hors de portée des enfants.
Informations générales sur l'utilisation sûre et efficace de la crème ZOVIRAX.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans une notice d'information destinée aux patients. N'utilisez pas la crème ZOVIRAX pour une affection pour laquelle elle n'a pas été prescrite. Ne donnez pas la crème ZOVIRAX à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire. Vous pouvez demander à votre pharmacien ou à votre professionnel de la santé des informations sur la crème ZOVIRAX destinées aux professionnels de la santé.
Quels sont les ingrédients de la crème ZOVIRAX ?
Ingrédient actif: aciclovir
Ingrédients inactifs: alcool cétostéarylique, huile minérale, poloxamère 407, propylène glycol, laurylsulfate de sodium, eau et vaseline blanche
Ces informations destinées aux patients ont été approuvées par la Food and Drug Administration des États-Unis.
