Famvir 250mg, 500mg Famciclovir Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Famvir et comment est-il utilisé ?
Famvir est un médicament d'ordonnance utilisé pour traiter les symptômes de l'herpès zoster aigu (zona), de l'herpès labiallis et de l'herpès génital. Famvir 250 mg peut être utilisé seul ou avec d'autres médicaments.
Famvir 250 mg appartient à une classe de médicaments appelés antiviraux, autres.
On ne sait pas si Famvir est sûr et efficace chez les enfants de moins de 18 ans.
Quels sont les effets secondaires possibles de Famvir 250 mg ?
Famvir 250 mg peut provoquer des effets indésirables graves, notamment :
- confusion,
- peu ou pas de miction,
- gonflement des pieds ou des chevilles,
- fatigue, et
- essoufflement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Famvir 500 mg incluent :
- maux de tête, et
- nausée
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Famvir. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
L'ingrédient actif des comprimés FAMVIR 500 mg est le famciclovir, un promédicament administré par voie orale de l'agent antiviral penciclovir. Chimiquement, le famciclovir est connu sous le nom de diacétate de 2-[2-(2-amino-9H-purine-9-yl)éthyl]-1,3-propanediol. Sa formule moléculaire est C14H19N5O4 ; son poids moléculaire est de 321,3. C'est un dérivé de guanine acyclique synthétique et a la structure suivante
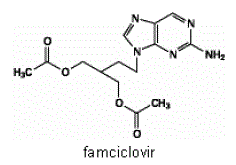
Le famciclovir est un solide blanc à jaune pâle. Il est librement soluble dans l'acétone et le méthanol, et peu soluble dans l'éthanol et l'isopropanol. À 25 °C, le famciclovir est initialement librement soluble (> 25 % p/v) dans l'eau, mais précipite rapidement sous forme de monohydrate peu soluble (2 % à 3 % p/v). Le famciclovir n'est pas hygroscopique en dessous de 85 % d'humidité relative. Les coefficients de partage sont : octanol/eau (pH 4,8) P=1,09 et octanol/tampon phosphate (pH 7,4) P=2,08.
Les comprimés FAMVIR 250 mg contiennent 125 mg, 250 mg ou 500 mg de famciclovir, ainsi que les ingrédients inactifs suivants : hydroxypropylcellulose, hydroxypropylméthylcellulose, lactose, stéarate de magnésium, polyéthylèneglycols, glycolate d'amidon sodique et dioxyde de titane.
LES INDICATIONS
Patients adultes immunocompétents
Herpès labial (boutons de fièvre)
FAMVIR est indiqué pour le traitement de l'herpès labial récurrent.
L'herpès génital
Épisodes récurrents :
FAMVIR est indiqué pour le traitement des épisodes récurrents d'herpès génital. L'efficacité de FAMVIR lorsqu'il est initié plus de 6 heures après le début des symptômes ou des lésions n'a pas été établie.
Thérapie suppressive :
FAMVIR 250 mg est indiqué pour le traitement suppressif chronique des épisodes récurrents d'herpès génital. L'efficacité et l'innocuité de FAMVIR pour la suppression de l'herpès génital récurrent au-delà d'un an n'ont pas été établies.
Zona (zona)
FAMVIR 500mg est indiqué pour le traitement du zona. L'efficacité de FAMVIR lorsqu'il est initié plus de 72 heures après le début de l'éruption cutanée n'a pas été établie.
Patients adultes infectés par le VIH
Herpès orolabial ou génital récurrent
FAMVIR est indiqué pour le traitement des épisodes récurrents d'herpès labial ou génital chez les adultes infectés par le VIH. L'efficacité de FAMVIR lorsqu'il est initié plus de 48 heures après le début des symptômes ou des lésions n'a pas été établie.
Limitation d'utilisation
L'efficacité et l'innocuité de FAMVIR n'ont pas été établies pour :
- Patients
- Patients présentant un premier épisode d'herpès génital
- Patients atteints de zona ophtalmique
- Patients immunodéprimés autres que pour le traitement de l'herpès orolabial ou génital récurrent chez les patients infectés par le VIH
- Patients noirs et afro-américains atteints d'herpès génital récurrent
DOSAGE ET ADMINISTRATION
FAMVIR 500 mg peut être pris avec ou sans nourriture.
Recommandation posologique chez les patients adultes immunocompétents
Herpès labial (boutons de fièvre)
La posologie recommandée de FAMVIR 500mg pour le traitement de l'herpès labial récurrent est de 1500 mg en dose unique. Le traitement doit être instauré dès le premier signe ou symptôme d'herpès labial (p. ex., picotements, démangeaisons, sensation de brûlure, douleur ou lésion).
L'herpès génital
Épisodes récurrents
La posologie recommandée de FAMVIR pour le traitement des épisodes récurrents d'herpès génital est de 1000 mg deux fois par jour pendant 1 jour. Le traitement doit être instauré dès le premier signe ou symptôme d'un épisode récurrent (p. ex., picotements, démangeaisons, sensation de brûlure, douleur ou lésion).
Thérapie suppressive
La posologie recommandée de FAMVIR 500 mg pour le traitement suppressif chronique des épisodes récurrents d'herpès génital est de 250 mg deux fois par jour.
Zona (zona)
La posologie recommandée de FAMVIR 250 mg pour le traitement du zona est de 500 mg toutes les 8 heures pendant 7 jours. Le traitement doit être initié dès que le zona est diagnostiqué.
Recommandation posologique chez les patients adultes infectés par le VIH
Herpès orolabial ou génital récurrent
La posologie recommandée de FAMVIR pour le traitement de l'herpès labial ou génital récurrent chez les patients infectés par le VIH est de 500 mg deux fois par jour pendant 7 jours. Le traitement doit être instauré dès le premier signe ou symptôme d'un épisode récurrent (p. ex., picotements, démangeaisons, sensation de brûlure, douleur ou lésion).
Recommandation posologique chez les patients atteints d'insuffisance rénale
Les recommandations posologiques pour les patients adultes atteints d'insuffisance rénale sont fournies dans le tableau 1 [voir Utilisation dans des populations spécifiques , PHARMACOLOGIE CLINIQUE ].
COMMENT FOURNIE
Formes posologiques et points forts
Les comprimés FAMVIR sont disponibles en 3 dosages :
- 125 mg : Blanc, rond pelliculé, biconvexe, bords biseautés, gravé « FAMVIR » d'un côté et « 125 » de l'autre côté
- 250 mg : Blanc, rond pelliculé, biconvexe, bords biseautés, gravé « FAMVIR » d'un côté et « 250 » de l'autre côté
- 500 mg : pelliculé blanc, ovale, biconvexe, gravé « FAMVIR » d'un côté et « 500 » de l'autre côté
Stockage et manutention
FAMVIR les comprimés sont fournis sous forme de comprimés pelliculés comme suit : 125 mg en flacons de 30 ; 250 mg en flacons de 30 ; 500 mg en flacons de 30 et conditionnements unitaires de 50 (destinés à un usage institutionnel uniquement).
- Comprimé FAMVIR 125 mg : Blanc, rond, pelliculé, biconvexe, bords biseautés, gravé « FAMVIR » sur une face et « 125 » sur l'autre. 125 mg 30 CDN 0078-0366-15
- FAMVIR 250 mg comprimé : Blanc, rond pelliculé, biconvexe, bords biseautés, gravé « FAMVIR » d'un côté et « 250 » de l'autre. 250 mg 30 CDN 0078-0367-15
- FAMVIR 500 mg comprimé : Blanc, ovale pelliculé, biconvexe, gravé « FAMVIR » d'un côté et « 500 » de l'autre. 500 mg 30 CDN 0078-0368-15 500 mg SUP 50's CDN 0078-0368-64
Conserver à 25 °C (77 °F); les excursions permises à 15-30°C (59-86°F) [voient USP la Température de Pièce Contrôlée].
Distribué par : Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Révisé : septembre 2016
EFFETS SECONDAIRES
L'insuffisance rénale aiguë est décrite plus en détail dans d'autres sections de l'étiquette [voir AVERTISSEMENTS ET PRECAUTIONS ].
Les événements indésirables les plus courants signalés dans au moins 1 indication par > 10 % des patients adultes traités par FAMVIR 250 mg sont les maux de tête et les nausées.
Expérience d'essais cliniques chez des patients adultes
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Patients immunocompétents
L'innocuité de FAMVIR 250 mg a été évaluée dans des études cliniques contrôlées contre placebo et actives impliquant 816 patients traités par FAMVIR atteints de zona (FAMVIR, 250 mg trois fois par jour à 750 mg trois fois par jour) ; 163 patients traités par FAMVIR atteints d'herpès génital récurrent (FAMVIR, 1000 mg deux fois par jour) ; 1 197 patients atteints d'herpès génital récurrent traités par FAMVIR 250 mg comme traitement suppressif (125 mg une fois par jour à 250 mg trois fois par jour) dont 570 patients ont reçu FAMVIR (en ouvert et/ou en double aveugle) pendant au moins 10 mois ; et 447 patients traités par FAMVIR atteints d'herpès labial (FAMVIR 500 mg, 1 500 mg une fois par jour ou 750 mg deux fois par jour). Le tableau 2 répertorie les événements indésirables sélectionnés.
Le tableau 3 énumère les anomalies de laboratoire sélectionnées dans les essais de suppression de l'herpès génital.
Patients infectés par le VIH
Chez les patients infectés par le VIH, les événements indésirables les plus fréquemment rapportés pour FAMVIR (500 mg deux fois par jour ; n = 150) et l'acyclovir (400 mg, 5x/jour ; n = 143), respectivement, étaient des maux de tête (17 % contre 15 % ), nausées (11 % contre 13 %), diarrhée (7 % contre 11 %), vomissements (5 % contre 4 %), fatigue (4 % contre 2 %) et douleurs abdominales (3 % contre 6 %).
Expérience post-commercialisation
Les événements indésirables énumérés ci-dessous ont été signalés lors de l'utilisation post-approbation de FAMVIR. Étant donné que ces événements sont signalés volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament :
Troubles du système sanguin et lymphatique : Thrombocytopénie
Affections hépatobiliaires : Tests de la fonction hépatique anormaux, ictère cholestatique
Troubles du système immunitaire : Choc anaphylactique, réaction anaphylactique
Troubles du système nerveux : Étourdissements, somnolence, convulsions
Troubles psychiatriques Confusion (y compris délire, désorientation et état confusionnel survenant principalement chez les personnes âgées), hallucinations
Affections de la peau et du tissu sous-cutané : Urticaire, érythème polymorphe, syndrome de Stevens-Johnson, nécrolyse épidermique toxique, œdème de Quincke (p. ex., œdème du visage, des paupières, périorbitaire et pharyngé), vascularite d'hypersensibilité
Troubles cardiaques : Palpitations
INTERACTIONS MÉDICAMENTEUSES
Potentiel pour FAMVIR 250 mg d'affecter d'autres médicaments
La pharmacocinétique à l'état d'équilibre de la digoxine n'a pas été modifiée par l'administration concomitante de doses multiples de famciclovir (500 mg trois fois par jour). Aucun effet cliniquement significatif sur la pharmacocinétique de la zidovudine, de son métabolite zidovudine glucuronide ou de l'emtricitabine n'a été observé après une dose orale unique de 500 mg de famciclovir co-administré avec la zidovudine ou l'emtricitabine.
Une étude in vitro utilisant des microsomes hépatiques humains suggère que le famciclovir n'est pas un inhibiteur des enzymes CYP3A4.
Possibilité que d'autres médicaments affectent le penciclovir
Aucune altération cliniquement significative de la pharmacocinétique du penciclovir n'a été observée après l'administration d'une dose unique de 500 mg de famciclovir après un prétraitement avec des doses multiples d'allopurinol, de cimétidine, de théophylline, de zidovudine, de prométhazine, lorsqu'il est administré peu de temps après un antiacide (hydroxyde de magnésium et d'aluminium), ou en concomitance avec l'emtricitabine. Aucun effet cliniquement significatif sur la pharmacocinétique du penciclovir n'a été observé après l'administration de doses multiples (trois fois par jour) de famciclovir (500 mg) avec des doses multiples de digoxine.
L'utilisation concomitante avec le probénécide ou d'autres médicaments éliminés de manière significative par la sécrétion tubulaire rénale active peut entraîner une augmentation des concentrations plasmatiques de penciclovir.
La conversion du 6-désoxy penciclovir en penciclovir est catalysée par l'aldéhyde oxydase. Des interactions avec d'autres médicaments métabolisés par cette enzyme et/ou inhibant cette enzyme pourraient potentiellement se produire. Les études d'interaction clinique du famciclovir avec la cimétidine et la prométhazine, inhibiteurs in vitro de l'aldéhyde oxydase, n'ont pas montré d'effets pertinents sur la formation de penciclovir. Le raloxifène, un puissant inhibiteur de l'aldéhyde oxydase in vitro, pourrait diminuer la formation de penciclovir. Cependant, aucune étude clinique sur les interactions médicamenteuses visant à déterminer l'ampleur de l'interaction entre le penciclovir et le raloxifène n'a été menée.
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Insuffisance rénale aiguë
Des cas d'insuffisance rénale aiguë ont été signalés chez des patients atteints d'insuffisance rénale sous-jacente qui ont reçu des doses élevées de FAMVIR inappropriées pour leur niveau de fonction rénale. Une réduction de la posologie est recommandée lors de l'administration de FAMVIR à des patients atteints d'insuffisance rénale [voir DOSAGE ET ADMINISTRATION , Utilisation dans des populations spécifiques ].
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA (Informations patient).
Il n'y a aucune preuve que FAMVIR affectera la capacité d'un patient à conduire ou à utiliser des machines. Cependant, les patients qui présentent des étourdissements, de la somnolence, de la confusion ou d'autres troubles du système nerveux central lors de la prise de FAMVIR 500 mg doivent s'abstenir de conduire ou d'utiliser des machines.
Étant donné que FAMVIR contient du lactose (les comprimés de FAMVIR à 125 mg, 250 mg et 500 mg contiennent du lactose à 26,9 mg, 53,7 mg et 107,4 mg, respectivement), les patients présentant des problèmes héréditaires rares d'intolérance au galactose, un déficit sévère en lactase ou une malabsorption du glucose et du galactose doivent être conseillé de discuter avec leur fournisseur de soins de santé avant de prendre FAMVIR.
Herpès labial (boutons de fièvre)
Il faut conseiller aux patients de commencer le traitement dès les premiers signes ou symptômes d'une récidive de boutons de fièvre (p. ex. picotements, démangeaisons, sensation de brûlure, douleur ou lésion). Les patients doivent être informés que le traitement des boutons de fièvre ne doit pas dépasser 1 dose. Les patients doivent être informés que FAMVIR ne guérit pas les boutons de fièvre.
L'herpès génital
Les patients doivent être informés que FAMVIR ne guérit pas l'herpès génital. Il n'y a pas de données évaluant si FAMVIR empêchera la transmission de l'infection à d'autres. L'herpès génital étant une maladie sexuellement transmissible, les patients doivent éviter tout contact avec des lésions ou des rapports sexuels lorsque des lésions et/ou des symptômes sont présents afin d'éviter d'infecter leurs partenaires. L'herpès génital est fréquemment transmis en l'absence de symptômes par excrétion virale asymptomatique. Par conséquent, les patients doivent être conseillés d'utiliser des pratiques sexuelles plus sûres.
Si un traitement épisodique de l'herpès génital récurrent est indiqué, il faut conseiller aux patients de commencer le traitement au premier signe ou symptôme d'un épisode.
Il n'y a pas de données sur l'innocuité ou l'efficacité d'un traitement suppressif chronique d'une durée supérieure à 1 an.
Zona (zona)
Il n'y a pas de données sur le traitement initié plus de 72 heures après le début de l'éruption cutanée de zona. Les patients doivent être informés qu'ils doivent commencer le traitement dès que possible après un diagnostic de zona.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Des études de cancérogénicité alimentaire de deux ans avec le famciclovir ont été menées chez des rats et des souris. Une augmentation de l'incidence de l'adénocarcinome mammaire (une tumeur courante chez les animaux de cette souche) a été observée chez les rats femelles recevant la dose élevée de 600 mg/kg/jour (1,1 à 4,5 x l'exposition systémique humaine à la dose orale quotidienne totale recommandée). entre 500 mg et 2 000 mg, sur la base des comparaisons de l'aire sous la courbe de concentration plasmatique [ASC sur 24 h] pour le penciclovir). Aucune augmentation de l'incidence des tumeurs n'a été signalée chez les rats mâles traités à des doses allant jusqu'à 240 mg/kg/jour (0,7 à 2,7x l'ASC humaine), ou chez les souris mâles et femelles à des doses allant jusqu'à 600 mg/kg/jour (0,3 à 1,2x l'AUC humaine).
Mutagenèse
Le famciclovir et le penciclovir (le métabolite actif du famciclovir) ont été testés pour leur potentiel génotoxique dans une batterie d'essais in vitro et in vivo. Le famciclovir et le penciclovir étaient négatifs dans les tests in vitro pour les mutations géniques dans les bactéries (S. typhimurium et E. coli) et la synthèse non programmée d'ADN dans les cellules HeLa 83 de mammifères (à des doses allant jusqu'à 10 000 et 5 000 mcg/plaque, respectivement). Le famciclovir était également négatif dans le test de lymphome de souris L5178Y (5000 mcg/mL), le test du micronoyau de souris in vivo (4800 mg/kg) et l'étude létale dominante chez le rat (5000 mg/kg). Le famciclovir a induit une augmentation de la polyploïdie dans les lymphocytes humains in vitro en l'absence de lésions chromosomiques (1200 mcg/mL). Le penciclovir était positif dans le test de lymphome de souris L5178Y pour les mutations géniques/aberrations chromosomiques, avec et sans activation métabolique (1000 mcg/mL). Dans les lymphocytes humains, le penciclovir a provoqué des aberrations chromosomiques en l'absence d'activation métabolique (250 mcg/mL). Le penciclovir a provoqué une incidence accrue de micronoyaux dans la moelle osseuse de souris in vivo lorsqu'il était administré par voie intraveineuse à des doses hautement toxiques pour la moelle osseuse (500 mg/kg), mais pas lorsqu'il était administré par voie orale.
Altération de la fertilité
Une toxicité testiculaire a été observée chez le rat, la souris et le chien après administration répétée de famciclovir ou de penciclovir. Les modifications testiculaires comprenaient une atrophie des tubules séminifères, une réduction du nombre de spermatozoïdes et/ou une incidence accrue de spermatozoïdes présentant une morphologie anormale ou une motilité réduite. Le degré de toxicité pour la reproduction des mâles était lié à la dose et à la durée d'exposition. Chez les rats mâles, une diminution de la fertilité a été observée après 10 semaines d'administration à 500 mg/kg/jour (1,4 à 5,7x l'ASC chez l'humain). Le niveau sans effet observable pour la toxicité des spermatozoïdes et des testicules chez le rat après une administration chronique (26 semaines) était de 50 mg/kg/jour (0,15 à 0,6x l'exposition systémique humaine sur la base des comparaisons de l'ASC). Une toxicité testiculaire a été observée suite à l'administration chronique à des souris (104 semaines) et à des chiens (26 semaines) de doses de 600 mg/kg/jour (0,3 à 1,2x l'ASC humaine) et de 150 mg/kg/jour (1,3 à 5,1x l'ASC). ASC humaine), respectivement.
Le famciclovir n'a eu aucun effet sur la performance reproductive générale ou la fertilité chez les rats femelles à des doses allant jusqu'à 1000 mg/kg/jour (2,7 à 10,8x l'ASC humaine).
Deux études contrôlées par placebo portant sur un total de 130 hommes par ailleurs en bonne santé avec un profil de sperme normal sur une période de référence de 8 semaines et un herpès génital récurrent recevant du FAMVIR oral (250 mg deux fois par jour) (n = 66) ou un placebo (n = 64) le traitement pendant 18 semaines n'a montré aucune preuve d'effets significatifs sur le nombre, la motilité ou la morphologie des spermatozoïdes pendant le traitement ou pendant un suivi de 8 semaines.
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse B
Après administration orale, le famciclovir (promédicament) est converti en penciclovir (médicament actif). Il n'y a pas d'études adéquates et bien contrôlées sur l'utilisation du famciclovir ou du penciclovir chez la femme enceinte. Aucun effet indésirable sur le développement embryofœtal n'a été observé dans les études de reproduction animale utilisant le famciclovir et le penciclovir à des doses supérieures à la dose humaine maximale recommandée (MRHD) et à l'exposition humaine. Étant donné que les études de reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, le famciclovir ne doit être utilisé pendant la grossesse qu'en cas de besoin.
Dans les études de reproduction chez l'animal, des rats et des lapins gravides ont reçu du famciclovir par voie orale à des doses (jusqu'à 1000 mg/kg/jour) qui fournissaient 2,7 à 10,8 fois (rats) et 1,4 à 5,4 fois (lapins) l'exposition systémique humaine sur la base de l'ASC. Aucun effet indésirable n'a été observé sur le développement embryo-fœtal. Dans d'autres études, des rats et des lapins gravides ont reçu du famciclovir par voie intraveineuse à des doses (360 mg/kg/jour) 1,5 à 6 fois (rats) et (120 mg/kg/jour) 1,1 à 4,5 fois (lapins) ou du penciclovir à des doses (80 mg/kg/jour) 0,3 à 1,3 fois (rats) et (60 mg/kg/jour) 0,5 à 2,1 fois (lapins) la MRHD basée sur des comparaisons de surface corporelle. Aucun effet indésirable n'a été observé sur le développement embryo-fœtal.
Déclaration d'exposition pendant la grossesse
Pour surveiller les résultats materno-fœtaux des femmes enceintes exposées au FAMVIR 500 mg, Novartis Pharmaceuticals Corporation maintient un système de rapport de grossesse FAMVIR. Les médecins sont encouragés à signaler leurs patients en appelant le 1-888-NOW-NOVA (669-6682).
Mères allaitantes
On ne sait pas si le famciclovir (promédicament) ou le penciclovir (médicament actif) sont excrétés dans le lait maternel. Après administration orale de famciclovir à des rates allaitantes, le penciclovir a été excrété dans le lait maternel à des concentrations supérieures à celles observées dans le plasma. Il n'y a pas de données sur la sécurité de FAMVIR 250 mg chez les nourrissons. FAMVIR 500 mg ne doit pas être utilisé chez les mères allaitantes à moins que les bénéfices potentiels ne soient considérés comme supérieurs aux risques potentiels associés au traitement.
Utilisation pédiatrique
L'efficacité de FAMVIR 250 mg n'a pas été établie chez les patients pédiatriques. Le profil pharmacocinétique et la sécurité du famciclovir (granulés expérimentaux mélangés à OraSweet® ou comprimés) ont été étudiés dans 3 études ouvertes.
L'étude 1 était une étude de pharmacocinétique et d'innocuité à dose unique chez des nourrissons âgés de 1 mois à
L'étude 2 était une étude de sécurité pharmacocinétique en ouvert, à dose unique et à doses multiples de granulés expérimentaux de famciclovir mélangés à OraSweet chez des enfants âgés de 1 à moins de 12 ans présentant une suspicion clinique d'infection par le VHS ou le virus varicelle-zona (VZV). Cinquante et un sujets ont été inclus dans la partie pharmacocinétique de l'étude et ont reçu une dose unique de famciclovir ajustée en fonction du poids corporel (doses allant de 125 mg à 500 mg). Ces doses ont été sélectionnées pour fournir des expositions systémiques au penciclovir similaires aux expositions systémiques au penciclovir observées chez les adultes après administration de 500 mg de famciclovir. Sur la base des données pharmacocinétiques observées avec ces doses chez les enfants, un nouvel algorithme de dosage basé sur le poids a été conçu et utilisé dans la partie sécurité à doses multiples de l'étude. Les données pharmacocinétiques n'ont pas été obtenues avec l'algorithme de dosage basé sur le poids révisé.
Au total, 100 patients ont été recrutés dans la partie sécurité à doses multiples de l'étude ; 47 sujets avec une infection HSV active ou latente et 53 sujets avec la varicelle. Les patients présentant une infection active ou latente à HSV ont reçu du famciclovir deux fois par jour pendant 7 jours. La dose quotidienne de famciclovir variait de 150 mg à 500 mg deux fois par jour en fonction du poids corporel du patient. Les patients atteints de varicelle ont reçu du famciclovir trois fois par jour pendant 7 jours. La dose quotidienne de famciclovir variait de 150 mg à 500 mg trois fois par jour selon le poids corporel du patient. Les événements indésirables cliniques et les anomalies des tests de laboratoire observés dans cette étude étaient similaires à ceux observés chez les adultes. Les données disponibles sont insuffisantes pour étayer l'utilisation du famciclovir pour le traitement des enfants de 1 à
Varicelle
L'efficacité du famciclovir pour le traitement de la varicelle n'a pas été établie chez les patients pédiatriques ou adultes. Le famciclovir est approuvé pour le traitement du zona chez les patients adultes. Cependant, l'extrapolation des données d'efficacité des adultes atteints de zona aux enfants atteints de varicelle ne serait pas appropriée. Bien que la varicelle et le zona soient causés par le même virus, les maladies sont différentes.
L'herpès génital
Les informations cliniques sur l'herpès génital chez les enfants sont limitées. Par conséquent, les données d'efficacité chez l'adulte ne peuvent pas être extrapolées à cette population. De plus, le famciclovir n'a pas été étudié chez les enfants de 1 à
Herpès labial
Il n'y a pas de données de pharmacocinétique et de sécurité chez les enfants âgés de 1 à
L'étude 3 était une étude ouverte à un seul bras visant à évaluer la pharmacocinétique, l'innocuité et l'activité antivirale d'une dose unique de 1 500 mg (trois comprimés de 500 mg) de famciclovir chez des enfants âgés de 12 à
Dans un essai de phase 3 chez des adultes au cours duquel les patients ont reçu une dose unique de 1500 mg de famciclovir ou un placebo, le temps médian de cicatrisation chez les patients présentant des lésions non avortées était de 4,4 jours dans le groupe dose unique de famciclovir 1500 mg et de 6,2 jours dans le groupe groupe placebo. Il convient de noter que dans l'étude sur les adultes, le traitement a été initié par les patients dans l'heure suivant l'apparition des symptômes [voir Etudes cliniques ]. Sur la base des résultats d'efficacité de l'étude 3, le famciclovir n'est pas recommandé chez les enfants de 12 à
Utilisation gériatrique
Sur 816 patients atteints de zona dans les études cliniques qui ont été traités par FAMVIR, 248 (30,4 %) étaient âgés de ≥ 65 ans et 103 (13 %) étaient âgés de ≥ 75 ans. Aucune différence globale n'a été observée dans l'incidence ou les types d'événements indésirables entre les patients plus jeunes et plus âgés. Sur 610 patients atteints d'herpès simplex récurrent (type 1 ou type 2) dans les études cliniques qui ont été traités par FAMVIR 500 mg, 26 (4,3 %) étaient âgés de plus de 65 ans et 7 (1,1 %) étaient âgés de plus de 75 ans. Les études cliniques de FAMVIR 500 mg chez des patients atteints d'herpès génital récurrent n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment par rapport aux sujets plus jeunes.
Aucun ajustement posologique du famciclovir en fonction de l'âge n'est recommandé sauf si la fonction rénale est altérée [voir DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE ]. En général, une prudence appropriée doit être exercée lors de l'administration et de la surveillance de FAMVIR 250 mg chez les patients âgés, ce qui reflète la fréquence plus élevée de diminution de la fonction rénale et l'utilisation concomitante d'autres médicaments.
Patients atteints d'insuffisance rénale
La clairance plasmatique apparente, la clairance rénale et la constante de vitesse d'élimination plasmatique du penciclovir ont diminué de façon linéaire avec les réductions de la fonction rénale. Après l'administration d'une dose orale unique de 500 mg de famciclovir (n = 27) à des volontaires sains et à des volontaires présentant divers degrés d'insuffisance rénale (CLCR allant de 6,4 à 138,8 mL/min), les résultats suivants ont été obtenus (Tableau 4) :
Dans une étude à doses multiples de famciclovir menée chez des sujets présentant divers degrés d'insuffisance rénale (n = 18), la pharmacocinétique du penciclovir était comparable à celle après des doses uniques.
Un ajustement posologique est recommandé chez les insuffisants rénaux [voir DOSAGE ET ADMINISTRATION ].
Patients atteints d'insuffisance hépatique
Une insuffisance hépatique légère ou modérée (hépatite chronique [n = 6], abus chronique d'éthanol [n = 8] ou cirrhose biliaire primitive [n = 1]) n'a eu aucun effet sur l'étendue de la disponibilité (ASC) du penciclovir après une dose unique de 500 mg de famciclovir. Cependant, il y a eu une diminution de 44 % de la concentration plasmatique maximale moyenne (Cmax) du penciclovir et le temps jusqu'à la concentration plasmatique maximale (tmax) a été augmenté de 0,75 heure chez les patients insuffisants hépatiques par rapport aux volontaires sains. Aucun ajustement posologique n'est recommandé chez les patients présentant une insuffisance hépatique légère ou modérée. La pharmacocinétique du penciclovir n'a pas été évaluée chez les patients atteints d'insuffisance hépatique sévère. La conversion du famciclovir en penciclovir, son métabolite actif, peut être altérée chez ces patients, entraînant une baisse des concentrations plasmatiques de penciclovir, et donc éventuellement une diminution de l'efficacité du famciclovir [voir PHARMACOLOGIE CLINIQUE ].
Patients noirs et afro-américains
Dans un essai randomisé, à double insu et contrôlé par placebo mené auprès de 304 adultes noirs et afro-américains immunocompétents atteints d'herpès génital récurrent, il n'y avait aucune différence dans le temps médian de guérison entre les patients recevant FAMVIR ou un placebo. En général, le profil des effets indésirables était similaire à celui observé dans d'autres essais cliniques FAMVIR chez des patients adultes [voir EFFETS INDÉSIRABLES ]. La pertinence de ces résultats d'étude pour d'autres indications chez les patients noirs et afro-américains est inconnue [voir Etudes cliniques ].
SURDOSAGE
Un traitement symptomatique et de soutien approprié doit être administré. Le penciclovir est éliminé par hémodialyse.
CONTRE-INDICATIONS
FAMVIR 250 mg est contre-indiqué chez les patients présentant une hypersensibilité connue au produit, à ses composants ou au Denavir® (crème de penciclovir).
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le famciclovir est un promédicament administré par voie orale de l'agent antiviral penciclovir [voir Microbiologie ].
Pharmacocinétique
Le famciclovir est l'analogue diacétyl 6-désoxy du composé antiviral actif penciclovir. Après administration orale, le famciclovir subit un métabolisme rapide et important en penciclovir et peu ou pas de famciclovir est détecté dans le plasma ou l'urine. Le penciclovir est principalement éliminé sous forme inchangée par le rein. Par conséquent, la dose de FAMVIR 500 mg doit être ajustée chez les patients présentant différents degrés d'insuffisance rénale [voir DOSAGE ET ADMINISTRATION ].
Pharmacocinétique chez l'adulte
Absorption et biodisponibilité :
La biodisponibilité absolue du penciclovir est de 77 ± 8 %, déterminée après l'administration d'une dose orale de 500 mg de famciclovir et d'une dose intraveineuse de 400 mg de penciclovir à 12 sujets sains de sexe masculin.
Les concentrations de penciclovir ont augmenté proportionnellement à la dose sur une plage de doses de famciclovir de 125 mg à 1000 mg administrée en une seule dose. Le tableau 5 montre les paramètres pharmacocinétiques moyens du penciclovir après administration unique de FAMVIR à des volontaires sains de sexe masculin.
Après administration orale d'une dose unique de 500 mg de famciclovir à 7 patients atteints de zona, l'ASC (moyenne ± ET), la Cmax et le tmax étaient de 12,1 ± 1,7 mcg h/mL, 4,0 ± 0,7 mcg/mL et 0,7 ± 0,2 heures , respectivement. L'ASC du penciclovir était supérieure d'environ 35 % chez les patients atteints de zona par rapport aux volontaires sains. Une partie de cette différence peut être due à des différences de fonction rénale entre les 2 groupes.
Il n'y a pas d'accumulation de penciclovir après l'administration de 500 mg de famciclovir trois fois par jour pendant 7 jours.
La Cmax du penciclovir a diminué d'environ 50 % et le tmax a été retardé de 1,5 heure lorsqu'une formulation de capsule de famciclovir a été administrée avec de la nourriture (le contenu nutritionnel était d'environ 910 kcal et 26 % de matières grasses). Il n'y avait aucun effet sur l'étendue de la disponibilité (AUC) du penciclovir. Il y a eu une diminution de 18 % de la Cmax et un retard du tmax d'environ 1 heure lorsque le famciclovir a été administré 2 heures après un repas par rapport à son administration 2 heures avant un repas. Étant donné qu'il n'y a eu aucun effet sur l'étendue de la disponibilité systémique du penciclovir, FAMVIR 250 mg peut être pris sans tenir compte des repas.
Distribution:
Le volume de distribution (Vdβ) était de 1,08 ± 0,17 L/kg chez 12 sujets sains de sexe masculin après une dose intraveineuse unique de penciclovir à 400 mg administrée en perfusion intraveineuse d'une heure. Le penciclovir est lié à moins de 20 % aux protéines plasmatiques sur la plage de concentration de 0,1 à 20 mcg/mL. Le rapport sang/plasma du penciclovir est d'environ 1.
Métabolisme:
Après administration orale, le famciclovir est désacétylé et oxydé pour former le penciclovir. Les métabolites inactifs comprennent le 6-désoxy penciclovir, le penciclovir monoacétylé et le 6-désoxy penciclovir monoacétylé (5 %, INTERACTIONS MÉDICAMENTEUSES ].
Élimination:
Environ 94 % de la radioactivité administrée ont été récupérés dans les urines sur 24 heures (83 % de la dose ont été excrétés au cours des 6 premières heures) après l'administration de 5 mg/kg de penciclovir radiomarqué en perfusion d'une heure à 3 volontaires sains de sexe masculin. Le penciclovir représentait 91 % de la radioactivité excrétée dans l'urine.
Suite à l'administration orale d'une dose unique de 500 mg de famciclovir radiomarqué à 3 volontaires sains de sexe masculin, 73 % et 27 % de la radioactivité administrée ont été récupérés dans l'urine et les fèces en 72 heures, respectivement. Le penciclovir représentait 82 % et le 6-désoxy penciclovir 7 % de la radioactivité excrétée dans l'urine. Environ 60 % de la dose radiomarquée administrée a été recueillie dans l'urine au cours des 6 premières heures.
Après administration intraveineuse de penciclovir chez 48 volontaires sains de sexe masculin, la clairance plasmatique totale moyenne ± ET du penciclovir était de 36,6 ± 6,3 L/h (0,48 ± 0,09 L/h/kg). La clairance rénale du penciclovir représentait 74,5 ± 8,8 % de la clairance plasmatique totale.
La clairance rénale du penciclovir après l'administration orale d'une dose unique de 500 mg de famciclovir à 109 volontaires sains de sexe masculin était de 27,7 ± 7,6 L/h. La sécrétion tubulaire active contribue à l'élimination rénale du penciclovir.
La demi-vie d'élimination plasmatique du penciclovir était de 2,0 ± 0,3 heures après administration intraveineuse de penciclovir à 48 volontaires sains de sexe masculin et de 2,3 ± 0,4 heures après administration orale de 500 mg de famciclovir à 124 volontaires sains de sexe masculin. La demi-vie chez 17 patients atteints de zona était de 2,8 ± 1,0 heures et de 2,7 ± 1,0 heures après des doses uniques et répétées, respectivement.
Populations particulières
Patients gériatriques
Sur la base d'une comparaison d'études croisées, l'ASC du penciclovir était supérieure de 40 % et la clairance rénale du penciclovir était inférieure de 22 % chez les sujets âgés (n = 18, âgés de 65 à 79 ans) par rapport aux sujets plus jeunes. Une partie de cette différence peut être due à des différences de fonction rénale entre les 2 groupes. Aucun ajustement posologique du famciclovir en fonction de l'âge n'est recommandé sauf si la fonction rénale est altérée [voir DOSAGE ET ADMINISTRATION , Utilisation dans des populations spécifiques ]
Patients atteints d'insuffisance rénale
Chez les sujets présentant divers degrés d'insuffisance rénale, la clairance plasmatique apparente, la clairance rénale et la constante de vitesse d'élimination plasmatique du penciclovir ont diminué de manière linéaire avec des réductions de la fonction rénale, après administration unique et répétée [voir Utilisation dans des populations spécifiques ]. Un ajustement posologique est recommandé chez les insuffisants rénaux [voir DOSAGE ET ADMINISTRATION ].
Patients atteints d'insuffisance hépatique
Une insuffisance hépatique légère ou modérée n'a eu aucun effet sur l'étendue de la disponibilité (ASC) du penciclovir [voir Utilisation dans des populations spécifiques ]. Aucun ajustement posologique n'est recommandé chez les patients présentant une insuffisance hépatique légère ou modérée. L'effet d'une insuffisance hépatique sévère sur la pharmacocinétique du penciclovir n'a pas été évalué.
Patients infectés par le VIH
Après administration orale d'une dose unique de 500 mg de famciclovir à des patients séropositifs pour le VIH, les paramètres pharmacocinétiques du penciclovir ont été comparables à ceux observés chez des sujets sains.
Le genre
La pharmacocinétique du penciclovir a été évaluée chez 18 volontaires sains de sexe masculin et 18 volontaires de sexe féminin après administration orale d'une dose unique de 500 mg de famciclovir. L'ASC du penciclovir était de 9,3 ± 1,9 mcg h/mL et de 11,1 ± 2,1 mcg h/mL chez les hommes et les femmes, respectivement. La clairance rénale du penciclovir était de 28,5 ± 8,9 L/h et de 21,8 ± 4,3 L/h, respectivement. Ces différences ont été attribuées à des différences de fonction rénale entre les 2 groupes. Aucun ajustement posologique du famciclovir en fonction du sexe n'est recommandé.
Course
Une évaluation rétrospective a été réalisée pour comparer les paramètres pharmacocinétiques obtenus chez des sujets noirs et caucasiens après administration unique et répétée une fois par jour, deux fois par jour ou trois fois par jour de famciclovir 500 mg. Les données d'une étude chez des volontaires sains (dose unique), d'une étude chez des sujets présentant divers degrés d'insuffisance rénale (dose unique et répétée) et d'une étude chez des sujets atteints d'insuffisance hépatique (dose unique) n'ont pas indiqué de différences significatives dans la pharmacocinétique de penciclovir entre sujets noirs et caucasiens.
Microbiologie
Mécanisme d'action
Le famciclovir est un promédicament du penciclovir, qui a démontré une activité inhibitrice contre le virus de l'herpès simplex de types 1 (HSV-1) et 2 (HSV-2) et le virus varicelle-zona (VZV). Dans les cellules infectées par le HSV-1, le HSV-2 ou le VZV, la thymidine kinase virale phosphoryle le penciclovir en une forme monophosphate qui, à son tour, est convertie par les kinases cellulaires en la forme active du penciclovir triphosphate. Des études biochimiques démontrent que le penciclovir triphosphate inhibe l'ADN polymérase du HSV-2 de manière compétitive avec la désoxyguanosine triphosphate. Par conséquent, la synthèse de l'ADN viral de l'herpès et, par conséquent, la réplication sont sélectivement inhibées. Le penciclovir triphosphate a une demi-vie intracellulaire de 10 heures dans le HSV-1, de 20 heures dans le HSV-2 et de 7 heures dans les cellules infectées par le VZV cultivées. Cependant, la signification clinique de la demi-vie intracellulaire est inconnue.
Activité antivirale
Dans les études de culture cellulaire, le penciclovir est inhibiteur des virus de l'herpès suivants : HSV-1, HSV-2 et VZV. L'activité antivirale du penciclovir contre les souches de type sauvage cultivées sur des fibroblastes de prépuce humain a été évaluée avec un test de réduction de plaque et une coloration au cristal violet 3 jours après l'infection pour le HSV et 10 jours après l'infection pour le VZV. Les valeurs médianes de la CE50 du penciclovir contre les isolats de laboratoire et cliniques de HSV-1, HSV-2 et VZV étaient de 2 μM (intervalle de 1,2 à 2,4 μM, n = 7), 2,6 μM (intervalle de 1,6 à 11 μM, n = 6) , et 34 μM (plage de 6,7 à 71 μM, n = 6), respectivement.
La résistance
Les mutants résistants au penciclovir du HSV et du VZV peuvent résulter de mutations dans les gènes viraux de la thymidine kinase (TK) et de l'ADN polymérase. Des mutations du gène viral TK peuvent entraîner une perte complète de l'activité TK (TK négative), des niveaux réduits d'activité TK (TK partielle) ou une altération de la capacité de la TK virale à phosphoryler le médicament sans perte équivalente de capacité à phosphoryler thymidine (TK altérée). Les valeurs médianes de CE50 observées dans un essai de réduction de plaque avec des HSV-1, HSV-2 et VZV résistants au penciclovir étaient de 69 μM (intervalle de 14 à 115 μM, n = 6), 46 μM (intervalle de 4 à > 395 μM, n = 9) et 92 μM (plage de 51 à 148 μM, n = 4), respectivement. La possibilité d'une résistance virale au penciclovir doit être envisagée chez les patients qui ne répondent pas ou qui subissent une excrétion virale récurrente pendant le traitement.
Résistance croisée
Une résistance croisée a été observée parmi les inhibiteurs de l'ADN polymérase du VHS. Les mutants résistants à l'acyclovir les plus couramment rencontrés qui sont TK négatifs sont également résistants au penciclovir.
Etudes cliniques
Herpès labial (boutons de fièvre)
Un essai randomisé, en double aveugle et contrôlé par placebo a été mené chez 701 adultes immunocompétents atteints d'herpès labial récurrent. Les patients ont commencé eux-mêmes un traitement dans l'heure suivant l'apparition des premiers signes ou symptômes d'un épisode récurrent d'herpès labial avec FAMVIR 1 500 mg en dose unique (n = 227), FAMVIR 750 mg deux fois par jour (n = 220) ou un placebo (n = 254) pendant 1 jour. Le délai médian de cicatrisation chez les patients présentant des lésions non avortées (progressant au-delà du stade papule) était de 4,4 jours dans le groupe FAMVIR à dose unique de 1500 mg (n = 152) contre 6,2 jours dans le groupe placebo (n = 168) . La différence médiane de temps de cicatrisation entre le groupe placebo et les groupes traités par FAMVIR à 1 500 mg était de 1,3 jours (IC à 95 % : 0,6 à 2,0). Aucune différence dans la proportion de patients présentant des lésions avortées (ne progressant pas au-delà du stade papule) n'a été observée entre les patients recevant FAMVIR 250 mg ou le placebo : 33 % pour FAMVIR 1 500 mg dose unique et 34 % pour le placebo. Le délai médian de disparition de la douleur et de la sensibilité était de 1,7 jours chez les patients traités par une dose unique de FAMVIR à 1 500 mg contre 2,9 jours chez les patients sous placebo.
L'herpès génital
Épisodes récurrents
Un essai randomisé, en double aveugle et contrôlé par placebo a été mené auprès de 329 adultes immunocompétents atteints d'herpès génital récurrent. Les patients ont eux-mêmes initié un traitement dans les 6 heures suivant le premier signe ou symptôme d'un épisode d'herpès génital récurrent avec FAMVIR 1000 mg deux fois par jour (n = 163) ou un placebo (n = 166) pendant 1 jour. Le délai médian de cicatrisation chez les patients présentant des lésions non avortées (progressant au-delà du stade papule) était de 4,3 jours chez les patients traités par FAMVIR (n = 125) contre 6,1 jours chez les patients traités par placebo (n = 145). La différence médiane de temps de guérison entre les groupes placebo et FAMVIR était de 1,2 jours (IC à 95 % : 0,5 à 2,0). Vingt-trois pour cent des patients traités par FAMVIR avaient des lésions avortées (pas de développement de lésions au-delà de l'érythème) contre 13 % chez les patients traités par placebo. Le délai médian de disparition de tous les symptômes (p. ex., picotements, démangeaisons, sensation de brûlure, douleur ou sensibilité) était de 3,3 jours chez les patients traités par FAMVIR contre 5,4 jours chez les patients traités par placebo.
Un essai randomisé (2:1), en double aveugle et contrôlé par placebo a été mené auprès de 304 adultes noirs et afro-américains immunocompétents atteints d'herpès génital récurrent. Les patients ont eux-mêmes initié un traitement dans les 6 heures suivant le premier signe ou symptôme d'un épisode d'herpès génital récurrent avec FAMVIR 1000 mg deux fois par jour (n = 206) ou un placebo (n = 98) pendant 1 jour. Le délai médian de cicatrisation chez les patients présentant des lésions non avortées était de 5,4 jours chez les patients traités par FAMVIR (n = 152) contre 4,8 jours chez les patients traités par placebo (n = 78). La différence médiane de temps de guérison entre les groupes placebo et FAMVIR était de -0,26 jours (IC à 95 % : -0,98 à 0,40).
Thérapie suppressive
Deux essais randomisés, en double aveugle, contrôlés par placebo, d'une durée de 12 mois ont été menés chez 934 adultes immunocompétents ayant des antécédents de 6 récidives ou plus d'épisodes d'herpès génital par an. Les comparaisons comprenaient FAMVIR 125 mg trois fois par jour, 250 mg deux fois par jour, 250 mg trois fois par jour et un placebo. À 12 mois, 60 % à 65 % des patients recevaient encore FAMVIR et 25 % recevaient un traitement placebo. Les taux de récidive à 6 et 12 mois chez les patients traités avec la dose de 250 mg deux fois par jour sont présentés dans le tableau 6.
Les patients traités par FAMVIR avaient environ 1/5 du nombre médian de récidives par rapport aux patients traités par placebo. Des doses plus élevées de FAMVIR 250 mg n'ont pas été associées à une augmentation de l'efficacité.
Herpès orolabial ou génital récurrent chez les patients infectés par le VIH
Un essai randomisé en double aveugle a comparé le famciclovir 500 mg deux fois par jour pendant 7 jours (n = 150) à l'acyclovir oral 400 mg 5 fois par jour pendant 7 jours (n = 143) chez des patients infectés par le VIH atteints d'herpès labial ou génital récurrent traités dans les 48 heures d'apparition de la lésion. Environ 40 % des patients avaient un taux de CD4+ inférieur à 200 cellules/mm3, 54 % des patients présentaient des lésions anogénitales et 35 % présentaient des lésions orolabiales. Le traitement au famciclovir était comparable à l'acyclovir oral en ce qui concerne la réduction de la formation de nouvelles lésions et le temps nécessaire à la guérison complète.
Zona (zona)
Deux essais randomisés en double aveugle, 1 contre placebo et 1 contre comparateur actif, ont été menés chez 964 adultes immunocompétents atteints de zona non compliqué. Le traitement a été initié dans les 72 heures suivant l'apparition de la première lésion et a été poursuivi pendant 7 jours.
Dans l'essai contrôlé par placebo, 419 patients ont été traités soit par FAMVIR 500 mg trois fois par jour (n = 138), FAMVIR 750 mg trois fois par jour (n = 135) ou un placebo (n = 146). Le délai médian d'apparition d'une croûte complète était de 5 jours chez les patients traités par FAMVIR à 500 mg, contre 7 jours chez les patients traités par placebo. Les temps de formation de croûtes complètes, de perte de vésicules, de perte d'ulcères et de perte de croûtes étaient plus courts pour les patients traités par FAMVIR à 500 mg que pour les patients traités par placebo dans la population globale de l'étude. Les effets de FAMVIR 500 mg étaient plus importants lorsque le traitement était initié dans les 48 heures suivant l'apparition de l'éruption cutanée ; elle était également plus profonde chez les patients de 50 ans ou plus. Parmi les 65,2 % de patients avec au moins 1 culture virale positive, les patients traités par FAMVIR avaient une durée médiane d'excrétion virale plus courte que les patients traités par placebo (1 jour et 2 jours, respectivement).
Il n'y avait aucune différence globale dans la durée de la douleur avant la guérison des éruptions cutanées entre les groupes FAMVIR et placebo. De plus, il n'y avait aucune différence dans l'incidence de la douleur après la guérison des éruptions cutanées (névralgie post-zostérienne) entre les groupes de traitement. Chez les 186 patients (44,4 % de la population totale de l'étude) qui ont développé une névralgie post-zostérienne, la durée médiane de la névralgie post-zostérienne était plus courte chez les patients traités par FAMVIR 500 mg que chez ceux traités par placebo (63 jours et 119 jours, respectivement). Aucune efficacité supplémentaire n'a été démontrée avec une dose plus élevée de FAMVIR.
Dans l'essai contrôlé contre traitement actif, 545 patients ont été traités avec 1 des 3 doses de FAMVIR trois fois par jour ou avec de l'acyclovir 800 mg cinq fois par jour. Les temps jusqu'à la formation de croûtes complètes sur les lésions et les temps jusqu'à la perte de la douleur aiguë étaient comparables pour tous les groupes et il n'y avait pas de différences statistiquement significatives dans le temps jusqu'à la perte de la névralgie post-zostérienne entre les groupes traités par FAMVIR et l'acyclovir.
INFORMATIONS PATIENTS
FAMVIR® (Fam'-veer) (famciclovir) Comprimés
Lisez ces informations patient avant de commencer à prendre FAMVIR et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre fournisseur de soins de santé au sujet de votre état de santé ou de votre traitement.
Qu'est-ce que FAMVIR ?
Famvir est un médicament antiviral délivré sur ordonnance utilisé pour :
- traiter les épidémies de boutons de fièvre (boutons de fièvre) chez les adultes en bonne santé
- traiter les poussées d'herpès génital chez les adultes en bonne santé
- diminuer le nombre de poussées d'herpès génital chez les adultes en bonne santé
- traiter les poussées de lésions d'herpès simplex dans ou autour de la bouche, des organes génitaux et de la région anale chez les personnes infectées par le VIH
- traiter le zona (herpès zoster) chez les adultes ayant un système immunitaire normal
On ne sait pas si FAMVIR 500 mg est sûr et efficace chez les enfants de moins de 18 ans.
FAMVIR 250 mg n'est pas un remède contre l'herpès. On ne sait pas si FAMVIR peut arrêter la propagation de l'herpès aux autres. Si vous êtes sexuellement actif, vous pouvez transmettre l'herpès à votre partenaire même si vous prenez FAMVIR. L'herpès peut être transmis même si vous n'avez pas de symptômes actifs. Vous devez continuer à pratiquer des rapports sexuels protégés pour réduire les risques de propagation de l'herpès génital à d'autres personnes. N'ayez pas de contact sexuel avec votre partenaire pendant une poussée d'herpès génital ou si vous présentez des symptômes d'herpès génital. Utilisez un préservatif en latex ou en polyuréthane lorsque vous avez un contact sexuel. Demandez à votre fournisseur de soins de santé pour plus d'informations sur les pratiques sexuelles plus sûres.
Qui ne devrait pas prendre FAMVIR?
Ne prenez pas FAMVIR 250 mg si vous êtes allergique à l'un de ses ingrédients ou au Denavir® (crème de penciclovir). Voir la fin de cette brochure d'information patiente pour une liste complète d'ingrédients dans FAMVIR.
Que dois-je dire à mon fournisseur de soins de santé avant de prendre FAMVIR 500 mg ?
Avant de commencer à prendre FAMVIR 500 mg, informez votre professionnel de la santé si vous :
- avez des problèmes rénaux ou hépatiques
- avez un problème génétique rare avec une intolérance au galactose, un déficit sévère en lactase ou vous n'absorbez pas le glucose-galactose (malabsorption)
- êtes enceinte ou planifiez une grossesse. On ne sait pas si FAMVIR 250 mg nuira à votre bébé à naître
- Rapports d'exposition pendant la grossesse : Novartis Pharmaceuticals Corporation recueille les rapports de grossesse qui sont signalés sur une base volontaire. En cas de grossesse, parlez à votre fournisseur de soins de santé de la déclaration de votre grossesse
- allaitez ou envisagez d'allaiter
Informez votre fournisseur de soins de santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Informez particulièrement votre fournisseur de soins de santé si vous prenez :
- tout autre médicament et produit que vous utilisez pour traiter les poussées d'herpès
- probénécide (Probalan)
Connaissez les médicaments que vous prenez. Gardez-en une liste avec vous pour la montrer à votre fournisseur de soins de santé et à votre pharmacien chaque fois que vous recevez un nouveau médicament.
Comment dois-je prendre FAMVIR ?
- Prenez FAMVIR exactement comme prescrit
- Votre fournisseur de soins de santé vous dira combien de FAMVIR prendre et quand les prendre. Votre dose de FAMVIR 250 mg et la fréquence à laquelle vous la prenez peuvent varier en fonction de votre état
- FAMVIR peut être pris avec ou sans nourriture
- Il est important que vous terminiez tous les médicaments comme prescrit, même si vous commencez à vous sentir mieux.
- Vos symptômes peuvent persister même après avoir terminé tout votre FAMVIR. Cela ne signifie pas que vous avez besoin de plus de médicaments, car vous avez déjà terminé un traitement complet de FAMVIR 500 mg et celui-ci continuera à agir dans votre corps. Parlez à votre fournisseur de soins de santé si vous avez des questions sur votre état et votre traitement
Quels sont les effets secondaires possibles de FAMVIR 250mg ?
Les effets secondaires les plus courants de FAMVIR 500 mg comprennent :
- mal de tête
- nausée
Parlez à votre fournisseur de soins de santé si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de FAMVIR. Demandez à votre fournisseur de soins de santé ou à votre pharmacien pour plus d'informations.
Appelez votre fournisseur de soins de santé pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA1088.
Comment dois-je conserver FAMVIR 500mg ?
- Conservez FAMVIR à température ambiante entre 59°F et 86°F (15°C à 30°C).
Gardez FAMVIR et tous les médicaments hors de portée des enfants.
Informations générales sur FAMVIR
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans les notices d'information destinées aux patients. N'utilisez pas FAMVIR pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas FAMVIR 500 mg à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Cette notice résume les informations les plus importantes sur FAMVIR. Si vous souhaitez plus d'informations, parlez-en à votre fournisseur de soins de santé. Votre fournisseur de soins de santé ou votre pharmacien peut vous donner des informations sur FAMVIR 500 mg qui sont écrites pour les professionnels de la santé. Pour plus d'informations, rendez-vous sur www.FAMVIR.com ou appelez le 1-888-669-6682.
Quels sont les ingrédients de FAMVIR ?
Ingrédient actif: famciclovir
Ingrédients inactifs: hydroxypropylcellulose, hydroxypropylméthylcellulose, lactose, stéarate de magnésium, polyéthylèneglycols, glycolate d'amidon sodique et dioxyde de titane
