Copegus 100mg Ribavirin Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que COPEGUS 100 mg et comment est-il utilisé ?
Copegus 100 mg est un médicament d'ordonnance utilisé pour traiter les symptômes de l'hépatite C chronique. Copegus 100 mg peut être utilisé seul ou avec d'autres médicaments.
Copegus appartient à une classe de médicaments appelés agents de l'hépatite B/hépatite C ; Agents VRS.
Quels sont les effets secondaires possibles de COPEGUS ?
Copegus peut provoquer des effets secondaires graves, notamment :
- urticaire,
- difficulté à respirer,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- problèmes de vue,
- douleur intense dans le haut de l'estomac se propageant à votre dos,
- nausée,
- vomissement,
- diarrhée,
- toux nouvelle ou qui s'aggrave,
- fièvre,
- douleur thoracique lancinante,
- respiration sifflante,
- essoufflement,
- dépression sévère,
- pensées d'automutilation ou de blesser quelqu'un d'autre,
- peau pâle ou jaunie,
- urine de couleur foncée,
- confusion,
- la faiblesse,
- des frissons,
- symptômes pseudo-grippaux,
- gencives enflées,
- plaies buccales,
- plaies cutanées,
- ecchymoses faciles,
- saignements inhabituels et
- étourdissement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de COPEGUS comprennent :
- nausée,
- vomissement,
- perte d'appétit,
- fièvre,
- frissons ou tremblements,
- faible nombre de cellules sanguines,
- anémie,
- la faiblesse,
- fatigue,
- mal de tête,
- douleur musculaire,
- des changements d'humeur,
- l'anxiété, et
- irritabilité
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Copegus. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
RISQUE DE TROUBLES GRAVES ET EFFETS ASSOCIÉS À LA RIBAVIRINE
COPEGUS (ribavirine) en monothérapie n'est pas efficace pour le traitement de l'infection chronique par le virus de l'hépatite C et ne doit pas être utilisé seul pour cette indication.
La principale toxicité clinique de la ribavirine est l'anémie hémolytique. L'anémie associée au traitement par la ribavirine peut entraîner une aggravation de la maladie cardiaque et entraîner des infarctus du myocarde mortels et non mortels. Les patients ayant des antécédents de maladie cardiaque importante ou instable ne doivent pas être traités par COPEGUS [voir MISES EN GARDE ET PRÉCAUTIONS, EFFETS INDÉSIRABLES et POSOLOGIE ET ADMINISTRATION].
Des effets tératogènes et/ou embryocides significatifs ont été démontrés chez toutes les espèces animales exposées à la ribavirine. De plus, la ribavirine a une demi-vie à doses multiples de 12 jours et elle peut persister dans les compartiments non plasmatiques jusqu'à 6 mois. Par conséquent, la ribavirine, y compris COPEGUS 100 mg, est contre-indiquée chez les femmes enceintes et chez les partenaires masculins des femmes enceintes. Des précautions extrêmes doivent être prises pour éviter une grossesse pendant le traitement et pendant 6 mois après la fin du traitement chez les patientes et les partenaires féminines des patients masculins qui prennent la ribavirine. Au moins deux formes fiables de contraception efficace doivent être utilisées pendant le traitement et pendant la période de suivi de 6 mois après le traitement [voir CONTRE-INDICATIONS, MISES EN GARDE ET PRÉCAUTIONS et Utilisation dans des populations spécifiques].
LA DESCRIPTION
COPEGUS 100 mg, ribavirine, est un analogue nucléosidique à activité antivirale. Le nom chimique de la ribavirine est 1-β-Dribofuranosyl-1H-1,2,4-triazole-3-carboxamide et a la formule structurelle suivante :
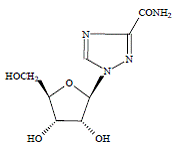
La formule empirique de la ribavirine est C8H12N4O5 et le poids moléculaire est de 244,2. La ribavirine est une poudre blanche à blanc cassé. Il est librement soluble dans l'eau et légèrement soluble dans l'alcool anhydre.
COPEGUS (ribavirine) est disponible sous forme de comprimé pelliculé plat, de forme ovale, de couleur rose pâle à rose, pour administration orale. Chaque comprimé contient 200 mg de ribavirine et les ingrédients inactifs suivants : amidon prégélatinisé, cellulose microcristalline, glycolate d'amidon sodique, amidon de maïs et stéarate de magnésium. L'enrobage du comprimé contient du Chromatone-P ou Opadry Pink (fabriqué à partir d'hydroxypropylméthylcellulose, de talc, de dioxyde de titane, d'oxyde de fer jaune synthétique et d'oxyde de fer rouge synthétique), d'éthylcellulose (ECD-30) et de triacétine.
LES INDICATIONS
COPEGUS 100 mg en association avec PEGASYS (peginterféron alfa-2a) est indiqué pour le traitement des patients âgés de 5 ans et plus atteints d'une infection chronique par le virus de l'hépatite C (CHC) qui ont une maladie hépatique compensée et n'ont pas été précédemment traités par l'interféron alpha.
Les points suivants doivent être pris en compte lors de l'instauration d'un traitement combiné COPEGUS 100 mg avec PEGASYS :
- Cette indication est basée sur des essais cliniques de thérapie combinée chez des patients atteints d'HCC et d'hépatopathie compensée, dont certains présentaient des signes histologiques de cirrhose (Child-Pugh classe A), et chez des patients adultes atteints d'une maladie VIH cliniquement stable et d'un nombre de CD4 supérieur à 100 cellules/mm³ .
- Cette indication est basée sur l'obtention d'un ARN du VHC indétectable après un traitement de 24 ou 48 semaines, en fonction du génotype du VHC, et sur le maintien d'une réponse virologique soutenue (RVS) 24 semaines après la dernière dose.
- Les données de sécurité et d'efficacité ne sont pas disponibles pour un traitement de plus de 48 semaines.
- L'innocuité et l'efficacité de COPEGUS 100 mg et du traitement par PEGASYS n'ont pas été établies chez les receveurs de greffe de foie ou d'autres organes, les patients atteints d'une maladie hépatique décompensée ou ceux qui n'ont pas répondu au traitement par interféron.
- L'innocuité et l'efficacité du traitement par COPEGUS pour le traitement des infections à adénovirus, VRS, parainfluenza ou grippe n'ont pas été établies. COPEGUS ne doit pas être utilisé dans ces indications. La ribavirine pour inhalation a une notice séparée, qui doit être consultée si un traitement par inhalation de ribavirine est envisagé.
DOSAGE ET ADMINISTRATION
COPEGUS 100 mg doit être pris avec de la nourriture. COPEGUS doit être administré en association avec PEGASYS ; il est important de noter que COPEGUS 100 mg ne doit jamais être administré en monothérapie. Voir Notice PEGASYS pour toutes les instructions concernant le dosage et l'administration de PEGASYS.
Monoinfection chronique par l'hépatite C
Patients adultes
La dose recommandée de COPEGUS 100 mg comprimés est fournie dans le Tableau 1. La durée de traitement recommandée pour les patients non préalablement traités par la ribavirine et l'interféron est de 24 à 48 semaines.
La dose quotidienne de COPEGUS 100 mg est de 800 mg à 1200 mg administrée par voie orale en deux doses fractionnées. La dose doit être adaptée au patient en fonction des caractéristiques initiales de la maladie (par exemple, le génotype), de la réponse au traitement et de la tolérabilité du traitement (voir ).
Patients pédiatriques
PEGASYS est administré à raison de 180 mcg/1,73 m² x surface corporelle une fois par semaine par voie sous-cutanée, jusqu'à une dose maximale de 180 mcg, et doit être administré en association avec la ribavirine. La durée de traitement recommandée pour les patients de génotype 2 ou 3 est de 24 semaines et pour les autres génotypes de 48 semaines.
COPEGUS doit être administré en association avec PEGASYS. COPEGUS 100 mg est disponible uniquement sous forme de comprimé de 200 mg et, par conséquent, le fournisseur de soins de santé doit déterminer si ce comprimé de taille peut être avalé par le patient pédiatrique. Les doses recommandées pour COPEGUS sont fournies dans la Table 2. Les patients qui lancent le traitement avant leur 18ème anniversaire devraient maintenir le dosage pédiatrique par l'achèvement de thérapie.
Hépatite C chronique avec co-infection par le VIH
Patients adultes
La dose recommandée pour le traitement de l'hépatite C chronique chez les patients co-infectés par le VIH est PEGASYS 180 mcg sous-cutané une fois par semaine et COPEGUS 800 mg par voie orale par jour pendant une durée totale de 48 semaines, quel que soit le génotype du VHC.
Modifications posologiques
Patients adultes et pédiatriques
Si des effets indésirables graves ou des anomalies de laboratoire se développent pendant le traitement par l'association COPEGUS/PEGASYS, la dose doit être modifiée ou interrompue, le cas échéant, jusqu'à ce que les effets indésirables s'atténuent ou diminuent en gravité. Si l'intolérance persiste après ajustement posologique, le traitement par COPEGUS/PEGASYS doit être arrêté. Le tableau 3 fournit des recommandations pour les modifications de dose et l'arrêt en fonction de la concentration d'hémoglobine et de l'état cardiaque du patient.
COPEGUS 100 mg doit être administré avec prudence aux patients présentant une maladie cardiaque préexistante. Les patients doivent être évalués avant le début du traitement et doivent être surveillés de manière appropriée pendant le traitement. En cas de détérioration de l'état cardiovasculaire, le traitement doit être arrêté [voir AVERTISSEMENTS ET PRECAUTIONS ].
Les directives pour les modifications de dose de COPEGUS 100 mg décrites dans ce tableau s'appliquent également aux anomalies de laboratoire ou aux effets indésirables autres que les diminutions des valeurs d'hémoglobine.
Patients adultes
Une fois que COPEGUS 100 mg a été retenu en raison d'une anomalie de laboratoire ou d'un effet indésirable clinique, une tentative peut être faite pour redémarrer COPEGUS 100 mg à 600 mg par jour et augmenter encore la dose à 800 mg par jour. Cependant, on ne lui recommande pas que COPEGUS soit augmenté à la dose assignée originale (1000 mgs à 1200 mgs).
Patients pédiatriques
Lors de la résolution d'une anomalie de laboratoire ou d'un effet indésirable clinique, une augmentation de la dose de COPEGUS 100 mg à la dose initiale peut être tentée en fonction du jugement du médecin. Si COPEGUS a été retenu en raison d'une anomalie de laboratoire ou d'un effet indésirable clinique, une tentative peut être faite pour redémarrer COPEGUS 100 mg à la moitié de la dose complète.
Insuffisance rénale
La dose quotidienne totale de COPEGUS doit être réduite chez les patients dont la clairance de la créatinine est inférieure ou égale à 50 mL/min; et la dose hebdomadaire de PEGASYS doit être réduite pour une clairance de la créatinine inférieure à 30 mL/min comme suit dans le tableau 4 [voir Utilisation dans des populations spécifiques , Pharmacocinétique , et Notice PEGASYS ].
La posologie de COPEGUS 100 mg ne doit pas être modifiée davantage chez les insuffisants rénaux. Si des réactions indésirables graves ou des anomalies de laboratoire se développent, COPEGUS doit être interrompu, le cas échéant, jusqu'à ce que les réactions indésirables s'atténuent ou diminuent en gravité. Si l'intolérance persiste après la reprise de COPEGUS 100 mg, le traitement par COPEGUS/PEGASYS doit être arrêté.
Aucune donnée n'est disponible pour les sujets pédiatriques atteints d'insuffisance rénale.
Arrêt du dosage
L'arrêt du traitement par PEGASYS/COPEGUS 100 mg doit être envisagé si le patient n'a pas réussi à démontrer une réduction d'au moins 2 log10 par rapport à la valeur initiale de l'ARN du VHC après 12 semaines de traitement, ou des taux d'ARN du VHC indétectables après 24 semaines de traitement.
Le traitement par PEGASYS/COPEGUS 100 mg doit être interrompu chez les patients qui développent une décompensation hépatique pendant le traitement [voir AVERTISSEMENTS ET PRECAUTIONS ].
COMMENT FOURNIE
Formes posologiques et points forts
COPEGUS (ribavirine) est disponible sous forme de comprimé pelliculé plat, de forme ovale, de couleur rose pâle à rose, pour administration orale. Chaque comprimé contient 200 mg de ribavirine.
COPEGUS® (ribavirine) est disponible sous forme de comprimés pour administration orale. Chaque comprimé contient 200 mg de ribavirine et est de couleur rose pâle à rose, plat, de forme ovale, pelliculé et gravé RIB 200 sur une face et ROCHE sur l'autre face. Ils sont conditionnés en flacon de 168 comprimés ( CDN 0004-0086-94).
Stockage et manutention
Conservez le flacon de COPEGUS® Comprimés à 25°C (77°F); les excursions sont autorisées entre 15°C et 30°C (59°F et 86°F) [voir Température ambiante contrôlée USP ]. Conserver le flacon bien fermé.
Fabriqué par : Hoffmann-La Roche, Inc. c/o Genentech, Inc. Un membre du groupe Roche, 1 DNA Way, South San Francisco, CA 94080-4990. Révisé : Août 2015
EFFETS SECONDAIRES
PEGASYS en association avec COPEGUS provoque une grande variété d'effets indésirables graves [voir AVERTISSEMENT ENCADRÉ et AVERTISSEMENTS ET PRECAUTIONS ]. Les effets indésirables graves ou potentiellement mortels les plus courants induits ou aggravés par COPEGUS/PEGASYS comprennent la dépression, le suicide, la rechute de la toxicomanie/le surdosage et les infections bactériennes, chacune se produisant à une fréquence inférieure à 1 %. Une décompensation hépatique est survenue chez 2 % (10/574) des patients atteints d'HCC/VIH [voir AVERTISSEMENTS ET PRECAUTIONS ].
Expérience des études cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
Patients adultes
Dans les essais d'enregistrement pivots NV15801 et NV15942, 886 patients ont reçu COPEGUS pendant 48 semaines à des doses de 1000/1200 mg en fonction du poids corporel. Dans ces essais, un ou plusieurs effets indésirables graves sont survenus chez 10 % des sujets monoinfectés par CHC et chez 19 % des sujets CHC/VIH recevant PEGASYS seul ou en association avec COPEGUS. L'événement indésirable grave le plus courant (3 % dans les CHC et 5 % dans les CHC/VIH) était une infection bactérienne (p. ex., septicémie, ostéomyélite, endocardite, pyélonéphrite, pneumonie).
D'autres effets indésirables graves sont survenus à une fréquence inférieure à 1 % et comprenaient : suicide, idées suicidaires, psychose, agressivité, anxiété, toxicomanie et surdosage, angine de poitrine, dysfonctionnement hépatique, stéatose hépatique, cholangite, arythmie, diabète sucré, phénomènes auto-immuns (p. ex., hyperthyroïdie, hypothyroïdie, sarcoïdose, lupus érythémateux disséminé, polyarthrite rhumatoïde), neuropathie périphérique, anémie aplasique, ulcère peptique, saignement gastro-intestinal, pancréatite, colite, ulcère cornéen, embolie pulmonaire, coma, myosite, hémorragie cérébrale, purpura thrombocytopénique thrombotique, troubles psychotiques et hallucinations.
Le pourcentage de patients dans les essais cliniques qui ont subi un ou plusieurs événements indésirables était de 98 %. Les effets indésirables les plus fréquemment rapportés étaient des réactions psychiatriques, notamment dépression, insomnie, irritabilité, anxiété et symptômes pseudo-grippaux tels que fatigue, pyrexie, myalgie, céphalées et frissons. Les autres réactions fréquentes étaient l'anorexie, les nausées et les vomissements, la diarrhée, les arthralgies, les réactions au site d'injection, l'alopécie et le prurit.
montre les taux d'événements indésirables survenus chez 5 % ou plus des sujets recevant un traitement combiné interféron pégylé et ribavirine dans l'essai clinique CHC, NV15801.
Dix pour cent des patients monoinfectés par CHC recevant 48 semaines de traitement par PEGASYS en association avec COPEGUS 100 mg ont arrêté le traitement ; 16 % des patients co-infectés CHC/VIH ont arrêté le traitement. Les raisons les plus courantes de l'arrêt du traitement étaient des troubles psychiatriques, un syndrome pseudo-grippal (p. ex., léthargie, fatigue, céphalées), des troubles dermatologiques et gastro-intestinaux et des anomalies de laboratoire (thrombocytopénie, neutropénie et anémie).
Dans l'ensemble, 39 % des patients atteints d'HCC ou d'HCC/VIH ont nécessité une modification du traitement par PEGASYS et/ou COPEGUS. La raison la plus courante de modification de la dose de PEGASYS chez les patients atteints d'HCC et d'HCC/VIH était les anomalies de laboratoire ; neutropénie (20 % et 27 %, respectivement) et thrombocytopénie (4 % et 6 %, respectivement). La raison la plus courante de modification de la dose de COPEGUS chez les patients atteints d'HCC et d'HCC/VIH était l'anémie (22 % et 16 %, respectivement).
La dose de PEGASYS a été réduite chez 12 % des patients recevant 1 000 mg à 1 200 mg de COPEGUS 100 mg pendant 48 semaines et chez 7 % des patients recevant 800 mg de COPEGUS pendant 24 semaines. La dose de COPEGUS a été réduite chez 21 % des patients recevant 1 000 mg à 1 200 mg de COPEGUS 100 mg pendant 48 semaines et chez 12 % des patients recevant 800 mg de COPEGUS 100 mg pendant 24 semaines.
Les patients monoinfectés par l'hépatite C chronique traités pendant 24 semaines avec PEGASYS et 800 mg de COPEGUS 100 mg ont présenté une incidence plus faible d'événements indésirables graves (3 % contre 10 %), une hémoglobine inférieure à 10 g/dL (3 % contre 15 %) , modification de dose de PEGASYS (30% vs 36%) et COPEGUS (19% vs 38%), et d'arrêt de traitement (5% vs 15%) par rapport aux patients traités pendant 48 semaines avec PEGASYS et 1000 mg ou 1200 mg COPEGUS. En revanche, l'incidence globale des événements indésirables semble similaire dans les deux groupes de traitement.
Patients pédiatriques
Dans un essai clinique portant sur 114 sujets pédiatriques (âgés de 5 à 17 ans) traités par PEGASYS seul ou en association avec COPEGUS 100 mg, des modifications de dose ont été nécessaires chez environ un tiers des sujets, le plus souvent pour neutropénie et anémie. En général, le profil de sécurité observé chez les sujets pédiatriques était similaire à celui observé chez les adultes. Dans l'étude pédiatrique, les événements indésirables les plus fréquents chez les sujets traités par la polythérapie PEGASYS et COPEGUS 100 mg pendant jusqu'à 48 semaines étaient les syndromes pseudo-grippaux (91 %), les infections des voies respiratoires supérieures (60 %), les céphalées (64 %), trouble gastro-intestinal (56 %), trouble cutané (47 %) et réaction au point d'injection (45 %). Sept sujets recevant un traitement combiné PEGASYS et COPEGUS pendant 48 semaines ont arrêté le traitement pour des raisons de sécurité (dépression, évaluation psychiatrique anormale, cécité transitoire, exsudats rétiniens, hyperglycémie, diabète sucré de type 1 et anémie). Des événements indésirables graves ont été signalés chez 2 sujets du groupe de traitement combiné PEGASYS plus COPEGUS 100 mg (hyperglycémie et cholécystectomie).
Chez les sujets pédiatriques randomisés pour le traitement combiné, l'incidence de la plupart des effets indésirables était similaire pendant toute la période de traitement (jusqu'à 48 semaines plus 24 semaines de suivi) par rapport aux 24 premières semaines, et n'a augmenté que légèrement pour les maux de tête, les troubles gastro-intestinaux , irritabilité et éruption cutanée. La majorité des effets indésirables sont survenus au cours des 24 premières semaines de traitement.
Inhibition de la croissance chez les sujets pédiatriques
[voir AVERTISSEMENTS ET PRECAUTIONS ].
Les sujets pédiatriques traités par le traitement combiné PEGASYS plus ribavirine ont montré un retard dans les augmentations de poids et de taille jusqu'à 48 semaines de traitement par rapport à la valeur initiale. Les scores z du poids pour l'âge et de la taille pour l'âge ainsi que les centiles de la population normative pour le poids et la taille du sujet ont diminué pendant le traitement. À la fin des 2 ans de suivi après le traitement, la plupart des sujets étaient revenus aux centiles de la courbe normative initiale pour le poids (64e centile moyen au départ, 60e centile moyen à 2 ans après le traitement) et la taille (54e centile moyen au départ, 56e centile centile moyen à 2 ans après le traitement). À la fin du traitement, 43 % (23 sur 53) des sujets ont présenté une diminution du centile de poids de plus de 15 centiles, et 25 % (13 sur 53) ont présenté une diminution du centile de taille de plus de 15 centiles sur les courbes de croissance normatives. À 2 ans après le traitement, 16 % (6 sur 38) des sujets étaient à plus de 15 centiles en dessous de leur courbe de poids initiale et 11 % (4 sur 38) étaient à plus de 15 centiles en dessous de leur courbe de taille initiale.
Trente-huit des 114 sujets inscrits à l'étude de suivi à long terme, s'étendant jusqu'à 6 ans après le traitement. Pour la plupart des sujets, la reprise post-traitement de la croissance à 2 ans après le traitement a été maintenue jusqu'à 6 ans après le traitement.
Effets indésirables courants chez les CHC avec co-infection par le VIH (adultes)
Le profil d'effets indésirables des patients co-infectés traités par PEGASYS/COPEGUS dans l'étude NR15961 était généralement similaire à celui présenté pour les patients monoinfectés dans l'étude NV15801 (tableau 5). Les événements survenus plus fréquemment chez les patients co-infectés étaient la neutropénie (40 %), l'anémie (14 %), la thrombocytopénie (8 %), la perte de poids (16 %) et l'altération de l'humeur (9 %).
Anomalies des tests de laboratoire
Patients adultes
L'anémie due à l'hémolyse est la toxicité la plus importante du traitement par la ribavirine. Une anémie (hémoglobine inférieure à 10 g/dL) a été observée chez 13 % de tous les patients traités par l'association COPEGUS et PEGASYS dans les essais cliniques. La baisse maximale de l'hémoglobine s'est produite au cours des 8 premières semaines d'initiation du traitement par la ribavirine [voir DOSAGE ET ADMINISTRATION ].
Patients pédiatriques
Les diminutions de l'hémoglobine, des neutrophiles et des plaquettes peuvent nécessiter une réduction de la dose ou l'arrêt définitif du traitement [voir DOSAGE ET ADMINISTRATION ]. La plupart des anomalies de laboratoire notées au cours de l'essai clinique sont revenues aux niveaux de base peu de temps après l'arrêt du traitement.
Chez les patients randomisés pour le traitement combiné, l'incidence des anomalies pendant toute la phase de traitement (jusqu'à 48 semaines plus 24 semaines de suivi) par rapport aux 24 premières semaines a légèrement augmenté pour les neutrophiles entre 500 et 1 000 cellules/mm³ et les valeurs d'hémoglobine entre 8,5 et 10g/dL. La majorité des anomalies hématologiques sont survenues au cours des 24 premières semaines de traitement.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés et signalés lors de l'utilisation post-approbation de la thérapie combinée PEGASYS/COPEGUS 100 mg. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Troubles du système sanguin et lymphatique
Aplasie pure des globules rouges
Troubles de l'oreille et du labyrinthe
Déficience auditive, perte auditive
Troubles oculaires
Décollement séreux de la rétine
Troubles immunitaires
Rejet de greffe hépatique et rénale
Troubles du métabolisme et de la nutrition
Déshydratation
Troubles de la peau et du tissu sous-cutané
Syndrome de Stevens-Johnson (SJS)
Nécrolyse épidermique toxique (TEN)
INTERACTIONS MÉDICAMENTEUSES
Les résultats d'une sous-étude pharmacocinétique n'ont démontré aucune interaction pharmacocinétique entre PEGASYS (peginterféron alfa-2a) et la ribavirine.
Inhibiteurs nucléosidiques de la transcriptase inverse (INTI)
Les données in vitro indiquent que la ribavirine réduit la phosphorylation de la lamivudine, de la stavudine et de la zidovudine. Cependant, aucune interaction pharmacocinétique (p. ex., concentrations plasmatiques ou concentrations intracellulaires de métabolites actifs triphosphorylés) ou pharmacodynamique (p. ex., perte de la suppression virologique du VIH/VHC) n'a été observée lorsque la ribavirine et la lamivudine (n = 18), la stavudine (n = 10) ou zidovudine (n = 6) ont été co-administrés dans le cadre d'un régime multimédicamenteux à des patients co-infectés VHC/VIH.
Dans l'étude NR15961 chez les patients cirrhotiques co-infectés CHC/VIH recevant des INTI, des cas de décompensation hépatique (certains mortels) ont été observés [voir AVERTISSEMENTS ET PRECAUTIONS ].
Les patients recevant PEGASYS/COPEGUS 100 mg et des INTI doivent faire l'objet d'une surveillance étroite des toxicités associées au traitement. Les médecins doivent consulter les informations de prescription des INTI respectifs pour obtenir des conseils sur la gestion de la toxicité. De plus, une réduction de la dose ou l'arrêt de PEGASYS, COPEGUS 100 mg ou les deux doivent également être envisagés si une aggravation des toxicités est observée, y compris une décompensation hépatique (par exemple, Child-Pugh supérieur ou égal à 6) [voir AVERTISSEMENTS ET PRECAUTIONS et DOSAGE ET ADMINISTRATION ].
Didanosine
La co-administration de COPEGUS et de didanosine est contre-indiquée. Les concentrations de didanosine ou de son métabolite actif (didésoxyadénosine 5'-triphosphate) sont augmentées lorsque la didanosine est co-administrée avec la ribavirine, ce qui pourrait provoquer ou aggraver des toxicités cliniques. Des cas d'insuffisance hépatique mortelle ainsi que de neuropathie périphérique, de pancréatite et d'hyperlactatémie/acidose lactique symptomatique ont été rapportés dans les essais cliniques [voir CONTRE-INDICATIONS ].
Zidovudine
Dans l'étude NR15961, les patients ayant reçu de la zidovudine en association avec PEGASYS/COPEGUS ont développé une neutropénie sévère (ANC inférieur à 500) et une anémie sévère (hémoglobine inférieure à 8 g/dL) plus fréquemment que des patients similaires ne recevant pas de zidovudine (neutropénie 15 % contre 9 %) (anémie 5 % contre 1 %). L'arrêt de la zidovudine doit être considéré comme médicalement approprié.
Médicaments métabolisés par le cytochrome P450
Des études in vitro indiquent que la ribavirine n'inhibe pas le CYP 2C9, le CYP 2C19, le CYP 2D6 ou le CYP 3A4.
Azathioprine
Il a été rapporté que l'utilisation de la ribavirine pour traiter l'hépatite C chronique chez les patients recevant de l'azathioprine induisait une pancytopénie sévère et pouvait augmenter le risque de myélotoxicité liée à l'azathioprine. L'inosine monophosphate déshydrogénase (IMDH) est nécessaire pour l'une des voies métaboliques de l'azathioprine. La ribavirine est connue pour inhiber l'IMDH, entraînant ainsi l'accumulation d'un métabolite de l'azathioprine, le 6-méthylthioinosine monophosphate (6-MTITP), qui est associé à une myélotoxicité (neutropénie, thrombocytopénie et anémie). Les patients recevant de l'azathioprine avec de la ribavirine doivent subir une numération globulaire complète, y compris une numération plaquettaire, surveillée chaque semaine pendant le premier mois, deux fois par mois pendant les deuxième et troisième mois de traitement, puis une fois par mois ou plus fréquemment si la posologie ou d'autres changements de traitement sont nécessaires [voir AVERTISSEMENTS ET PRECAUTIONS ].
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Les effets indésirables importants associés à la thérapie combinée COPEGUS/PEGASYS comprennent la dépression sévère et les idées suicidaires, l'anémie hémolytique, la suppression de la fonction de la moelle osseuse, les troubles auto-immuns et infectieux, les troubles ophtalmologiques, les troubles cérébrovasculaires, le dysfonctionnement pulmonaire, la colite, la pancréatite et le diabète.
La notice de PEGASYS doit être lue dans son intégralité pour des informations de sécurité supplémentaires avant le début du traitement combiné.
Grossesse
COPEGUS 100 mg peut provoquer des malformations congénitales et/ou la mort du fœtus exposé. La ribavirine a démontré des effets tératogènes et/ou embryocides significatifs chez toutes les espèces animales chez lesquelles des études adéquates ont été menées. Ces effets se sont produits à des doses aussi faibles qu'un vingtième de la dose humaine recommandée de ribavirine.
La thérapie COPEGUS ne devrait pas être commencée à moins qu'un rapport d'un test de grossesse négatif n'ait été obtenu juste avant l'initiation planifiée de thérapie. Des précautions extrêmes doivent être prises pour éviter une grossesse chez les patientes et chez les partenaires féminines des patients masculins. Les patientes doivent être informées qu'elles doivent utiliser au moins deux formes de contraception efficaces pendant le traitement et pendant 6 mois après l'arrêt du traitement. Les tests de grossesse doivent avoir lieu tous les mois pendant le traitement par COPEGUS 100 mg et pendant 6 mois après l'arrêt du traitement [voir AVERTISSEMENT ENCADRÉ , CONTRE-INDICATIONS , Utilisation dans des populations spécifiques , et INFORMATIONS PATIENTS ].
Anémie
La principale toxicité de la ribavirine est l'anémie hémolytique, qui a été observée chez environ 13 % de tous les sujets traités par COPEGUS/PEGASYS dans les essais cliniques. L'anémie associée à COPEGUS 100 mg survient dans les 1 à 2 semaines suivant le début du traitement. Étant donné que la baisse initiale de l'hémoglobine peut être importante, il est conseillé d'obtenir l'hémoglobine ou l'hématocrite avant le traitement et à la semaine 2 et à la semaine 4 du traitement ou plus fréquemment si cliniquement indiqué. Les patients doivent ensuite être suivis comme cliniquement approprié. La prudence s'impose lors de l'instauration du traitement chez tout patient présentant un risque initial d'anémie sévère (p. ex., sphérocytose, antécédents d'hémorragie gastro-intestinale) [voir DOSAGE ET ADMINISTRATION ].
Des infarctus du myocarde mortels et non mortels ont été signalés chez des patients souffrant d'anémie causée par COPEGUS. Les patients doivent être évalués pour une maladie cardiaque sous-jacente avant le début du traitement par la ribavirine. Les patients présentant une maladie cardiaque préexistante doivent subir des électrocardiogrammes avant le traitement et doivent être surveillés de manière appropriée pendant le traitement. En cas de détérioration de l'état cardiovasculaire, le traitement doit être suspendu ou interrompu [voir DOSAGE ET ADMINISTRATION ]. Étant donné que la maladie cardiaque peut être aggravée par une anémie d'origine médicamenteuse, les patients ayant des antécédents de maladie cardiaque importante ou instable ne doivent pas utiliser COPEGUS [voir AVERTISSEMENT ENCADRÉ et DOSAGE ET ADMINISTRATION ].
Défaillance hépatique
Les patients atteints d'hépatite C chronique (HCC) atteints de cirrhose peuvent présenter un risque de décompensation hépatique et de décès lorsqu'ils sont traités avec des interférons alpha, y compris PEGASYS. Les patients cirrhotiques CHC co-infectés par le VIH recevant un traitement antirétroviral hautement actif (HAART) et l'interféron alfa-2a avec ou sans ribavirine semblent présenter un risque accru de développer une décompensation hépatique par rapport aux patients ne recevant pas de HAART. Dans l'étude NR15961 [voir Etudes cliniques ], parmi 129 patients cirrhotiques CHC/VIH recevant un HAART, 14 (11 %) de ces patients dans tous les bras de traitement ont développé une décompensation hépatique entraînant 6 décès. Les 14 patients prenaient tous des INTI, dont la stavudine, la didanosine, l'abacavir, la zidovudine et la lamivudine. Ces petits nombres de patients ne permettent pas de discriminer entre des INTI spécifiques ou le risque associé. Pendant le traitement, l'état clinique et la fonction hépatique des patients doivent être étroitement surveillés afin de détecter tout signe et symptôme de décompensation hépatique. Le traitement par PEGASYS/COPEGUS 100 mg doit être interrompu immédiatement chez les patients présentant une décompensation hépatique [voir CONTRE-INDICATIONS ].
Hypersensibilité
Des réactions d'hypersensibilité aiguës sévères (p. ex., urticaire, œdème de Quincke, bronchoconstriction et anaphylaxie) ont été observées au cours d'un traitement par l'interféron alpha et la ribavirine. Si une telle réaction se produit, le traitement par PEGASYS et COPEGUS 100 mg doit être interrompu immédiatement et un traitement médical approprié instauré. Des réactions cutanées graves, y compris des éruptions vésiculobulleuses, des réactions dans le spectre du syndrome de Stevens-Johnson (érythème polymorphe majeur) avec divers degrés d'atteinte de la peau et des muqueuses et une dermatite exfoliative (érythrodermie) ont été signalées chez des patients recevant PEGASYS avec et sans ribavirine. Les patients développant des signes ou des symptômes de réactions cutanées sévères doivent interrompre le traitement [voir EFFETS INDÉSIRABLES ].
Troubles pulmonaires
Dyspnée, infiltrats pulmonaires, pneumonite, hypertension pulmonaire et pneumonie ont été signalés au cours du traitement par la ribavirine et l'interféron. Des cas occasionnels de pneumonie mortelle se sont produits. De plus, la sarcoïdose ou l'exacerbation de la sarcoïdose a été rapportée. S'il existe des signes d'infiltrats pulmonaires ou d'altération de la fonction pulmonaire, les patients doivent être étroitement surveillés et, le cas échéant, l'association COPEGUS/PEGASYS doit être interrompue.
Suppression de la moelle osseuse
Une pancytopénie (diminution marquée des globules rouges, des neutrophiles et des plaquettes) et une suppression de la moelle osseuse ont été signalées dans la littérature comme se produisant dans les 3 à 7 semaines suivant l'administration concomitante d'interféron pégylé/ribavirine et d'azathioprine. Chez ce nombre limité de patients (n = 8), la myélotoxicité était réversible dans les 4 à 6 semaines après l'arrêt du traitement antiviral contre le VHC et de l'azathioprine concomitante et ne réapparaissait pas lors de la réintroduction de l'un ou l'autre traitement seul. PEGASYS, COPEGUS 100 mg et l'azathioprine doivent être arrêtés en cas de pancytopénie, et l'interféron pégylé/ribavirine ne doit pas être réintroduit avec l'azathioprine concomitante [voir INTERACTIONS MÉDICAMENTEUSES ].
Pancréatite
Le traitement par COPEGUS et PEGASYS doit être suspendu chez les patients présentant des signes et symptômes de pancréatite, et interrompu chez les patients présentant une pancréatite confirmée.
Impact sur la croissance des patients pédiatriques
Au cours d'un traitement combiné allant jusqu'à 48 semaines avec PEGASYS plus ribavirine, une inhibition de la croissance a été observée chez les sujets pédiatriques âgés de 5 à 17 ans. Des diminutions du poids pour l'âge z-score et de la taille pour l'âge z-score jusqu'à 48 semaines de traitement par rapport à la ligne de base ont été observées. À 2 ans après le traitement, 16 % des sujets pédiatriques étaient à plus de 15 centiles en dessous de leur courbe de poids de base et 11 % étaient à plus de 15 centiles en dessous de leur courbe de taille de base.
Les données disponibles à plus long terme sur les sujets qui ont été suivis jusqu'à 6 ans après le traitement sont trop limitées pour déterminer le risque de diminution de la taille adulte chez certains patients [voir Expérience des études cliniques ].
Tests de laboratoire
Avant de commencer le traitement combiné PEGASYS/COPEGUS, des tests de laboratoire hématologiques et biochimiques standard sont recommandés pour tous les patients. Un dépistage de grossesse chez les femmes en âge de procréer doit être effectué. Les patients qui ont des anomalies cardiaques préexistantes doivent subir des électrocardiogrammes avant le traitement par PEGASYS/COPEGUS.
Après le début du traitement, des tests hématologiques doivent être effectués à 2 et 4 semaines et des tests biochimiques doivent être effectués à 4 semaines. Des tests supplémentaires doivent être effectués périodiquement pendant le traitement. Dans les études cliniques chez l'adulte, le CBC (y compris le taux d'hémoglobine et le nombre de globules blancs et de plaquettes) et les chimies (y compris les tests de la fonction hépatique et l'acide urique) ont été mesurés à 1, 2, 4, 6 et 8 semaines, puis toutes les 4 à 6 semaines ou plus fréquemment si des anomalies ont été trouvées. Dans l'essai clinique pédiatrique, les évaluations hématologiques et chimiques ont eu lieu à 1, 3, 5 et 8 semaines, puis toutes les 4 semaines. L'hormone stimulant la thyroïde (TSH) a été mesurée toutes les 12 semaines. Un test de grossesse mensuel doit être effectué pendant le traitement combiné et pendant 6 mois après l'arrêt du traitement.
Les critères d'entrée utilisés pour les études cliniques de COPEGUS 100 mg et PEGASYS peuvent être considérés comme une ligne directrice pour des valeurs de base acceptables pour l'initiation du traitement :
- Numération plaquettaire supérieure ou égale à 90 000 cellules/mm³ (aussi bas que 75 000 cellules/mm³ chez les patients VHC avec cirrhose ou 70 000 cellules/mm³ chez les patients avec CHC et VIH)
- Nombre absolu de neutrophiles (ANC) supérieur ou égal à 1500 cellules/mm³
- TSH et T4 dans les limites normales ou fonction thyroïdienne correctement contrôlée
- Nombre de cellules CD4+ supérieur ou égal à 200 cellules/mm³ ou nombre de cellules CD4+ supérieur ou égal à 100 cellules/mm³ mais inférieur à 200 cellules/mm³ et ARN du VIH-1 inférieur à 5 000 copies/mL chez les patients co-infectés par le VIH
- Hémoglobine supérieure ou égale à 12 g/dL pour les femmes et supérieure ou égale à 13 g/dL pour les hommes chez les patients monoinfectés par CHC
- Hémoglobine supérieure ou égale à 11 g/dL pour les femmes et supérieure ou égale à 12 g/dL pour les hommes chez les patients atteints d'HCC et de VIH
Informations sur les conseils aux patients
- Voir Étiquetage des patients approuvé par la FDA (Guide des médicaments)
Grossesse
Les patientes doivent être informées que la ribavirine peut provoquer des malformations congénitales et/ou la mort du fœtus exposé. La thérapie COPEGUS 100 mg ne doit pas être utilisée par les femmes enceintes ou par les hommes dont la partenaire féminine est enceinte. Des précautions extrêmes doivent être prises pour éviter une grossesse chez les patientes et chez les partenaires féminines de patients masculins prenant COPEGUS et pendant 6 mois après le traitement. Les patientes doivent utiliser deux méthodes fiables de contraception pendant le traitement par COPEGUS et pendant 6 mois après le traitement. La thérapie de COPEGUS ne devrait pas être lancée jusqu'à ce qu'un rapport d'un test de grossesse négatif ait été obtenu immédiatement avant l'initiation de thérapie. Les patientes doivent effectuer un test de grossesse tous les mois pendant le traitement et pendant 6 mois après le traitement.
Les patientes en âge de procréer et les patients de sexe masculin avec des partenaires féminines en âge de procréer doivent être informés des risques tératogènes/embryocides et doivent être informés de la pratique d'une contraception efficace pendant le traitement par COPEGUS et pendant 6 mois après le traitement. Les patientes doivent être avisées d'aviser immédiatement le fournisseur de soins de santé en cas de grossesse [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Anémie
L'événement indésirable le plus fréquemment associé à la ribavirine est l'anémie, qui peut être sévère [voir AVERTISSEMENT ENCADRÉ , AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ]. On devrait conseiller aux patients que les évaluations de laboratoire sont exigées avant de commencer la thérapie COPEGUS et périodiquement par la suite [voir AVERTISSEMENTS ET PRECAUTIONS ]. Il est conseillé aux patients de bien s'hydrater, en particulier pendant les premières étapes du traitement.
Les patients qui développent des étourdissements, de la confusion, de la somnolence et de la fatigue doivent être avertis d'éviter de conduire ou d'utiliser des machines.
Il faut conseiller aux patients de prendre COPEGUS 100 mg avec de la nourriture.
Les patients doivent être interrogés sur leurs antécédents de toxicomanie avant de commencer COPEGUS/PEGASYS, car des rechutes de toxicomanie et des surdoses médicamenteuses ont été rapportées chez des patients traités par interférons.
Les patients doivent être avertis de ne pas boire d'alcool, car l'alcool peut exacerber l'hépatite C chronique.
Les patients doivent être informés de ce qu'il faut faire s'ils oublient une dose de COPEGUS. Les doses oubliées doivent être prises dès que possible au cours de la même journée. Les patients ne doivent pas doubler la dose suivante. Les patients doivent être avisés d'appeler leur fournisseur de soins de santé s'ils ont des questions.
Les patients doivent être informés que l'effet du traitement par PEGASYS/COPEGUS de l'hépatite C sur la transmission n'est pas connu et que des précautions appropriées pour prévenir la transmission du virus de l'hépatite C pendant le traitement ou en cas d'échec du traitement doivent être prises.
Les patients doivent être informés des avantages et des risques potentiels liés à l'utilisation de COPEGUS. Des instructions sur l'utilisation appropriée doivent être données, y compris un examen du contenu de la notice ci-jointe. GUIDE DES MÉDICAMENTS , qui ne constitue pas une divulgation de tous les effets indésirables ou des effets indésirables possibles.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Dans une étude de cancérogénicité chez la souris p53 (+/-) jusqu'à la dose maximale tolérée de 100 mg/kg/jour, la ribavirine n'a pas été oncogène. La ribavirine n'était pas non plus oncogène dans une étude de cancérogénicité de 2 ans chez le rat à des doses allant jusqu'à la dose maximale tolérée de 60 mg/kg/jour. Sur la base de la surface corporelle, ces doses sont respectivement d'environ 0,5 et 0,6 fois la dose humaine quotidienne maximale recommandée de ribavirine.
Mutagenèse
La ribavirine a démontré une activité mutagène dans le test in vitro du lymphome de souris. Aucune activité clastogène n'a été observée dans un essai in vivo du micronoyau de souris à des doses allant jusqu'à 2 000 mg/kg. Cependant, les résultats d'études publiées dans la littérature montrent une activité clastogène dans le test in vivo du micronoyau de souris à des doses orales allant jusqu'à 2000 mg/kg. Un test de létalité dominante chez le rat était négatif, indiquant que si des mutations se produisaient chez le rat, elles n'étaient pas transmises par les gamètes mâles.
Altération de la fertilité
Dans une étude de fertilité chez le rat, la ribavirine a montré une réduction marginale du nombre de spermatozoïdes à la dose de 100 mg/kg/jour sans effet sur la fertilité. À l'arrêt du traitement, la récupération totale s'est produite après 1 cycle de spermatogenèse. Des anomalies du sperme ont été observées dans des études chez la souris visant à évaluer l'évolution dans le temps et la réversibilité de la dégénérescence testiculaire induite par la ribavirine à des doses de 15 à 150 mg/kg/jour (environ 0,1 à 0,8 fois la dose quotidienne maximale recommandée de ribavirine chez l'homme) administrées pendant 3 à 6 mois. À l'arrêt du traitement, une récupération essentiellement totale de la toxicité testiculaire induite par la ribavirine était apparente en 1 ou 2 cycles spermatogènes.
Les patientes en âge de procréer et les patients de sexe masculin avec des partenaires féminines en âge de procréer ne doivent pas recevoir COPEGUS à moins que le patient et son partenaire utilisent une contraception efficace (deux formes fiables). Sur la base d'une demi-vie de doses multiples (t½) de ribavirine de 12 jours, une contraception efficace doit être utilisée pendant 6 mois après le traitement (c'est-à-dire 15 demi-vies de clairance pour la ribavirine).
Aucune étude de toxicologie reproductive n'a été réalisée avec PEGASYS en association avec COPEGUS. Cependant, le peginterféron alfa-2a et la ribavirine, lorsqu'ils sont administrés séparément, ont chacun des effets indésirables sur la reproduction. Il faut supposer que les effets produits par l'un ou l'autre agent seul seraient également causés par la combinaison des deux agents.
Utilisation dans des populations spécifiques
Grossesse
Catégorie X [voir CONTRE-INDICATIONS ]. La ribavirine a produit des effets embryocides et/ou tératogènes significatifs chez toutes les espèces animales chez lesquelles des études adéquates ont été menées. Des malformations du crâne, du palais, des yeux, de la mâchoire, des membres, du squelette et du tractus gastro-intestinal ont été notées. L'incidence et la gravité des effets tératogènes ont augmenté avec l'augmentation de la dose de médicament. La survie des fœtus et de la progéniture a été réduite [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Dans les études conventionnelles d'embryotoxicité/tératogénicité chez les rats et les lapins, les niveaux de dose sans effet observés étaient bien inférieurs à ceux pour l'utilisation clinique proposée (0,3 mg/kg/jour pour le rat et le lapin ; environ 0,06 fois la dose humaine quotidienne recommandée de ribavirine) . Aucune toxicité maternelle ou effet sur la progéniture n'a été observé dans une étude de toxicité péri/postnatale chez des rats ayant reçu par voie orale jusqu'à 1 mg/kg/jour (environ 0,01 fois la dose quotidienne maximale recommandée de ribavirine chez l'homme).
Traitement et post-traitement : risque potentiel pour le fœtus
La ribavirine est connue pour s'accumuler dans les composants intracellulaires d'où elle est éliminée très lentement. On ne sait pas si la ribavirine est contenue dans le sperme et, si c'est le cas, exercera un effet tératogène potentiel lors de la fécondation des ovules. Cependant, en raison des effets tératogènes potentiels de la ribavirine chez l'homme, il convient de conseiller aux patients de sexe masculin de prendre toutes les précautions nécessaires pour éviter tout risque de grossesse pour leurs partenaires féminines.
COPEGUS ne doit pas être utilisé par les femmes enceintes ou par les hommes dont la partenaire féminine est enceinte. Les patientes en âge de procréer et les patients de sexe masculin avec des partenaires féminines en âge de procréer ne doivent pas recevoir COPEGUS à moins que le patient et son partenaire utilisent une contraception efficace (deux formes fiables) pendant le traitement et pendant 6 mois après le traitement [voir CONTRE-INDICATIONS ].
Registre des grossesses de la ribavirine
Un registre des grossesses à base de ribavirine a été établi pour surveiller les issues materno-fœtales des grossesses de patientes et de partenaires féminines de patients masculins exposés à la ribavirine pendant le traitement et pendant les 6 mois suivant l'arrêt du traitement. Les fournisseurs de soins de santé et les patients sont encouragés à signaler de tels cas en appelant le 1-800-593-2214.
Mères allaitantes
On ne sait pas si la ribavirine est excrétée dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel et pour éviter tout risque d'effets indésirables graves chez les nourrissons allaités par la ribavirine, une décision doit être prise soit d'arrêter l'allaitement soit le traitement par COPEGUS 100 mg, en fonction de l'importance du traitement pour la mère.
Utilisation pédiatrique
Les évaluations pharmacocinétiques chez les patients pédiatriques n'ont pas été réalisées.
La sécurité et l'efficacité de COPEGUS n'ont pas été établies chez les patients âgés de moins de 5 ans.
Utilisation gériatrique
Les études cliniques de COPEGUS 100 mg et PEGASYS n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans ou plus pour déterminer s'ils répondent différemment des sujets plus jeunes. Aucune évaluation pharmacocinétique spécifique de la ribavirine chez les personnes âgées n'a été réalisée. Le risque de réactions toxiques à ce médicament peut être plus élevé chez les patients dont la fonction rénale est altérée. La dose de COPEGUS 100 mg doit être réduite chez les patients dont la clairance de la créatinine est inférieure ou égale à 50 mL/min ; et la dose de PEGASYS doit être réduite chez les patients dont la clairance de la créatinine est inférieure à 30 mL/min [voir DOSAGE ET ADMINISTRATION ; Utilisation dans des populations spécifiques ].
Course
Une étude pharmacocinétique chez 42 sujets a démontré qu'il n'y a pas de différence cliniquement significative dans la pharmacocinétique de la ribavirine entre les sujets noirs (n = 14), hispaniques (n = 13) et caucasiens (n = 15).
Insuffisance rénale
La fonction rénale devrait être évaluée dans tous les patients avant l'initiation de COPEGUS en estimant l'autorisation creatinine du patient.
Un essai clinique a évalué le traitement par COPEGUS et PEGASYS chez 50 sujets atteints d'HCC présentant une insuffisance rénale modérée (clairance de la créatinine de 30 à 50 ml/min) ou sévère (clairance de la créatinine inférieure à 30 ml/min) ou une insuffisance rénale terminale (IRT) nécessitant une hémodialyse chronique (HD). Dans 18 sujets avec ESRD recevant HD chronique, COPEGUS a été administré à une dose de 200 mgs tous les jours sans la différence apparente dans le profil d'événement défavorable en comparaison aux sujets avec la fonction rénale normale. Des réductions de dose et des interruptions temporaires de COPEGUS (en raison d'effets indésirables liés à COPEGUS, principalement l'anémie) ont été observées chez jusqu'à un tiers des sujets ESRD/HD pendant le traitement ; et seulement un tiers de ces sujets ont reçu COPEGUS pendant 48 semaines. Les expositions plasmatiques à la ribavirine étaient environ 20 % inférieures chez les sujets atteints d'insuffisance rénale terminale sous HD par rapport aux sujets ayant une fonction rénale normale recevant la dose quotidienne standard de COPEGUS de 1 000/1 200 mg.
Les sujets atteints d'insuffisance rénale modérée (n = 17) ou sévère (n = 14) n'ont pas toléré des doses quotidiennes de 600 mg ou 400 mg de COPEGUS, respectivement, en raison d'effets indésirables liés à COPEGUS, principalement de l'anémie, et ont présenté 20 % à 30 % des expositions plasmatiques à la ribavirine plus élevées (malgré des modifications fréquentes de la dose) par rapport aux sujets ayant une fonction rénale normale (clairance de la créatinine supérieure à 80 mL/min) recevant la dose standard de COPEGUS. Les taux d'abandon étaient plus élevés chez les sujets présentant une insuffisance rénale sévère par rapport à ceux observés chez les sujets présentant une insuffisance rénale modérée ou une fonction rénale normale. La modélisation et la simulation pharmacocinétique indiquent qu'une dose de 200 mg par jour chez les patients présentant une insuffisance rénale sévère et une dose de 200 mg par jour en alternance avec 400 mg le jour suivant chez les patients présentant une insuffisance rénale modérée fourniront une exposition plasmatique à la ribavirine similaire à celle des patients ayant une fonction rénale normale. recevant le régime approuvé de COPEGUS. Ces doses n'ont pas été étudiées chez les patients [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
D'après les résultats de pharmacocinétique et d'innocuité de cet essai, les patients dont la clairance de la créatinine est inférieure ou égale à 50 mL/min devraient recevoir une dose réduite de COPEGUS; et les patients dont la clairance de la créatinine est inférieure à 30 ml/min doivent recevoir une dose réduite de PEGASYS. L'état clinique et hématologique des patients dont la clairance de la créatinine est inférieure ou égale à 50 ml/min recevant COPEGUS 100 mg doit être étroitement surveillé. Les patients présentant des anomalies de laboratoire cliniquement significatives ou des effets indésirables qui sont persistants ou qui s'aggravent doivent faire arrêter le traitement [voir DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE , et Notice PEGASYS ].
Insuffisance hépatique
L'effet d'affaiblissement hépatique sur le pharmacokinetics de ribavirin suite à l'administration de COPEGUS n'a pas été évalué. Les essais cliniques de COPEGUS 100 mg ont été limités aux patients atteints de la maladie de classe A de Child-Pugh.
Le genre
Aucune différence cliniquement significative dans la pharmacocinétique de la ribavirine n'a été observée entre les sujets masculins et féminins.
La pharmacocinétique de la ribavirine, lorsqu'elle est corrigée en fonction du poids, est similaire chez les patients masculins et féminins.
Receveurs de greffes d'organes
L'innocuité et l'efficacité du traitement par PEGASYS et COPEGUS 100 mg n'ont pas été établies chez les patients ayant subi une transplantation hépatique ou autre. Comme avec les autres interférons alpha, des rejets de greffe hépatique et rénale ont été rapportés sous PEGASYS, seul ou en association avec COPEGUS [voir EFFETS INDÉSIRABLES ].
SURDOSAGE
Aucun cas de surdosage avec COPEGUS n'a été signalé dans les essais cliniques. Une hypocalcémie et une hypomagnésémie ont été observées chez des personnes ayant reçu une dose supérieure à la dose recommandée de ribavirine. Dans la plupart de ces cas, la ribavirine a été administrée par voie intraveineuse à des doses allant jusqu'à et dans certains cas dépassant quatre fois la dose quotidienne orale maximale recommandée.
CONTRE-INDICATIONS
COPEGUS (ribavirine) est contre-indiqué dans :
- Les femmes enceintes. COPEGUS peut nuire au fœtus lorsqu'il est administré à une femme enceinte. COPEGUS est contre-indiqué chez les femmes enceintes ou susceptibles de l'être. Si ce médicament est utilisé pendant la grossesse, ou si la patiente tombe enceinte pendant qu'elle prend ce médicament, la patiente doit être informée du risque potentiel pour le fœtus [voir AVERTISSEMENTS ET PRECAUTIONS , Utilisation dans des populations spécifiques , et INFORMATIONS PATIENTS ].
- Hommes dont la partenaire féminine est enceinte.
- Patients atteints d'hémoglobinopathies (p. ex., thalassémie majeure ou anémie falciforme).
- En association avec la didanosine. Des cas d'insuffisance hépatique mortelle, ainsi que de neuropathie périphérique, de pancréatite et d'hyperlactatémie/acidose lactique symptomatique ont été rapportés dans les essais cliniques [voir INTERACTIONS MÉDICAMENTEUSES ].
Le traitement combiné COPEGUS et PEGASYS est contre-indiqué chez les patients présentant :
- Hépatite auto-immune.
- Décompensation hépatique (score de Child-Pugh supérieur à 6 ; classe B et C) chez les patients cirrhotiques monoinfectés par CHC avant traitement [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Décompensation hépatique (score de Child-Pugh supérieur ou égal à 6) chez les patients cirrhotiques HCC co-infectés par le VIH avant traitement [voir AVERTISSEMENTS ET PRECAUTIONS ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
La ribavirine est un médicament antiviral [voir Microbiologie ].
Pharmacocinétique
Des données pharmacocinétiques de doses multiples de ribavirine sont disponibles pour les patients VHC qui ont reçu de la ribavirine en association avec du peginterféron alfa-2a. Après l'administration de 1200 mg/jour avec de la nourriture pendant 12 semaines moyenne ± ET (n = 39 ; poids corporel supérieur à 75 kg), l'ASC0-12 h était de 25 361 ± 7 110 ng·h/mL et la Cmax était de 2 748 ± 818 ng/mL. Le temps moyen pour atteindre la Cmax était de 2 heures. Les concentrations plasmatiques minimales de ribavirine après 12 semaines d'administration avec de la nourriture étaient de 1 662 ± 545 ng/mL chez les patients infectés par le VHC qui ont reçu 800 mg/jour (n = 89) et de 2 112 ± 810 ng/mL chez les patients qui ont reçu 1 200 mg/jour ( n=75 ; poids corporel supérieur à 75 kg).
La demi-vie terminale de la ribavirine après administration d'une dose orale unique de COPEGUS est d'environ 120 à 170 heures. La clairance apparente totale après administration d'une dose orale unique de COPEGUS 100 mg est d'environ 26 L/h. Il y a une accumulation importante de ribavirine après plusieurs doses (deux fois par jour), de sorte que la Cmax à l'état d'équilibre était quatre fois supérieure à celle d'une dose unique.
Effet de la nourriture sur l'absorption de la ribavirine
La biodisponibilité d'une dose orale unique de ribavirine a été augmentée par la co-administration avec un repas riche en graisses. L'absorption a été ralentie (le Tmax a été doublé) et l'ASC0-192h et la Cmax ont augmenté de 42 % et 66 %, respectivement, lorsque COPEGUS a été pris avec un repas riche en graisses par rapport aux conditions de jeûne [voir DOSAGE ET ADMINISTRATION et INFORMATIONS PATIENTS ].
Élimination et métabolisme
La contribution des voies rénales et hépatiques à l'élimination de la ribavirine après administration de COPEGUS 100 mg n'est pas connue. Des études in vitro indiquent que la ribavirine n'est pas un substrat des enzymes CYP450.
Insuffisance rénale
Un essai clinique a évalué 50 sujets atteints d'HCC présentant une insuffisance rénale modérée (clairance de la créatinine de 30 à 50 ml/min) ou sévère (clairance de la créatinine inférieure à 30 ml/min) ou une insuffisance rénale terminale (IRT) nécessitant une hémodialyse chronique (HD). La clairance apparente de la ribavirine a été réduite chez les sujets ayant une clairance de la créatinine inférieure ou égale à 50 mL/min, y compris les sujets atteints d'IRT sous HD, présentant environ 30 % de la valeur trouvée chez les sujets ayant une fonction rénale normale. La modélisation et la simulation pharmacocinétique indiquent qu'une dose de 200 mg par jour chez les patients atteints d'insuffisance rénale sévère et une dose de 200 mg par jour en alternance avec 400 mg le jour suivant chez les patients atteints d'insuffisance rénale modérée fourniront des expositions plasmatiques à la ribavirine similaires à celles observées chez les patients atteints d'insuffisance rénale. fonction rénale normale recevant la dose quotidienne standard de 1000/1200 mg de COPEGUS. Ces doses n'ont pas été étudiées chez les patients.
Dans 18 sujets avec ESRD recevant HD chronique, COPEGUS a été administré à une dose de 200 mgs tous les jours. Les expositions plasmatiques à la ribavirine chez ces sujets étaient environ 20 % inférieures à celles des sujets ayant une fonction rénale normale recevant la dose quotidienne standard de COPEGUS de 1 000/1 200 mg [voir DOSAGE ET ADMINISTRATION , Utilisation dans des populations spécifiques ].
La ribavirine plasmatique est éliminée par hémodialyse avec un taux d'extraction d'environ 50 % ; cependant, en raison du grand volume de distribution de la ribavirine, l'exposition plasmatique ne devrait pas changer avec l'hémodialyse.
Microbiologie
Mécanisme d'action
Le mécanisme par lequel la ribavirine contribue à son efficacité antivirale en clinique n'est pas entièrement compris. La ribavirine a une activité antivirale directe en culture tissulaire contre de nombreux virus à ARN. La ribavirine augmente la fréquence des mutations dans les génomes de plusieurs virus à ARN et la ribavirine triphosphate inhibe la polymérase du VHC dans une réaction biochimique.
Activité antivirale en culture cellulaire
Dans le système de modèle de culture cellulaire stable du VHC (réplicon du VHC), la ribavirine a inhibé la réplication autonome de l'ARN du VHC avec une valeur de concentration efficace à 50 % (CE50) de 11 à 21 mcM. Dans le même modèle, le PEG-IFN α-2a a également inhibé la réplication de l'ARN du VHC, avec une valeur EC50 de 0,1-3 ng/mL. La combinaison de PEG-IFN α-2a et de ribavirine était plus efficace pour inhiber la réplication de l'ARN du VHC que l'un ou l'autre des agents seuls.
La résistance
Différents génotypes du VHC présentent une variabilité clinique considérable dans leur réponse au PEG-IFN-α et à la ribavirine. Les déterminants génétiques viraux associés à la réponse variable n'ont pas été définitivement identifiés.
Résistance croisée
Aucune résistance croisée entre l'IFNα et la ribavirine n'a été observée.
Toxicologie animale
Dans une étude chez le rat, il a été conclu que la létalité dominante n'était pas induite par la ribavirine à des doses allant jusqu'à 200 mg/kg pendant 5 jours (jusqu'à 1,7 fois la dose humaine maximale recommandée de ribavirine).
Des études à long terme chez la souris et le rat (18 à 24 mois ; dose de 20 à 75 et 10 à 40 mg/kg/jour, respectivement, environ 0,1 à 0,4 fois la dose humaine quotidienne maximale de ribavirine) ont démontré une relation entre une exposition chronique à la ribavirine et une incidence accrue de lésions vasculaires (hémorragies microscopiques) chez la souris. Chez les rats, une dégénérescence rétinienne s'est produite chez les témoins, mais l'incidence a augmenté chez les rats traités à la ribavirine.
Etudes cliniques
Patients atteints d'hépatite C chronique
Patients adultes
L'innocuité et l'efficacité de PEGASYS en association avec COPEGUS pour le traitement de l'infection par le virus de l'hépatite C ont été évaluées dans deux essais cliniques contrôlés randomisés. Tous les patients étaient des adultes, avaient une maladie hépatique compensée, un virus de l'hépatite C détectable, un diagnostic d'hépatite chronique par biopsie hépatique et n'avaient pas été traités auparavant par l'interféron. Environ 20 % des patients des deux études avaient une cirrhose compensée (Child-Pugh classe A). Les patients co-infectés par le VIH ont été exclus de ces études.
Dans l'étude NV15801, les patients ont été randomisés pour recevoir soit PEGASYS 180 mcg sous-cutané une fois par semaine avec un placebo oral, PEGASYS 180 mcg une fois par semaine avec COPEGUS 1 000 mg par voie orale (poids corporel inférieur à 75 kg) ou 1 200 mg par voie orale (poids corporel supérieur à ou égal à 75 kg) ou interféron alfa-2b 3 MUI sous-cutané trois fois par semaine plus ribavirine 1000 mg ou 1200 mg par voie orale. Tous les patients ont reçu 48 semaines de traitement suivies de 24 semaines de suivi sans traitement. COPEGUS ou assignation au traitement placebo a été réalisée en aveugle. Une réponse virologique soutenue a été définie comme un ARN du VHC indétectable (moins de 50 UI/mL) à la semaine 68 de l'étude ou après. PEGASYS en association avec COPEGUS 100 mg a entraîné une RVS plus élevée par rapport à PEGASYS seul ou à l'interféron alfa-2b et à la ribavirine (Tableau 9) . Dans tous les bras de traitement, les patients porteurs du génotype viral 1, quelle que soit leur charge virale, ont présenté un taux de réponse inférieur à PEGASYS en association avec COPEGUS 100 mg par rapport aux patients porteurs d'autres génotypes viraux.
La différence dans la réponse globale au traitement (PEGASYS/COPEGUS – Interféron alfa-2b/ribavirine) était de 9 % (IC à 95 % 2,3, 15,3).
Dans l'étude NV15942, tous les patients ont reçu 180 mcg de PEGASYS par voie sous-cutanée une fois par semaine et ont été randomisés pour recevoir un traitement de 24 ou 48 semaines et une dose de COPEGUS de 800 mg ou de 1 000 mg/1 200 mg (pour un poids corporel inférieur à 75 kg/supérieur à ou égal à 75 kg). L'attribution aux quatre groupes de traitement a été stratifiée selon le génotype viral et le titre viral initial du VHC. Les patients avec un génotype 1 et un titre viral élevé (défini comme supérieur à 2 x 106 copies d'ARN du VHC/mL de sérum) ont été préférentiellement assignés au traitement pendant 48 semaines.
Réponse virologique soutenue (RVS) et génotype du VHC
VHC 1 et 4 — Quel que soit le titre viral initial, un traitement de 48 semaines avec PEGASYS et 1000 mg ou 1200 mg de COPEGUS a entraîné une RVS plus élevée (définie comme un ARN du VHC indétectable à la fin de la période de suivi sans traitement de 24 semaines) par rapport à un traitement plus court (24 semaines) et/ou 800 mg de COPEGUS.
VHC 2 et 3 — Indépendamment du titre viral initial, un traitement de 24 semaines avec PEGASYS et 800 mg de COPEGUS a entraîné une RVS similaire par rapport à un traitement plus long (48 semaines) et/ou 1000 mg ou 1200 mg de COPEGUS (voir Tableau 10).
Le nombre de patients atteints des génotypes 5 et 6 était trop faible pour permettre une évaluation significative.
Patients pédiatriques
Les sujets pédiatriques non traités auparavant âgés de 5 à 17 ans (55 % de moins de 12 ans) atteints d'hépatite C chronique, d'une maladie hépatique compensée et d'ARN du VHC détectable ont été traités par COPEGUS 100 mg environ 15 mg/kg/jour plus PEGASYS 180 mcg/1,73 m² x surface corporelle une fois par semaine pendant 48 semaines. Tous les sujets ont été suivis pendant 24 semaines après le traitement. La réponse virologique soutenue (RVS) a été définie comme un taux d'ARN du VHC indétectable (moins de 50 UI/mL) à la semaine 68 de l'étude ou après celle-ci. les sujets en échec de la monothérapie par PEGASYS à 24 semaines ou plus pouvaient recevoir COPEGUS en ouvert plus PEGASYS. Les bras randomisés initiaux ont été équilibrés pour les facteurs démographiques ; 55 sujets ont reçu un traitement combiné initial de COPEGUS 100 mg plus PEGASYS et 59 ont reçu PEGASYS plus placebo ; dans la population globale en intention de traiter, 45 % étaient des femmes, 80 % étaient de race blanche et 81 % étaient infectés par le VHC de génotype 1. Les résultats de la RVS sont résumés dans le tableau 11.
Autres prédicteurs de la réponse au traitement
Les taux de réponse au traitement sont plus faibles chez les patients présentant de mauvais facteurs pronostiques recevant un traitement par interféron alpha pégylé. Dans les études NV15801 et NV15942, les taux de réponse au traitement étaient plus faibles chez les patients âgés de plus de 40 ans (50 % contre 66 %), chez les patients atteints de cirrhose (47 % contre 59 %), chez les patients pesant plus de 85 kg (49 % contre 60 %), et chez les patients de génotype 1 avec une charge virale élevée ou faible (43 % contre 56 %). Les patients afro-américains avaient des taux de réponse inférieurs à ceux des Caucasiens.
Dans les études NV15801 et NV15942, l'absence de réponse virologique précoce à 12 semaines (définie comme un ARN du VHC indétectable ou supérieur à 2 log10 inférieur à la valeur initiale) était un motif d'arrêt du traitement. Parmi les patients qui n'avaient pas de réponse virale précoce à 12 semaines et qui ont suivi le traitement recommandé malgré une option définie par le protocole pour interrompre le traitement, 5/39 (13 %) ont obtenu une RVS. Parmi les patients qui n'avaient pas de réponse virale précoce à 24 semaines, 19 ont terminé un traitement complet et aucun n'a obtenu de RVS.
Patients co-infectés par l'hépatite C chronique et le VIH
Dans l'étude NR15961, les patients atteints d'HCC/VIH ont été randomisés pour recevoir soit PEGASYS 180 mcg sous-cutané une fois par semaine plus un placebo oral, PEGASYS 180 mcg une fois par semaine plus COPEGUS 800 mg par voie orale tous les jours ou l'interféron alfa-2a, 3 MUI sous-cutané trois fois par semaine plus COPEGUS 800 mg par voie orale tous les jours. Tous les patients ont reçu 48 semaines de traitement et la réponse virologique soutenue (RVS) a été évaluée à 24 semaines de suivi sans traitement. L'attribution du traitement COPEGUS 100 mg ou placebo a été réalisée en aveugle dans les bras de traitement PEGASYS. Tous les patients étaient des adultes, avaient une maladie hépatique compensée, un virus de l'hépatite C détectable, un diagnostic d'hépatite C chronique par biopsie hépatique et n'avaient pas été traités auparavant par l'interféron. Les patients avaient également un nombre de cellules CD4+ supérieur ou égal à 200 cellules/mm³ ou un nombre de cellules CD4+ supérieur ou égal à 100 cellules/mm³ mais inférieur à 200 cellules/mm³ et un ARN VIH-1 inférieur à 5 000 copies/mL, et un état stable du VIH. Environ 15 % des patients de l'étude avaient une cirrhose. Les résultats sont présentés dans le tableau 12.
Les taux de réponse au traitement étaient plus faibles chez les patients atteints d'HCC/VIH présentant de mauvais facteurs pronostiques (y compris le génotype 1 du VHC, l'ARN du VHC supérieur à 800 000 UI/mL et la cirrhose) recevant un traitement par interféron alpha pégylé.
Parmi les patients qui n'ont pas démontré d'ARN du VHC indétectable ou au moins une réduction de 2 log10 par rapport à la valeur initiale du titre d'ARN du VHC après 12 semaines de thérapie combinée PEGASYS et COPEGUS, 2 % (2/85) ont obtenu une RVS.
Chez les patients atteints d'HCC co-infectés par le VIH qui ont reçu pendant 48 semaines PEGASYS seul ou en association avec COPEGUS 100 mg, les titres moyens et médians d'ARN du VIH n'ont pas augmenté au-dessus de la ligne de base pendant le traitement ou 24 semaines après le traitement.
INFORMATIONS PATIENTS
COPEGUS® (Co-PEG-UHS) (ribavirine) Comprimés
Lisez attentivement ce Guide des médicaments avant de commencer à prendre COPEGUS 100 mg et lisez le Guide des médicaments chaque fois que vous prenez plus de COPEGUS. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre fournisseur de soins de santé au sujet de votre état de santé ou de votre traitement.
Lisez également le Guide des médicaments pour PEGASYS (peginterféron alfa-2a).
Quelles sont les informations les plus importantes que je devrais connaître sur COPEGUS ?
- Les femmes doivent subir un test de grossesse avant de commencer COPEGUS, tous les mois pendant le traitement par COPEGUS 100 mg, et tous les mois pendant les 6 mois suivant le traitement par COPEGUS.
- Si vous ou votre partenaire sexuelle tombez enceinte pendant que vous prenez COPEGUS 100 mg ou dans les 6 mois suivant l'arrêt de COPEGUS, informez-en immédiatement votre fournisseur de soins de santé. Vous ou votre fournisseur de soins de santé devriez communiquer avec le Registre des grossesses de la ribavirine en appelant le 1-800-593-2214. Le registre des grossesses de la ribavirine recueille des informations sur ce qui arrive aux mères et à leurs bébés si la mère prend COPEGUS pendant qu'elle est enceinte.
Qu'est-ce que COPEGUS 100 mg ?
COPEGUS 100 mg est un médicament délivré sur ordonnance utilisé avec un autre médicament appelé PEGASYS (peginterféron alfa-2a) pour traiter l'hépatite C chronique (de longue durée) chez les personnes de 5 ans et plus dont le foie fonctionne toujours normalement et qui n'ont pas été traités auparavant par un médicament appelé interféron alpha. On ne sait pas si COPEGUS est sûr et fonctionnera chez les enfants de moins de 5 ans.
Qui ne devrait pas prendre COPEGUS 100mg ?
Voir « Quelle est l'information la plus importante que je devrais connaître sur COPEGUS 100 mg ?
Ne prenez pas COPEGUS si vous :
- avez certains types d'hépatite causée par votre système immunitaire attaquant votre foie (hépatite auto-immune)
- avez certains troubles sanguins, tels que la thalassémie majeure ou la drépanocytose (hémoglobinopathies)
- prendre de la didanosine (Videx ou Videx EC)
Parlez-en à votre fournisseur de soins de santé avant de commencer le traitement par COPEGUS 100 mg si vous avez l'une de ces conditions médicales.
Que dois-je dire à mon fournisseur de soins de santé avant de prendre COPEGUS 100 mg ?
Avant de prendre COPEGUS, informez votre professionnel de la santé si vous avez ou avez eu :
- un traitement contre l'hépatite C qui n'a pas fonctionné pour vous
- réactions allergiques graves à COPEGUS ou à l'un des ingrédients de COPEGUS. Voir la fin de ce Guide de Médication pour une liste d'ingrédients.
- problèmes de respiration. COPEGUS 100 mg peut provoquer ou aggraver vos problèmes respiratoires que vous avez déjà.
- problèmes de vue. COPEGUS peut causer des problèmes oculaires ou aggraver des problèmes oculaires que vous avez déjà. Vous devriez passer un examen de la vue avant de commencer le traitement par COPEGUS.
- certains troubles sanguins tels que l'anémie
- hypertension artérielle, problèmes cardiaques ou avez eu une crise cardiaque. Votre fournisseur de soins de santé devrait tester votre sang et votre cœur avant de commencer le traitement par COPEGUS.
- problèmes de thyroïde
- Diabète. L'association COPEGUS 100 mg et PEGASYS peut aggraver votre diabète ou le rendre plus difficile à traiter.
- problèmes de foie autre que l'infection par le virus de l'hépatite C
- virus de l'immunodéficience humaine (VIH) ou d'autres problèmes d'immunité
- problèmes de santé mentale, y compris la dépression ou les pensées suicidaires
- problèmes rénaux
- une greffe d'organe
- toxicomanie ou abus
- infection par le virus de l'hépatite B
- toute autre condition médicale
- allaitent. On ne sait pas si COPEGUS 100 mg passe dans votre lait maternel. Vous et votre professionnel de la santé devez décider si vous prendrez COPEGUS ou si vous allaiterez.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Certains médicaments peuvent provoquer des effets indésirables graves s'ils sont pris pendant que vous prenez également COPEGUS. Certains médicaments peuvent affecter l'action de COPEGUS 100 mg ou COPEGUS 100 mg peut affecter l'action de vos autres médicaments.
Informez en particulier votre professionnel de la santé si vous prenez des médicaments pour traiter le VIH, y compris la didanosine (Videx ou Videx EC), ou si vous prenez de l'azathioprine (Imuran ou Azasan).
Connaissez les médicaments que vous prenez. Conservez-en une liste pour la montrer à votre fournisseur de soins de santé ou à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je prendre COPEGUS 100 mg ?
- Prenez COPEGUS exactement comme votre professionnel de la santé vous l'a indiqué. Votre fournisseur de soins de santé vous dira combien de COPEGUS prendre et quand le prendre. Pour les enfants de 5 ans et plus, votre fournisseur de soins de santé vous prescrira la dose de COPEGUS 100 mg en fonction du poids.
- Prenez COPEGUS avec de la nourriture.
- Si vous oubliez une dose de COPEGUS 100 mg, prenez la dose oubliée dès que possible au cours de la même journée. Ne doublez pas la dose suivante. Si vous avez des questions sur ce qu'il faut faire, appelez votre fournisseur de soins de santé.
- Si vous avez pris trop de COPEGUS 100 mg, appelez immédiatement votre fournisseur de soins de santé ou le centre antipoison local, ou rendez-vous immédiatement à la salle d'urgence de l'hôpital le plus proche.
- Votre fournisseur de soins de santé devrait faire des tests sanguins avant de commencer le traitement par COPEGUS, aux semaines 2 et 4 de traitement, puis au besoin pour voir dans quelle mesure vous tolérez le traitement et pour vérifier les effets secondaires. Votre fournisseur de soins de santé peut modifier votre dose de COPEGUS 100 mg en fonction des résultats des tests sanguins ou des effets secondaires que vous pourriez avoir.
- Si vous avez des problèmes cardiaques, votre fournisseur de soins de santé devrait vérifier votre cœur en faisant un électrocardiogramme avant de commencer le traitement par COPEGUS, et si nécessaire pendant le traitement.
Que dois-je éviter pendant que je prends COPEGUS ?
COPEGUS 100 mg peut provoquer une sensation de fatigue, d'étourdissement ou de confusion. Vous ne devez pas conduire ou utiliser de machines si vous présentez l'un de ces symptômes.
Ne buvez pas d'alcool, y compris la bière, le vin et l'alcool. Cela peut aggraver votre maladie du foie.
Quels sont les effets secondaires possibles de COPEGUS ?
COPEGUS 100 mg peut provoquer des effets indésirables graves, notamment :
Voir « Quelles sont les informations les plus importantes que je devrais connaître sur COPEGUS 100 mg ? »
- Gonflement et irritation de votre pancréas (pancréatite). Vous pouvez avoir des douleurs à l'estomac, des nausées, des vomissements ou de la diarrhée.
- Réactions allergiques sévères. Les symptômes peuvent inclure de l'urticaire, une respiration sifflante, des difficultés respiratoires, des douleurs thoraciques, un gonflement de la bouche, de la langue ou des lèvres ou une éruption cutanée sévère.
- Graves problèmes respiratoires. La difficulté à respirer peut être le signe d'une infection pulmonaire grave (pneumonie) pouvant entraîner la mort.
- Problèmes oculaires graves pouvant entraîner une perte de vision ou la cécité.
- Problèmes de foie. Certaines personnes peuvent avoir une aggravation de la fonction hépatique. Informez immédiatement votre fournisseur de soins de santé si vous présentez l'un de ces symptômes : ballonnements d'estomac, confusion, urine brune et yeux jaunes.
- Dépression sévère
- Pensées et tentatives suicidaires
- Effet sur la croissance des enfants. Les enfants peuvent éprouver un retard dans la prise de poids et l'augmentation de la taille pendant le traitement par PEGASYS et COPEGUS. Le rattrapage de la croissance se produit après l'arrêt du traitement, mais certains enfants peuvent ne pas atteindre la taille qu'ils étaient censés avoir avant le traitement. Parlez à votre fournisseur de soins de santé si vous êtes préoccupé par la croissance de votre enfant pendant le traitement par PEGASYS et COPEGUS.
Appelez votre fournisseur de soins de santé ou obtenez de l'aide médicale immédiatement si vous présentez l'un des symptômes énumérés ci-dessus. Ceux-ci peuvent être des signes d'un effet secondaire grave du traitement par COPEGUS 100 mg.
Les effets secondaires courants de COPEGUS pris avec PEGASYS comprennent :
- symptômes pseudo-grippaux - sensation de fatigue, maux de tête, tremblements accompagnés d'une température élevée (fièvre) et douleurs musculaires ou articulaires
- changements d'humeur, irritabilité, anxiété et difficulté à dormir
- perte d'appétit, nausées, vomissements et diarrhée
- chute de cheveux
- démangeaison
Informez votre fournisseur de soins de santé de tout effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles du traitement COPEGUS. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Vous pouvez également signaler les effets secondaires à Genentech au 1-888-835-2555.
Comment conserver COPEGUS 100 mg ?
- Conservez les comprimés COPEGUS entre 59°F et 86°F (15°C et 30°C).
- Gardez le flacon bien fermé.
Gardez COPEGUS 100 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de COPEGUS
On ne sait pas si le traitement par COPEGUS 100 mg en association avec PEGASYS empêchera une personne infectée de transmettre le virus de l'hépatite C à une autre personne pendant le traitement.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. Ne pas utiliser COPEGUS 100 mg pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas COPEGUS à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Ce Guide de Médication résume les renseignements les plus importants sur COPEGUS. Si vous souhaitez plus d'informations, parlez-en à votre fournisseur de soins de santé. Vous pouvez demander à votre professionnel de la santé ou à votre pharmacien des informations sur COPEGUS rédigées à l'intention des professionnels de la santé.
Quels sont les ingrédients de COPEGUS 100mg ?
Ingrédient actif : ribavirine
Ingrédients inactifs : Le noyau du comprimé contient de l'amidon prégélatinisé, de la cellulose microcristalline, du glycolate d'amidon sodique, de l'amidon de maïs et du stéarate de magnésium. L'enrobage du comprimé contient du Chromatone-P ou Opadry Pink (fabriqué à partir d'hydroxypropylméthylcellulose, de talc, de dioxyde de titane, d'oxyde de fer jaune synthétique et d'oxyde de fer rouge synthétique), d'éthylcellulose (ECD-30) et de triacétine.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
