Clozaril 25mg, 50mg, 100mg Clozapine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Clozaril et comment est-il utilisé ?
Clozaril 100 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de la schizophrénie. Clozaril 50 mg peut être utilisé seul ou avec d'autres médicaments.
Clozaril 100 mg appartient à une classe de médicaments appelés antipsychotiques de 2e génération.
On ne sait pas si Clozaril 25 mg est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Clozaril?
Clozaril peut provoquer des effets secondaires graves, notamment :
- la faiblesse,
- fièvre,
- gencives enflées,
- mal de gorge,
- plaies buccales douloureuses,
- douleur à la déglutition,
- plaies cutanées,
- symptômes de rhume ou de grippe,
- toux,
- difficulté à respirer,
- mouvements musculaires incontrôlables des lèvres, de la langue, des yeux, du visage, des bras ou des jambes,
- maux de tête avec douleurs thoraciques et étourdissements sévères,
- des battements de cœur battants,
- flottant dans ta poitrine,
- étourdissement,
- toux soudaine,
- Respiration rapide,
- tousser du sang,
- sensation de serrement dans le cou ou la mâchoire,
- contractions ou mouvements musculaires incontrôlables,
- convulsions (perte de connaissance ou convulsions),
- peu ou pas de miction,
- gonflement des pieds ou des chevilles,
- fatigue,
- essoufflement,
- nausée,
- douleur dans le haut du ventre,
- perte d'appétit,
- saignement inhabituel,
- urine foncée,
- selles de couleur argile,
- jaunissement de la peau ou des yeux (jaunisse),
- muscles très raides (rigides),
- forte fièvre,
- transpiration,
- confusion,
- battements cardiaques rapides ou irréguliers,
- tremblements,
- augmentation de la soif,
- augmentation de la miction,
- faim,
- bouche sèche,
- odeur d'haleine fruitée,
- somnolence,
- peau sèche,
- Vision floue,
- perte de poids,
- ecchymoses ou saignements faciles,
- picotements ou engourdissements sévères,
- faiblesse musculaire,
- douleur dans le haut du ventre,
- douleur thoracique,
- toux nouvelle ou qui s'aggrave, et
- difficulté à respirer
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Clozaril comprennent :
- gain de poids,
- tremblement,
- vertiges,
- sensation de rotation,
- mal de tête,
- somnolence,
- nausée,
- constipation,
- bouche sèche,
- augmentation de la salivation,
- Vision floue,
- rythme cardiaque rapide, et
- augmentation de la transpiration
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Clozaril. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
NEUTROPÉNIE SÉVÈRE ; HYPOTENSION ORTHOSTATIQUE, BRADYCARDIE ET SYNCOPE ; SAISIE; MYOCARDITE ET CARDIOMYOPATHIE ; AUGMENTATION DE LA MORTALITÉ CHEZ LES PATIENTS ÂGÉS ATTEINTS DE PSYCHOSE LIÉE À LA DÉMENCE
Neutropénie sévère
Le traitement par CLOZARIL a provoqué une neutropénie sévère, définie comme un nombre absolu de neutrophiles (ANC) inférieur à 500/μL. Une neutropénie sévère peut entraîner une infection grave et la mort. Avant de commencer le traitement par CLOZARIL, un ANC de référence doit être d'au moins 1 500/μL pour la population générale ; et doit être d'au moins 1 000/μL pour les patients atteints de neutropénie ethnique bénigne (BEN) documentée. Pendant le traitement, les patients doivent bénéficier d'un suivi régulier des CPN. Conseillez aux patients de signaler immédiatement les symptômes compatibles avec une neutropénie grave ou une infection (p. ex. fièvre, faiblesse, léthargie ou mal de gorge) [voir POSOLOGIE ET ADMINISTRATION et MISES EN GARDE ET PRÉCAUTIONS].
En raison du risque de neutropénie sévère, CLOZARIL n'est disponible que dans le cadre d'un programme restreint dans le cadre d'une stratégie d'évaluation des risques et d'atténuation (REMS) appelée le programme REMS Clozapine. [voir MISES EN GARDE ET PRÉCAUTIONS].
Hypotension orthostatique, bradycardie, syncope
Une hypotension orthostatique, une bradycardie, une syncope et un arrêt cardiaque se sont produits avec le traitement par CLOZARIL. Le risque est le plus élevé pendant la période de titration initiale, en particulier avec une augmentation rapide de la dose. Ces réactions peuvent survenir dès la première dose, avec des doses aussi faibles que 12,5 mg par jour. Initier le traitement à 12,5 mg une ou deux fois par jour ; titrer lentement; et utiliser des doses fractionnées. Utilisez CLOZARIL avec prudence chez les patients atteints de maladies cardiovasculaires ou cérébrovasculaires ou de conditions prédisposant à l'hypotension (p. ex., déshydratation, utilisation de médicaments antihypertenseurs) [voir POSOLOGIE ET ADMINISTRATION et MISES EN GARDE ET PRÉCAUTIONS].
Saisies
Des convulsions se sont produites avec le traitement par CLOZARIL 25 mg. Le risque est dose-dépendant. Initier le traitement à 12,5 mg, titrer progressivement et utiliser une dose fractionnée. Soyez prudent lors de l'administration de CLOZARIL 50 mg à des patients ayant des antécédents de convulsions ou d'autres facteurs de risque prédisposant aux convulsions (pathologie du SNC, médicaments abaissant le seuil convulsif, abus d'alcool). Avertir les patients de s'engager dans toute activité où une perte de conscience soudaine pourrait entraîner un risque grave pour eux-mêmes ou pour les autres [voir POSOLOGIE ET ADMINISTRATION, MISES EN GARDE ET PRÉCAUTIONS].
Myocardite et cardiomyopathie
Une myocardite et une cardiomyopathie mortelles se sont produites avec le traitement par CLOZARIL. Arrêtez CLOZARIL 25 mg et obtenez une évaluation cardiaque en cas de suspicion de ces réactions. En règle générale, les patients atteints de myocardite ou de cardiomyopathie liée au clozaril ne doivent pas reprendre CLOZARIL. Envisager la possibilité d'une myocardite ou d'une cardiomyopathie en cas de douleur thoracique, de tachycardie, de palpitations, de dyspnée, de fièvre, de symptômes pseudo-grippaux, d'hypotension ou de modifications de l'ECG [voir MISES EN GARDE ET PRÉCAUTIONS].
Augmentation de la mortalité chez les patients âgés atteints de psychose liée à la démence
Les patients âgés atteints de psychose liée à la démence traités avec des médicaments antipsychotiques courent un risque accru de décès. CLOZARIL n'est pas approuvé pour une utilisation chez les patients atteints de psychose liée à la démence [voir MISES EN GARDE ET PRÉCAUTIONS].
LA DESCRIPTION
CLOZARIL® (clozapine), un antipsychotique atypique, est un dérivé tricyclique de la dibenzodiazépine, la 8-chloro-11-(4-méthyl-1-pipérazinyl)-5H-dibenzo [b,e] [1,4] diazépine. La formule structurale est
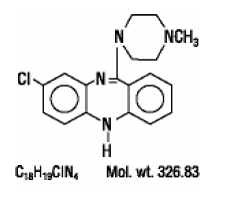
CLOZARIL est disponible en comprimés jaune pâle de 25 mg et 100 mg pour administration orale.
Ingrédient actif: clozapine
Les ingrédients inactifs sont le dioxyde de silicium colloïdal, le lactose, le stéarate de magnésium, la povidone, l'amidon (maïs) et le talc.
LES INDICATIONS
Schizophrénie résistante au traitement
CLOZARIL 50 mg est indiqué pour le traitement des patients gravement malades atteints de schizophrénie qui ne répondent pas de manière adéquate au traitement antipsychotique standard. En raison des risques de neutropénie sévère et de convulsions associés à son utilisation, CLOZARIL ne doit être utilisé que chez les patients qui n'ont pas répondu de manière adéquate au traitement antipsychotique standard [voir AVERTISSEMENTS ET PRECAUTIONS ].
L'efficacité de CLOZARIL dans la schizophrénie résistante au traitement a été démontrée dans une étude de 6 semaines, randomisée, en double aveugle, contrôlée contre comparateur actif comparant CLOZARIL et la chlorpromazine chez des patients en échec avec d'autres antipsychotiques [voir Etudes cliniques ].
Réduction du risque de comportement suicidaire récurrent dans la schizophrénie ou le trouble schizo-affectif
CLOZARIL est indiqué pour réduire le risque de comportement suicidaire récurrent chez les patients atteints de schizophrénie ou de trouble schizo-affectif jugés à risque chronique de récidive d'un comportement suicidaire, sur la base des antécédents et de l'état clinique récent. Le comportement suicidaire fait référence aux actions d'un patient qui le mettent en danger de mort.
L'efficacité de CLOZARIL dans la réduction du risque de comportements suicidaires récurrents a été démontrée sur une période de traitement de deux ans dans l'essai InterSePT™ [voir Etudes cliniques ].
DOSAGE ET ADMINISTRATION
Tests de laboratoire requis avant le début et pendant le traitement
Avant de commencer le traitement avec CLOZARIL, un ANC de base doit être obtenu. L'ANC de base doit être d'au moins 1 500/μL pour la population générale et d'au moins 1 000/μL pour les patients atteints de neutropénie ethnique bénigne (BEN). Pour poursuivre le traitement, l'ANC doit être surveillé régulièrement [voir AVERTISSEMENTS ET PRECAUTIONS ].
Informations sur le dosage
La dose initiale est de 12,5 mg une fois par jour ou deux fois par jour. La dose quotidienne totale peut être augmentée par paliers de 25 mg à 50 mg par jour, si elle est bien tolérée, pour atteindre une dose cible de 300 mg à 450 mg par jour (administrée en doses fractionnées) au bout de 2 semaines. Par la suite, la dose peut être augmentée une fois par semaine ou deux fois par semaine, par paliers allant jusqu'à 100 mg. La dose maximale est de 900 mg par jour. Pour minimiser le risque d'hypotension orthostatique, de bradycardie et de syncope, il est nécessaire d'utiliser cette faible dose initiale, un schéma d'ajustement progressif et des doses fractionnées [voir AVERTISSEMENTS ET PRECAUTIONS ].
CLOZARIL peut être pris avec ou sans nourriture [voir Pharmacocinétique ].
Traitement d'entretien
Généralement, les patients répondant à CLOZARIL doivent poursuivre le traitement d'entretien à leur dose efficace au-delà de l'épisode aigu.
Arrêt du traitement
La méthode d'arrêt du traitement variera en fonction de la dernière CPN du patient :
- Voir les tableaux 2 ou 3 pour une surveillance appropriée des soins prénatals en fonction du niveau de neutropénie si un arrêt brutal du traitement est nécessaire en raison d'une neutropénie modérée à sévère.
- Réduisez progressivement la dose sur une période de 1 à 2 semaines si l'arrêt du traitement par CLOZARIL 50 mg est prévu et qu'il n'y a aucun signe de neutropénie modérée à sévère.
- En cas d'arrêt brutal de la clozapine pour une raison non liée à la neutropénie, la poursuite de la surveillance ANC existante est recommandée pour les patients de la population générale jusqu'à ce que leur ANC soit ≥1500/μL et pour les patients BEN jusqu'à ce que leur ANC soit ≥1000/μL ou au-dessus de leur valeur initiale.
- Une surveillance supplémentaire de la CPN est requise pour tout patient signalant un début de fièvre (température de 38,5 °C ou 101,3 °F, ou plus) pendant les 2 semaines suivant l'arrêt [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Surveillez attentivement tous les patients pour détecter la récurrence des symptômes psychotiques et des symptômes liés au rebond cholinergique, tels que transpiration abondante, maux de tête, nausées, vomissements et diarrhée.
Ré-initiation du traitement
En redémarrant CLOZARIL dans les patients qui ont arrêté CLOZARIL (c'est-à-dire, 2 jours ou plus depuis la dernière dose), recommencez avec 12.5 mgs une fois tous les jours ou deux fois par jour. Cela est nécessaire pour minimiser le risque d'hypotension, de bradycardie et de syncope [voir AVERTISSEMENTS ET PRECAUTIONS ]. Si cette dose est bien tolérée, la dose peut être augmentée jusqu'à la dose thérapeutique antérieure plus rapidement que celle recommandée pour le traitement initial.
Ajustements posologiques en cas d'utilisation concomitante d'inhibiteurs du CYP1A2, CYP2D6, CYP3A4 ou d'inducteurs du CYP1A2, CYP3A4
Des ajustements posologiques peuvent être nécessaires chez les patients qui utilisent en même temps : des inhibiteurs puissants du CYP1A2 (par exemple, la fluvoxamine, la ciprofloxacine ou l'énoxacine) ; inhibiteurs modérés ou faibles du CYP1A2 (p. ex., contraceptifs oraux ou caféine); Inhibiteurs du CYP2D6 ou du CYP3A4 (p. ex., cimétidine, escitalopram, érythromycine, paroxétine, bupropion, fluoxétine, quinidine, duloxétine, terbinafine ou sertraline) ; inducteurs du CYP3A4 (p. ex., phénytoïne, carbamazépine, millepertuis et rifampicine) ; ou inducteurs du CYP1A2 (p. ex., tabagisme) (tableau 1) [voir INTERACTIONS MÉDICAMENTEUSES ].
Insuffisance rénale ou hépatique ou métaboliseurs lents du CYP2D6
Il peut être nécessaire de réduire la dose de CLOZARIL 50 mg chez les patients présentant une insuffisance rénale ou hépatique importante, ou chez les métaboliseurs lents du CYP2D6 [voir Utilisation dans des populations spécifiques ].
COMMENT FOURNIE
Formes posologiques et points forts
CLOZARIL (clozapine) est disponible sous forme de comprimés ronds, jaune pâle, non enrobés dosés à 25 mg, 50 mg et 100 mg, avec une rainure facilitée sur une face. Les comprimés de Clozaril (clozapine) à 200 mg sont des comprimés en forme de capsule, jaune pâle, non enrobés avec une rainure facilitée sur un côté.
Comprimés CLOZARIL® (clozapine)
25mg
Comprimé rond, jaune pâle, non enrobé. Débossé avec "CLOZARIL" une fois sur la périphérie d'un côté. En creux avec un score facilité et "25" une fois de l'autre côté. Flacon de 100 ......... CDN 69809-0126-05
50mg
Comprimé rond, jaune pâle, non enrobé. Débossé avec "CLOZARIL" une fois sur la périphérie d'un côté. En creux "50", un score facilité et "mg" de l'autre côté. Flacon de 100 ......... CDN 69809-0130-05
100mg
Comprimé rond, jaune pâle, non enrobé. Débossé avec "CLOZARIL" une fois sur la périphérie d'un côté. En creux avec un score facilité et "100" une fois de l'autre côté. Flacon de 100 ......... CDN 69809-0127-05
200mg
Comprimé en forme de capsule, jaune pâle, non enrobé. En creux avec "CLOZARIL" une fois sur un côté. En creux avec "200", un score facilité et "mg" de l'autre côté. Flacon de 100 ......... CDN 69809-0135-05
Stockage et manutention
La température de stockage ne doit pas dépasser 30°C (86°F).
Tenir hors de portée des enfants.
Distribué par : HLS Therapeutics (USA), Inc., Rosemont, PA 19010, (844) 457-8721. Révisé : février 2021
EFFETS SECONDAIRES
Les effets indésirables suivants sont discutés plus en détail dans d'autres sections de l'étiquetage :
- Neutropénie sévère [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypotension orthostatique, bradycardie et syncope [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Chutes [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Saisies [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Myocardite, cardiomyopathie et insuffisance valvulaire mitrale [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Augmentation de la mortalité chez les patients âgés atteints de psychose liée à la démence [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypomotilité gastro-intestinale avec complications graves [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Éosinophilie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Allongement de l'intervalle QT [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Modifications métaboliques (hyperglycémie et diabète sucré, dyslipidémie et prise de poids) [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Syndrome malin des neuroleptiques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hépatotoxicité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- fièvre [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Embolie pulmonaire [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Toxicité anticholinergique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Interférence avec les performances cognitives et motrices [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Dyskinésie tardive [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Effets indésirables cérébrovasculaires [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Récidive de la psychose et rebond cholinergique après arrêt brutal [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
Les réactions défavorables le plus communément annoncées (≥5 %) à travers les essais cliniques CLOZARIL étaient : les réactions CNS, en incluant la sédation, le vertige/le vertige, le mal de tête et le tremblement; réactions cardiovasculaires, y compris tachycardie, hypotension et syncope ; réactions du système nerveux autonome, y compris hypersalivation, transpiration, bouche sèche et troubles visuels ; réactions gastro-intestinales, y compris constipation et nausées ; et fièvre. La table 9 résume les réactions défavorables le plus communément annoncées (≥ 5 %) dans les patients CLOZARIL-traités (comparés aux patients chlorpromazine-traités) dans le pivot, 6 semaines, le procès contrôlé dans la schizophrénie résistante au traitement.
La table 10 résume les réactions défavorables annoncées dans les patients CLOZARIL-traités à une fréquence de 2 % ou plus grand à travers toutes les études CLOZARIL (excluant l'Étude d'InterSePT ™ de 2 ans). Ces taux ne sont pas ajustés en fonction de la durée d'exposition.
Le tableau 11 résume les effets indésirables les plus fréquemment signalés (> 10 % du groupe CLOZARIL ou olanzapine) dans l'étude InterSePT™. Il s'agissait d'une étude adéquate et bien contrôlée de deux ans évaluant l'efficacité de CLOZARIL par rapport à l'olanzapine pour réduire le risque de comportement suicidaire chez les patients atteints de schizophrénie ou de trouble schizo-affectif. Les taux ne sont pas ajustés en fonction de la durée d'exposition.
Dystonie
Effet de classe
Des symptômes de dystonie, des contractions anormales prolongées de groupes musculaires, peuvent survenir chez les personnes sensibles au cours des premiers jours de traitement. Les symptômes dystoniques comprennent : un spasme des muscles du cou, évoluant parfois vers une oppression de la gorge, une difficulté à avaler, une difficulté à respirer et/ou une protrusion de la langue. Bien que ces symptômes puissent survenir à de faibles doses, ils surviennent plus fréquemment et avec une plus grande gravité avec une puissance élevée et à des doses plus élevées de médicaments antipsychotiques de première génération. Un risque élevé de dystonie aiguë est observé chez les hommes et les groupes d'âge plus jeunes.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de la clozapine. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Système nerveux central
Délire, EEG anormal, myoclonie, paresthésie, cataplexie possible, état de mal épileptique, symptômes obsessionnels compulsifs, syndrome des jambes sans repos et effets indésirables de rebond cholinergique post-arrêt.
Système cardiovasculaire
Fibrillation auriculaire ou ventriculaire, tachycardie ventriculaire, palpitations, allongement de l'intervalle QT, torsades de pointes, incompétence de la valve mitrale associée à une cardiomyopathie liée à la clozapine, infarctus du myocarde, arrêt cardiaque, myocardite et œdème périorbitaire.
Système endocrinien
Pseudophéochromocytome
Système digestif
Pancréatite aiguë, dysphagie, gonflement des glandes salivaires, colite, mégacôlon, ischémie intestinale ou infarctus.
Système hépatobiliaire
Cholestase, hépatite, ictère, hépatotoxicité, stéatose hépatique, nécrose hépatique, fibrose hépatique, cirrhose hépatique, atteinte hépatique (hépatique, cholestatique et mixte) et insuffisance hépatique.
Troubles du système immunitaire
Angiœdème, vascularite leucocytoclasique.
Système urogénital
Néphrite interstitielle aiguë, énurésie nocturne, priapisme, insuffisance rénale et éjaculation rétrograde.
Troubles de la peau et du tissu sous-cutané
Réactions d'hypersensibilité : photosensibilité, vascularite, érythème polymorphe, trouble de la pigmentation cutanée et syndrome de Stevens-Johnson.
Troubles du système musculo-squelettique et du tissu conjonctif
Syndrome myasthénique, rhabdomyolyse et lupus érythémateux disséminé.
Système respiratoire
Aspiration, épanchement pleural, pneumonie, infection des voies respiratoires inférieures, apnée du sommeil.
Système sanguin et lymphatique
Leucopénie légère, modérée ou sévère, agranulocytose, granulocytopénie, diminution des globules blancs, thrombose veineuse profonde, hémoglobine/hématocrite élevée, augmentation de la vitesse de sédimentation des érythrocytes (VS), septicémie, thrombocytose et thrombocytopénie.
Troubles de la vision
Glaucome à angle fermé.
Divers
Élévation de la créatine phosphokinase, hyperuricémie, hyponatrémie, polysérite et perte de poids.
INTERACTIONS MÉDICAMENTEUSES
Possibilité que d'autres médicaments affectent CLOZARIL
La clozapine est un substrat pour de nombreuses isozymes du cytochrome P450, en particulier CYP1A2, CYP3A4 et CYP2D6. Soyez prudent lors de l'administration concomitante de CLOZARIL 100 mg avec des médicaments qui sont des inducteurs ou des inhibiteurs de ces enzymes.
Inhibiteurs du CYP1A2
L'utilisation concomitante de CLOZARIL et d'inhibiteurs du CYP1A2 peut augmenter les taux plasmatiques de clozapine, entraînant potentiellement des effets indésirables. Réduisez la dose CLOZARIL à un tiers de la dose originale quand CLOZARIL est coadministered avec de forts inhibiteurs CYP1A2 (par ex, fluvoxamine, ciprofloxacin ou enoxacin). La dose de CLOZARIL doit être augmentée à la dose initiale lorsque la co-administration d'inhibiteurs puissants du CYP1A2 est interrompue [voir DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE ].
Les inhibiteurs modérés ou faibles du CYP1A2 comprennent les contraceptifs oraux et la caféine. Surveillez étroitement les patients lorsque CLOZARIL est coadministré avec ces inhibiteurs. Envisager de réduire la posologie de CLOZARIL 25 mg si nécessaire [voir DOSAGE ET ADMINISTRATION ].
Inhibiteurs du CYP2D6 et du CYP3A4
Un traitement concomitant avec CLOZARIL et des inhibiteurs du CYP2D6 ou du CYP3A4 (p. ex., cimétidine, escitalopram, érythromycine, paroxétine, bupropion, fluoxétine, quinidine, duloxétine, terbinafine ou sertraline) peut augmenter les taux de clozapine et entraîner des effets indésirables [voir PHARMACOLOGIE CLINIQUE ]. Soyez prudent et surveillez étroitement les patients lors de l'utilisation de tels inhibiteurs. Envisagez de réduire la dose de CLOZARIL 100 mg [voir DOSAGE ET ADMINISTRATION ].
Inducteurs du CYP1A2 et du CYP3A4
Le traitement d'élément avec les médicaments qui induisent CYP1A2 ou CYP3A4 peut diminuer la concentration de plasma de clozapine, ayant pour résultat l'efficacité diminuée de CLOZARIL. La fumée de tabac est un inducteur modéré du CYP1A2. Les inducteurs puissants du CYP3A4 comprennent la carbamazépine, la phénytoïne, le millepertuis et la rifampicine. Il peut être nécessaire d'augmenter la dose de CLOZARIL 50 mg en cas d'utilisation concomitante avec des inducteurs de ces enzymes. Cependant, l'utilisation concomitante de CLOZARIL et d'inducteurs puissants du CYP3A4 n'est pas recommandée [voir DOSAGE ET ADMINISTRATION ].
Envisager de réduire la posologie de CLOZARIL 50 mg lors de l'arrêt des inducteurs enzymatiques co-administrés ; car l'arrêt des inducteurs peut entraîner une augmentation des taux plasmatiques de clozapine et un risque accru d'effets indésirables [voir DOSAGE ET ADMINISTRATION ].
Médicaments anticholinergiques
Un traitement concomitant par la clozapine et d'autres médicaments à activité anticholinergique (p. ex., benztropine, cyclobenzaprine, diphénhydramine) peut augmenter le risque de toxicité anticholinergique et d'effets indésirables gastro-intestinaux graves liés à l'hypomotilité. Éviter l'utilisation concomitante de CLOZARIL avec des médicaments anticholinergiques lorsque cela est possible [voir AVERTISSEMENTS ET PRECAUTIONS ].
Médicaments qui provoquent un allongement de l'intervalle QT
Soyez prudent lors de l'administration concomitante de médicaments qui allongent l'intervalle QT ou inhibent le métabolisme de la clozapine. Les médicaments qui provoquent un allongement de l'intervalle QT comprennent : des antipsychotiques spécifiques (p. ex., ziprasidone, ilopéridone, chlorpromazine, thioridazine, mésoridazine, dropéridol et pimozide), des antibiotiques spécifiques (p. ex., érythromycine, gatifloxacine, moxifloxacine, sparfloxacine), des antiarythmiques de classe 1A (p. ex., quinidine, procaïnamide) ou des antiarythmiques de classe III (p. ex., amiodarone, sotalol) et d'autres (p. ex., pentamidine, acétate de lévométhadyle, méthadone, halofantrine, méfloquine, mésylate de dolasétron, probucol ou tacrolimus) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Potentiel pour CLOZARIL d'affecter d'autres médicaments
L'utilisation concomitante de CLOZARIL 25 mg avec d'autres médicaments métabolisés par le CYP2D6 peut augmenter les taux de ces substrats du CYP2D6. Soyez prudent lors de la co-administration de CLOZARIL 50 mg avec d'autres médicaments métabolisés par le CYP2D6. Il peut être nécessaire d'utiliser des doses plus faibles de ces médicaments que celles habituellement prescrites. Ces médicaments comprennent des antidépresseurs spécifiques, des phénothiazines, de la carbamazépine et des antiarythmiques de type 1C (p. ex., propafénone, flécaïnide et encaïnide).
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Neutropénie sévère
Arrière plan
CLOZARIL peut provoquer une neutropénie (un faible nombre absolu de neutrophiles (ANC)), définie comme une réduction en dessous des taux normaux de neutrophiles sanguins avant le traitement. L'ANC est généralement disponible en tant que composant de la numération globulaire complète (CBC), y compris différentielle, et est plus pertinente pour la neutropénie induite par les médicaments que la numération des globules blancs (WBC). L'ANC peut également être calculé à l'aide de la formule suivante : l'ANC est égal au nombre total de globules blancs multiplié par le pourcentage total de neutrophiles obtenu à partir du différentiel (les « segments » de neutrophiles plus les « bandes » de neutrophiles). Les autres granulocytes (basophiles et éosinophiles) contribuent de façon minime à la neutropénie et leur mesure n'est pas nécessaire [voir EFFETS INDÉSIRABLES ]. La neutropénie peut être légère, modérée ou sévère (voir les tableaux 2 et 3). Pour améliorer et normaliser la compréhension, « neutropénie sévère » remplace les termes précédents leucopénie sévère, granulocytopénie sévère ou agranulocytose.
Une neutropénie sévère, ANC inférieur à (
Deux algorithmes de prise en charge distincts sont fournis ci-dessous, le premier pour les patients de la population générale et le second pour les patients identifiés comme ayant une neutropénie initiale.
CLOZARIL Traitement et surveillance dans la population générale des patients (voir tableau 2)
Obtenir un CBC, y compris la valeur ANC, avant de lancer le traitement avec CLOZARIL 25 mg pour assurer la présence d'un nombre de neutrophiles de base normal (égal ou supérieur à 1500/μL) et pour permettre des comparaisons ultérieures. Les patients de la population générale avec un NAN égal ou supérieur à (≥) 1 500/μL sont considérés comme se situant dans la plage normale (Tableau 2) et sont éligibles pour initier un traitement. Une surveillance hebdomadaire des soins prénatals est requise pour tous les patients pendant les 6 premiers mois de traitement. Si l'ANC d'un patient reste égal ou supérieur à 1500/μL pendant les 6 premiers mois de traitement, la fréquence de surveillance peut être réduite à toutes les 2 semaines pendant les 6 mois suivants. Si l'ANC reste égal ou supérieur à 1 500/μL pendant les 6 seconds mois de traitement continu, la fréquence de surveillance de l'ANC peut ensuite être réduite à une fois toutes les 4 semaines.
CLOZARIL Traitement et surveillance chez les patients atteints de neutropénie ethnique bénigne (voir tableau 3)
La neutropénie ethnique bénigne (BEN) est une affection observée dans certains groupes ethniques dont les valeurs moyennes de l'ANC sont inférieures aux plages de laboratoire « standard » pour les neutrophiles. Il est le plus souvent observé chez les personnes d'ascendance africaine (prévalence approximative de 25 à 50 %), certains groupes ethniques du Moyen-Orient et d'autres groupes ethniques non caucasiens à la peau plus foncée. BEN est plus fréquent chez les hommes. Les patients atteints de BEN ont un nombre de cellules souches hématopoïétiques et une maturation myéloïde normaux, sont en bonne santé et ne souffrent pas d'infections répétées ou graves. Ils ne courent pas un risque accru de développer une neutropénie induite par CLOZARIL. Une évaluation supplémentaire peut être nécessaire pour déterminer si la neutropénie de base est due au BEN. Envisager une consultation d'hématologie avant d'initier ou pendant le traitement par CLOZARIL 50 mg si nécessaire.
Les patients avec BEN ont besoin d'un algorithme différent d'ANC pour la gestion CLOZARIL en raison de leurs niveaux d'ANC de ligne de base inférieurs. Le tableau 3 fournit des lignes directrices pour la gestion du traitement par CLOZARIL 100 mg et la surveillance des soins prénatals chez les patients atteints de BEN.
Directives générales pour la prise en charge de tous les patients atteints de fièvre ou de neutropénie
- Fièvre : Interrompre CLOZARIL par mesure de précaution chez tout patient qui développe de la fièvre, définie comme une température de 38,5 °C [101,3 °F] ou plus, et obtenir un niveau ANC. La fièvre est souvent le premier signe d'une infection neutropénique.
- ANC inférieur à 1 000/μL : en cas de fièvre chez un patient ayant un ANC inférieur à 1 000/μL, initier un bilan et un traitement appropriés contre l'infection et consulter les tableaux 2 ou 3 pour la prise en charge.
- Envisagez une consultation en hématologie.
- Voir Syndrome malin des neuroleptiques [SMN] et fièvre sous AVERTISSEMENTS ET PRECAUTIONS et Instructions pour les patients, sous INFORMATIONS PATIENTS .
Rechallenge après un ANC inférieur à 500/μL (neutropénie sévère)
Pour certains patients qui connaissent la neutropénie sévère CLOZARIL-liée, le risque de maladie psychiatrique sérieuse d'arrêter le traitement CLOZARIL peut être plus grand que le risque de rechallenge (par ex, les patients avec la maladie schizophrène sévère qui n'ont aucune option de traitement autre que CLOZARIL). Une consultation d'hématologie peut s'avérer utile pour décider de reconvoquer un patient. En général, cependant, ne réessayez pas les patients qui développent une neutropénie sévère avec CLOZARIL ou un produit à base de clozapine.
Si un patient doit être réexaminé, le clinicien doit tenir compte des seuils fournis dans les tableaux 2 et 3, des antécédents médicaux et psychiatriques du patient, d'une discussion avec le patient et son soignant sur les avantages et les risques de la réintroduction de CLOZARIL 50 mg, et la gravité et les caractéristiques de l'épisode neutropénique.
Utilisation de CLOZARIL avec d'autres médicaments associés à la neutropénie
On ne sait pas si l'utilisation concomitante d'autres médicaments connus pour provoquer une neutropénie augmente le risque ou la gravité de la neutropénie induite par CLOZARIL. Il n'y a aucune justification scientifique solide pour éviter le traitement par CLOZARIL chez les patients traités simultanément avec ces médicaments. Si CLOZARIL 100 mg est utilisé en même temps qu'un agent connu pour provoquer une neutropénie (par exemple, certains agents chimiothérapeutiques), envisager de surveiller les patients plus étroitement que les directives de traitement fournies dans les tableaux 2 et 3. Consulter l'oncologue traitant chez les patients recevant une chimiothérapie concomitante.
Programme REMS Clozapine
CLOZARIL n'est disponible que dans le cadre d'un programme restreint dans le cadre d'un REMS appelé Programme REMS Clozapine en raison du risque de neutropénie sévère.
Les exigences notables du programme REMS Clozapine comprennent :
- Les professionnels de la santé qui prescrivent CLOZARIL 25 mg doivent être certifiés par le programme en s'inscrivant et en suivant une formation
- Les patients qui reçoivent CLOZARIL 100 mg doivent être inscrits au programme et se conformer aux exigences de test et de surveillance des soins prénatals
- Les pharmacies qui délivrent CLOZARIL 50 mg doivent être certifiées avec le programme en s'inscrivant et en suivant la formation et ne doivent distribuer qu'aux patients éligibles pour recevoir CLOZARIL
De plus amples informations sont disponibles sur www.clozapinerems.com ou au 1-844-267-8678.
Hypotension orthostatique, bradycardie et syncope
Une hypotension, une bradycardie, une syncope et un arrêt cardiaque sont survenus avec le traitement par la clozapine. Le risque est le plus élevé pendant la période de titration initiale, en particulier avec une augmentation rapide de la dose. Ces réactions peuvent survenir dès la première dose, à des doses aussi faibles que 12,5 mg. Ces réactions peuvent être mortelles. Le syndrome correspond à une bradycardie réflexe à médiation neurale (NMRB).
Le traitement doit débuter à une dose maximale de 12,5 mg une fois par jour ou deux fois par jour. La dose quotidienne totale peut être augmentée par paliers de 25 mg à 50 mg par jour, si elle est bien tolérée, jusqu'à une dose cible de 300 mg à 450 mg par jour (administrée en doses fractionnées) à la fin de 2 semaines. Par la suite, la dose peut être augmentée chaque semaine ou deux fois par semaine, par paliers allant jusqu'à 100 mg. La dose maximale est de 900 mg par jour. Utilisez une titration prudente et un schéma posologique divisé pour minimiser le risque de réactions cardiovasculaires graves [voir DOSAGE ET ADMINISTRATION ]. Envisagez de réduire la dose en cas d'hypotension. Lors du redémarrage des patients qui ont eu même un bref intervalle sans CLOZARIL (c'est-à-dire 2 jours ou plus depuis la dernière dose), ré-initier le traitement à 12,5 mg une fois par jour ou deux fois par jour [voir DOSAGE ET ADMINISTRATION ].
Utilisez CLOZARIL avec prudence chez les patients atteints de maladies cardiovasculaires (antécédents d'infarctus du myocarde ou d'ischémie, d'insuffisance cardiaque ou d'anomalies de la conduction), de maladies cérébrovasculaires et d'affections qui prédisposeraient les patients à l'hypotension (p. ex., utilisation concomitante d'antihypertenseurs, déshydratation et hypovolémie).
Des chutes
CLOZARIL 25 mg peut provoquer une somnolence, une hypotension orthostatique, une instabilité motrice et sensorielle, pouvant entraîner des chutes et, par conséquent, des fractures ou d'autres blessures. Pour les patients atteints de maladies, d'affections ou de médicaments susceptibles d'exacerber ces effets, effectuer des évaluations du risque de chute lors de l'instauration d'un traitement antipsychotique et de manière récurrente pour les patients sous traitement antipsychotique à long terme.
Saisies
On a estimé que les convulsions se produisent en association avec l'utilisation de la clozapine à une incidence cumulative à un an d'environ 5 %, d'après la survenue d'une ou de plusieurs crises chez 61 des 1 743 patients exposés à la clozapine au cours de ses essais cliniques avant la commercialisation nationale (c.-à-d. , un taux brut de 3,5 %). Le risque de convulsions est lié à la dose. Initier le traitement avec une faible dose (12,5 mg), titrer lentement et utiliser une dose fractionnée.
Soyez prudent lors de l'administration de CLOZARIL 50 mg à des patients ayant des antécédents de convulsions ou d'autres facteurs de risque prédisposant aux convulsions (par exemple, traumatisme crânien ou autre pathologie du SNC, utilisation de médicaments qui abaissent le seuil épileptogène ou abus d'alcool). À cause du risque substantiel de saisie associé à l'utilisation de CLOZARIL, avertissez des patients de s'engager dans n'importe quelle activité où la perte soudaine de conscience pourrait causer le risque sérieux à eux-mêmes ou d'autres (par ex, en conduisant une automobile, en faisant fonctionner des machines complexes, en nageant, en grimpant).
Myocardite, cardiomyopathie et insuffisance valvulaire mitrale
Une myocardite et une cardiomyopathie sont survenues avec l'utilisation de CLOZARIL. Ces réactions peuvent être mortelles. Arrêtez CLOZARIL 25 mg et obtenez une évaluation cardiaque en cas de suspicion de myocardite ou de cardiomyopathie. En règle générale, les patients ayant des antécédents de myocardite ou de cardiomyopathie associée à la clozapine ne doivent pas reprendre CLOZARIL. Cependant, si le bénéfice du traitement par CLOZARIL 25 mg est jugé supérieur aux risques potentiels de récidive de myocardite ou de cardiomyopathie, le clinicien peut envisager de reprendre CLOZARIL en consultation avec un cardiologue, après une évaluation cardiaque complète et sous surveillance étroite.
Envisager la possibilité d'une myocardite ou d'une cardiomyopathie chez les patients recevant CLOZARIL qui présentent des douleurs thoraciques, une dyspnée, une tachycardie persistante au repos, des palpitations, de la fièvre, des symptômes pseudo-grippaux, une hypotension, d'autres signes ou symptômes d'insuffisance cardiaque ou des résultats électrocardiographiques (bas voltages, anomalies ST-T, arythmies, déviation de l'axe droit et mauvaise progression de l'onde R). La myocardite survient le plus souvent au cours des 2 premiers mois de traitement par la clozapine. Les symptômes de la cardiomyopathie surviennent généralement plus tard que la myocardite associée à la clozapine et généralement après 8 semaines de traitement. Cependant, une myocardite et une cardiomyopathie peuvent survenir à n'importe quelle période du traitement par CLOZARIL. Il est courant que des symptômes pseudo-grippaux non spécifiques tels que des malaises, des myalgies, des douleurs thoraciques pleurétiques et des fièvres légères précèdent des signes plus manifestes d'insuffisance cardiaque. Les résultats de laboratoire typiques incluent une troponine I ou T élevée, une créatinine kinase MB élevée, une éosinophilie périphérique et une protéine C-réactive (CRP) élevée. La radiographie thoracique peut montrer un élargissement de la silhouette cardiaque et l'imagerie cardiaque (échocardiogramme, études radionucléotidiques ou cathétérisme cardiaque) peut révéler des signes de dysfonctionnement ventriculaire gauche. Chez les patients chez qui on a diagnostiqué une cardiomyopathie alors qu'ils prenaient CLOZARIL 50 mg, une incompétence de la valve mitrale a été rapportée. Ces cas ont signalé une régurgitation mitrale légère ou modérée à l'échocardiographie bidimensionnelle. En cas de suspicion de cardiomyopathie, envisager un examen Doppler 2D pour identifier l'incompétence de la valve mitrale.
Augmentation de la mortalité chez les patients âgés atteints de psychose liée à la démence
Les patients âgés atteints de psychose liée à la démence traités avec des médicaments antipsychotiques courent un risque accru de décès. Les analyses de 17 essais contrôlés par placebo (durée modale de 10 semaines), en grande partie chez des patients prenant des antipsychotiques atypiques, ont révélé un risque de décès chez les patients traités par des médicaments compris entre 1,6 et 1,7 fois le risque de décès chez les patients traités par placebo. Au cours d'un essai contrôlé typique de 10 semaines, le taux de décès chez les patients traités par médicament était d'environ 4,5 %, contre un taux d'environ 2,6 % dans le groupe placebo. Bien que les causes de décès aient été variées, la plupart des décès semblaient être de nature cardiovasculaire (p. ex., insuffisance cardiaque, mort subite) ou infectieuse (p. ex., pneumonie). Des études observationnelles suggèrent que, comme pour les médicaments antipsychotiques atypiques, le traitement avec des médicaments antipsychotiques conventionnels peut augmenter la mortalité dans cette population. La mesure dans laquelle les résultats d'une mortalité accrue dans les études observationnelles peuvent être attribuées au médicament antipsychotique par opposition à certaines caractéristiques des patients n'est pas claire. CLOZARIL n'est pas approuvé pour le traitement des patients atteints de psychose liée à la démence [voir AVERTISSEMENT ENCADRÉ ].
Hypomotilité gastro-intestinale avec complications graves
Des réactions indésirables gastro-intestinales graves se sont produites avec l'utilisation de CLOZARIL, principalement en raison de ses effets anticholinergiques puissants et de l'hypomotilité gastro-intestinale qui en résulte. Dans l'expérience post-commercialisation, les effets rapportés vont de la constipation à l'iléus paralytique. Une fréquence accrue de constipation et un diagnostic et un traitement tardifs ont augmenté le risque de complications graves de l'hypomotilité gastro-intestinale, entraînant une occlusion intestinale, une fécalome, un mégacôlon et une ischémie intestinale ou un infarctus [voir RÉACTION INDÉSIRABLE ]. Ces réactions ont entraîné une hospitalisation, une intervention chirurgicale et la mort. Le risque d'effets indésirables graves est encore accru avec les médicaments anticholinergiques (et d'autres médicaments qui diminuent le péristaltisme gastro-intestinal); par conséquent, l'utilisation concomitante doit être évitée dans la mesure du possible [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
Avant de commencer CLOZARIL 50 mg, dépister la constipation et traiter si nécessaire. Les symptômes subjectifs de constipation peuvent ne pas refléter exactement le degré d'hypomotilité gastro-intestinale chez les patients traités par CLOZARIL. Par conséquent, réévaluez fréquemment la fonction intestinale en portant une attention particulière à tout changement dans la fréquence ou le caractère des selles, ainsi qu'aux signes et symptômes de complications de l'hypomotilité (p. ex., nausées, vomissements, distension abdominale, douleur abdominale). Si une constipation ou une hypomotilité gastro-intestinale sont identifiées, surveiller étroitement et traiter rapidement avec des laxatifs appropriés, si nécessaire, pour prévenir les complications graves. Envisager des laxatifs prophylactiques chez les patients à haut risque.
Éosinophilie
L'éosinophilie, définie comme un nombre d'éosinophiles sanguins supérieur à 700/μL, s'est produite avec le traitement par CLOZARIL à 100 mg. Dans les essais cliniques, environ 1 % des patients ont développé une éosinophilie. L'éosinophilie liée à la clozapine survient généralement au cours du premier mois de traitement. Chez certains patients, il a été associé à une myocardite, une pancréatite, une hépatite, une colite et une néphrite. Une telle atteinte organique pourrait être compatible avec une réaction médicamenteuse avec éosinophilie et syndrome de symptômes systémiques (DRESS), également connu sous le nom de syndrome d'hypersensibilité induite par un médicament (DIHS). Si l'éosinophilie se développe pendant le traitement par CLOZARIL, évaluez rapidement les signes et les symptômes de réactions systémiques, tels qu'une éruption cutanée ou d'autres symptômes allergiques, une myocardite ou une autre maladie spécifique à un organe associée à l'éosinophilie. Si une maladie systémique liée à CLOZARIL est suspectée, arrêtez CLOZARIL 50 mg immédiatement.
Si une cause d'éosinophilie non liée à CLOZARIL 50 mg est identifiée (par exemple, asthme, allergies, maladie vasculaire du collagène, infections parasitaires et néoplasmes spécifiques), traiter la cause sous-jacente et continuer CLOZARIL.
L'éosinophilie liée à la clozapine s'est également produite en l'absence d'atteinte organique et peut disparaître sans intervention. Il y a des rapports de rechallenge réussi après l'arrêt de la clozapine, sans récidive de l'éosinophilie. En l'absence d'atteinte d'organes, continuer CLOZARIL sous surveillance étroite. Si le nombre total d'éosinophiles continue d'augmenter pendant plusieurs semaines en l'absence de maladie systémique, la décision d'interrompre le traitement par CLOZARIL 25 mg et de recommencer après la diminution du nombre d'éosinophiles doit être basée sur l'évaluation clinique globale, en consultation avec un interniste ou un hématologue.
Allongement de l'intervalle QT
Un allongement de l'intervalle QT, des torsades de pointes et d'autres arythmies ventriculaires potentiellement mortelles, un arrêt cardiaque et une mort subite sont survenus avec le traitement par CLOZARIL à 100 mg. Lors de la prescription de CLOZARIL, tenez compte de la présence de facteurs de risque supplémentaires d'allongement de l'intervalle QT et de réactions cardiovasculaires graves. Les conditions qui augmentent ces risques comprennent les suivantes : antécédents d'allongement de l'intervalle QT, syndrome du QT long, antécédents familiaux de syndrome du QT long ou de mort cardiaque subite, arythmie cardiaque importante, infarctus du myocarde récent, insuffisance cardiaque non compensée, traitement avec d'autres médicaments qui provoquent un allongement de l'intervalle QT, traitement avec des médicaments qui inhibent le métabolisme de la clozapine et des anomalies électrolytiques.
Avant de commencer le traitement avec CLOZARIL 25 mg, effectuez un examen physique minutieux, les antécédents médicaux et les antécédents de médication concomitante. Envisagez d'obtenir un ECG de base et un panel de chimie sérique. Corrigez les anomalies électrolytiques. Arrêtez CLOZARIL 25 mg si l'intervalle QTc dépasse 500 msec. Si les patients présentent des symptômes compatibles avec des torsades de pointes ou d'autres arythmies (par exemple, syncope, présyncope, étourdissements ou palpitations), obtenir une évaluation cardiaque et arrêter CLOZARIL.
Soyez prudent lors de l'administration concomitante de médicaments qui allongent l'intervalle QT ou inhibent le métabolisme de CLOZARIL. Les médicaments qui provoquent un allongement de l'intervalle QT comprennent : des antipsychotiques spécifiques (p. ex., ziprasidone, ilopéridone, chlorpromazine, thioridazine, mésoridazine, dropéridol, pimozide), des antibiotiques spécifiques (p. ex., érythromycine, gatifloxacine, moxifloxacine, sparfloxacine), des antiarythmiques de classe 1A (p. ex., quinidine, procaïnamide) ou des antiarythmiques de classe III (p. ex., amiodarone, sotalol) et d'autres (p. ex., pentamidine, acétate de lévométhadyle, méthadone, halofantrine, méfloquine, mésylate de dolasétron, probucol ou tacrolimus). La clozapine est principalement métabolisée par les isoenzymes CYP 1A2, 2D6 et 3A4. Un traitement concomitant avec des inhibiteurs de ces enzymes peut augmenter la concentration de CLOZARIL [voir INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
L'hypokaliémie et l'hypomagnésémie augmentent le risque d'allongement de l'intervalle QT. L'hypokaliémie peut résulter d'un traitement diurétique, d'une diarrhée et d'autres causes. Soyez prudent lors du traitement de patients à risque de troubles électrolytiques importants, en particulier d'hypokaliémie. Obtenir des mesures de base des taux sériques de potassium et de magnésium et surveiller périodiquement les électrolytes. Corrigez les anomalies électrolytiques avant de commencer le traitement par CLOZARIL.
Changements métaboliques
Les antipsychotiques atypiques, dont CLOZARIL 50 mg, ont été associés à des modifications métaboliques pouvant augmenter le risque cardiovasculaire et cérébrovasculaire. Ces changements métaboliques comprennent l'hyperglycémie, la dyslipidémie et la prise de poids corporel. Alors que les médicaments antipsychotiques atypiques peuvent produire certains changements métaboliques, chaque médicament de la classe a son propre profil de risque spécifique.
Hyperglycémie et diabète sucré
Une hyperglycémie, parfois extrême et associée à une acidocétose ou à un coma hyperosmolaire ou au décès, a été signalée chez des patients traités par des antipsychotiques atypiques, dont CLOZARIL. L'évaluation de la relation entre l'utilisation d'antipsychotiques atypiques et les anomalies glycémiques est compliquée par la possibilité d'un risque de fond accru de diabète sucré chez les patients atteints de schizophrénie et l'incidence croissante du diabète sucré dans la population générale. Compte tenu de ces facteurs de confusion, la relation entre l'utilisation d'antipsychotiques atypiques et les effets indésirables liés à l'hyperglycémie n'est pas complètement comprise. Cependant, des études épidémiologiques suggèrent un risque accru d'effets indésirables liés à l'hyperglycémie liés au traitement chez les patients traités par les antipsychotiques atypiques. Des estimations précises du risque d'effets indésirables liés à l'hyperglycémie chez les patients traités par des antipsychotiques atypiques ne sont pas disponibles.
Les patients avec un diagnostic établi de diabète sucré qui commencent à prendre CLOZARIL 100 mg doivent être surveillés régulièrement pour détecter une aggravation du contrôle glycémique. Les patients présentant des facteurs de risque de diabète sucré (p. ex., obésité, antécédents familiaux de diabète) qui commencent un traitement avec des antipsychotiques atypiques doivent subir un test de glycémie à jeun au début du traitement et périodiquement pendant le traitement. Tout patient traité avec des antipsychotiques atypiques doit être surveillé pour des symptômes d'hyperglycémie, y compris la polydipsie, la polyurie, la polyphagie et la faiblesse. Les patients qui développent des symptômes d'hyperglycémie pendant le traitement avec des antipsychotiques atypiques doivent subir un test de glycémie à jeun. Dans certains cas, l'hyperglycémie a disparu après l'arrêt de l'antipsychotique atypique ; cependant, certains patients ont nécessité la poursuite du traitement antidiabétique malgré l'arrêt du médicament suspect.
Dans une analyse des données regroupées de 8 études menées chez des sujets adultes atteints de schizophrénie, les variations moyennes de la glycémie à jeun dans les groupes CLOZARIL 50 mg et chlorpromazine étaient respectivement de +11 mg/dL et +4 mg/dL. Une proportion plus élevée du groupe CLOZARIL a démontré des augmentations catégoriques par rapport à la ligne de base des concentrations de glucose à jeun, par rapport au groupe chlorpromazine (Tableau 4). Les doses de CLOZARIL 25 mg étaient de 100 à 900 mg par jour (dose modale moyenne : 512 mg par jour). La dose maximale de chlorpromazine était de 1800 mg par jour (dose modale moyenne : 1029 mg par jour). La durée médiane d'exposition était de 42 jours pour CLOZARIL et la chlorpromazine.
Dyslipidémie
Des altérations indésirables des lipides sont survenues chez des patients traités par des antipsychotiques atypiques, y compris CLOZARIL. La surveillance clinique, y compris les évaluations lipidiques de base et de suivi périodiques chez les patients utilisant CLOZARIL, est recommandée.
Dans une analyse de données mises en commun de 10 études dans les sujets adultes avec la schizophrénie, le traitement CLOZARIL a été associé aux augmentations dans le sérum le cholestérol total. Aucune donnée n'a été recueillie sur le cholestérol LDL et HDL. L'augmentation moyenne du cholestérol total était de 13 mg/dL dans le groupe CLOZARIL 25 mg et de 15 mg/dL dans le groupe chlorpromazine. Dans une analyse des données regroupées de 2 études chez des sujets adultes atteints de schizophrénie, le traitement par CLOZARIL 50 mg a été associé à des augmentations des triglycérides sériques à jeun. L'augmentation moyenne des triglycérides à jeun était de 71 mg/dL (54 %) dans le groupe CLOZARIL 100 mg et de 39 mg/dL (35 %) dans le groupe chlorpromazine (Tableau 5). De plus, le traitement par CLOZARIL a été associé à des augmentations catégorielles du cholestérol total sérique et des triglycérides, comme illustré dans le tableau 6. La proportion de patients présentant des augmentations catégorielles du cholestérol total ou des triglycérides à jeun a augmenté avec la durée de l'exposition. La durée médiane d'exposition à CLOZARIL 50 mg et à la chlorpromazine était de 45 jours et de 38 jours, respectivement. La gamme de dose CLOZARIL était 100 mgs à 900 mgs tous les jours; la dose maximale de chlorpromazine était de 1800 mg par jour.
Gain de poids
Un gain de poids est survenu avec l'utilisation d'antipsychotiques, y compris CLOZARIL. Surveillez votre poids pendant le traitement par CLOZARIL. La table 7 résume les données sur le gain de poids par la durée d'exposition mises en commun de 11 études avec CLOZARIL et comparators actifs. La durée médiane d'exposition était de 609, 728 et 42 jours, dans le groupe CLOZARIL 25 mg, olanzapine et chlorpromazine, respectivement.
Le tableau 8 résume les données regroupées de 11 études chez des sujets adultes atteints de schizophrénie démontrant un gain de poids ≥ 7 % du poids corporel par rapport au départ. La durée médiane d'exposition était de 609, 728 et 42 jours, dans le groupe CLOZARIL, olanzapine et chlorpromazine, respectivement.
Syndrome malin des neuroleptiques
Les médicaments antipsychotiques, y compris CLOZARIL 50 mg, peuvent provoquer un complexe de symptômes potentiellement mortel appelé syndrome malin des neuroleptiques (SMN). Les manifestations cliniques du SMN comprennent l'hyperpyrexie, la rigidité musculaire, l'altération de l'état mental et l'instabilité autonome (pouls ou tension artérielle irréguliers, tachycardie, diaphorèse et troubles du rythme cardiaque). Les signes associés peuvent inclure une élévation de la créatine phosphokinase (CPK), une myoglobinurie, une rhabdomyolyse et une insuffisance rénale aiguë.
L'évaluation diagnostique des patients atteints de ce syndrome est compliquée. Il est important de tenir compte de la présence d'autres affections médicales graves (p. ex., neutropénie grave, infection, coup de chaleur, pathologie primaire du SNC, toxicité anticholinergique centrale, symptômes extrapyramidaux et fièvre médicamenteuse).
La prise en charge du SMN doit inclure (1) l'arrêt immédiat des médicaments antipsychotiques et d'autres médicaments non essentiels au traitement concomitant, (2) un traitement symptomatique intensif et une surveillance médicale, et (3) le traitement des conditions médicales comorbides. Il n'y a pas d'accord général sur les traitements pharmacologiques spécifiques du SMN.
Si un patient nécessite un traitement médicamenteux antipsychotique après avoir récupéré d'un SMN, la réintroduction potentielle d'un traitement médicamenteux doit être soigneusement envisagée. NMS peut se reproduire. Surveillez attentivement si vous reprenez un traitement avec des antipsychotiques.
Un SMN est survenu avec CLOZARIL en monothérapie et avec des médicaments agissant sur le SNC en concomitance, y compris le lithium.
Hépatotoxicité
Des cas d'hépatotoxicité grave, menaçant le pronostic vital et, dans certains cas, mortels, notamment une insuffisance hépatique, une nécrose hépatique et une hépatite, ont été rapportés dans des études post-commercialisation chez des patients traités par la clozapine [voir EFFETS INDÉSIRABLES ]. Surveillez l'apparition de signes et de symptômes d'hépatotoxicité tels que fatigue, malaise, anorexie, nausées, jaunisse, bilirubinémie, coagulopathie et encéphalopathie hépatique. Effectuez des tests sériques pour les lésions hépatiques et envisagez d'arrêter définitivement le traitement si l'hépatite ou les élévations des transaminases associées à d'autres symptômes systémiques sont dues à la clozapine.
Fièvre
Pendant le traitement par la clozapine, des patients ont présenté une fièvre transitoire liée à la clozapine. L'incidence maximale se situe dans les 3 premières semaines de traitement. Bien que cette fièvre soit généralement bénigne et spontanément résolutive, elle peut nécessiter l'arrêt du traitement. La fièvre peut être associée à une augmentation ou à une diminution du nombre de globules blancs. Évaluer soigneusement les patients fébriles pour exclure une neutropénie grave ou une infection. Envisager la possibilité d'un NMS [voir AVERTISSEMENTS ET PRECAUTIONS ].
Embolie pulmonaire
Des embolies pulmonaires et des thromboses veineuses profondes sont survenues chez des patients traités par CLOZARIL. Envisager la possibilité d'embolie pulmonaire chez les patients qui présentent une thrombose veineuse profonde, une dyspnée aiguë, des douleurs thoraciques ou d'autres signes et symptômes respiratoires. Il n'est pas clair si l'embolie pulmonaire et la thrombose veineuse profonde peuvent être attribuées à la clozapine ou à certaines caractéristiques des patients.
Toxicité anticholinergique
CLOZARIL 50 mg a de puissants effets anticholinergiques. Le traitement par CLOZARIL peut entraîner une toxicité anticholinergique périphérique et sur le SNC, en particulier à des doses plus élevées, ou dans des situations de surdosage [voir SURDOSAGE ]. Utiliser avec prudence chez les patients ayant un diagnostic actuel ou des antécédents de constipation, de rétention urinaire, d'hypertrophie prostatique cliniquement significative ou d'autres conditions dans lesquelles les effets anticholinergiques peuvent entraîner des effets indésirables importants. Dans la mesure du possible, évitez l'utilisation concomitante d'autres médicaments anticholinergiques car le risque de toxicité anticholinergique ou d'effets indésirables gastro-intestinaux graves est accru [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
Interférence avec les performances cognitives et motrices
CLOZARIL peut provoquer une sédation et une altération des performances cognitives et motrices. Avertissez des patients des machines dangereuses d'exploitation, en incluant des automobiles, jusqu'à ce qu'ils soient raisonnablement certains que CLOZARIL ne les affecte pas défavorablement. Ces réactions peuvent être liées à la dose. Envisagez de réduire la dose si cela se produit.
Dyskinésie tardive
Des dyskinésies tardives (DT) sont survenues chez des patients traités par des antipsychotiques, y compris CLOZARIL. Le syndrome consiste en des mouvements dyskinétiques involontaires potentiellement irréversibles. On pense que le risque de DT et la probabilité qu'elle devienne irréversible augmentent avec des durées de traitement plus longues et des doses cumulées totales plus élevées. Cependant, le syndrome peut se développer après des périodes de traitement relativement brèves à faibles doses. Prescrivez CLOZARIL de la manière la plus susceptible de minimiser le risque de développer la TD. Utilisez la dose efficace la plus faible et la durée la plus courte nécessaire pour contrôler les symptômes. Évaluer périodiquement la nécessité de poursuivre le traitement. Envisagez d'arrêter le traitement en cas de TD. Cependant, certains patients peuvent nécessiter un traitement par CLOZARIL 100 mg malgré la présence du syndrome.
Il n'existe aucun traitement connu pour la TD. Cependant, le syndrome peut disparaître partiellement ou complètement si le traitement est interrompu. Le traitement antipsychotique lui-même peut supprimer (ou supprimer partiellement) les signes et les symptômes, et il a le potentiel de masquer le processus sous-jacent. L'effet de la suppression des symptômes sur l'évolution à long terme de la DT est inconnu.
Effets indésirables cérébrovasculaires
Dans des essais contrôlés, les patients âgés atteints de psychose liée à la démence traités par certains antipsychotiques atypiques présentaient un risque accru (par rapport au placebo) d'effets indésirables cérébrovasculaires (p. ex., accident vasculaire cérébral, accident ischémique transitoire), y compris d'issue fatale. Le mécanisme de ce risque accru n'est pas connu. Un risque accru ne peut être exclu pour CLOZARIL ou d'autres antipsychotiques ou d'autres populations de patients. CLOZARIL 50 mg doit être utilisé avec prudence chez les patients présentant des facteurs de risque d'effets indésirables cérébrovasculaires.
Récidive de psychose et rebond cholinergique après arrêt brutal de CLOZARIL
Si l'arrêt brutal de CLOZARIL est nécessaire (en raison d'une neutropénie sévère ou d'une autre condition médicale, par exemple) [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS ], surveillez attentivement la récurrence des symptômes psychotiques et des effets indésirables liés au rebond cholinergique, tels que transpiration abondante, maux de tête, nausées, vomissements et diarrhée.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Aucun potentiel carcinogène n'a été démontré dans des études à long terme chez la souris et le rat à des doses allant jusqu'à 0,3 fois et 0,4 fois, respectivement, la dose humaine recommandée maximale (MRHD) de 900 mg/jour sur une base de surface corporelle en mg/m².
Mutagenèse
La clozapine n'a pas été génotoxique lorsqu'elle a été testée dans les tests de mutation génique et d'aberration chromosomique suivants : le test d'Ames bactérien, le V79 de mammifère in vitro dans des cellules de hamster chinois, la synthèse d'ADN non programmée in vitro dans des hépatocytes de rat ou le test du micronoyau in vivo chez la souris.
Altération de la fertilité
La clozapine n'a eu aucun effet sur les paramètres de fertilité, de grossesse, de poids fœtal ou de développement postnatal lorsqu'elle a été administrée par voie orale à des rats mâles 70 jours avant l'accouplement et à des rats femelles pendant 14 jours avant l'accouplement à des doses allant jusqu'à 0,4 fois la MRHD de 900 mg/jour sur une base de surface corporelle en mg/m².
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse B
Résumé des risques
Il n'y a pas d'études adéquates ou bien contrôlées sur la clozapine chez les femmes enceintes.
Des études de reproduction ont été réalisées chez des rats et des lapins à des doses allant jusqu'à 0,4 et 0,9 fois, respectivement, la dose humaine recommandée maximale (MRHD) de 900 mg/jour sur une base de surface corporelle en mg/m². Les études n'ont révélé aucune preuve d'altération de la fertilité ou d'atteinte au fœtus due à la clozapine. Puisque les études de reproduction d'animal ne sont pas toujours prédictives de réponse humaine, CLOZARIL devrait être utilisé pendant la grossesse seulement si clairement nécessaire.
Considérations cliniques
Tenez compte du risque d'exacerbation de la psychose lors de l'arrêt ou de la modification du traitement avec des médicaments antipsychotiques pendant la grossesse et le post-partum. Envisager un dépistage précoce du diabète gestationnel chez les patientes traitées avec des médicaments antipsychotiques [voir AVERTISSEMENTS ET PRECAUTIONS ]. Les nouveau-nés exposés à des médicaments antipsychotiques au cours du troisième trimestre de la grossesse sont à risque de symptômes extrapyramidaux et/ou de sevrage après l'accouchement. Surveiller les nouveau-nés pour des symptômes d'agitation, d'hypertonie, d'hypotonie, de tremblements, de somnolence, de détresse respiratoire et de difficultés d'alimentation. La gravité des complications peut varier de symptômes spontanément résolutifs à certains nouveau-nés nécessitant un soutien en unité de soins intensifs et une hospitalisation prolongée.
Données animales
Dans les études sur le développement embryofœtal, la clozapine n'a eu aucun effet sur les paramètres maternels, la taille des portées ou les paramètres fœtaux lorsqu'elle a été administrée par voie orale à des rats et des lapins gravides pendant la période d'organogenèse à des doses allant jusqu'à 0,4 et 0,9 fois, respectivement, la MRHD de 900 mg/jour. sur une base de surface corporelle en mg/m².
Dans des études sur le développement péri/postnatal, des rates gravides ont reçu de la clozapine pendant le dernier tiers de la grossesse et jusqu'au jour 21 post-partum. Les observations ont été faites sur les fœtus à la naissance et pendant la période postnatale ; la progéniture a été autorisée à atteindre la maturité sexuelle et s'est accouplée. La clozapine a provoqué une diminution du poids corporel maternel mais n'a eu aucun effet sur la taille de la portée ou le poids corporel des générations F1 ou F2 à des doses allant jusqu'à 0,4 fois la MRHD de 900 mg/jour sur une base de surface corporelle en mg/m².
Mères allaitantes
CLOZARIL 50 mg est présent dans le lait maternel. À cause du potentiel pour les réactions défavorables sérieuses dans les bébés allaités de CLOZARIL, une décision devrait être prise si arrêter allaiter ou arrêter le médicament, en tenant compte de l'importance du médicament à la mère.
Utilisation pédiatrique
L'innocuité et l'efficacité chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Il n'y a pas eu de nombres suffisants de patients gériatriques dans les études cliniques utilisant CLOZARIL 50 mg pour déterminer si les personnes de plus de 65 ans diffèrent des sujets plus jeunes dans leur réponse à CLOZARIL.
Une hypotension orthostatique et une tachycardie peuvent survenir avec le traitement par CLOZARIL 50 mg [voir AVERTISSEMENT ENCADRÉ et AVERTISSEMENTS ET PRECAUTIONS ]. Les patients âgés, en particulier ceux dont le fonctionnement cardiovasculaire est compromis, peuvent être plus sensibles à ces effets.
Les patients âgés peuvent être particulièrement sensibles aux effets anticholinergiques de CLOZARIL, tels que la rétention urinaire et la constipation [voir AVERTISSEMENTS ET PRECAUTIONS ].
Sélectionnez soigneusement les doses de CLOZARIL 50 mg chez les patients âgés, en tenant compte de leur plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque, ainsi que d'autres maladies concomitantes et d'autres traitements médicamenteux. L'expérience clinique suggère que la prévalence de la dyskinésie tardive semble être la plus élevée chez les personnes âgées ; surtout les femmes âgées [voir AVERTISSEMENTS ET PRECAUTIONS ].
Patients atteints d'insuffisance rénale ou hépatique
Une réduction de la dose peut être nécessaire chez les patients présentant une insuffisance significative de la fonction rénale ou hépatique. Les concentrations de clozapine peuvent être augmentées chez ces patients, car la clozapine est presque complètement métabolisée puis excrétée [voir DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE ].
Métaboliseurs lents du CYP2D6
Une réduction de dose peut être nécessaire chez les patients métaboliseurs lents du CYP2D6. Les concentrations de clozapine peuvent être augmentées chez ces patients, car la clozapine est presque complètement métabolisée puis excrétée [voir DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE ].
Patients de l'hospice
Pour les patients hospitalisés (c'est-à-dire les patients en phase terminale dont l'espérance de vie est estimée à six mois ou moins), le prescripteur peut réduire la fréquence de surveillance des soins prénatals à une fois tous les 6 mois, après une discussion avec le patient et son soignant. Les décisions de traitement individuelles doivent peser l'importance de la surveillance des soins prénatals dans le contexte de la nécessité de contrôler les symptômes psychiatriques et la maladie terminale du patient.
SURDOSAGE
Expérience de surdosage
Les signes et symptômes les plus fréquemment rapportés associés à un surdosage de clozapine sont : sédation, délire, coma, tachycardie, hypotension, dépression ou insuffisance respiratoire ; et hypersalivation. Des cas de pneumonie par aspiration, d'arythmies cardiaques et de convulsions ont été signalés. Des surdosages mortels ont été rapportés avec la clozapine, généralement à des doses supérieures à 2 500 mg. Il y a également eu des rapports de patients se remettant d'une surdose bien supérieure à 4 g.
Gestion du surdosage
Il n'y a aucun antidote spécifique disponible à un surdosage de CLOZARIL. Établir et maintenir une voie aérienne ; assurer une oxygénation et une ventilation adéquates. Surveiller l'état cardiaque et les signes vitaux. Utiliser des mesures symptomatiques générales et de soutien. Envisagez la possibilité d'une implication de plusieurs médicaments.
Contactez un centre antipoison certifié pour obtenir les informations les plus récentes sur la gestion du surdosage (1-800 222-1222).
CONTRE-INDICATIONS
CLOZARIL est contre-indiqué chez les patients ayant des antécédents d'hypersensibilité grave à la clozapine (p. ex., photosensibilité, vascularite, érythème polymorphe ou syndrome de Stevens-Johnson) ou à tout autre composant de CLOZARIL [voir EFFETS INDÉSIRABLES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le mécanisme d'action de la clozapine est inconnu. Cependant, il a été proposé que l'efficacité thérapeutique de la clozapine dans la schizophrénie soit médiée par l'antagonisme des récepteurs de la dopamine de type 2 (D2) et de la sérotonine de type 2A (5ÂHT2A). CLOZARIL agit également comme antagoniste des récepteurs adrénergiques, cholinergiques, histaminergiques et autres récepteurs dopaminergiques et sérotoninergiques.
Pharmacodynamie
La clozapine a démontré une affinité de liaison avec les récepteurs suivants : histamine H1 (Ki 1,1 nM), α1A adrénergique (Ki 1,6 nM), sérotonine 5-HT6 (Ki 4 nM), sérotonine 5-HT2A (Ki 5,4 nM), muscarinique M1 (Ki 6,2 nM), sérotonine 5-HT7 (Ki 6,3 nM), sérotonine 5-HT2C (Ki 9,4 nM), dopamine D4 (Ki 24 nM), adrénergique α2A (Ki 90 nM), sérotonine 5-HT3 (Ki 95 nM), sérotonine 5-HT1A (Ki 120 nM), dopamine D2 (Ki 160 nM), dopamine D1 (Ki 270 nM), dopamine D5 (Ki 454 nM) et dopamine D3 (Ki 555 nM).
La clozapine provoque peu ou pas d'élévation de la prolactine.
Les études cliniques d'électroencéphalogramme (EEG) ont démontré que la clozapine augmente l'activité delta et thêta et ralentit les fréquences alpha dominantes. Une synchronisation améliorée se produit. Une forte activité ondulatoire et des complexes pointes-ondes peuvent également se développer. Des patients ont signalé une intensification de l'activité onirique pendant le traitement par la clozapine. Le sommeil paradoxal s'est avéré être augmenté à 85% du temps de sommeil total. Chez ces patients, le début du sommeil paradoxal s'est produit presque immédiatement après l'endormissement.
Pharmacocinétique
Absorption
Chez l'homme, les comprimés de CLOZARIL (25 mg et 100 mg) sont également biodisponibles par rapport à une solution de CLOZARIL. Suite à l'administration orale de CLOZARIL 100 mg deux fois par jour, la concentration plasmatique maximale moyenne à l'état d'équilibre était de 319 ng/mL (intervalle : 102 à 771 ng/mL), survenant en moyenne 2,5 heures (intervalle : 1 à 6 heures) après dosage. La concentration minimale moyenne à l'état d'équilibre était de 122 ng/mL (intervalle : 41 à 343 ng/mL), après une administration de 100 mg deux fois par jour. La nourriture ne semble pas affecter la biodisponibilité systémique de CLOZARIL. Ainsi, CLOZARIL 50 mg peut être administré avec ou sans nourriture.
Distribution
La clozapine est liée à environ 97 % aux protéines sériques. L'interaction entre la clozapine et d'autres médicaments fortement liés aux protéines n'a pas été entièrement évaluée mais peut être importante [voir INTERACTIONS MÉDICAMENTEUSES ].
Métabolisme et excrétion
La clozapine est presque complètement métabolisée avant l'excrétion, et seules des traces de médicament inchangé sont détectées dans l'urine et les fèces. La clozapine est un substrat pour de nombreuses isozymes du cytochrome P450, en particulier CYP1A2, CYP2D6 et CYP3A4. Environ 50 % de la dose administrée est excrétée dans l'urine et 30 % dans les fèces. Les dérivés déméthylés, hydroxylés et N-oxydes sont des composants à la fois de l'urine et des matières fécales. Des tests pharmacologiques ont montré que le métabolite déméthylé (norclozapine) n'avait qu'une activité limitée, tandis que les dérivés hydroxylés et N-oxydes étaient inactifs. La demi-vie d'élimination moyenne de la clozapine après une dose unique de 75 mg était de 8 heures (intervalle : 4 à 12 heures), comparativement à une demi-vie d'élimination moyenne de 12 heures (intervalle : 4 à 66 heures), après l'atteinte de l'état d'équilibre. avec 100 mg deux fois par jour.
Une comparaison de l'administration d'une dose unique et de doses multiples de clozapine a démontré que la demi-vie d'élimination augmentait significativement après administration de doses multiples par rapport à celle après administration d'une dose unique, suggérant la possibilité d'une pharmacocinétique concentration-dépendante. Cependant, à l'état d'équilibre, des changements approximativement proportionnels à la dose en ce qui concerne l'ASC (aire sous la courbe), les concentrations plasmatiques maximales et minimales de clozapine ont été observés après l'administration de 37,5, 75 et 150 mg deux fois par jour.
Études sur les interactions médicament-médicament
Fluvoxamine
Une étude pharmacocinétique a été menée chez 16 patients schizophrènes ayant reçu de la clozapine à l'état d'équilibre. Après l'administration concomitante de fluvoxamine pendant 14 jours, les concentrations minimales moyennes de clozapine et de ses métabolites, la N-desméthylclozapine et le N-oxyde de clozapine, ont été augmentées d'environ trois fois par rapport aux concentrations initiales à l'état d'équilibre.
Paroxétine, fluoxétine et sertraline
Dans une étude portant sur des patients schizophrènes (n = 14) ayant reçu de la clozapine à l'état d'équilibre, la co-administration de paroxétine n'a produit que des modifications mineures des taux de clozapine et de ses métabolites. Cependant, d'autres rapports publiés décrivent des élévations modestes (moins de deux fois) des concentrations de clozapine et de métabolites lorsque la clozapine était prise avec de la paroxétine, de la fluoxétine et de la sertraline.
Études de population spécifiques
Insuffisance rénale ou hépatique
Aucune étude pharmacocinétique spécifique n'a été menée pour étudier les effets d'une insuffisance rénale ou hépatique sur la pharmacocinétique de la clozapine. Des concentrations plasmatiques de clozapine plus élevées sont probables chez les patients présentant une insuffisance rénale ou hépatique importante lorsqu'ils reçoivent des doses habituelles.
Métaboliseurs lents du CYP2D6
Un sous-ensemble (3 % à 10 %) de la population a une activité réduite du CYP2D6 (métaboliseurs lents du CYP2D6). Ces personnes peuvent développer des concentrations plasmatiques de clozapine plus élevées que prévu lorsqu'elles reçoivent des doses habituelles.
Etudes cliniques
Schizophrénie résistante au traitement
L'efficacité de CLOZARIL 100 mg dans la schizophrénie résistante au traitement a été établie dans une étude multicentrique, randomisée, en double aveugle, contrôlée contre comparateur actif (chlorpromazine) chez des patients avec un diagnostic DSM-III de schizophrénie qui avaient des réponses inadéquates à au moins 3 antipsychotiques différents ( d'au moins 2 classes chimiques différentes) au cours des 5 dernières années. Les essais antipsychotiques doivent avoir été jugés adéquats ; les doses d'antipsychotiques doivent avoir été équivalentes ou supérieures à 1000 mg par jour de chlorpromazine pendant une période d'au moins 6 semaines, chacune sans réduction significative des symptômes. Il ne doit y avoir eu aucune période de bon fonctionnement au cours des 5 années précédentes. Les patients doivent avoir eu un score de base d'au moins 45 sur l'échelle d'évaluation psychiatrique brève (BPRS) évaluée par l'investigateur. Sur le BPRS à 18 items, 1 indique l'absence de symptômes et 7 indique des symptômes sévères ; le score BPRS total potentiel maximal est de 126. Au départ, le score BPRS moyen était de 61. De plus, les patients doivent avoir obtenu un score d'au moins 4 sur au moins deux des quatre éléments BPRS individuels suivants : désorganisation conceptuelle, suspicion, hallucination. comportement et un contenu de pensée inhabituel. Les patients doivent avoir un score Clinical Global Impressions-Severity Scale d'au moins 4 (modérément malade).
Dans la phase prospective préliminaire de l'essai, tous les patients (N = 305) ont initialement reçu un traitement en simple aveugle par l'halopéridol (la dose moyenne était de 61 mg par jour) pendant 6 semaines. Plus de 80 % des patients ont terminé l'essai de 6 semaines. Les patients avec une réponse inadéquate à l'halopéridol (n = 268) ont été randomisés pour un traitement en double aveugle avec CLOZARIL (N = 126) ou chlorpromazine (N = 142). La dose quotidienne maximale de CLOZARIL était de 900 mg; la dose quotidienne moyenne était > 600 mg. La dose quotidienne maximale de chlorpromazine était de 1800 mg; la dose quotidienne moyenne était > 1200 mg.
Le critère d'évaluation principal était la réponse au traitement, prédéfinie comme une diminution du score BPRS d'au moins 20 % et soit (1) un score CGI-S
Comportement suicidaire récurrent dans la schizophrénie ou le trouble schizo-affectif
L'efficacité de CLOZARIL dans la réduction du risque de comportement suicidaire récurrent a été évaluée dans le cadre de l'International Suicide Prevention Trial (InterSePT™, une marque déposée de Novartis Pharmaceuticals Corporation). Il s'agissait d'une comparaison prospective, randomisée, ouverte, multicentrique, internationale, en groupes parallèles, de CLOZARIL versus olanzapine (*Zyprexa®, une marque déposée d'Eli Lilly and Company) chez 956 patients atteints de schizophrénie ou de troubles schizo-affectifs ( DSM-IV) jugés à risque de comportements suicidaires récurrents. Seulement environ un quart de ces patients (27 %) étaient considérés comme résistants au traitement médicamenteux antipsychotique standard. Pour participer à l'essai, les patients doivent avoir satisfait à l'un des critères suivants :
- Ils avaient tenté de se suicider au cours des trois années précédant leur évaluation initiale.
- Ils avaient été hospitalisés pour prévenir une tentative de suicide dans les trois ans précédant leur évaluation initiale.
- Ils ont démontré des idées suicidaires modérées à sévères avec une composante dépressive dans la semaine précédant leur évaluation de base.
- Ils ont démontré des idées suicidaires modérées à sévères accompagnées d'hallucinations d'ordre de s'automutiler dans la semaine précédant leur évaluation de base.
Les schémas posologiques pour chaque groupe de traitement ont été déterminés par des investigateurs individuels et ont été individualisés par patient. La posologie était flexible, avec une gamme de doses de 200 à 900 mg/jour pour CLOZARIL et de 5 à 20 mg/jour pour l'olanzapine. Pour les 956 patients qui ont reçu CLOZARIL ou l'olanzapine dans cette étude, il y avait une utilisation importante de psychotropes concomitants : 84 % avec des antipsychotiques, 65 % avec des anxiolytiques, 53 % avec des antidépresseurs et 28 % avec des thymorégulateurs. Il y avait une utilisation significativement plus importante de médicaments psychotropes concomitants chez les patients du groupe olanzapine.
La principale mesure d'efficacité était le temps écoulé avant (1) une tentative de suicide importante, y compris un suicide réussi ; (2) hospitalisation en raison d'un risque suicidaire imminent, y compris un niveau accru de surveillance des tendances suicidaires pour les patients déjà hospitalisés ; ou (3) aggravation de la sévérité de la suicidalité, comme démontrée par « une aggravation importante » ou « une aggravation très importante » par rapport au départ dans l'impression clinique globale de la sévérité de la suicidalité telle qu'évaluée par l'échelle du psychiatre en aveugle (CGI-SS-BP). Le Suicide Monitoring Board (SMB), un groupe d'experts ignorant les données des patients, a déterminé si un événement signalé répondait ou non au critère 1 ou 2 ci-dessus.
Au total, 980 patients ont été randomisés dans l'étude et 956 ont reçu le médicament de l'étude. Soixante-deux pour cent des patients ont reçu un diagnostic de schizophrénie et les autres (38 %) ont reçu un diagnostic de trouble schizo-affectif. Seul un quart environ de la population totale de patients (27 %) a été identifié comme « résistant au traitement » au départ. Il y avait plus d'hommes que de femmes dans l'étude (61 % de tous les patients étaient des hommes). L'âge moyen des patients entrant dans l'étude était de 37 ans (intervalle de 18 à 69 ans). La plupart des patients étaient de race blanche (71 %), 15 % étaient noirs, 1 % étaient asiatiques et 13 % étaient classés comme appartenant à d'"autres" races.
Les patients traités par CLOZARIL 100 mg présentaient un délai statistiquement plus long avant la survenue de comportements suicidaires récurrents par rapport à l'olanzapine. Ce résultat doit être interprété uniquement comme une preuve de l'efficacité de CLOZARIL pour retarder la survenue de comportements suicidaires récurrents et non comme une démonstration de l'efficacité supérieure de CLOZARIL 50 mg par rapport à l'olanzapine.
La probabilité de subir (1) une tentative de suicide importante, y compris un suicide réussi, ou (2) une hospitalisation en raison d'un risque suicidaire imminent, y compris un niveau accru de surveillance des tendances suicidaires pour les patients déjà hospitalisés, était plus faible pour les patients sous CLOZARIL que pour les patients sous olanzapine à Semaine 104 : CLOZARIL 24 % versus olanzapine 32 % ; IC à 95 % de la différence : 2 %, 14 % (Figure 1).
Figure 1 : Probabilité cumulée d'une tentative de suicide importante ou d'une hospitalisation pour prévenir le suicide chez les patients atteints de schizophrénie ou de trouble schizo-affectif à haut risque de suicidalité
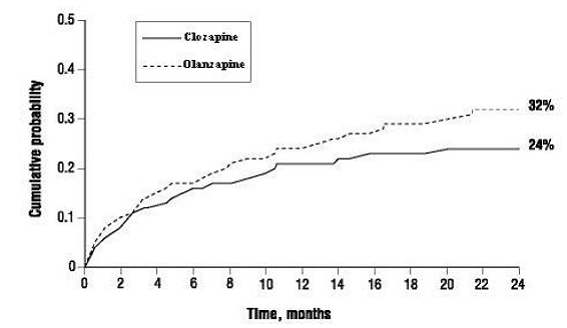
INFORMATIONS PATIENTS
Discutez des problèmes suivants avec les patients et les soignants :
- Neutropénie sévère :
- Instruisez les patients (et les travailleurs sociaux) commençant le traitement avec CLOZARIL du risque de développer la neutropénie sévère et l'infection.
- Demandez aux patients de signaler immédiatement à leur médecin tout symptôme ou signe d'infection (p. ex., syndrome pseudo-grippal, fièvre, léthargie, faiblesse ou malaise général, ulcération des muqueuses, infection cutanée, pharyngée, vaginale, urinaire ou pulmonaire, ou faiblesse extrême). ou léthargie) survenant à tout moment pendant le traitement par CLOZARIL 100 mg, pour faciliter l'évaluation de la neutropénie et pour instituer une prise en charge rapide et appropriée. [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Informer les patients et les soignants CLOZARIL 25 mg est disponible uniquement dans le cadre d'un programme restreint appelé Programme REMS Clozapine conçu pour assurer la surveillance sanguine requise, afin de réduire le risque de développer une neutropénie sévère. Informez les patients et les soignants de l'importance de subir des tests sanguins comme suit :
- Des tests sanguins hebdomadaires sont nécessaires pendant les 6 premiers mois.
- Une CPN est requise toutes les 2 semaines pendant les 6 mois suivants si une CPN acceptable est maintenue pendant les 6 premiers mois de traitement continu,
- Un ANC est requis une fois toutes les 4 semaines par la suite si un ANC acceptable est maintenu pendant les 6 deuxièmes mois de traitement continu.
- CLOZARIL 50 mg est disponible uniquement dans les pharmacies certifiées participant au programme. Fournir aux patients (et aux soignants) des informations sur le site Web et le numéro de téléphone permettant d'obtenir le produit (www.clozapinerems.com ou 1-844-267-8678) [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Hypotension orthostatique, bradycardie et syncope : Informez les patients et les soignants du risque d'hypotension orthostatique et de syncope, en particulier pendant la période de titration de la dose initiale. Demandez-leur de suivre strictement les instructions du clinicien concernant la posologie et l'administration. Conseillez aux patients de consulter immédiatement leur médecin s'ils se sentent faibles, perdent connaissance ou présentent des signes ou des symptômes évoquant une bradycardie ou une arythmie [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS ].
- Convulsions : Informer les patients et les soignants du risque important de convulsions pendant le traitement par CLOZARIL 100 mg. Avertissez-les de la conduite et de toute autre activité potentiellement dangereuse pendant la prise de CLOZARIL [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Hypomotilité gastro-intestinale avec complications graves : éduquer les patients et les soignants sur les risques, la prévention et le traitement de la constipation induite par la clozapine, y compris les médicaments à éviter dans la mesure du possible (par exemple, les médicaments à activité anticholinergique). Encouragez une hydratation, une activité physique et un apport en fibres appropriés et insistez sur le fait qu'une attention et un traitement rapides du développement de la constipation ou d'autres symptômes gastro-intestinaux sont essentiels pour prévenir les complications graves. Conseillez aux patients et aux soignants de contacter leur fournisseur de soins de santé s'ils présentent des symptômes de constipation (p. ex., difficulté à évacuer les selles, passage incomplet des selles, diminution de la fréquence des selles) ou d'autres symptômes associés à une hypomotilité gastro-intestinale (p. ex., nausées, distension ou douleur abdominale, vomissements) [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
- Allongement de l'intervalle QT : Conseillez aux patients de consulter immédiatement leur médecin s'ils se sentent faibles, perdent connaissance ou présentent des signes ou des symptômes suggérant une arythmie. Demandez aux patients de ne pas prendre CLOZARIL avec d'autres médicaments qui provoquent un allongement de l'intervalle QT. Demandez aux patients d'informer leurs cliniciens qu'ils prennent CLOZARIL 25 mg avant tout nouveau médicament [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
- Changements métaboliques (hyperglycémie et diabète sucré, dyslipidémie, prise de poids) : Éduquer les patients et les soignants sur le risque de changements métaboliques et la nécessité d'une surveillance spécifique. Les risques comprennent l'hyperglycémie et le diabète sucré, la dyslipidémie, la prise de poids et les réactions cardiovasculaires. Éduquer les patients et les soignants sur les symptômes de l'hyperglycémie (glycémie élevée) et du diabète sucré (p. ex., polydipsie, polyurie, polyphagie et faiblesse). Surveiller tous les patients pour ces symptômes. Les patients qui reçoivent un diagnostic de diabète ou qui présentent des facteurs de risque de diabète (obésité, antécédents familiaux de diabète) doivent faire surveiller leur glycémie à jeun avant de commencer le traitement et périodiquement pendant le traitement. Les patients qui développent des symptômes d'hyperglycémie doivent subir des évaluations de la glycémie à jeun. Une surveillance clinique du poids est recommandée [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Interférence avec les performances cognitives et motrices : étant donné que CLOZARIL peut avoir le potentiel d'altérer le jugement, la réflexion ou les habiletés motrices, les patients doivent être avertis de l'utilisation de machines dangereuses, y compris les automobiles, jusqu'à ce qu'ils soient raisonnablement certains que le traitement par CLOZARIL ne les affecte pas défavorablement [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Doses oubliées et reprise du traitement : informez les patients et les soignants que si le patient oublie de prendre CLOZARIL 50 mg pendant plus de 2 jours, il ne doit pas reprendre son traitement à la même posologie, mais doit contacter son médecin pour obtenir des instructions sur la posologie [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS ].
- Grossesse : les patientes et les soignants doivent informer le clinicien si la patiente tombe enceinte ou a l'intention de tomber enceinte pendant le traitement [voir Utilisation dans des populations spécifiques ].
- Soins infirmiers : Avisez les patients et les soignants que le patient ne doit pas allaiter un nourrisson s'ils prennent CLOZARIL [voir Utilisation dans des populations spécifiques ].
- Médicaments concomitants : conseillez aux patients d'informer leur fournisseur de soins de santé s'ils prennent ou prévoient de prendre des médicaments sur ordonnance ou en vente libre ; il existe un potentiel d'interactions médicamenteuses importantes [voir DOSAGE ET ADMINISTRATION , INTERACTIONS MÉDICAMENTEUSES ].
