Anafranil 10mg, 25mg, 50mg Clomipramine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Anafranil 10 mg et comment est-il utilisé ?
Anafranil 50 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes du trouble obsessionnel-compulsif. Anafranil 50 mg peut être utilisé seul ou avec d'autres médicaments.
Anafranil appartient à une classe de médicaments appelés antidépresseurs, TCA.
On ne sait pas si Anafranil 50 mg est sûr et efficace chez les enfants de moins de 10 ans.
Quels sont les effets secondaires possibles d'Anafranil 25mg ?
Anafranil 50 mg peut provoquer des effets secondaires graves, notamment :
- démangeaison de la peau,
- fièvre,
- glandes enflées,
- symptômes pseudo-grippaux,
- douleurs musculaires,
- grande faiblesse,
- ecchymoses inhabituelles,
- jaunissement de la peau et des yeux (jaunisse),
- changements de comportement,
- anxiété,
- crises de panique,
- troubles du sommeil,
- comportement impulsif,
- irritabilité,
- agitation,
- hostilité,
- agressivité,
- hyperactif (mentalement ou physiquement),
- la dépression,
- pensées suicidaires,
- Vision floue,
- vision tunnel,
- douleur ou gonflement des yeux,
- voir des halos autour des lumières,
- fréquence cardiaque rapide,
- tremblements ou secousses,
- confusion,
- peur extrême,
- miction douloureuse ou difficile,
- saisie,
- fièvre,
- hallucinations,
- transpiration,
- frissons,
- rythme cardiaque rapide,
- rigidité musculaire,
- contractions musculaires,
- manque de coordination,
- nausée,
- des vomissements et
- diarrhée
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Anafranil comprennent:
- bouche sèche,
- nausée,
- maux d'estomac,
- perte d'appétit,
- constipation,
- ressentir de l'anxiété,
- vertigineux,
- somnolence,
- fatigué,
- problèmes de sommeil,
- changements d'appétit ou de poids,
- problèmes de mémoire,
- difficulté à se concentrer,
- augmentation de la transpiration,
- engourdissement ou fourmillement,
- changements de vision,
- diminution de la libido,
- l'impuissance, et
- difficulté à avoir un orgasme
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Anafranil. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
Suicidalité et antidépresseurs
Les antidépresseurs ont augmenté le risque par rapport au placebo de pensées et de comportements suicidaires (suicidalité) chez les enfants, les adolescents et les jeunes adultes dans des études à court terme sur le trouble dépressif majeur (TDM) et d'autres troubles psychiatriques. Quiconque envisage l'utilisation de chlorhydrate de clomipramine ou de tout autre antidépresseur chez un enfant, un adolescent ou un jeune adulte doit équilibrer ce risque avec le besoin clinique. Les études à court terme n'ont pas montré d'augmentation du risque de suicide avec les antidépresseurs par rapport au placebo chez les adultes au-delà de 24 ans ; il y avait une réduction du risque avec les antidépresseurs par rapport au placebo chez les adultes âgés de 65 ans et plus. La dépression et certains autres troubles psychiatriques sont eux-mêmes associés à une augmentation du risque de suicide. Les patients de tous âges qui commencent un traitement antidépresseur doivent être surveillés de manière appropriée et observés de près pour déceler une aggravation clinique, des tendances suicidaires ou des changements inhabituels de comportement. Les familles et les soignants doivent être informés de la nécessité d'une surveillance étroite et d'une communication avec le prescripteur. L'utilisation du chlorhydrate de clomipramine n'est pas approuvée chez les patients pédiatriques, à l'exception des patients atteints de trouble obsessionnel compulsif (TOC) (voir AVERTISSEMENTS , Aggravation clinique et risque de suicide ; INFORMATIONS PATIENTS ; et PRÉCAUTIONS , Utilisation pédiatrique ).
LA DESCRIPTION
Anafranil™ (chlorhydrate de clomipramine) Capsules USP est un médicament antiobsessionnel qui appartient à la classe (dibenzazépine) d'agents pharmacologiques connus sous le nom d'antidépresseurs tricycliques. Anafranil est disponible sous forme de gélules de 25, 50 et 75 mg pour administration orale.
Le chlorhydrate de clomipramine USP est le monochlorhydrate de 3-chloro-5-[3-(diméthylamino)propyl]-10,11-dihydro5H-dibenz[b,f]azépine, et sa formule structurale est :
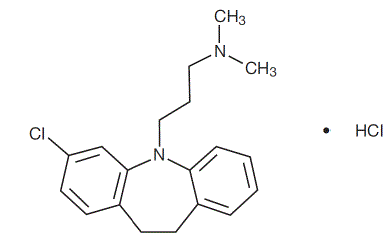
C19H23ClN2 • HCl PM = 351,31
Le chlorhydrate de clomipramine USP est une poudre cristalline blanche à blanc cassé. Il est librement soluble dans l'eau, dans le méthanol et dans le chlorure de méthylène, et insoluble dans l'éther éthylique et dans l'hexane.
Ingrédients inactifs. D&C Red No. 33 (capsules de 25 mg uniquement), D&C Yellow No. 10, FD&C Blue No. 1 (capsules de 50 mg uniquement), FD&C Yellow No. 6, gélatine, stéarate de magnésium, méthylparabène, propylparabène, amidon (maïs), et dioxyde de titane.
LES INDICATIONS
Les capsules Anafranil™ (chlorhydrate de clomipramine) USP sont indiquées pour le traitement des obsessions et des compulsions chez les patients atteints de trouble obsessionnel-compulsif (TOC). Les obsessions ou les compulsions doivent causer une détresse marquée, prendre du temps ou interférer de manière significative avec le fonctionnement social ou professionnel, afin de répondre au diagnostic de TOC du DSM-III-R (vers 1989).
Les obsessions sont des idées, des pensées, des images ou des impulsions récurrentes et persistantes qui sont ego-dystoniques. Les compulsions sont des comportements répétitifs, délibérés et intentionnels exécutés en réponse à une obsession ou de manière stéréotypée, et sont reconnus par la personne comme excessifs ou déraisonnables.
L'efficacité d'Anafranil 25 mg pour le traitement du TOC a été démontrée dans des études multicentriques, contrôlées contre placebo, en groupes parallèles, dont deux études de 10 semaines chez des adultes et une étude de 8 semaines chez des enfants et des adolescents de 10 à 17 ans. Les patients de toutes les études présentaient un TOC modéré à sévère (DSM-III), avec des notes de base moyennes sur l'échelle de Yale-Brown Obsessive Compulsive Scale (YBOCS) allant de 26 à 28 et une note de base moyenne de 10 sur le NIMH Clinical Global Obsessive Échelle compulsive (NIMH-OC). Les patients prenant CMI ont connu une réduction moyenne d'environ 10 sur l'YBOCS, ce qui représente une amélioration moyenne sur cette échelle de 35 % à 42 % chez les adultes et de 37 % chez les enfants et les adolescents. Les patients traités par CMI ont connu une décrémentation de 3,5 unités sur le NIMH-OC. Les patients sous placebo n'ont montré aucune réponse clinique importante sur l'une ou l'autre des échelles. La dose maximale était de 250 mg/jour pour la plupart des adultes et de 3 mg/kg/jour (jusqu'à 200 mg) pour tous les enfants et adolescents.
L'efficacité d'Anafranil 25 mg pour une utilisation à long terme (c'est-à-dire pendant plus de 10 semaines) n'a pas été systématiquement évaluée dans des essais contrôlés par placebo. Le médecin qui choisit d'utiliser Anafranil 10 mg pendant de longues périodes doit réévaluer périodiquement l'utilité à long terme du médicament pour le patient individuel (voir DOSAGE ET ADMINISTRATION ).
DOSAGE ET ADMINISTRATION
Les schémas thérapeutiques décrits ci-dessous sont basés sur ceux utilisés dans les essais cliniques contrôlés d'Anafranil 50 mg chez 520 adultes et 91 enfants et adolescents atteints de TOC. Lors de la titration initiale, Anafranil doit être administré en doses fractionnées avec les repas pour réduire les effets secondaires gastro-intestinaux. L'objectif de cette phase de titration initiale est de minimiser les effets secondaires en permettant à la tolérance aux effets secondaires de se développer ou en laissant au patient le temps de s'adapter si la tolérance ne se développe pas.
Étant donné que le CMI et son métabolite actif, le DMI, ont de longues demi-vies d'élimination, le prescripteur doit tenir compte du fait que les taux plasmatiques à l'état d'équilibre peuvent ne pas être atteints avant 2 à 3 semaines après le changement de posologie (voir PHARMACOLOGIE CLINIQUE ). Par conséquent, après la titration initiale, il peut être approprié d'attendre 2 à 3 semaines entre d'autres ajustements posologiques.
Traitement initial/ajustement posologique (adultes)
Le traitement par Anafranil 25 mg doit être initié à une posologie de 25 mg par jour et progressivement augmenté, selon la tolérance, jusqu'à environ 100 mg au cours des 2 premières semaines. Lors de la titration initiale, Anafranil 50 mg doit être administré en doses fractionnées avec les repas pour réduire les effets secondaires gastro-intestinaux. Par la suite, la posologie peut être augmentée progressivement au cours des semaines suivantes, jusqu'à un maximum de 250 mg par jour. Après titration, la dose quotidienne totale peut être administrée une fois par jour au coucher pour minimiser la sédation diurne.
Traitement initial/ajustement posologique (enfants et adolescents)
Comme pour les adultes, la dose initiale est de 25 mg par jour et doit être progressivement augmentée (également administrée en doses fractionnées avec les repas pour réduire les effets secondaires gastro-intestinaux) au cours des 2 premières semaines, selon la tolérance, jusqu'à un maximum quotidien de 3 mg/kg ou 100 mg, selon la valeur la plus petite. Par la suite, la posologie peut être augmentée progressivement au cours des semaines suivantes jusqu'à un maximum quotidien de 3 mg/kg ou 200 mg, selon la valeur la plus faible (voir PRÉCAUTIONS , Utilisation pédiatrique ). Comme pour les adultes, après titration, la dose quotidienne totale peut être administrée une fois par jour au coucher pour minimiser la sédation diurne.
Traitement d'entretien/continuation (adultes, enfants et adolescents)
Bien qu'il n'y ait pas d'études systématiques qui répondent à la question de combien de temps continuer Anafranil 10 mg, le TOC est une maladie chronique et il est raisonnable d'envisager la poursuite pour un patient répondeur. Bien que l'efficacité d'Anafranil 50 mg après 10 semaines n'ait pas été documentée dans des essais contrôlés, les patients ont poursuivi le traitement dans des conditions en double aveugle jusqu'à 1 an sans perte de bénéfice. Cependant, des ajustements posologiques doivent être effectués pour maintenir le patient à la dose efficace la plus faible, et les patients doivent être réévalués périodiquement pour déterminer la nécessité d'un traitement. Pendant l'entretien, la dose quotidienne totale peut être administrée une fois par jour au coucher.
Passage d'un patient à ou à partir d'un inhibiteur de la monoamine oxydase (IMAO) destiné à traiter les troubles psychiatriques
Au moins 14 jours doivent s'écouler entre l'arrêt d'un IMAO destiné à traiter les troubles psychiatriques et l'instauration d'un traitement par Anafranil. A l'inverse, il faut attendre au moins 14 jours après l'arrêt d'Anafranil avant de débuter un IMAO destiné à traiter les troubles psychiatriques (voir CONTRE-INDICATIONS ).
Utilisation d'Anafranil 25 mg avec d'autres IMAO, tels que le linézolide ou le bleu de méthylène
Ne pas commencer Anafranil 50 mg chez un patient traité par linézolide ou bleu de méthylène par voie intraveineuse car il existe un risque accru de syndrome sérotoninergique. Chez un patient nécessitant un traitement plus urgent d'une affection psychiatrique, d'autres interventions, y compris l'hospitalisation, doivent être envisagées (voir CONTRE-INDICATIONS ).
Dans certains cas, un patient recevant déjà un traitement par Anafranil 25 mg peut nécessiter un traitement urgent avec du linézolide ou du bleu de méthylène par voie intraveineuse. Si des alternatives acceptables au traitement par le linézolide ou le bleu de méthylène par voie intraveineuse ne sont pas disponibles et que les avantages potentiels du traitement par le linézolide ou le bleu de méthylène par voie intraveineuse sont jugés supérieurs aux risques de syndrome sérotoninergique chez un patient particulier, Anafranil doit être arrêté rapidement et le linézolide ou le bleu de méthylène par voie intraveineuse peut être administré. Le patient doit être surveillé pour des symptômes de syndrome sérotoninergique pendant deux semaines ou jusqu'à 24 heures après la dernière dose de linézolide ou de bleu de méthylène par voie intraveineuse, selon la première éventualité. Le traitement par Anafranil peut être repris 24 heures après la dernière dose de linézolide ou de bleu de méthylène par voie intraveineuse (voir AVERTISSEMENTS ).
Le risque d'administration de bleu de méthylène par des voies non intraveineuses (telles que des comprimés oraux ou par injection locale) ou à des doses intraveineuses bien inférieures à 1 mg/kg avec Anafranil 50 mg n'est pas clair. Le clinicien doit néanmoins être conscient de la possibilité d'apparition de symptômes de syndrome sérotoninergique avec une telle utilisation (voir AVERTISSEMENTS ).
COMMENT FOURNIE
Anafranil™ (chlorhydrate de clomipramine) Capsules USP
Gélules 25 mg - corps ivoire imprimé en noir avec "M" et capuchon jaune melon imprimé en noir avec "ANAFRANIL 25 mg"
Bouteilles de 30………....………...……….....……… … NDC 0406-9906-03
Gélules 50 mg – corps ivoire imprimé en noir avec « M » et capuchon bleu aqua imprimé en noir avec « ANAFRANIL 50 mg »
Bouteilles de 30………..………....………...………... ..…NDC 0406-9907-03
Gélules 75 mg – corps ivoire imprimé en noir avec « M » et capuchon jaune imprimé en noir avec « ANAFRANIL 75 mg »
Bouteilles de 30………..………...……….....……….. ..…NDC 0406-9908-03
Stockage
Conserver entre 20 et 25 °C (68 et 77 °F) [voir Température ambiante contrôlée USP ].
Distribuer dans des récipients bien fermés avec une fermeture à l'épreuve des enfants. Protéger de l'humidité.
Toxicologie animale
Une phospholipidose et des modifications testiculaires, couramment associées aux composés tricycliques, ont été observées avec Anafranil. Dans les études chroniques chez le rat, les changements liés à Anafranil 50 mg consistaient en une phospholipidose systémique, des altérations des testicules (atrophie, minéralisation) et des changements secondaires dans d'autres tissus. De plus, une thrombose cardiaque et une dermatite/kératite ont été observées chez des rats traités pendant 2 ans à des doses qui étaient respectivement de 24 et 10 fois la dose quotidienne maximale recommandée chez l'homme (MRHD), exprimée en mg/kg, et de 4 et 1,5 fois la MRHD. , respectivement, sur une base mg/m².
Mallinckrodt, la marque "M", le logo Mallinckrodt Pharmaceuticals, M Â et d'autres marques sont des marques déposées d'une société Mallinckrodt.
Fabriqué par : Patheon Inc., Whitby, Ontario, Canada, L1N 5Z5 pour SpecGx LLC, Webster Groves, MO 63119 USA. Révisé : mars 2019
EFFETS SECONDAIRES
Couramment observé
Les événements indésirables les plus fréquemment observés associés à l'utilisation d'Anafranil 10 mg et non observés à une incidence équivalente chez les patients traités par placebo étaient les troubles gastro-intestinaux, notamment la bouche sèche, la constipation, les nausées, la dyspepsie et l'anorexie ; affections du système nerveux, y compris somnolence, tremblements, étourdissements, nervosité et myoclonie ; plaintes génito-urinaires, y compris modification de la libido, échec de l'éjaculation, impuissance et trouble de la miction ; et d'autres plaintes diverses, notamment la fatigue, la transpiration, l'augmentation de l'appétit, la prise de poids et les changements visuels.
Conduisant à l'arrêt du traitement
Environ 20 % des 3 616 patients qui ont reçu Anafranil dans le cadre d'essais cliniques de précommercialisation aux États-Unis ont interrompu le traitement en raison d'un événement indésirable. Environ la moitié des patients qui ont arrêté (9 % du total) avaient de multiples plaintes, dont aucune ne pouvait être classée comme primaire. Lorsqu'une raison principale d'arrêt a pu être identifiée, la plupart des patients ont arrêté en raison de troubles du système nerveux (5,4 %), principalement de somnolence. La deuxième raison la plus fréquente d'abandon était les troubles digestifs (1,3 %), principalement les vomissements et les nausées.
Il n'y avait aucune relation apparente entre les événements indésirables et les concentrations plasmatiques élevées de médicament.
Incidence dans les essais cliniques contrôlés
Le tableau suivant énumère les événements indésirables survenus à une incidence de 1 % ou plus chez les patients atteints de TOC qui ont reçu Anafranil 10 mg dans des essais cliniques contrôlés par placebo chez l'adulte ou l'enfant. Les fréquences ont été obtenues à partir de données regroupées d'essais cliniques portant soit sur des adultes recevant Anafranil (N = 322) ou un placebo (N = 319), soit sur des enfants traités avec Anafranil (N = 46) ou un placebo (N = 44). Le prescripteur doit être conscient que ces chiffres ne peuvent pas être utilisés pour prédire l'incidence des effets secondaires dans le cadre de la pratique médicale habituelle, dans laquelle les caractéristiques des patients et d'autres facteurs diffèrent de ceux qui ont prévalu dans les essais cliniques. De même, les fréquences citées ne peuvent être comparées aux chiffres obtenus à partir d'autres investigations cliniques impliquant différents traitements, utilisations et investigateurs. Les chiffres cités, cependant, fournissent au médecin une base pour estimer la contribution relative des facteurs médicamenteux et non médicamenteux à l'incidence des effets secondaires dans les populations étudiées.
Incidence des effets indésirables apparus sous traitement dans les essais cliniques contrôlés par placebo (pourcentage de patients signalant un événement)
Autres événements observés lors de l'évaluation précommercialisation d'Anafranil
Au cours des essais cliniques aux États-Unis, plusieurs doses d'Anafranil 50 mg ont été administrées à environ 3600 sujets. Les événements indésirables associés à cette exposition ont été enregistrés par les investigateurs cliniques en utilisant la terminologie de leur choix. Par conséquent, il n'est pas possible de fournir une estimation significative de la proportion d'individus présentant des événements indésirables sans d'abord regrouper des types similaires d'événements indésirables dans un plus petit nombre de catégories d'événements standardisées.
Dans les tableaux qui suivent, un dictionnaire de terminologie modifié de l'Organisation mondiale de la santé a été utilisé pour classer les événements indésirables signalés. Les fréquences présentées représentent donc la proportion des 3525 personnes exposées à Anafranil qui ont vécu un événement du type cité à au moins une occasion alors qu'elles recevaient Anafranil. Tous les événements sont inclus à l'exception de ceux déjà répertoriés dans le tableau précédent, ceux rapportés en termes si généraux qu'ils ne sont pas informatifs et ceux dans lesquels une association avec le médicament était éloignée. Il est important de souligner que bien que les événements rapportés se soient produits pendant le traitement par Anafranil, ils n'en ont pas nécessairement été la cause.
Les événements sont en outre classés par système corporel et répertoriés par ordre de fréquence décroissante selon les définitions suivantes : les événements indésirables fréquents sont ceux qui se produisent en une ou plusieurs occasions chez au moins 1 patient sur 100 ; les événements indésirables peu fréquents sont ceux qui surviennent chez 1/100 à 1/1000 patients ; les événements rares sont ceux qui surviennent chez moins de 1/1000 patients.
Corps dans son ensemble - Peu fréquent - œdème général, sensibilité accrue aux infections, malaise. Rare - œdème dépendant, syndrome de sevrage.
Système cardiovasculaire - Peu fréquent - ECG anormal, arythmie, bradycardie, arrêt cardiaque, extrasystoles, pâleur. Rare - anévrisme, flutter auriculaire, bloc de branche, insuffisance cardiaque, hémorragie cérébrale, bloc cardiaque, infarctus du myocarde, ischémie myocardique, ischémie périphérique, thrombophlébite, vasospasme, tachycardie ventriculaire.
Système digestif - Peu fréquent - fonction hépatique anormale, sang dans les selles, colite, duodénite, ulcère gastrique, gastrite, reflux gastro-œsophagien, gingivite, glossite, hémorroïdes, hépatite, augmentation de la salive, syndrome du côlon irritable, ulcère peptique, hémorragie rectale, ulcération de la langue, caries dentaires. Rare - chéilite, entérite chronique, selles décolorées, dilatation gastrique, saignement gingival, hoquet, occlusion intestinale, œdème buccal/pharyngé, iléus paralytique, hypertrophie des glandes salivaires.
Système endocrinien - Peu fréquent - hypothyroïdie. Rare - goitre, gynécomastie, hyperthyroïdie.
Système sanguin et lymphatique - Peu fréquent - lymphadénopathie. Rare - réaction leucémique, trouble de type lymphome, aplasie médullaire.
Trouble métabolique et nutritionnel - Peu fréquent - déshydratation, diabète sucré, goutte, hypercholestérolémie, hyperglycémie, hyperuricémie, hypokaliémie. Rare - intolérance aux graisses, glycosurie.
Système musculo-squelettique - Peu fréquent - arthrose. Rare - dystonie, exostose, éruption lupique érythémateuse, ecchymoses, myopathie, myosite, périartérite noueuse, torticolis.
Système nerveux - Fréquent - pensées anormales, vertiges. Peu fréquent - coordination anormale, EEG anormal, démarche anormale, apathie, ataxie, coma, convulsions, délire, délire, dyskinésie, dysphonie, encéphalopathie, euphorie, trouble extrapyramidal, hallucinations, hostilité, hyperkinésie, hallucinations hypnagogiques, hypokinésie, crampes dans les jambes, réaction maniaque , névralgie, paranoïa, trouble phobique, psychose, troubles sensoriels, somnambulisme, stimulation, idées suicidaires, tentative de suicide, grincements de dents. Rare - syndrome anticholinergique, aphasie, apraxie, catalepsie, syndrome cholinergique, choréoathétose, spasme généralisé, hémiparésie, hyperesthésie, hyperréflexie, hypoesthésie, illusion, troubles du contrôle des impulsions, indécision, mutisme, neuropathie, nystagmus, crise oculogyre, paralysie du nerf oculomoteur, réaction schizophrène , stupeur, suicide.
Système respiratoire - Peu fréquent - bronchite, hyperventilation, augmentation des expectorations, pneumonie. Rare - cyanose, hémoptysie, hypoventilation, laryngisme.
Peau et Appendices - Peu fréquent - alopécie, cellulite, kyste, eczéma, éruption érythémateuse, prurit génital, éruption maculopapuleuse, réaction de photosensibilité, psoriasis, éruption pustuleuse, décoloration de la peau. Rare - chloasma, folliculite, hypertrichose, horripilation, séborrhée, hypertrophie cutanée, ulcération cutanée.
Sens spéciaux - Peu fréquent - hébergement anormal, surdité, diplopie, mal d'oreille, douleur oculaire, sensation de corps étranger, hyperacousie, parosmie, photophobie, sclérite, perte du goût. Rare - blépharite, chromatopsie, hémorragie conjonctivale, exophtalmie, glaucome, kératite, trouble du labyrinthe, cécité nocturne, trouble rétinien, strabisme, anomalie du champ visuel.
Système urogénital - Peu fréquent - endométriose, épididymite, hématurie, nycturie, oligurie, kyste ovarien, douleur périnéale, polyurie, trouble prostatique, calcul rénal, douleur rénale, trouble urétral, incontinence urinaire, hémorragie utérine, hémorragie vaginale. Rare - albuminurie, anorgasmie, engorgement mammaire, fibroadénose mammaire, dysplasie cervicale, hyperplasie endométriale, éjaculation précoce, pyélonéphrite, pyurie, kyste rénal, inflammation utérine, trouble vulvaire.
Expérience post-commercialisation
L'effet indésirable suivant a été signalé lors de l'utilisation d'Anafranil après l'approbation. Étant donné que cette réaction est signalée volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer la fréquence de manière fiable.
Troubles oculaires - Glaucome à angle fermé.
Troubles du système immunitaire - Drug Rash avec éosinophilie et symptômes systémiques (DRESS).
Troubles du métabolisme et de la nutrition - Hyponatrémie.
Troubles endocriniens - Syndrome de sécrétion inappropriée d'hormone antidiurétique (SIADH).
INTERACTIONS MÉDICAMENTEUSES
Les risques liés à l'utilisation d'Anafranil en association avec d'autres médicaments n'ont pas été systématiquement évalués. Compte tenu des principaux effets d'Anafranil sur le SNC, la prudence est recommandée lors de son utilisation concomitante avec d'autres médicaments agissant sur le SNC (voir PATIENT INFORMATIONS ). Anafranil ne doit pas être utilisé avec des inhibiteurs de la MAO (voir CONTRE-INDICATIONS ).
Une surveillance étroite et un ajustement soigneux de la posologie sont nécessaires lorsqu'Anafranil est administré avec des médicaments anticholinergiques ou sympathomimétiques.
Il a été rapporté que plusieurs antidépresseurs tricycliques bloquent les effets pharmacologiques de la guanéthidine, de la clonidine ou d'agents similaires, et un tel effet peut être anticipé avec l'ICM en raison de sa similitude structurelle avec d'autres antidépresseurs tricycliques.
Il a été rapporté que la concentration plasmatique de CMI était augmentée par l'administration concomitante d'halopéridol ; les concentrations plasmatiques de plusieurs antidépresseurs tricycliques étroitement apparentés ont été signalées comme étant augmentées par l'administration concomitante de méthylphénidate ou d'inhibiteurs d'enzymes hépatiques (p. ex., cimétidine, fluoxétine) et diminuées par l'administration concomitante d'inducteurs d'enzymes hépatiques (p. ex., barbituriques, phénytoïne), et un tel effet peut également être anticipé avec CMI. Il a été rapporté que l'administration de CMI augmente les taux plasmatiques de phénobarbital, s'il est administré en concomitance (voir PHARMACOLOGIE CLINIQUE , Interactions ).
Médicaments métabolisés par le P450 2D6
L'activité biochimique du médicament métabolisant l'isoenzyme cytochrome P450 2D6 (débrisoquine hydroxylase) est réduite dans un sous-ensemble de la population caucasienne (environ 7 % à 10 % des Caucasiens sont dits "métaboliseurs lents") ; des estimations fiables de la prévalence de l'activité réduite de l'isoenzyme P450 2D6 parmi les populations asiatiques, africaines et autres ne sont pas encore disponibles. Les métaboliseurs lents ont des concentrations plasmatiques d'antidépresseurs tricycliques (ATC) plus élevées que prévu lorsqu'ils reçoivent des doses habituelles. Selon la fraction de médicament métabolisée par le P450 2D6, l'augmentation de la concentration plasmatique peut être faible ou assez importante (augmentation de 8 fois de l'ASC plasmatique du TCA). De plus, certains médicaments inhibent l'activité de cette isozyme et font ressembler les métaboliseurs normaux aux métaboliseurs lents. Un individu qui est stable avec une dose donnée de TCA peut devenir brusquement toxique lorsqu'il reçoit l'un de ces médicaments inhibiteurs en traitement concomitant. Les médicaments qui inhibent le cytochrome P450 2D6 comprennent certains qui ne sont pas métabolisés par l'enzyme (quinidine, cimétidine) et beaucoup qui sont des substrats pour P450 2D6 (de nombreux autres antidépresseurs, phénothiazines et les antiarythmiques de type 1C propafénone et flécaïnide). Bien que tous les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), par exemple la fluoxétine, la sertraline, la paroxétine et la fluvoxamine, inhibent P450 2D6, leur degré d'inhibition peut varier. Il a également été démontré que la fluvoxamine inhibe le P450 1A2, une isoforme également impliquée dans le métabolisme du TCA. La mesure dans laquelle les interactions SSRI-TCA peuvent poser des problèmes cliniques dépendra du degré d'inhibition et de la pharmacocinétique du SSRI impliqué. Néanmoins, la prudence est de mise lors de la co-administration des ATC avec l'un des ISRS et également lors du passage d'une classe à l'autre. Il est particulièrement important de veiller à ce qu'un délai suffisant s'écoule avant d'initier un traitement par TCA chez un patient sevré de la fluoxétine, compte tenu de la longue demi-vie du parent et du métabolite actif (au moins 5 semaines peuvent être nécessaires). L'utilisation concomitante d'agents de la classe des antidépresseurs tricycliques (qui comprend Anafranil) avec des médicaments qui peuvent inhiber le cytochrome P450 2D6 peut nécessiter des doses plus faibles que celles habituellement prescrites pour l'agent antidépresseur tricyclique ou l'autre médicament. De plus, chaque fois que l'un de ces médicaments est retiré de la co-thérapie, une dose accrue d'agent antidépresseur tricyclique peut être nécessaire. Il est souhaitable de surveiller les taux plasmatiques de TCA chaque fois qu'un agent de la classe des antidépresseurs tricycliques, y compris Anafranil, va être co-administré avec un autre médicament connu pour être un inhibiteur de P450 2D6 (et/ou P450 1A2).
Étant donné qu'Anafranil est fortement lié aux protéines sériques, l'administration d'Anafranil à des patients prenant d'autres médicaments fortement liés aux protéines (par exemple, la warfarine, la digoxine) peut entraîner une augmentation des concentrations plasmatiques de ces médicaments, entraînant potentiellement des effets indésirables. Inversement, des effets indésirables peuvent résulter du déplacement d'Anafranil lié aux protéines par d'autres médicaments fortement liés (voir PHARMACOLOGIE CLINIQUE , Distribution ).
Inhibiteurs de la monoamine oxydase (IMAO)
(Voir CONTRE-INDICATIONS , AVERTISSEMENTS , et DOSAGE ET ADMINISTRATION .)
Médicaments sérotoninergiques
(Voir CONTRE-INDICATIONS , AVERTISSEMENTS , et DOSAGE ET ADMINISTRATION .)
Toxicomanie et dépendance
Anafranil n'a pas été systématiquement étudié chez les animaux ou les humains pour son potentiel d'abus, de tolérance ou de dépendance physique. Bien que divers symptômes de sevrage aient été décrits en association avec l'arrêt d'Anafranil 50 mg (voir PRÉCAUTIONS , Les symptômes de sevrage ), il n'y a aucune preuve de comportement de recherche de drogue, à l'exception d'un seul rapport d'abus potentiel d'Anafranil par un patient ayant des antécédents de dépendance à la codéine, aux benzodiazépines et à plusieurs médicaments psychoactifs. Le patient a reçu Anafranil pour dépression et crises de panique et semblait devenir dépendant après sa sortie de l'hôpital.
Malgré le manque de preuves suggérant un risque d'abus d'Anafranil dans la commercialisation à l'étranger, il n'est pas possible de prédire dans quelle mesure Anafranil pourrait être mal utilisé ou abusé une fois commercialisé aux États-Unis. suivre ces patients de près.
AVERTISSEMENTS
Aggravation clinique et risque de suicide
Les patients atteints de trouble dépressif majeur (TDM), à la fois adultes et pédiatriques, peuvent présenter une aggravation de leur dépression et/ou l'émergence d'idées et de comportements suicidaires (suicidalité) ou des changements de comportement inhabituels, qu'ils prennent ou non des antidépresseurs, et cela le risque peut persister jusqu'à ce qu'une rémission significative se produise. Le suicide est un risque connu de dépression et de certains autres troubles psychiatriques, et ces troubles eux-mêmes sont les meilleurs prédicteurs du suicide. Cependant, on craint depuis longtemps que les antidépresseurs puissent jouer un rôle dans l'aggravation de la dépression et l'émergence de comportements suicidaires chez certains patients au cours des premières phases du traitement. Des analyses groupées d'essais contrôlés par placebo à court terme portant sur des antidépresseurs (ISRS et autres) ont montré que ces médicaments augmentent le risque de pensées et de comportements suicidaires (suicidalité) chez les enfants, les adolescents et les jeunes adultes (âgés de 18 à 24 ans) atteints de dépression majeure. (MDD) et d'autres troubles psychiatriques. Les études à court terme n'ont pas montré d'augmentation du risque de suicide avec les antidépresseurs par rapport au placebo chez les adultes au-delà de 24 ans ; il y avait une réduction avec les antidépresseurs par rapport au placebo chez les adultes âgés de 65 ans et plus.
Les analyses groupées d'essais contrôlés par placebo chez des enfants et des adolescents atteints de TDM, de trouble obsessionnel-compulsif (TOC) ou d'autres troubles psychiatriques comprenaient un total de 24 essais à court terme de 9 antidépresseurs chez plus de 4 400 patients. Les analyses groupées d'essais contrôlés par placebo chez des adultes atteints de TDM ou d'autres troubles psychiatriques comprenaient un total de 295 essais à court terme (durée médiane de 2 mois) de 11 antidépresseurs chez plus de 77 000 patients. Il y avait une variation considérable du risque de suicidalité entre les médicaments, mais une tendance à une augmentation chez les patients plus jeunes pour presque tous les médicaments étudiés. Il y avait des différences dans le risque absolu de suicidalité entre les différentes indications, avec l'incidence la plus élevée dans le TDM. Les différences de risque (médicament vs placebo) étaient cependant relativement stables au sein des tranches d'âge et entre les indications. Ces différences de risque (différence médicament-placebo dans le nombre de cas de suicidalité pour 1000 patients traités) sont présentées dans le tableau 1.
Aucun suicide n'est survenu dans aucun des essais pédiatriques. Il y a eu des suicides dans les essais sur les adultes, mais le nombre n'était pas suffisant pour tirer une conclusion sur l'effet du médicament sur le suicide.
On ne sait pas si le risque de suicide s'étend à une utilisation à plus long terme, c'est-à-dire au-delà de plusieurs mois. Cependant, il existe des preuves substantielles provenant d'essais d'entretien contrôlés par placebo chez des adultes souffrant de dépression que l'utilisation d'antidépresseurs peut retarder la récurrence de la dépression.
Tous les patients traités avec des antidépresseurs pour toute indication doivent être surveillés de manière appropriée et observés de près pour déceler une aggravation clinique, des tendances suicidaires et des changements inhabituels de comportement, en particulier au cours des premiers mois d'un traitement médicamenteux, ou lors de changements de dose, soit des augmentations ou diminue.
Les symptômes suivants, anxiété, agitation, attaques de panique, insomnie, irritabilité, hostilité, agressivité, impulsivité, akathisie (agitation psychomotrice), hypomanie et manie, ont été rapportés chez des patients adultes et pédiatriques traités avec des antidépresseurs pour un trouble dépressif majeur ainsi comme pour les autres indications, tant psychiatriques que non psychiatriques. Bien qu'un lien de causalité entre l'apparition de tels symptômes et soit l'aggravation de la dépression et/ou l'émergence d'impulsions suicidaires n'ait pas été établi, on craint que ces symptômes puissent représenter des précurseurs d'une suicidalité émergente.
Il convient d'envisager de modifier le schéma thérapeutique, y compris éventuellement d'arrêter le médicament, chez les patients dont la dépression s'aggrave de manière persistante, ou qui présentent des tendances suicidaires émergentes ou des symptômes qui pourraient être des précurseurs d'une aggravation de la dépression ou des tendances suicidaires, en particulier si ces symptômes sont graves, brusques. au début ou ne faisaient pas partie des symptômes présentés par le patient.
Les familles et les soignants des patients traités avec des antidépresseurs pour un trouble dépressif majeur ou d'autres indications, à la fois psychiatriques et non psychiatriques, doivent être alertés de la nécessité de surveiller les patients pour l'apparition d'agitation, d'irritabilité, de changements inhabituels de comportement et des autres symptômes décrits ci-dessus. , ainsi que l'émergence de tendances suicidaires, et de signaler immédiatement ces symptômes aux professionnels de la santé. Une telle surveillance devrait inclure une observation quotidienne par les familles et les soignants. Les ordonnances de chlorhydrate de clomipramine doivent être rédigées pour la plus petite quantité de gélules compatible avec une bonne prise en charge du patient, afin de réduire le risque de surdosage.
Dépistage des patients pour le trouble bipolaire
Un épisode dépressif majeur peut être la présentation initiale d'un trouble bipolaire. Il est généralement admis (bien que non établi dans des essais contrôlés) que le traitement d'un tel épisode avec un antidépresseur seul peut augmenter la probabilité de précipitation d'un épisode mixte/maniaque chez les patients à risque de trouble bipolaire. On ne sait pas si l'un des symptômes décrits ci-dessus représente une telle conversion. Cependant, avant d'initier un traitement avec un antidépresseur, les patients présentant des symptômes dépressifs doivent faire l'objet d'un dépistage adéquat pour déterminer s'ils présentent un risque de trouble bipolaire ; un tel dépistage devrait inclure des antécédents psychiatriques détaillés, y compris des antécédents familiaux de suicide, de trouble bipolaire et de dépression. Il convient de noter que le chlorhydrate de clomipramine n'est pas approuvé pour une utilisation dans le traitement de la dépression bipolaire.
Syndrome sérotoninergique
Le développement d'un syndrome sérotoninergique potentiellement mortel a été rapporté avec les IRSN et les ISRS, y compris Anafranil 50 mg, seuls mais particulièrement avec l'utilisation concomitante d'autres médicaments sérotoninergiques (y compris les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, le tryptophane, la buspirone et millepertuis) et avec des médicaments qui altèrent le métabolisme de la sérotonine (en particulier les IMAO, tant ceux destinés à traiter les troubles psychiatriques que d'autres, comme le linézolide et le bleu de méthylène par voie intraveineuse).
Les symptômes du syndrome sérotoninergique peuvent inclure des modifications de l'état mental (p. ex., agitation, hallucinations, délire et coma), une instabilité autonome (p. ex., tachycardie, tension artérielle labile, étourdissements, diaphorèse, bouffées vasomotrices, hyperthermie), des modifications neuromusculaires (p. ex., tremblements, rigidité, myoclonies, hyperréflexie, incoordination), convulsions et/ou symptômes gastro-intestinaux (p. ex., nausées, vomissements, diarrhée). Les patients doivent être surveillés pour détecter l'apparition d'un syndrome sérotoninergique.
L'utilisation concomitante d'Anafranil 10 mg avec des IMAO destinés à traiter les troubles psychiatriques est contre-indiquée. Anafranil 50 mg ne doit pas non plus être démarré chez un patient qui est traité avec des IMAO tels que le linézolide ou le bleu de méthylène par voie intraveineuse. Tous les rapports avec le bleu de méthylène qui ont fourni des informations sur la voie d'administration impliquaient une administration intraveineuse dans la gamme de doses de 1 mg/kg à 8 mg/kg. Aucun rapport n'impliquait l'administration de bleu de méthylène par d'autres voies (telles que des comprimés oraux ou une injection tissulaire locale) ou à des doses plus faibles. Il peut y avoir des circonstances où il est nécessaire d'initier un traitement avec un IMAO tel que le linézolide ou le bleu de méthylène par voie intraveineuse chez un patient prenant Anafranil. Anafranil doit être arrêté avant d'initier un traitement par IMAO (voir CONTRE-INDICATIONS et DOSAGE ET ADMINISTRATION ).
Si l'utilisation concomitante d'Anafranil 10 mg avec d'autres médicaments sérotoninergiques, y compris les triptans, les antidépresseurs tricycliques, le fentanyl, le lithium, le tramadol, la buspirone, le tryptophane et le millepertuis est cliniquement justifiée, les patients doivent être informés d'un risque accru potentiel de syndrome sérotoninergique, en particulier lors de l'initiation du traitement et des augmentations de dose.
Le traitement par Anafranil 10 mg et tout agent sérotoninergique concomitant doit être interrompu immédiatement si les événements ci-dessus se produisent et un traitement symptomatique de soutien doit être instauré.
Glaucome à angle fermé
La dilatation pupillaire qui survient après l'utilisation de nombreux antidépresseurs, dont Anafranil, peut déclencher une attaque à angle fermé chez un patient présentant des angles anatomiquement étroits qui n'a pas subi d'iridectomie perméable.
Saisies
Au cours de l'évaluation préalable à la commercialisation, la saisie a été identifiée comme le risque le plus important de l'utilisation d'Anafranil.
L'incidence cumulée observée des convulsions chez les patients exposés à Anafranil 25 mg à des doses allant jusqu'à 300 mg/jour était de 0,64 % à 90 jours, 1,12 % à 180 jours et 1,45 % à 365 jours. Les taux cumulés corrigent le taux brut de 0,7 % (25 patients sur 3519) pour la durée variable d'exposition dans les essais cliniques.
Bien que la dose semble être un facteur prédictif de crise, il existe une confusion entre la dose et la durée d'exposition, ce qui rend difficile l'évaluation indépendante de l'effet de l'un ou l'autre facteur seul. La capacité à prédire la survenue de convulsions chez les sujets exposés à des doses de CMI supérieures à 250 mg est limitée, étant donné que la concentration plasmatique de CMI peut être dose-dépendante et peut varier entre les sujets recevant la même dose. Néanmoins, il est conseillé aux prescripteurs de limiter la dose quotidienne à un maximum de 250 mg chez l'adulte et 3 mg/kg (ou 200 mg) chez l'enfant et l'adolescent (voir DOSAGE ET ADMINISTRATION ).
Des précautions doivent être prises lors de l'administration d'Anafranil 50 mg à des patients ayant des antécédents de convulsions ou d'autres facteurs prédisposants, par exemple des lésions cérébrales d'étiologie variable, l'alcoolisme et l'utilisation concomitante d'autres médicaments qui abaissent le seuil épileptogène.
De rares cas de décès associés à des crises d'épilepsie ont été rapportés par la surveillance post-commercialisation à l'étranger, mais pas dans les essais cliniques américains. Dans certains de ces cas, Anafranil avait été administré avec d'autres agents épileptogènes ; dans d'autres, les patients impliqués avaient peut-être des conditions médicales prédisposantes. Ainsi, une association causale entre le traitement par Anafranil 25 mg et ces décès n'a pas été établie.
Les médecins doivent discuter avec les patients du risque de prendre Anafranil lors d'activités dans lesquelles une perte de conscience soudaine pourrait entraîner des blessures graves pour le patient ou d'autres personnes, par exemple, le fonctionnement de machines complexes, la conduite, la natation, l'escalade.
ROBE
De rares cas d'éruption médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) ont été rapportés avec l'utilisation de la clomipramine. En cas de réactions aiguës sévères telles que DRESS, interrompre immédiatement le traitement par la clomipramine et instituer un traitement approprié.
PRÉCAUTIONS
Général
Suicide
Étant donné que la dépression est une caractéristique couramment associée au TOC, le risque de suicide doit être pris en compte. Les prescriptions d'Anafranil doivent être rédigées pour la plus petite quantité de gélules compatible avec une bonne prise en charge du patient, afin de réduire le risque de surdosage.
Effets cardiovasculaires
Des diminutions orthostatiques modestes de la pression artérielle et une tachycardie modérée ont chacune été observées chez environ 20 % des patients prenant Anafranil 10 mg dans les essais cliniques ; mais les patients étaient souvent asymptomatiques. Parmi environ 1400 patients traités par CMI dans l'expérience de précommercialisation qui avaient des ECG, 1,5 % ont développé des anomalies pendant le traitement, contre 3,1 % des patients recevant des médicaments témoins actifs et 0,7 % des patients recevant un placebo. Les modifications ECG les plus courantes étaient les PVC, les modifications de l'onde ST-T et les anomalies de la conduction intraventriculaire. Ces changements étaient rarement associés à des symptômes cliniques significatifs. Néanmoins, la prudence s'impose lors du traitement de patients atteints d'une maladie cardiovasculaire connue et une titration progressive de la dose est recommandée.
Psychose, confusion et autres phénomènes neuropsychiatriques
Il a été rapporté que les patients traités par Anafranil 10 mg présentaient divers signes et symptômes neuropsychiatriques, notamment des délires, des hallucinations, des épisodes psychotiques, de la confusion et de la paranoïa. En raison de la nature non contrôlée de nombreuses études, il est impossible de fournir une estimation précise de l'ampleur du risque imposé par le traitement par Anafranil. Comme les antidépresseurs tricycliques auxquels il est étroitement lié, Anafranil 25 mg peut précipiter un épisode psychotique aigu chez les patients atteints de schizophrénie non reconnue.
Manie/hypomanie
Au cours des tests de précommercialisation d'Anafranil 10 mg chez des patients souffrant de troubles affectifs, une hypomanie ou une manie a été précipitée chez plusieurs patients. L'activation de la manie ou de l'hypomanie a également été rapportée chez une petite proportion de patients atteints de troubles affectifs traités avec des antidépresseurs tricycliques commercialisés, qui sont étroitement apparentés à l'Anafranil.
Changements hépatiques
Au cours des tests de précommercialisation, Anafranil a parfois été associé à des élévations du SGOT et du SGPT (incidence regroupée d'environ 1 % et 3 %, respectivement) d'importance clinique potentielle (c'est-à-dire des valeurs supérieures à 3 fois la limite supérieure de la normale). Dans la grande majorité des cas, ces augmentations d'enzymes n'étaient pas associées à d'autres résultats cliniques suggérant une lésion hépatique ; de plus, aucun n'a eu la jaunisse. De rares cas de lésions hépatiques plus graves, dont certaines mortelles, ont été enregistrés dans l'expérience post-commercialisation à l'étranger. La prudence s'impose chez les patients atteints d'une maladie hépatique connue et une surveillance périodique des taux d'enzymes hépatiques est recommandée chez ces patients.
Changements hématologiques
Bien qu'aucun cas de toxicité hématologique sévère n'ait été observé lors de la précommercialisation d'Anafranil 25 mg, des cas de leucopénie, d'agranulocytose, de thrombocytopénie, d'anémie et de pancytopénie associés à l'utilisation d'Anafranil 50 mg ont été signalés après commercialisation. Comme c'est le cas avec les antidépresseurs tricycliques auxquels Anafranil 25 mg est étroitement lié, des numérations leucocytaires et différentielles doivent être obtenues chez les patients qui développent de la fièvre et des maux de gorge pendant le traitement par Anafranil.
Système nerveux central
Plus de 30 cas d'hyperthermie ont été enregistrés par des systèmes de surveillance post-commercialisation non domestiques. La plupart des cas sont survenus lorsque Anafranil était utilisé en association avec d'autres médicaments. Lorsque Anafranil 25 mg et un neuroleptique étaient utilisés de manière concomitante, les cas étaient parfois considérés comme des exemples de syndrome malin des neuroleptiques.
Dysfonction sexuelle
Le taux de dysfonctionnement sexuel chez les patients masculins atteints de TOC qui ont été traités par Anafranil dans l'expérience de précommercialisation a été nettement augmenté par rapport aux témoins placebo (c'est-à-dire, 42 % ont connu une insuffisance éjaculatoire et 20 % ont connu une impuissance, contre 2,0 % et 2,6 %, respectivement, dans le groupe placebo). Environ 85 % des hommes souffrant de dysfonction sexuelle ont choisi de poursuivre le traitement.
Hyponatrémie
Une hyponatrémie est survenue à la suite d'un traitement par la clomipramine. Dans de nombreux cas, l'hyponatrémie semble être le résultat du syndrome de sécrétion inappropriée d'hormone antidiurétique (SIADH). Les patients âgés peuvent être plus à risque de développer une hyponatrémie avec un antidépresseur sérotoninergique. En outre, les patients prenant des diurétiques ou qui présentent une hypovolémie peuvent être plus à risque. L'arrêt d'Anafranil chez les patients présentant une hyponatrémie symptomatique et une intervention médicale appropriée doivent être instaurés. Les signes et symptômes de l'hyponatrémie comprennent des maux de tête, des difficultés de concentration, des troubles de la mémoire, de la confusion, de la faiblesse et de l'instabilité, ce qui peut entraîner des chutes. Les cas plus graves et/ou aigus ont inclus des hallucinations, des syncopes, des convulsions, un coma, un arrêt respiratoire et la mort.
Changements de poids
Dans des études contrôlées sur le TOC, une prise de poids a été rapportée chez 18 % des patients recevant Anafranil, contre 1 % des patients recevant un placebo. Dans ces études, 28 % des patients recevant Anafranil 25 mg avaient un gain de poids d'au moins 7 % de leur poids corporel initial, contre 4 % des patients recevant le placebo. Plusieurs patients ont eu des gains de poids supérieurs à 25 % de leur poids corporel initial. A l'inverse, 5% des patients recevant Anafranil et 1% recevant le placebo ont eu des pertes de poids d'au moins 7% de leur poids corporel initial.
La thérapie par électrochocs
Comme pour les antidépresseurs tricycliques étroitement apparentés, l'administration concomitante d'Anafranil avec une thérapie électroconvulsive peut augmenter les risques ; un tel traitement doit être limité aux patients pour lesquels il est essentiel, car l'expérience clinique est limitée.
Opération
Avant une intervention chirurgicale programmée sous anesthésie générale, le traitement par Anafranil 50 mg doit être interrompu aussi longtemps que cela est cliniquement possible et l'anesthésiste doit en être informé.
Utilisation en cas de maladie concomitante
Patients présentant une insuffisance rénale significative.
Les symptômes de sevrage
Divers symptômes de sevrage ont été rapportés en association avec l'arrêt brutal d'Anafranil 50 mg, notamment des étourdissements, des nausées, des vomissements, des maux de tête, des malaises, des troubles du sommeil, de l'hyperthermie et de l'irritabilité. De plus, ces patients peuvent connaître une aggravation de leur état psychiatrique. Bien que les effets de sevrage d'Anafranil 10 mg n'aient pas été systématiquement évalués dans des essais contrôlés, ils sont bien connus avec des antidépresseurs tricycliques étroitement apparentés, et il est recommandé de réduire progressivement la posologie et de surveiller attentivement le patient pendant l'arrêt (voir Toxicomanie et dépendance ).
Informations pour les patients
Les prescripteurs ou autres professionnels de la santé doivent informer les patients, leurs familles et leurs soignants des avantages et des risques associés au traitement par le chlorhydrate de clomipramine et doivent les conseiller sur son utilisation appropriée. Un guide de médication pour le patient sur les «médicaments antidépresseurs, la dépression et d'autres maladies mentales graves et les pensées ou actions suicidaires» est disponible pour le chlorhydrate de clomipramine. Le prescripteur ou le professionnel de la santé doit demander aux patients, à leurs familles et à leurs soignants de lire le Guide des médicaments et doit les aider à comprendre son contenu. Les patients doivent avoir la possibilité de discuter du contenu du Guide de Médication et d'obtenir des réponses à toutes les questions qu'ils pourraient avoir. Le texte complet du Guide de Médication est réimprimé à la fin de ce document.
Les patients doivent être informés des problèmes suivants et invités à alerter leur médecin traitant si ceux-ci surviennent lors de la prise de chlorhydrate de clomipramine.
Aggravation clinique et risque de suicide
Les patients, leurs familles et leurs soignants doivent être encouragés à être attentifs à l'émergence d'anxiété, d'agitation, d'attaques de panique, d'insomnie, d'irritabilité, d'hostilité, d'agressivité, d'impulsivité, d'akathisie (agitation psychomotrice), d'hypomanie, de manie, d'autres changements inhabituels de comportement , aggravation de la dépression et idées suicidaires, en particulier au début du traitement antidépresseur et lorsque la dose est ajustée à la hausse ou à la baisse. Il faut conseiller aux familles et aux soignants des patients de rechercher l'apparition de tels symptômes au jour le jour, car les changements peuvent être brusques. De tels symptômes doivent être signalés au médecin prescripteur ou au professionnel de la santé du patient, en particulier s'ils sont graves, d'apparition brutale ou ne font pas partie des symptômes présentés par le patient. De tels symptômes peuvent être associés à un risque accru de pensées et de comportements suicidaires et indiquent la nécessité d'une surveillance très étroite et éventuellement de modifications de la médication.
Il est conseillé aux médecins de discuter des problèmes suivants avec les patients pour lesquels ils prescrivent Anafranil :
- Le risque de convulsion (voir AVERTISSEMENTS );
- L'incidence relativement élevée de la dysfonction sexuelle chez les hommes (voir Dysfonction sexuelle );
- Étant donné qu'Anafranil 50 mg peut altérer les capacités mentales et/ou physiques nécessaires à l'exécution de tâches complexes, et qu'Anafranil 25 mg est associé à un risque de convulsions, les patients doivent être avertis de l'exécution de tâches complexes et dangereuses (voir AVERTISSEMENTS );
- Les patients doivent être avertis de l'utilisation simultanée d'alcool, de barbituriques ou d'autres dépresseurs du SNC, car Anafranil 50 mg peut exagérer leur réponse à ces médicaments ;
- Les patientes doivent informer leur médecin si elles tombent enceintes ou ont l'intention de tomber enceintes pendant le traitement;
- Les patientes doivent informer leur médecin si elles allaitent.
Les patients doivent être informés que la prise d'Anafranil peut provoquer une légère dilatation pupillaire qui, chez les personnes sensibles, peut entraîner un épisode de glaucome à angle fermé. Le glaucome préexistant est presque toujours un glaucome à angle ouvert car le glaucome à angle fermé, lorsqu'il est diagnostiqué, peut être traité définitivement par iridectomie. Le glaucome à angle ouvert n'est pas un facteur de risque de glaucome à angle fermé. Les patients peuvent souhaiter être examinés pour déterminer s'ils sont sensibles à la fermeture de l'angle et subir une intervention prophylactique (p. ex., iridectomie), s'ils y sont sensibles.
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune preuve de cancérogénicité n'a été trouvée dans deux essais biologiques de 2 ans chez le rat à des doses allant jusqu'à 100 mg/kg, soit 24 et 4 fois la dose quotidienne humaine recommandée maximale (MRHD) sur une base mg/kg et mg/m², respectivement , ou dans un essai biologique de 2 ans chez la souris à des doses allant jusqu'à 80 mg/kg, soit 20 et 1,5 fois la MRHD sur une base mg/kg et mg/m², respectivement.
Dans les études de reproduction, aucun effet sur la fertilité n'a été trouvé chez les rats ayant reçu jusqu'à 24 mg/kg, ce qui est 6 fois et approximativement égal à la MRHD sur une base mg/kg et mg/m², respectivement.
Catégorie de grossesse C
Aucun effet tératogène n'a été observé dans les études réalisées chez le rat et la souris à des doses allant jusqu'à 100 mg/kg, soit 24 fois la dose quotidienne maximale recommandée chez l'humain (MRHD) en mg/kg et 4 fois (rats) et 2 fois ( souris) le MRHD sur une base de mg/m². De légers effets embryonnaires/fœtotoxiques non spécifiques ont été observés chez la progéniture des rats traités ayant reçu 50 et 100 mg/kg et des souris traitées ayant reçu 100 mg/kg.
Il n'y a pas d'études adéquates ou bien contrôlées chez les femmes enceintes. Des symptômes de sevrage, notamment de la nervosité, des tremblements et des convulsions, ont été signalés chez des nouveau-nés dont les mères avaient pris Anafranil 50 mg jusqu'à l'accouchement. Anafranil 10 mg ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Mères allaitantes
Anafranil a été trouvé dans le lait maternel. En raison du risque d'effets indésirables, une décision doit être prise soit d'interrompre l'allaitement soit d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère.
Utilisation pédiatrique
La sécurité et l'efficacité dans la population pédiatrique autre que les patients pédiatriques atteints de TOC n'ont pas été établies (voir AVERTISSEMENT DE BOÎTE et AVERTISSEMENTS , Aggravation clinique et risque de suicide ). Toute personne envisageant l'utilisation d'Anafranil chez un enfant ou un adolescent doit équilibrer les risques potentiels avec le besoin clinique.
Dans un essai clinique contrôlé chez des enfants et des adolescents (âgés de 10 à 17 ans), 46 patients ambulatoires ont reçu Anafranil 50 mg pendant 8 semaines maximum. Par ailleurs, 150 patients adolescents ont reçu Anafranil 10 mg dans des protocoles en ouvert pendant des périodes de plusieurs mois à plusieurs années. Sur les 196 adolescents étudiés, 50 avaient 13 ans ou moins et 146 avaient entre 14 et 17 ans. Le profil des effets indésirables dans ce groupe d'âge (voir EFFETS INDÉSIRABLES ) est similaire à celle observée chez les adultes.
Les risques, le cas échéant, qui peuvent être associés à l'utilisation prolongée d'Anafranil chez les enfants et les adolescents atteints de TOC n'ont pas été systématiquement évalués. Les preuves à l'appui de la conclusion selon laquelle Anafranil 50 mg peut être utilisé sans danger chez les enfants et les adolescents proviennent d'études cliniques à relativement court terme et de l'extrapolation de l'expérience acquise avec des patients adultes. En particulier, aucune étude n'évalue directement les effets de l'utilisation à long terme d'Anafranil 25 mg sur la croissance, le développement et la maturation des enfants et des adolescents. Bien qu'il n'y ait aucune preuve suggérant qu'Anafranil 10 mg affecte négativement la croissance, le développement ou la maturation, l'absence de tels résultats n'est pas suffisante pour exclure le potentiel de tels effets en cas d'utilisation chronique.
La sécurité et l'efficacité chez les patients pédiatriques de moins de 10 ans n'ont pas été établies. Par conséquent, des recommandations spécifiques ne peuvent être faites pour l'utilisation d'Anafranil chez les patients pédiatriques de moins de 10 ans.
Utilisation gériatrique
Les études cliniques d'Anafranil 50 mg n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment des sujets plus jeunes ; 152 patients âgés d'au moins 60 ans participant à divers essais cliniques américains ont reçu Anafranil pendant des périodes de plusieurs mois à plusieurs années. Aucun événement indésirable inhabituel lié à l'âge n'a été identifié dans cette population. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la fréquence plus élevée de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
Anafranil a été associé à des cas d'hyponatrémie cliniquement significative. Les patients âgés peuvent être plus exposés à cet effet indésirable (voir PRÉCAUTIONS , Hyponatrémie ).
SURDOSAGE
Des décès peuvent survenir à la suite d'un surdosage avec cette classe de médicaments. L'ingestion de plusieurs médicaments (y compris l'alcool) est fréquente en cas de surdosage tricyclique délibéré. Comme la prise en charge est complexe et changeante, il est recommandé au médecin de contacter un centre antipoison pour obtenir des informations à jour sur le traitement. Les signes et symptômes de toxicité se développent rapidement après un surdosage tricyclique. Par conséquent, une surveillance hospitalière est requise dès que possible.
Expérience humaine
Dans les essais cliniques américains, 2 décès sont survenus dans 12 cas signalés de surdosage aigu avec Anafranil seul ou en association avec d'autres médicaments. Un décès concernait un patient soupçonné d'avoir ingéré une dose de 7 000 mg. Le second décès concernait un patient suspecté d'avoir ingéré une dose de 5750 mg. Les 10 cas non mortels impliquaient des doses allant jusqu'à 5 000 mg, accompagnées de taux plasmatiques allant jusqu'à 1 010 ng/mL. Les 10 patients ont complètement récupéré. Parmi les rapports d'autres pays sur le surdosage d'Anafranil, la dose la plus faible associée à un décès était de 750 mg. Sur la base de rapports post-commercialisation au Royaume-Uni, la létalité de CMI en cas de surdosage est considérée comme similaire à celle rapportée pour des composés tricycliques étroitement apparentés commercialisés comme antidépresseurs.
manifestations
Les signes et les symptômes varient en gravité en fonction de facteurs tels que la quantité de médicament absorbée, l'âge du patient et le temps écoulé depuis l'ingestion du médicament. Les manifestations critiques d'un surdosage comprennent des troubles du rythme cardiaque, une hypotension sévère, des convulsions et une dépression du SNC, y compris le coma. Les modifications de l'électrocardiogramme, en particulier de l'axe ou de la largeur du QRS, sont des indicateurs cliniquement significatifs de la toxicité tricyclique. D'autres manifestations du SNC peuvent inclure somnolence, stupeur, ataxie, agitation, agitation, délire, transpiration intense, réflexes hyperactifs, rigidité musculaire et mouvements athétoides et choréiformes. Les anomalies cardiaques peuvent inclure une tachycardie, des signes d'insuffisance cardiaque congestive et, dans de très rares cas, un arrêt cardiaque. Une dépression respiratoire, une cyanose, un choc, des vomissements, une hyperpyrexie, une mydriase et une oligurie ou une anurie peuvent également être présents.
La gestion
Obtenir un ECG et commencer immédiatement la surveillance cardiaque. Protégez les voies respiratoires du patient, établissez une voie intraveineuse et lancez la décontamination gastrique. Un minimum de 6 heures d'observation avec surveillance cardiaque et observation des signes de dépression du SNC ou respiratoire, d'hypotension, de troubles du rythme cardiaque et/ou de blocs de conduction et de convulsions est nécessaire.
Si des signes de toxicité apparaissent à tout moment au cours de cette période, une surveillance prolongée est requise. Il existe des rapports de cas de patients succombant à des troubles du rythme mortels tard après un surdosage; ces patients présentaient des signes cliniques d'empoisonnement important avant le décès et la plupart ont reçu une décontamination gastro-intestinale inadéquate. La surveillance des concentrations plasmatiques du médicament ne doit pas guider la prise en charge du patient.
Décontamination gastro-intestinale
Tous les patients suspectés de surdosage tricyclique doivent recevoir une décontamination gastro-intestinale. Cela devrait inclure un lavage gastrique à grand volume suivi de charbon actif. Si la conscience est altérée, les voies respiratoires doivent être sécurisées avant le lavage. Les vomissements sont contre-indiqués.
Cardiovasculaire
Une durée maximale du QRS des dérivations des membres ≥ 0,10 seconde peut être la meilleure indication de la sévérité du surdosage. Le bicarbonate de sodium intraveineux doit être utilisé pour maintenir le pH sérique entre 7,45 et 7,55. Si la réponse du pH est inadéquate, l'hyperventilation peut également être utilisée. L'utilisation concomitante d'hyperventilation et de bicarbonate de sodium doit être effectuée avec une extrême prudence, avec une surveillance fréquente du pH. Un pH >7,60 ou un pCO2
Dans de rares cas, l'hémoperfusion peut être bénéfique en cas d'instabilité cardiovasculaire aiguë réfractaire chez les patients présentant une toxicité aiguë. Cependant, l'hémodialyse, la dialyse péritonéale, les exsanguinotransfusions et la diurèse forcée ont généralement été signalées comme inefficaces dans l'intoxication tricyclique.
SNC
Chez les patients souffrant de dépression du SNC, une intubation précoce est conseillée en raison du risque de détérioration brutale. Les convulsions doivent être contrôlées avec des benzodiazépines ou, si celles-ci sont inefficaces, avec d'autres anticonvulsivants (p. ex., phénobarbital, phénytoïne). La physostigmine n'est pas recommandée, sauf pour traiter les symptômes potentiellement mortels qui n'ont pas répondu aux autres traitements, et uniquement en consultation avec un centre antipoison.
Suivi psychiatrique
Étant donné que le surdosage est souvent délibéré, les patients peuvent tenter de se suicider par d'autres moyens pendant la phase de récupération. Une référence psychiatrique peut être appropriée.
Gestion pédiatrique
Les principes de prise en charge des surdosages chez l'enfant et chez l'adulte sont similaires. Il est fortement recommandé que le médecin contacte le centre antipoison local pour un traitement pédiatrique spécifique.
CONTRE-INDICATIONS
Anafranil est contre-indiqué chez les patients ayant des antécédents d'hypersensibilité à Anafranil 25 mg ou à d'autres antidépresseurs tricycliques.
Inhibiteurs de la monoamine oxydase (IMAO)
L'utilisation des IMAO destinés à traiter les troubles psychiatriques par Anafranil ou dans les 14 jours suivant l'arrêt du traitement par Anafranil est contre-indiquée en raison d'un risque accru de syndrome sérotoninergique. L'utilisation d'Anafranil 10 mg dans les 14 jours suivant l'arrêt d'un IMAO destiné à traiter les troubles psychiatriques est également contre-indiquée (voir AVERTISSEMENTS et DOSAGE ET ADMINISTRATION ).
L'initiation d'Anafranil chez un patient traité par linézolide ou bleu de méthylène par voie intraveineuse est également contre-indiquée en raison d'un risque accru de syndrome sérotoninergique (voir AVERTISSEMENTS et DOSAGE ET ADMINISTRATION ).
Infarctus du myocarde
Anafranil est contre-indiqué pendant la période de récupération aiguë après un infarctus du myocarde.
PHARMACOLOGIE CLINIQUE
Pharmacodynamie
La clomipramine (CMI) est supposée influencer les comportements obsessionnels et compulsifs par ses effets sur la transmission neuronale sérotoninergique. Le mécanisme neurochimique réel est inconnu, mais la capacité du CMI à inhiber la recapture de la sérotonine (5-HT) est considérée comme importante.
Pharmacocinétique
Absorption/Biodisponibilité
Le CMI d'Anafranil 25 mg gélules est aussi biodisponible que le CMI d'une solution. La biodisponibilité du CMI à partir de capsules n'est pas significativement affectée par la nourriture.
Dans une étude de proportionnalité de la dose impliquant plusieurs doses de CMI, les concentrations plasmatiques à l'état d'équilibre (Css) et les courbes aire sous concentration plasmatique-temps (ASC) du CMI et du principal métabolite actif du CMI, la déméthylclomipramine (DMI), n'étaient pas proportionnelles à la dose sur les plages évaluées, c'est-à-dire entre 25 et 100 mg/jour et entre 25 et 150 mg/jour, bien que la Css et l'ASC soient approximativement linéairement liées à la dose entre 100 et 150 mg/jour. La relation entre la dose et les concentrations de CMI/DMI à des doses quotidiennes plus élevées n'a pas été systématiquement évaluée, mais s'il existe une dépendance significative à la dose à des doses supérieures à 150 mg/jour, il existe un risque de Css et d'ASC considérablement plus élevées, même pour les patients traités dans les limites de la dose. gamme recommandée. Cela peut présenter un risque potentiel pour certains patients (voir AVERTISSEMENTS et INTERACTIONS MÉDICAMENTEUSES ).
Après une dose orale unique de 50 mg, les concentrations plasmatiques maximales de CMI surviennent en 2 à 6 heures (moyenne, 4,7 h) et varient de 56 ng/mL à 154 ng/mL (moyenne, 92 ng/mL). Après plusieurs doses quotidiennes de 150 mg d'Anafranil 25 mg, les concentrations plasmatiques maximales à l'état d'équilibre varient de 94 ng/mL à 339 ng/mL (moyenne, 218 ng/mL) pour l'IMC et de 134 ng/mL à 532 ng/mL ( moyenne, 274 ng/mL) pour l'IMD. Des informations supplémentaires provenant d'une étude de doses croissantes de doses allant jusqu'à 250 mg suggèrent que le DMI peut présenter une pharmacocinétique non linéaire sur la plage de dosage habituelle. À une dose d'Anafranil 200 mg, les sujets qui avaient un seul échantillon de sang prélevé environ 9 à 22 heures (médiane 16 heures), après la dose avaient des concentrations plasmatiques allant jusqu'à 605 ng/mL pour le CMI, 781 ng/mL pour le DMI , et 1386 ng/mL pour les deux.
Distribution
Le CMI se distribue dans le liquide céphalo-rachidien (LCR) et le cerveau et dans le lait maternel. Le DMI se distribue également dans le LCR, avec un rapport moyen LCR/plasma de 2,6. La liaison protéique de CMI est d'environ 97 %, principalement à l'albumine, et est indépendante de la concentration de CMI. L'interaction entre le CMI et d'autres médicaments fortement liés aux protéines n'a pas été entièrement évaluée, mais peut être importante (voir INTERACTIONS MÉDICAMENTEUSES ).
Métabolisme
Le CMI est largement biotransformé en DMI et en d'autres métabolites et leurs conjugués glucuronides. Le DMI est pharmacologiquement actif, mais ses effets sur les comportements TOC sont inconnus. Ces métabolites sont excrétés dans les urines et les fèces, après élimination biliaire. Après une dose radiomarquée de 25 mg de CMI chez deux sujets, 60 % et 51 %, respectivement, de la dose ont été récupérés dans les urines et 32 % et 24 %, respectivement, dans les fèces. Dans la même étude, les récupérations urinaires combinées de CMI et DMI n'étaient que d'environ 0,8% à 1,3% de la dose administrée. Le CMI n'induit pas d'enzymes métabolisant les médicaments, tel que mesuré par la demi-vie de l'antipyrine.
Élimination
Les preuves que la Css et l'ASC du CMI et du DMI peuvent augmenter de manière disproportionnée avec l'augmentation des doses orales suggèrent que le métabolisme du CMI et du DMI peut être limité en termes de capacité. Ce fait doit être pris en compte dans l'évaluation des estimations des paramètres pharmacocinétiques présentés ci-dessous, car ceux-ci ont été obtenus chez des individus exposés à des doses de 150 mg. Si la pharmacocinétique du CMI et du DMI n'est pas linéaire à des doses supérieures à 150 mg, leur demi-vie d'élimination peut être considérablement allongée à des doses proches de l'extrémité supérieure de la plage posologique recommandée (c'est-à-dire de 200 mg/jour à 250 mg/jour). Par conséquent, le CMI et le DMI peuvent s'accumuler, et cette accumulation peut augmenter l'incidence de tout effet indésirable dépendant de la dose ou de la concentration plasmatique, en particulier les convulsions (voir AVERTISSEMENTS ).
Après une dose de 150 mg, la demi-vie du CMI varie de 19 heures à 37 heures (moyenne, 32 h) et celle du DMI de 54 heures à 77 heures (moyenne, 69 h). Les niveaux à l'état d'équilibre après plusieurs doses sont généralement atteints dans les 7 à 14 jours pour l'IMC. Les concentrations plasmatiques du métabolite dépassent celles de la molécule mère lors d'administrations multiples. Après plusieurs doses de 150 mg/jour, le facteur d'accumulation pour le CMI est d'environ 2,5 et pour le DMI est de 4,6. Il est important de noter que cela peut prendre deux semaines ou plus pour atteindre cette accumulation à dosage constant en raison des demi-vies d'élimination relativement longues du CMI et du DMI (voir DOSAGE ET ADMINISTRATION ). Les effets de l'insuffisance hépatique et rénale sur l'élimination d'Anafranil n'ont pas été déterminés.
Interactions
La co-administration d'halopéridol avec le CMI augmente les concentrations plasmatiques de CMI. L'administration concomitante de CMI et de phénobarbital augmente les concentrations plasmatiques de phénobarbital (voir INTERACTIONS MÉDICAMENTEUSES ). Les sujets plus jeunes (âgés de 18 à 40 ans) ont mieux toléré l'IMC et présentaient des concentrations plasmatiques à l'état d'équilibre significativement plus faibles que les sujets de plus de 65 ans. Les enfants de moins de 15 ans présentaient des rapports concentration plasmatique/dose significativement inférieurs à ceux des adultes. Les concentrations plasmatiques de CMI étaient significativement plus faibles chez les fumeurs que chez les non-fumeurs.
INFORMATIONS PATIENTS
Anafranil™ (chlorhydrate de clomipramine) Capsules USP
Médicaments antidépresseurs, dépression et autres maladies mentales graves, et pensées ou actions suicidaires
Lisez le Guide des médicaments qui accompagne votre médicament antidépresseur ou celui d'un membre de votre famille. Ce guide de médication concerne uniquement le risque de pensées et d'actions suicidaires avec les médicaments antidépresseurs. Parlez à votre fournisseur de soins de santé ou à celui d'un membre de votre famille de :
- tous les risques et avantages du traitement avec des antidépresseurs
- tous les choix de traitement pour la dépression ou d'autres maladies mentales graves
Quelles sont les informations les plus importantes que je devrais connaître sur les médicaments antidépresseurs, la dépression et autres maladies mentales graves, et les pensées ou actions suicidaires ?
1. Les médicaments antidépresseurs peuvent augmenter les pensées ou actions suicidaires chez certains enfants, adolescents et jeunes adultes au cours des premiers mois de traitement.
2. La dépression et d'autres maladies mentales graves sont les causes les plus importantes de pensées et d'actions suicidaires. Certaines personnes peuvent avoir un risque particulièrement élevé d'avoir des pensées ou des actions suicidaires. Ceux-ci incluent les personnes qui ont (ou ont des antécédents familiaux de) maladie bipolaire (également appelée maladie maniaco-dépressive) ou des pensées ou actions suicidaires.
3. Comment puis-je surveiller et essayer de prévenir les pensées et actions suicidaires chez moi-même ou chez un membre de ma famille ?
- Portez une attention particulière à tout changement, en particulier les changements soudains, d'humeur, de comportement, de pensées ou de sentiments. Ceci est très important lorsqu'un médicament antidépresseur est commencé ou lorsque la dose est modifiée.
- Appelez immédiatement le fournisseur de soins de santé pour signaler des changements nouveaux ou soudains d'humeur, de comportement, de pensées ou de sentiments.
- Gardez toutes les visites de suivi avec le fournisseur de soins de santé comme prévu. Appelez le fournisseur de soins de santé entre les visites au besoin, surtout si vous avez des inquiétudes au sujet des symptômes.
Appelez immédiatement un fournisseur de soins de santé si vous ou un membre de votre famille présentez l'un des symptômes suivants, surtout s'ils sont nouveaux, s'aggravent ou vous inquiètent :
- pensées sur le suicide ou la mort
- tentatives de suicide
- dépression nouvelle ou pire
- anxiété nouvelle ou pire
- se sentir très agité ou agité
- crises de panique
- troubles du sommeil (insomnie)
- irritabilité nouvelle ou pire
- agir de manière agressive, être en colère ou violent
- agir sur des impulsions dangereuses
- une augmentation extrême de l'activité et de la conversation (manie)
- autres changements inhabituels de comportement ou d'humeur
Faible taux de sel (sodium) dans le sang. Les personnes âgées peuvent être plus à risque pour cela. Les symptômes peuvent inclure :
- mal de tête
- faiblesse ou sensation d'instabilité
- confusion, problèmes de concentration ou de réflexion ou problèmes de mémoire
Problèmes visuels
- douleur oculaire
- changements de vision
- gonflement ou rougeur dans ou autour de l'œil
Seules certaines personnes sont à risque pour ces problèmes. Vous voudrez peut-être subir un examen de la vue pour voir si vous êtes à risque et recevoir un traitement préventif si vous l'êtes.
Qui ne devrait pas prendre Anafranil ?
Ne prenez pas Anafranil si vous :
- prendre un inhibiteur de la monoamine oxydase (IMAO). Demandez à votre fournisseur de soins de santé ou à votre pharmacien si vous n'êtes pas sûr de prendre un IMAO, y compris l'antibiotique linézolide.
- Ne prenez pas d'IMAO dans les 2 semaines suivant l'arrêt d'Anafranil 25 mg, sauf indication contraire de votre médecin.
- Ne commencez pas Anafranil si vous avez arrêté de prendre un IMAO au cours des 2 dernières semaines, sauf indication contraire de votre médecin.
Que dois-je savoir d'autre sur les médicaments antidépresseurs ?
- N'arrêtez jamais un médicament antidépresseur sans en parler d'abord à un fournisseur de soins de santé. L'arrêt soudain d'un médicament antidépresseur peut provoquer d'autres symptômes.
- Les antidépresseurs sont des médicaments utilisés pour traiter la dépression et d'autres maladies. Il est important de discuter de tous les risques de traiter la dépression et aussi des risques de ne pas la traiter. Les patients et leurs familles ou autres soignants doivent discuter de tous les choix de traitement avec le fournisseur de soins de santé, et pas seulement de l'utilisation d'antidépresseurs.
- Les antidépresseurs ont d'autres effets secondaires. Parlez au fournisseur de soins de santé des effets secondaires du médicament prescrit pour vous ou un membre de votre famille.
- Les médicaments antidépresseurs peuvent interagir avec d'autres médicaments. Connaissez tous les médicaments que vous ou un membre de votre famille prenez. Gardez une liste de tous les médicaments à montrer au professionnel de la santé. Ne commencez pas de nouveaux médicaments sans d'abord consulter votre fournisseur de soins de santé.
- Tous les médicaments antidépresseurs prescrits aux enfants ne sont pas approuvés par la FDA pour une utilisation chez les enfants. Parlez au fournisseur de soins de santé de votre enfant pour plus d'informations.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
